
抗凝药物的种类及合理使用
1.1 分类(见表1)
肝素是机体自身存在的物质。临床使用的肝素是由猪肠粘膜或牛肺组织纯化制得的一种多功能的酸性黏多糖,体内、体外均有强大的抗凝作用,口服无效,常用皮下注射或静脉注射,可分为三类。
类别抗凝药物代表药物分子量(道尔顿)第一代普通肝素(UFH)肝素12000-15000
第二代低分子肝素(LMWH)达肝素、依诺肝素、
那屈肝素、亭扎肝素
3000-8000
第三代肝素戊糖(HPS)磺达肝癸钠1728
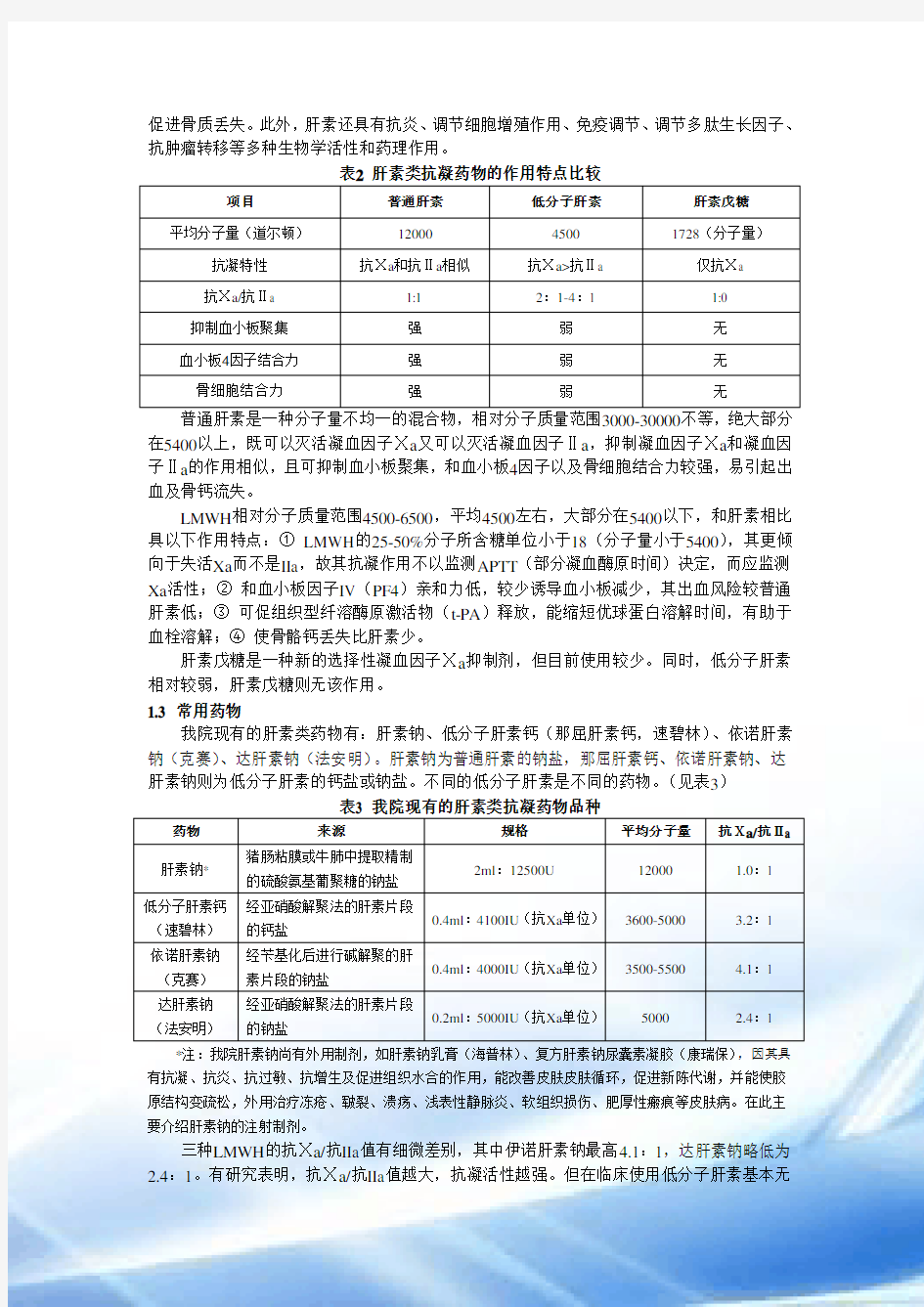
第一代普通肝素,平均分子量较大;第二代为将普通肝素经化学或酶裂解制得的低分子肝素,平均分子量较第一代小;第三代为合成的肝素戊糖,分子量最小,仅1728道尔顿。1.2 肝素类药物抗凝作用机制(见表2)
1.2.1 激活抗凝血酶Ⅲ(AT-Ⅲ)
肝素类抗凝药物能和抗凝血酶Ⅲ(AT-Ⅲ)结合,催化灭活多种凝血因子。AT有一个精氨酸反应中心可以和凝血因子的丝氨酸活化中心共价结合,从而使含有丝氨酸活化中心的凝血因子(Ⅱa、Ⅹa等)失去活性。在没有肝素存在的情况下,AT灭活凝血因子的速度非常缓慢。肝素可以和AT的赖氨酸部位结合,使AT的精氨酸反应中心构象发生改变,AT由慢性凝血酶抑制剂变为快速抑制剂,灭活凝血因子的速度可以增加1000-2000倍。肝素和AT结合后可以脱落参和再利用。肝素-AT复合物能够灭活多种凝血因子,其中IIa和Ⅹa最易受抑制,但机制有所不同。
1.2.1.1 灭活凝血因子Ⅱa
肝素、AT和凝血因子Ⅱa只有形成三联复合物,AT才能发挥作用灭活Ⅱa因子,而要形成三联复合物肝素分子链必须有足够的长度,至少要达到18个糖单位,相对分子质量要大于5400。而相对分子质量小于5400的肝素分子由于不能形成三联复合物,不能灭活Ⅱa因子。
1.2.1.2 灭活凝血因子Ⅹa
灭活凝血因子Ⅹa,肝素分子只需和AT结合不需要同时和Ⅹa因子结合,不需要形成肝素、AT和Ⅹa因子三联复合物,对肝素相对分子质量大小没有要求。因此所有肝素分子只要含有特殊的戊糖结构就可灭活Ⅹa因子。
1.2.2 激活肝素辅因子Ⅱ
肝素能激活肝素辅因子Ⅱ而直接灭活凝血因子Ⅱa。该作用是电荷依赖性的,不依赖戊糖结构,需要较高的肝素浓度。肝素辅因子Ⅱ介导的凝血因子Ⅱa的灭活是相对分子质量依赖性的,需要至少24个糖单位(相对分子质量7200以上)。在严重AT缺乏时,肝素的这种机制可起作用。
1.2.3 促进组织因子途经抑制物(TFPI)释放
TFPI是体内主要的生理抗凝物质。肝素能够促进和内皮结合的TFPI的释放,TFPI和凝血因子Ⅹa结合并灭活Ⅹa,形成TFPI/凝血因子Ⅹa复合物,灭活和组织因子结合的凝血因子Ⅶa。肝素通过该途径可抑制内皮损伤和粥样斑块破裂所导致的血栓形成。
1.2.4 其它
分子量较大的肝素还可和血小板结合,既抑制血小板表面凝血酶的形成,又抑制血小板聚集和释放,和血小板4因子(PF4)结合后可抑制PF4依赖性血小板功能,引起出血。还可增加血管壁的通透性,抑制血管平滑肌细胞的增生,抑制成骨细胞的合成,激活破骨细胞
促进骨质丢失。此外,肝素还具有抗炎、调节细胞增殖作用、免疫调节、调节多肽生长因子、抗肿瘤转移等多种生物学活性和药理作用。
项目普通肝素低分子肝素肝素戊糖平均分子量(道尔顿)1200045001728(分子量)抗凝特性抗Ⅹa和抗Ⅱa相似抗Ⅹa>抗Ⅱa 仅抗Ⅹa
抗Ⅹa/抗Ⅱa 1:1 2:1-4:1 1:0
抑制血小板聚集强弱无
血小板4因子结合力强弱无骨细胞结合力强弱无
普通肝素是一种分子量不均一的混合物,相对分子质量范围3000-30000不等,绝大部分在5400以上,既可以灭活凝血因子Ⅹa又可以灭活凝血因子Ⅱa,抑制凝血因子Ⅹa和凝血因子Ⅱa的作用相似,且可抑制血小板聚集,和血小板4因子以及骨细胞结合力较强,易引起出血及骨钙流失。
LMWH相对分子质量范围4500-6500,平均4500左右,大部分在5400以下,和肝素相比具以下作用特点:①LMWH的25-50%分子所含糖单位小于18(分子量小于5400),其更倾向于失活Xa而不是IIa,故其抗凝作用不以监测APTT(部分凝血酶原时间)决定,而应监测Xa活性;②和血小板因子IV(PF4)亲和力低,较少诱导血小板减少,其出血风险较普通肝素低;③可促组织型纤溶酶原激活物(t-PA)释放,能缩短优球蛋白溶解时间,有助于血栓溶解;④使骨骼钙丢失比肝素少。
肝素戊糖是一种新的选择性凝血因子Ⅹa抑制剂,但目前使用较少。同时,低分子肝素相对较弱,肝素戊糖则无该作用。
1.3 常用药物
我院现有的肝素类药物有:肝素钠、低分子肝素钙(那屈肝素钙,速碧林)、依诺肝素钠(克赛)、达肝素钠(法安明)。肝素钠为普通肝素的钠盐,那屈肝素钙、依诺肝素钠、达肝素钠则为低分子肝素的钙盐或钠盐。不同的低分子肝素是不同的药物。(见表3)
表3 我院现有的肝素类抗凝药物品种
药物来源规格平均分子量抗Ⅹa/抗Ⅱa
肝素钠* 猪肠粘膜或牛肺中提取精制
的硫酸氨基葡聚糖的钠盐
2ml:12500U12000 1.0:1
低分子肝素钙(速碧林)经亚硝酸解聚法的肝素片段
的钙盐
0.4ml:4100IU(抗Xa单位)3600-5000 3.2:1
依诺肝素钠(克赛)经苄基化后进行碱解聚的肝
素片段的钠盐
0.4ml:4000IU(抗Xa单位)3500-5500 4.1:1
达肝素钠(法安明)经亚硝酸解聚法的肝素片段
的钠盐
0.2ml:5000IU(抗Xa单位)5000 2.4:1
*注:我院肝素钠尚有外用制剂,如肝素钠乳膏(海普林)、复方肝素钠尿囊素凝胶(康瑞保),因其具有抗凝、抗炎、抗过敏、抗增生及促进组织水合的作用,能改善皮肤皮肤循环,促进新陈代谢,并能使胶原结构变疏松,外用治疗冻疮、皲裂、溃疡、浅表性静脉炎、软组织损伤、肥厚性瘢痕等皮肤病。在此主要介绍肝素钠的注射制剂。
三种LMWH的抗Ⅹa/抗IIa值有细微差别,其中伊诺肝素钠最高4.1:1,达肝素钠略低为2.4:1。有研究表明,抗Ⅹa/抗IIa值越大,抗凝活性越强。但在临床使用低分子肝素基本无
差别。
1.4 药代动力学
由于普通肝素和LMWH相对分子量的不同,使两者的抗凝作用靶点和强度有所不同。不同的LMWH制备工艺不同,因此化学结构上,它们虽有相同的主链,但末端侧链都不相同,低分子肝素钙和达肝素钠均为5元环,而依诺肝素钠为6元环。因此肝素类抗凝药物有着不同的药代动力学特性。(见表4)
参数肝素钠
低分子肝素
低分子肝素钙
(速碧林)
依诺肝素钠
(克赛)
达肝素钠
(法安明)
蛋白、内皮细胞、巨噬细胞
结合力
强弱弱弱T1/2(h)
(以抗Ⅹa计,单次给药)
约1 3.5 4 2-4 T max(h)2-4 3 3-5 3-4 生物利用度(%)20~30 近100 近100 90 血浆蛋白结合率高(约80%)低低低通过胎盘或血脑屏障不通过不通过不通过不通过
清除机制
血管内皮系统
(部分经肾脏)
肾脏(少量代谢形
式或原型)
40%肾脏(其中
原型10%)
肾脏
剂量依赖性消除是否否略相关
由表4可以看出,相对分子量大的普通肝素其药代动力学具以下特点:在体内可和多种蛋白质结合,血浆蛋白结合率高,生物利用度下降,抗凝活性降低;和内皮细胞、巨噬细胞结合力很强,结合后即被灭活,另有相当大比例的普通肝素经和内皮细胞结合后由网状内皮系统清除(快速饱和机制),故血浆半衰期缩短;只有部分经肾脏清除(慢速非饱和清除机制),且消除半衰期随着剂量的增加而增大。这些特点使治疗剂量下的普通肝素抗凝反应为非线性,抗凝强度和持续时间和剂量增加不成比例。
相对分子量小的LMWH,同普通肝素相比,其药动学特点为:和血浆蛋白结合力下降,生物利用度明显提高,达90%以上,使其具有良好的剂效反应关系;和血管内皮细胞、巨噬细胞结合较少,被细胞灭活少,半衰期是肝素的2-4倍;主要通过肾脏途径清除,消除半衰期和给药剂量不相关或略相关。
LMWH中,低分子肝素钙和达肝素钠的T1/2相似,依诺肝素钠单一给药T1/2和前两者相似,但重复给药后T1/2可延长至7h。低分子肝素钙和依诺肝素钠的消除不受剂量影响。达肝素钠的生物利用度较低分子肝素钙和依诺肝素钠略低,且消除半衰期和给药剂量略相关。
普通肝素和低分子肝素均不能通过胎盘或血脑屏障。
1.5 适应症、用法用量和禁忌症
1.5.1 肝素钠适应症、用法用量、禁忌
适应症:血栓形成或栓塞性疾病;各种原因引起的DIC;血液透析、体外循环、导管术、微血管手术等操作中及某些血液标本或器械的抗凝。
用法用量:①深部ih:首次5000~10000U,以后每8h 8000~10000U或每12h 15000~20000U;24h总量30000~40000U;② iv:首次5000~10000U后,或每4h100U/kg,NS 稀释;③ ivgtt:20000~40000U/d,加至NS1000ml持续滴注;滴注前先iv5000U作为初始剂;
④预防性治疗:防止腹部术后深部静脉血栓,术前2h先5000U皮下注射,但应避免硬膜外麻醉,然后每隔8~12h 5000U,共约7日。
禁忌症:对本品过敏、有自发出血倾向、血液凝固迟缓、活动性出血及严重肝功能不全者禁用。
1.5.2低分子肝素药物的适应症、用法用量、禁忌症(见表5)
表5低分子肝素类抗凝药物的适应症、用法用量和禁忌症
适应症低分子素钙
(速碧林)
依诺肝素钠
(克赛)
达肝素钠
(法安明)
预防中度血栓形成危
险手术
(腹部等手术)
2850IU(0.3ml)/d ih,首
次约术前2h给药。平均时
间使用<10日。
0.2ml或0.4ml,ih
qd(术前2h第1次
给药)一般持续
7-10天
术前1-2h 2500IU ih,术后每日晨
2500IU ih,直到可以活动(一般5-7
日或更长),后5000IU ih,qd,持续
12-14日。
高度
血栓
形成
危险
手术
髋、膝关
节置换
等矫形
外科术)
38IU/kg/d。术前12h、术
后12h各一次。后每天1次
用3日,第4日起
57IU/kg/d;可持续使用或
随后口服抗凝。
0.4ml ih qd(术前
12h第1次给药),
可持续连续3周
术前晚间5000IU ih,术后每晚5000IU
ih,直到可以活动(一般5-7日),也
可术前1-2h 2500IU ih,术后8-12h
2500IU ih,后每日晨5000IU ih,最多
持续5周。
其他
2850IU(0.3ml),ih qd,
使用时间小于10日
内科:有血栓栓塞
疾病史等患者
2850IU(0.3ml),ih qd
0.4ml ih qd,持续
6-14日(至患者不
需卧床为止)
血液透析
血管注射。无出血危险或
血透持续4h者,透析开始
动脉端单次注射65IU/kg
100IU/kg;高度出
血倾向,双侧
50IU/kg或单侧
75IU/kg;出现纤
维蛋白环,再给
50-100IU/kg。
慢性肾衰:血透不超过4h,30-40IU/kg
或快速iv5000IU;血透超过4h,快速
iv 30-40IU/kg,继以10-15IU/kg/h
ivgtt;急性肾衰:快速iv 5-10IU/kg,
继以每小时4-5IU/kg ivgtt。
治疗性深静脉血栓形成
0.1ml/10kg ih q12h,不应
超过10日。
150AxaIU/kg ih qd
或100AxaIU/kg ih
bid,持续10日
Ih qd: 200IU/kg≦18000IU/d;
ih bid: 100IU/kg (出血风险较高者)
ivgtt: 100IU/kg,q12h;
用本品的同时可立即口服VitK,联合
治疗至少5天。
不稳定心绞痛和
非Q波性心梗
联合阿司匹林(推荐
725-325mg),86IU/kg Ih
或iv,q12h,尽早使用,6
日达稳定。
100AxaIU/kg ih
q12h,和阿司匹林
同用。一般疗程
2-8日。
5000IU ih q12h (体重﹤80kg女性和
体重﹤70kg男性);7500IU ih q12h
(体重≧80kg女性和体重≧70kg男
性)。最大10000IU/12h。至少持续6
日。若需延长,推荐使用固定剂量作
为延长期治疗,直至进行血管重建操
作。总周期≦45日。
禁忌:对低分子肝素或其其中任何赋形剂过敏者禁用;有使用低分子肝素发生血小板减少的病史者、和止血异常有关的活动性出血或出血风险增加者、可能引起出血的器质性损伤、出血性脑血管意外、严重肾功能损害、未控制的高血压者禁用。
1.6 不良反应和注意事项
1.6.1 不良反应和注意事项(见表6)
药物常见不良反应注意事项过量处理特殊人群
肝素钠自发性出血;骨质疏
松和自发性骨折;肝
功能不良者长期使用
可有A T-Ⅲ耗竭而血
栓形成倾向。
①用药前及用药期间定时测定
凝血时间。②开始治疗1个月
内定期监测血小板计数
1%鱼精蛋白溶液缓慢
滴注。1mg可中和100U
肝素钠。
①妊娠后期和产后妇女
慎用②60岁以上,尤其
是老年妇女,减量并加
强用药随访。
低分子肝素
钙(速碧林)不同部位出血,一过
性转氨酶升高,注射
部位小血肿、反应。
①治疗前测定血小板计数,用药
后biw监测,持续21日,此后需
延长者,每周测定。如第5-21日
血小板数量下降至基础值
30-50%、出现血栓或原血栓恶
化、DIC须停用;有肝素引起血
小板减少病史,需qd进行临床监
测和血小板计数评估
②肝功能不全、严重动脉性高血
压、可能引起出血器质性损伤
史、绒毛膜-视网膜血管疾病、
脑部/脊髓或眼外科术后须注意
③有高血钾风险者监测血钾
④和腰穿、脊髓麻醉或硬膜外麻
醉有足够的使用间隙
③低体重者(女性<45kg,男性
<57kg),严密监测。
只有情况严重时考虑
使用硫酸鱼精蛋白。
0.6ml中和约950IU抗
Ⅹa活性。
①不建议妊娠期和哺
乳期妇女使用
②肾功能轻度损害者
不需减量;30 ml/min﹤
ccr<50ml/min时,剂量减
少25-33%。
依诺肝素钠(克赛)出血;部分注射部位
瘀点、瘀斑;治疗几
个月后有骨质疏松倾
向,转氨酶升高。
缓慢静脉注射鱼精蛋
白。1mg中和1mg抗凝
作用,中和抗Ⅹa活性
最大60%。
①老年人如肾功能正
常,预防量无需调整②
孕妇权衡利弊,哺乳期
停止哺乳③儿童禁用④
肾功能不全,qd,预防
2000IU,治疗1000IU,
轻中度严密监测⑤肝功
能不全须注意。
达肝素钠(法安明)大剂量引起出血;注
射部位皮下血肿和暂
时性轻微的血小板减
少症(Ⅰ型)
凝血时间延长可被完
全中和,抗Ⅹa活性只
被中和约25-50%。1mg
抑制100IU抗Xa活性。
不推荐孕妇使用。
项目肝素钠
低分子肝素
那屈肝素钙
(速碧林)
依诺肝素钠
(克赛)
达肝素钠
(法安明)
血小板减少症1-3% <0.1% 0.1% 0.1% 骨质疏松症高低低低监测抗凝活性常规非常规非常规非常规
监测血小板计数开始治疗1个月内
定期
治疗前,治疗中一
周2次,共21日
治疗前,治疗中
治疗前,治疗中定
期,特别是第一周
鱼精蛋白中和
(抗Ⅹa活性)
完全部分60% 25-50%
不需要常规监测抗凝活性,但必须在治疗前和治疗中监测血小板计数,而普通肝素用药期间均应定时测定凝血时间和定期监测血小板计数。那屈肝素钙的血小板减少发生较其它两种低分子肝素少。由于低分子肝素和蛋白的结合力弱,因此抗Xa活性不能被鱼精蛋白完全中和,药物过量的解毒一般在紧急情况下考虑。
1.6.3 “钙盐”和“钠盐”的区别
“钙盐”和“钠盐”在体内代谢过程基本相似,抗凝作用相似,不良反应基本相似,但“钙盐”不会减少细胞间毛细血管的钙胶质,也不改变血管通透性,可减少“钠盐”易致出血的副作用,较少出现皮肤瘀斑。“钙盐”的注射局部疼痛刺激也较“钠盐”轻。
1.7 药物相互作用
1.7.1 加重出血危险而不宜合用的药物
①解热镇痛剂量的乙酰水杨酸类药物及其他非甾体类消炎镇痛药(全身性),能抑制血小板功能和对胃十二指肠粘膜有侵蚀作用。
②右旋糖酐40(胃肠外途径)、噻氯吡啶能抑制血小板功能,不建议合用。
③皮质类固醇(糖皮质激素,全身性运用),能增加肝素使用后的出血危险(胃肠道粘膜,血管脆性),尤其是在大剂量或治疗时间超过10日以上。联合使用时必须调整用量并加强监测。
④华法令等香豆素类药物可导致严重的凝血因子Ⅸ缺乏而致出血。
⑤抗血小板凝集剂量的乙酰水杨酸(治疗不稳定性心绞痛,非Q波心肌梗塞),潜在出血危险,常规临床监测。
⑥其它尚有依他尼酸、组织纤溶酶原激活物(t-PA)、尿激酶、链激酶等。
1.7.2 肝素的配伍禁忌
阿米卡星、柔红霉素、乳糖酸红霉素、硫酸庆大霉素、氢化可的松琥珀酸钠万古霉素、头孢哌酮、氯丙嗪、异丙嗪、麻醉性镇痛药等。
1.7.3 其它
①肝素合用碳酸氢钠、乳酸钠等纠正酸中毒的药物可促进肝素的抗凝作用。
②肝素可和胰岛素受体作用,从而改变胰岛素的结合和作用,已有肝素致低血糖的报道。
③甲巯咪唑、丙基硫氧嘧啶和肝素有协同作用。
依诺肝素钠注射液 警示语: 【药品名称】通用名称:依诺肝素钠注射液 汉语拼音:Yinuo Gansuna Zhusheye 【性状】本品为无色或淡黄色澄明液体。 【适应症】 2000AxaIU和4000AxaIU注射液 ·预防静脉栓塞性疾病(防止静脉内血栓形成),特别是与骨科或普外手术有关的血栓形成。6000AxaIU,8000AxaIU,和10000AxaIU注射液 ·治疗不稳定性心绞痛及非Q波心肌梗死,与阿司匹林同用。 ·治疗已形成的深静脉栓塞,伴或不伴有肺栓塞。 ·用于血液透析体外循环中,防止血栓形成。 【规格】(1)0.4ml:4000AxaIU;(2)0.6ml:6000AxaIU 【用法与用量】为预防及治疗目的而使用低分子肝素时应采用深部皮下注射给药,用于血液透析体外循环时为血管内途径给药。 本品为成人用药。 禁止肌肉内注射。 每毫升注射液含10000 AxaIU ,相当于100mg依诺肝素钠。每毫克(0.01ml)依诺肝素钠约等于100 AxaIU。 皮下用药须知:在注射之前不需排出注射器内的气泡。 预装药液注射器可供直接使用。应于患者平躺后进行注射。应于左右腹壁的前外侧或后外侧皮下组织内交替给药。注射时针头应垂直刺入皮肤而不应成角度,在整个注射过程中,用拇指和食指将皮肤捏起,并将针头全部扎入皮肤皱折内注射。 应严格遵循推荐剂量或遵医嘱。 在外科患者中,预防静脉血栓栓塞性疾病 当患者有中度血栓形成危险时(如腹部手术),本品推荐剂量为2000AxaIU(0.2ml)或4000AxaIU(0.4ml)每日一次皮下注射。在普外手术中,应于术前2小时给予第一次皮下注射。当患者有高度血栓形成倾向时(如矫形外科手术),本品推荐剂量为术前12小时开始给药,每日一次皮下注射4000AxaIU(0.4ml)。 在蛛网膜下腔/硬膜外麻醉及经皮冠脉腔内成形术时,应特别注意给药间隔,见特殊警告。依诺肝素治疗一般应持续应用7至10天。某些患者适合更长的治疗周期,若患者有静脉栓塞倾向,应延长治疗至静脉血栓栓塞消失且患者不需要卧床为止。在矫形外科手术中,连续3周每日一次给药4000AxaIU是有益的。 在内可治疗患者中,预防静脉血栓栓塞性疾病 依诺肝素钠推荐剂量为每日一次皮下给药4000AxaIU(0.4ml)。依诺肝素钠治疗最短应为6天直至患者不需卧床为止,最长为14天。 治疗伴有或不伴有肺栓塞的深静脉血栓 依诺肝素钠可用于为皮下每日一次注射150AxaIU/kg或每日两次100AxaIU/kg。当患者合并栓塞性疾病时,推荐每日两次100AxaIU/kg。依诺肝素钠治疗一般为10天。应该在适当时开始口服抗凝剂治疗,并应持续依诺肝素钠治疗直至到抗凝治疗效果(INR:2至3)。 治疗不稳定性心绞痛及非Q波心梗 皮下注射依诺肝素钠推荐剂量为每次100AxaIU/kg,每12小时给药一次,应与阿司匹林同用(每日一次口服100至325mg)。在以上患者中推荐疗程最小为2天,至临床症状稳定。一般疗程为2至8天。
无肝素透析 在护士配置无比紧缺的国内血透室,每位透析护士都被锻炼成了“千手观音”,可以轻松同时负责多个病人的穿刺,上下机,报警处理等常规操作。 但是根据小编不算多的经验来看有几类情况是临床护士相对不愿意面对的: 1.同组导管太多; 2.血管通路功能不良; 3.患者状态不佳,并发症多…… 要是再附加一个无肝素抗凝的患者,我相信每位当班护士都会疯掉 护士小花:无肝素呀,要是凝血可咋办? 无良小编:无肝素哦,凝血才是正常的。 不闹了,言归正传,今天聊聊无抗凝剂治疗的护理: 那么目前我们针对无肝素抗凝的操作方法是什么?先来复习一下2010版SOP,虽看似简单的几段话,其实步步充满玄机。 01 透析器的预处理环节 应重视透析器的预处理,这在很久以前推送的一篇文章内已经表述很清晰,然而,无肝素治疗在此基础上又添加了一些“料”, 比如:用肝素钠注射液4mg/dl=20mg/500ml密闭循环10~30min时间不等,然后再用500ml生理盐水替换管路及透析器内的肝素盐水(但据小编了解,有些临床医护对无肝素的认识很不到位,管路内的肝素盐水并未替换) 说明1:各个透析室剂量有所不同,此处仅举例;
说明2:关于肝素钠mg与U单位剂量的话题 替换的目的是让透析膜肝素化的同时将残余的肝素冲掉避免进入病人体内。 小编去查了查资料,肝素是一种带负电荷的氨基葡聚糖硫酸脂,而目前市场上最主流的合成膜大部分带负电荷:比如PMMA膜、PAN膜等(我们都知道同性相斥,gay和les除外)但是我们却非要它们在一起(冤孽啊)!!!但是同时现在的膜都带有一定的吸附力,假设它们真的克服困难(真爱)在一起了,那500ml盐水的冲洗到底能不能阻断这场孽缘? -----关于肝素和透析膜的资料均来源于《血液净 化学第4版》 这个时候又要分成两种情况: 1.彻底了断(包括膜)那么肝素化就成了空谈---几乎不可能; 2.藕断丝连(多数老师都喜欢这样吧,原因不可描述),那就意味着在治疗中有未知量的肝素在持续进入人体(能吸附在膜上自然也就能冲下来),这也许是用肝素循环后治疗时间有效延长的真正原因;那这样还算不算无肝素抗凝?如果患者出血量增大算谁的责任? 02 治疗中的冲洗环节 第二步是治疗中每30-60min用100-200ml生理盐水冲洗管路。 为了方便举例小编取中间值每45min冲洗150ml来计算, 冲洗时候血泵速度以150ml/min运转(速度也是坑,快了怕病人心衰,慢了担心停止时间过长),假设需要治疗3小时,那整个治疗过程中需要冲洗盐水450-600ml,超滤量也相应等量增加;同样从患者动脉通路至泵前补液管这段血液会因此导致停滞3-4次,每次约1min左右。
min 10121416182022 nRIU 5000 10000 15000 20000 25000 30000 min 10121416182022 mAU 1 2 3 4 1 8 . 2 1 9 1 6 . 1 3 1 9 . 9 8 UV 234 nm RI Columns: Zenix?-100 (3 m, 100 ?, 7.8x300 mm) Flow Rate: Mobile phase: 0.5 mL/min 2.84% Na2SO4, pH 5.0 Temperature: 35 o C Detection: UV 234 nm and RI Injection volume: 25 μL Samples: 10 mg/mL Dalteparin in water, pH 6.0, MW 3,000 – 8,000 Da LMW Heparin-Dalteparin and Enoxaparin Analysis on Zenix?-100 (7830)
Columns: Zenix ?-100 (3 m, 100 ?, 7.8x300 mm) Flow Rate: Mobile phase: 0.5 mL/min 2.84% Na 2SO 4, pH 5.0 Temperature: 35 o C Detection: UV 234 nm and RI Injection volume: 25 μL Samples: 10 mg/mL Enoxaparin in mobile phase, MW 3,000 – 8,000 Da Keywords: Size exclusion, Zenix, Zenix-100, low molecular weight heparin, high resolution, Enoxaparin, Dalteparin, Pharmaceuticals
商品名:克赛/Clexane 英文名:Enoxaparin 通用名:依诺肝素 【理化特性】 成分及含量: 每个注射器:20mg40mg60mg80mg100mg 依诺肝素钠:20mg40mg60mg80mg100mg 加注射用水至0.2ml0.4ml0.6ml0.8ml 1.0ml 剂型: 无菌无致热源可注射液,已预装入注射器。 药理治疗分类 抗栓剂/低分子肝素 (B:血液,造血器官) 【药理作用】 药效动力学特性: 本品为具有高活性抗Xa(100 I.U./mg)作用和低活性抗IIa 或抗凝血酶(28 I.U./mg)作用的低分子肝素. 在不同适应证所需的剂量下, 本品并不延长出血时. 在预防剂量时, 本品对APTT没有明显改变. 既不影响血小板聚集也不影响纤维蛋白原与血小板的结合. 药代动力学特性: 药代动力学参数源于对血浆中抗Xa因子活性的研究.
生物利用度:皮下注射本品可迅速并完全被吸收, 本品的生物利用度接近95%. 分布:皮下注射本品3小时后达最大血浆活性. 抗Xa活性存在于血管内. 生物转化:本品主要在肝脏代谢. 消除:使用40 mg 本品时其抗Xa 活性的半衰期约为4.4小时. 使用60mg 或 80mg 本品时约为4小时. 排泄:本品经尿排出. 在老年患者中消除半衰期略延长. 赋形剂成分:注射用水 【适应证】 -20 mg和40 mg注射液: .预防静脉栓塞性疾病 (防止静脉内血栓形成) 尤其是与某些手术有关的栓塞 .用于血液透析体外循环中,防止血栓形成 -60 mg, 80 mg和100 mg注射液: .治疗深静脉血栓形成 .治疗急性不稳定性心绞痛及非Q波心肌梗死,与阿司匹林同用 【用法及用量】 1 mg依诺肝素产生相当于100 I.U抗Xa活性 为预防及治疗目的而使用依诺肝素时应采用深部皮下注射给药,用于血
核准日期:2009年8月12日 修改日期: 依诺肝素钠注射液说明书 请仔细阅读说明书并在医师指导下使用 警示语:椎管内血肿。当实施椎管内麻醉(脊麻和硬膜外麻醉)或椎管穿刺时应注意,使用低分子肝素或肝素类物质预防血栓并发症的病人,有可能引起椎管内血肿,导致长期甚至永久性瘫痪,以上事件很少发生。放置硬膜外导管或反复硬膜外穿刺,合并使用影响止血功能的药物,如非甾体类抗炎药(NSAIDs)、血小板抑制剂或其它抗凝药物等,血肿发生率可能会更高。此种情况,应监测病人神经损害的症状和体征,如发现有可能损伤神经,应紧急处理。医生在对此类病人实施椎管内干预(麻醉或穿刺)时,应进行利弊权衡。 【药品名称】 通用名称:依诺肝素钠注射液 商品名称:克赛?Clexane 英文名称:Enoxaparin Sodium Injection 汉语拼音:Yinuogansuna Zhusheye 【成份】 化学名称:依诺肝素钠(低分子肝素钠) 化学结构式: 分子量:3500至5500道尔顿 辅料:注射用水 【性状】本品为无色或淡黄色的澄明液体。
【适应症】 2000 Axa IU 和4000 Axa IU注射液: ?预防静脉血栓栓塞性疾病(预防静脉内血栓形成) ,特别是与骨科或普外手术有关的 血栓形成。 6000 Axa IU, 8000 Axa IU 和10000 Axa IU注射液: ? 治疗已形成的深静脉栓塞,伴或不伴有肺栓塞,临床症状不严重,不包括需要外科手 术或溶栓剂治疗的肺栓塞。 ? 治疗不稳定性心绞痛及非Q波心肌梗死,与阿司匹林合用。 ? 用于血液透析体外循环中,防止血栓形成。 ? 治疗急性ST段抬高型心肌梗死,与溶栓剂联用或同时与经皮冠状动脉介入治疗(PCI)联用。 【规格】(1)0.2ml :2000 AxaIU (2)0.4ml: 4000 AxaIU (3)0.6ml: 6000 AxaIU (4)0.8ml :8000 AxaIU (5)1.0ml :10000 AxaIU 【用法用量】 预防静脉血栓栓塞性疾病,治疗深静脉栓塞,治疗不稳定性心绞痛及非Q波心肌梗死时应采用深部皮下注射给予依诺肝素;血液透析体外循环时为血管内途径给药;对于ST段抬高型急性心肌梗死,初始的治疗为静脉注射,随后改为皮下注射治疗。 本品为成人用药 禁止肌内注射 每毫升注射液含10000 AxaIU,相当于100mg依诺肝素。每毫克(0.01ml)依诺肝素约等于100 AxaIU。 皮下注射技术: 根据患者体重调整依诺肝素的注射剂量,注射前需将多余量排出,而在注射之前无需排 出注射器内的气泡。 预装药液注射器可供直接使用。应于患者平躺后进行注射。应于左、右腹壁的前外侧或 后外侧皮下组织内交替给药。 注射时针头应垂直刺入皮肤而不应成角度,在整个注射过程中,用拇指和食指将皮肤捏起,并将针头全部扎入皮肤皱折内注射。 只用于治疗ST段抬高型急性心肌梗死的静脉注射技术: 通过静脉通路给予依诺肝素,不能与其他药物混合或同时注射。为避免依诺肝素与其他 药物混合,应在给予依诺肝素的前后,使用足量的生理盐水或葡萄糖溶液冲洗静脉通路 以清除其它药物。依诺肝素和0.9%生理盐水或5%葡萄糖溶液合用是安全的。 ?初始3000AxaIU的静脉给药 对于初始3000AxaIU的静脉给药,用预填充的依诺肝素,注射器内保留3000AxaIU (0.3ml),排出多余的液体。可将3000AxaIU的剂量直接注射入静脉血管内。 ?冠脉血管成形术的额外静脉负荷剂量: 如果最后一次皮下给药在囊球扩张前8小时以上,冠脉血管成形术患者需要额外的 30AxaIU/kg静脉给药。为了确保该小注射量的准确性,推荐稀释药物至300AxaIU/ml。 为了得到300AxaIU的溶液,使用6000AxaIU的预填充依诺肝素钠注射液,推荐使用50ml 输液袋[使用例如生理盐水(0.9%)或5%葡萄糖溶液]进行如下操作:
无肝素透析操作流程 血管通路的选择 内瘘、股静脉或颈内静脉穿刺的插管,(经济条件不好)血管条件好的紧急血液透析患者,尽量选择粗大血管进行直接穿刺。 透析方法 1.用1000ml的生理盐水预先冲洗透析器和动、静脉血路管,血流量设定为100~150ml/min,预冲透析器时先不接旁路,注满透析器及血路管并排净透析器内所有的气体,待血室预冲完后(排完气后)再接旁路,常规冲洗透析器及管路。 2.用含肝素12500U/500ml的生理盐水预先冲洗动、静脉血路管和透析器,并循环浸泡,减慢密闭循环时的血流速度(<100ml/min),透析机脱水量设定为750m1/h,使肝素盐水中的肝素充分、均匀的吸附在透析器及管路的管壁上,使局部形成良好的抗凝效果,循环20分钟~30分钟吸附肝素。[有资料依据] 3.用500ml的0.9%生理盐水冲去透析器和血路管通路中残留的肝素即可进行透析。 4.高血流量透析是无肝素透析的关键,透析开始后只要患者能耐受,血流量尽可能快速打高,血流量可打至
250~300m1/min,透析液流量500ml/min,透析时间为4小时。[有资料依据] 5.治疗结束后,降低血流量至65m1/min,关血泵,将动脉穿刺针上的卡子夹住(停止引血),接0.9%生理盐水100ml 回血。[目前科室使用方法] 监护要点 1.透前一定要确保预充的质量,排尽空气使透析膜和管路产生良好的抗凝效果。 2.血流量要充足,始终保持在250~300 ml/min。 3.加强透析过程的监护,密切观察静脉压、透析器和管道的颜色变化,动静脉滤网处有无变色和分层及血栓,静脉液面有无大量泡沫,有无纤维蛋白析出等,应及时处理,尽量减少报警次数,防止引起凝血。 4.透析过程中避免输血、输高张盐、高渗糖、脂肪乳剂等,以免造成凝血,超滤除水不宜过多,以免血液浓缩引起凝血。 5.观察透析前后患者的出血情况,记录透析后透析器及管 路凝血情况、透析器复用次数、穿刺点压迫止血时间,同时有条件的监测透析前后的凝血时间(CT)(试管法)、凝血酶原时间(PT)、血小板计数(PC)。 凝血的常见原因
无肝素透析操作流程 一、应用指征 1、有活动性出血及高危出血倾向的患者,如颅内出血、消化道出血、近期手术、大面积创伤或创伤性检查等。 2、凝血系统疾病有凝血功能功能障碍的患者。 3、应用肝素有禁忌证者,如肝素过敏、肝素引起的血小板减少症等。 二、方法与护理 1.透析前准备: (1)备齐用物,核对患者姓名、透析器、透析管路的型号及有效期、透析机及透析方式; (2)准备机器,开机,机器自检。准备透析液,检查透析液浓度及有效期,正确连接透析液管路。 2.检查血液透析器及透析管路有无破损,外包装是否完好,查看有效日期、型号,遵循无菌原则按照体外循环的血流方向依次安装管路和透析器; 3.预冲: (1)启动透析机血泵80-100毫升/分钟,用生理盐水先排净透析管路和透析器血室(膜内)气体,生理盐水流向为动脉端→透析器→静脉端,不得逆向预冲;此时透析器静脉端朝上。 (2)将泵速调至200-300毫升/分钟,连接透析液接头与透析器旁路,排净透析器透析液室(膜外)气体;此时透析器动脉端朝上。 (3)生理盐水预冲量,应严格按照透析器说明书中的要求进行; (4)用肝素生理盐水进行闭式循环15-20分钟。 (5)引血透析前用生理盐水500Ml将透析器及管路中的肝素盐水全部排掉,以免肝素进入患者体内。 2、建立良好的血液通路,保证透析时有充分的血流量,通过内瘘、深静脉留置插管均可建立体外循环,以确保透析的效果和防止凝血。上机后在患者可耐受的情况下,尽可能设置高流量,一般血流量为250~300 ml/min。
3、透析过程中每20~30分钟用100~200ml生理盐水冲洗透析器及管路一次。 4、应随着冲洗NS的增加,调整脱水量,以维持血容量平衡。 (5).不能完全避免体外凝血,对严重贫血,血小板低下患者效果好,无贫血,有高凝状态的患者凝血机会大,一般3-4h;(6).过程中严密观察动静脉压和血色,上升提示有凝血可能,加强冲洗;持续上升应做好回血准备。(7).观察透析器颜色的变化,颜色变黑有凝血可能,同时观察动脉壶张力,上升提示凝血可能;(8).便于观察,动静脉滤网液面在2/3较合理;(9).无肝素透析,不应在动脉管路上输血和输注脂肪乳剂,因两者均可增加透析器凝血的危险。(二)护理 1、做好心理护理。治疗前加强与患者和家属沟通,让患者和家属了解无抗凝透析的必要性和可能所致的凝血。心理因素对患者的治疗配合及血透效果起着重要的作用。透析前护士应用亲切的语言及和蔼的态度了解病情,安慰患者,用熟练准确的技术为患者治疗护理,使其在心理上解除恐惧,产生安全感,使患者得到精神支持,更好地配合我们进行血液透析治疗。 2、根据患者病情尽可能将血流量维持在250~300ml/min。护士操作要熟练,要保证体外循环血泵安全有效持续运转,严防血泵停止转动。对神志不清的患者,要妥善固定穿刺侧肢体和血管通路,避免血管不通畅、血流量不足而引起体外循环凝血。 3、单次透析时间以3小时左右为宜,并选择一次性使用透析器。定期冲洗管路冲洗时应关闭管路动脉端口,用预先连接好的生理盐水迅速冲洗管路及透析器,冲洗时观察透析器及管路有无血凝块,严防血凝块进入患者体内。冲洗频率可按需要增减。严格掌握透析过程中冲洗生理盐水的时间和剂量,并做好记录。因冲洗而进入体外循环血管通路内的液体量应通过增加等量的超滤来加以清除,以维持治疗时的液体平衡,避免患者血容量的增加而加重其心脏负担。若有心衰的患者应在短时间内先进行单超,减轻心脏负荷后再进行无肝素透析。透析过程
?L IMIT OF F LUORIDE ADDITIONAL REQUIREMENTS [N OTE —Use plasticware throughout this test.] ?P ACKAGING AND S TORAGE : Preserve in tight, light-resistant Buffer: Dissolve 110g of sodium chloride and 1g of containers, and avoid exposure to excessive heat.sodium citrate in 700mL of water in a 2000-mL volu-?USP R EFERENCE S TANDARDS ?11?metric flask. Cautiously add 150g of sodium hydroxide,USP Enflurane RS and dissolve with shaking. Cool to room temperature,and, while stirring, cautiously add 450mL of glacial acetic acid to the cooled solution. Cool, add 600mL of isopropyl alcohol, and dilute with water to volume; the pH of this solution is 5.0–5.5. Enoxaparin Sodium Standard stock solution: 1mg/mL of fluoride ion, pre-pared as follows. Transfer 221mg of sodium fluoride,previously dried at 150° for 4 h, to a 100-mL volumet-ric flask. Add 20mL of water, and mix to dissolve. Add 1.0mL of sodium hydroxide solution (1 in 2500), and dilute with water to volume. [N OTE —Store in a tightly closed plastic container.] Standard solution A: 100mL of a solution containing 1μg/mL of fluoride ion in Buffer , from Standard stock solution Standard solution B: 100mL of a solution containing 3μg/mL of fluoride ion in Buffer , from Standard stock solution Standard solution C: 100mL of a solution containing 5μg/mL of fluoride ion in Buffer , from Standard stock solution Standard solution D: 100mL of a solution containing 10μg/mL of fluoride ion in Buffer , from Standard stock solution [9041-08-1]. Sample stock solution: Enflurane and water (1:1).Shake the Sample stock solution for 5 min, allow the DEFINITION liquids to separate completely, and use the water layer.Enoxaparin Sodium is the sodium salt of a depolymerized Sample solution: Sample stock solution and Buffer heparin. It is obtained by alkaline depolymerization of (1:1). Use volumetric glassware. heparin benzyl ester. The starting material, heparin, is ob-Electrode system: Use a pH meter capable of a mini-tained exclusively from porcine intestinal mucosa. Heparin mum reproducibility of ±0.2 mV, equipped with a glass-source material used in the manufacture of Enoxaparin sleeved, calomel-fluoride, specific-ion electrode system Sodium complies with the compendial requirements (see pH ?791?).stated in the Heparin Sodium monograph. Enoxaparin So-Analysis dium consists of a complex set of oligosaccharides that Samples: Standard solutions and Sample solution have not yet been completely characterized. The majority Transfer the solution to a 150-mL beaker, add a of the components have a 4-enopyranose uronate struc-polytef-coated stirring bar, and immerse the elec-ture at the nonreducing end of their chain. About 20% of trodes in the solution. Stir with a magnetic stirrer the materials contain a 1,6-anhydro derivative on the re-having an insulated top until equilibrium is obtained ducing end of the chain, the range being between 15%(1–2 min), and record the potential, in mv. [N OTE —and 25%. The weight-average molecular weight of Enox-Rinse and dry the electrodes between measurements,aparin Sodium is 4500 Da, the range being between taking care to avoid damaging the crystal of the spe-3800 and 5000 Da; about 16% have a molecular weight cific-ion electrode.] of less than 2000 Da, the range being between 12.0% Plot the logarithm of the fluoride-ion concentrations,and 20.0%; about 74% have a molecular weight between in μg/mL, of the Standard solutions versus the poten-2000 and 8000 Da, the range being between 68.0% and tial, in mV. From the measured potential of the Sam-82.0%. NMT 18.0% have a molecular weight higher than ple solution and the standard curve, determine the 8000 Da. When prepared as a solution, the solution is concentration, in μg/mL, of fluoride ions in the Sam-analyzed for clarity and degree of color using a validated ple solution . method. The degree of sulfation is NLT 1.8per disaccha-Acceptance criteria: NMT 10μg/mL ride unit. It has a potency of NLT 90 and NMT 125 Anti-?L IMIT OF N ONVOLATILE R ESIDUE Factor Xa International Units (IU)/mg, and NLT 20.0 and Analysis: Allow 10.0mL to evaporate at room tempera-NMT 35.0 Anti-Factor IIa IU/mg, calculated on the dried ture in a tared evaporating dish, dry the residue at 50°basis. The ratio of Anti-Factor Xa activity to Anti-Factor IIa for 2 h, and weigh. activity is between 3.3 and 5.3. Acceptance criteria: NMT 2mg of residue remains.IDENTIFICATION SPECIFIC TESTS ?A . U LTRAVIOLET A BSORPTION ?197U ??S PECIFIC G RAVITY ?841?: 1.516–1.519 Medium: 0.01 N hydrochloric acid ?R EFRACTIVE I NDEX ?831?: 1.3020–1.3038 at 20° Sample solution: 500μg/mL ?W ATER D ETERMINATION , Method I ?921?: NMT 0.14%Acceptance criteria: The spectra exhibit maxima at ?A CIDITY OR A LKALINITY 231±2 nm. Sample: Shake 20mL of Enflurane with 20mL of car-bon dioxide-free water for 3 min, and allow the layers to separate. Draw off the water layer, add bromocresol Change to read: purple TS as the indicator, and titrate with 0.010 N sodium hydroxide or 0.010 N hydrochloric acid. ?B . 13C NMR S PECTRUM Acceptance criteria: NMT 0.10mL of 0.010 N sodium (See ?Nuclear Magnetic Resonance Spectroscopy ?761??(CN hydroxide or NMT 0.60mL of 0.010 N hydrochloric 1-May-2016).) acid is required for neutralization. Standard solution: Dissolve 200mg of USP Enoxaparin Sodium RS in a mixture of 0.2mL of deuterium oxide U S P M o n o g r a p h s
血液透析室护理查房 查房过程记录: 病例 患者,于1年前无明显诱因出现泡沫尿,无眼睑及双下肢水肿,自觉乏力,食欲减退,劳累后有腰痛后背部不适,遂来我院就诊。查血示Cr600、7ummol/L,诊断为慢性肾衰竭,住院治疗并给予规律透析治疗。1月前无明显诱因出现恶心,伴上腹部疼痛,口服奥美拉唑肠溶胶囊治疗,症状改善不明显。5天前出现大便带血,为鲜血,无胸闷,憋喘,门诊以血便查因收住院。 评估:1、有无血友病等遗传性出血性疾病。 2、就是否长期使用华法林等抗凝血药物或抗血小板药物。 3、既往存在消化道溃疡等潜在出血风险的疾病。 4、严重创伤或外科手术后24 小时内。 5、对患者凝血状况、血常规、血流量等情况进行评估。 准备: 1、相对无肝素:预冲管路及透析器后,用50mg肝素加入500ml0、9%NS,充分循环15—20min再用生理盐水将管路中的肝素盐水冲走。 2、透析器与血路管要充分排气,减少凝血机会。 3、温度设置为36、5℃—37℃,防止温度过低发生凝血,过高发生溶血。 4、根据病人的具体情况选择合适的透析器。 5、冲洗的生理盐水总量应计算到超滤总量中。 护理问题:潜在并发症:透析器及管路凝血。 护理措施: 1、保证足够的血流量就是避免凝血的关键。选择有血流量充足的血管进行穿刺,在患者可耐受的情况下,血量最好能250~300ml/min,时间少于3小时。 2、避免出现透析中有抽吸现象。因为在血流量的抽吸中容易引起机器报警与停 泵而增加凝血频率的发生。 3、对于行为活动不能很好控制的患者加强专人护理,必要时给予约束带。避免由于血流量不足引起体外循环凝血而影响透析质量。 4、透析中,根据病人情况,每30~60 min冲洗透析器。冲洗时泵速最好在100—130 mL/min。每次盐水冲管时,密切透析动静脉壶内有无小凝血块,任何细小的血丝、小的凝血块及小气泡都有可能导致凝血。 5、冲洗应瞧到透析器一半以上变白,动静脉壶颜色变淡,如观察到冲洗时动静脉壶,
Revision Bulletin 1 Official December 1, 2008 Add the following: the dried basis. The ratio of anti-factor X a activity to anti-factor II a activity is between 3.3 and 5.3. Packaging and storage—Preserve in tight containers, and store be-low 40°, preferably at room temperature. s Enoxaparin Sodium USP Reference standards ?11?—USP Benzyl Alcohol RS . USP En-dotoxin RS . USP Enoxaparin Sodium RS . USP Enoxaparin Sodium Solution for Bioassays RS . USP Enoxaparin Sodium Molecular Weight Calibrant A RS. USP Enoxaparin Sodium Molecular Weight Calibrant B RS.Identification— A: Ultraviolet Absorption ?197U ?—Solution:500μg per mL. Medium:0.01N hydrochloric acid. The spectra exhibit maxima at 231±2 nm. B:13C NMR spectrum (see Nuclear Magnetic Resonance ?761?)— Standard solution—Dissolve 200mg of USP Enoxaparin Sodium RS in a mixture of 0.2mL of deuterium oxide and 0.8mL of water.Add 0.05mL of deuterated methanol to serve as an internal reference. Test solution—Dissolve 200mg of Enoxaparin Sodium in a mix-ture of 0.2mL of deuterium oxide and 0.8mL of water. Add 0.05mL of deuterated methanol. [9041-08-1].Procedure—Transfer the Standard solution and the Test solution to NMR tubes of 5-mm diameter. Using a pulsed (Fourier trans-Change to read: form) NMR spectrometer operating at not less than 75MHz for 13C,record the 13C NMR spectra of the Standard solution and the Test ? Enoxaparin Sodium is the sodium salt of a de-solution at 40°. The spectra are similar. polymerized heparin. It is obtained by alkaline de-C:The ratio of the numerical value of the anti-factor X a activ-polymerization of heparin benzyl ester. The starting ity, in Anti-Factor X a IU per mg, to the numerical value of the anti-factor II a activity, in Anti-Factor II a IU per mg, as determined by material, heparin, is obtained exclusively from porcine the Assay (anti-factor X a activity) and the Anti-factor II a activity,intestinal mucosa. ?Heparin source material used in the respectively, is not less than 3.3 and not more than 5.3. manufacture of Enoxaparin Sodium complies with the D:Molecular weight distribution and weight-average molecu-compendial requirements stated in the Heparin Sodium lar weight— monograph.?(RB 01-Dec-2008) Enoxaparin Sodium consists Mobile phase—Prepare a 0.5M lithium nitrate solution. Pass of a complex set of oligosaccharides that have not yet through a membrane filter having a porosity of 0.45 μm or less, and degas with helium. been completely characterized. The majority of the Standard solution—Dissolve about 10mg of USP Enoxaparin components have a 4-enopyranose uronate structure at Sodium RS, accurately weighed, in 1mL of Mobile phase . the non-reducing end of their chain. About 20 percent Test solution—Dissolve about 10mg of Enoxaparin Sodium, ac-of the materials contain a 1,6-anhydro derivative on the curately weighed, in 1mL of Mobile phase. reducing end of the chain, the range being between 15Chromatographic system (see Chromatography ?621?)—The and 25 percent. The weight-average molecular weight high performance size exclusion chromatograph is equipped with a of Enoxaparin Sodium is 4,500 Da, the range being be-differential refractive index detector, a 6- × 40-mm guard column tween 3,800 and 5,000 Da; about 16 percent have a and two 7.8- × 300-mm analytical columns in series, both analytical and guard columns prepacked with packing L59, and used at room molecular weight of less than 2,000 Da, the range being temperature. The flow rate is about 0.6mL per minute maintained between 12.0 and 20.0 percent; about 74 percent have a constant to ±1.0%. molecular weight between 2,000 and 8,000 Da, the Procedure—Reconstitute one vial each of USP Enoxaparin So-range being between 68.0 and 82.0 percent. Not more dium Molecular Weight Calibrant A RS and USP Enoxaparin So-than 18.0 percent have a molecular weight higher than dium Molecular Weight Calibrant B RS in 1mL of Mobile phase.Separately inject 20 μL of USP Enoxaparin Sodium Molecular 8,000 Da. When prepared as a solution, the solution is Weight Calibrant A RS and USP Enoxaparin Sodium Molecular analyzed for clarity and degree of color using a vali-Weight Calibrant B RS, record the chromatograms, and measure the dated method. The degree of sulfation is not less than retention times. Inject in duplicate 20 μL of each of the Standard 1.8 per disaccharide unit. It has a potency of not less solution and the Test solution, and record the chromatograms for a than 90 and not more than 125 Anti-Factor X a Interna-length of time to ensure complete elution, including salt and solvent peaks. Calculate the total area under each of the Standard solution tional Units (IU) per mg, and not less than 20.0 and not and Test solution chromatograms, excluding salt and solvent peaks more than 35.0 Anti-Factor II a IU per mg, calculated on at the end. Calibration curve—Plot the retention times on the x -axis against the peak molecular weights on the y -axis for the peaks in the chro-matograms of USP Enoxaparin Sodium Molecular Weight Calibrant A RS and USP Enoxaparin Sodium Molecular Weight Copyright 2008 The United States Pharmacopeial Convention All Rights Reserved.