(六)酶的抑制实验
一、实验目的
理解两大类抑制反应的基本原理和主要特点,并掌握可逆抑制反应确定的原
理和方法。
二、实验原理
根据抑制剂与酶结合的特点可分为不可逆抑制和可逆抑制二种类型,其中可
逆抑制有可分为三种类型:竞争性抑制、非竞争性抑制和反竞争性抑制。
(1)竞争性抑制类型:
酶不能同时与底物和抑制剂结合。动力学特征为:表观米氏常数Km'增加,
Vmax'不变。(Ki 为抑制剂常数,[I]为抑制剂浓度)。
][)][1(][S K I K S V v i
m m ++= )][1('i m m K I K K += (2)非竞争性抑制类型:
抑制剂、底物能同时与酶结合,但此复合物不能进一步分解为产物,Km ’不
变,Vmax’下降。
])[)(][1(][S K K I S V v m i m ++= i
m K I V V ][1'+= (3)反竞争性抑制类型:
抑制剂必须在酶和底物结合后方能与酶形成复合物,但此物不能分解为产物。
Km'、Vmax' 都发生变化。
])[][1(][S K I K S V v i m m ++= i
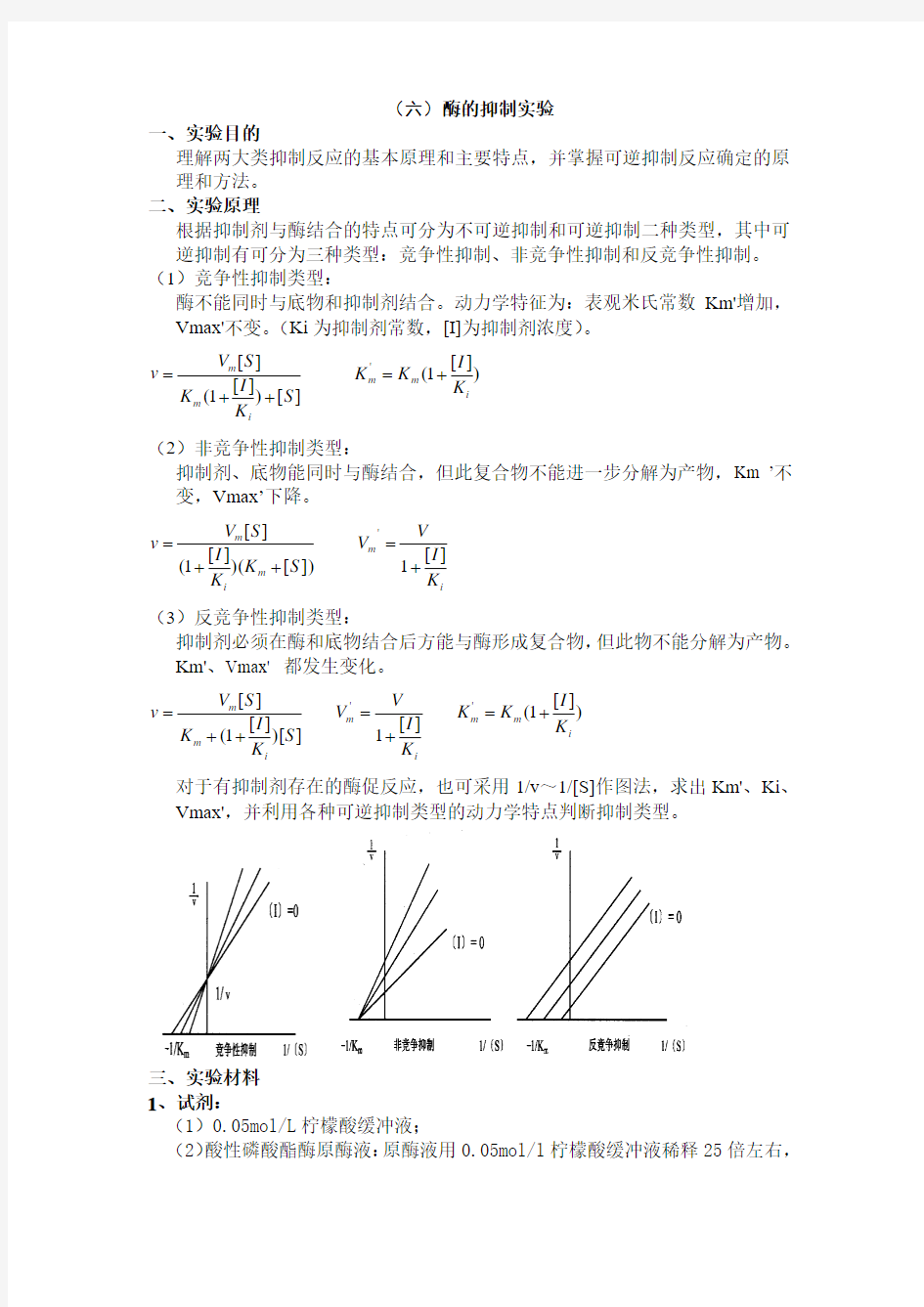
m K I V V ][1'+= )][1('i m m K I K K += 对于有抑制剂存在的酶促反应,也可采用1/v ~1/[S]作图法,求出Km'、Ki 、
Vmax',并利用各种可逆抑制类型的动力学特点判断抑制类型。
三、实验材料
1、试剂:
(1)0.05mol/L 柠檬酸缓冲液;
(2)酸性磷酸酯酶原酶液:原酶液用0.05mol/l 柠檬酸缓冲液稀释25
倍左右,
使测定的第五管A405,在0.6-0.7之间;
(3)1.2 mmol/L NPP;
(4)0.3 mol/L NaOH;
(5)10mmol/LKH2PO4
(6)3mmol/LNaF
2、仪器与玻璃器皿:
(1)恒温水浴槽;
(2)可见光分光光度计;
(3)试管、刻度吸管。
四、方法步骤
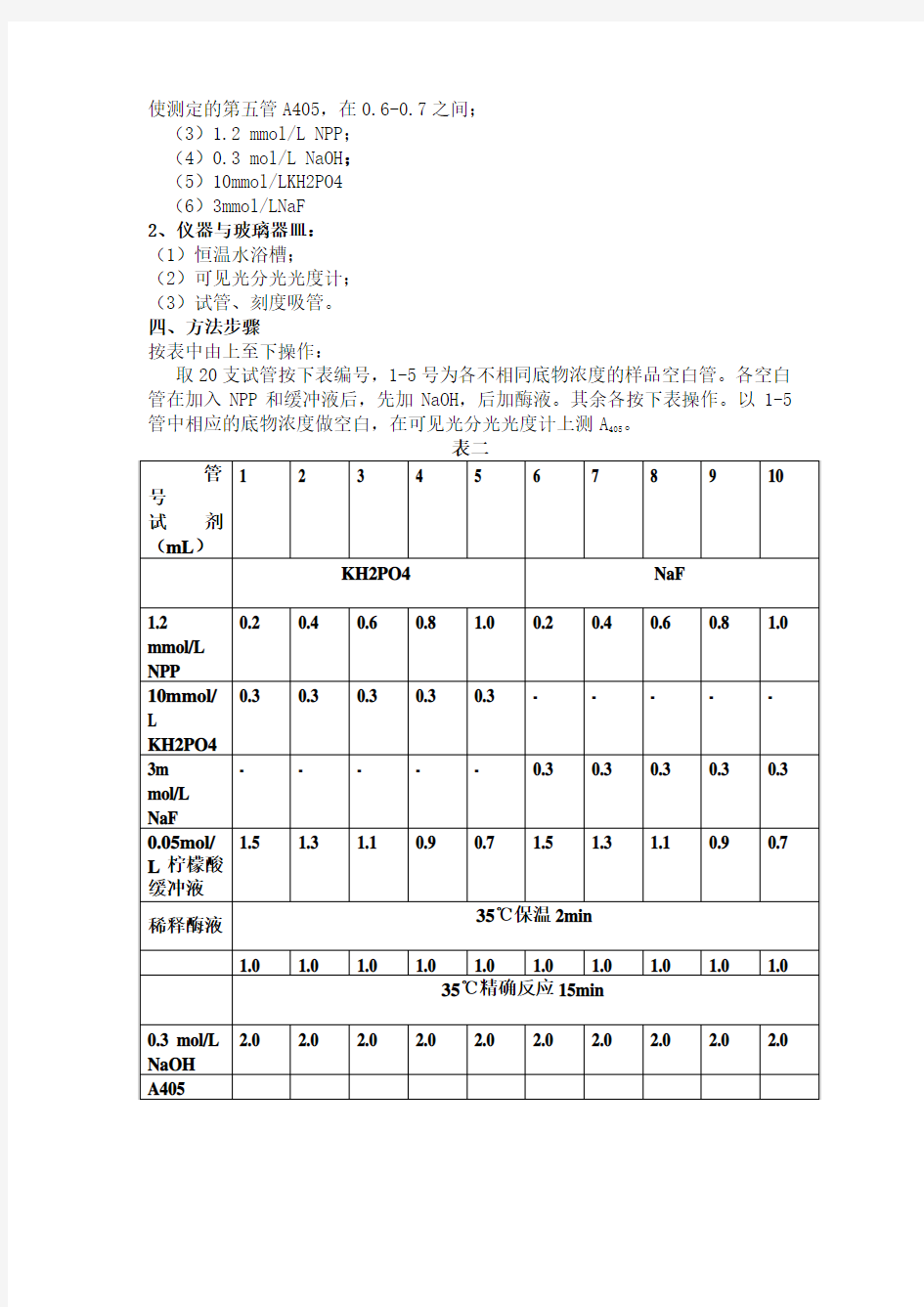
按表中由上至下操作:
取20支试管按下表编号,1-5号为各不相同底物浓度的样品空白管。各空白管在加入NPP和缓冲液后,先加NaOH,后加酶液。其余各按下表操作。以1-5管中相应的底物浓度做空白,在可见光分光光度计上测A
。
405
总结:KH2PO4为竞争性抑制剂Km’增大Vmax’不变,则 Km’=1.0,Km=0.286 Vmax’=Vmax=4*10-4,Ki=0.4。
NaF为反竞争性抑制剂, Km’增大, Vmax’增大,则 Km’=0.714,Km=0.286 Vmax’=10-3 ,Vmax=4*10-4, Ki=-0.5.说明 NaF对反应有促进作用,或者由于绘制曲线造成的误差,使抑制剂的效果不明显甚至变成激活剂。但从酶活力测定A405来看,NaF反应测得的 A405的确比无 NaF时的 A405值大,可能绘制回归曲线时,应该画非竞争性抑制类型。但是
NaF的1/V值都在无抑制剂的下方,说明不可能为非竞争性抑制类型。总之, NaF的类型存在争议,应多次测定并且用SPSS软件精确分析其回归方程后,才能确定其类型。
淀粉酶活力测定实验报告 淀粉酶活力测定实验报告实验三、淀粉酶活性的测定实验报告 实验四、淀粉酶活性的测定 一、实验目的: 1、了解α - 淀粉酶和β - 淀粉酶的不同性质及其淀粉酶活性测定的意义; 2、学会比色法测定淀粉酶活性的原理及操作要点。 二、实验原理: 淀粉酶存在于几乎所有植物中,特别是萌发后的禾谷类种子,淀粉酶活力最强,其中主要是α-淀粉酶和β-淀粉酶。根据α-淀粉酶和β-淀粉酶特性不同,α-淀粉酶不耐酸,在pH3.6以下迅速钝化;β-淀粉酶不耐热,70? 15min 则被钝化。测定时,使其中一种酶失活,即可测出另一种酶的活性。 淀粉在淀粉酶的催化作用下可生成麦芽糖,利用麦芽糖的还原性与3,5-二硝基水杨酸反应生成棕色的3-氨基-5-硝基水杨酸,测定其吸光度,从而确定酶液中淀粉酶活力(单位重量样品在一定时间内生成麦芽糖的量)。 三、实验用具: 1、实验设备 研钵,具塞刻度试管,离心管,分光光度计,酸度计,电热 恒温水浴锅,离心机,电磁炉。 2、实验材料与试剂 (1)0.1mol/l pH5.6的柠檬酸缓冲液:A液:称取柠檬酸20.01g,定容至 1000ml;B液:称取柠檬酸钠29.41g,定容至1000ml;取A液55ml与B液145ml混匀。 (2)1%可溶性淀粉溶液:1g淀粉溶于100ml 0.1mol/l pH5.6
的柠檬酸缓冲液; (3)1%3,5-二硝基水杨酸试剂:称取3,5-二硝基水杨酸1g、NaOH 1.6g、酒石酸钾钠30g,定容至100ml水中,紧盖瓶塞,勿使CO2进入; (4)麦芽糖标准溶液:取麦芽糖0.1g溶于100ml水中; (5)pH 6.8的磷酸缓冲液: 取磷酸二氢钾6.8g,加水500ml使溶解,用 0.1mol/L氢氧化钠溶液调节pH值至 6.8,加水稀释至1000ml即得。 (6)0.4mol/L的NaOH溶液; (7)1%NaCl溶液。 (8)实验材料:萌发的谷物种子(芽长约1cm) 四、操作步骤 1、酶液提取:取6.0g浸泡好的原料,去皮后加入10.0mL 1%的NaCl 溶液,磨碎后以2000r/min 离心10min,转出上清液备用。取上清液1.0ml,用pH 为6.8的缓冲溶液稀释5倍,所得酶液。 2、a- 淀粉酶活力测定 (1) 取试管4支,标明2支为对照管,2支为测定管。 (2) 于每管中各加酶液lml ,在 70?士0.5? 恒温水浴中准确加热15min ,取出后迅速用流水冷却。 (3) 在对照管中加入4m1 0.4mol/L氢氧化钠。 (4) 在4支试管中各加入1ml pH5.6的柠檬酸缓冲液。 (5) 将4支试管置另一个40?士 0.5? 恒温水浴中保温15min ,再向各管分别加入40?下预热的1,淀粉溶液 2m1,摇匀,立即放入40?恒温水浴准确计时保温 5min。取出后向测定管迅速加入4ml 0.4mol/L氢氧化钠,终止酶 活动,准备测糖。
目录 摘要 (1) 关键词 (1) Abstract (1) Key words (1) 引言 (2) 1 α-淀粉酶抑制剂的介绍 (2) 1.1 α-淀粉酶抑制剂的来源 (2) 1.2 α-淀粉酶抑制剂的特性研究 (3) 2 α-淀粉酶抑制剂的制备 (4) 2.1 来源于天然植物的α-淀粉酶抑制剂 (4) 2.11 豆类植物 (5) 2.12 麦类植物 (5) 2.13 齿苋类植物 (6) 2.14 其他植物 (7) 2.2 来源于微生物的α-淀粉酶抑制剂 (7) 3 α-淀粉酶抑制剂的分离纯化 (8) 4 α-淀粉酶抑制剂的检测方法 (9) 4.1 碘比色法 (9) 4.2 3,5-二硝基水杨酸(DNS)比色法 (9) 5 α-淀粉酶抑制剂的筛选方法 (10) 6 α-淀粉酶抑制剂的研究进展 (11) 6.1 国内外研究概况 (11)
α淀粉酶抑制剂的研究进展 摘要:α-淀粉酶抑制剂是一种糖苷水解酶抑制剂。抑制糖类消化吸收药物,减少糖分的摄取,降低血糖和血脂含量,还可作为抗虫基因。目前在医学和农业上具有广泛的用途。本文对α-淀粉酶抑制剂的制备、检测、筛选方法、特性以及发展进行了综述,并对其前景作了展望。 关键词:α-淀粉酶抑制剂,制备,检测,筛选方法,特性Research progress of α-amylase inhibitor Abstract:α-amylase inhibitor is a kind of glycoside hydrolase inhibitor, It can be potentially use as medicines of diabetes owing to inhibiting glucose from being absorbed in the digestive tracts. Which can reduce ingestion of sugar and blood fat contet and has hypoglycemic activity, and its gene can be used as insect-resistant genes in crops breeding. There is comprehensive, application in agriculture and medicine . The preparation、detection、screening methods、characteristics and development of the α-amylase inhibitors were reviwed in this paper, and the prospects were forecasted. Key words:α-amylase inhibitor, preparation, detection, screening methods, characteristics .
实验四、淀粉酶活性的测定 一、实验目的: 1、了解α - 淀粉酶和β - 淀粉酶的不同性质及其淀粉酶活性测定的意义; 2、学会比色法测定淀粉酶活性的原理及操作要点。 二、实验原理: 淀粉酶存在于几乎所有植物中,特别是萌发后的禾谷类种子,淀粉酶活力最强,其中主要是α-淀粉酶和β-淀粉酶。根据α-淀粉酶和β-淀粉酶特性不同,α-淀粉酶不耐酸,在pH3.6以下迅速钝化;β-淀粉酶不耐热,70℃ 15min 则被钝化。测定时,使其中一种酶失活,即可测出另一种酶的活性。 淀粉在淀粉酶的催化作用下可生成麦芽糖,利用麦芽糖的还原性与3,5-二硝基水杨酸反应生成棕色的3-氨基-5-硝基水杨酸,测定其吸光度,从而确定酶液中淀粉酶活力(单位重量样品在一定时间内生成麦芽糖的量)。 三、实验用具: 1、实验设备 研钵,具塞刻度试管,离心管,分光光度计,酸度计,电热恒温水浴锅,离心机,电磁炉。 2、实验材料与试剂 (1)0.1mol/l pH5.6的柠檬酸缓冲液:A液:称取柠檬酸20.01g,定容至1000ml;B液:称取柠檬酸钠29.41g,定容至1000ml;取A液55ml与B液145ml混匀。 (2)1%可溶性淀粉溶液:1g淀粉溶于100ml 0.1mol/l pH5.6的柠檬酸缓冲液; (3)1%3,5-二硝基水杨酸试剂:称取3,5-二硝基水杨酸1g、NaOH 1.6g、酒石酸钾钠30g,定容至100ml水中,紧盖瓶塞,勿使CO2进入; (4)麦芽糖标准溶液:取麦芽糖0.1g溶于100ml水中; (5)pH 6.8的磷酸缓冲液:取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8,加水稀释至1000ml即得。 (6)0.4mol/L的NaOH溶液; (7)1%NaCl溶液。 (8)实验材料:萌发的谷物种子(芽长约1cm) 四、操作步骤 1、酶液提取:取6.0g浸泡好的原料,去皮后加入10.0mL 1%的NaCl 溶液,磨碎后以2000r/min 离心10min,转出上清液备用。取上清液1.0ml,用pH 为6.8的缓冲溶液稀释5倍,所得酶液。 2、a- 淀粉酶活力测定 (1) 取试管4支,标明2支为对照管,2支为测定管。 (2) 于每管中各加酶液lml ,在 70℃士0.5℃恒温水浴中准确加热15min ,取出后迅速用流水冷却。 (3) 在对照管中加入4m1 0.4mol/L氢氧化钠。 (4) 在4支试管中各加入1ml pH5.6的柠檬酸缓冲液。 (5) 将4支试管置另一个40℃士 0.5℃恒温水浴中保温15min ,再向各管分别加入40℃下预热的1%淀粉溶液2m1,摇匀,立即放入40℃恒温水浴准确计时保温5min。取出后向测定管迅速加入4ml 0.4mol/L氢氧化钠,终止酶
土壤酶的测定 1.三角瓶用稀HNO 3(3-5%)或用洗衣粉浸泡24h,后刷洗,然后再用蒸馏水润洗,晾干。 2.土样研磨精细后分袋装好。土量需2g+2.5g+5g+5g=14.5g,重复一次,14.5×2=29g。 一、过氧化氢酶(容量法)(关松荫P323) 1.试剂配制: (1)0.3%过氧化氢溶液: ①(1:100 30%的H 2O 2和水) ②(0.5molH 2O 2+49.5ml蒸馏水) ③(1ml30% H 2O 2+99ml蒸馏水) (2)3N硫酸: (10ml硫酸+50ml水) (3)0.1N高锰酸钾溶液: (1.58gKMnO
4+100ml蒸馏水) 2.操作步骤: 2g风干土置100三角烧瓶→注入40ml蒸馏水和5ml 0.3%过氧化氢(现配)→在往复式振荡机上振荡20min→加入5ml3N硫酸(以稳定未分解的H 2O 2)→用慢速型滤纸过滤,→吸取25ml滤液,用0.1N高锰酸钾的滴定至淡粉红色 3.结果计算 过氧化氢酶的活性(M),以20min后1g土壤的0.1N KMnO 4的毫升数表示: M=(A-B)×T 式中: A: 空白消耗的0.1N KMnO 4毫升数 B: 滤液消耗的0.1 N KMnO 4毫升数 T: KMnO 4滴定度的校正值
以容量法测H2O2的酶活: Kappen (1913)首先介绍硫酸存在下用高锰酸钾滴定剩余的过氧化氢测定酶活。此法根据H 2O 2与土壤相互作用时,未分解的H 2O 2的数量用容量法(常用高锰酸钾滴定未分解的H 2O 2)测定H 2O 2的酶活 2 KMnO 4+5H 2O 2+3H 2SO 4→2MnSO 4+K 2SO
透明质酸预防外科术后粘连的研究进展 杨晓红凌沛学王凤山 透明质酸(hyaluronic acid,HA),又称玻璃酸,是1934年由Meyer和Palmer 首次从牛眼玻璃体中分离出的一种酸性黏多糖。70年代开始将1%HA溶液应用于眼科手术和治疗某些骨关节疾病,并由此形成了两门新兴的学科:眼科黏性手术学(viscosurgery)和黏弹性补充疗法(viscosupp-lement)。近年来,国内外对HA的分布、化学结构、生理功能和临床应用[1,2]等方面进行了广泛、深入的研究,其已成为具有较高临床价值的治疗药物,主要应用于:眼黏性手术、关节病、软组织修复和作为药物载体等,特别是在预防和减少外科术后组织粘连中取得了较大的进展。本文重点结合HA的生理功能,概述其自防止外科术后粘连方面的研究进展。 1 HA的生理功能 HA是由(1→3)-2-乙酰氨基-2-脱氧-β-D-葡糖-(1→4)-O-D-葡糖醛酸的双糖重复单位所组成的一种线形聚阴离子电解质。作为人体生理所必需的物质,它广泛存在于动物的各种组织中,包括结缔组织、皮肤、软骨、眼玻璃体和滑液等。HA分子位于细胞间的胶原与弹性纤维等的空间内,由多种细胞的细胞膜所产生,合成后直接进入细胞间质。作为细胞间质的主要成分之一,HA具有填充细胞空间、稳定细胞结构、覆盖和保护细胞的作用。它的重要的生物学作用之一就是稳定纤维蛋白和膜蛋白的细胞间结构。HA和细胞间纤维蛋白结合构成具有黏弹性、保护性、润滑性和稳定性的基质,细胞镶嵌在其中。HA的水溶液具有极强的黏弹性和假可塑性,即使在低浓度时也呈较高的流变学特性。HA的这种高黏弹性和低浓度特性使代谢产物可以从镶嵌有HA分子网筛中的细胞间自由扩散。 HA特定的流变学特性取决于它的线性聚阴离子结构,分子量可高达4×106~5×106。在水溶液中,HA以无规则螺旋形式存在,有很大的分子容积,使其在低浓度下(<0.01%)能够交织缠绕并且互相透入,因而增强了HA的流变学特性[3]。 HA能润滑和保护由胶原网络构成的组织表面(软骨和肌腱)和镶嵌于胶原网络中的结缔组织细胞(滑液组织、肌鞘和筋膜)。大分子HA作用于淋巴脊髓
实验五激活剂、抑制剂、温度及PH对酶活性的影响 一、目的要求通过实验加深对酶性质的认识,了解测定α-淀粉酶活力的方法。 二、实验原理 酶是生物体内具有催化作用的蛋白质,通常称为生物催化剂。酶催化的反应称为酶促反应。生物催化剂催化生化反应时具有:催化效率好、有高度的专一性、反应条件温和、催化活力与辅基,辅酶,金属离子有关等特点。 能提高酶活力的物质,称为激活剂。激活剂对酶的作用有一定的选择性,其种类多为无机离子和简单的有机化合物。使酶的活力中心的化学性质发生变化,导致酶的催化作用受抑制或丧失的物质称为酶抑制剂。氯离子为唾液淀粉酶的激活剂,铜离子为其抑制剂。应注意的是激活剂和抑制剂不是绝对的,有些物质在低浓度时为某种酶的激活剂,而在高浓度时则为该酶的抑制剂。如氯化钠达到约30%浓度时可抑制唾液淀粉酶的活性。 酶促反应中,反应速度达到最大值时的温度和PH值称为某种酶作用时的最适温度和PH值。温度对酶反应的影响是双重的:一方面随着温度的增加,反应速度也增加,直至最大反应速度为止;另一方面随着温度的不断升高,而使酶逐步变性从而使反应速度降低。同样,反应中某一PH范围内酶活力可达最高,在最适PH的两侧活性骤然下降,其变化趋势呈钟形曲线变化。 食品级α-淀粉酶是一种由微生物发酵生产而制备的微生物酶制剂,主要由枯草芽孢杆菌、黑曲霉、米曲霉等微生物产生。但不同菌株产生的酶在耐热性、酶促反应的最适温度、PH、对淀粉的水解程度,以及产物的性质等均有差异。α-淀粉酶属水解酶,作为生物催化剂可随机作用于直链淀粉分子内部的α-1,4糖苷键,迅速地将直链淀粉分子切割为短链的糊精或寡糖,使淀粉的粘度迅速下降,淀粉与碘的反应逐渐消失,这种作用称为液化作用,生产上又称α-淀粉酶为液化淀粉酶。α-淀粉酶不能水解淀粉支链的α-1,6糖苷键,因此最终水解产物是麦芽糖、葡萄糖和α-1,6键的寡糖。 本实验通过淀粉遇碘显蓝色,糊精按其分子量的大小遇碘显紫蓝、紫红、红棕色,较小的糊精(少于6个葡萄糖单位)遇碘不显色的呈色反应,来追踪α-淀粉酶作用于淀粉基质的水解过程,从而了解酶的性质以及动力学参数。 三、激活剂和抑制剂对唾液淀粉酶活力的影响
实验二、萌发麦苗淀粉酶活力及水溶性蛋白含量的测定。 (报告写作提示及思考题) 注意:实验二整体是为了完成如何在正确的总体思路的指导下合理设计实验方案及其细节。所以我们首先以对生物催化剂-酶的基本认识确定了酶活测定实验的总体设计思路,并在其指导下,明确了总体方案及最关键的设计细节。 然后以我们比较熟悉的禾谷类种子的萌发状态及其代谢途径为具体思考对象,进行了淀粉酶活力测定相关的分析,然后认可并已完成了前人设计的实验。所以淀粉酶活力测定实验报告的结果就绝不仅仅是计算得出的两个酶活力数据,或说那两个数据只是一个必然的实验数据,“实验结果”是我们设计并完成了对淀粉酶,这类在禾谷类种子萌发过程中起关键作用的酶的活力的测定,即,是实验设计本身。所以结果分析应该是围绕实验设计展开。根据实验具体实施过程中可操作性的特点、操作误差对结果的可能影响,以实际材料完成实验后得到的具体结果数据结合相关生理功能一起思考判断,是否能初步确定该实验设计不仅理论上可行而且实验后的结果也可信,从而最终确认整个实验设计的基本合理可行可信。 实验后思考题: 1.α-淀粉酶活性测定时70℃水浴为何要严格保温15分钟?保温后为什么要立即于冰浴中骤冷?而经如此处理,为什么在随后的40℃温浴和酶促反应中就能保证β-淀粉酶不会再参与催化反应。 2.酶的最适反应温度(一般都是生理温度)和最适保存温度(一般0℃以下)为什么不一样?而这两个状态都是需要维护酶的空间结构。 3.为什么3,5-二硝基水杨酸与还原糖的反应要先沸水浴然后再稀释测定? 4. 在设计酶活测定的实验时,要求酶促反应初速度对底物浓度的小量变化不敏感,具体要求为:在底物浓度有10%的变化幅度范围内,而所测初速度的变化幅度小于1%。则【S】/K M应该大于多少才能保证这一点?(设定为米氏酶) 5.转氨酶在细胞内的作用及生理意义?细胞内有众多的转氨酶,但相关研究及医学临床应用中却几乎都是只检测谷丙转氨酶(GPT)和谷草转氨酶(GOT)的活力,而极少测定其它转氨酶活力,你推测可能的原因会是什么?为什么? 6、转氨酶催化的是双底物可逆反应,根据酶活力测定的总体思路,要保证测定反应的初速度,根据实验指导所提供的资料,你认为是否保证了这一点?是如何保证的? 7、指导所提供的两个转氨酶活力测定实验方案,设计的酶促反应时间是多少?终止酶促反应用的什么试剂?与淀粉酶活力测定规定的酶促反应时间相比是否有差异?差异可能的原因你分析认为会是因为什么?
探究影响酶活性的因素 一、探究温度对酶活性的影响 (一)实验原理(注:市售a-淀粉酶的最适温度约600C): 1.淀粉遇碘后,形成紫蓝色的复合物。 2.淀粉酶可以使淀粉逐步水解成麦芽糖和葡萄糖,麦芽糖和葡萄糖遇碘后不显色。 (二)方法步骤: 1、取3支试管,编上号(A、B、C),然后分别注入2mL可溶性淀粉溶液。 2、另取3支试管,编上号(a、b、c),然后分别注入1mL新鲜淀粉酶溶液。 3、将装有淀粉溶液和酶溶液的试管分成3组,A和a试管放入热水(约600C)、B和b放 入沸水,C和c放入冰块中,维持各自的温度5min。 思考题1、不能只用不同温度处理淀粉溶液或酶溶液,这是为什么? 4、分别将淀粉酶溶液注入相同温度下的淀粉溶液中,摇匀后,维持各自的温度5min。 5、在3支试管中各滴入1-2滴碘液,摇匀后观察这3支试管中溶液颜色变化并记录。 思考题2、在试管A、B、C中分别能观察到什么现象? 思考题3、通过上述实验,你能得出什么结论? 思考题4、在上述实验中,自变量是什么?无关变量是什么? 思考题5、探究温度对酶活性的影响实验中是否可以用斐林试剂来检验实验结果? 为什么? 二、探究PH值对酶活性的影响 (一)实验原理:思考题6、请依据下面所列实验操作步骤,写出该实验的实验原理。
(二)操作步骤:用表格显示实验步骤:(注意操作顺序不能错) 思考题7、请在上表中填入你所观察到的实验现象。 思考题8、通过上述实验,你能得出什么结论? 思考题9、在上述实验中,自变量是什么?无关变量是什么? 思考题10、在设计“影响酶活性的条件”实验中最关键的一步是什么? 附加实验:思考题11、能否用淀粉酶探究PH对酶活性的影响? 课堂练习: 1.(多选)在证明酶的催化作用受温度影响的实验时,有学生取两支试管分别将淀粉溶液与唾
能抑制α-淀粉酶的抑制剂 如链霉菌YM-25菌株产生的hairm;链霉菌S. corchoruchii菌株产生的paim以及链霉菌S. dimorph ogenes菌株产生的萃他丁(trestatin)等都是α-淀粉酶抑制剂,它们对不同来源的α-淀粉酶均显示出强的抑制作用,但不抑制β-淀粉酶和β-糖苷酶。 以萃他丁为例:它含有A,B,C三个组分的α-淀粉酶抑制剂属于低聚糖同系物。它是无色粉末,紫外光谱呈末端吸收,对蒽酮、酚-硫酸呈阳性反应,对坂口、红四唑呈阴性反应。Trestatin对猪胰α-淀粉酶、曲霉α-淀粉酶、枯草杆菌α-淀粉酶都有抑制作用,但不抑制β-淀粉酶和β-葡萄糖苷酶。 国外α-淀粉酶抑制剂研究起步较早,早在上世纪四十年代就有小麦种子中α-淀粉酶抑制剂的报道[5~7]。它是一种电迁移率为0.2,分子量为21000的蛋白质。但在随后的25年间很少有这方面的报道[8]。之后Shainkin和Birk[9]提出小麦粉中存在两种α-淀粉酶抑制剂,并阐述了它们的分离和性质。它们的电迁移率不同,对不同来源的α-淀粉酶专一性不同。从后来的研究[10~14]知道:它们在小麦种子中是多分子形式的蛋白质,能不同程度的抑制昆虫和哺乳动物的淀粉酶。 1945又在普通大豆上有过报道[15~16],1972年α-淀粉酶抑制剂曾经在微生物上有过报道,因其在医药上的价值而被广泛研究。α-淀粉酶抑制剂在20世纪70年代被深入研究,在20世纪80年代和90年代,由于发现其在医学上的重要性,尤其在抑制糖尿病和高血糖以及对昆虫选择性控制等方面具有重要作用而加速研究[17]。 70年代以来,已研究发现100多种来自植物和微生物的抑制α-淀粉酶的活性物质,有的已经进入临床实验[18]。微生物来源的糖苷水解酶抑制剂的筛选研究在近些年来已成为比较活跃的领域之一,尤其在联邦德国和日本。现已报道的这类酶抑制剂20~30种。Namiki等报道从一株链霉菌发酵液中分理出一种新的寡糖类α-糖苷水解酶抑制剂Adiposin。体内实验Trestatins对胰腺或唾液的α-淀粉酶有很强的抑制作用,并能降低血糖和血脂的浓度,是一种新的α-淀粉酶抑制剂[19]。 国内酶抑制剂方面的研究始于70年代末,福建省微生物所从土壤中筛选到产生的淀粉酶抑制剂的产生菌S-2-35菌株,并对其代谢产物的分离及其理化性质进行深入研究,研究成果显著[20],上海医药工业研究所在80年代初就开始与日本东京微生物化学研究所,日本麒麟啤酒和美国辉瑞公司等合作从土壤中寻找新的有为生物产生的生理物质的研究,建立淀粉酶抑制剂等的筛选模型。国内研究突出得是河北科学院生物研究所从链霉菌中获得产生α-淀粉酶抑制剂的菌种S-19-1,是国内首次从淡紫灰类群中筛选出该抑制剂菌株,建立适合S-19-1菌株的发酵工艺,并对其化学性质进行研究。发酵滤液中的α-淀粉酶抑制剂活性超过70%。经BALB小鼠试
唾液淀粉酶活性的观察实验报告范文 唾液淀粉酶活性的观察实验报告范文 2 唾液淀粉酶活性观察实验报告 一、实验目的 1.了解环境因素对酶活性的影响及酶的高效性; 2.掌握酶定性分析的方法和注意事项。 二、基本原理 1.酶是生物催化剂,具有极高的催化效率,其催化效率比一般催化剂高106~1013.在生物体内过氧化氢酶能催化H2O2分解成H2O和O2,铁粉地H2O2分解也有催 化作用,但其效率远低于酶。 2.酶的活性受温度的影响。在一定的温度范围内,温度升高,酶的活性也会增大。当到了最大值后,此时温度为酶的最适温度,由于温度过高,酶开始失活,导致酶的效率降低,最后完全失活。 3.酶的活性受PH值的影响。酶在一定范围的PH值下才有活性,高于或低于最适PH,都会使酶的活性降低。 4.酶活性常受到某些物质的影响。有些物质能使酶的活性增加,称为激活剂,有些物质能使酶的活性降低,称为抵制剂。 5.碘液指示淀粉水解程度的不同色变化: 淀粉淀粉酶紫色糊精淀粉酶暗褐糊精淀粉酶红色糊精淀粉酶麦
芽糖+少量葡萄糖 加碘后:蓝色 紫红色 暗褐色红棕色 黄色 三、试剂与器材 影响唾液淀粉酶活性的研究 摘要:讨论了不同条件下唾液淀粉酶的活性差异,实验结果表明,影响唾液淀粉 酶活性的因素很多,必须在适宜的条件下,才能发挥最佳催化作用;淀粉酶具有 高度专一性,其活性受温度、pH值、激活剂及抑制剂、酶浓度以及作用时间等多 种因素的影响;每个人产生唾液淀粉酶的量不同,活性强弱也有差异。 关键词:淀粉酶;活性;温度;抑制剂;激活剂;专一性 2影响唾液淀粉酶的活性的因素 实验目的 观察淀粉在水解过程中遇碘后溶液颜色的变化。观察温度、pH、激活剂与抑制剂对唾液淀粉酶活性的影响。 实验原理 人唾液中淀粉酶为α-淀粉酶,在唾液腺细胞中合成。在唾液淀
测定蛋白酶活力实验 一、实验目的 1.加深了解酶活力的概念。 2.学习掌握测定蛋白酶活力的方法。 二、实验原理 酶活力指酶催化某一特定反应的能力。其大小可用在一定条件下酶催化反应进行一定时间后,反应体系中底物的减少量或产物的生成量来表示。 酶活力单位是表示酶活力大小的重要指标。本实验规定酶活力单位(U)为一定条件下每分钟分解1μg 酪氨酸所需的酶量。 实验选用枯草杆菌蛋白酶水解酪蛋白产生酪氨酸的反应体系。产物酪氨酸在碱性条件下与Folin-酚试剂反应生成蓝色化合物,该蓝色化合物在680nm 处有最大光吸收,其吸光值与酪氨酸含量呈正比。 因此通过测定一定条件下产物酪氨酸的含量变化,可计算出蛋白酶的活力。 三、仪器和试剂 仪器: 恒温水浴锅、分光光度计、试管及试管架、干燥滤纸、玻璃漏斗。原料 枯草杆菌蛋白酶:称取1g 枯草杆菌蛋白酶粉,用少量L,磷酸缓冲液溶解并定容至100mL,震荡15分钟,使充分溶解,干纱布过滤,取滤液冰箱备用。使用时视酶活力高低用缓冲液适当稀释。
试剂 1. Folin-酚试剂: 在2L 磨口回流瓶中加入钨酸钠(Na2WoO4. 2H2O)100g,钼酸钠(Na2WoO4. 2H2O)25g,蒸馏水700mL,85%磷酸50mL 以及浓盐酸100mL,充分混匀后,微火回流加热10小时。再加入硫酸锂150g,蒸馏水50mL 和液溴数滴,摇匀后开口继续煮沸15min,以驱赶过剩的溴。冷却后加蒸馏水定容至1000mL,过滤,溶液呈黄绿色,置于棕色试剂瓶中暗处贮藏。使用前用标准NaOH 溶液、酚酞为指示剂标定酸度(约为2mol/L),然后加水稀释至1mol/L,即可使用。 2. 0.2mol/L 盐酸溶液 3. L 氢氧化钠溶液 4. L 碳酸钠溶液 5. 10%三氯乙酸溶液 6. 磷酸缓冲液: 称取磷酸氢二钠(Na2HPO4 . 12H2O)7.16g,用水定容至100mL(A 液);称取磷酸二氢钠(Na2HPO4.12H2O)3.12g,用水定容至100mL(B 液)。取A 液84mL,B 液16mL 混合后,得到磷酸缓冲液,可长期存放。临用时稀释10倍即可。 7. 标准酪氨酸溶液(50μg/mL):称取以烘干至恒重的酪氨酸,用L 盐酸约30mL 溶解后,蒸馏水定容至250mL。 8. 酪蛋白溶液%):称取1.25g 酪蛋白,用L 氢氧化钠溶液(20mL)溶解,再用磷酸缓冲液定容到250mL。
实验七尿淀粉酶活性测定 淀粉酶(AMY或AMS在体内的主要作用是水解淀粉,它随机地作用于淀粉分子内的 a—1, 4糖苷键生成葡萄糖、麦芽糖、寡糖及糊精。血清中的淀粉酶主要有胰型(P型)和 唾液型(S型)及其亚型同工酶组成,P型淀粉酶主要来源于胰腺,S型淀粉酶主要来源于唾 液腺。正常淀粉酶因分子量小,故可从肾小球滤过而由尿中排出。 【目的】 1、验证淀粉酶的催化作用。 2、观察淀粉及其水解产物分别与碘反应呈现的颜色变化。 【原理】血清及尿中的淀粉酶来源于胰腺和唾液腺,正常血清与尿中有一定活性。 Winslow 氏法测定尿和血清中淀粉酶活性是将试样作等比稀释,观察一系列试样在规定的 37C、30分钟的条件下,恰好能将0.1%淀粉溶液1ml水解(指加入碘液后不再呈蓝色)的 酶量定为淀粉酶的一个活性单位,乘以尿的稀释倍数,即可得知每项ml 尿液中的淀粉酶活性。 【器材】 试管(10mn X 100mr)、试管架、电热恒温水浴箱、吸管、洗耳球、滴管。 【试剂】 1 、 9%NaCl 2、0.3%碘液 3、0.1%淀粉溶液 【操作】 1 、准备尿液(自备)。 2、取 10支试管,编号,用吸管向管中加入0.9%NaCl 1ml。 3、用1ml吸管(注意应用刻度到头的)向第一管加尿液1ml,混合,再将试管中的液 体吸起,然后任其流回试管,如此重复三次,以便全管混匀,并借此冲洗吸管内壁。吸出此混合液1ml 移入第二管中。 4、用同法处理第二管使之混匀,并取出1ml 置于第三管中。依此类推,如此继续稀释 至第九管后,吸出1ml混合液弃之,这样既可获得分别含原尿液为1/2ml,1/4ml,1/8ml, ... 1/512ml 的不同浓度的尿稀释液。第十管不加尿液作为对照管。 5、从第十管起依次向各管迅速准确加入0.1%淀粉液2ml,迅速摇匀(是否充分混匀往
白芸豆提取物 (高比例α-淀粉酶抑制剂) 产品说明与营养标签 (α--淀粉酶抑制剂(α-AI)≥40000 IU/g ,两小时淀粉糖化阻断率≥80%。) 〖警示〗:常规提取技术与一般饮食烹饪会完全破坏α-淀粉酶抑制剂活性,请认真阅读本文,并谨慎选择采购合作。 胡小能.2020年C版
白芸豆提取物(高比例α-淀粉酶抑制剂) 【简介】白芸豆提取物(主含α--淀粉酶抑制剂,俗称“淀粉阻断剂”),因提取时利用分层技术分离除去了杂质与大部分淀粉,同步利用酶解技术析出并保护了活性白芸豆水解蛋白粉(保留活性才是a--淀粉酶抑制剂),因此,本提取物主要有效成分为活性水解蛋白粉(化学名称是α--淀粉酶抑制剂,它是一种糖蛋白,分子量为56KDa)。反映在下表中即蛋白质。科学证明α--淀粉酶抑制剂具有非常强大的抑制淀粉酶水解淀粉转化为碳水化合物的能力。 【重要提示】 1)同样是叫白芸豆提取物,不要以为都有降糖减肥功能,是只有激活了白芸豆中的á--淀粉酶抑制剂,并在后续工序中分离并保护下来的提取物才有此功能。激活与保护活性牵涉到特殊提取工艺,一般提取工厂根本不知道此奥秘。 2)白芸豆提取物有没有降糖减肥功能,重要看两个指标,其一,蛋白质(活性水解蛋白粉)含量,这个近似于α-淀粉酶抑制剂的占比;其二,α-淀粉酶抑制剂活性(α-AI),单位IU/g。尤其是后者,最为关键。 3)白芸豆中同时含有白芸豆凝集素,这种植物凝集素(普通扁豆同)是一种防御性蛋白(就是植物的抵御外力侵害时的自毒护体能力),对人体尤其是心血管病人有一定危害,在加工工艺中往往通过高温灭其活性,一般水提取过程会经过高温,但α-淀粉酶抑制剂如遇高温也一样会失去活性。所以除去白芸豆凝集素必须用其它方法。一般提取工厂生产的白芸豆提取物(包括直接食用熟的白芸豆)不具备活性,原因也在此。 4)以上3条告诉你,激活与保护a--淀粉酶抑制剂活性在提取过程中,并不简单,不是谁都能生产出有活性或高活性的a--淀粉酶抑制剂。 5)并不是只有白芸豆才有a--淀粉酶抑制剂,实际上谷物(小麦、玉米、大米)与部分豆科含量都较高,但它们的提取工艺难度是一样的,只是出粉率(主要指α-淀粉酶抑制剂含有量)有差异,选择哪种提取源可以因需要决定,白芸豆并不是唯一的选择。 【产品基础信息】 商品名称:白芸豆提取物(主要成分α-淀粉酶抑制剂,占近半)
班级:植物092 姓名:徐炜佳学号:03 淀粉酶活性的测定 一、研究背景及目的 酶是高效催化有机体新陈代谢各步反应的活性蛋白,几乎所有的生化反应都离不开酶的催化,所以酶在生物体内扮演着极其重要的角色,因此对酶的研究有着非常重要的意义。酶的活力是酶的重要参数,反映的是酶的催化能力,因此测定酶活力是研究酶的基础。酶活力由酶活力单位表征,通过计算适宜条件下一定时间内一定量的酶催化生成产物的量得到淀粉酶是水解淀粉的糖苷键的一类酶的总称,按照其水解淀粉的作用方式,可分为α-淀粉酶和β-淀粉酶等。α-淀粉酶和β-淀粉酶是其中最主要的两种,存在于禾谷类的种子中。β-淀粉酶存在于休眠的种子中,而α-淀粉酶是在种子萌发过程中形成的。 α-淀粉酶活性是衡量小麦穗发芽的一个生理指标,α-淀粉酶活性低的品种抗穗发芽,反之则易穗发芽。目前,关于α-淀粉酶活性的测定方法很多种,活力单位的定义也各不相同,国内外测定α-淀粉酶活性的方法常用的有凝胶扩散法、3 ,5-二硝基水杨酸比色法和降落值法。这3 种方法所用的材料分别是新鲜种子、萌动种子和面粉,获得的α-淀粉酶活性应该分别是延迟(内 二、实验原理 萌发的种子中存在两种淀粉酶,分别是α-淀粉酶和β-淀粉酶,β-淀粉酶不耐热,在高温下易钝化,而α-淀粉酶不耐酸,在下则发生钝化。本实验的设计利用β-淀粉酶不耐热的特性,在高温下(70℃)下处理使得β-淀粉酶钝化而测定α-淀粉酶的酶活性。 酶活性的测定是通过测定一定量的酶在一定时间内催化得到的麦芽糖的量来实现的,淀粉酶水解淀粉生成的麦芽糖,可用3,5-二硝基水杨酸试剂测定,由于麦芽糖能将后者还原生成硝基氨基水杨酸的显色基团,将其颜色的深浅与糖的含量成正比,故可求出麦芽糖的含量。常用单位时间内生成麦芽糖的毫克数表示淀粉酶活性的大小。然后利用同样的原理测得两种淀粉酶的总活性。实验中为了消除非酶促反应引起的麦芽糖的生成带来的误差,每组实验都做了相应的对照实验,在最终计算酶的活性时以测量组的值减去对照组的值加以校正。 在实验中要严格控制温度及时间,以减小误差。并且在酶的作用过程中,四支测定管及空白管不要混淆。
实验二淀粉酶活性测定 实验报告 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
淀粉酶活性的测定 一、实验目的 酶的活力是酶的重要参数,反映的是酶的催化能力,因此测定酶活力是研究酶的基础。酶活力由酶活力单位表征,通过计算适宜条件下一定 时间内一定量的酶催化生成产物的量得到。 淀粉酶是水解淀粉的糖苷键的一类酶的总称。α-淀粉酶是一种典型 的内切型淀粉酶,主要作用于淀粉水解的液化阶段,因此又叫液化酶。作 为一种最重要的工业酶制剂,α-淀粉酶广泛存在于动物,植物和微生物中。其中,微生物α-淀粉酶以其经济易得成为工业生产主要来源。目前,关于α-淀粉酶活性的测定方法很多种。 本实验采用杨氏改良法测定α-淀粉酶;掌握测定α-淀粉酶活性大 小与温度关系的方法,通过分析得出酶的最适温度范围。 二、实验原理 酶促反应中,反应速度达到最大值时的温度和pH值称为某种酶作用 时的最适温度和pH值。温度对酶反应的影响是双重的:一方面随着温度的增加,反应速度也增加,直至最大反应速度为止;另一方面随着温度 的不断升高,而使酶逐步变性从而使反应速度降低,其变化趋势呈钟形 曲线变化。 不同菌株产生的酶在耐热性、酶促反应的最适温度、PH、对淀粉的水解程度,以及产物的性质等均有差异。α-淀粉酶属水解酶,作为生物催化剂可随机作用于直链淀粉分子内部的α-1,4糖苷键,迅速地将直链淀 粉分子切割为短链的糊精或寡糖,使淀粉的粘度迅速下降,淀粉与碘的
反应逐渐消失,这种作用称为液化作用,生产上又称α-淀粉酶为液化淀粉酶。α-淀粉酶不能水解淀粉支链的α-1,6糖苷键,因此最终水解产物是麦芽糖、葡萄糖和α-1,6键的寡糖。 本实验通过淀粉遇碘显蓝色,淀粉含量越高,颜色越深。用分管光度计检测显色效应大小,通过分管光度值计算酶活力 注意:实验中为了消除非酶促反应引起的淀粉水解带来的误差,每组实验都做了相应的对照实验,在最终计算酶的活性时以测量组的值减去对照组的值加以校正。 在实验中要严格控制温度及时间,以减小误差。并且在酶的作用过程中,三支测定管及空白管不要混淆。 三、材料、试剂与仪器 实验材料:α-淀粉酶 仪器:分光光度计、电热恒温水浴锅、小台秤、研钵、玻璃仪器若干 试剂: ① 0.4M NaOH/0.4M CH3COOH及0.1M HCl: ② 0.005%工作碘液:0.5克I2和5.0克KI水中研磨,定容至1000mL; ③1%糊化淀粉溶液:称取1.0克淀粉,加入25mL0.4M NaOH,60℃ COOH,定容至100mL; 5min,冷却后加25mL0.4M CH 3 ④稀释α-淀粉酶溶液:待测样品 四、实验步骤 ① 10mL1%淀粉溶液加入试管中,室温25/45/65℃保温10min
低分子量及寡聚玻璃酸 郭学平,凌沛学,张天民目前临床上应用的玻璃酸(又称透明质酸,HA)制剂,如眼科手术用黏弹剂、治疗关节炎的关节腔注射液、术后防粘连制剂、滴眼液等,所用HA 的平均分子量一般为50万~500万。低分子量HA(LMW-HA)的分子量范围尚无统一标准,一般为1万~50万。而HA寡聚糖(oligosaccharides of HA,简称oligo-HA)为分子量在1万以下,单糖残基数量为2~40(一般为4~16)的HA分子片段。LMW-HA还属于大分子多糖范畴,在物理性质和生物活性方面与普通HA接近,而oligo-HA属于小分子多糖,其性质与普通HA有很大不同,甚至具有完全相反的作用。人体内源性HA的分子量分布较宽,从高分子到寡聚糖均存在,HA在体内总是经历高分子→低分子→寡聚糖→单糖的代谢过程。注射到体内的外源性HA也要经历这种代谢过程。因此HA在不同的代谢阶段,因分子量的不同而产生不同的生理或药理作用。本文对LMH-HA和oligo-HA的制备方法和生物活性的研究做一介绍。 1 制备方法 LMW-HA可在普通HA的制备过程中,先对HA进行一定程度的降解,再进行纯化精制,直接制得LMW-HA。由于HA降解后,黏度下降,使得过滤等操作容易进行,因此适用LMW-HA的大量生产。实验室中少量的制备可将HA直接降解制得。降解的方法有多种,主要为化学降解、酶解和物理降解,见表1。不同的降解方法各有特点,需要注意的是,除了要得到所需的平均分子量,还要考虑分子量分布范围。用凝胶色谱法可测定LMW-HA的平均分子量及分布。平均分子量分为重均分子量M w和数均分子量M n,其比值称
唾液淀粉酶最适pH值的测定实验 实验目的 1.掌握设计性实验的基本思路,并完成设计报告。 2.掌握唾液淀粉酶最适PH的测定原理和方法。 3.熟悉影响酶促反应速度的因素。 实验原理 1.酶促反应速度受到许多因素的影响,如温度、PH、激动剂和抑制剂等。上述诸因素对唾液淀粉酶催化淀粉水解反应速度的影响,可用定性或定量的反应来观察。利用碘与淀粉机器不同程度纾解产物反应的颜色,来衡量酶促反应的速度的快慢。蓝色—紫红色—黄色,颜色由蓝变黄,表示酶促反应速度由慢到快。此为定性观察。 2.进一步利用郎伯—比尔定律来判定溶液的吸光度与溶液的浓度符合一定的比例关系。由于在被水解的程度也不一样。当唾液淀粉酶不能将完全水解时,淀粉遇碘呈蓝色,吸收波长位于660nm处。不同PH环境中唾液淀粉酶与淀粉的反应程度不同,吸光度值也不同。因此,通过测量660nm处的吸光度值,可以了解PH对酶促反应的影响,吸光度最小的溶液其PH即为唾液淀粉酶的最适PH。
实验器材 仪器材料:方盘,试管架,中试管,毛刷,吸耳球,玻璃铅笔,小烧杯,白瓷板,坐标纸,漱口杯。0.1ml、0.5ml、1.0ml、2.0ml、5.0ml、10.0ml刻度吸管,胶头滴管,37 C恒温水浴箱,分光光度计,电磁炉。 试剂药品:0.02%淀粉溶液. 0.2mol/L磷酸二氢钠溶液、0.2mol/L 磷酸氢二钠溶液碘液;称取碘1g,碘酸钾2g,溶于300ml蒸馏水中。
实验步骤: 1、缓冲液的配置 pH 0.2mol/L 0.2mol/L NaH2PO4(ml) Na2HPO4(ml) 5.7 93.5 6.5 5.8 92.0 8.0 5.9 90.0 10.0 6.0 8 7.7 12.3 6.1 85.0 15.0 6.2 81.5 18.5 6.3 7 7.5 22.5 6.4 73.5 26.5 6.5 68.5 31.5 6.6 62.5 3 7.5 6.7 56.5 43.5 6.8 51.0 49.0
淀粉酶活性的测定 一、实验目的 酶的活力是酶的重要参数,反映的是酶的催化能力,因此测定酶活力是研究酶的基础。酶活力由酶活力单位表征,通过计算适宜条件下一定时间内一定量的酶催化生成产物的量得到。 淀粉酶是水解淀粉的糖苷键的一类酶的总称。α-淀粉酶是一种典型的内切型淀粉酶,主要作用于淀粉水解的液化阶段,因此又叫液化酶。作为一种最重要的工业酶制剂,α-淀粉酶广泛存在于动物,植物和微生物中。其中,微生物α-淀粉酶以其经济易得成为工业生产主要来源。目前,关于α-淀粉酶活性的测定方法很多种。 本实验采用杨氏改良法测定α-淀粉酶;掌握测定α-淀粉酶活性大小与温度关系的方法,通过分析得出酶的最适温度范围。 二、实验原理 酶促反应中,反应速度达到最大值时的温度和pH值称为某种酶作用时的最适温度和pH值。温度对酶反应的影响是双重的:一方面随着温度的增加,反应速度也增加,直至最大反应速度为止;另一方面随着温度的不断升高,而使酶逐步变性从而使反应速度降低,其变化趋势呈钟形曲线变化。 不同菌株产生的酶在耐热性、酶促反应的最适温度、PH、对淀粉的水解程度,以及产物的性质等均有差异。α-淀粉酶属水解酶,作为生物催化剂可随机作用于直链淀粉分子内部的α-1,4糖苷键,迅速地将直链淀粉分子切割为短链的糊精或寡糖,使淀粉的粘度迅速下降,淀粉与碘的反应逐渐消失,这种作用称为液化作用,生产上又称α-淀粉酶为液化淀粉酶。α-淀粉酶不能水解淀粉支链的α-1,6糖苷键,因此最终水解产物是麦芽糖、葡萄糖和α-1,6键的寡糖。 本实验通过淀粉遇碘显蓝色,淀粉含量越高,颜色越深。用分管光度计检测显色效应大小,通过分管光度值计算酶活力 注意:实验中为了消除非酶促反应引起的淀粉水解带来的误差,每组实验都做了相应的对照实验,在最终计算酶的活性时以测量组的值减去对照组的值加以
班级:植物092 姓名:徐炜佳学号:0901080223 淀粉酶活性的测定 一、研究背景及目的 酶是高效催化有机体新陈代谢各步反应的活性蛋白,几乎所有的生化反应都离不开酶的催化,所以酶在生物体内扮演着极其重要的角色,因此对酶的研究有着非常重要的意义。酶的活力是酶的重要参数,反映的是酶的催化能力,因此测定酶活力是研究酶的基础。酶活力由酶活力单位表征,通过计算适宜条件下一定时间内一定量的酶催化生成产物的量得到淀粉酶是水解淀粉的糖苷键的一类酶的总称,按照其水解淀粉的作用方式,可分为α-淀粉酶和β-淀粉酶等。α-淀粉酶和β-淀粉酶是其中最主要的两种,存在于禾谷类的种子中。β-淀粉酶存在于休眠的种子中,而α-淀粉酶是在种子萌发过程中形成的。 α-淀粉酶活性是衡量小麦穗发芽的一个生理指标,α-淀粉酶活性低的品种抗穗发芽,反之则易穗发芽。目前,关于α-淀粉酶活性的测定方法很多种,活力单位的定义也各不相同,国内外测定α-淀粉酶活性的方法常用的有凝胶扩散法、3,5-二硝基水杨酸比色法和降落值法。这3种方法所用的材料分别是新鲜种子、萌动种子和面粉,获得的α-淀粉酶活性应该分别是延迟(内源)α-淀粉酶、萌动种子α-淀粉酶和后熟面粉的α-淀粉酶活性。
本实验的目的在于掌握α-淀粉酶和β-淀粉酶的提取和测定方法。 二、实验原理 萌发的种子中存在两种淀粉酶,分别是α-淀粉酶和β-淀粉酶,β-淀粉酶不耐热,在高温下易钝化,而α-淀粉酶不耐酸,在pH3.6下则发生钝化。本实验的设计利用β-淀粉酶不耐热的特性,在高温下(70℃)下处理使得β-淀粉酶钝化而测定α-淀粉酶的酶活性。 酶活性的测定是通过测定一定量的酶在一定时间内催化得到的麦芽糖的量来实现的,淀粉酶水解淀粉生成的麦芽糖,可用3,5-二硝基水杨酸试剂测定,由于麦芽糖能将后者还原生成硝基氨基水杨酸的显色基团,将其颜色的深浅与糖的含量成正比,故可求出麦芽糖的含量。常用单位时间内生成麦芽糖的毫克数表示淀粉酶活性的大小。然后利用同样的原理测得两种淀粉酶的总活性。实验中为了消除非酶促反应引起的麦芽糖的生成带来的误差,每组实验都做了相应的对照实验,在最终计算酶的活性时以测量组的值减去对照组的值加以校正。 在实验中要严格控制温度及时间,以减小误差。并且在酶的作用过程中,四支测定管及空白管不要混淆。 三、材料、试剂与仪器 实验材料: