
应化物理化学Ⅰ
题型说明各考点内容
符号名称考点内容考点内容考点内容
A 简答题01 热力学第一定律07 13
B 选择题02 热力学第二定律08 14
C 计算题03 多组分系统热力学及其
在溶液中的应用
09 15
D 概念及术语04 相平衡10 16
E 05 化学平衡11 17
F 06 12 18
`0001 01A1
理想气体的微观模型是什么?
~0001
分子本身没有体积;分子之间没有作用力。
`0002 05A1
工业上制水煤气为C(s)+H2O(g)?CO(g)+H2(g),反应的标准摩尔焓变为133.5KJ?mol-1,设反应在673K时达成平衡。试讨论如下各种因素对平衡的影响。
(1)增加C(s)的含量;。
(2)提高反应的温度;
(3)增加系统的压力;
(4)增加H2O(g)的分压;
(5)增加N2(g)的分压。
~0002
(1)增加C(s)的含量;固体的活度为1,不影响平衡。
(2)吸热反应,增加温度,平衡右移
(3)平衡左移
(4)平衡右移
(5)平衡左移
`0003 05A2
PCl5(g)的分解反应为PCl5(g)?PCl3+Cl2(g),在一定的温度和压力下,反应达到平衡,试讨论如下各种因素对PCl5(g)解离度的影响。(1)降低气体的总压;
(2)通入N2(g),保持压力不变,使体积增加一倍;
(3)通入N2(g),保持体积不变,使压力增加一倍;
通入Cl2(g),保持体积不变,使压力增加一倍。
~0003
(1)平衡右移,PCl5(g)解离度增大
(2)通入N2(g),保持压力不变,相当于减少平衡系统的压力,平衡右移,PCl5(g)解离度增大
(3)压力增加一倍,分压不变,离解度不变,平衡不移动。
(4)平衡左移
`0004 04A3
单组分系统硫的相图如下图。
试用相律分析图中各点、线、面的相平衡关系及自由度数。
~0004
解:各面的自由度F:
F=C-P+2=1-1+2=2 各线的自由度F:
F=C-P+2=1-2+2=1 各点(b,c,f)的自由度F: F=C-P+2=1-3+2=0 各线的相平衡关系:
ab: 正交硫 硫蒸气; bc: 正交硫 单斜硫; cd: 正交硫 液体硫; cf: 单斜硫 液体硫; fe : 液体硫 硫蒸气; fb : 单斜硫 硫蒸气。 各点的相平衡关系:
b: 正交硫 硫蒸气 单斜硫; c: 正交硫 液体硫 单斜硫; f: 单斜硫
液体硫 硫蒸气。 `0005 04A3
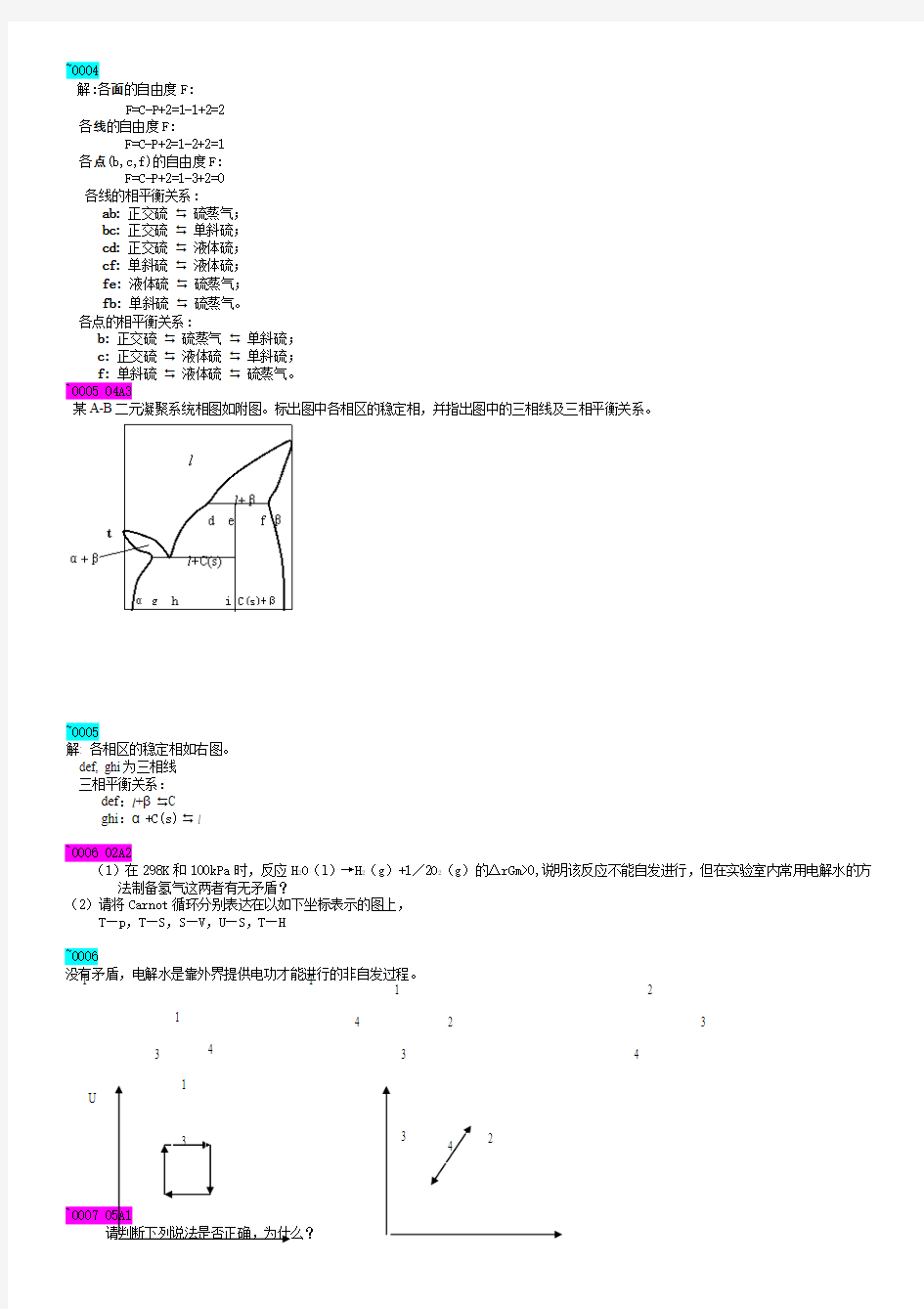
某A-B 二元凝聚系统相图如附图。标出图中各相区的稳定相,并指出图中的三相线及三相平衡关系。
~0005
解: 各相区的稳定相如右图。 def, ghi 为三相线 三相平衡关系:
def :l +β C ghi :α+C(s) l
`0006 02A2
(1)在298K 和100kPa 时,反应H 2O (l )→H 2(g )+1/2O 2(g )的△rGm>0,说明该反应不能自发进行,但在实验室内常用电解水的方
法制备氢气这两者有无矛盾?
(2)请将Carnot 循环分别表达在以如下坐标表示的图上, T —p ,T —S ,S —V ,U —S ,T —H
~0006
没有矛盾,电解水是靠外界提供电功才能进行的非自发过程。
`0007 05A1
请判断下列说法是否正确,为什么?
1 3 4 T 1 T
3 4 2 3 4 U 1
3 2 2 3 4
(1)某一反应的平衡常数是一个不变的常数; (2)
G
m Θ
是平衡状态时Gibbs 自由能的变化值,因为
?r
G
m Θ
=-RTln
K
p
Θ
(3)反应CO(g)+H 2O(g)?CO(g)+H 2(g),因为反应前后气体分子数相等,所以无论压力如何变化,对平衡均无影响。 (4)在一定的温度和压力下,某反应的?r
G
m
>0,所以要寻找合适的催化剂,使反应得以进行;
某反应的?r
G
m
< 0所以该反应一定能正向进行;
~0007
(1)错误,
K
p
Θ是温度的函数,Kp 是温度压力的函数。
(2)错误,平衡时,m r G ?=0
(3)错误,压力变大时,存在着某物质由气相变液相的问题。
(4)错误,合适的催化剂只能加快到达平衡的时间,不能改变反应的方向。 (5)错误,?r
G
m
< 0只能判断反应能发生,但速度可能很慢,甚至可能根本不反应。
`0008 05A1
化学反应的?r
G
m 的下标“m ”的含义是什么?若用下列两个化学计量方程来表示合成氨的反应,问两者的
?r
G
m Θ
,
k
p
Θ之间的关
系如何?
(1)3H 2(g)+N 2(g)?2NH 3(g )
?r
G
m Θ
1,,
k
p Θ1
,
(2)23H 2
(g)+2
1N 2
(g)?NH 3
(g ) ?r G m Θ2,,k p Θ
2,
~0008
表示反应进度为一摩尔,?r
G
m Θ
1,=2
?r
G
m Θ
2,,
k
p Θ1
,2=
k
p Θ2
,
`0009 05A2
若选取不同的标准态,则Θ
μ(T )不同,所以反应的
?r
G
m Θ
也会不同,那么用化学反应等温式
?r
G m Θ
=
?r
G
m Θ
+RTln
K
p
Θ计算出
来的?r
G
m
值是否也会改变,为什么?
~0009不会,?r
G
m
Θ由标准态选取的不同而不同,但
?r
G
m
不会因标准态选取的不同而改变。
`0010 05A1
根据公式
?r G
m Θ
=-RTln
K
p Θ
,能否认为
?r
G
m
Θ是处在平衡态时的Gibbs 自由能的变化值,为什么?
~0010
不能,m r G ?=0
`0011 05A1
合成氨反应3H 2(g)+N 2(g)?NH 3(g )达到平衡后,在保持温度和压力不变的情况下,加入水气作为惰性气体,设气体近似作为理想气体处理,问:氨的含量会不会发生变化?K
p
Θ值会不会改变,为什么?
~0011
平衡向左移动氨的含量减少,
K
p
Θ值不变
`0012 03A1
下列过程均为等温、等压和不做非膨胀功的过程,根据热力学公式:dG=-SdT+Vdp ,都得到?G=0的结论。这些结论哪个对,哪个不对,为什么?
(1) H 2O(l,268K,100kPa)→H 2O(s,268K,100kPa); (2) 在298K ,100KPa 时,H 2(g)+Cl 2(g)=2HCl(g);
(3) 在298K ,100KPa 时,一定量的NaCl(s)溶于水中; (4) H 2O(l,373K,100kPa)→H 2O(g,373K,100kPa)。
~0012
(4)对,?G=0。(1)、(2)、(3)的体系组成改变了应使用公式dG=-SdT+Vdp+∑B
dn
μ
`0013 03A1
试比较下列H 2O 在不同状态时的化学势的大小,根据的原理是什么? (1) (a)H 2O(l,373K,100kPa) 与 (b) H 2O(g,373K,100kPa) (2) (c)H 2O(l,373K,200kPa) 与 (d) H 2O(g,373K,200kPa)
(3) (e)H 2O(l,374K,100kPa) 与 (f) H 2O(g,374K,100kPa) (4) (a)H 2O(l,373K,100kPa) 与 (d) H 2O(g,373K,200kPa)
~0013
(1)b a μμ= (2)c d μμ>c (3)f e μμ>
(4)a d μμ>
应用公式dG=-SdT+Vdp `0014 03A2
理想液态混合物模型的微观特征是什么?它有几种不同的定义式?不同定义式之间有何关系?
~0014
各组分体积大小相等;组分间作用力与组分本身间作用力相同,分子间作用能,热力学能有加合性。
0,0=?=?H U mix mix )
ln ln (*
*B B A A B A m ix x n x n R S S S +--=?)ln ln (B B A A m ix x n x n RT A +=?)ln ln (B B A A m ix x n x n RT G +=?
`0015 05A2
设某分解反应为A(s)?B(g)+2C(g),若其平衡常数和解离压力分别为K
p
Θ,p,写出平衡常数与解离压力的关系式。
~0015
K
p Θ
=
27
4(P/ΘP )3
`0016 05A2
气相反应CO(g)+2H 2(g)?CH 3OH(l),已知其标准摩尔Gibbs 生成自由能与温度的关系为?r
G
m Θ
=(-90.625+0.221T/K )KJ ?mol -1
,
若要使平衡常数K
p
Θ>1,则温度应控制在多少为宜?
~0016
K T T RT
G RT
G K K RT G m r m
r p
p
m
r 07.410;0221.0/0625.9;01
]exp[;ln <>->?->?-=-=?Θ
Θ
ΘΘΘ
`0018 02A1
指出下列过程中,Q,W,△U,△H,△S,△A,△G 等热力学函数的变量哪些为零,那些绝对值相等? (1)理想气体真空膨胀。 (2)理想气体等温可逆膨胀 (3)理想气体绝热节流膨胀 (4)实际气体绝热可逆膨胀 (5)实际气体绝热节流膨胀
(6)H 2(g )O 2(g )在绝热钢瓶中发生反生成水
~0018
(1)Q=W=?U=?H=0
(2)?U=?H=0 Q=-W R ?G=?A (3)?U=?H=0
(4)Q R =?S=0 W=?U (5)?U=Q v =?H=0 (6)-W R =?A=Qv ?U=0 `0005 02A1
`0019 02A1
判断下列恒温恒压过程中,熵值的变化,是大于零小于零还是等于零,为什么? (1)将食盐放入水中生成氯化钠溶液。 (2)HCl (g )溶于水中生成盐酸溶液 (3)NH 4Cl (s )→NH 3(g )+HCl (g ) (4)H 2(g )+1/2O 2→H 2O (l )
(5)1dm 3(N 2,g )+1dm 3(Ar,g)→2dm 3
(N 2+Ar,g)
(6)1dm 3(N 2,g)+1dm 3(Ar,g)→1dm 3
(N 2+Ar,g)
(7)1dm 3(N 2,g )+1dm 3(N 2,g )→2dm 3
(N 2,g )
(8)1dm 3(N 2,g )+1dm 3(N 2,g )→1dm 3
(N 2,g )
~0019
(1) 小于零,放热过程。 (2) 小于零,同理。 (3) 大于零,吸热过程。 (4) 小于零,放热过程。
(5) 大于零,02ln 22ln 2ln
2>=+=?+?=?V
V R V V R V V R S S S Ar N (6) 两气体的始终态未发生改变,△S=0
(7) 两气体的始终态未发生改变,△S=0 (8) 02
1
ln 2ln
<==?nR V V nR S
`0020 04A3
指出附图中二组分凝聚系统相图 内各相区的稳定相,指出三相线的相平衡关系。
~0020
解: 各相区的稳定相如右图。
三相线的相平衡关系:
def: l +B(s) C 2(s) ghi: C 1(s)+C 2(s) l jkm: α+ C 1(s) l
`0017 03A1
下列说法是否正确,为什么?
(1) 溶液的化学势等于溶液中各组分的化学势之和; (2) 对于纯组分,其化学势就等于它的Gibbs 自由能;
(3) 在同一稀溶液中,溶质B 的浓度分别用x B ,m B ,c B 表示,其标准态的表示方法也不同,则其相应的化学势也就不同; (4) 在同一溶液中,若标准态规定不同,则其相应的相对活度也就不同; (5) 二组分理想液态混合物的总蒸汽压,一定大于任意组分的蒸汽分压;
~0017
(1)错,化学势是指某一组分的化学势,溶液时多组分体系,无化学势。 (2)错,对于纯组分,其化学势就等于它的摩尔Gibbs 自由能 (3)错,同一溶液中溶质B 的化学势相同,与表示方法无关。
(4)对,化学势x B B B a RT ,ln +=Θ
μμ是强度性质,与表示方法无关。标准态选取不同,相对活度就不同。 (5)对
`0400 03A1
想一想,这是为什么?
(1) 在寒冷的国家,冬天下雪之前,在路上撒盐;
(2) 口渴的时候喝海水,感觉渴得更厉害;
(3) 盐碱地上,庄稼总是长势不良;施太浓的肥料,庄稼就会“烧死”; (4) 吃冰棒时,边吃边吸,感觉甜味越来越淡;
(5) 被砂锅里的肉汤烫伤的程度要比被开水烫伤厉害的多;
(6) 北方冬天吃冻梨前,先将冻梨放入凉水浸泡一段时间。发现冻梨表面结了一层薄冰,而里面却已经解冻了。
~0400
(1)降低雪的熔点
(2)海水中盐分大,渗透压大于体液。
(3)盐类(肥料)在土壤中浓度大于植物浓度,水分通过植物细胞膜向土壤反渗透,故使植物失水。 (4)由于渗透压的存在,使感觉器官两侧的浓度差越来越小,所以感觉甜越来越淡, (5)溶液的依数性,肉汤的沸点高于热水的沸点。
(6)凉水比冻梨温度高 解冻 冻梨含糖 凝固点低于水的凝固点 `0401 03A1
在稀溶液中,沸点升高、凝固点降低和渗透压等依数性质都处于同一个原因,这个原因是什么?能否把他们的计算公式用同一个公式联系起来?
~0401
与溶液中溶质的数目成正比,而与溶质本身的性质无关,称之为依数性,
RT V T T R H T T R H p p p m A b
b m vap f f m fus A A
a B ∏-=-?=-?=-=)11()11(*
*** `0402 03A2
`0402 03A2
在如下的偏微分公式中,哪些表示偏摩尔量,哪些表示化学势,哪些什么都不是? (1) C n p T B n H ,,???? ????(2) C n V T B n G ,,???? ????(3)C n V S B n U ,,???? ????(4) C n p T B n A ,,????
???? (5)C n p T B n G ,,????
???? (6) C n p S B n H ,,???? ????(7)C n T S B n U ,,???? ???? (8) C
n V T B n A ,,????
????
~0402 (1)、(4) 表示偏摩尔量 ,(3)、(5)、(6)、(8)表示化学势,(2)、(7)均不是。 `0021 05A2
反应MgO(s)+Cl 2(g)?MgCl 2+2
1O 2
(g)达平衡后,保持温度不变,增加总压,K p Θ
和x K 分别有什么变化,设气体为理想气体。
~0021
K
p Θ
与温度有关,温度不变,
K
p Θ
不变。
K
p
Θ
=x K (P/Θ
P )ΣγB
,此反应Σγ
B < 0 ,故增加总压,K X 增加。
`0022 02A1
指出下列公式的适用范围 (1)?mixS=-R ∑n B ㏑x B ;
(2)△S=nR ㏑p 1/p 2+Cp ㏑T 2/T 1 = nR ㏑V 2/V 1+Cv ㏑T 2/T 1; (3)dU=TdS-pdV (4)?G=∫Vdp
(5)?S,△A,△G 作为判据时必须满足的条件
~0022
(1)封闭系统平衡态,理想气体等温混合 (2)理想气体P,V,T 变化。
(3)组成不变的封闭系统平衡态,不作非膨胀功的一切过程;, (4)组成不变的封闭系统,不做非膨胀功的等温变化过程
(5)孤立体系,等温等容不做非体积功,等温等压不做非体积功 `0023 02A2
热力学第一定律和第二定律的联合表达式是什么? ~0023
0≥-
T
Q
dS δ。
`0024 03C1
在298K 时,纯C 6H 6(l)和纯C 6H 5C H 3(l)的蒸汽压分别为9.96kPa 和2.97kPa 。今以等质量的苯和甲苯混合成理想液态混合物,试求 (1) 与液态混合物相对应的气相中,苯和甲苯的分压; (2) 液面上蒸气的总压力。
~0024
a a a kP
P P P kP
x P P kP x P P x M m M m M m x 75.6)2(36.1;39.5459.0;541.0)1(*
*=+=======+
=
甲苯苯甲苯甲苯甲苯苯苯苯甲苯甲苯
苯苯苯;p 苯=5.39kpa p 甲苯=1.36kpa
`0025 03C3
在298K 时,纯苯的气、液相标准摩尔生成焓分别为:Θ
?m f H (C 6H 6,g)=82.93kJmol -1和Θ
?m f H (C 6H 6,l)=49.0kJmol -1,纯苯在101.33kPa 压力下的沸点是353K 。若在298K 时,甲烷溶在苯中达平衡后,溶液中含甲烷的摩尔分数为x 甲=0.0043时,其对应的气相中甲烷的分压为
p 甲=245.0kPa 。试求:在298K 时,
(1) 当含甲烷的摩尔分数x 甲=0.01时,甲烷苯溶液的总蒸汽压; (2) 与上述溶液对应的气相组成。
~0025
(1)苯甲总P P P += (Ⅰ) (a) 甲烷为溶质服从henry 定律,甲甲x P κ=,298K 时
245kPa=0.0043κ(Ⅱ) ;κ010
。P =甲 (Ⅲ) (Ⅱ)式除以(Ⅲ)式得P 甲=245kPa ×0.01/0.0043=569.77kPa (b)苯为溶剂,服从Roult 定律,苯苯苯x P P *
= 298K 时
)()6666g H C (l H C ?
11.93.33.)4993.82(),()(--ΘΘ=-=?-?=?mol kJ mol kJ l H ,g H H m f m f m vap 苯苯 )29813531(..314.8.3393033.101)(ln );21()()(ln 11122112K K mol K J mol J kPa T p T T R H T p T p m vap -=-?=--- kPa K )(p T p 00.12298)(*2==苯
298K 时kPa kPa x p p 88.11)01.01(00.12*=-?==苯苯苯
kPa kPa 。(p p p 65.581)118877569=+=+=苯甲总
(2)上述溶液的气相组成为:
02.065.58188.11;98.065.58177.569======kPa
kPa p p y kPa kPa p p y 总苯苯总甲
甲
`0026 03C2
293K 时,HCl(g)溶于C 6H 6(l)中,形成理想的稀溶液。当达到气--液平衡时,液相中HCl 的摩尔分数为0.0385,气相中C 6H 6(g)的摩尔分数为0.095。已知293K 时,C 6H 6(l)的饱和蒸汽压为10.01kPa 。试求 (1) 气--液平衡时气相的总压;
(2) 293K 时,HCl(g)在苯溶液中的Henry 系数k x ,B 。
~0026 (1)a H C H C H C H C a H C H C H C kP y P P P y P kP x P
P 316.101;;625.96
6666666666
666*==
===总总
(2)a HCl
HCl
B x HCl B x HCl a H
C HCl kP x P k x k P kP
y P P 56.2381;;69.91,,6
6
=====总
`0027 03C3
在333K 时,纯的苯胺和水的饱和蒸汽压分别为0.76kPa 和19.9kPa ,在该温度下,苯胺和水部分互溶,分成两层。在两个液相中,苯胺的摩尔分数分别为0.732和0.088。假设每个液相中溶剂遵守Roult 定律,溶质遵守Henry 定律,试求 (1) 在两液相中,分别作为溶质的水和苯胺的Henry 系数; (2) 求出水层中,每个组分的相对活度系数。
~0027 (1)
a
B
B
B B B B B
B B a A
A A A A
A A
A A A A A
B B B B B B A A A kP x x P k x k x P P kP x x
P k x k x P P x k P x P P x k P x P P 7.6732;32.641);4();3()
2();1('*'*'*
'*''**
==;==)式相等
)式与(同理(==;=)式相等)式和(压只有一个,所以(由于溶液上方苯胺的分=在水层中:在苯胺层中:====
(2)
294.0088
.01732.01821748);7(;1)6()3()6(32.85)1()5(;'
'''''''*'*'
*''**
'
*'*=--===))代入(;(==
))代入(()
(=同理=定律为基准时:;当以==式式代入=;同理===)式得式代入(定律为基准时:当以B B B B B B H
B A
A A
A H
A B
B B H
B A A A H A H A A A A B B B B R B
B
B B R
B A A A A A A R A
A
A A
R
A R A A A A x x x k x k x k x k x k P x k P x k P Henry x P x P x P P x x x P x P x P P x P P Raoult γγγγγγγγγγ==
= γ
水
=0.294
`0028 03C1
在室温下,液体A 与液体B 能形成理想液态混合物。现有一混合物的蒸汽相,其中A 的摩尔分数为0.4,把它放在一个带活塞的汽缸内,在室温下将汽缸缓慢压缩。已知纯液体A 与B 的饱和蒸汽压分别为=40.0kPa ,=120.0kPa ,试求 (1) 当液体开始出现时,汽缸内气体的总压;
(2) 当气体全部液化后,再开始气化时气体的组成。
~0028
(1);66.663333
.0,6667.0)1()2()1()
2)(1();1(;6
.0,4.0*
***
**a B B A A B A B A A B A
A B A A B B B A A A A B A B A kP x P x P P P P x x x P x P y y x P Py P x P Py P P P P y y =+=+===--====+===;解得:=式式除以相组成为原始组成当液体开始出现时,气 (2)818.0;182.088;72;166
.0,4.0**====
=+=======P
P
y P P y kP P P P kP x P P kP x P P x x B B A A a
B A a B B B a A A A B A 成为气体全部液化后液相组
`0029 03C1
在293K 时,乙醚的蒸气压为58.95kPa ,今在0.1kg 乙醚中,容入某非挥发性有机物质0.01kg ,乙醚的蒸气压降低到56.79kPa ,试求该有机物质的摩尔质量。已知:M 乙醚=0.07411kg.mol -1
~0029
1
***.195.01///;1),1(-=-=+-=-=mol kg M P P M m M m M m P P x x P P B a A
A A
B B B B a A B B a A M B =0.1776Kgmol -1
`0030 03C1
设某一新合成的有机物R ,其中含碳、氢和氧的质量分数分别为:c W =0.632,H W =0.088,o W =0.280。今将0.0702g 该有机物溶于0.804g 樟脑中,其凝固点比纯樟脑下降15.3K 。试求该有机物的摩尔质量及其化学分子式。已知樟脑的凝固点降低常数kf=40.0Kmol-1kg (由于樟脑的凝固点降低常数较大,虽然溶质的用量较少,但凝固点降低值仍较大,相对于沸点升高的实验,其准确度较高)。
~0030
4
201214;
2283.0)016.01001.05012.03(1
:5:3::;.2283.0;)
(/)(O H C n n N N N mol kg M A m M B m K m K T O H C B B
f
B f f 该化合物的化学式为==?+?+?====?-
`0031 03C1
将12.2g 苯甲酸溶于100g 乙醇中,使乙醇的沸点升高了1.13K 。若将这些苯甲酸溶于100g 苯中,则苯的沸点升高了1.36K 。计算苯甲酸在这俩种溶剂中的摩尔质量。计算结果说明了什么问题。已知在乙醇中得沸点升高常数为K b =1.19Kmol -1kg ,在苯中为K b =2.60Kmol -1kg 。
~0031
在乙醇中 M B =0.128Kgmol-1 在苯中 M B =0.233Kgmol-1 说明苯甲酸在苯中以双分子缔和 `0032 03C1
在300K 时,将葡萄糖(C 6H 12O 6)溶于水中,得葡萄糖的质量分数为0.044的溶液。试求 (1) 该溶液的渗透压; (2) 若用葡萄糖不能透过的半透膜,将溶液和纯水隔开,试问在溶液一方需要多高的水柱才能使之平衡。设这时溶液的密度为1.015×103kg . m -3。已知水和汞的密度分别为103kg.m -3和13.6×103kg.m -3。
~0032
(1)a B B P m M RT
m 510189.6)
/(?==
∏ρ
(2) H g O H gh gh )()(2ρρ==∏h H2O =63.13m
`0033 03C1
(1)人类血浆的凝固点为-0.5℃(272.65K ),求在37℃(310.15K)时血浆的渗透压。已知水的凝固点降低常数K f =1.86Kmol -1kg ,血浆的密度近似等于水的密度,为1×103kg ·m -3;
(2)假设某人在310K 时其血浆的渗透压为729kPa ,试计算葡萄糖等渗透溶液的质量摩尔浓度。
~0033
(1)π=6.93×105pa
(2) m B =0.2829mol ·kg -1 `0034 03C2
某水溶液含有非挥发性溶质,在271.65K 时凝固。试求
(1)该溶液的正常沸点,已知水的K b =0.52K.kg.mol -1,K f =1.86K.kg.mol -1; (2)在298K 时的蒸汽压,已知该温度时纯水的蒸气压为3.178kPa ; (3)在298K 时的渗透压。假设溶液是理想的稀溶液。
~0034 (1)
K
K T K K T T T T K K T T m K T m K T K T f f b b b b b b
f b
f B b b B f f f 57.3735.186
.152.015.373;
;5.165.27115.273**=?+=?+=?+==??=?=?=-=? (2)
a B A A A A B f
f B B f f p x p x p p m ol k
g kg m ol
x kg
m ol m ol kg K K K T m m K T 3132)0143
.01(10178.3)1(0143
.0)
.0182.0/(1086.0806.0.086.0..85.15.1;13
**11
1
1=-??=-===+=
==
?==?----
(3)以1kg 稀溶液为基准,则
a
B B p kg m K m ol K J kg m ol kg m RT n V RT n 613311113310998.11015.298..314.8.806.0.10?=??=
==∏-------
`0035 05C3
已知101325Pa 下A 与B 的熔点分别为500℃和800℃,A 与B 可形成固体化合物AB (s ),该化合物在400℃分解为AB 2(s )和=B x 0.4
的液相。AB 2(s )在600℃分解为B (s )和=B x 0.55的液相,该系统有一个低共熔点,温度为300℃,组成为=B x 0.10。请:
(1)作出相图 (2)计算将组成为=B x 0.20的液态混合物100mol 冷却到接近300℃,然后再交替使用分离加热手段,最多可得多少纯B 。
~0035 (1)相图如图
(2)将100mol 组成为=B x 0.20的系统降温到接近300℃,则
20
.050.010.020.0100)
()
(--=
-s AB s AB n n 得
mol
n s AB 25)(=
将得到的25molAB (s )加热到温度刚刚超过400℃,AB (s )分解为组成为=B x 0.4液相及AB2(s ),则
50
.067.040
.050.025)
()
(22--=
-s AB s AB n n 得
mol
n s AB 26.9)(=
将得到的9.26molAB2(s )加热到600℃,AB2(s )分解为组成为=B x 0.55的液相及B (s ),则
67
.000.155
.067.026.9)()(--=
-s B s B n
n 得mol
n s AB 47.2)(=
`0036 01C1
理想气体经可逆多方过程膨胀,过程方程式为pV n
=C,式中C ,n 均为常数,n>1。(l )若n=2,1mol 气体从V 1膨胀到V 2,温度由T 1=573K
到T 2=473K ,求过程的功W ;⑵如果气体的C V,m =20.9J ·K -1·mol -1
,求过程中的Q ,△U 和△H 。
~0036
J
J J W U Q J T T nC dT C H J T T nC dT C U J T T nR V P V P V V C dV V C PdV W V C P n C PV m P P T T m V V T T V V V V n
6.12584.8312090,4.2921)(,2090)()2(4.831)()()1
1(,2,)1(12,12,2122112
1222
1
2
1
21
21-=+-=-?=-=-==?-=-==?-=--=--=--=-=-====?
?
??则
`0037 01C1
在298K 时,有一定量的单原子理想气体C V,m =3R/2,从始态2000kPa 及20dm 3
经下列不同过程,膨胀到终态压力为100kPa ,求各个过程的W, △U, △H 和Q 。⑴等温可逆膨胀;⑵绝热可逆膨胀;⑶以δ=1.3的多方过程可逆膨胀。
~0037
kJ
W U Q kJ T T nR
W kJ T T R n T T nC H T T R n T T nC U K K P P T P P T C T P nRT PV C PV kJ
T T R n T T nC H kJ U W kJ T T R n T T nC U K K P P T P P T T P T P R
R C C Q kJ P P nRT W Q m ol RT V P n H U m P m V m P m V m V m P 08.37,42.67)(1,56.50)(25)()(23)(,3.149298)20()(,,)3(76.70)(2
5
)(,46.42,46.42)(23)(9.89298)20()(,,667.12325
,0)2(4.121ln ,36.16,0;0)1(121212.1212.3.13.1111212'11212.1212.667.1667
.111121
2212111..2
111
1=-?=-=---=-=-=-=?=
-=-=??=====-==-=-=?-=?=-=-=-=?=?=========-===
=?=?-------δ
γδ
δδδδγγγγγγ联立上两式得:多方可逆绝热可逆等温可逆
`0038 02C1
有5mol 某双原子理想气体,已知其Cv,m=2.5R,从始态400K,200kPa 经绝热可逆压缩至400kPa 后,再真空膨胀至200kPa ,求整个过程中Q ,W ,△U ,△H ,△S
~0038
1
212121212112
1
22222212.11121.17
/21121
2
..21211111.81.28,4.127458.9103,8.9103,0.81.28ln
,0,0)(,0)2(4.12745)(,8.9103,8.9103)(6.487400)400200(
)(,4.157,,0,0)1(2------=?+?=?=?+?=?-=?+?=?-=+==+===?=-?===?=?=?-==-=?-==?-=--==?========?==K J S S S J H H H J U U U J W W W Q Q Q K J P P nR S W U Q T f H U V P W J
T T nC H J W U J T T nC W K
K kPa
kPa T P P T C C T P T P T Q S Q Q m P m V m V m P R R ,整个过程 :逆过程熵变计算可设计等温可不变。理想气体真空膨胀温度真空膨胀绝热可逆压缩外χ
γ
γγγγγ
`0039 02C1
在298K 的等温情况下,在一个中间有导热隔板分开的盒子中,一边放0.2mol O 2(g ),压力为20kPa ,另一边放0.8mol N 2(g ),压力为80kPa 。抽去隔板使两种气体混合,该气体为理想气体。试求 ;
(1)混合后盒子中的压力(2)混合过程中的Q ,W ,△U ,△S ,△G (3)如果假设在等温情况下,使混合气体再可逆回到始态,计算该过程的Q 、W 的值
~0039
J W W W J V V
RT n W J V V RT n W J Q W U J S T Q J S T S T H G K J V V
R n V V R n S S S Q U W P V RT
n P m P RT n V m P RT n V O N N N O O R mix R mix mix mix mix N N O O N O mix a
N N N O O O 1717,86.1373ln ,46.343ln
,1717,0,1717)3(17170,.763.5ln ln
0,0,0)2(49991,02478.0,02478.0)1(2222222
222222
222
221
212133=+==-==-==-==?-=?-=-=?-=?-?=?=+=?+?=?==?===
=
==
-总总总总
总总回原态。
等温可逆分离使气体各又是等温过程,合过程没有对外作功,以整个盒子为体系,混
`0040 02C1
有2mol 理想气体,从始态300K ,20dm 3经下列不同过程等温膨胀至50dm 3
,计算各过程的Q ,W ,△U ,△H ,△S (1)可逆膨胀。(2)真空膨胀(3)对抗恒外压100kPa 膨胀
~0040
)2(,7.300,30003000)10201050(10)(0)3(.24.15ln 50,00)2(.24.15,8.4570,8.4570ln
,0)1(2
22333351211
232112熵变值同Q=,等温恒外压膨胀,则为设计等温可逆膨胀至,Q=真空等温膨胀等温可逆膨胀外K nR
V P T J W U J m m P V V P W H U K J V V
nR T Q S dm V W U H U K J T
Q
S J W U Q J V V nRT W H U a R R R ==
=-?-=?-??-=--==?=?===
?=-?=?=?==?=-?=-=-==?=?----
`0041 02C1
有1mol 甲苯CH 3C 6H 5(l )
在其沸点383K 时蒸发为气,计算该过程的Q,W,△U\,△H,△S,△A,△G,已知在该温度下,甲苯的汽化热为362kJ ·kg -1
~0041
Qp=33.35kJ △vapHm=33.35kJmol -1 W=-P(V g -V l )=-PV g =-nRT=-3.186kJ △U=Q+W=30,16kjmol -1 △vapGm=0, △A=-W=3.186kJ ·mol -1
△vapSm=Q R /T=87.03J ·mol -1K -1
`0042 02C2
有1mol 过冷水,从始态263K,101kPa 变成同温同压的冰,求该过程的熵变。并用计算说明这一过程的可逆性。已知水和冰在该温度范围
内的平均摩尔定压热熔分别为,Cp ,m (H 2O ,l )=75.3J ·K -1mol -1 Cp ,m (H 2O ,s )=37.7JK -1mol -1
,在273K101kPa 时水的摩尔凝固热为△fre H
(H 2O ,s )=-5.90kJ ·mol
-1
~0042
逆过程。
所以该过程为自发不可T可逆冷却可逆加热环系隔环
系
环系系0..79.0,..00.21,.5524.377.5900.753),(),([),(,.21.20.41.1ln .61.21,.82.2ln )
101,273,()101,273,()
101,263,()101,263,(1111111122232113211
1
2.312112.12231
222
1
2
1
21
21
2
>=?+?=?=?-=?-=--=+?-+=?+?+?=?-=?+?+?=?-===?-=?-=?===??
↑??↓?→?------------???
???
K m ol J S S S K m ol J H S m ol J m ol J m ol J m ol J dT
s O H C s O H H dT l O H C H H H H K J S S S S K J T T nC dT T C S K J T H S K J T T nC dT T C S kP K s O H kP K l O H S S kP K s O H kP K l O H P T T m fus P T T m P P
T T m fus m P P T T a S a a S
a
`0043 02C1
1molN 2(g )可看作理想气体,从始态298K,100kPa ,经如下两个等温过程,到达相同的终态压力600kPa ,分别求过程的Q ,W ,△U ,△H ,△A ,△G ,△S ,△Siso (1)等温可逆压缩。(2)等外压为600kPa 时压缩。
~0043
1
1
121221211
1
2max 2
1
.67.2657.419.14.57.4129812388,12388,12388)1()()(,,,,)1()2(0
,.90.14,.90.142982.4439,2.4439ln 2.4439,2.4439,2.4439ln
,0,600)1(----=+-=?+?=?==-=?-=-?==--=--=--=?????=?+?=?=-=?-=-==?==?==?-=-?==-==?=?K J S S S K J K J
T Q S J W U Q J P P nRT P nRT P nRT P V V P W S G A H U S S S K J T Q S K J K J T Q S J P P nRT G J W A J W U Q J P P nRT W H U kP R T R R R a 环系隔离环外环系隔离系环系的值不变。的始终态相同,故和过程等温可逆压缩至
`0044 02C1
将1mol O 2(g )从298K ,100kPa 始态,绝热可逆压缩到600kPa 试求该过程的Q ,W ,△U ,△H ,△A ,△G ,△S ,△Siso 。设O 2(g )的
Cp,m=3.5R,S ⊙m(O 2,g)=205.14JK -1mol -1
.
~0044
0,0,4.35067)2982.497(.14.2055.57965.36723)2982.497(.14.2054.4140,,0,5.5796)(4.4140,4.4140)(,2.497)
(,,4.15.2/5.3/,0111212121212
112212
1
11=?+?=?=-
=?-=-?-=?-?=?-=-?-=?-?=?==-=?==-=?=?==-=?=======-----环系隔离环系所以S S S T
Q
S J K K J J T S H G J K K J J T S U A S S S S S J T T C H J
U W J T T C U K P P
T T T P T P C C Q P V V P γ
γ
γγ
γγγ
`0045 02C1
将1mol 双原子理想气体从始态298K 100kPa 绝热可逆压缩到体积为5dm 3
,试求终态的温度,压力和过程的Q ,W ,△U ,△H ,△S
~0045
,7778)(5556,0,5556)(,3.565,940)(
02478.0,4.15/7,12122
22121231
1
12211==?=-=?=?===-=?======
===T Q
S J T T C H J U W Q J T T C U K nR V P T kP P V V P m P nRT V V P V P P V a γγ
γγ绝热可逆过程方程
`0046 02C2
. 将1mol 苯C 6H 6(l)在正常沸点353K 和101.3kPa 压力下,向真空蒸发为同温同压的蒸汽已知在该条件下,苯的摩尔汽化焓为
△vapHm=30.77kJ ·mol -1
设气体为理想气体试求:(1)该过程的Q ,W (2)苯的摩尔汽化焓△vapSm 和摩尔气化Gibbs 自由能△vapGm (3)环境的熵变△S 环(4)根据计算结果,判断上述过程的可逆性
~0046
过程。
故真空蒸发为 不可逆ⅡⅡ环环体隔离环外外,0.3.8)4(.9.7835327835)3(0
,..2.87)2(27835)()]()([)()(,0)1(11
11>=?+?=?+?=?-=-=-=?=?-?=?=?=
?=-?=-?≈--?=+=?=-?==----K J S S n S S S K J K
J T Q S S T H G K m ol J T
H S J nRT H n g V P H n l V g V P H n W Q U W U Q W m vap m vap m vap m vap m
vap m vap m vap m m vap m m m vap p
`0047 02C1
某一化学反应,在298K 和标准大气压力下进行,当反应进度为1 mol 时,放热40.0KJ 。若使反应通过可逆电池来完成,反应程度相同,则吸热4.0KJ 。
(1)计算反应进度为1 mol 时的熵变m r S ? (2)当反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,从隔离系统的总熵变值说明了什么问题。 (3)计算系统可能做的最大功的值
~0047
J G W J J J Q H S T H G K mol J S S S K mol J mol
K J
T Q S K mol J mol
K J T Q S S f R P R r m r 44000,4400040004000030..6.147,..2.134129840000)2(..42.1312984000/)1(max .111111-=?=-=--=-?=?-?=?>=?+?=?=?=-=?=?==
?=?------)(。说明该过程能自发进行环体隔离环ξξξ
`0048 02C2
1mol 单原子理想气体,从始态273K,100kpa,分别经下列可逆变化达到各自的终态,试计算个过程的Q ,W ,△U ,△H ,△S ,△A ,△G 已
知该气体在273K,100kPa 的摩尔熵△Sm=100JK -1mol -1
(1)恒温下压力加倍(2)恒压下体积加倍(3)恒容下压力加倍(4)绝热可逆膨胀至压力减少一半(5)绝热不可逆反抗50kPa 恒外压膨胀至平衡
~0048
(1)△U=△H=0 W=-Q=1573J △S=-5.763JK -1
△A=W=1573J △G=△A=1573J
(2)△U=3405J W=-2270J △Q=5675J △H=5674J=Qp △S=114.4JK -1 △G=-2.949*104J △A=-3.176*104
J
(3)W=0 △U=3405J Qv=△U=3405J △ H=5674J △S=108.6JK -1 △G=-2.632*104J △A=-2.859*104
J (4)Q=0 △U=-823.1J W=△U=-823.1J △H=-1372J △S=0 △G=5228J △A=5777J
(5)Q=0 △U=W=-680.9J △H=-1135J △S=101.1JK -1
△G=4085J △A=4539J `0049 02C2
将1molH 2O (g )从373K100kPa 下,小心等温压缩,在没有灰尘等凝聚中心存在时,得到了373K ,200kPa 的介稳水蒸气,但不久介稳水蒸气
全变成了液态水,即)2,373,()2,373,(22P K l O H P K g O H ?→?,求该过程的△H △G △S 已知在该状态下,水的摩尔气化焓为46.02kJ ·mol
-1
水的密度为1000kg ·m-3
设气体为理想气体,液体体积受压力的影响可忽略不计.
~0049
1
3211
11232111
21.6.11702.46,2148,82.1)1013251013252(.1000.018.01)(,0,21502ln 373..314.81ln
21-Θ
-----=?-?=?-=?=?-=?+?+?=?=-???=-==?=?-=????==??K J T
G H S kJ H n H J G G G G J P P mol kg mol kg mol P P nM
dP V G G J P P K K mol J mol P P nRT G m r a a l P P ρ
`0050 02C1
用合适的判据证明 ;(1)在373K 和200kPa 压力下,H 2O (l )比H 2O (g )更稳定(2)在263K 和100kPa 压力下,H 2O (s )比H 2O (l )更稳定
~0050 (1)
H 2O(l,373K,200kPa) △G
H 2O(g,373K,200kPa)
△G1
△G=0
△G3
的液态水稳定。
所以a l g a g
a g kP kP l a l kP kP kP K V V kP G G G G V kP dP V G G V kP dP V G a
a
a
a
200,373,0)(100100,0,100321200100321002001>-?=?+?+?=??==?=??-==??
?
(2)
的冰稳定。
所以a s l s l l l K
K
s s s K
K
kP K S S K S S G G G G K
S dT S G G K S K K S dT S G 100,263)
(0100)(100,0,100)263273(321263273322732631>>?-=?+?+?=??=-=?=??-=--=-=??
?
`0051 02C2 在298K 和100kPa 压力下已知金刚石和石墨的摩尔熵摩尔燃烧焓和密度分别为:
物质 △Sm(J ·mol -1·K -1) △rHm(kJ ·mol -1
) (kg ·m -1)
金刚石 2.45 -395.40 3513
石墨 5.71 -393.51 2260 试求:
(1)在298K 及100kPa 下C (石墨)→C (金刚石)的△trsGm ⊙
(2)在298K 及100kPa 时,哪个晶体更为稳定?
(3)增加压力能否使稳定晶体向不稳定晶体转化?如有可能,至少要加多大压力,才能实现这种转化?
~0051
(1)C (石墨)→C (金刚石)
=?-?=?Θ
ΘΘ)H )H H m c m c m trs 金石(((-393.51KJ.mol -1)-(-395.40KJ.mol -1)=1.89KJ.mol -1 =?-?=?ΘΘΘm trs m trs m trs S T H G 1.89KJ.mol -1-298K ×[(2.377-5.74)×10-3KJ.K -1.mol -1]=2.893KJ.mol -1
(2)在 298K,100Kpa 下Θ
?m trs G >0,反应不能右向进行,故石墨稳定。
(3)加压?????=??=???2121;)(G G P P T VdP G d V P
G
=-?+?=?Θ
Θ)()1()2(12P P V G G m t r s m t r s m t r s
2893J.mol -1
+).2260.012011.0.3513.012011.0(3
1
31-----m
Kg mol Kg m Kg mol Kg ×(P 2-1×105Pa) 欲使0)2(≤?Θ
m trs G 解上式得P 2≥1.526×109Pa
`0052 02C3
某实际气体的状态方程为P RT PV m α+=,式中α为常数。设有1mol 该气体,在温度为T 的等温条件下,由p 1可逆的变到p 2.试写出Q ,W ,△U ,△S ,△H ,△A ,△G 的计算表示式。
~0052
2
1211212112221
21
1
212ln )ln (1),()()(0)(ln 0,0)()]([)()()(
,ln //ln ln ,)(2
P P
nR P P nRT T T W T W U T Q S P P n P RT n P RT n V P V P PV U H P P
nRT W U Q Virial U P P P n V nR
T P n V nRT T T P T P T P V S T V U PdV TdS dU P P
nRT P nRT P nRT nRT n V n V nRT dV n V nRT PdV W nRT n V P R V V T T V V
=--=-=-?==
?-=+-+=-+=?+?=?=-?==?=-=--=--??=-??=-??=??-=-=-=---=--
=-==-??αααα
ααααα膨胀时内能不变。明分子间无引力,等温方程无压力校正项,说该状态方程
`0053 02C1
计算下述催化加氢反应,在298K 时计算如下反应的△rGm (298K )从所得数值判断反应的可能性(1)CH 4+1/2O 2(g )→CH 3OH (l ) (2) C (石墨)+2H 2(g )+1/2O 2(g )→CH 3OH (l)
H 2O(s,263K,100kPa)
△G
H 2O(l,263K,100kPa)
H 2O(s,273K,100kPa)
H 2O,273K,100kPa) △G1
△G2=0
△G3
物质 ).(1-Θ?mol kJ H m f )..(1
1--ΘK mol J S m CH 4 -74.81 186.264 O 2 0 205.138 CH 3OH -238.66 126.8 C(石墨) 0 5.74 H 2 0 130.684
~0053
的可能性更大一些。
减少方向进行,反应自发变化总是朝自由能石墨)2(.28.166..877.242)298,,(2
1)298,,(2)298,,()298,,(.66.238)298,,()2(.564.115..033.162)298,(2
1)298,()298,,(.85.163)298,()298,,()1(1112231
31
1
12431
43-Θ
ΘΘ--ΘΘΘΘΘ-ΘΘ-Θ
ΘΘ--ΘΘΘΘ-Θ
ΘΘ-=?-?=?-=-?--=?-=?=?-=?-?=?-=--=?-=?-?=?m ol kJ S T H G K m ol J K g O S K g H S K s C S K l OH CH S S m ol kJ K l OH CH H H m ol kJ S T H G K m ol J K O S K CH S K l OH CH S S m ol kJ K CH H K l OH CH H H m r m r m r m m m m m r m f m r m r m r m r m m m m r m f m f m r
`0054 02A2
试说明△G ~0054 (1)环境对体系做的非体积功大于体系吉氏自由能的升高值;(2)体系对环境做的的非体积功的绝对值小于体系吉氏自由能降低的绝对值。 `0055 02C2 对vanderWaals 实际气体,试证明2)(m T V a V U =?? ~0055 2 22222222)()()1()2() 2()(,;))((:)1()()()( ,m T V V T T V a V a n V a n nb V nRT nb V nRT V U nb V nR T P V a n nb V nRT P nRT nb V V a n P s vanderWeal P T P T P V S T V U PdV TdS dU ==----=??-= ??--==-+-??=-??=??-=得代入方程 `0056 02C2 在600K,100kPa 压力下,生石膏的脱水反应为CaSO 4·2H 2O(s)→CaSO 4(s)+2H 2O (g )试计算该反应进度为1mol 时的Q,W,△Um,△Hm,△Sm,△A,△Gm已知各物质在298K100kPa的热力学数据为 物质 △f Hm ⊙(kJ ·mol -1) △Sm ⊙(J ·mol -1K -1 ) Cp,m(J ·K -1·mol -1 ) CaSO 4·2H 2O (s ) -2021.12 193.97 186.20 CaSO 4(s ) -1432.68 106.70 99.60 H 2O (g ) -241.82 188.83 33.58 ~0056 1 1 11131 1111111600298)600()298(1124241 21211 11111600298) 600() 298(1 124.2.4.12424.67144)600()600()600(.57174..79.276600.109.108)600()600()600(..79.276..60.13..39.290298600ln ..44.19)298()600(,)(,..39.290),2(),(2),()298(.953.881,977.9),2()(,.93.98)600(.93.98)298600(..44.19.8.104)600(,)..44.19(..44.19),2(),(2),()(.8.104),2(),(2),()298(-ΘΘΘ----ΘΘΘ--------Θ ΘΘ ??Θ--ΘΘΘΘ------Θ --Θ ??--Θ-Θ ΘΘΘ-=?-?=?-=?-?=?-?=?=-=?-?=??=??=???=?-+=?=+= ?-=-=-=--===-?-=?-=?-=?--=?=???=??-?+?=???? ? Θ ΘΘΘm ol J K S T K H K G m ol J K m ol J K m ol J K S T K U K A K m ol J K m ol J K m ol J K K K m ol J K S K S T dT C S d T C T S K m ol J s O H CaSO S g O H S s CaSO S K S m ol kJ m ol W Q U kJ nRT g O H PV V V P W m ol kJ K Q m ol kJ K K K m ol J m ol kJ K H dT K m ol J H d K m ol J s O H CaSO C g O H C s CaSO C C T H m ol kJ s O H CaSO H g O H H s CaSO H K H m r m r m r m r m r m r m r m r P r K K m r K S K S P r P m r m m m m r m P m r K K m r K H K H m P m P m P P r m r m f m f m f m r m r m r m r m r `0057 02C3 将1mol 固体典I 2(s )从298K ,100kPa 的始态,转变成457K ,100kPa 的I 2(g )计算在457K 时I 2(g )的标准摩尔熵和过程的熵变。已 知I 2(s )在298K ,100kPa 时的标准摩尔熵为Sm ⊙(I 2,s ,298K )=116.14J ·K -1·mol -1,熔点为387K 标准摩尔熔化焓△fus H m (I 2, s )=15.66kJ ·mol -1 设在298-387K 的温度区间内,固体与液体碘的摩尔比定压热熔分别为Cp ,m (I2,s )=54.68J ·K -1·mol -1,Cp ,m (I 2,l )=79.59J ·K -1·mol -1 , 碘在沸点457K 时的摩尔气化焓为△vapHm (I 2,l )=25.52kJ ·mol -1 ~0057 )) 387(,()387()()457(,())457(,()298,(223 ,24 ,1,222 ,K T l I K T g I S K T l I S S K T g I K s I f S f m b m m b S m m r ??→??↑↓ ↓?↑?↓??→???Θ 1 11 3 4,111112,3,1 132,111112,1,..84.55457.1052.20..23.13387457ln ..59.79ln )(..47.403871066.15..29.14298387ln ..68.54ln )(---Θ------Θ ----=?= ?= ?=?==?=?=?= ?=?==?K m ol J K m ol J T H S K m ol J K k K m ol j T T l C S K m ol J K J T H S K m ol J K K k m ol J T T s C S b m vap m m p m f m fus m m p m 1 111221 14,3,2,1,..9.239..)8.12314.116()298,,()457,,(..8.123------=+=?+==?+?+?+?=?K m ol J K m ol J S K g I S K g I S K m ol J S S S S S m m m m m m `0058 02C1 保持压力为标准压力,计算丙酮蒸汽在1000K 时的标准摩尔熵值。已知在298K 时丙酮蒸汽的标准摩尔熵值Sm ⊙(298K )=294.9JK -1mol -1 在273-1500K 的温度区间内,丙酮蒸汽的定压摩尔热熔Cp ,m ⊙与温度的关系式为:Cp ,m ⊙=[22.47+201.8*10-3(T /K)-63.5*10-6 (T /K)2]J ·K -1·mol -1 ~0058 ??-----??--?++===??)()(1 12122612312122121 ..]})()[(21 105.63)(108.201ln 4.22{)()(;;)(T S T S T T P P p K mol J T T T T T T T S T S T dT C dS T C T S )1000(K S =434,83J ·mol -1K -1 `0059 04A1 判断下列说法是否正确,为什么? (1)在一个密封的容器内,装满了373.2K 的水,一点空隙也不留,这时水的蒸气压等于零; (2)在室温和大气压力下,纯水的蒸气压为* P ,若在水面上充入N 2(g )以增加外压。则纯水的蒸气压下降; (3)小水滴与水汽混在一起成雾状,因为它们都有相同的化学组成和性质,所以是一个相; (4)面粉和米粉混合的十分均匀,肉眼已无法分清彼此,所以它们已成为一相; ~0059 (1) 错,蒸汽压是液体的本性。 (2) 错,外压增加,纯水的蒸汽压增大。 (3) 错,是两相。 (4) 错,两者化学性质不同是两相。 `0060 04A1 指出下列平衡系统中的物种数、组分数、相数和自由度数。 (1)NH 4Cl (s )在真空容器中,分解成NH 3(g )和HCl (g )达平衡; (2)NH 4Cl (s )在含有一定量NH 3(g )的容器中,分解成NH 3(g)和HCl (g )达平衡; (3)CaCO 3在真空容器中,分解成CO 2(g )和CaO (s )达平衡; (4)NH 4HCO 3(s )在真空容器中,分解成NH 3(g),CO 2(g)和H 2O(g)达平衡; ~0060 (1) S=3;C=1; φ=2;f=1 (2) S=3;C=2; φ=2;f=2 (3) S=3;C=2; φ=2;f=2 (4) S=4;C=1; φ=2;f=1 `0061 04C3 回答下列问题。 (1)在同一温度下,某研究系统中有两相共存,但它们的压力不等,能否达成平衡? (2)为什么把CO 2(s)叫做干冰?什么时候能见到CO 2(l)? (3)能否用市售的60o 烈性白酒,经多次蒸馏后,得到无水乙醇? (4)在相图上,哪些区域能使用杠杆规则,在三相共存的平衡线上能否使用杠杆规则? ~0061 (1) 可以,如渗透平衡。 (2) CO 2(s)可以升华直接变为CO 2(g),在较大压力下,可以在合适温度下得到CO 2(l). (3) 不能,白酒是非理想的二组分溶液与Roault 定律的正偏差很大,在T-X 图上有最低点,恒沸混合物中乙醇的质量分数为0.9557。 所以开始用乙醇浓度小于0.9557的混合物进行分馏,得不到乙醇,只能得到浓度 为0.9557的恒沸混合物。 (4) 两相平衡区可以使用杠杆规则。 `0062 03C2 在288K 和大气压力下,某酒窖中存有酒10.0m 3,其中含乙醇的质量的质量分数为0.96。令欲加水调制含乙醇的质量分数为0.56的酒,试计算 (1) 应加水的体积; (2) 加水后,能得到含乙醇的质量分数为0.56的酒的体积。 已知该条件下,纯水的密度为999.1kgm -3,水和乙醇的偏摩尔体积为 0.96 14.61 58.01 0.56 17.11 56.58 ~0062 (1) ) 2() 1(96.02252522252525252O H O H OH H C OH H C O H O H OH H C OH H C OH H C OH H C V n V n V M n M n M n +==+联立(1)式和(2)式解得m ol n m ol n O H OH H C 4 510788.110679.1252?=?= 稀释后,含乙醇0.56的乙醇溶液的质量为 Kg m m m Kg x M n x m m OH H C O H OH H C OH H C OH H C 3410067.610379.1522525252?=-=?== = 需添加水的质量和体积为 3 3 3''3143'75.5.1.99910745.510745.5.018.010788.110067.6222 m m Kg Kg m V Kg m ol Kg m ol Kg m O H O H O H =?== ?=??-?=--ρ (2)利用偏摩尔量加和公式:33.15225252m V n V n V O H O H O H H C O H H C =+= `0063 03C1 在298K 和大气压力下,甲醇(B)的摩尔分数x B 为0.30的水溶液中,水(A)和甲醇(B)的偏摩尔体积分别为:V(H 2O)=17.765cm 3mol -1,V(甲醇)=38.632cm 3mol -1.。已知在该条件下,甲醇和水的摩尔体积分别为:Vm(H 2O)=18.068cm 3mol -1,Vm(甲醇)=40.722cm 3mol -1.。现在需要配置上述水溶液1000cm3,试求 (1) 需要纯水和纯甲醇的体积; (2) 混合前后体积的变化值。 ~0063 (1) 1 3025.2421) 2)(/()1(2233232233-=++=+=mol cm V x V x V n n V V V n V n V O H O H OH CH OH CH m O H OH CH m O H OH CH OH CH O H =)式得)式代入(将( 欲配制1000cm3上述溶液,根据(2)式需要甲醇和水的物质的量分别为 mol n x n mol n x n mol V V n n n O H O H OH CH OH CH m O H OH CH 136.29487.12;623.41/223323======+总总总= 这些纯物质相应的体积为:V(CH 3OH)=n CH3OH V m,CH3OH =508.5cm 3;V(H 2O)=n H2O V m,H2O =526.43cm 3 混合前的总体积为:V 前=V(CH 3OH)+V(H 2O)=1034.93cm 3 (2) 混合前后体积变化值为:△V=V 前-V 后=1034.93cm 3-1000cm 3=34.93cm 3 `0064 03C2 在298K 和大气压力下,溶质NaCl(s)(B)溶于1.0kgH 2O(l)(A)中,所得溶液的体积V 与溶入NaCl(s)(B)的物质的量n B 之间的关系式为: V=[1001.38+16.625(l mo n B ;)+1.774(l mo n B ;)3/2+0.119(l mo n B ;)2]cm 3 试求:(1) H 2O(l)和NaCl 的偏摩尔体积与溶入的NaCl(s)的物质的量n B 之间的关系; (2) n B=0.5mol 时,H 2O(l)和NaCl 的偏摩尔体积; (3) 在无限稀释时,H 2O(l)和NaCl 的偏摩尔体积。 ~0064 (1)556.55/)119.0774.138.1001(;119.02774.1625.162 2 32 12 3 2B B O H B B NaCl n n V n n V --=??++= (2)1313)(626.18;019.182--?=?=mol cm V mol cm V NaCl l O H (3)无限稀释时,n B →0,则 V NaCl =16.625cm3mol -1 V H2O =18.041cm 3mol -1 `0065 03C1 在293K 时,氨的水溶液A 中NH 3与水的量之比是1:8.5,溶液A 上方NH 3的分压为10.64kPa ;氨的水溶液B 中NH 3与水的量之比是1:21,溶液B 上方NH3的分压为3.597kPa 。试求在相同温度下 (1) 从大量的溶液A 中转移1molNH 3(g)到大量的溶液B 中的△G ; (2) 将处于标准压力下的1molNH3(g)到大量的溶液B 中的△G 。 ~0065 (1) (2)) 1 .2642)(/)(ln[]}/)(ln[{]}/)(ln[{),(),(),(),(33333333-Θ Θ Θ Θ -==+-+=-=-=?mol J A P B P RT P A P RT P B P RT g A g B l A l B G NH NH NH NH NH NH NH NH μμμμμμ1 **.8100]/),(ln[),(),(3 33333-Θ -==-=-=?mol J P g B P RT g B l B G NH NH NH NH NH NH μμμμ `0066 03C1 300K 时,纯A 和纯B 可形成理想的混合物,试计算如下两种情况的Gibbs 自由能的变化值。 (1) 从大量的等物质量的纯A 和纯B 形成理想的混合物中,分出1mol 纯A 的△G ; (2) 从纯A 与纯B 各为2mol 所形成理想的混合物中,分出1mol 纯A 的△G 。 ~0066 .J RT m ol RT RT RT RT G n G n G G G W m ol J x RT n n n n G n G n G G G W B A A B A B A A B A B m B B B m B B f A A A B A A B A B m B B B m B B f 2138]2)3 2)(31ln[(1)]21ln (2)21ln (2[]1)32ln (2)31ln (1[)22()121()()()2(.1717ln ) (])1[()()()1(4* *** **' ',,1**,,=?=+?++?- ?++?++?=?+?-?+?+?=-= -=?==-=-=+-++-=-=-=?=∑∑∑∑-μμμμμμμμμμμμμμμμμ前后前后前后前后 `0067 03C1 在413K 时,纯C 6H 5Cl(l)和纯C 6H 5Br(l)的蒸汽压分别为125.24kPa 和66.10kPa 。假定两种液体形成某理想液态混合物,在101.33kPa 和413K 时沸腾,试求 (1) 沸腾时理想液态混合物的组成; (2) 沸腾时液面上蒸汽的组成。 ~0067 2637 .017363.0;4043.01;5957.0) ()1(* ***** ***=-====-==--=-+=-+=+=A B A A A A B B A B A B A A B A B A A B A y y P x P y x x P P P P x P P x P x P x P P P P `0068 03C1 液体A 与液体B 能形成理想液态混合物,在343K 时,1mol 纯A 与2mol 纯B 形成的理想液态混合物的总蒸汽压为50.66kPa 。若在液态混合物中再加入3mol 纯A ,则液态混合物的总蒸汽压为70.93kPa 。试求 (1) 纯A 与纯B 的饱和蒸汽压; (2) 对第一种理想液态混合物,在相应的气相中A 和B 各自的摩尔分数。 ~0068 (1) a B a A B A a B A a B B A A kP P kP P P P P P P P x P x P P 39.30;20.91)2(3 13270930) 1(3 23150660; * *** *** *==+=+=+=联立两式得 (2) 4.01; 6 .0*=-====A B A a A A y y P x P P P y `0069 01C1 1mol 单原子理想气体,m V C ,=3R/2,始态⑴的温度为273K ,体积为22.4dm 3 ,经历如下三步,又回到始态,请计算每步过程的Q,W 和△U 。 ⑴等容可逆升温由始态⑴到546K 的状态⑵; ⑵等温(546K )可逆膨胀由状态⑵到44.8dm 3 的状态⑶; ⑶经等压过程由状态⑶回到始态⑴。 ~0069 ⑴Q J T T nC dT C U pdV W T T V V ==-==?=-=??6.3404)(0 2 1 12 ⑵J W Q T f U J V V nRT W R R 5.3146;0)(;5.3146ln 12 =-===?-=-= ⑶J W U Q J T T nC U J V V V nRT V p W m V 3.5674;6.3404)(7.2269)(12,3111 -=-?=-=-=?=--=?-= `0070 01C1 在298时,有2mol N 2(g ),始态体积为15 dm 3,保持温度不变,经下列三个过程膨胀到终态体积为50 dm 3 ,计算各个过程的△U ,△ H,W 和Q 的值,设气体为理想气体。 ⑴自由膨胀;⑵反抗恒定外压100KPa 膨胀;⑶可逆膨胀。 ~0070 ⑴W=0 △H=△U=0 Q=0 ⑵W=-Pe △V=-3500J △H=△U=f(T)=0 Q=3500J ⑶J V V nRT W 9.5965ln 1 2 -=-= △H=△U=f(T)=0 Q=5965.9J `0071 01C1 在水的正常沸点(373.15K,101.325KPa ),有1mol H 2O (l )变为同温同压的H 2O (g ),已知水的摩尔汽化焓变值为△vap H M =40.69KJ ·mol -1 ,请计算该变化的Q, △U, △H 的值各位多少? ~0071 J W Q U J nRT V V p V p W kJ H n Q p l g m Vap p 37588;4.3102)(;69.40=+=?-=-=--=?-==?=外外 `0072 01C3 理想气体等温可逆膨胀,体积从V 1膨胀到10 V 1,对外做了41.85KJ 的功,系统的起始压力为202.65KPa 。⑴求起始体积V 1;⑵若气体的量为2mol ,试求系统的温度。 ~0072 (1)31 11208968.0;2186;ln m p nRT V K T V V nRT W ===-=解得⑴V 1=0.08968m 3 ⑵ P 1V 1=nRT 1;T 1=1093K `0073 01C1 在101.325KPa 及423K 时,将1molNH 3(g )等温压缩到体积等于10 dm 3 ,求最少需要做多少功?⑴假定气体是理想气体;⑵假定符合van der Waals 方程式,已知van der Waals 常数a=0.417Pa ·m 6·mol -2,b=3.71×10-5 Pa ·m 6·mol -1 。 ~0073 J V V nRT W m p nRT V 4376ln ;03471.0)1(1 2311=-=== ??=---=-===-+21214345)(;03464.0;))()(2(223 2V V V V m m m J dV V an nb V nRT pdV W m V RT b V V a p 解得 `0074 01C3 已知在373K 和100KPa 压力时,1Kg H 2O (l )的体积为1.043 dm 3,1kg H 2O (g )的体积为1677 dm 3,H 2O (l )的摩尔汽化焓变值△vap H M =40.69KJ ·mol -1 。当1mol 的H 2O (l )的在373K 和100KPa 时完全蒸发变成H 2O (g ),试求:⑴蒸发过程中系统对环境所做的功;⑵假定液态水的体积可忽略不计,试求蒸发过程中系统对环境所做的功,并计算所得计算结果的相对误差;⑶假定把蒸汽看做是理想气体,且略去液态水的体积,求系统所做的功;⑷求⑴中变化的△vap U M 和△vap H M ;⑸解释何故蒸发的焓变大于系统所做的功。 ~0074 (1) W=-P(Vg-V l )=-101325Pa ×(1.677-1.043×10-3)m 2.Kg -1×18×10-3Kg=-3.057KJ (2) W=-PVg=-101325Pa ×18×10-3Kg ×1.677m 2.Kg -1=-3.059KJ (3) W=-PVg=-nRT=-1mol ×8.314J.mol -1.K -1×373K=-3.101KJ (4) p m vap Q H =?=40.66KJ.ml -1 (5) W Q U m vap +=?=40.66+(-3.057)=37.60KJ.mol -1 . 吸的热一部分对外作功。另一部分用于克服分子间引力,增加分子间距离,提高分子热力学能。 `0075 01C2 1mol 单原子理想气体,从始态:273K ,200KPa ,到终态323K,100KPa ,通过两个途径:⑴先等压加热至323K ,再等温可逆膨胀至100KPa ;⑵先等温可逆膨胀至100KPa ,再等压加热至323K 。请分别计算两种途径的Q W △U 和△H ,试比较两种结果为何不同,试说明为什么? ~0075 ⑴W=-2277.1J △H=1039.25J △U=623.55J Q=2900.65J ⑵W=-1989J △H=1039.25J △U=623.55J Q=2612.55J 小结⑴状态函数的变化只与始态的状态有关,而与变化过程无关 ⑵热和功与过程有关 `0076 01C1 273K ,压力为5×105Pa 时,N 2(g )的体积为2.0dm 3 ,在外压为100KPa 下等温膨胀,直到N 2(g )的压力也等于100KPa 为止。求过程中得W, △U, △H 和Q 。假定气体是理想气体。 ~0076 始态 a a kP p dm V K T P p 1000.2;273;10523 1151===?=终态过程等温横外压膨胀, J p p V p p p nRT p nRT p nRT p V V p w 800)1()1()()1 2111 21 11 21212-=--=--=--=--=(外 J J W U Q T f H U 800)800(00 )(=--=-?===?=? `0077 01C1 0.02kg 乙醇在其沸点时蒸发为气体。已知蒸发热为858kJ ·kg -1,蒸汽的比容为0.607 m 3·kg -1 。求过程中得W, △U, △H 和Q 。(计算时略去液体的体积) ~0077 物理化学实验(B) 实验报告 【实验名称】B.5 液体饱和蒸气压的测定 【】J.N 【班级】第4小组 【学号】 【组编号】5号 【实验日期】2015年5月11日 【室温】24.1 ℃ 【大气压】100.11 kPa 【摘要】 本实验通过静态法测得CCl4的lg(p pθ )与T的关系为 lg(p p )=?1709.9 T +4.9078,平均摩尔汽化热为3.274×104 J?mol?1, 气化熵为93.87 J?mol?1?K?1。通过动态法测得水的lg(p p ) 与T的关系为lg(p pθ)=?2078.7 T +5.5792,平均摩尔汽化热为3.980× 104 J?mol?1,气化熵为106.7 J?mol?1?K?1。温度读数的不准确对实验的误差极小,实验误差的主要是由于静态法中肉眼判断液面平衡的不准确性以及动态法中金属测温探头在沸腾过程中并非一端位于液面下一端位于液面上等因素所引起的。 一、实验部分 1.主要仪器药品和设备 1.1 主要药品 CCl4、二次水等 1.2 主要仪器 数字式温度-压力测定仪,循环水流泵,1/10刻度温度计,电磁搅拌器,电加热器,两口圆底烧瓶,真空缓冲瓶,安全瓶,直形冷凝管,搅拌磁子,真空脂,冷凝水循环系统 2.实验步骤 2.1 静态法测定饱和蒸气压 2.1.1 仪器装置 1-盛水大烧杯, 2-温度计,3-搅拌, 4-平衡管,5-冷凝管, 6-开口U型水银压 力计,7-缓冲瓶,8- 进气活塞,9-抽气活 塞,10-放空活塞, 11-安全瓶,12、13- 橡皮管,14-三通活 塞。 实际仪器略有 差异,压力温度数值 从温度-压力测定仪 中读出。 平衡管中加入 CCL4至容量的2/3. 2.1.2 检验气密性 打开油泵,再开缓冲瓶上连接油泵的活塞,使体系压力减少50 kPa。关闭活塞,若5 min压强变化少于0.3 kPa,则装置气密性良好。 2.1.3 测大气压下沸点 使体系与大气相通,水浴加热至78 ℃,停止加热不断搅拌。当b、c液面达到同一水平时,立即记下此时的温度和大气压力。重复测定,若连续两次测定沸点差小于0.05 ℃,则空气已排净,此时温度即为大气压下沸点。 2.1.4 测定不同压强下沸点 关闭通往大气的活塞。先开由泵,再开连油泵的活塞,使体系减压约6.7 kPa。关闭接油泵活塞,搅拌,至b、c液面达到同一水平时,立即记下此时的温度和大气压力。继续减压,测定其沸点。至压力差为50 kPa,结束实验,读大气压力。2.1.5 整理仪器 打开所有活塞,关闭搅拌器、温度-压力测定仪、冷凝水进出口及油泵开关, 第一章 气体的pVT 关系 1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下: 1 1T T p V p V V T V V ???? ????-=??? ????= κα 试导出理想气体的V α、T κ与压力、温度的关系 解:对于理想气体,pV=nRT 111 )/(11-=?=?=??? ????=??? ????= T T V V p nR V T p nRT V T V V p p V α 1211 )/(11-=?=?=???? ????-=???? ????- =p p V V p nRT V p p nRT V p V V T T T κ 1-2 气柜内有、27℃的氯乙烯(C 2H 3Cl )气体300m 3 ,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时 解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为 mol RT pV n 623.1461815 .300314.8300 106.1213=???== 每小时90kg 的流量折合p 摩尔数为 13 3153.144145 .621090109032-?=?=?=h mol M v Cl H C n/v=(÷)=小时 1-3 0℃、的条件常称为气体的标准状况。试求甲烷在标准状况下的密度。 解:33 714.015 .273314.81016101325444 --?=???=?=?=m kg M RT p M V n CH CH CH ρ 1-4 一抽成真空的球形容器,质量为。充以4℃水之后,总质量为。若改用充以25℃、的某碳氢化合物气体,则总质量为。试估算该气体的摩尔质量。 解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρ n=m/M=pV/RT mol g pV RTm M ?=?-??== -31.3010 13330) 0000.250163.25(15.298314.84 1-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。若将其 物理化学实验报告 溶解热的测定 实验时间:2018年4月日 姓名:刘双 班级: 学号: 1.实验目的 (1)了解电热补偿法测量热效应的基本原理。 (2)用电热补偿法测定硝酸钾在水中的积分溶解热,通过计算或者作图求出硝酸钾在水中的微分溶解热、积分冲淡热和微分冲淡热。 (3)掌握微机采集数据、处理数据的实验方法和实验技术。 2.实验原理 物质溶解于溶剂过程的热效应称为溶解热,物质溶解过程包括晶体点阵的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等过程,这些过程热效应的代数和就是溶解过程的热效应,溶解热包括积分(或变浓)溶解热和微分(或定浓)溶解热。把溶剂加到溶液中使之稀释,其热效应称为冲淡热。包括积分(或变浓)冲淡热和微分(或定浓)冲淡热。 溶解热Q:在恒温、恒压下,物质的量为n2的溶质溶于物质的量为n1的溶剂(或溶于某浓度的溶液)中产生的热效应。 积分溶解热Qs:在恒温、恒压下,1mol溶质溶于物质的量为n1的溶剂中产生的热效应。 微分溶解热(eQ en2)n 1 :在恒温、恒压下,1mol溶质溶于某一确定浓度的无限量的溶液中 的热效应。 冲淡热:在恒温、恒压下,物质的量为n1的溶剂加入到某浓度的溶液中产生的热效应。 积分冲淡热Q d:在恒温、恒压下,把原含1mol溶质和n02mol溶剂的溶液冲淡到含溶剂为n01mol时的热效应,为某两浓度的积分溶解热之差。 微分冲淡热eQ en1n 2或eQ S en0n 2 :在恒温、恒压下,1mol溶剂加入到某一确定浓度的无限 量的溶液中产生的热效应。 它们之间的关系可表示为: dQ=eQ 1n 2 dn1+ eQ 2n 1 dn2 上式在比值n1 n2 恒定下积分,得: Q=eQ en1 n2 n1+ eQ en2 n1 n2 Q n2=Q s,令:n1 n2 =n0,则有: ?Q ?n1 = ?(n2Q s ?n2n0 =( ?Q s ?n0 ) Q d=Q s n01?Q s n02 其中积分溶解热Q s可以直接由实验测定,其他三种可以由Q s?n0曲线求得。 欲求溶解过程中的各种热效应,应先测量各种浓度下的的积分溶解热。可采用累加的方法,先在纯溶剂中加入溶质,测出热效应,然后再这溶液中再加入溶质,测出热效应,根据先后加入的溶质的总量可计算出n0,而各次热效应总和即为该浓度下的溶解热。本实验测量硝酸钾溶解在水中的溶解热,是一个溶解过程中温度随反应的进行而降低的吸热反应,故采用电热补偿法测定。先测定体系的初始温度T,当反应进行后温度不断降低时,由电加热法使体系复原到起始温度,根据所耗电能求出热效应Q。 3.仪器和试剂 反应热测量数据采集接口装置: NDRH-1型,温度测量范围0~40℃,温度测量分辨率0.001℃,电压测量范围0~20V,电压测量分辨率0.01V,电流测量范围0~2A,电流测量分辨率0.01A。 精密稳流电源:YP-2B型。 微机、打印机。 量热计(包括杜瓦瓶,搅拌器,加热器,搅拌子)。 称量瓶8只,毛笔,研钵。 硝酸钾(A.R.) 4.实验操作 (1)取8个称量瓶,分别编号。 (2)取KNO3于研钵中,研磨充分。 (3)分别称量约 2.5、1.5、2.5、3.0、3.5、4.0、4.0、4.5g 研磨后的硝酸钾,放入 8 个称量瓶中,并精确称量瓶子与药品的总质量。记录下所称量的数据。 (4)使用0.1g精度的天平称量216.2g的去离子水,放入杜瓦瓶中,将杜瓦瓶放在磁力搅 第一章 气体pVT 性质 1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下: 1 1T T p V p V V T V V ???? ????-=??? ????= κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT 111 )/(11-=?=?=??? ????=??? ????= T T V V p nR V T p nRT V T V V p p V α 1211 )/(11-=?=?=???? ????-=???? ????- =p p V V p nRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时? 解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为 mol RT pV n 623.1461815 .300314.8300 106.1213=???== 每小时90kg 的流量折合p 摩尔数为 13 3153.144145 .621090109032-?=?=?=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时 1-3 0℃、101.325kPa 的条件常称为气体的标准状况。试求甲烷在标准状况下的密度。 解:33 714.015 .273314.81016101325444 --?=???=?=?=m kg M RT p M V n CH CH CH ρ 1-4 一抽成真空的球形容器,质量为25.0000g 。充以4℃水之后,总质量为125.0000g 。若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。试估算该气体的摩尔质量。 解:先求容器的容积33) (0000.1001 0000.100000.250000.1252 cm cm V l O H ==-=ρ 第二章 热力学第一定律 思考题.:1. 一封闭系统,当始终态确定后:(a )当经历一个绝热过程,则功为定值;(b )若经历一个等容过程,则Q 有定值:(c )若经历一个等温过程,则热力学能有定值:(d )若经历一个多方过程,则热和功的和有定值。 解释:始终态确定时,则状态函数的变化值可以确定,非状态函数则不是确定的。但是热力学能U 和焓没有绝对值,只有相对值,比较的主要是变化量。 2. 从同一始态A 出发,经历三种不同途径到达不同的终态: (1)经等温可逆过程从A→B;(2)经绝热可逆过程从A→C;(3)经绝热不可逆过程从A→D。 试问: (a )若使终态的体积相同,D 点应位于BC 虚线的什么位置,为什么? (b )若使终态的压力相同,D 点应位于BC 虚线的什么位置,为什么,参见图 12p p (a) (b) 图 2.16 解释: 从同一始态出发经一绝热可逆膨胀过程和一经绝热不可逆膨胀过程,当到达相同的 终态体积V 2或相同的终态压力p 2时,绝热可逆过程比绝热不可逆过程作功大,又因为W (绝热)=C V (T 2-T 1),所以T 2(绝热不可逆)大于T 2(绝热可逆),在V 2相同时,p=nRT/V,则p 2(绝热不可逆)大于 p 2(绝热可逆)。在终态p 2相同时,V =nRT/p ,V 2(绝热不可逆)大于 V 2(绝热可逆)。 不可逆过程与等温可逆过程相比较:由于等温可逆过程温度不变,绝热膨胀温度下降,所以T 2(等温可逆)大于T 2(绝热不可逆);在V 2相同时, p 2(等温可逆)大于 p 2(绝热不可逆)。在p 2相同时,V 2(等温可逆)大于 V 2(绝热不可逆)。 综上所述,从同一始态出发经三种不同过程, 当V 2相同时,D 点在B 、C 之间,p 2(等温可逆)>p 2(绝热不可逆)> p 2(绝热可逆)当p 2相同时,D 点在B 、C 之间,V 2(等温可逆)> V 2(绝热不可逆)>V 2(绝热可逆)。 总结可知:主要切入点在温度T 上,绝热不可逆做功最小。 实验7 凝固点降低法测定摩尔质量 姓名:憨家豪;学号:2012012026;班级:材23班;同组实验人员:赵晓慧 实验日期:2014-3-8;提交报告日期:2014-3-15 带实验的助教姓名:袁斌 1. 引言 1.1 实验目的 1.用凝固点降低法测定尿素的摩尔质量。 2.学会用步冷曲线对溶液凝固点进行校正。 3.通过本实验加深对稀溶液依数性的认识。 1.2 实验原理 稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为: *×f f f f B T T T K b ?=-= 式中:f T ?为凝固点降低值,* f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为: 1000× ×B f f A m T K M m ?= 即 310B f f A m M K T m =? 式中: f K 为溶剂的凝固点降低常数(单位为K ·kg ·mol -1 );M 为溶质的摩尔质量(单位为g ·mol -1 )。 如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ?,利用上式即可求出溶质的摩尔质量。 常用溶剂的f K 值见下表1。 表1 常用溶剂的f K 值 实验中,要测量溶剂和溶液的凝固点之差。对于纯溶剂如图1所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。相对恒定的温度即为凝固点。 对于溶液来说,除温度外还有溶液浓度的影响。当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。因此,凝固点不是一个恒定的值。如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。要精确测量,应测出步冷曲线,按图1(b )所示方法,外推至f T 校正。 图1 溶剂和溶液的步冷曲线 2. 实验操作 2.1 实验用品、仪器型号及测试装置示意图 SWC-IID 精密数字温度温差仪、冷阱、大试管、移液管(25 mL )、85-2型恒温磁力搅拌器、DC-2010节能型智能恒温槽、分析天平。 去离子水,尿素(分析纯)。 测试装置示意图(如下) 纯液体饱和蒸汽压的测量 目的要求 一、 明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱 和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。 二、 用数字式真空计测量不同温度下环己烷的饱和蒸气压。初步掌握真空实验 技术。 三、 学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸 点。 实验原理 通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol 液体所吸收的热量称为该温度下液体的摩尔气化热。 液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm (101.325kPa )时,液体的沸点称为该液体的正常沸点。 液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示: 2 m vap d ln d RT H T p ?= (1) 式中,R 为摩尔气体常数;T 为热力学温度;Δvap H m 为在温度T 时纯液体的摩尔 气化热。 假定Δvap H m 与温度无关,或因温度范围较小,Δvap H m 可以近似作为常数,积分上式,得: C T R H p +??-=1 ln m vap (2) 其中C 为积分常数。由此式可以看出,以ln p 对1/T 作图,应为一直线,直线的斜率为 R H m vap ?- ,由斜率可求算液体的Δvap H m 。 静态法测定液体饱和蒸气压,是指在某一温度下,直接测量饱和蒸气压,此 法一般适用于蒸气压比较大的液体。静态法测量不同温度下纯液体饱和蒸气压,有升温法和降温法二种。本次实验采用升温法测定不同温度下纯液体的饱和蒸气压,所用仪器是纯液体饱和蒸气压测定装置,如图1所示: 平衡管由A 球和U 型管B 、C 组成。平衡管上接一冷凝管,以橡皮管与压 《大学化学基础实验2》实验报告 课程:物理化学实验 专业:环境科学 班级: 学号: 学生姓名:邓丁 指导教师:谭蕾 实验日期:5月24日 实验一、溶解焓的测定 一、实验名称:溶解焓的测定。 二、目的要求:(1)学会用量热法测定盐类的积分溶解焓。 (2)掌握作图外推法求真实温差的方法。 三、基本原理: 盐类的溶解通常包含两个同时进行的过程:一是晶格的破坏,为吸热过程;二是离子的溶剂化,即离子的水合作用,为放热过程。溶解焓则是这两个过程热效应的总和,因此,盐类的溶解过程最终是吸热还是放热,是由这两个热效应的相应大小所决定的。影响溶解焓的主要因素有温度、压力、溶质的性质以及用量等。热平衡式: △sol H m=-[(m1C1+m2C2)+C]△TM/m2 式中, sol H m 为盐在溶液温度及浓度下的积分溶解焓, J·mol , m1 , m2 分别为水和溶质的质量, M 为溶质的摩尔质量,kg·mol -1 ;C1 ,C 2 分别为溶剂水, kg; 溶质的比热容,J·kg -1;T 为溶解过程中的真实温差,K;C 为量热计的热容, J·K- 1 ,也称热量计常数.本实验通过测定已知积分溶解焓的标准物质 KCl 的 T ,标定出量热计热容 C 的值. 四、实验主要仪器名称: NDRH-2S型溶解焓测定实验装置1套(包括数字式温度温差测量仪1台、300mL简单量热计1只、电磁搅拌器1台);250mL容量瓶1个;秒表1快;电子 ;蒸馏水 天平1台;KCl;KNO 3 五、实验步骤: (1)量热计热容 C 的测定 ( 1 ) 将仪器打开 , 预热 . 准确称量 5.147g 研磨好的 KCl , 待用 . n KCl : n水 = 1: 200 (2)在干净并干燥的量热计中准确放入 250mL 温室下的蒸馏水,然后将温度传感器的探头插入量热计的液体中.打开搅拌器开关,保持一定的搅拌速度,待温差变化基本稳定后,读取水的温度 T1 ,作为基温. (3)同时, 每隔30s就记录一次温差值,连续记录8 次后, 将称量好的 5.174g KCl 经漏斗全部迅速倒入量热计中,盖好.10s记录一次温度值,至温度基本稳定不变,再每隔 30s记录一次温度的数值,记录 8 次即可停止. (4)测出量热计中溶液的温度,记作 T2 .计算 T1 , T2 平均值,作为体系的温度.倒出溶液,取出搅拌子,用蒸馏水洗净量热计. KNO3 熔解热的测定:标准称量 3.513g KNO3 ,代替 KCl 重复上述操作. 气体pVT 性质 1. 1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下: 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每 小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时? 解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为 每小时90kg 的流量折合p 摩尔数为 133153.144145 .621090109032-?=?=?=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时 1-3 0℃、101.325kPa 的条件常称为气体的标准状况。试求甲烷在标准状况下的密度。 解:33714.015 .273314.81016101325444--?=???=?=?=m kg M RT p M V n CH CH CH ρ 1-4 一抽成真空的球形容器,质量为25.0000g 。充以4℃水之后,总质量为125.0000g 。若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。试估算该气体的摩尔质量。 解:先求容器的容积33)(0000.1001 0000.100000.250000.1252cm cm V l O H ==-=ρ n=m/M=pV/RT 1-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。若将其中一个球加热到100℃,另一个球则维持0℃,忽略连接管中气体体积,试求该容器内空气的压力。 解:方法一:在题目所给出的条件下,气体的量不变。并且设玻璃泡的体积不随温度而变化,则始态为 )/(2,2,1i i i i RT V p n n n =+= 终态(f )时 ??? ? ??+=???? ??+=+=f f f f f f f f f f T T T T R V p T V T V R p n n n ,2,1,1,2,2,1,2,1 1-6 0℃时氯甲烷(CH 3Cl )气体的密度ρ随压力的变化如下。试作ρ/p —p 图,用外推法求氯甲烷的相对分子质量。 解:将数据处理如下: P/kPa 101.325 67.550 50.663 33.775 25.331 (ρ/p)/ (g ·dm -3·kPa ) 0.02277 0.02260 0.02250 0.02242 0.02237 作(ρ/p)对p 图 当p →0时,(ρ/p)=0.02225,则氯甲烷的相对分子质量为 1-7 今有20℃的乙烷-丁烷混合气体,充入一抽真空的200 cm 3容器中,直至压力达101.325kPa ,测得容器中混合气体的质量为0.3879g 。试求该混合气体中两种组分的摩尔分数及分压力。 解:设A 为乙烷,B 为丁烷。 B A B B A A y y mol g M y M y n m M 123.580694.30 867.46008315 .03897.01+=?==+==- (1) 1=+B A y y (2) 联立方程(1)与(2)求解得401.0,599.0==B B y y 燃烧热的测定 姓名:憨家豪学号:2012012026 班级:材23 同组人:赵晓慧 实验日期:2014年4月19日提交报告日期:2014年4月20日 实验老师姓名:郭勋 1 引言 1.1实验目的 (1)熟悉弹式量热计的原理、构造及使用方法; (2)明确恒压燃烧热与恒容燃烧热的差别及相互关系; (3)掌握温差测量的实验原理和技术; (4)学会用雷诺图解法校正温度改变值; 1.2实验原理 在指定温度及一定压力下,1 mol物质完全燃烧时的定压反应热,称为该物质在此温度下的摩尔燃烧热,记作△c H m。通常,完全燃烧是指C→CO2(g),H2→H2O(l),S→SO2(g),而N、卤素、银等元素变为游离状态。由于在上述条件下△H=Q p,因此△c H m也就是该物质燃烧反应的等压热效应Q p。 在实际测量中,燃烧反应在恒容条件下进行(如在弹式量热计中进行),这样直接测得的是反应的恒容热效应Q v(即燃烧反应的△c U m)。若反应系统中的气体均为理想气体,根据热力学推导,Q p和Q v的关系为 Q P=Q V+?nRT(1)式中:T——反应温度,K; ?n——反应前后产物与反应物中气体的物质的量之差; R——摩尔气体常数。 通过实验测得Q V值,根据上式就可计算出Q P,即燃烧热的值。 测量热效应的仪器称作量热计。量热计的种类很多。一般测量燃烧热用弹式量热计。本实验所用量热计和氧弹结构如图2-2-1和图2-2-2所示。实验过程中外水套保持恒温,内水桶与外水套之间以空气隔热。同时,还对内水桶的外表面进行了电抛光。这样,内水桶连同其中的氧弹、测温器件、搅拌器和水便近似构成一个绝热体系。 弹式量热计的基本原理是能量守恒定律。样品完全燃烧所释放的能量使得氧弹本身及 第一章 气体pVT 性质 1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下: 1 1T T p V p V V T V V ???? ????-=??? ????= κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT 111 )/(11-=?=?=??? ????=??? ????= T T V V p nR V T p nRT V T V V p p V α 1211 )/(11-=?=?=???? ????-=???? ????- =p p V V p nRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时? 解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为 mol RT pV n 623.1461815 .300314.8300 106.1213=???== 每小时90kg 的流量折合p 摩尔数为 13 3153.144145 .621090109032-?=?=?=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时 1-3 0℃、101.325kPa 的条件常称为气体的标准状况。试求甲烷在标准状况下的密度。 解:33 714.015 .273314.81016101325444 --?=???=?=?=m kg M RT p M V n CH CH CH ρ 1-4 一抽成真空的球形容器,质量为25.0000g 。充以4℃水之后,总质量为125.0000g 。若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。试估算该气体的摩尔质量。 一章气体的pVT关系 1.1 物质的体膨胀系数与等温压缩率的定义如下 试推出理想气体的,与压力、温度的关系。 解:根据理想气体方程 1.2 气柜内贮有121.6 kPa,27℃的氯乙烯(C2H3Cl)气体300 m3,若以每小时90 kg的流量输往使用车间,试问贮存的气体能用多少小时? 解:假设气柜内所贮存的气体可全部送往使用车间。 1.3 0℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度? 解:将甲烷(M w=16g/mol)看成理想气体: PV=nRT , PV =mRT/ M w 甲烷在标准状况下的密度为=m/V= PM w/RT =101.32516/8.314273.15(kg/m3) =0.714 kg/m3 1.4 一抽成真空的球形容器,质量为25.0000g充以4℃水之后,总质量为125.0000g。若改充以25℃,13.33 kPa的某碳氢化合物气体,则总质量为 25.0163g。试估算该气体的摩尔质量。水的密度1g·cm3计算。 解:球形容器的体积为V=(125-25)g/1 g.cm-3=100 cm3 将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M w M w= mRT/ PV=(25.0163-25.0000)8.314300.15/(1333010010-6) M w =30.51(g/mol) 1.5 两个容积均为V 的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球加热到 100℃,另一个球则维持 0℃,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。 标准状态: 因此, 1.6 0℃时氯甲烷(CH 3Cl )气体的密度ρ随压力的变化如下。试作p p -ρ 图,用外推法求氯甲烷的相对 分子质量。 《物理化学实验》 报告册 —学年第学期 专业: 班级: 姓名: 学号: 物理化学实验是继无机化学实验、分析化学实和有机化学实验之后的一门基础实验课。综合了化学领域中各分支所需的基本研究工具和方法,通过实验的手段,研究物质的物理化学性质以及这些物理化学性质与化学反应之间的关系,从而形成规律的认识,使学生掌握物理化学的有关理论、实验方法和实验技术,以培养学生分析问题和解决问题的能力。 物理化学实验的主要目的是使学生能够掌握物理化学实验的基本方法和技能,从而能够根据所学原理设计实验,正确选择和使用仪器,培养学生正确地观察现象,记录数据和处理数据以及分析式样结果的能力;培养学生严肃认真、实事求是的科学态度和作风;通过物理化学实验课程的教学还可以验证所学的原理,加深和巩固对物理化学原理的理解,提高学生对物理化学知识灵活运用的能力。 为了达到上述目的,必须对学生进行正确而严格的基本操作训练,并提出明确的要求。实验过程中的具体要求分为以下三个方面: 一、实验前的预习 1.实验前必须充分预习,明确实验内容和目的,掌握实验的基本原理,了解所用仪器、仪表的构造和操作规程,熟悉实验步骤,明确实验要测量的数据并做好实验记录。 2.写出预习报告,内容包括实验目的、原理和简单的实验内容提要,针对实验时要记录的数据详细地设计一个原始数据记录表格,预习报告在实验前交教师检查。 二、实验过程 1.进入实验室后不得大声喧哗和乱摸乱动,根据教师安排按实验台编号进入到指定的实验台,检查核对所需仪器。 2.不了解仪器使用方法前不得乱试,不得擅自拆卸仪器。仪器安装调试好后,必须经教师检查无误后方能进行实验。 3.遇有仪器损坏,应立即报告,检查原因,并登记损坏情况。 4.严格按实验操作规程进行,不得随意改动,若确有改动的必要,事先应取得教师的同意。5.应注意养成良好的记录习惯。记录数据要求完全,准确.、整齐、清楚。所有数据应记录在预习报告上,不能只拣好的记,不得用铅笔或红笔记录。要采用表格形式记录数据。不能随意涂改数据。如发现某个数据有问题应该舍弃时,可用笔先将其划掉,再写出正确数据。6.充分利用实验时间,观察现象,记录数据,分析和思考问题,提高学习效率。 7.实验完毕,应将数据交教师审查合格并签字后,再拆实验装置,如数据不合格需补做或重做。 8.实验过程中应爱护仪器,节约药品。实验完毕后应仔细清洗和整理实验仪器,打扫实验室卫生。 三、实验报告 实验结束后,应严格地根据实验记录,对实验现象作出解释,写出有关反应,或根据实验数据进行处理和计算,作出相应的结论,并对实验中的问题进行讨论,独立完成实验报告,及时交指导教师审阅。书写实验报告应字迹端正,简明扼要,整齐清洁。 第四章多组分系统热力学 4.1有溶剂A与溶质B形成一定组成的溶液。此溶液中B的浓度为c B,质量摩尔浓度为b B,此溶液的密度为。以M A,M B分别代表溶剂和溶质的摩尔质量,若溶液的组成用B的摩尔分数x B表示时,试导出x B与c B,x B与b B之间的关系。 解:根据各组成表示的定义 4.2D-果糖溶于水(A)中形成的某溶液,质量分数,此溶液在20 C时的密度。求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。 解:质量分数的定义为 4.3在25 C,1 kg水(A)中溶有醋酸(B),当醋酸的质量摩尔浓度b B 介于和之间时,溶液的总体积 。求: (1)把水(A)和醋酸(B)的偏摩尔体积分别表示成b B的函数关系。 (2)时水和醋酸的偏摩尔体积。 解:根据定义 当时 4.460 C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。二者可形成理想液态混合物。若混合物的组成为二者的质量分数各50 %,求60 C时此混合物的平衡蒸气组成,以摩尔分数表示。 解:质量分数与摩尔分数的关系为 求得甲醇的摩尔分数为 根据Raoult定律 4.580 C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。两液体可形成理想液态混合物。若有苯-甲苯的气-液平衡混合物,80 C时气相中苯的摩尔分数,求液相的组成。 解:根据Raoult定律 4.6在18 C,气体压力101.352 kPa下,1 dm3的水中能溶解O 2 0.045 g, 能溶解N 2 0.02 g。现将 1 dm3被202.65 kPa空气所饱和了的水溶液加热至沸腾, 赶出所溶解的O 2和N 2 ,并干燥之,求此干燥气体在101.325 kPa,18 C下的 体积及其组成。设空气为理想气体混合物。其组成体积分数为:, 解:显然问题的关键是求出O 2和N 2 的Henry常数。 18 C,气体压力101.352 kPa下,O 2和N 2 的质量摩尔浓度分别 为 这里假定了溶有气体的水的密度为(无限稀溶液)。 根据Henry定律, 1 dm3被202.65 kPa空气所饱和了的水溶液中O 2和N 2 的质量摩 尔浓度分 别为 物理化学实验报告 院系化学化工学院 班级化学061 学号13 姓名沈建明 实验名称 化学电池温度系数的测定 日期 2009.4.20 同组者姓名 史黄亮 室温 19.60 ℃ 气压 102.0 kPa 成绩 一、目的和要求 1、掌握可逆电池电动势的测量原理和电位差计的操作技术; 2、学会几种电极和盐桥的制备方法; 3、通过原电池电动势的测定求算有关 热力学函数。 二、基本原理 (一)、凡是能使化学能转变为电能的装置都称之为电池对定温定压下的可 逆电池而言 : r m (1) nFE T , p G E S nF (2) r m T p E H nE F nF T (3) r m T p 式中,F 为法拉弟(Farady)常数;n 为电极反应式中电子的计量系数 ;E 为电池 的电动势。 另, 可逆电池应满足如下条件: 1.电池反应可逆,亦即电池电极反应可逆。 2.电池中不允许存在任何不可逆的液接界。 即充放电过程必须在平衡态下进行,3.电池必须在可逆的情况下 工作, 因此在制备可逆电池、 测定可逆电池的电动势时应符合上述条件, 不高的测量中,常用正负离子迁移数比较接近的盐类构成 “盐桥 ”来消除液接电 位。用电位差计测量电动势也可满足通过电池电流为无限小的条件。 (二)、求电池反应的 Δ r G m 、Δr S m 、Δr H m 设计电池如下 : Ag(s) | AgCl(s) |饱和 KCl | Hg 2Cl 2(s) | Hg(l) 分别 测定电池在各个温度下的电动势,作 E — T 图,从曲线斜率可求得任一温度 下的 E T p 利用公式 (1),(2),(3) 即可求得该电池反应的 Δ r G m 、Δr S m 、Δr H m 三、仪器、试剂 SDC — Ⅱ数字电位差综合测试仪 1 台 精密稳压电源(或蓄电池) SC — 15A 超级恒温槽 铜电极 2 只 铂电极 1 只 饱和甘汞电极 1 只 恒温夹套烧杯 2 只 HCl ( 0.1000mol k ·g-1) AgNO3 ( 0.1000mol k ·g-1) 镀银溶液 镀铜溶液 四、实验步骤 一、电极的制备 1.银电极的制备 将欲用的两只 Pt 电极(一个电极 Pt 较短,作为阳极, 另一个电极作为阴极, 用于镀银) 浸入稀硝酸溶液片刻, 取出用蒸馏水洗净。 将洗净的电极分别插入盛 有镀银液( AgNO 3 3g ,浓氨水, KI 60g )中,控制电流为 0.3mA ,电镀 1h ,得 白色紧密的镀银电极一只。 2. Ag-AgCl 电极制备 在精确度 KCl 饱和溶液 粘度法测定高聚物相对分子质量 一.实验目的 1.掌握用乌氏粘度计测定高聚物溶液粘度的原理和方法。 2.测定线型聚合物聚乙二醇的粘均相对分子质量。 二.实验原理 聚合物的相对分子质量是一个统计的平均值。粘度法测定高聚物相对分子质量适用的相对分子质量范围为1×104~1×107,方法类型属于相对法。 粘性液体在流动过程中所受阻力的大小可用粘度系数来表示。粘度分绝对粘度和相对粘度。绝对粘度有两种表示方法:动力粘度和运动粘度。相对粘度是某液体粘度与标准液体粘度之比。 溶液粘度与纯溶剂粘度的比值称作相对粘度ηr,即ηr=η/ηo,相对于溶剂,溶液粘度增加的分数称为增比粘度,ηsp=ηr-1。 使用同一粘度计,在足够稀的聚合物溶液里,ηr=η/ηo=t/t o,只要测定溶液和溶剂在毛细管中的流出时间就可得到ηr;同时,在足够稀的溶液里,质量浓度c,ηr和[η] 之间符合经验公式:(lnηr)/c=[η]-β[η]2c,通过lnηr/c对c作图,外推至c=0时所得截距即为[η];同时,在足够稀的溶液里,质量浓度c,ηsp和[η]之间符合经验公式:ηsp/c=[η]+k[η]2c,通过ηsp/c对c作图,外推至c=0时所得截距即为[η]。两个线性方程作图得到的截距应该在同一点。 聚合物溶液的特性粘度[η]与聚合物相对分子质量之间的关系,可以通过Mark——Houwink经验方程来计算,[η]=KMηα;Mη是粘均相对分子质量,K、α是与温度、聚合物及溶剂的性质相关的常数;聚乙二醇水溶液在30℃的K值为12.5×106/m3·kg-1,α值为0.78。 通过以上的原理阐述,就可以通过本次实验测定高聚物的粘均相对分子质量。三.实验仪器和试剂 仪器:恒温槽1套;乌氏粘度计1支;100ml容量瓶5只;秒表1只。 试剂:聚乙二醇(AR);去离子水。 四.实验步骤 1.设定恒温槽温度为30℃±0.5℃。 2.配制溶液。8%(质量分数)的聚乙二醇溶液5ml、10ml、15ml、20ml、25ml定容于100ml容量瓶中。 3.洗涤粘度计。 4.测定溶剂流出时间t o,测定不同浓度的溶液流出时间t。 五.数据记录与处理 实验室室温:28.5℃大气压:101.52Kpa t o:纯溶剂在a、b线移动所需时间; t1:5ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间; t2:10ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间; t3:15ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间; t4:20ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间; t5:25ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间; 所有溶液的密度以1×103kg/m3的水的标准密度,以简化计算。 第一章 333气体pVT 性质 1-1物质的体膨胀系数V α及等温压缩系数T κ的定义如下: 1 1T T p V p V V T V V ???? ????-=??? ????= κα 试导出理想气体的V α、T κ及压力、温度的关系? 解:对于理想气体,pV=nRT 111 )/(11-=?=?=??? ????=??? ????= T T V V p nR V T p nRT V T V V p p V α 1211 )/(11-=?=?=???? ????-=???? ????- =p p V V p nRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时? 解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为 mol RT pV n 623.1461815 .300314.8300 106.1213=???== 每小时90kg 的流量折合p 摩尔数为 13 3153.144145 .621090109032-?=?=?=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时 1-3 0℃、101.325kPa 的条件常称为气体的标准状况。试求甲烷在标准状况下的密度。 解:33 714.015 .273314.81016101325444 --?=???=?=?=m kg M RT p M V n CH CH CH ρ 1-4 一抽成真空的球形容器,质量为25.0000g 。充以4℃水之后,总质量为125.0000g 。若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。试估算该气体的摩尔质量。 一 1、体系在某过程中向环境放热,则体系的内能减少。 2恒温过程的Q一定就是零。( ) 3、经历任意一个循环过程时,系统从环境吸收的热等于系统对外所做的功( )对 4尽管Q与W都就是途径函数,但(Q+W)的数值与途径无关。( ) 5、由于热力学能就是状态函数,则理想气体的状态改变时,其热力学能一定跟着改变( )错 6、封闭体系经历一个不作其它功的等压过程,其热量只决定于体系的初终态( )对 7在绝热、密闭、坚固的容器中发生化学反应,△U一定为零,△H不一定为零。( ) 8不可逆过程就就是过程发生后,系统不能再复原的过程。( ) 9、因△H = Q p所以只有等压过程才有△H。( ) 10、理想气体,不管就是恒压过程,还就是恒容过程,公式dT H p都适 C 用。( ) 1 2 3 4 5 6 7 8 9 10 ××√√×√√××√ 二 二、判断题(每小题1分,共10分) 1.绝热可逆过程的?S = 0,绝热不可逆膨胀过程的?S > 0,绝热不可逆压缩过程的 ?S < 0。( ) 2.自由度就就是可以独立变化的变量。( ) 3.水溶液的蒸气压一定小于同温度下纯水的饱与蒸气压,而与溶质挥发性无关。( ) 4.从同一始态经不同的过程到达同一终态,则Q 与W 的值一般不同,Q -W 的值一般也不相同。( ) 5.冬季建筑施工时,为了保证施工质量,常在浇筑混凝土时加入盐类,效果比较理想。() 6.在等压下,机械搅拌绝热容器中的液体,使其温度上升,则ΔH = Q p = 0。( ) 7.理想气体反应 A + B = 2C,当p A= p B= p C 时,的大小就决定了反应进行方向。( ) 8.系统由V1膨胀到V2,其中经过可逆途径时做的功最多。 ( ) 9.一定量的理想气体由0℃、200kPa的始态反抗恒定外压(p环= 100kPa),绝热膨胀达平衡,则末态温度不变。( ) 10.对于计量系数?ν= 0的理想气体化学反应,增加压力与惰性气体不改变平衡点。( ) 1、(×) 2、(×) 3、(×) 4、(√) 5、(√) 6、(×) 7、(√) 8、(×) 9、(√) 10、(√) 三 第一章热力学第一定律判断题及答案 1.道尔顿分压定律,对理想气体与实际混合气体来说关系式PB=Nb(RT/V)都成立。----解:错。对实际气体不适应。 2.在两个封闭的容器中,装有同一种理想气体,压力、体积相同,那么温度也相同。----解:错。数量不同,温度可能不同。 3.物质的温度越高,则热量越多;天气预报:今天很热。其热的概念与热力学相同。解:错。没有与环境交换,无热可言;不就是相同概念,天气热就是指温度高。 4.恒压过程也就就是恒外压过程,恒外压过程也就就是恒过程。解:错。恒外压过程不一定就是恒压过程。液体饱和蒸气压的测定_物化实验报告
物理化学上册习题答案
物理化学实验报告-溶解热的测定
物理化学上册的答案-第五版上册
物理化学傅献彩上册习题答案
凝固点-物化实验报告
大学物理化学实验报告---液体饱和蒸汽压的测定
物理化学实验报告.
物理化学上册的答案_第五版上册
燃烧热物化实验报告
【物理化学上册完整习题答案】第五版 高等教育出版社
物理化学(天津大学第四版)上册答案完整版
物化实验报告册
第五版物理化学第四章习题答案
大学物理化学实验报告-化学电池温度系数的测定课件.doc
物化实验实验报告
物理化学上册的答案第五版上册
物理化学上册判断题及答案