
化妆品中霉菌和酵母菌的检验2014年8月26日下载(2008-05-22 15:45:21)
转载▼
标签:
杂谈
化妆品中霉菌和酵母菌的检验
科学2006-3-5 23:47
化妆品中霉菌和酵母菌的检验
1 概述
1.1 化妆品真菌污染的现状
真菌在自然界中分布甚广,化妆品的酸碱度,温度湿度和营养适合其生长繁殖。目前国内外有资料表明,化妆品中真菌污染是相当严重的。Wilson对眉目化妆品进行微生物检查,结果真菌污染率为12%,从睫毛油里检出茄病镰刀菌,密封的眼用化妆品染菌率为1.5%,在使用过程中急剧增至60%。所染真菌中曲霉,念珠菌居首。我国部分省市化妆品中霉菌染菌率也不低,一般为7~62.7%。有资料报道在100份化妆品中分离到真菌15个(属14种)。优势菌为酵母属,其次为青霉属和曲子霉属等。Kuehne等人对233名妇女眉笔眼影霉菌检查,结果有115人(份)检出不同真菌19属(种),计有草酸青霉、黄曲霉、交链孢霉和致病的白色念珠菌和新型隐球菌等。
1.2 化妆品的真菌病
1.2.1 念珠菌病:由白色念珠菌(白色假丝酵母)引起的急性、亚急性或慢性真菌病,可侵犯皮肤、粘膜或指甲,也可侵犯内脏或血行播散引起鹅口疮、唇炎、甲沟炎、泛发性皮肤念珠病、念珠性肉芽肿、支气管及肺念珠病、心内膜炎及脑炎和血行播散性念珠菌病等。
1.2.2 青霉病:由少数青霉菌引起呼吸道及肺部感染,使皮肤暴露部位出现湿疹样改变,还可致敏引起鼻炎及哮喘。
1.2.3 新型隐球菌病:由新型隐球酵母及其变种引起的一种深部真菌病,可侵犯肺、骨骼、皮肤淋巴结及内胖器官,主要侵犯中枢神经系统,引起隐球菌性脑膜炎。
1.2.4 曲霉病:由曲霉菌引起,可侵犯皮肤,指甲、外耳道、鼻窦、眼、气管、肺、心膜、子官、脑膜等器官形成炎性肉芽肿。
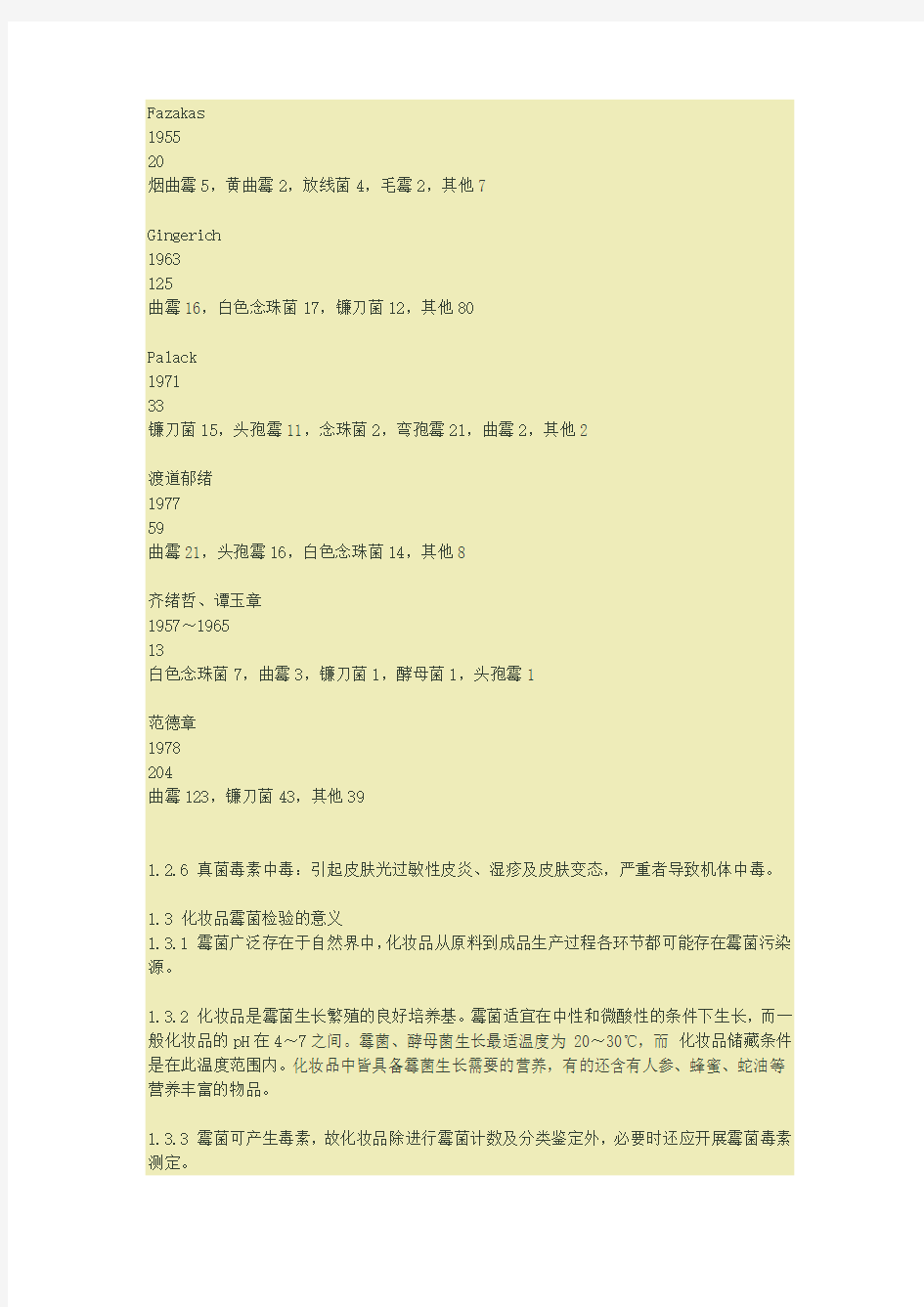
1.2.5 眼真菌病:真菌性角膜炎可由曲霉菌、镰刀菌、白色念珠菌等真菌引起角膜溃疡,见表3-2-1。
作者
年份
倒数
菌种及株数
Fazakas
1955
20
烟曲霉5,黄曲霉2,放线菌4,毛霉2,其他7
Gingerich
1963
125
曲霉16,白色念珠菌17,镰刀菌12,其他80
Palack
1971
33
镰刀菌15,头孢霉11,念珠菌2,弯孢霉21,曲霉2,其他2
渡道郁绪
1977
59
曲霉21,头孢霉16,白色念珠菌14,其他8
齐绪哲、谭玉章
1957~1965
13
白色念珠菌7,曲霉3,镰刀菌1,酵母菌1,头孢霉1
范德章
1978
204
曲霉123,镰刀菌43,其他39
1.2.6 真菌毒素中毒:引起皮肤光过敏性皮炎、湿疹及皮肤变态,严重者导致机体中毒。
1.3 化妆品霉菌检验的意义
1.3.1 霉菌广泛存在于自然界中,化妆品从原料到成品生产过程各环节都可能存在霉菌污染源。
1.3.2 化妆品是霉菌生长繁殖的良好培养基。霉菌适宜在中性和微酸性的条件下生长,而一般化妆品的pH在4~7之间。霉菌、酵母菌生长最适温度为20~30℃,而化妆品储藏条件是在此温度范围内。化妆品中皆具备霉菌生长需要的营养,有的还含有人参、蜂蜜、蛇油等营养丰富的物品。
1.3.3 霉菌可产生毒素,故化妆品除进行霉菌计数及分类鉴定外,必要时还应开展霉菌毒素测定。
1.4 几个概念
1.4.1 真菌及其在生物学上的地位
真菌是具有细胞壁、无根茎叶、不含叶绿素,以吸收方式吸取营养,具真核细胞的一类微生物。根据目前国际上广泛应用的Ainsworth分类系统及陈世骧等(1979)提出三个总界,下设五个界的分类系统,真菌在生物学上的地位如下:
1.4.2 霉菌
霉菌是指真菌中不形成子实体的丝状菌类。霉菌不是分类学上的名词,是一种俗称。霉菌常寄生于粮食、食品、化妆品等物品上,使其发霉变质。有的霉菌产毒,危害人体健康;有的霉菌应用于工业,造福人类。
1.4.3 霉菌的形态
一般霉菌鉴定主要靠形态分类。不同培养条件下生长的同一种霉菌形态也有差异,因此各种霉菌均有其标准培养基,如青霉和曲霉用察氏培养基、镰刀菌用马铃薯培养基、酵母菌用麦芽汁等。
霉菌的形态主要分菌丝和孢子。
在显微镜下观察霉菌的菌丝呈管状,直径2~10μm。有的霉菌(如根霉和毛霉)菌丝无隔膜,为多核细胞。大多数霉菌如青霉和曲霉菌丝有隔膜。有些霉菌的菌丝密集成团、坚硕称菌核。有些霉菌的菌丝特化成厚的壁呈球形的壳细胞。菌丝又有一定程度的分化。长在培养基内的称营养菌丝;在培养基上生出的称气生菌丝;产生孢子的气生菌丝又称繁殖菌丝,菌丝能产生不同色素,呈不同颜色。这些都是分类鉴定的依据。
霉菌的孢子是繁殖器管,孢子分为无性生殖孢子和有性生殖孢子。无性生殖孢子有叶状孢子、芽生孢子(酵母菌、念珠菌);厚膜孢子(镰刀菌);节孢子(白地霉)。分生孢子和孢子囊孢子均为无性生殖孢子器官。这些不同形态和不同着生状态的生殖器官是霉菌分类鉴定的重要依据。
霉菌的有性生殖是经两个细胞交配后产生的有性了解子。如卵孢子(水霉)、接合孢子(毛霉和根霉)、子囊孢子(醇母)。
2 霉菌及酵母菌总数的测定方法
2.1 霉菌数测定
霉菌数的测定是指化妆品检样在一定条件下培养后,lg或lml化妆品中所污染的活霉菌数量。藉此测定,判明化妆品被霉菌污染的程度及其一般卫生状况。
2.1.1 培养基和试剂
2.1.1.1 稀释液
成分:氯化钠 8.5g
吐温-80 7g
蒸馏水 1000ml
卵磷脂 1g
制法:先将卵磷脂用少量蒸馏水溶解,然后与氯化钠,吐温80加到蒸馏水中,混匀、溶解、分装、高压灭菌121℃20min。
2.1.1.2 虎红(孟加拉红)培养基(1)
成分:蛋白胨 5g
葡萄糖 10g
磷酸二氢钾 1g
硫酸镁(含7H20) 0.5g
琼脂 20g
1/30000虎红水溶液 100ml
蒸馏水 1000ml
制法:将上述各成分(除虎红外)加入蒸馏水中溶解后,再加入虎红溶液,分装后,高压灭菌121℃20min。
2.1.2 操作步骤(2)
似无菌操作称取检样10g(或10m1)加到90ml稀释液中,充分振荡,使之溶解并混匀,即为1:10稀释液。
用灭菌吸管吸取1m1 1:10稀释液,沿管壁注入装有9ml灭菌稀释液的试管中,另取1支lml 灭菌吸管反复吸吹,使之混匀,即为1:10稀释液,同法再作1:1000稀释液。
取1:10,1:100,1:1000的稀释液各1ml分别注入灭菌平皿内,每个稀释度各用2~3个平
板,置25~28℃培养72小时。每天都应观察,见有菌生长就要及时计数,以免蔓延生长而无法计数。
2.1.3 计算方法
先数每个平板上生长的霉菌菌落数(3)(如长有细菌不作计数),求出每个稀释度的平均菌落数。判定结果时,选取平均在30~100个范围之内的菌落数乘以稀释倍数,即为每克(或每毫升)检样中所含的霉菌数。若有两个稀释度的菌落数皆在规定范围之间或三个稀释度皆不在此范围时,应参照细菌总数的报告方式报告。
2.1.4 结果报告
以每克(或每毫升)化妆品含霉菌菌落数个七(ml)表示之。
注解:
(1)用于测定霉菌总数的常用培养基有三种,它们的优缺点如下:用改良察氏培养基测定霉菌数时生长速度明显较慢;用沙氏培养基测霉菌总数时所得回收菌数较少;用虎红琼脂测霉菌总数较理想,首先培养基配制简单,测得回收菌数准确,菌落出现较早,虎红可使霉菌染上颜色,易观察。
(2)三种不同分离方法测霉菌数的比较:用离心集菌法操作,步骤繁琐、时间长、环节多、易污染、影响结果准确性因素较多;用培养基稀释法测定时操作繁杂,结果与常规法无显著差异,因此最好还是用常规法测定霉菌数,既操作简单又省时,结果准确。
(3)菌落形态的观察
霉菌在虎红平板上的菌落形态具有放射状或树枝状的菌丝是菌落特征。初形成时多无色透明,有明显的折光性,在较暗背景下,以透射光观察易于识别。少数生长在琼脂表面的菌落,起初时似如一小块水迹,需借助暗反射光才能看清。形成孢子的菌落多数有各种颜色,是鉴定的特征之一。
2.2 酵母菌数测定在化妆品中的应用范围
凡化妆品内含有蜂蜜和皇浆等的奶状、蜜状制品均可在用虎红琼脂测霉菌数的同时用酵母膏。蛋白胨。葡萄、糖琼脂培养基(简称YPD)测酵母菌数。因为霉菌和酵母菌种类繁多,采用以上两种培养基将适合更多的霉菌酵母菌生长。
2.2.1 培养基的配制
酵母膏。蛋白胨。葡萄糖琼脂培养基(YPD)
成分:蛋白胨 10g
葡萄糖 20g
琼脂 15~20g
蒸馏水 1000ml
制法:以上各物于蒸馏水中加热溶液,分装,经115℃、15min高压灭菌。
2.2.2 酵母菌菌落形态
在虎红琼脂板上,多数为圆形凸起,边缘整齐,表面光滑湿润,呈不透明乳脂状,乳白色或粉红色,少数表面粗糙或皱褶。有的菌落周边呈细分枝状,位于琼脂内的菌落可呈铁饼形、三角形及多角形。菌落外观与细菌菌落不易区别时,应挑取菌落用水制片形,置于高倍显微镜下观察,其细胞个体比细菌大得多。一般细菌为 1μm;酵母为2.6~7μm。此外酵母具特征性的形态,即有的酵母细胞一端带有芽生抱子。在YPD琼脂平板上的酵母菌落与虎红平板上的形态相似,但稍大,多数为乳白色。
3 霉菌的鉴定技术
3.1 培养基
霉菌在不同培养基上形态可不同,因此确定菌种要用标准培养基,如察氏培养基,YPD,葡萄糖蛋白胨玉脂等。为了促使各真菌不同特点明显显示,又可用特殊培养基米粉吐温琼脂)促使白念珠菌产生厚壁孢子;马铃薯葡萄糖琼脂刺激真菌色素产生,加入一定量微量元素促使某些真菌产毒或抑制毒素产生。
3.2 菌种分离
用接种钩挑选单个菌落接种于灭菌察氏斜面上,以获得纯菌种。
3.3 菌落的观察
将菌种点种于培养基平板上,每平皿以"品"字形排列点种3点培养。可测定其菌落直径(即生长速度)及观察菌落形态特点。
3.4 微培养法(载玻片法)
取直径7cm圆形滤纸,铺于直径9cm平皿内,上放U玻棒,在棒上放洁净坡片,盖好平皿后灭菌;在滤纸上加约10ml灭菌20%甘油溶液;在载玻片中央滴融化琼脂,使成薄片状,盖上灭菌大盖玻片;在边上接种孢子悬液;25~27℃培养,随时可取出在低倍镜下观察真菌生长发育情况及结构特征。此法缺点是观察时孢子易外溢而污染环境。
3.5 菌丝尖端培养
将单介菌落点种在培养皿中央,当菌落生长直径约1cm时,切取小块菌落边缘琼脂,将其种植在新鲜斜面上,进行培养。
3.6 单孢子分离
遇菌种子不纯时最好采用显微镜单孢子分离器进行分离。若无仪器可用下法分离。
3.6.1 透明薄平板的制备:在100ml蒸馏水中加1.8~2g精制细琼脂,使融化并用棉花过滤,分装试管。每管5~6ml,在121℃下经30min灭菌后倾皿,即为透明薄平板。
3.6.2 孢子悬液的制备:将孢子稀释至适当浓度(约102孢子/ml),取1~2滴滴于上述平板上使分布均匀,平放3~5min,以28℃培养4~6小时进行检查。
3.6.3 单孢子分离:将上述平板反扣在显微镜载物台上,用低倍镜检查,可观察已萌芽的单孢子,选取与其他孢子距离较远的单个孢子,做上记号,用无菌眼科小刀按记号切下琼脂,移植于新鲜培养基斜面上。
3.7 悬滴培养
观察真菌发芽率及生长情况
3.7.1 孢子悬液制备:取一白金耳菌液于25ml灭菌生理盐水的玻珠三角烧瓶中,充分振摇15分钟,使孢子单个分散。
3.7.2 制作标本:加一滴灭菌水于凹玻片之凹窝内,将培养基融化冷却至45~50℃并加入2滴孢子悬液摇匀,在盖玻片上涂布薄层,反盖于凹玻片的窝上,用凡士林封固,经25~30℃培养。
3.7.3 镜检:培养10~15小时后取出标本在高倍镜下观察真菌的发芽率。
3.7.4 发芽的计算
发芽率=α/A×100%
式中: α----发芽孢子数;
A----发芽及不发芽孢子总数。
3.8 制片观察
为了详细观察真菌形态结构以准确鉴定,必须进行显微镜检查,故制片技术是重要的。
3.8.1 制片液剂:霉菌最常用的、效果好的制片液剂是乳酸苯酚液。它既有杀菌又能保持数月不干。其成分如下:
苯酚(结晶C.P) 10g
乳酸(相对密度1.21) 10ml
甘油 20ml
蒸馏水 10ml
配制法是将苯酚加在水中加热溶解,加入乳酸及甘油混匀即成,折射率为1.45。
3.8.2 标本制备:放1滴乳酸苯酚液于载片中央,用无菌针挑取极少量典型材料于液滴中,用二根分离针小心撕开成小块,切忌搅揉,盖上盖玻片,加滴量适当则可避免气泡。
赶去空气气泡方法(特别适用于青霉属):将材料放在载片的一滴酒精内,等大部分酒精挥发后,加入一大滴乳酸苯酚,撕开标本,盖上盖玻片即成。
当乳酸苯酚折射率与真菌菌丝接近时,无色构造极模糊,那就需要染色。但酵母等只需用水作介质就可制片了。
3.8.3 制片的保存:用黑色的虫蜡,透明无色的指甲蜡为封片剂。
注意事项:盖玻片盖时要没有外渗,没有空气。如有空气要用制片剂充填,封片剂稠度要适当,以能缓慢滴流为度。虫蜡用酒精调至适当浓度。指甲蜡可加少量丙酮稀释。用转盘及细刷子先封上极薄的一层,待封片剂全干燥后再加封。
4 化妆品中几种霉菌的鉴定
在化妆品中普遍存在着霉菌,检出率相当高,这里仅列出几种代表性霉菌。
4.1 白色假丝酵母(Candida albicans berkhout)
酵母样菌落白色、乳白色,有假菌丝也有真菌丝,在玉米琼脂上产生厚壁孢子,为无性生殖,细胞圆形、卵圆形、长椭圆形(2×6μm),芽生。
4.2 新隐球酵母(Cryp tococcus neoformans)
乳白色细菌样粘液性菌落。不规则圆形,表面有蜡样光泽。无菌丝。无性生殖结构为多样发芽形式,菌体孢子形态多样。
4.3 根霉(Rhizorus)
菌落为白色灰褐到黑褐色,疏松菌丝。背面灰色蔓延,生长迅速而不分隔的匍匐菌丝,生假根。与假根相对面上生出产孢结构,簇生或单生,长1000μm,褐黑球形孢子囊,有囊托、轴顶生于囊梗。分生孢子形态不规则,无色或浅褐色单孢子。子囊了解子在孢囊内。
4.4 毛霉(Mucor)
菌落白色到灰褐色,絮状蔓延生长迅速,菌丝粗不分隔。产孢子结构为单生或轮生,孢子囊顶生,单生于囊梗,褐色球形,有囊轴无托。分生孢子球形椭圆形,单孢无色光滑。子囊孢子在孢囊内。
4.5 交链饱霉(Alternara)
菌落绒状灰黑至黑色,蔓延生长,分生孢子梗有隔,分枝或不分枝褐绿色较短。
分生孢子倒棒状,暗褐色一顶端呈喙状分隔,子囊孢子呈链状,有时链分枝于梗上。
4.6 芽枝霉(Cladosporium)
菌落绒状、絮状橄榄色,黑绿色,背面黑绿、局限生长。分生孢子梗直立分隔,有短枝暗绿色。分生孢子呈卵形、卵圆形、有隔的长形。子囊孢子成链并分枝,顶生于梗呈树枝状。
4.7 黄曲霉(Aspergillus flavus)
菌落生长较快,丝绒状黄绿色,表面粉末状。分生孢子头放射状, 200~500μm分生孢子梗生在基质壁上粗糙无色,顶囊烧瓶形、球形。分生孢子球形、近球形,少数椭圆形,粗糙有菌核。
4.8 杂色曲霉(Aspergill versicoir)
菌落局限像小钮扣,丝绒状、絮状,黄色、橙色、黄绿、豆绿色,有或无渗出液,背面无色或黄褐色、紫色。分生孢子头球形或放射状,分生孢子梗壁光滑无色,呈放射状排列。顶囊烘瓶形,稍呈椭圆形。分生孢子球形、近球形,粗糙,有的有球形的壳细胞。
4.9 草酸青霉(Penicillium Oxalicam)
菌落绒状,暗蓝绿色,反面无色略带黄色。镜检为非对称性帚状枝,大多二轮,较紧密,偶有单孢或具尾副枝,分生孢子椭圆形,光滑。
分离培养:无菌采取病料接种马铃薯琼脂培养基中,置37℃恒温箱中培养24小时,长成绒毛样菌丝,未见其它细菌生长。经48小时培养长成白色菌落。72小时菌落呈纽扣状,由中心向外周逐渐变深,转变成灰白色、灰绿色。取培养物镜检可见大量球形的分生孢子。 通常人们把真菌和霉菌认为是一种病原的两种说法。真正真菌包括霉菌,霉菌只是众多真菌中的一种。真菌是由单细胞或多细胞组成,按有性或无性方式进行繁殖的真核细胞类微生物。根据其侵犯人体的部位分为前部真菌和深部通常人们把真菌和霉菌认为是一种病原的两种说法。真正真菌包括霉菌,霉菌只是众多真菌中的一种。真菌是由单细胞或多细胞组成,按有性或无性方式进行繁殖的真核细胞类微生物。根据其侵犯人体的部位分为前部真菌和深部真菌,包括皮肤癣菌、孢子丝菌、念珠菌、曲霉菌、隐球菌、组织胞浆菌等。而霉菌多为细胞真菌的一种,也为深部感染真菌,包括烟曲菌、黄曲菌、黑曲菌、土曲菌等,常发生于免疫力低下的患者,引起全身播散性感然,影响预后。 培养基的选择应根据实验材料和检验目的来确定。目前国标方法中使用的培养基有:马铃薯葡萄糖琼脂(PDA),孟加拉培养基(RBC)、高盐察氏培养基(CAO),其中PDA和RBC适合于一般的霉菌和酵母菌生长,而CAO则适合于高渗性霉菌生长,酵母菌几乎不长。在日常检测中我们发现,有些常见的耐高渗性霉菌,如局限曲霉、谢瓦曲霉、赤曲霉、Wallemia等在PDA、RBC上生长非常缓慢或不长,而这些菌在高渗培养基如M40Y、DG18(M40Y琼脂配方:蔗糖400g,麦芽提取汁20g,酵母提取汁5g,琼脂20g,氯霉素50mg,蒸馏水1000ml;DG18琼脂配方:葡萄糖10g,蛋白胨5g,KH2PO41g,MgSO4·7H2O 0.5g,氯霉素0.1g,0.2%二氯硝基苯胺1.0mL,琼脂15g,蒸馏水1000mL,PH6.5)上则正常生长,孢子、形态特征发育良好,而且酵母菌也能在M40Y、DG18上生长,因此,若能同时采用PDA和M40Y(或DG18)分离培养各类样品中的霉菌,将能更全面地反映出污染霉菌的菌相。特别是对干燥食品、高糖食品、淹渍食品等,更有必要同时采用M40Y或DG18。 由于霉菌中很多种类不会产生有毒的霉菌毒素,危害较小,而有的菌株即使污染数量不多,但其产生的霉菌毒素却危害较大,因此仅作霉菌计数并不能全面反映其危害程度,重要的是要知道污染菌的菌相,才能更好地判断被污染食品的安全程度。为此,国外有些研究者设计出各类选择性培养基,可以识别产毒的霉菌。如AFPA培养基(配方:酵母提取汁20g,蛋白胨10g,柠檬酸铁铵0.5g,0.2%二氯硝基苯胺1.0mL,琼脂15g,蒸馏水1000mL,PH5.6)用于分离黄曲霉毒素产生菌高污染率的食品。产黄曲霉毒素的菌株黄曲霉和寄生曲霉在AFPA上30℃培养2~3天就形成背面有亮橙黄色的特征性菌落,非常容易识别。有人利用该培养基分离黄曲霉高污染食品花生、玉米等,取得了满意的结果。因此,针对不同样品,有目的地设计出相应的选择性培养基,以筛选污染菌中的危险菌群,将是一个值得探索的方向。 2接种方式 接种方式主要有倾注法和涂布法两种。目前国际方法中采用倾注法,但近来国际上有不少学者认为霉菌计数采用涂布法更合适。Beuchat和Matsuda等人分别对这两种方法作了大
霉菌检测方法 (GB 4789.15—2010) 样品的稀释 1.1 固体和半固体样品:称取10 g 样品至盛有90 mL 灭菌生理盐水的锥形瓶中,充分振摇,即为1:10。(可在瓶内预置适当数量的无菌玻璃珠) 1.2 液体样品:以无菌吸管吸取10 mL 样品至盛有90mL 生理盐水的锥形瓶(可在瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10 的样品匀液。 1.3 取1 mL 1:10 稀释液注入含有9 mL 无菌水的试管中, 另换一支1 mL 无菌吸管反复吹吸,此液为1:100 稀释液。 1.4 按1.3 操作程序,制备10 倍系列稀释样品匀液。每递增稀释一次,换用1 次1 mL 无菌吸管。 1.5 根据对样品污染状况的估计,选择2 个~3 个适宜稀释度的样品匀液(液体样品可包括原液),在进行10 倍递增稀释的同时,每个稀释度分别吸取1 mL 样品匀液于2 个无菌平皿内。同时分别取1 mL 样品稀释液加入2 个无菌平皿作空白对照。 1.6 及时将15 mL~20 mL 冷却至46 ℃的霉菌培养基倾注平皿,并转动平皿使其混合均匀。 培养 待琼脂凝固后,将平板倒置,28℃±1℃培养3-5d,观察并记录。 菌落计数
肉眼观察,必要时可用放大镜,记录各稀释倍数和相应的霉菌和酵母数。以菌落形成单位(colonyforming units,CFU)表示。 选取菌落数在10 CFU~150 CFU 的平板,根据菌落形态分别计数霉菌和酵母数。霉菌蔓延生长覆盖整个平板的可记录为无法计数。菌落数应采用两个平板的平均数。 结果与报告 1 计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数计算。 1.2 若所有平板上菌落数均大于150 CFU,则对稀释度最高的平板进行计数,其他平板可记录为无法计数,结果按平均菌落数乘以最高稀释倍数计算。 1.3 若所有平板上菌落数均小于10 CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。 1.4 若所有稀释度平板均无菌落生长,则以小于1 乘以最低稀释倍数计算;如为原液,则以小于1计数。 2 报告 2.1 菌落数在100 以内时,按“四舍五入”原则修约,采用两位有效数字报告。 2.2 菌落数大于或等于100 时,前3 位数字采用“四舍五入”原则修约后,取前2 位数字,后面用0 代替位数来表示结果;也可用10 的指数形式来表示,此时也按“四舍五入”原则修约,采用两位有效数字。
霉菌与酵母菌计数方法 1试验菌液得制备与使用(以白色念珠菌为示例) 白色念珠菌(0)代 ↓ 传代培养 ↓ 实验菌液得制备:沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养 基,培养温度20~25℃,培养时间2~3天 ↓ 计数培养基适用性检查:胰酪大豆胨琼脂培养基,培养温度30~35℃, 培养时间不超过5天,接种量不大于100cfu ↓ 计数方法适用性试验:胰酪大豆胨琼脂培养基(MPN法不适用),培养温 度30~35℃,培养时间不超过5天,接种量不大于100cfu 注:当需用玫瑰红钠琼脂培养基测定霉菌与酵母菌总数时,应进行培养基适用性检查,检查方法同沙氏葡萄糖琼脂培养基 1.1菌种 试验用菌株得传代次数不得超过5代(从菌种保藏中心获得得干燥菌种为第0代),并采用适宜得菌种保藏技术进行保存,以保证试验菌株得生物学特性。 1。2菌液制备(按表1规定程序培养各试验菌株) 取白色念珠菌得新鲜培养物 ↓ 用pH7、0无菌氯化钠—蛋白胨缓冲液或0、9%无菌氯化钠溶液制成适宜浓度得菌悬液 取黑曲霉得新鲜培养物 ↓ 加入3~5ml含0.05%聚山梨酯80得pH7.0无菌氯化钠—蛋白胨缓冲液或0、9%无 菌氯化钠溶液,将孢子洗脱 ↓ 采用适宜得方法吸出孢子悬液至无菌试管内 ↓ 用含0。05%聚山梨酯80得pH7.0无菌氯化钠—蛋白胨缓冲液或0。9%无菌氯 化钠溶液制成适宜浓度得黑曲霉孢子悬液 菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用、稳定得黑曲霉孢子悬液可保存在2~8℃,在验证过得贮存期内使用、
1。3阴性对照 为确认试验条件就是否符合要求,应进行阴性对照试验,阴性对照试验应无菌生长。如阴性对照有菌生长,应进行偏差调查、 2、培养基适用性检查 按表1规定,接种不大于100cfu得菌液至沙氏葡萄糖琼脂培养基平板 ↓ 置表1规定条件下培养 ↓ 每一试验菌株平行制备2管或2个平皿 ↓ 同时,用相应得对照培养基替代被检培养基进行上述试验 ↓ 被检固体培养基上得菌落平均数与对照培养基上得菌落平均数得比值应在0。5-2范围内,且菌落形态大小应与对照培养基上得菌落一致;被检液体培养基管与对照培养基管比较,试验 菌应生长良好 3计数方法适用性试验 供试液制备:水不溶性非油脂类供试品 ↓ 取供试品,用pH7.0无菌氯化钠-蛋白胨缓冲液,或pH7。2磷酸盐缓冲液,或胰酪大豆胨 液体培养基 ↓ 制备成1:10供试液。 ↓ 若需要,调节供试液pH值至6~8。必要时,用同一稀释液将供试液进一步10倍系列稀释、 ⒉接种与稀释 所加菌液得体积应不超过供试液体积得1%、为确认供试品中得微生物能被充分检出,首先应选择最低稀释级得供试液进行计数方法适用性试验。
霉菌和酵母菌介绍及检测方法 一、霉菌和酵母菌介绍: 霉菌和酵母菌及其检验酵母菌是真菌中的一大类,通常是单细胞,呈圆形,卵圆形、腊肠形或杆状。霉菌也是真菌,能够形成疏松的绒毛状的菌丝体的真菌称为霉菌。 霉菌和酵母广泛分布于自然界并可作为食品中正常菌相的一部分。长期以来,人们利用某些霉菌和酵母加工一些食品,如用霉菌加工干酪和肉,使其味道鲜美;还可利用霉菌和酵母酿酒、制酱;食品、化学、医药等工业都少不了霉菌和酵母。但在某些情况下,霉菌和酵母也可造成中腐败变质。由于它们生长缓慢和竞争能力不强,故常常在不适于细菌生长的食品中出现,这些食品是pH低、湿度低、含盐和含糖高的食品、低温贮藏的食品,含有抗菌素的食品等。由于霉菌和酵母能抵抗热、冷冻,以及抗菌素和辐照等贮藏及保藏技术,它们能转换某些不利于细菌的物质,而促进致病细菌的生长;有些霉菌能够合成有毒代谢产物-霉菌毒素。霉菌和酵母往往使食品表面失去色、香、味。例如,酵母在新鲜的和加工的食品中繁殖,可使食品发生难闻的异味,它还可以使液体发生混浊,产生气泡,形成薄膜,改变颜色及散发不正常的气味等。因此霉菌和酵母也作为评价食品卫生质量的指示菌,并以霉菌和酵母计数来制定食品被污染的程度。目前已有若干个国家制订了某些食品的霉菌和酵母限量标准。我国已制订了一些食品中霉菌和酵母的限量标准。 二、检验方法: 霉菌和酵母的计数方法,与菌落总数的测定方法基本相似。主要步骤为:将样品制作成10倍梯度的稀释液,选择3个合适的稀释度,吸取1mL于平皿,倾注培养基后,培养观察,计数。对霉菌的计数,还可以采用显微镜直接镜检计数的方法。 具体检测标准参见: GB4789.15-94,《中华人民共和国国家标准食品卫生微生物检验霉菌和酵母计数》三、说明: 1.样品的处理。为了准确测定霉菌和酵母数,真实反映被检食品的卫生质量,首先应注意样品的代表性。对大的固体食品样品,要用灭菌刀或镊子从不同部位采取试验材料,再混合磨碎。如样品不太大,最好把全部样品放到灭菌均质器杯内搅拌2min。液体或半固体样品可用迅速颠倒容器25次来混匀。 2.样品的稀释:为了减少榈稀释倍数的误差,在连续递增稀释时,每一稀释度应更换一根吸管。在稀释过程中,为了使霉菌的孢子充分散开,需用灭菌吸管反复吹吸50次。 3.培养基的选择:在霉菌和酵母计数中,主要使用以下几种选择性培养基。 马铃薯-葡萄糖-琼脂培养基(PDA):霉菌和酵母在PDA培养基上生长良好。用PDA作平板计数时,必项加入抗菌素以抑制细菌。 孟加拉红(虎红)培养基:该培养基中的孟加拉红和抗菌素具有抑制细菌的作用。孟加拉红还可抑制霉菌菌落的蔓延生长。在菌落背面由孟加拉红产生的红色有助于霉菌和酵母菌落的计数。 高盐察氏培养基:粮食和食品中常见的曲霉和青霉在该培养基上分离效果良好,它具有抑制细菌和减缓生长速度快的毛霉科菌种的作用。 4.倾注培养。每个样品应选择3个适宜的稀释度,每个稀释度倾注2个平皿。培养基熔化后冷却至45℃,立即倾注并旋转混匀,先向一个方向旋转,再转向相反方向,充分混合均匀。培养基凝固后,把平皿翻过来放温箱培养。大多数霉菌和酵母在25-30℃的情况下生长良好,因此培养温度25~28℃。培养3d后开始观察菌落生长情况,共培养5d观察记录结果。 5.菌落计数及报告:选取菌落数10~150之间的平板进行计数。一个稀释度使用两个平
霉菌和酵母菌介绍及检测方法 令狐文艳 一、霉菌和酵母菌介绍: 霉菌和酵母菌及其检验酵母菌是真菌中的一大类,通常是单细胞,呈圆形,卵圆形、腊肠形或杆状。霉菌也是真菌,能够形成疏松的绒毛状的菌丝体的真菌称为霉菌。 霉菌和酵母广泛分布于自然界并可作为食品中正常菌相的一部分。长期以来,人们利用某些霉菌和酵母加工一些食品,如用霉菌加工干酪和肉,使其味道鲜美;还可利用霉菌和酵母酿酒、制酱;食品、化学、医药等工业都少不了霉菌和酵母。但在某些情况下,霉菌和酵母也可造成中腐败变质。由于它们生长缓慢和竞争能力不强,故常常在不适于细菌生长的食品中出现,这些食品是pH低、湿度低、含盐和含糖高的食品、低温贮藏的食品,含有抗菌素的食品等。由于霉菌和酵母能抵抗热、冷冻,以及抗菌素和辐照等贮藏及保藏技术,它们能转换某些不利于细菌的物质,而促进致病细菌的生长;有些霉菌能够合成有毒代谢产物-霉菌毒素。霉菌和酵母往往使食品表面失去色、香、味。例如,酵母在新鲜的和加工的食品中繁殖,可使食品发生难闻的异味,它还可以使液体发生混浊,产生气泡,形成薄膜,改变颜色及散发不正常的气味等。因此霉菌和酵母也作为评价食品卫生质量的指示菌,并以霉菌和酵母计数来制定食品被污染的程度。目前已有若干个国家制订了
某些食品的霉菌和酵母限量标准。我国已制订了一些食品中霉菌和酵母的限量标准。 二、检验方法: 霉菌和酵母的计数方法,与菌落总数的测定方法基本相似。主要步骤为:将样品制作成10倍梯度的稀释液,选择3个合适的稀释度,吸取1mL于平皿,倾注培养基后,培养观察,计数。对霉菌的计数,还可以采用显微镜直接镜检计数的方法。 具体检测标准参见: GB4789.15-94,《中华人民共和国国家标准食品卫生微生物检验霉菌和酵母计数》 三、说明: 1.样品的处理。为了准确测定霉菌和酵母数,真实反映被检食品的卫生质量,首先应注意样品的代表性。对大的固体食品样品,要用灭菌刀或镊子从不同部位采取试验材料,再混合磨碎。如样品不太大,最好把全部样品放到灭菌均质器杯内搅拌2min。液体或半固体样品可用迅速颠倒容器25次来混匀。 2.样品的稀释:为了减少榈稀释倍数的误差,在连续递增稀释时,每一稀释度应更换一根吸管。在稀释过程中,为了使霉菌的孢子充分散开,需用灭菌吸管反复吹吸50次。 3.培养基的选择:在霉菌和酵母计数中,主要使用以下几种选择性培养基。
食品中霉菌检测方法探究 作者:施震地 来源:《沿海企业与科技》2012年第12期 [摘要] 目的:研究食品中霉菌的检测方法。方法:釆用不同的培养基、不同的接种方法对食品中的霉菌进行检测。结果:孟加拉红培养基和倾注法更适合进行食品中霉菌的计数。 [关键词] 霉菌;孟加拉红培养基;马铃薯葡萄糖培养基;倾注法;涂布法 [作者简介] 施震地,启东市产品质量监督检验所工程师,江苏启东,226200 [中图分类号] D155.5 [文献标识码] A [文章编号] 1007-7723(2012)12-0006-0003 霉菌广泛分布于自然界中,同时由于其可形成各种微小的孢子,因而很容易污染食品。霉菌污染食品后不仅可造成腐败变质,而且有些霉菌还可产生毒素,人畜因误食霉菌毒素而中毒。霉菌毒素是霉菌产生的一种有毒的次生代谢产物,自从20世纪60年代发现强致癌的黄曲霉毒素以来,霉菌与霉菌毒素对食品的污染日益引起重视。我国在2011年颁布了国家标准GB2761-2011《食品中真菌毒素限量》,各级食品监督检测机构全面开展霉菌的检测工作。本文主要对日常食品中霉菌的检验方法及检验过程中遇到的几个问题进行探讨。 一、检验方法的选择 国内现行有效的食品中霉菌的检测方法有两种:一种是GB4789.15-2010食品微生物学检验霉菌和酵母计数[1];另外一种是食品中霉菌和酵母计数 PetrifilmTM测试片法[2]。这两种方法主要区别如下: 1. 样品稀释液的不同。测试片要求1%的蛋白胨水或者磷酸盐缓冲液,而国标方法使用灭菌的蒸馏水即可。 2. 相对于国标法,测试片法操作起来简洁方便,不用对大量的培养皿进行灭菌,不用制备培养基,样品稀释后直接接种,省时快速。 3. 测试片法所用的测试片价格比较昂贵。 综上所述,一般情况下我们还是选择国标法。 二、培养基的选择
细菌数量的测定方法 1、计数器测定法: 即用血细胞计数器进行计数。取一定体积的样品细胞悬液置于血细胞计数器的计数室内,用显微镜观察计数。由于计数室的容积是一定的(O.1mm3),因而根据计数器刻度内的细菌数,可计算样品中的含菌数。本法简便易行,可立即得出结果。 本法不仅适于细菌计数,也适用于酵母菌及霉菌孢子计数。 2、电子计数器计数法: 电子计数器的工作原理是测定小孔中液体的电阻变化,小孔仅能通过一个细胞,当一个细胞通过这个小孔时,电阻明显增加,形成一个脉冲,自动记录在电子记录装置上。 该法测定结果较准确,但它只识别颗粒大小,而不能区分是否为细菌。因此,要求菌悬液中不含任何碎片。 3、活细胞计数法 常用的有平板菌落计数法,是根据每个活的细菌能长出一个菌落的原理设计的。取一定容量的菌悬液,作一系列的倍比稀释,然后将定量的稀释液进行平板培养,根据培养出的菌落数,可算出培养物中的活菌数。此法灵敏度高,是一种检测污染活菌数的方法,也是目前国际上许多国家所采用的方法。使用该法应注意:①一般选取菌落数在30~300之间的平板进行计数,过多或过少均不准确;②为了防止菌落蔓延,影响计数,可在培养基中加入O.001%2,3,5一氯化三苯基四氮唑(TTC);③本法限用于形成菌落的微生物。 广泛应用于水、牛奶、食物、药品等各种材料的细菌检验,是最常用的活菌计数法。 4、比浊法 比浊法是根据菌悬液的透光量间接地测定细菌的数量。细菌悬浮液的浓度在一定范围内与透光度成反比,与光密度成正比,所以,可用光电比色计测定菌液,用光密度(OD值)表示样品菌液浓度。 此法简便快捷,但只能检测含有大量细菌的悬浮液,得出相对的细菌数目,对颜色太深的样品,不能用此法测定。 5、测定细胞重量法 此法分为湿重法和干重法。湿重法系单位体积培养物经离心后将湿菌体进行称重;干重
目录 一、微生物检验标准 二、总则 三、微生物检验操作指导 1.菌落总数测定 2.大肠菌群测定 3.嗜冷菌/低温菌测定 4.芽孢及耐热芽孢总数测定 5.霉菌和酵母菌计数 6.商业无菌 7.消毒洁净度及膜类微生物检测 8.空气微生物检测 9.大肠杆菌的测定 修订:徐冬梅、张彩霞审核:孙秀芝 审批:李印所日期: 2006年2月17日
一、微生物检验标准S 注:所引用标准未注明年号的执行最新有效版本
二、总则S 执行GB/T 4789.1《食品卫生微生物学检验总则》、GB/T4789.28《食品卫生微生物学检验染色法、培养基和试剂》。 (一)样品的采集 1. 样品的采集必须遵循无菌操作程序。抽样工具如整套不锈钢勺子、镊子、剪刀等应当灭菌;容器须灭菌,且清洁、干燥、防漏、广口、大小适合盛放检样。 2. 抽样全过程中,应采取必要的措施防止食品中固有微生物的数量和生长能力发生变化。 3. 确定检验批,应注意产品的均质性和来源,确保检样的代表性。 4.成品检样,对包装完整的样品进行采集;已开包的坏包样品须及时转移至无菌容器中,再进行微生物检测。 5.常见的抽样方法有 5.1直接食用的小包装食品 尽可能取原包装,直到检验前不要开封,以防污染。 5.2桶装或大容器包装的液体食品 5.2.1抽样前摇动或用灭菌棒搅拌液体,尽量使其达到均质;抽样时应先将抽样用具浸入液体内略加漂洗,然后再取所需量的样品;装入灭菌盛样容器的量,不应超过其容量的四分之三,以便于检验前将样品摇匀。 5.2.2如为非冷藏易腐食品,应迅速将所抽样品冷却至0-4℃。 5.3桶装或大容器包装的固体食品 5.3.1每份样品应用灭菌抽样器由几个不同部位采取,一起放入一个灭菌容器内。 5.3.2注意不要使样品过度潮湿,以防食品中固有的细菌增殖。 5.4生产过程中的抽样 5.5.1划分检验批次,应注意同批产品质量的均一性。 5.5.2如用固定在贮液桶或流水作业线上的抽样龙头抽样时,应事先将龙头消毒。 (二)样品的标记、保存和运送 抽样过程中应对所抽样品进行及时、准确的标记;抽样结束后,应由抽样人写出完整的抽样记录,使样品尽可能保持在原有条件下迅速发送到实验室。
收稿日期:2007208227 作者简介:翁建中(1953-),男,江苏苏州人,高级工程师. [29]段洪涛,张柏,宋开山等.查干湖叶绿素a 浓度高光谱定量模型研究[J ].环境科学,2006,27(3):5031~5071 [30]段洪涛,张柏等.长春市南湖富营养化高光谱遥感监 测模型[J ].湖泊科学,2005,17(3):282~2881 [31]李云梅,黄家柱等.湖泊富营养化状态的地面高光谱 遥感评价[J ].环境科学,2006,(2):1770~17751 环境空气中细菌总数和霉菌总数监测方法的研究 翁建中,徐恒省,王亚超,赵凌宇 (苏州市环境监测中心站, 江苏苏州215004) 摘 要:分别对环境空气中细菌和霉菌监测的不同采样仪器、采样方式、培养条件的结果进行对比分析,并进行差异显著性检验。结果表明,FA -1型和FA -2型采样器的采样结果无显著性差异;细菌和霉菌监测的采样时间以5min 为最佳;细菌的培养以48h 、37℃±1℃为优,霉菌的培养为96h 、28℃±1℃为宜;对实验结果进行精密度检验,均达到了质量控制的要求。 关键词:监测方法;空气;微生物;细菌总数;霉菌总数 中图分类号:X 83012 文献标识码:A 文章编号:100226002(2008)0420028203 Study on Monitoring Method for Detecting Total B acteria and Mildew in the Air WE NGJian 2zhong ,et al (Suzhou Environmental M onitoring Centre ,Suzhou 215004,China ) Abstract :The com parative results of the tests were analyzed and contrasted in sam plers ,sam pling and culture methods of bacteria and mildew in the air.The results of significance test results indicated that no differences in air microorganism capture function of FA -1and FA -2sam plers.The suitable sam pling time was 5minutes ,culture tem perature for Bacteria 37℃±1℃and for mildew 28℃±1℃,culture time for bacteria 48hours and for mildew 96hours.The accuracy examinations of the tests meet the quality control requirements.K ey w ords :M onitoring method ;Air ;M icroorganism ;T otal bacteria ;T otal mildew 空气中的微生物数目、菌谱是评价环境空气质量及其危害人体健康程度的重要指标,因此对 空气中的微生物进行监测就显得尤为重要[1-3] 。目前,在采样方法、使用仪器、采样时间及体积、培养时间和温度等方面的室外空气微生物监测标准 方法尚不统一[4-9] ,对空气微生物监测方法开展研究很有必要。2005年3月至2006年3月对空气中细菌和霉菌的监测方法和实验室质量保证方面进行了分析,为建立可靠和实用的空气细菌和霉菌监测方法进行了尝试。 1 实验部分 111 仪器与试剂 FA -1型和FA -2型安德森(Andersen )固体 撞击式采样器;营养琼脂培养基;马丁霉菌培养基。 112 样品采集 悬浮在空气中的菌体撞击到各级营养平板上,分别用两种采样器在监测点采集空气微生物。采样器在采集前用酒精灯火焰灭菌,在采样5min 或10min 后及时关闭采样器(精确到秒)。样品采 集后应及时、安全送至实验室[4,9] 。113 微生物培养 空气微生物采样后分别在28℃和37℃恒温条件下培养。细菌在37℃±1℃连续培养4d ,每24h 记录1次结果。霉菌在28℃±1℃连续培养5d ,每24h 检测和记录1次结果。用菌落计数器或放大镜立即进行平皿菌落的计数[10] 。114 方法 运用SPSS1115处理软件对经不同采样仪器、采样方法、微生物的培养条件获得的结果进行t 检验,比较不同处理方式的微生物结果的差异性。 第24卷 第4期2008年8月 中 国 环 境 监 测 Environmental M onitoring in China V ol.24 N o.4 Aug.2008
霉菌毒素检测方法综述 由于产生毒素的霉菌无处不在,以及我们对大多数有利于霉菌生长和霉菌毒素产生的条件控制不力,造成食品和饲料的霉菌毒素污染问题越来越成为现代农业生产中不可忽视的重大难题。在各种农产品上生长着的各种各样的霉菌,这些霉菌都能产生霉菌毒素,霉菌毒素是有毒的化合物,有些甚至是致癌的。霉菌毒素有很多种(CAST,2003),包括黄曲霉毒素,主要是黄曲霉毒素B1和M1(Aflatoxins,FB1、FM1);赭(棕)曲霉毒素A(OchratoxinA,OA);杂色(柄)曲霉毒素(Terigmatocystin);展青霉素(Patulin,PTL);玉米赤霉烯酮(Zearalenone,ZEN(F-2));串珠镰刀菌素(Moniliformin,MF),三硝基丙酸以及属于单端孢霉烯族化合物(Trichothecenes)的T -2毒素(T-2toxin,T-2);脱氧雪腐镰刀菌烯醇(呕吐毒素)(Deoxynivalenol,DON);二乙酰镳草镰刀菌烯醇(Diacetoxyscirpenol,DAS)等。 联合国粮农组织在近期的报道中指出,全世界至少99个国家,占世界人口的87%,针对粮食和饲料的霉菌毒素污染问题都有相关的规定。在未来的几年里,与不断变化的全球气候有关的气象突发事件的增多将进一步向我们提出挑战。霉菌毒素污染给食品企业、粮油加工企业、畜禽养殖场以及饲料的加工企业造成了巨大的经济损失。 目前霉菌毒素检测常用的方法如下几种: 一、薄层层析法: TLC法是针对不同的样品,用适宜的提取溶剂将霉菌毒素从样品中提取出来,经柱层析净化,再在薄层板上层析展开、分离,利用霉菌毒素的荧光性,根据荧光斑点的强弱与标准比较测定其最低含量。TLC法样品前处理繁琐,且提取和净化效果不够理想,提取液中杂质较多,在展开时影响斑点的荧光强度。 二、色谱法: 色谱法,包括薄层色谱、气相色谱、液相色谱等,一直是最重要的霉菌毒素的化学分析方法。现在比较普遍的霉菌毒素的分析方法还是液相色谱法,包括液相色谱-质谱联用技术。该法快速而准确,但需要昂贵的仪器设备,仅限于专业检测机构获得科研和调查分析、监测使用,未能在企业及基层广泛推广使用,而且其结果的滞后效应大大降低了对生产实际的指导效果。 三、免疫化学检测法:(胶体金免疫层析法,酶联免疫吸附法) 免疫学检测方法是基于抗体与抗原或半抗原之间的选择性反应而建立起来的一种生物化学分析法。通常具有高的选择性和很低的检出限,广泛用于各种抗原、半抗或抗体的测定,一般可分为荧光免疫法、发光免疫法、免疫法及电化学免疫法等非放射免疫法和放射免疫法,其中在饲料霉菌毒素检测中应用较广的主要是酶联免疫吸附法(ELISA)和胶体金免疫层析法。 免疫学检测方法由于其快速、灵敏、准确、可定量、操作简便、无需贵重仪器设备,且对样品纯度要求不高等特性,特别适用于饲料厂、粮油/食品加工厂、养殖场等企业进行原料或成品的检测以及工商质监部门现场检测。 该类方法有以下特点: 1) 灵敏度高 2) 干扰小:抗体抗原的免疫反应特异性很强,结构类似物、荧光物质、有色物质对检测的干扰很小。 3) 操作简便快捷:由于特异性强,简化了样品的预处理和提取纯化过程,同时操作步骤也非常简便,测定时间也短。 4) 安全性高,污染少,成本低廉:不需要昂贵的测定仪器,所用试剂也相对较少,特别是因为灵敏
霉菌总数检测操作规程 1 原理 根据霉菌生理特性,选择适宜霉菌生长而不适宜细菌生长的培养基,采用平板计数法测定霉菌总数。 2 试剂与仪器 2.1 所用器具 三角烧瓶、玻璃珠、具塞试管、培养皿、1000μL枪头、5mL枪头、称量勺、接种环、接种针、移液器 2.2 仪器:分析天平、恒温培养箱、微型振荡器、超净工作台、高压灭菌锅 2.3 所用试剂和培养基 高盐察氏培养基 取高盐察氏培养基109g,加入蒸馏水1L,搅拌加热至完全溶解,分装三角瓶,115℃高压灭菌30 min,备用。 3、操作步骤 3.1配制0.85%生理盐水 称取氯化钠8.5g溶于1000mL蒸馏水中。 3.2 锥形瓶加入生理盐水90mL,试管中加入生理盐水9mL,121℃灭菌30min。(三角烧瓶个数与样品数量一致,试管数量与稀释次数相关)。 3.3 将1000μL枪头、培养皿、5mL枪头、称量勺、带6颗玻璃珠具塞试管,121℃灭菌30min。(注意计算数量) 3.4 枪头、培养皿置于烘箱103℃烘干。(1-3步需提前一天完成) 3.5 对称量房间进行紫外灭菌30分钟,关灯静置60 min。以无菌操作取样品10g于含90mL 生理盐水三角烧瓶中,于振荡器上振荡30min,制成1:10的均匀稀释液。 3.6 吸取1:10稀释液10mL注入带玻璃珠的试管,置微型混合器上混合3min。 3.7 用1000μL枪头吸取1:10稀释液1mL,沿管壁慢慢注入含有灭菌生理盐水9mL的试管中,于振荡器上混合均匀,制成1:100的均匀稀释液。 3.8 另取一只1mL灭菌吸管,按照上述操作方法,作10倍递增稀释,如此每递增稀释一
韩国检测霉菌的方法是Howard霉菌计数法(Howard Mold Counting Assay)。其方法如下: 1.所需设备 1)高速混合器 可调速的高速混合器,4-8个尖锐的不锈钢刃在200ml容量的不锈钢杯容器的底部附近旋转,使用旋转速度最少0~10,000rpm之间,并用带有旋转速度仪的高速混合器。 2)Howard霉菌计数玻片(Howard Mold Counting Slide) 依外壕被围绕的20×15mm大小的四角的玻璃片。试料点滴平面的两个侧面盖玻片支架比试料点滴平面高出0.1mm的整齐突起。盖玻片放在支架上面时,使用试料点滴平面与盖玻片之间的深度达到0.1mm的玻片。 3)显微镜 使用配有4个黑白接物镜并以10-400倍的倍率可以观察的显微镜。 2.试剂 1)1%氢氧化钠溶液(NaOH) 2)氧化硅胶液小包制或者2-辛醇(2-octanol) 3)稳定液(5%果胶溶液):高速搅拌器里注入475ml、85℃水搅拌的同时将25g的果胶(pectin)少量的添加并溶解。 3.试验操作 1)试验溶液的调配
称5g检样放入高速混合器。100ml的1%氢氧化钠溶液分2 次添加,第一次添加约30ml在10,000rpm的速度下搅拌5秒,然后用余下的70ml清洗混合器内壁上的附着物。把混合器内的混合物以10,000rpm的速度搅拌3分钟后,滴入氧化硅胶液3~4滴除去泡沫,以上的混合物100g与25g的稳定液混合作为显微镜镜检试料。 2)试验操作 (1)显微镜镜检试料的操作 Howard霉菌计数玻片的试料平面上利用滴管点滴试料。在点滴的试料上,大的检样片或籽等用微型镊子取出后,尽量不产生斑点或线条的小心放上盖玻片,然后在显微镜载物台上插入霉菌计数玻片。 (2)霉菌菌丝的诊断 在显微镜的100~450倍观察时,霉菌菌丝有下列外观特性。 ★细胞壁的平行 ★分节 ★形成粒子 ★分枝 ★菌丝的末梢 ★非折射性的外观 (3)阳性划区判定 对一个可视划区判定阳性或者阴性。哪一个划区也不能一次以上的判定阳性。为判定一个划区为阳性,三根以下的霉菌菌丝的总长度(合计长度)需要超过可视划区直径的1/6.大部分的阳性划区判
霉菌与酵母菌计数方法 1试验菌液的制备和使用(以白色念珠菌为示例) 白色念珠菌(0)代 ↓ 传代培养 ↓ 实验菌液的制备:沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养 基,培养温度20~25℃,培养时间2~3天 ↓ 计数培养基适用性检查:胰酪大豆胨琼脂培养基,培养温度30~35℃, 培养时间不超过5天,接种量不大于100cfu ↓ 计数方法适用性试验:胰酪大豆胨琼脂培养基(MPN法不适用),培养温 度30~35℃,培养时间不超过5天,接种量不大于100cfu 注:当需用玫瑰红钠琼脂培养基测定霉菌和酵母菌总数时,应进行培养基适用性检查,检查方法同沙氏葡萄糖琼脂培养基 1.1菌种 试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。 1.2菌液制备(按表1规定程序培养各试验菌株) 取白色念珠菌的新鲜培养物 ↓ 用pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液取黑 曲霉的新鲜培养物 ↓ 加入3~5ml含0.05%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化 钠溶液,将孢子洗脱 ↓ 采用适宜的方法吸出孢子悬液至无菌试管内 ↓ 用含0.05%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯 化钠溶液制成适宜浓度的黑曲霉孢子悬液
菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用。稳定的黑曲霉孢子悬液可保存在2~8℃,在验证过的贮存期内使用。 1.3阴性对照 为确认试验条件是否符合要求,应进行阴性对照试验,阴性对照试验应无菌生长。如阴 性对照有菌生长,应进行偏差调查。 2.培养基适用性检查 按表1规定,接种不大于100cfu的菌液至沙氏葡萄糖琼脂培养基平板 ↓ 置表1规定条件下培养 ↓ 每一试验菌株平行制备2管或2个平皿 ↓ 同时,用相应的对照培养基替代被检培养基进行上述试验 ↓ 被检固体培养基上的菌落平均数与对照培养基上的菌落平均数的比值应在0.5-2范围内,且菌落形态大小应与对照培养基上的菌落一致;被检液体培养基管与对照培养基管比较,试 验菌应生长良好 3计数方法适用性试验 供试液制备:水不溶性非油脂类供试品 ↓ 取供试品,用pH7.0无菌氯化钠-蛋白胨缓冲液,或pH7.2磷酸盐缓冲液,或胰酪大豆胨 液体培养基 ↓ 制备成1:10供试液。 ↓ 若需要,调节供试液pH值至6~8。必要时,用同一稀释液将供试液进一步10倍系列稀 释。
细菌总数的测定法 一、细菌数测定的基本概念 药品细菌数测定是微生物的定量检查,是用来判断药品被细菌污染程度和卫生质量评价的重要指标,也是检测药品质量的重要指标之一。细菌计数是指在一定条件下(如需氧情况、营养条件、pH 位、培养温度和时间等)每1g、lml、l0cm2供试品液经培养后所生长的菌落数。所谓一定条件是按我国药典规定,在需氧条件下,30~35℃,一般培养48h,在营养琼脂培养基平板上生长的细菌菌落数。细菌数的测定方法有多种:平板法、薄膜过滤法、涂抹法。 药品细菌数测定是活菌计数,最常用的平板法是以平板菌落计数为依据,即每个菌落代表个菌细胞,但有的菌落也可能是多个菌细胞形成,如双球菌、四联球菌、八叠球菌、葡萄球菌等,很可能是多个菌细胞在一起。故准确地说,细菌数测定值实际上是菌落形成单位数( CFU)。 平板法菌落计数法,是受一定条件的限制:如供试液是否均质,供试液中的细菌是否充分分散;培养基的质量、培养温度及培养时间的影响;有繁殖能力的菌细胞才能形成菌落,死菌及某此受损伤的细菌或营养要求苛刻的细菌在规定的培养基上不能生长,因而不被计数。在试验操作中应考虑到这此问题。 二、设施、设备、仪器及器皿 1、设施 细菌数测定全过程应严格遵守无菌操作,在环境洁净净度l0000级和局部洁净度100 级单向流空气区域内进行,以防止再污染。 2、设备、仪器 恒温培养箱(30~35℃)、微波炉、匀浆仪(4000~10000r / min )、康氏振荡器、恒温水浴、电热干燥箱(250~300℃)、电冰箱、空调、高压蒸汽灭菌器(使用时要进行灭菌效果验证并应定期请有关部门检定) 菌落计数器、显微镜(1500X)、电子天平(感量0.1g)、pH 值系列比色计、全封闭可拆卸或开放式的薄膜过滤器。 3、器皿 锥形瓶(250~300ml )、培养皿(∮9cm)、量筒(100ml)、试管(18×18mm)、刻度吸管(l ml , 10ml)、载玻片、玻璃或搪瓷、不锈钢消毒缸(带盖)。 玻璃器皿用前应洗涤干净,无残留抗菌物质。吸管上端距0 .5 cm 处塞入约2 cm 左右的适当疏松棉花,装入吸管筒内或牛皮纸口袋中。锥形瓶、量筒、试管塞(硅氟塑料塞),再用牛皮纸包扎。使用的器皿应采用经验证合格的方法进行灭菌。 4、用具 大、小橡皮乳头(置干净带盖的容器中并应定期用5%来苏尔溶液浸泡),无菌衣、帽、口罩、手套(洗净后用布袋或牛皮纸包严)灭菌,备用。也可使用一次性无菌衣、帽、口罩。接种环(白依金或镍铬合金)、乙醇(酒精)灯、乙醇棉球或碘伏锦球、灭菌剪刀、镊子或灭菌的手术刀、不锈钢药匙、试管架、火柴、记号笔等。 二、培养基、稀释剂 除另有规定外一般使用营养肉汤琼脂培养基, 可按处方配制亦可采用干燥脱水培养基。 主要稀释剂有0. 9%无菌氯化钠一蛋白胨缓冲液(供试品稀释用),0.9%无菌氯化钠溶液(对照菌稀释用)。 三、检验方法 1、试验前的准备 1)、将试验用灭菌的器皿、稀释剂及供试品外包装去掉,内包装消毒后移至无菌室内。每
霉菌试验 ?一、概述 ?二、霉菌的试验方法 ?三、防霉措施 ?四、有关标准 概述 ?霉菌的危害 ?霉菌试验的定义 ?霉菌试验的目的 霉菌对材料和产品的影响 ?直接危害是霉菌生长食取材料中的有机成分,直接导致结构破坏、强度降低、物理性质变化等。间接危害是霉菌分泌的新陈代谢排泄物有机酸和其他离子化合物,造成电解或老化效应,某些触媒剂,还促成氧化或分解作用的发生,间接导致材料及部件的损坏。长霉造成的故障模式: ---引起电子或电气设备失灵 ---减低绝缘材料的电性能 ---造成燃油系统的腐蚀和堵塞 ---破坏密封 ---使金属件腐蚀 ---使玻璃产生蚀刻 低压与霉菌 这两个因素的组合不会增大二者本身的影响太阳辐射与霉菌因为太阳辐射产生热,所以这个组合不可能产生影响,和高温与霉菌的组合相同。此外未经过滤的太阳辐射中的紫外线具有显著的杀菌作用盐雾与霉菌这是一个相容的组合湿度与霉菌湿度有助于霉菌和微生物的生长,但不会增大它们的影响高温与霉菌霉菌和微生物的生长,需要比较高的温度,但是,在71℃(160 ℉)以上,霉菌和微生物就不能生长了 低温与霉菌 低温影响霉菌的生长。在零度以下,霉菌保持在假死状态 霉菌试验的定义 ?霉菌试验是气候环境试验的一个项目。用于考核产品或材料抵抗霉菌侵袭的能力。它于一般环境试验一样,考虑产品在实际运输、储存或使用中,最易遭受霉菌危害的环境条件,在试验室中用人工模拟创造霉菌生长最适宜环境进行试验。 霉菌试验的目的 ?为确定产品抗霉菌侵蚀能力,必须制定一个与实际工作条件相似,能判断霉菌的侵蚀作用和给出正确评价的试验方法。它将为产品的选材、结构和设计提供依据以保证产品能在有大量霉菌存在的气候环境中安全可靠地运行
霉菌试验就是检测产品抗霉菌的能力和在有利于霉菌生长的条件下(即高湿温暖的环境中和有无机盐存在的条件下),设备是否受到霉菌的有害影响。用途:霉菌试验主要针对军用装备及民用电子产品、线材、橡胶等材料,按标准规定进行各类霉菌的培养,在规定的时间(通常28天)后,对产品外观性能进行评价,以确定产品防霉的等级。 霉菌试验的标准有: GJB 150.10A-2009军用设备环境试验方法霉菌试验 HB 6167.11-1989民用飞机机载设备环境条件和试验方法霉菌试验. GJB4.10舰船电子设备环境试验霉菌试验 GB T 2423.16-1999电工电子产品环境试验第2部分试验方法试验J和导则长霉 GB/T10588-2002 GB 10588-89 除了霉菌测试,GRGT开展的其他可靠性测试项目有: 1.气候环境可靠性:高温试验、低温试验、恒温恒湿、高温高湿、低温低湿、快速温度变化、冷热冲击、高压蒸煮(HAST)、盐雾腐蚀(中性盐雾试验、铜加速盐雾试验、醋酸盐雾试验交变盐雾试验)、人工汗液试验、气体腐蚀测试(SO2/H2S/HO2/CL2)、耐焊接热,沾锡性,防尘测试(IP1X-6X),防水测试(IPX1-X8)、产品阻燃测试,UV老化(荧光紫外灯)、太阳辐射(氙灯老化、卤素灯)等项目; 2.机械环境可靠性:振动(随机振动,正弦振动)、机械冲击(半正弦波、方波和锯齿波)、
碰撞试验、跌落测试、斜面冲击试验,温湿度+振动三综合、高加速寿命测试(HALT)、高加速应力筛选(HASS、HASA)、插拔力,插拔寿命测试,按键寿命测试、摇摆试验、耐磨测试、附着力测试、百格测试等; 3.电气性能包含:接触电阻,绝缘电阻,耐电压,电流测试,电缆阻抗测试等等
霉菌和酵母菌检测 1范围 本规范规定了化妆品中霉菌和酵母菌数的检测方法。 本规范适用于各种化妆品中霉菌和酵母菌的总数测定。 2定义 本规范采用下列定义。 霉菌和酵母菌总数是指化妆品检样在一定条件下培养后,1g或1mL化妆品中所污染的活的霉菌和酵母菌菌落总数,藉以判明化妆品被霉菌和酵母菌污染程度及其一般卫生状况。 本方法根据霉菌和酵母菌特有的形态和培养特性,在虎红培养基上,置28℃培养72h,计算所生长的霉菌和酵母菌数。 3仪器和设备 3.1恒温霉菌培养箱:28℃。 3.2振荡器。 3.3天平。 3.4三角瓶。 3.5试管。 3.6试管架。 3.7平皿: 直径90mm。 3.8刻度吸管:1mL、2mL、10mL。 3.9量筒。
3.10酒精灯。 3.11高压灭菌器。 4培养基和试剂 4.1生理盐水 4.2虎xx(xxxx)培养基 成分: 蛋白胨5g 葡萄糖10g 磷酸二氢钾1g 硫酸镁(含7H 2O) 0.5g xx20g 虎红溶液100mL (四氯四碘荧光素) 蒸馏水1000mL 氯霉素100mg 制法: 将上述前5种成分加入蒸馏水中溶解后,再加入虎红溶液。分装后,103.43kPa(15
lb)20min高压灭菌。另用少量乙醇溶解氯霉素,过滤除菌后,加入培养基中,若无氯霉素,可用链霉素代替,每1000mL培养基加链霉素30mg。 5操作步骤 5.1样品稀释: 用灭菌吸管吸取1:10稀释的检液2mL,分别注入到两个灭菌平皿内,每皿1mL。 另取1mL注入到9mL灭菌生理盐水试管中(注意勿使吸管接触液面),更换一支吸管,并充分混匀,制成1:100检液。吸取2mL,分别注入到两个灭菌平皿内,每皿1mL。如样品含菌量高,还可再稀释成1:1000,1:100,……等,每种稀释度应换1支吸管。。 5.2取1:10的检液2mL分别注入2个灭菌平皿内,每皿1mL(若菌量较多时可顺序再做10倍稀释),另取1个灭菌空平皿(作空白对照),每皿分别注入融化并冷至45℃左右的虎红培养基约15mL,充分摇匀。凝固后,翻转平板,置28℃培养箱,培养72h,计数平板内生长的霉菌和酵母菌数。若有霉菌蔓延生长,为避免影响其它霉菌和酵母菌的计数时,于48h应及时将此平板取出计数。 5.3计算方法: 先点数每个平板上生长的霉菌和酵母菌菌落数,求出每个稀释度的平均菌落数。判定结果时,应选取菌落数在5~50个范围之内的平皿计数,乘以稀释倍数后,即为每g(或每mL)检样中所含的霉菌和酵母菌数。其它范围内的菌落数报告应参照菌落总数的报告方法报告之。 5.4每g(或每mL)化妆品含霉菌和酵母菌数以CFU/g(mL)表示。