
试验九配合物与沉淀——溶解平衡
一.实验目的:
1.加深理解配合物的组成和稳定性。了解配合物形成时特征
2.加深理解沉淀—溶解平衡和溶度积的概念。掌握溶度积规则及其应用
3.初步学习利用沉淀反应和配位溶解的方法,分离常见混合阳离子
4.学习电动离心机的使用和固—液分离操作
二.实验原理:
配合物石油形成体(又称为中心离子或原子)与一定数目的配位体(负离子或中性分子)。以配位键结合而形成的一类复杂化合物,是路易斯(Lewis)酸和路易斯(Lewis)碱的加合物。配合物的内层与外层之间以离子键结合,在水溶液中完全解离。配位个体在水溶液中分步解离,其类似于弱电解质。
在一定条件下,中心离子。配位个体和配位个体之间达到配位平衡。例:
Cu2++ 4NH3——[Cu(NH3)4]2+
相应反应的标准平衡常数Kf Q。成为配合物的稳定常数。对于相同类型的配合物Kf Q数值愈大就愈稳定。
在水溶液中,配合物的生成反应。主要有配位体的取代反应和加合反应
例:[Fe(SCN)n]3++ ===[FeF6]3-+ nScn-
HgI2(s) + 2I-==[HgI4]2-
配合物形成时,往往伴随溶液颜色、酸碱性(即PH)。难溶电解质溶解度,中心离子氧化还原的改变等特征。
2.沉淀—溶解平衡
在含有难溶电解质晶体的饱和溶液中,难溶强电解质与溶液中相应离子间的多相离子平衡。称为:沉淀—溶解平衡。
用通式表示如下;
AnBn(s) == mA n+(ag)+ nB m-(ag)
其溶度积常数为:
Ksp Q(A m B n)==[c(A n+)/c Q]m[c(B m-)/c Q]n
沉淀的生成和溶解。可以根据溶度积规则判断:
J Q> Ksp Q有沉淀析出、平衡向右移动
J Q= Ksp Q 处于平衡状态、溶液为饱和溶液
J Q< Ksp Q无沉淀析出、或平衡向右移动,原来的沉淀溶解
溶液PH的改变,配合物的形成发生氧化还原反应。往往会引起难溶电解质溶解度的改变。
对于相同类型的难溶电解质。可以根据其Ksp Q的相对大小判断沉淀的先后顺序,对于不同类型的难溶电解质,则要根据计算所需测定试剂浓度的大小来判断测定的先后顺序。
两种测定间相互转换的难易程度,要根据沉淀转化反应的标准平衡常数确定。利用测定反应和配位溶解。可以分离溶液中心某些离子。
四.思考题
1.比较[FeCl4]-,[Fe(NCS)3-和[FeF6]3-稳定性。
2.比较[Ag(NH3)2]+,[Ag(S2O3)2]3-和[AgI]-的稳定性3.试计算0.1mo l·L-1Na2H2Y溶液的pH
4.如何正确地使用电动离心机?
7 沉淀-溶解平衡习题解答(p180-182) 1. 解答:(1)解:AgI (2)解:Mg(OH)2 2. 解答:(1) CaF 2 ? Ca 2+ + 2F - s+0.0010 2s K sp =(s+0.0010)(2s)2≈4?0.0010s 2 (2) Ag 2CrO 4 ? 2Ag + + CrO 42- 2s+0.010 s K θsp =(2s+0.010)2?s ≈0.0102?s 3. 解答: M 2X = 2M + + X 2- X 2-有酸效应: 4. 解答:(1) CaF 2 ? Ca 2+ + 2F - (2) BaSO 4 ? Ba 2+ + SO 42- (3) CuS ? Cu 2+ + S 2- ) L mol (104.1)L mol ()5.077.234104.1(11612 62 ----??=???==s K sp ) L m ol (102.1)L m ol ()32.581105.8(44)2(11113 33 2 ----??=????==?=s s s K sp 1 5111 L mol 102.8L mol 0010.04107.20.00104----??=???= ?= θsp K s 1 82 12 2L mol 100.2010.0100.2010.0---??=?==θ sp K s 19 2 12 2X(H)100.1Ka Ka ][H Ka ][H 1?=++=++α) L (mol 100.14100.1100.44)2(1103 19 493 X(H) sp X(H) sp 'sp 2---??=???=?= ?==?ααθθ θK s K K s s ) L (mol 102.14)10(107.24 )2(1010 8.6101][1133 2 2.1113 2 ) (2 ) (22 .14 2 ) (-----+??=??= ?= ?=?=?+=+=H F sp H F sp a H F K s K s s K H αααθθ) L (mol 104.110101.11010 2.10 .21][1142.210)() (22 .22 ) (24 24 224----+??=??=?=?==?+=+=--- H SO sp H SO sp a H SO K s K s K H αααθθ ) L (mol 102.21010610][][1189.1936)() (29 .192 ) (222 122---++??=??=?=?==++=--- H S sp H S sp a a a H S K s K s K K H K H αααθθ
第四节难溶电解质的溶解平衡 第1课时沉淀溶解平衡与溶度积 [学习目标] 1.知道难溶电解质的沉淀溶解平衡及其影响因素,能多角度、动态地分析难溶电解质的溶解平衡。 2.知道溶度积的意义,建立根据溶度积和离子积的大小关系判断反应进行方向的思维模型。 一、难溶电解质的溶解平衡 1.AgCl沉淀溶解平衡的建立 (1)在装有少量难溶的AgCl白色固体的试管中,加入约5 mL蒸馏水,充分振荡后静置。 ①取约2 mL上层清液于另一试管中,滴加浓盐酸,观察到的现象是有白色沉淀生成。 ②由上述实验得出的结论是原上层清液中含有Ag+。 (2)分析AgCl的溶解过程:AgCl在溶液中存在下述两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面溶于水中,即存在溶解过程;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,即存在沉淀过程。在一定温度下,当AgCl溶解和生成的速率相等时,达到溶解平衡状态,得到AgCl的饱和溶液。 Cl-(aq)+Ag+(aq),由于沉淀、溶解之间的这(3)AgCl溶于水的平衡方程式是AgCl(s)溶解 沉淀 种动态平衡的存在,决定了Ag+和Cl-的反应不能进行到底。 2.溶解平衡的概念与特征 (1)概念 在一定温度下,当沉淀溶解和生成的速率相等时,即建立了动态平衡,叫做沉淀溶解平衡。 (2)特征
(3)反应完全的标志 对于常量的化学反应来说,化学上通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀就达完全。 3.影响因素 (1)实例分析 已知溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较): 条件改变移动方向c(Mg2+)c(OH-) 加水正向移动不变不变 升温正向移动增大增大 加MgCl2(s)逆向移动增大减小 加盐酸正向移动增大减小 加NaOH(s)逆向移动减小增大 (2)外界条件对沉淀溶解平衡的影响 ①温度:升高温度,多数溶解平衡向溶解方向移动;少数溶解平衡向生成沉淀方向移动,如Ca(OH)2的溶解平衡。 ②浓度:加水稀释,溶解平衡向溶解方向移动。 ③同离子:加入与难溶电解质构成中相同的离子,平衡向生成沉淀方向移动。 ④其他:加入可与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解方向移动。 (1)易溶电解质或难溶电解质的饱和溶液中存在溶解平衡,不饱和溶液中不存在溶解平衡。 (2)影响难溶电解质溶解平衡的因素,除内因外,主要涉及温度、浓度(包括稀释、加入同种离子)等。 例1下列关于溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)的说法正确的是() A.AgCl沉淀的生成和溶解同时在不断进行,且速率相等 B.等物质的量的AgNO3和NaCl溶于水后,溶液中不存在Ag+和Cl- C.只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成
第四单元难溶电解质的沉淀溶解平衡 第二课时沉淀溶解平衡原理的应用教学设计 (一)三维目标 知识与技能目标 1、使学生能够运用平衡移动的观点对沉淀的溶解、生成与转化过程进行分析。 2、知道沉淀转化的本质并能够对相关实验的现象以及生活中的一些相关问题进行解 释。 过程与方法目标 初步建立解决沉淀溶解平衡问题的一般思路,尝试运用微粒观、动态观、定量观分析沉淀溶解平衡的相关问题。 情感态度价值观目标 通过对生产、生活中与沉淀溶解平衡有关的某些现象的讨论,使学生体会到化学对于提高人类生活质量、促进社会发展的作用,激发学生学习化学的热情。 (二)教学重点 1.沉淀的转化的基本原理; 2.解决沉淀溶解平衡相关问题的基本思路; ( 三)教学难点 用微粒观、动态观、定量观分析水溶液中的平衡问题。 ( 四)教学过程 【教师】上一节课我们学习了难溶电解质的沉淀溶解平衡,我们要求大家要学会描述沉淀溶解平衡的建立,这里我们以AgCl悬浊液为例,请一位同学来描述一下在这个体系中,沉淀溶解平衡是如何建立的? 【学生】微观上说,在AgCl悬浊液体系,一方面,在水分子的作用下,少量的Ag+和Cl-脱离AgCl表面进入水中,这是沉淀溶解过程;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl表面析出,这是沉淀生成过程。在一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,达到平衡状态,形成AgCl饱和溶液,这种平衡就是沉淀溶解平衡。 【教师】我们可以用平衡表示式表示沉淀溶解平衡。
【教师】 【教师】为了便于分析,我们省略相关标注。 【教师】沉淀溶解平衡是一个动态平衡,也会因影响因素的变化而发生移动。影响沉淀溶解平衡的因素有温度、离子浓度、pH等。根据平衡移动原理,如果改变影响平衡的条件,平衡将向能够减弱这种改变的方向移动。例如,当AgCl悬浊液体系达到沉淀溶解平衡时,增大体系中Cl-的浓度,平衡就会向生成AgCl沉淀的方向移动;反之,如果减小体系中Cl-的浓度,那么平衡就会向AgCl沉淀溶解的方向移动。因此,根据平衡移动原理,选择适当的条件,使平衡向着需要的方向移动。这就是沉淀溶解平衡的应用。 【板书】第2课时沉淀溶解平衡原理的应用 [讲述] 那么现在我们就通过实验来初步体会沉淀溶解平衡的应用。 (学生完成第90页的“活动与探究”) [学生] 滴加AgNO3溶液后出现白色沉淀,滴加KI溶液后,变成黄色沉淀,滴加Na2S 溶液,变成黑色沉淀。 [引导思考]那么,如何解释这种现象呢?这里我们提供给同学们关于难溶物颜色的资料。刚才看到的不同颜色的沉淀应该分别是哪些呢?发生了什么样的变化。 [PPT演示] AgCl、AgI、Ag2S的颜色 [引导学生表述] 根据所给数据结合已学知识,白色沉淀应该是AgCl,黄色沉淀是AgI,黑色沉淀是Ag2S沉淀。刚才的现象说明了向AgCl溶液中滴加KI溶液,AgCl会转化为AgI;而继续滴加Na2S溶液,则沉淀转化为Ag2S黑色沉淀。 [讲述] 这就是沉淀溶解平衡的一个重要应用——沉淀的转化。 [板书] 一、沉淀的转化 [设疑] 为什么会发生上述沉淀的转化?沉淀转化有什么一般性的规律呢?我在上面给 大家上述沉淀的溶解度数据,大家可以参考这些数据,然后和小组的同学一起讨论。 [组织] 请同学以前后两桌4~6个人为一组进行讨论,然后请各组同学派代表来回答问题。开始讨论! [PPT演示] AgCl、AgI、Ag2S的溶解度(25℃) [学生讨论,老师参与讨论,并适当引导学生得出较为准确的结论] [学生汇报讨论结果,教师及时给予引导] 向NaCl溶液加AgNO3溶液,生成白色的AgCl 沉淀生成。由于AgCl是难溶电解质,在溶液中存在沉淀溶解平衡。(利用已写板书,不再进行书写) 。
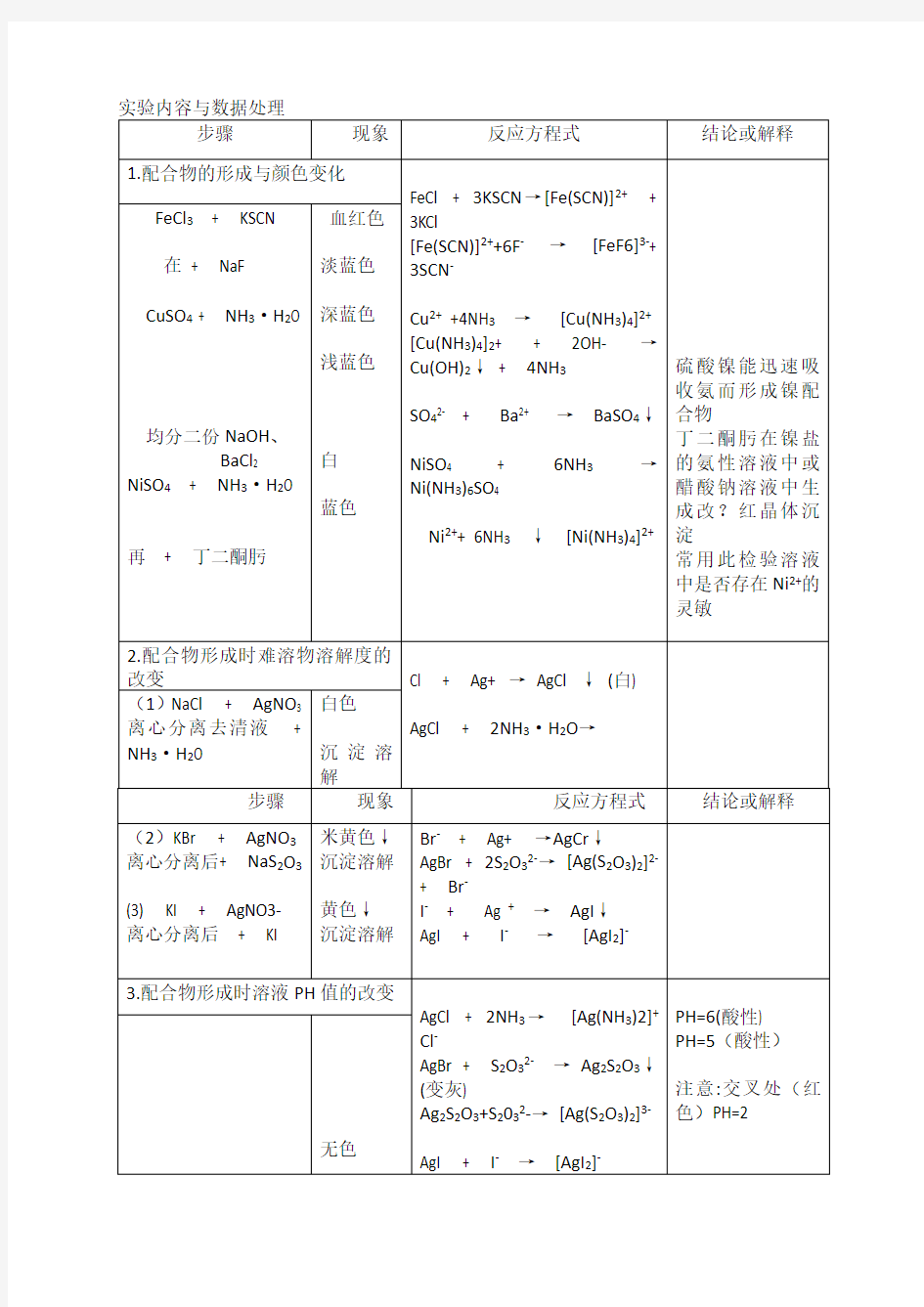
试验九配合物与沉淀一一溶解平衡 一.实验目的: 1. 加深理解配合物的组成和稳定性。了解配合物形成时特征 2. 加深理解沉淀一溶解平衡和溶度积的概念。掌握溶度积规则及其应用 3. 初步学习利用沉淀反应和配位溶解的方法,分离常见混合阳离子 4. 学习电动离心机的使用和固一液分离操作 二.实验原理: 配合物石油形成体(又称为中心离子或原子)与一定数目的配位体(负离子或中性分子)。以配位键结合而形成的一类复杂化合物,是路易斯(Lewis)酸和路易斯(Lewis) 碱的加合物。配合物的内层与外层之间以离子键结合,在水溶液中完全解离。配位个体在水溶液中分步解离,其类似于弱电解质。 在一定条件下,中心离子。配位个体和配位个体之间达到配位平衡。例: CiF + 4NH3 ——[Cu (NH3)4]2+\ 相应反应的标准平衡常数Kf Q0成为配合物的稳定常数。对于相同类型的配合物Kf°数值愈大就愈稳定。 在水溶液中,配合物的生成反应。主要有配位体的取代反应和加合反应\例:[Fe (SCN n]3+ + ===[FeF]3- + nScri Hgb(s) + 2I- ==[Hgk]2- 配合物形成时,往往伴随溶液颜色、酸碱性(即PH)。难溶电解质溶解度,中心离子氧 化还原的改变等特征。 2 .沉淀一溶解平衡 在含有难溶电解质晶体的饱和溶液中,难溶强电解质与溶液中相应离子间的多相离子平衡。称为:沉淀一溶解平衡。 用通式表示如下; \ AnBn (s) == mA n+(ag) + n B m-(ag) 其溶度积常数为: \K S H (A m B n) ==[c(A n+)/c Q]m[c(B m-)/c Q]n/ 沉淀的生成和溶解。可以根据溶度积规则判断: J Q > Ksp Q有沉淀析出、平衡向右移动 J = Ksp3处于平衡状态、溶液为饱和溶液 J Q < Ksp Q无沉淀析出、或平衡向右移动,原来的沉淀溶解 溶液PH的改变,配合物的形成发生氧化还原反应。往往会引起难溶电解质溶解度的改变。 对于相同类型的难溶电解质。可以根据其Ksp3的相对大小判断沉淀的先后顺序,对于不同类型的难溶电解质,则要根据计算所需测定试剂浓度的大小来判断测定的先后顺序。 两种测定间相互转换的难易程度,要根据沉淀转化反应的标准平衡常数确定。利用测定反应和配位溶解。可以分离溶液中心某些离子。
沉淀溶解平衡的应用、溶度积的相关计算及溶解图像 (解析版) 一、单选题(本大题共22小题,每题1分,共22分) 1.一定温度下,三种碳酸盐MCO 3 (M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M),p(CO2-3)=-lg c(CO2-3)。下列说法正确的是 ( ) A.MgCO 3、CaCO 3 、MnCO 3 的K sp依次增大 B.a点可表示MnCO 3 的饱和溶液,且c(Mn2+)=c(CO2-3) C.b点可表示CaCO 3 的饱和溶液,且c(Ca2+)
第1课时沉淀溶解平衡原理 学习目标 1.知道沉淀溶解平衡建立的过程。 2.了解溶度积和离子积的关系,知道溶度积的含义,并由此学会判断反应进行的方向。学习过程 知识点1 沉淀溶解平衡原理 1.难溶电解质在水中的溶解性 (1)实验探究 实验步骤实验现象实验结论 ①中PbI2于水 ②中产生色沉淀①PbI2水溶液中含有,证明PbI2在水中 ②绝对不溶的物质是不存在的 以AgCl(s) ,溶解 沉淀 Ag+(aq)+Cl-(aq)为例: 2.沉淀溶解平衡 (1)含义 在一定的温度下,当沉淀的速率和沉淀的速率相等时,形成饱和溶液,达到平衡状态。 (2)特征 ①“难” ——研究对象:。
②“动”——动态平衡,溶解的速率和沉淀的速率并不为。 ③“等”——。 ④“定”——达到平衡时,溶液中离子的浓度保持。 ⑤“变”——当改变外界条件时,溶解平衡将,达到新的平衡。 (3)影响因素 内因:难溶物质本身性质——主要决定因素 外因:①浓度—加水,平衡向方向移动 ②温度—升温,多数平衡向方向移动 ③同离子效应—向平衡体系中加入相同的离子使平衡向方向移动 ④其他—向平衡体系中加入可与体系中某些离子反应生成更难溶物质或气体时,平衡。「特别提醒」沉淀溶解平衡是针对与难溶电解质而言的,其状态为形成饱和溶液,特征是固体溶解的速率和离子沉淀的速率相等,固体的质量和离子的浓度不再变化。应该注意到:沉淀溶解平衡同化学平衡相似,也是一个动态平衡,平衡移动原理同样也适用于沉淀溶解平衡体系。 知识点2 溶度积 1.含义 难溶电解质达到溶解平衡时,其称为溶度积常数,即难溶电解质饱和溶液 中的幂之积,简称溶度积,用K sp表示。 2.表达式 (1)如AgCl Ag++Cl-,K sp=。 (2)如Fe(OH)3Fe3++3OH-,K sp=。 3.意义
第3节沉淀溶解平衡 第1课时沉淀溶解平衡与溶度积 基础过关练 题组一沉淀溶解平衡 1.下列对沉淀溶解平衡的描述正确的是( ) A.开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀速率和溶解速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D.沉淀溶解达到平衡时,再加入该沉淀,将促进溶解 2.下列有关CaCO3的沉淀溶解平衡的说法中不正确的是( ) A.CaCO3沉淀生成和沉淀溶解不断进行,但速率相等 B.CaCO3难溶于水,其饱和溶液不导电,属于弱电解质 C.升高温度,CaCO3的溶解度增大 D.向CaCO3沉淀中加入纯碱固体,CaCO3溶解的量减少 3.对“AgCl(s) Ag+(aq)+Cl-(aq)”的理解正确的是( ) A.说明AgCl没有完全电离,AgCl是弱电解质 B.说明溶解的AgCl已完全电离,是强电解质 C.说明Ag+与Cl-反应不能完全进行到底 D.说明Ag+与Cl-反应可以完全进行到底 4.(双选)(2020河北唐山期末)一定温度下,BaSO4(s) Ba2+(aq)+S O42-(aq)体系中,c(Ba2+)和c(S O42-)关系如图所示。下列说法正确的是( ) A.a、b、c三点对应的K sp相等 B.BaSO4在c点的溶解量比b点的大 C.BaSO4溶于水形成的饱和溶液中,c(Ba2+)=c(S O42-)
D.b点的溶液中加入BaCl2固体,c(S O42-)沿曲线向a点方向变化 题组二溶度积 5.下列关于沉淀溶解平衡的说法中不正确的是(深度解析) A.难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 B.K sp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关 C.K sp反映了物质在水中的溶解能力,可直接根据K sp的大小比较电解质在水中的溶解能力大小 D.K sp改变,可使沉淀溶解平衡移动 6.已知25 ℃时BaSO4饱和溶液中存在沉淀溶解平衡:BaSO4(s) Ba2+(aq)+S O42-(aq),K sp(BaSO4)=1.1×10-10 mol2·L-2,下列有关BaSO4的溶度积和沉淀溶解平衡的叙述正确的是( ) A.25 ℃时,向c平(S O42-)=1.05×10-5mol·L-1的BaSO4溶液中加入BaSO4固体,c平(S O42-)增大 B.向该饱和溶液中加入Ba(NO3)2固体,BaSO4的溶度积增大 C.向该饱和溶液中加入Na2SO4固体,该溶液中c平(Ba2+)>c平(S O42-) D.向该饱和溶液中加入BaCl2固体,该溶液中c平(S O42-)减小 7.已知K sp(AgCl)=1.8×10-10 mol2·L-2,K sp(AgI)=8.3×10-17 mol2·L-2。下列关于难溶物之间转化的说法中错误的是( ) A.AgCl不溶于水,不能转化为AgI B.两种难溶物的K sp相差越大,难溶物就越容易转化为更难溶的物质 C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI × D.常温下,要使AgCl在NaI溶液中转化为AgI,则NaI的浓度必须不低于 √1.8 10-12mol·L-1 8.(2020湖北宜昌期末)已知:K sp(AgCl)=1.8×10-10 mol2·L-2,K sp(AgI)=8.3×10-17 mol2·L- 2,K -13 mol2·L-2,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( ) sp(AgBr)=5.0×10 A.AgCl>AgI>AgBr B.AgBr>AgI>AgCl C.AgBr>AgCl>AgI D.AgCl>AgBr>AgI 9.(2020福建师范大学附中期末)某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1 mol/L的Na2S 溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已 知:lg2=0.3,K sp(ZnS)=3×10-25 mol2·L-2。下列有关说法正确的是( )
第3章物质在水溶液中的行为(鲁科版) 第3节沉淀溶解平衡教学设计 海南中学萱书慧 一、教材内容分析 本节是普通高中课程标准实验教科书(鲁科版)化学《化学反应原理》 第3章第3节沉淀溶解平衡。本节教材按照由简到繁、逐步递进的原则 构建。首先分析单一难溶电解质在水中的行为,建立起沉淀溶解平衡的概 念,引入描述这种平衡的平衡常数——溶度积;在此基础上分析沉淀的生 成和溶解,最后考虑比较复杂的沉淀转化问题。本节教材设计中始终依据 实际例子来诠释抽象的概念,通过对具体问题的讨论分析带动原理的学习, 引导学生利用平衡移动的一般规律一步步揭示沉淀溶解平衡的本质。 二、教学目标 1、知道难溶电解质在水中存在沉淀溶解平衡,并能结合实例进行描述。 2、能描述沉淀溶解平衡,写出溶度积的表达式,知道溶度积的含义, 知道溶度积是沉淀平衡的平衡常数、溶度积可以反映难溶电解质在水中的 溶解能力。 3、能够运用平衡移动的观点对沉淀的溶解、生成过程进行分析。 三、教学重点与难点 重点:溶度积常数的含义,沉淀的溶解、生成的本质 难点:沉淀溶解平衡 四、教学方法 习题练习、讲解启发、实验法、自主学习、合作探究、多媒体展示 五、教学过程
第一课时 【导入新课】 当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。石灰石岩层在经历了数万年的岁月侵蚀之后,会形成各种奇形异状的溶洞,如何形成? 小朋友吃糖不刷牙易形成蛀牙又什么原因?这都与我们要学习第3节沉淀溶解平衡有一定的关系。 【图片展示】千姿百态的岩石、溶洞、蛀牙。 【老师】现在学习沉淀溶解平衡之前,我们首先思考讨论两个问题: 问题一:在NaCl的水溶液中,再加入固体溶质,固体有没有溶解过程?【学生思考讨论】分两种情况:当溶液没有达到饱和时,固体能继续溶解;当溶液达到饱和时不能继续溶解。 【老师提出质疑】达到饱和后固体真的不能溶解了吗? 【图片展示】将形状不规则的NaCl固体放在饱和食盐水中过了一昼夜后发现变成形状规则的固体且质量不变。你得到什么启示? 【老师提示】联想如何改变固定形状的积木?拆——拼。 【学生】其实有溶解也有结晶的过程。质量不变说明这两种过程的速率相等。 【老师】可用NaCl(S) Na+ (aq) + Cl-表示 【老师】问题二:NaCl能不能与盐酸反应?在饱和NaCl溶液中加入浓盐酸有什么现象? 【学生实验】在饱和NaCl溶液中滴加浓盐酸 实验现象:有大量白色沉淀产生。 【老师】你认为白色沉淀是什么物质?产生白色沉淀的原因是什么?(提示联系问题一)
1.(1)已知K sp(AgBr)=4.9×10-13,则将AgBr放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是多少? (2)已知常温时,K sp[Mg(OH)2]=4.0×10-12mol3·L-3, 则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH 为多少? (3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH 溶液,刚好出现沉淀时,溶液的pH是多少?当Mg2+完全沉淀时,溶液的pH为多少? 2.已知K sp(AgCl)=1.8×10-10mol2·L-2, K sp(Ag2CrO4)=1.6×10-12mol3·L-3, 现在向0.001 m ol·L-1 K2CrO4和0.01 mol·L-1 KCl混合液中滴加0.01 mol·L-1 AgNO3溶液,通过计算回答: (1)Cl-、CrO2-4谁先沉淀? (2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设滴加过程中体积不变)
3.(2009·广东,18改编) 硫酸锶(SrSO4)在水中的 沉淀溶解平衡曲线如图。 下列说法正确的是( ) A.温度一定时,K sp(SrSO4) 随c(SO2-4)的增大而减小 B.三个不同温度中,313 K时K sp(SrSO4)最大 C.283 K时,图中a点对应的溶液是饱和溶液 D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 9. 已知:pAg=-lg[c(Ag+)], K sp(AgCl)=1×10-12mol2·L-2。 如图是向10 mL AgNO3溶液中 逐渐加入0.1 mol·L-1的NaCl 溶液时,溶液的pAg随着加入 NaCl溶液的体积(单位mL)变化的图像(实线)。根据图像所得下列结论正确的是( ) A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 B.图中x点的坐标为(100,6) C.图中x点表示溶液中Ag+被恰好完全沉淀 D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1 NaI 则图像在终点后变为虚线部分
课堂检测·素养达标 1.下列对沉淀溶解平衡的描述正确的是( ) A.BaSO4属于难溶物,它在水中完全不能溶解 B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 【解析】选B。虽然难溶电解质的溶解度很小,但在水中仍有极少量的溶解,A项不正确;v(沉淀)=v(溶解)是溶解平衡的特征,B项正确;沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,如Ag2SO4沉淀溶解达到平衡 时,c(Ag+)=2c(S),C项不正确;沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动,D项不正确。 2.(2019·绵阳高二检测)已知 AgCl 的 K sp=1.8×10-10,在 50 mL 5.0×10-5mol·L-1的 KCl 溶液中,加入 50 mL 4.0×10-6mol·L-1的 AgNO3溶液,下列说法正确的是 ( ) A.无 AgCl沉淀生成 B.有 AgCl 沉淀生成 C.有沉淀生成但不是 AgCl D.无法确定 【解析】选A。50 mL 5.0×10-5mol·L-1的 KCl 溶液中,加入 50 mL 4.0× 10-6mol·L-1的 AgNO3溶液,可知Q=× =5.0×10-11 沉淀溶解平衡 【考纲要求】了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。 【高考链接】 (11—26)(14分)0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。 (4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Kap[Cu(OH)2]=2.2×10-20)。 若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。 (13—10)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是 A.处理过程中银器一直保持恒重 B.银器为正极,Ag2S被还原生成单质银 C.该过程中总反应为2Al + 3Ag2S = 6Ag + A12S3 D.黑色褪去的原因是黑色Ag2S转化为白色AgCl (13—11)己知某溶液中含有C1-, Br-和CrO 4 2-,浓度均为0.010mo1·L-,向该 溶液中逐滴加入0.010mol·L-1的AgNO 3 溶液时,三种阴离子产生沉淀的先后顺序为 A.C1-、Br-、CrO 42- B. CrO 4 2-、Br-、C1- C. Br-、C1-、CrO 42- D. Br-、CrO 4 2-、C1- (14—11)溴酸银( AgBr03)溶解度随温度变化曲 线如图所示,下列说法错误的是 A、温度升高时溴酸银溶解速度加快 B、溴酸银的溶解是放热过程 C、60℃溴酸银的K SP 约等于6 x 10-4 D、若硝酸钾中含有少里溴酸银,可用重结晶方 法提纯 (15—10)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是 试验九配合物与沉淀——溶解平衡 一.实验目的: 1.加深理解配合物的组成和稳定性。了解配合物形成时特征 2.加深理解沉淀—溶解平衡和溶度积的概念。掌握溶度积规则及其应用 3.初步学习利用沉淀反应和配位溶解的方法,分离常见混合阳离子 4.学习电动离心机的使用和固—液分离操作 二.实验原理: 配合物石油形成体(又称为中心离子或原子)与一定数目的配位体(负离子或中性分子)。以配位键结合而形成的一类复杂化合物,是路易斯(Lewis)酸和路易斯(Lewis)碱的加合物。配合物的内层与外层之间以离子键结合,在水溶液中完全解离。配位个体在水溶液中分步解离,其类似于弱电解质。 在一定条件下,中心离子。配位个体和配位个体之间达到配位平衡。例: Cu2++ 4NH3——[Cu(NH3)4]2+ 相应反应的标准平衡常数Kf Q。成为配合物的稳定常数。对于相同类型的配合物Kf Q 数值愈大就愈稳定。 在水溶液中,配合物的生成反应。主要有配位体的取代反应和加合反应 例:[Fe(SCN)n]3++ ===[FeF6]3-+ nScn- HgI2(s) + 2I-==[HgI4]2- 配合物形成时,往往伴随溶液颜色、酸碱性(即PH)。难溶电解质溶解度,中心离子氧化还原的改变等特征。 2.沉淀—溶解平衡 在含有难溶电解质晶体的饱和溶液中,难溶强电解质与溶液中相应离子间的多相离子平衡。称为:沉淀—溶解平衡。 用通式表示如下; AnBn(s) == mA n+(ag)+ nB m-(ag) 其溶度积常数为: Ksp Q(A m B n)==[c(A n+)/c Q]m[c(B m-)/c Q]n 沉淀的生成和溶解。可以根据溶度积规则判断: J Q> Ksp Q有沉淀析出、平衡向右移动 J Q= Ksp Q 处于平衡状态、溶液为饱和溶液 J Q< Ksp Q无沉淀析出、或平衡向右移动,原来的沉淀溶解 溶液PH的改变,配合物的形成发生氧化还原反应。往往会引起难溶电解质溶解度的改变。 对于相同类型的难溶电解质。可以根据其Ksp Q的相对大小判断沉淀的先后顺序,对于不同类型的难溶电解质,则要根据计算所需测定试剂浓度的大小来判断测定的先后顺序。 两种测定间相互转换的难易程度,要根据沉淀转化反应的标准平衡常数确定。利用测定反应和配位溶解。可以分离溶液中心某些离子。 实验内容与数据处理 沉淀溶解平衡的计算: 1:已知一定温度下,Mg(OH)2在水中的溶解度为5.8 ×10-3g/L。 (1)求Mg(OH)2饱和溶液中的溶度积K sp (2)求Mg(OH)2饱和溶液中的pH和[OH-] (3)求Mg(OH)2在0.001mol/L的NaOH溶液中的溶解度。 (4)求Mg(OH)2在0.001mol/L的MgCl2溶液中的溶解度。 2.(1)已知25 ℃时,K sp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下: 25 ℃时,在Mg(OH)2____________。 (2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl 的K sp=1.0×10-10,忽略溶液的体积变化,请计算: ①完全沉淀后,溶液中c(Ag+)=__________。②完全沉淀后,溶液的pH=__________。 ③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成? ________________(填“是”或“否”)。 (3)在某温度下,K sp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)= 1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的 c(H+)约为__________________。 沉淀溶解平衡的应用: 例1:已知:Cu(OH)2: Ksp为2.2×10-20, Fe(OH)3: Ksp为1.6×10-39 现有浓度均为0.1mol/L的 Cu2+、Fe3+的混合溶液, 1.6×10-39则: ⑴Fe3+开始沉淀时的c(OH-)=_____,完全沉淀时的c(OH-)=_____ , (离子浓度小于10-5时可看成完全沉淀) Cu2+开始沉淀时的c(OH-)=_____ 。 ⑵若要除去Fe3+,应将pH调节至____________ 例2锅炉水垢既会降低燃料的利用率,造成能源浪费,也会影响锅炉的使用寿命,还可能形成安全隐患,因此要定期除去锅炉水垢。水垢中含有CaSO4,用酸很难除去。思考:如何去除CaSO4 ?写出相应方程式。 例3:BaSO4的Ksp比 BaCO3小,你认为能实现这一转化吗?已知常温下, BaCO3的K SP = 5.1×10-9 mol2?L-2,BaSO4的K SP =1.0×10-10 mol2?L-2 。现将0.233g BaSO4固体放入100mL水中(忽略溶液体积变化),则: ①溶液中c(Ba2+)= , ②若在上述体系中,实现BaSO4向BaCO3转化, CO32-浓度的取值范围是。 7沉淀-溶解平衡习题解答(p180-182) 1.解答:(1)解:AgI (2)解:Mg(OH)2 2.解答:(1)CaF2?Ca2++2F- s+0.00102s K sp=(s+0.0010)(2s)2?4?0.0010s2 (2)Ag2CrO4?2Ag++CrO42- 2s+0.010s K?sp=(2s+0.010)2?s?0.0102?s Ca3(PO4)2=3Ca2++2PO43- 3s2s 11.解答:AgCl=Ag++Cl- Ag+与NH3会形成配合物,影响AgCl沉淀的溶解平衡 或者:AgCl+2NH3=Ag(NH3)2++Cl- 12.解:[Ba2+]=0.010/1.0=0.010mol?L-1[F-]=0.020/1.0=0.020mol?L-1 Ba2++2F-=BaF2J=[Ba2+][F-]2=0.010?0.0202=4.0?10-6?K?sp有沉淀生成 s?(2s)2=K?sp=1.0?10-6 [Ba2+]=6.3?10-3mol?L-1[F-]=2s=0.013mol?L-1 13.解答: J=[Mg2+][OH-]2=1.0?10-3?(1.8?10-6)=3.2?10-15?K?sp 所以:无Mg(OH)2沉淀生成 14.解:MnS(s)+2HAc(aq)=Mn 2+(aq)+2Ac -(aq)+H 2S(aq) x 0.200.400.20 所以,溶解0.20molMnS 需HAc 的浓度为:0.032+0.40=0.43mol ?L -1 15.解:必须同时考虑同离子效应和酸效应。 αS 2-(H )=1+β1[H +]+β2[H +]2 β1=1/k a2=121069.7?;β2=1/k a1k a2=191010.8? 所以αS 2-(H )=131010.8? θsp θsp K 'K =αS 2-(H )=41086.4-? 16.所以[Cl - 同理,K θsp 同理,n (CO2)当加入与NaOH 等当量的NH4Cl 时,完全生成NH3 ∴必须再加入NH4Cl 形成缓冲溶液,再降低溶液pH ∴加入的总的NH4Cl 解法二,0.357 101.43 50.0 20.00.5050.0 50.020.00.05020.0 O H 2NH Mg 2NH (s) Mg(OH)223242=?=+?+??+=+-++x ∴加入的总的NH4Cl 19.解答: J=[Zn 2+][OH -]=2.6?10-16?K ?sp =1.2?10-17 计算说明有Zn(OH)2沉淀生成。 第1课时 沉淀溶解平衡原理 [目标要求] 1.能描述沉淀溶解平衡。2.了解溶度积和离子积的关系,并由此学会判断反应进行的方向。 一、沉淀溶解平衡的建立 1.生成沉淀的离子反应之所以能够发生的原因 生成沉淀的离子反应之所以能够发生,在于生成物的溶解度小。 尽管生成物的溶解度很小,但不会等于0。 2.溶解平衡的建立 以AgCl 溶解为例: 从固体溶解平衡的角度,AgCl 在溶液中存在下述两个过程:一方面,在水分子作用下,少量Ag +和Cl -脱离AgCl 的表面溶于水中;另一方面,溶液中的Ag +和Cl - 受AgCl 表面正、负离子的吸引,回到AgCl 的表面析出——沉淀。 溶解平衡:在一定温度下,当沉淀溶解和生成的速率相等时,即得到AgCl 的饱和溶液,如 AgCl 沉淀体系中的溶解平衡可表示为AgCl(s)Cl -(aq)+Ag + (aq)。由于沉淀、溶解之间的这种动态平衡的存在,决定了Ag +和Cl - 的反应不能进行到底。 3.生成难溶电解质的离子反应的限度 不同电解质在水中的溶解度差别很大,例如AgCl 和AgNO 3;但难溶电解质与易溶电解质之间并无严格的界限,习惯上将溶解度小于0.01 g 的电解质称为难溶电解质。对于常量的化学反应来说,0.01 g 是很小的,因此一般情况下,相当量的离子互相反应生成难溶电解质,可以认为反应完全了。 化学上通常认为残留在溶液中的离子浓度小于1×10-5 mol·L -1 时,沉淀就达完全。 二、溶度积 1.表达式 对于下列沉淀溶解平衡: 溶解 沉淀 M m A n (s)m M n+(aq)+n A m-(aq) K sp=[c(M n+)]m·[c(A m-)]n。 2.意义 K sp表示难溶电解质在溶液中的溶解能力。 3.规则 通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Q c的相对大小,可以判断在给定条件下沉淀能否生成或溶解: Q c>K sp,溶液过饱和,有沉淀析出; Q c=K sp,溶液饱和,沉淀与溶解处于平衡状态; Q c 难溶电解质的溶解平衡 一.固体物质的溶解度 1.溶解度:在一定温度下,某固体物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。符号:S ,单位:g ,公式:S=(m 溶质/m 溶剂 )×100g 2.不同物质在水中溶解度差别很大,从溶解度角度,可将物质进行如下分类: 3.解度随温度的升高而减小。 二?沉淀溶解平衡 1.溶解平衡的建立 讲固态物质溶于水中时,一方面,在水分子的作用下,分子或离子脱离固体表面进入水中,这一过程叫溶解过程;另一方面,溶液中的分子或离子又在未溶解的固体表面聚集成晶体,这一过程叫结晶过程。当这两个相反过程速率相等时,物质的溶解达到最大限度,形成饱和溶液,达到溶解平衡状态。 溶质溶解的过程是一个可逆过程: ? ?? ??→<→=→>????→→晶体析出 溶解平衡固体溶解 结晶溶液中的溶质溶解固体溶质结晶溶解结晶溶解结晶溶解v v v v v v 2.沉淀溶解平衡 绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。以AgCl 为例:在一定温度下,当沉淀溶解和生成的速率相等时,便得到饱和溶液,即建立下列动态平衡: AgCl(s)Ag + (aq)+Cl - (aq) 3.溶解平衡的特征 1)动:动态平衡 2)等:溶解和沉淀速率相等 3)定:达到平衡,溶液中离子浓度保持不变 4)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。 三.沉淀溶解平衡常数——溶度积 1)定义:在一定温度下,难溶性物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫溶度积常数。 2)表达式:即:AmBn(s)mA n+ (aq)+nB m - (aq) Ksp =[A n+]m ·[B m -]n 例如:常温下沉淀溶解平衡:AgCl(s)Ag + (aq)+Cl - (aq), Ksp(AgCl)=[Ag + ][Cl - ] =1.8×10 -10 常温下沉淀溶解平衡:Ag 2CrO 4(s)2Ag + (aq)+CrO 42-(aq), Ksp(Ag 2CrO 4)=[Ag +]2 [CrO2- 4] =1.1×10 -12 3)意义:反应了物质在水中的溶解能力。对于阴阳离子个数比相同的电解质,Ksp 数值越大,电解质在 溶解 沉淀 第3节沉淀溶解平衡课堂学案 第一课时 2008-12-12 【学习目标】 1、知道难溶电解质在水中存在沉淀溶解平衡,并能结合实例进行描述 2、能描述沉淀溶解平衡,写出溶度积表达式 3、能够运用平衡移动的观点对沉淀的溶解、生成与转化过程进行分析,知道沉 淀转化的本质并能够对生活中的一些相关问题进行解释。 【重点】溶度积常数的含义,沉淀的溶解、生成和转化的本质 [预习检测] 1、有关溶度积K sp说法正确的是() A. K sp的数值只与难溶电解质的性质与温度有关 B.K sp的大小与沉淀量和溶液中的离子有关 C.当溶液中离子的浓度改变时,K sp也随之改变 D.对于阴阳离子个数比相同的电解质,K sp值越大,电解质在水中的溶解能力越强 2、写出BaSO4 Al(OH)3 的沉淀溶解平衡的表达式并写出其溶度积K SP表达式:BaSO 4 Al(OH) 3 【课堂导学】本环节得分 【观察、思考】P90 1.(1)现象,说明了,结论 (2)描述PbI2达到沉淀溶解平衡的过程 2.难溶电解质A m B n的沉淀溶解平衡可表示为:_____________________ K sp=______________________________ 3.有人认为K sp越小,其物质的溶解度越小,你认为正确吗? 一、沉淀溶解平衡: 1、难溶电解质在水中的沉淀溶解平衡和化学平衡、电离平衡一样,合乎平衡的基本特征、满足平衡的变化基本规律。 【练习】1.下列对沉淀溶解平衡的描述正确的是() A.反应开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 E.向硫酸钡饱和溶液中加水,K sp增大 【问题探究】 对于平衡:AgCl Ag+ + Cl- 若改变条件,对其有何影响 改变条件平衡移动方向C(Ag)C(Cl) 升温 加水 加AgCl(s) 加NaCl(s) 加AgNO (s) 2、影响沉淀溶解平衡的因素: ①内因:______________________________________ ②外因: 〖巩固训练1〗 在平衡体系Ca(OH)2(s) Ca2++2OH-中,能使c(Ca2+)减小,而使c(OH-)增大的是() A.加入少量MgCl2固体B.加入少量Na2CO3固体 C.加入少量KCl固体D.加入少量Ba(OH)2固体 二、沉淀溶解平衡常数-----溶度积常数或溶度积Ksp 1、溶度积Ksp 有单位 2、表达式:例如:PbI 2(s) Pb 2+ + 2I - 25℃Ksp = 〖巩固训练2〗请写出AgCl Cu(OH)2 BaSO4 CaCO3 Al(OH)3 CuS 的沉淀溶解平衡与溶度积K SP表达式 3、溶度积性质: a.溶度积(Ksp )的大小与_________和_________有关,与沉淀的量无关。 b. Ksp反映了难溶电解质在水中的_____________。相同类型的难溶电解质的沉淀溶解平衡复习学案(高三一轮复习)
实验九配合物与沉淀溶解平衡
沉淀溶解平衡计算及图像分析教学文案
基础化学沉淀溶解平衡习题参考答案
高中化学(知识清单+对点训练+课后作业)第一单元第1课时沉淀溶解平衡原理(含解析)苏教版选修
沉淀溶解平衡知识点
沉淀溶解平衡课堂学案