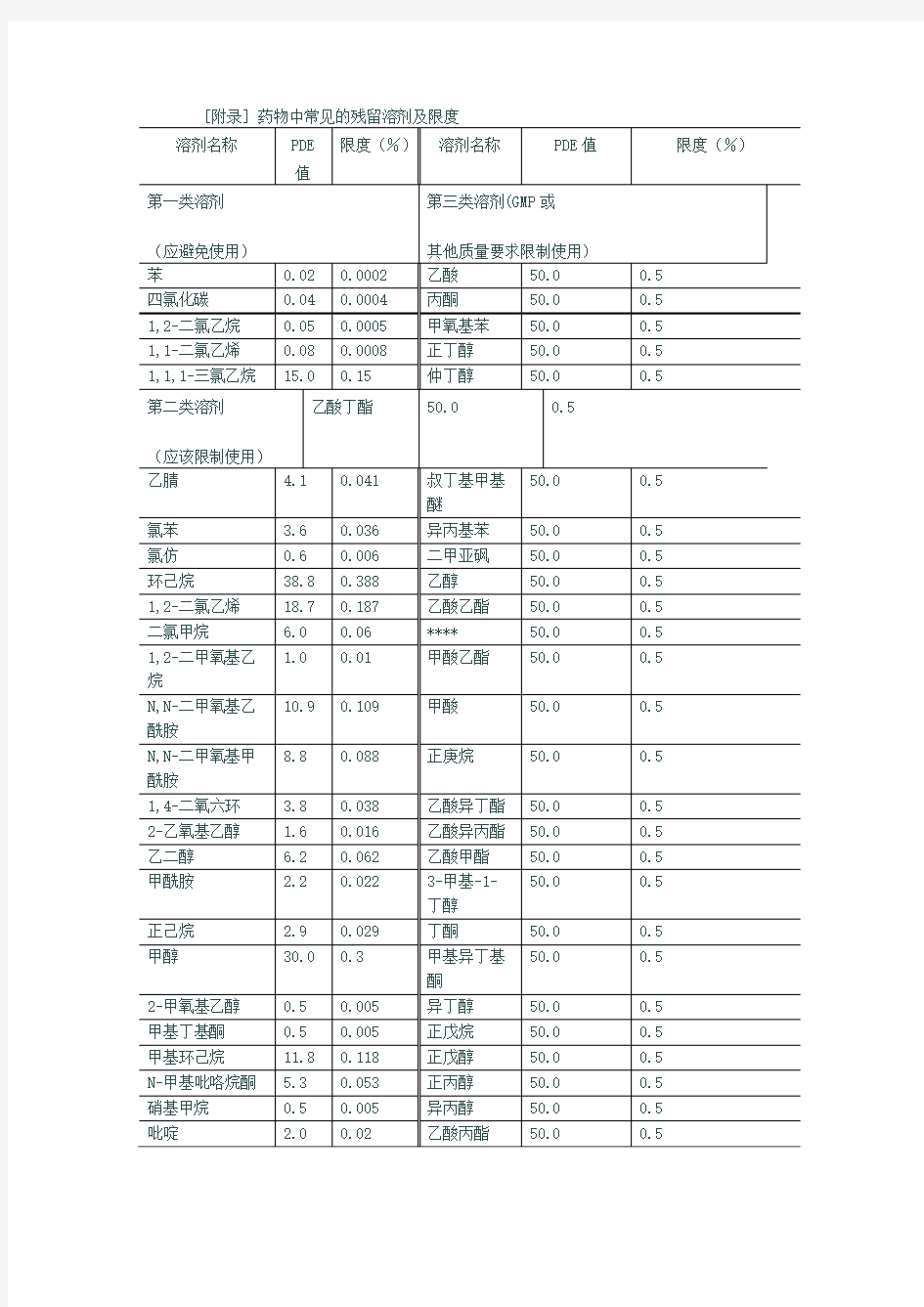
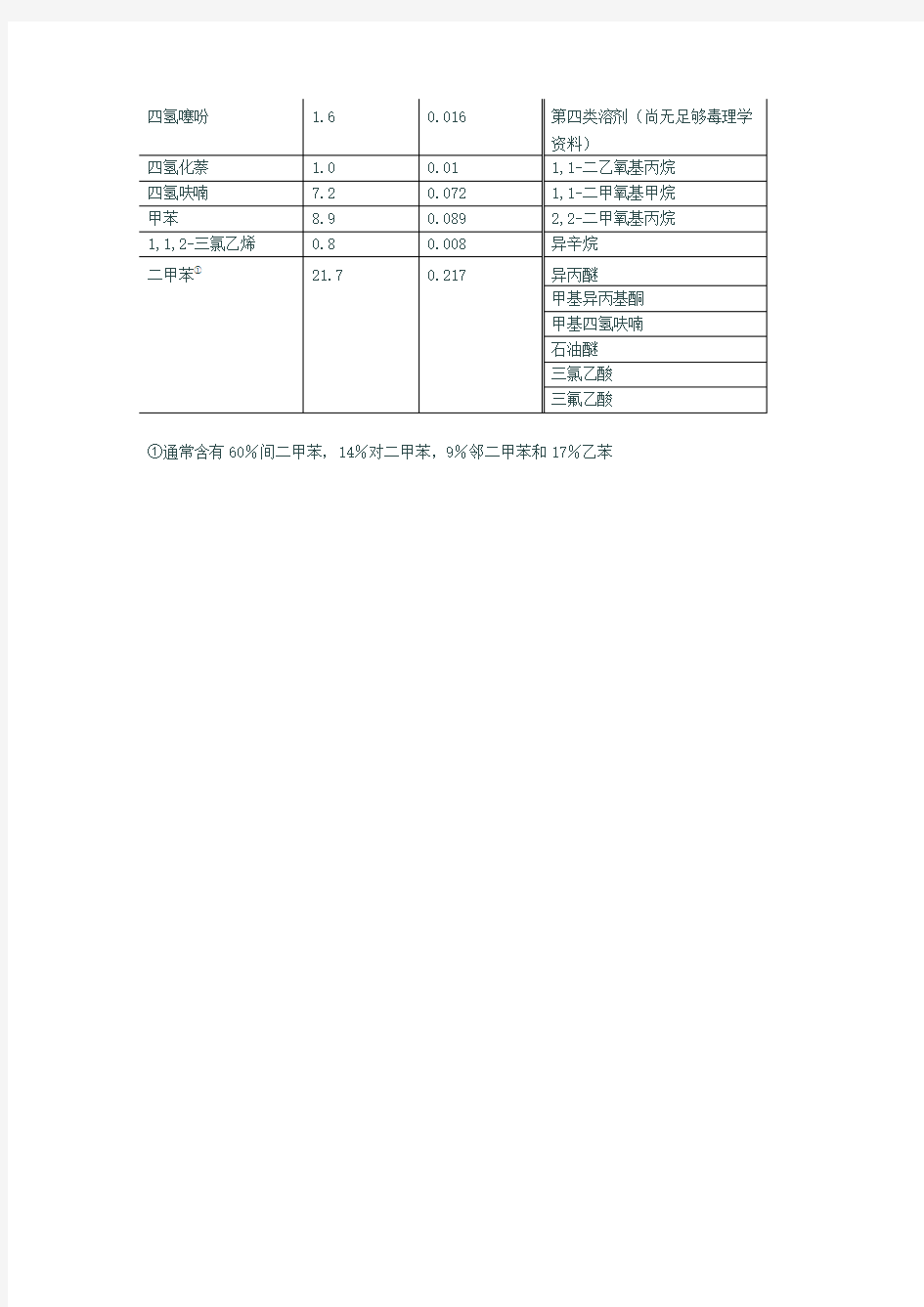
①通常含有60%间二甲苯,14%对二甲苯,9%邻二甲苯和17%乙苯
残留溶剂的鉴定和控制 在本章下描述的测试程序可能适用于以下几种情况: (1)原料药、辅料以及制剂中的大多数未知一类和二类溶剂的鉴定。 (2)原料药、辅料以及制剂中的一类和二类溶剂的限度测试。 (3)对于限度大于1000ppm的二类溶剂以及三类溶剂的定量测试。 一类、二类及三类溶剂在5.4残留溶剂里面都列出来了。 样品配制的三种溶剂以及顶空进样的色谱系统条件都在本章中进行了描述。本章中规定了两个色谱系统,但是系统A是优先推荐的,系统B是用于确证同一性而使用的。样品配制程序的选择主要是根据样品本身的溶解度以及需要控制的溶剂类别来确定的。 下面几种溶剂不适合用顶空进样测定:甲酰胺、2-乙氧基乙醇、2-甲氧基乙醇、乙二醇、N-甲基吡咯烷酮以及环丁砜。其他合适的程序可以用于这些溶剂的测定。 当一种方法被用于定量控制原料药中的残留溶剂,必须进行验证。 测试程序:使用顶空进样气相色谱法进行测量。 样品制备方法1:该方法主要用于易溶于水系统的残留溶剂的测定。 样品溶液(1)将0.200g样品溶于水中,用水稀释至20ml。 样品制备方法2:该方法主要用于难溶于水系统的残留溶剂的测定。 样品溶液(2)将0.200g样品溶于DMF中,用DMF稀释至20ml。 样品制备方法3:该方法主要用于控制N,N-二甲基乙酰胺以及N,N-二甲基甲酰胺的测定。 样品溶液(3)将0.200g样品溶于1,3-二甲基-咪唑啉酮中,用1,3-二甲基-咪咪唑啉酮稀释至20ml。 某些情况下,以上的几种样品配制方法都不适用的时候,所选择的样品配制方法以及顶空条件必须证明是合适的。 溶剂溶液(a)取1.0ml一类溶剂标准品,加9mlDMSO,用水稀释至100ml。取1.0ml至10.0ml水中。 相关溶液包括以下几种:苯:2ppm,四氯化碳:4ppm,1,2-二氯乙烷:5ppm,1,1-二氯乙烷:8ppm,1,1,1-三氯乙烷:10ppm。
残留溶剂测定法
残留溶剂测定法 1 简述 药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用过,但在工艺过程中未能完全去除的有机溶剂。药物中常见的残留溶剂及限度参照《中国药典》2015年版四部通则0861附表1的规定,除另有规定外,第一、第二、第三类溶剂的残留量应符合其规定;对其他溶剂,应根据生产工艺的特点,制订相应的限度,使其符合产品质量标准的要求。本法照气相色谱法(《中国药典》2015年版四部通则0521测定。 本测定方法适用于对各论项下未收载残留溶剂检测方法的品种中残留溶剂的检验,也可用于指导建立各论项下具体品种的残留溶剂检查方法。 2 仪器和用具 2.1 气相色谱仪,带FID检测器,顶空进样器。 2.2 计算机,安装工作站软件。 2.3 色谱柱 2.3.1 毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互代使用。2.3.1.1 非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。 2.3.1.2 极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。 2.3.1.3 中极性色谱柱固定液为(35%)二苯基-(65%)二甲基聚硅氧烷,(50%)二苯基-(50%)二甲基聚硅氧烷,(35%)二苯基-(65%)二甲基亚芳基聚硅氧烷,(14%)氰丙基苯基-(86%)二甲基聚硅氧烷,(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱。 2.3.1.4 弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷,(5%)二苯基-(95%)二甲基亚芳基硅氧烷共聚物的毛细管柱。 2.3.2 填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。 3 供试品溶液和对照品溶液的制备 3.1 供试品溶液的制备 3.1.1 顶空进样除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺、二甲基亚砜或其他适宜溶剂;
usp[467] 有机挥发性杂质 残留溶剂限度 残留溶剂:不得残留 Ⅰ级已知人体实验致癌物质;强烈疑似人体实验致癌物 质;环境危害物质 残留溶剂:应在限度内 Ⅱ级动物实验非生殖毒性(遗传);动物实验致癌物质或其它可能的非可逆致病因子;产生毒性如神经毒性或致畸性;其它疑似重大但可逆毒性 残留溶剂:低潜在毒性溶剂 Ⅲ级对人体存在低毒性溶剂;无人体摄入量规定(注:Ⅲ级残留溶剂 PDEs上限为≥ 50mg/天) 表 1 Ⅰ级残留溶剂 溶剂浓度限度( ppm)不良反应 苯2致癌物四氯化碳4中毒和外周脑组织损害1,2- 二氯乙烷5中毒 1,1- 二氯乙烷8中毒 1,1,1- 三氯乙烷1500环境危害 Ⅱ级残留溶剂 表 2 Ⅱ级残留溶剂 溶剂PDE(mg/天)浓度限度( ppm) 乙腈 4.1410 氯苯 3.6360 氯仿0.660 环己烷38.83880 1,2- 二氯乙烯18.71870 1,2- 二甲氧乙烷 1.0100 N,N-二甲基乙酰胺10.91090 N,N-二甲基甲酰胺8.8880 1,4- 二氧六环 3.8380 2- 乙氧基乙醇 1.6160 乙二醇 6.2620 甲酰胺 2.2220 己烷 2.9290 甲醇30.03000 2- 甲氧基乙醇0.550 甲基丁基(甲)酮 0.550 2- 己酮 甲基环己烷11.81180
二氯甲烷 6.0600 N-甲基吡咯烷酮 5.3530硝酸甲烷0.550 吡啶 2.0200环丁砜 1.6160四氢呋喃7.2720 1,2,3,4- 四氢化萘 1.0100甲苯8.9890三氯乙烯0.880 二甲苯 *21.72170 *通常含有 60%间- 二甲苯, 14%对 - 二甲苯, 9%邻- 二甲苯和 17%乙苯 Ⅲ级残留溶剂 表 3Ⅲ级残留溶剂 (GMP或其它原料药、赋形剂和药物制剂质量标准规定) 醋酸庚烷 丙酮乙酸异丁酯 苯甲醚乙酸异丙酯 正丁醇乙酸甲酯 2- 丁醇3- 甲基 -1- 丁醇 乙酸丁酯甲基乙基酮 叔丁基甲基醚甲基异丁基酮 异丙基苯2- 甲基 -1- 丙醇 二甲基亚砜戊烷 乙醇1- 戊醇 乙酸乙酯1- 丙醇 乙醚2- 丙醇 甲酸乙酯乙酸丙酯 甲酸 表 4其它残留溶剂 (缺乏足够的毒物学方面的资料) 1, 1- 二乙氧基丙烷甲基异丙基酮 1, 1- 二甲氧基甲烷甲基四氢呋喃 2, 2- 二甲氧基丙烷溶剂己烷 异辛烷三氯醋酸 异丙醚三氟醋酸 除另有规定外,样品中残留的有机挥发性杂质不得超过下表中规定限度:有机挥发性杂质限度(μ g/g ) 氯仿60 1,4- 二氧杂环己烷380 二氯甲烷600 三氯乙烷80
USP[467]有机挥发性杂质 残留溶剂限度 Ⅰ级需避免的溶剂 已知人体实验致癌物质; 强烈疑似人体实验致癌物质;环境危害物质 Ⅱ级需被限制的溶剂 动物实验非生殖毒性(遗传);动物实验致癌物质或其它可能的非可逆致病因子;产生毒性如神经毒性或致畸性; 其它疑似重大但可逆毒性 Ⅲ级具有低潜在毒性溶剂 对人体存在低毒性溶剂;无人体摄入量规定(注:Ⅲ级残留溶剂PDEs上限为≥50mg/天) 表1 Ⅰ级残留溶剂 溶剂浓度限度(ppm)不良反应 苯 2 致癌物四氯化碳 4 中毒和外周脑组织损害1,2-二氯乙烷 5 中毒 1,1-二氯乙烷8 中毒 1,1,1-三氯乙烷1500 环境危害 Ⅱ级残留溶剂 表2 Ⅱ级残留溶剂 溶剂PDE(mg/天)浓度限度(ppm) 乙腈Acetonitrile 4.1 410 氯苯Chlorobenzene 3.6 360 氯仿Chloroform0.6 60 环己烷Cyclohexane38.8 3880 1,2-二氯乙烯 1,2-Dichloroethene 18.7 1870 1,2-二甲氧乙烷 1.0 100 N,N-二甲基乙酰胺 N,N-Dimethylacetamide 10.9 1090 N,N-二甲基甲酰胺 N,N-Dimethylformamide 8.8 880 1,4-二氧六环 1,4-Dioxane 3.8 380 2-乙氧基乙醇 1.6 160 乙二醇Ethylene glycol 6.2 620 甲酰胺Formamide 2.2 220
己烷Hexane 2.9 290 甲醇Methanol30.0 3000 2-甲氧基乙醇0.5 50 甲基丁基(甲)酮 0.5 50 2-己酮 甲基环己烷11.8 1180 二氯甲烷 6.0 600 N-甲基吡咯烷酮 5.3 530 硝酸甲烷0.5 50 吡啶 2.0 200 环丁砜 1.6 160 四氢呋喃7.2 720 1,2,3,4-四氢化萘 1.0 100 甲苯8.9 890 三氯乙烯0.8 80 二甲苯* 21.7 2170 *通常含有60%间-二甲苯,14%对-二甲苯,9%邻-二甲苯和17%乙苯 Ⅲ级残留溶剂 表3 Ⅲ级残留溶剂 (GMP或其它原料药、赋形剂和药物制剂质量标准规定) 醋酸Acetic acid 庚烷Heptane 丙酮Acetone 乙酸异丁酯 苯甲醚乙酸异丙酯 正丁醇乙酸甲酯 2-丁醇3-甲基-1-丁醇 乙酸丁酯甲基乙基酮 叔丁基甲基醚甲基异丁基酮 异丙基苯2-甲基-1-丙醇 二甲基亚砜戊烷 乙醇1-戊醇 乙酸乙酯1-丙醇 乙醚2-丙醇 甲酸乙酯乙酸丙酯 甲酸 表4 其它残留溶剂 (缺乏足够的毒物学方面的资料) 1,1-二乙氧基丙烷甲基异丙基酮 1,1-二甲氧基甲烷甲基四氢呋喃 2,2-二甲氧基丙烷溶剂己烷 异辛烷三氯醋酸 异丙醚三氟醋酸除另有规定外,样品中残留的有机挥发性杂质不得超过下表中规定限度:
残留溶剂的指导原则 1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。使用低毒溶剂(第三类,表3)较为理想。附录1中列出了指导原则中的全部溶剂。 表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、准赋形剂和准制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如30天或更短)使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录2。 3.通则 3.1 根据危害程度对残留溶剂分类 “可耐受的日摄人量”(TDI)是国际化学品安全纲要(IPCS)用于描述毒性化合物接触限度的术语。“可接受的日摄人量”(ADI)是WHO及一些国家和国际卫生组织所用的术语。新术语“允许的日接触量”(PDE)是本指导原则中用于定义药物中可接受的有机溶剂摄人量,以避免与同一物质的ADI混淆。 本原则中残留溶剂的评价以通用名和结构列于附录1,根据它们对人体可能造成的危害分为以下三类; (1)第一类溶剂:应避兔的溶剂 为人体致癌物、疑为人体致癌物或环境危害物。 (2)第二类溶剂。应限制的溶剂 非遗传毒性动物致癌或可能导致其他不可逆毒性测神经毒性或致畸性)的试剂。 可能具其他严重的但可逆毒性的溶剂。
四、附录 16
1、残留溶剂表示方法 1.1允许日接触量 允许日接触量(permitted daily exposure, PDE)是指某一有机溶剂被允许摄入而不产生毒性的日平均最大剂量,单位为mg/天。某一具体有机溶剂的PDE值是由不产生反应量、体重调整系数、种属之间差异的系数、个体差异、短期接触急性毒性研究的可变系数等推算出的。部分有机溶剂的PDE 值见附录。由于国内目前尚未对此有系统的研究,附录中所列出的数据均是参考ICH残留溶剂研究指导原则中的数据。 1.2浓度限度 在PDE 表示方法的基础上,为了更加便于计算,引入了浓度限度(%)表示方法,其计算公式为浓度限度(%)=PDE(mg/天)9 /(1000×剂量(g/天))×100%,其中剂量初步定为10g/天。部分有机溶剂的浓度限度见附录。 1.3两种表示方法的比较 以上两种表示方法在残留溶剂研究中均可行,但需要指出的是,PDE值是绝对值,也就是说无论原料药、辅料和制剂,只要能明确各成分的溶剂残留量,以PDE值来计算是很精确的;而对于某一具体制剂来说,由于很难确定处方中各活性成分和各辅料的残留溶剂水平,因此以浓度限度来计算更为简便,只要日摄入总量不超过10g,就无需进一步计算。综合以上情况并考虑目前国内的实际情况,由于大多数药物的日摄入量不会超过10g(包括活性成分和辅料),浓度
限度表示方式是目前更为简便可行的。当然,在某些原料、辅料或制剂的残留溶剂不符合浓度限度时,可根据实际测定的各种残留溶剂量及用法用量计算实际日接触量,并与PDE值比较,如符合限量要求则也属可行。 此外,虽然本指导原则采用浓度限度的表示方式,但由于PDE 值的精确性,药物研发者可采用适当的PDE 值的方式进行残留溶剂研究。
医药中常用有机溶剂分类及残留限度 医药中常用有机溶剂分类及残留限度 药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。 药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。药品还可被来自包装、运输、仓储中的有机溶剂污染。药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。 各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。 按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估): 第一类溶剂 是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。在可能的情况下,应避免使用这类溶剂。如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如: 苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。
杂质:残留溶剂的指导原则
杂质:残留溶剂的指导原则
1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的 可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理 学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以 及在制剂制备过程中产生或使用的有机挥发性化合物, 它们在工艺中 不能完全除尽。 在合成原料药中选择适当的溶剂可提高产量或决定药 物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常 关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂, 也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作 出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以 符合产品规范、GMP 或其他基本的质量要求。制剂所含残留溶剂的 水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类, 表 1) ,除非被证明特别合理,在原药、赋形剂及制剂生产中应避免 使用。一些溶剂毒性不太大(第二类,表 2)应限制使用,以防止病 人潜在的不良反应。使用低毒溶剂(第三类,表 3)较为理想。附录 1 中列出了指导原则中的全部溶剂。
第 1 页 共 18 页
杂质:残留溶剂的指导原则
表中所列溶剂并非详尽无遗, 其他可能使用的溶剂有待日后补充 列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性 资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资 料应符合本指导原则或原料药指导原则(Q3A 新原料药中的杂质) 或新药制剂(Q3B 新药制剂中的杂质)中所述的杂质控制原则,或者 符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、 赋形剂或制剂中所含残留溶剂. 因此, 当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也 只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性 地测定制剂, 但也可以从制剂中各成分的残留溶液水平来累积计算制 剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制 剂可考虑不检查残留溶剂, 但如果计算结果高于建议水平则应进行检 测, 以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水 平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、 准赋形剂和准 制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如 30 天或更短) 使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同 的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录 2。
第 2 页 共 18 页
Annexes to: CPMP/ICH/283/95 Impurities: Guideline for residual solvents & CVMP/VICH/502/99 Guideline on impurities: residual Solvents EMA关于残留溶剂指南CPMP/ICH/283/95 杂质-残留溶剂指南和CVMP/VICH/502/99 杂质指南-残留溶剂的附录 Annex I: specifications for class 1 and class 2 residual solvents in active Substances 附录I:API中I类和II类残留溶剂质量标准 Annex II: residues of solvents used in the manufacture of finished products 附录II:制剂生产中使用溶剂的残留 Discussion at Quality Working Party 质量工作组讨论会议January 2003 to June 2004 2003.01~2004.06 Adoption by CVMP CVMP 采纳July 2004 2004.07 Adoption by CHMP CHMP 采纳July 2004 2004.07 Date for coming into operation 生效时间January 2005 2005.01 Rev. 01 Adoption by Quality Working Party 质量工作组采纳的01版本22 November 2012 2012.11.22 Rev. 01 Adoption by CVMP CVMP采纳的01版本7 February 2013 2013.02.07 Rev. 01 Adoption by CHMP CHMP采纳的01版本11 February 2013 2013.02.11 Rev. 01 Date for coming into operation 01版本生效1 March 2013 2013.03.01
杂质:残留溶剂的指导原则 1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。使用低毒溶剂(第三类,表3)较为理想。附录1中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、准赋形剂和准制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如30天或更短)使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录2。
ICH常用有机溶剂分类及残留限度 2009-12-04 11:50 残留溶剂无防治作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。 药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。药品还可被来自包装、运输、仓储中的有机溶剂污染。药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。 各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。 按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估): 第一类溶剂 是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。在可能的情况下,应避免使用这类溶剂。如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如: 苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。 第二类溶剂 是指无基因毒性但有动物致癌性的溶剂。按每日用药10克计算的每日允许接触量如下: 2-甲氧基乙醇(50ppm)、氯仿(60ppm)、1,1,2-三氯乙烯(80ppm)、1,2-二甲氧基乙烷(100ppm)、1,2,3,4-四氢化萘(100ppm)、2-乙氧基乙醇(160ppm)、环丁砜(160ppm)、嘧啶(200ppm)、甲酰胺(220ppm)、正己烷(290ppm)、氯苯(360ppm)、二氧杂环己烷(380ppm)、乙腈(410ppm)、
残留溶剂的鉴定及控制 该方法适用于: . 1.在活性物质、赋形剂或药品中的未知的一类或二类溶剂残留量 的鉴定; 2.在活性物质、赋形剂或药品中的一类或二类溶剂残留量的限量 试验; 3.当二类溶剂的限度大于1000ppm(0.1%)或要求检测三类溶剂时的限量试验。—类溶剂、二类溶剂、三类溶剂的分类见5.4 以下给出了三种样品溶液的稀释方法,以及气相色谱顶空进样的系统条件。还给出了两种气相色谱的系统条件,系统A为首选方法,同时系统B适用于一般的鉴别试验。样品溶液的制备方法由样品的溶解性和待测的溶剂种类决定。 下列溶剂不适于用顶空进样法测定:甲酰胺、2—乙氧基乙醇、2—甲氧基乙醇、乙二醇、N-甲基吡咯烷酮、环丁砜(四氢噻吩砜),但可采用其他的适当的方法测定。当采用其他的方法定量测定有机残留量时,必须进行方法验证 采用静态顶空进样法测定 样品溶液制备1: 适用于在水中易溶的物质的残留溶剂的测定 样品溶液(1):取0.200g待测物质,用水溶解并稀释至20m1 样品溶液制备2: 适用于在水中不溶的物质的残留溶剂的测定 样品溶液(2):取0.200g待测物质,用N,N--二甲基甲酰胺(DMF)溶解并稀释至20ml
样品溶液制备3: 适用于测定N,N---二甲基乙酰胺或N,N--二甲基甲酰胺的残留量,当怀疑他们存在时。 样品溶液(3):取0.200g待测物质,用1,3—二甲基-2-咪唑啉酮(DMI)溶解并稀释至20ml 如果上述方法均不适宜,那么所用稀释方法及静态顶空进样条件均必须验证其合理性。 溶剂溶液(a):吸取一类残留溶剂标准溶液1.0ml,用水稀释至100.0ml,再吸取该溶液1.0ml,用水稀释至10.0ml。 溶剂溶液(b):吸取适量二类溶剂溶于二甲基亚砜,用水稀释至100.0ml,再用水将该溶液稀释至限量的1/20(限量见5.4表格二)。 溶剂溶液(c):称取1.00g溶剂或待测物质中存在的,用二甲基亚砜或水溶解,用水稀释至100.0ml,再用水将该溶液稀释至限量的1/20(限量见5.4表格一或二)。 空白溶液:不加入溶剂,按溶剂溶液(c)制备方法配制(用于验证有无干扰峰)。 测试溶液:吸取5.0ml样品溶液和1.0ml空白溶液于进样瓶中 参比溶液(a)(一类溶剂):吸取1.0ml溶剂溶液(a)和5.0ml合适稀释剂的溶液于进样瓶中 参比溶液(a1)(一类溶剂):吸取5.0ml样品溶液和1.0ml溶剂溶液(a)于进样瓶中 参比溶液(b)(二类溶剂):吸取1.0ml溶剂溶液(b)和5.0ml适当稀释剂于进样瓶中 参比溶液(c):吸取5.0ml样品溶液和1.0ml溶剂溶液(c)于进样瓶中 参比溶液(d):吸取1.0ml空白溶液和5.0ml适当稀释剂于进样瓶中
I C H常用有机溶剂分类 及残留限度 YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】
ICH常用有机溶剂分类及残留限度 2009-12-04 11:50 残留溶剂无防治作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。 药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。药品还可被来自包装、运输、仓储中的有机溶剂污染。药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。 各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。 按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估): 第一类溶剂 是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。在可能的情况下,应避免使用这类溶剂。如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如: 苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷 (8ppm)、1,1,1-三氯乙烷(1500ppm)。 第二类溶剂 是指无基因毒性但有动物致癌性的溶剂。按每日用药10克计算的每日允许接触量如下: 2-甲氧基乙醇(50ppm)、氯仿(60ppm)、1,1,2-三氯乙烯(80ppm)、1,2-二甲氧基乙烷(100ppm)、1,2,3,4-四氢化萘(100ppm)、2-乙氧基乙醇 (160ppm)、环丁砜(160ppm)、嘧啶(200ppm)、甲酰胺(220ppm)、正己烷 (290ppm)、氯苯(360ppm)、二氧杂环己烷(380ppm)、乙腈(410ppm)、二氯甲烷
<467>溶剂残留 简介:INTRODUCTION This general chapter applies to existing drug substances, excipients, and products. All substances and products are subject to relevant control of solvents likely to be present in a substance or product. 本章节适用于现有的原料药,辅料和制剂。应对原料药或制剂产品中可能存在溶剂的所有原料及制剂产品进行控制。 Where the limits to be applied comply with those given below, tests for residual solvents are not generally mentioned in specific monographs, because the solvents employed may vary from one manufacturer to another. 当限值与下面提供的数值相符合,残留溶剂的测试方法一般不会在专论中特别,因为不同制造商所使用的溶剂不同。 The objective of this general chapter is to provide acceptable amounts of residual solvents in pharmaceuticals for the safety of the patient. The chapter recommends the use of less toxic solvents and describes levels considered to be toxicologically acceptable for some residual solvents. 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。 For pharmacopeial purposes, residual solvents in pharmaceuticals are defined as organic volatile chemicals that are used or produced in the manufacture of drug substances or excipients, or in the preparation of drug products. The residual solvents are not completely removed by practical manufacturing techniques. Appropriate selection of the solvent for the synthesis of a drug substance or an excipient may enhance the yield, or determine characteristics such as crystal form, purity, and
原料药中残留溶剂限度的确定方法 前言 药品的三个性质为安全、有效和质量可控。杂质的研究应从对药品安全性和质量可控性两个方面的影响来考虑。化学试剂作为广义概念上的杂质的一部分,也需要评估其残留对药品安全性和质量可控性的影响,其残留限度的制定也是如此。如某化学试剂有基因警示结构,其限度应根据相应指导原则(《ICHM7》)制定。如为无机盐,应根据无机盐的控制策略及相应指导原则制定,在API成品检测炽灼残渣,研究元素杂质(《ICHQ3D》)等。某些有机试剂如残留溶剂中的四类溶剂的限度则应该先查找相应的安全性的数据,如动物毒理研究数据、职业环境暴露量研究数据等,然后根据安全性的数据计算相应的残留限度。本文着重论述如何根据查到的安全性的数据计算化学试剂允许的残留限度。 通过PDE 计算限度 ICHQ3C中收载了PDE的计算方法: PDE = NOEL x Mass Adjustment/[F1 x F2 x F3 x F4 x F5] 其中PDE为允许日暴露量,单位为mg/天;NOEL为该杂质的最大无作用的剂量,单位为mg/kg/天。 Mass Adjustment为体重调整系数,一般取为50kg。F1….. F5为各种修正因子,其含义与应取的值请查阅ICHQ3C相
应内容,不再细述。 通过以上公式得出PDE的值之后,然后除以药品的最大日剂量,即得出该化学试剂的限度。 从LD50 计算NOEL 很多时候我们查找不到NOEL的数据,我们只能查到LD50(半数致死量)。目前最权威的计算方法出自欧盟原料药委员会在其发布的《原料药工厂中清洁验证指南》,其中收载了由LD50计算NOEL的公式:NOEL=LD50×70/2000。但这一公式却会误导PDE的计算,因为很多人会用这一公式计算出来的NOEL直接代入上文的公式计算PDE,却没有注意到《原料药工厂中清洁验证指南》一文中的NOEL 的单位是mg/天,而不是上文公式中的mg/kg/天。原因就是公式中的70是欧洲人的评价体重。所以如果需要用LD50计算NOEL用于计算PDE,则不应该乘以70,公式应该是NOEL=LD50/2000,2000是经验常数。该公式可参见文献Layton D W,Mallon B J,RosenblattD H,et.Deriving allowable daily intakes for systemic toxicants lacking chronic toxicity data[J].Reg02 To'xicol Pharm,1983,3(1):224。由ppm 计算相应NOEL 有些时候我们查到的相应药理毒理研究数据(特别是某些低沸点溶剂)是研究空气中特定含量的吸入产生的效果,其单位常见的是ppm为体积比,如何换算成mg/kg/天的单位呢?
残留溶剂限度的计算方法举例(参考ICH Q3C(R7)和ICH M7) 第一种情况: 在大多数情况下,我们要检查的残留溶剂在中国药典或者ICH 中已列出限度,不需要我们计算,例如:甲醇接触限度为0.3%,乙醇接触限度为0.5%,二氯甲烷接触限度为0.06%……当然这是最完美的情形。 第二种情况(PDE 评估法): 如果我们要检查的残留溶剂接触限度在中国药典或者ICH 中未被列出,我们可以通过查询数据库(如美国毒物网:https://https://www.doczj.com/doc/9c12923621.html,/;美国国家毒理部https://https://www.doczj.com/doc/9c12923621.html,/等)搜索该化合物的PDE 值,参照ICH ,通过公式计算: C (ppm )= 1000×PDE 10g/day 其中,PDE 单位:mg/day 第三种情况(NOEL 或LOEL 法): 有时候我们搜索不到PDE 值,但是可以搜索到NOEL 或LOEL 值,这时候我们可以通过NOEL 值(或LOEL 值,但优先使用NOEL 值)计算出PDE 值,再依照第二种情况(PDE 评估法)计算出残留溶剂接触限度。公式如下: PDE = NOEL(LOEL)×体重调整F 1×F 2×F 3×F 4×F 5 其中,PDE 单位:mg/day ;NOEL(LOEL)单位:mg/Kg/day 。 当我们查询到一些低沸点的溶剂的NOEL 时,其单位可能是ppm ,此时,我们该如何计算化合物的接触限度呢? 举例1:大鼠吸入四氯化碳(分子量153.84)生殖毒性资料显示其NOEL 值为300ppm ,应该如何计算四氯化碳的接触限度? 思路:将NOEL 单位由ppm 转换为mg/L 或者mg/m 3, 由:PV=nRT ,得: n V =P RT ,nM V =PM RT 即:300×10?6×atm ×153840mg ·mol ?10.082L×atm ×K ?1·mol ?1×298K =46.15mg 24.45L =1.89mg/L 举例2:雄性大鼠吸入四氢呋喃(分子量72.10),每日6h ,每周5天,生殖毒性资料显示其NOEL 值为200ppm ,应该如何计算四氢呋喃的接触限度?
医药中常用有机溶剂分类及残留限度
医药中常用有机溶剂分类及残留限度 医药中常用有机溶剂分类及残留限度 药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。 药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。药品还可被来自包装、运输、仓储中的有机溶剂污染。药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。 各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估): 第一类溶剂 是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。在可能的情况下,应避免使用这类溶剂。如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如: 苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。 第二类溶剂 是指无基因毒性但有动物致癌性的溶剂。按每日用药10克计算的每日允许接触量如下: 2-甲氧基乙醇(50ppm)、氯仿(60ppm)、1,1,2-三氯乙烯(80ppm)、1,2-二甲氧基乙烷(100ppm)、1,2,3,4-四氢化萘(100ppm)、2-乙氧基乙醇(160ppm)、环丁砜(160ppm)、嘧啶(200ppm)、甲酰胺(220ppm)、正己烷(290ppm)、氯苯 (360ppm)、二氧杂环己烷(380ppm)、乙腈(410ppm)、二氯甲烷(600ppm)、乙烯基乙二醇(620ppm)、N,N-二甲基甲酰胺 (880ppm)、甲苯(890ppm)、N,N-二甲基乙酰胺(1090ppm)、甲
残留溶剂检查方法的选择和验证要点 一、概述 药物中的残留溶剂系指在原料药或辅料的生产中,以及制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。 按有机溶剂的毒性和对环境的危害,ICH将有机溶剂分为避免使用、限制使用、低毒和毒性依据尚不足四种情况。 因残留溶剂会影响产品的安全性,故需对其进行研究。 二、残留溶剂检查方法的选择 残留溶剂的测定一般采用气相色谱法,推荐使用毛细管色谱柱-顶空进样系统,当然也可以使用普通填充柱,溶液直接进样方法。 对不宜采用气相色谱法测定的含氮碱性化合物,如N-甲基吡咯烷酮等可采用其它方法,如离子色谱法等。 测定残留溶剂应从以下几个方面考虑:确定被测的有机溶剂、选择合适的色谱柱、制备供试品溶液和对照品溶液、选择合适的进样方法和满足检测灵敏度要求的检测器,下面分别进行介绍: 1、确定被测的有机溶剂 根据制备工艺确定被测有机溶剂的范围。通常应对制备工艺过程中使用的二类以上溶剂和重结晶用溶剂,以及根据工艺特点要求的其它溶剂进行残留量的研究。建议对合成最后三步使用的三类溶剂也进行研究,这样能更好地对未知峰进行归属;对制剂过程中使用的有机溶剂也建议考察其残留情况,特别是缓、控释微丸包衣过程使用的有机溶剂更应引起注意。 残留溶剂的限度要求同ICH的规定。 2、选择合适的色谱柱 按照相似相溶的原理选择色谱柱。毛细管柱有极性柱、非极性柱、弱极性柱和中等极性柱。填充柱有高分子多孔小球或涂渍适宜固定液的填充柱。 测定含氮的碱性有机溶剂时,由于普通气相色谱仪的不锈钢管路、进样器衬管等对有机胺等含氮的碱性化合物具有较强的吸附作用,致使其检出的灵敏度降低。通常采用弱极性色谱柱或经碱处理过的色谱柱分析含氮的碱性有机溶剂,如果采用胺分析专用柱进行分析,则效果更好。 3、供试品和对照品的制备 顶空进样方法通常以水为溶剂,对于非水溶性的药物,可采用DMF、DMSO或其他适宜溶剂。溶液直接进样方法用水或合适的溶剂溶解样品。 制备供试品的溶剂的选择应兼顾供试品和被测有机溶剂的溶解度,且所用溶剂应不干扰被测有机溶剂的测定。水是首选溶剂,特别是顶空进样系统。因为水中不含有机溶剂,故干扰较少,且在FID检测器上,以水为溶剂时,各残留溶剂的灵敏度最高。当药物不溶于水时,可加入适当的酸或碱以增加药物的溶解度,最好选用不挥发的酸或碱。以DMSO等为溶剂时,可加入一定量的水以增加检测的灵敏度,或用盐析的方法增加灵敏度。测定含氮的碱性溶剂时,供试品溶液应不呈酸性,以免被测物与酸反应后不易汽化。 对照品的制备方法应与供试品的制备方法相同。在申报资料中发现对照品(溶液)为直接进样,供试品则为固体直接顶空进样,供试品和对照品不但制备方法不同,而且进样方法和进样量也不同,无法进行比较。提请申报单位注意。 4、供试品溶液和对照品溶液浓度的确定 配制供试品溶液的浓度应满足定量测定的需要,一般供试品取样量在0.1~1g之间。限度检