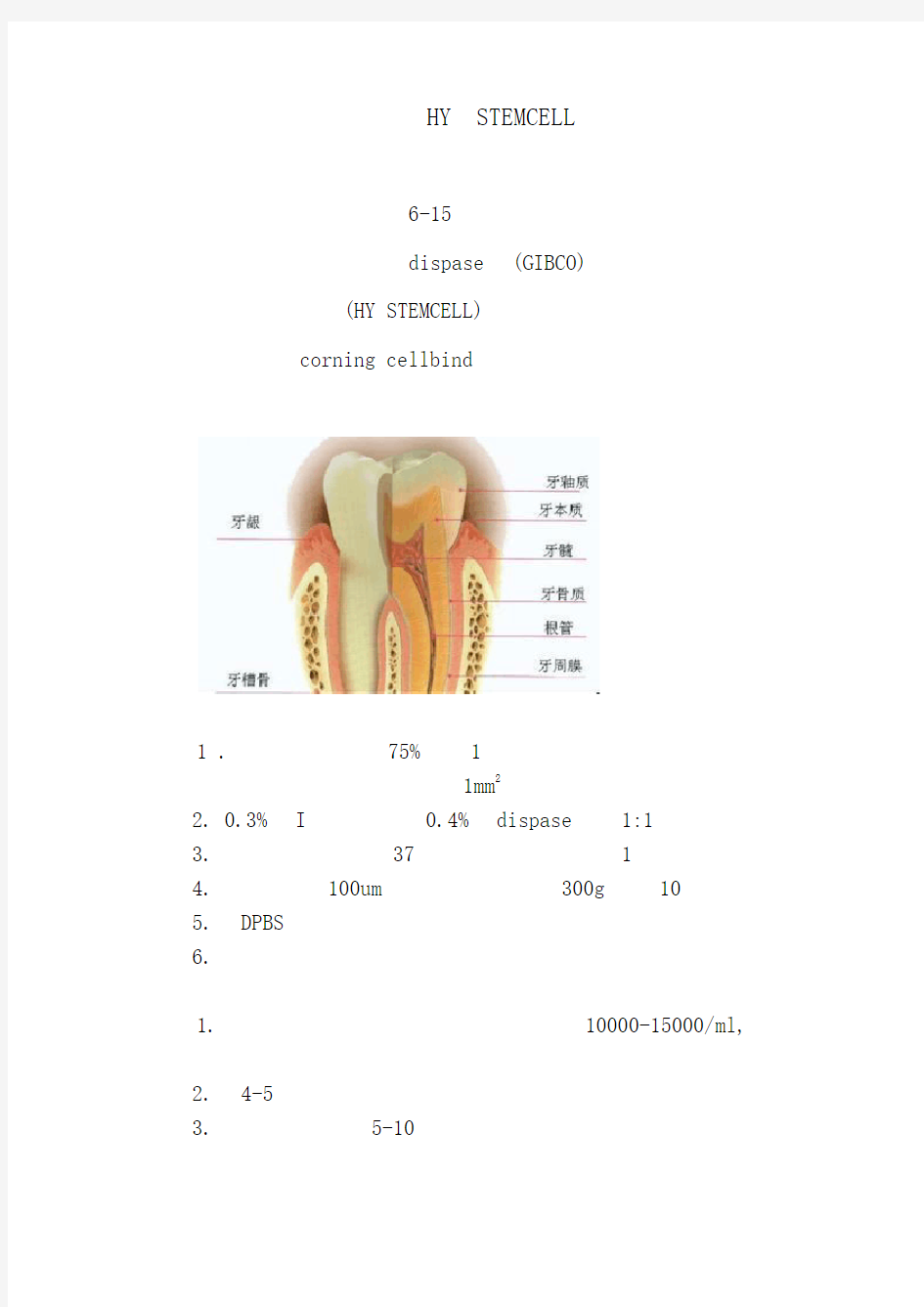

HY STEMCELL
6-15
dispase(GIBCO)
(HY STEMCELL)
corning cellbind
1 .75%1
1mm2
2. 0.3%I0.4%dispase1:1
3.371
4.100um300g10
5.DPBS
6.
1.10000-15000/ml,
2.4-5
3.5-10
4.80%
间充质干细胞培养方法 1、间充质干细胞MSC基本形态 2、干细胞应用与干细胞调控。 3、间充质干细胞MSC生长过程 4、间充质干细胞MSC培养得合适气体环境 5、细胞培养板得选择 7、如何维持培养液p H 6、如何选用细胞培养基? 8、血清与干细胞得培养?9、胎牛血清(F B S )就是否需要灭活?10、细胞得细菌、真菌污染及排除?11、细胞培养污染得预防 12、使用胰蛋白酶时加入 E DTA得目得就是什么 13、胶原酶得种类与选型?14、胶原酶V S胰酶?15、干细胞得种类与表面标记 16、间质干细胞培养原理概述? 17、间质干细胞成脂与成骨诱导分化?18、干细胞老化得表现 20、冷冻保护剂作用与选择? 21、细胞冻存指导 19、细胞传代消化过程指导? 与处理? 22、干细胞冷冻与复苏 23、移植细胞得基因修饰?1。间充质干细胞MSC基本形态?体外培养细胞根据它们在培养器皿就是否能贴附于支持物上生长特征,可分为贴附型生长细胞,常表现为成纤维型细胞与上皮细胞。悬浮型细胞在培养中悬浮生长.?间充质干细胞MSC基本形态:形态与成纤维细胞类似,细胞在支持物表面呈梭形或不规则三角形生长,细胞中央有卵圆形核,胞质向外伸出2-3厘米个长短不同得突起。可瞧到细胞成螺旋状生长。 ?2.干细胞应用与干细胞调控 干细胞得调控就是指给出适当得因子条件,对干细胞得增殖与分化进行调控,使之向指定得方向发?2、1内源性调控 展.? 干细胞自身有许多调控因子可对外界信号起反应从而调节其增殖与分化,包括调节细胞不对称分裂得蛋白,控制基因表达得核因子等。另外,干细胞在终末分化之前所进行得分裂次数也受到细胞内调控因子得制约。 (1)胞内蛋白对干细胞分裂得调控?干细胞分裂可能产生新得干细胞或分化得功能细胞。这种分化得不对称就是由于细胞本身成分得不均等分配与周围环境得作用造成得.细胞得结构蛋白,特别就是细胞骨架成分对细胞得发育非常重要。如在果蝇卵巢中,调控干细胞不对称分裂得就是一种称为收缩体得细胞器,包含有许多调节蛋白,如膜收缩蛋白与细胞周期素A。收缩体与纺锤体得结合决定了干细胞分裂得部位,从而把维持干细胞性状所必需得成分保留在子代干细胞中。?(2)转录因子得调控在脊椎动物中,转录因子对干细胞分化得调节非常重要。比如在胚胎干细胞得发生中,转录因子Oct 4就是必需得.Oct4 就是一种哺乳动物早期胚胎细胞表达得转录因子,它诱导表达得靶基因产物就是FGF—4等生长因子,能够通过生长因子得旁分泌作用调节干细胞以及周围滋养层得进一步分化。Oct4缺失突变得胚胎只能发育到囊胚期,其内部细胞不能发育成内层细胞团。另外白血病抑制因子(LIF)对培养得小鼠ES 细胞得自我更新有促进作用,而对人得成体干细胞无作用,说明不同种属间得转录调控就是不完全一致得。又如Tcf/Lef转录因子家族对上皮干细胞得分化非常重要.T cf/Lef就是Wnt 信号通路得中间介质,当与β-Catenin 形成转录复合物后,促使角质细胞转化为多能状态并分化为毛囊.? 2、2外源性调控 除内源性调控外,干细胞得分化还可受到其周围组织及细胞外基质等外源性因素得影响。?(1)分泌因子?间质细胞能够分泌许多因子,维持干细胞得增殖,分化与存活。有两类因子在不同组织甚至不同种属中都发挥重要作用,它们就是TGFβ家族与Wnt信号通路.比如TGF 家族中至少有两个成员能够调节神经嵴干细胞得分化。最近研究发现,胶质细胞衍生得神经营养因子(GDNF)不仅能够促进多
牙髓干细胞 1牙髓干细胞概念 牙髓组织位于牙齿内部的牙髓腔内,是牙体组织中唯一的软组织。2000年Gronthos[1]等通过对人牙髓细胞的研究,发现了一种与骨髓间充质干细胞有着极其相似的免疫表型及形成矿化结节能力的细胞,细胞中形态呈梭形,可自我更新和多向分化,有着较强的克隆能力。这些由牙髓组织中分离出的成纤维状细胞就称为牙髓干细胞(Dental Pulp Stem Cells,DPSCs)。现在普遍认为牙髓组织中具有形成细胞克隆能力和较强增殖能力的未分化间充质细胞即DPSCs[2]。 2牙源性干细胞 至今,已从人类牙齿相关组织中分离和鉴定出7种干细胞: (1)牙髓干细胞(dental pulp stem cell,DPSC)[1],来自恒牙牙髓;张巍巍等[3]以人牙髓干细胞为种子细胞与PLGA支架材料在体外进行复合培养,表明PLGA 有利于于牙髓干细胞的粘附与增值。Lindroos等[4]得到DPSC与其他间充质源性干细胞具有相似的表面标志物和骨相关性的标志物的结论,支持DPSC在硬组织再生方面的可能性。从成人第三磨牙牙髓中分离的DPSC在适宜的条件下可诱导分化为有功能活性的神经细胞,并在基因和蛋白水平表达神经组织专有的标志物[5],为治疗神经系统方面的疾病提供了新的途径。DPSCs不表达成牙本质细胞特征性蛋白DSP、DMP,则表明DP-SCs尚处于未分化状态[6]。我国学者通过对根髓和冠髓进行比较时发现:DPSCs 存在于全部牙髓之中,在根髓中的密度更高[7]。 (2)人类脱落乳牙牙髓干细胞(stem cell from the pulp of human exfoliated deciduous teeth, SHED),来自儿童脱落乳牙的牙髓;Miura等[8]研究发现,正常脱落的乳牙牙髓中的细胞经培养会表现出成纤维细胞样生长,其增殖率和群体倍增数均比骨髓基质干细胞(BMMSC)、DPSCs高,于是首次提出了SHED的概念。Shen YY等[9]发现SHED在体外培养过程中可以表达成骨细胞的标志,如RUNX-2、OCN、BSP,表明SHED在体外可以分化为成骨细胞;将SHED与人类牙齿切片复合后,在体外培养或是植入免疫缺陷小鼠皮下,均表达成牙本质细胞分化的标志( DSPP,DMP-1,MEPE)[10]。一系列实验表明SHED在体内只能诱导宿主细胞分化为成骨细胞[11],而其自身无法分化为成骨细胞,但在体外培养过程中却可以分化为成骨细胞。SHED 可能还具有参与机体的免疫调节等功能[12]。李丽文[13]等用不同密度接种培养DPSCs,计算细胞产量、倍增次数, 观察细胞形态、检查克隆形成率和钙结节形成能力的方法得到,1.5~3cells/cm2低密度接种培养DPSCs 有利于细胞快速扩增,扩增后的细胞保持较高的增殖和分化潜能。SHED 的增殖能力、克隆形成效率和钙结节形成能力均优于DPSCs。 (3)根尖乳头干细胞(stem cell from the apical papilla,SCAP)[14,15],来自牙根发育未完成的根尖乳头;Abe等[16]从人年轻第三磨牙根末端分离根尖周牙乳头,并采用酶消化法从中分离出细胞进行研究,结果发现这种细胞在低密度下培养时,
脐带间充质干细胞治疗技术的临床研究策略 脐带间充质干细胞(UCMSC )具备药品的“工厂化、规模化、标准化”生产特点,是目前“成药”性最高的成体干细胞(ASC )之一。UCMSC 还有广泛的生物效应,对各种损伤、退变和炎症性疾病的疗效明确,且具有免疫原性低、异体治疗无免疫排斥反应、临床应用的安全性高、无伦理限制等临床应用优势。UCMSC 的研究与应用受到了国内外研究者的广泛关注,已对其高效制备技术、体内生物学行为、临床疗效与机制及安全性进行了深入研究,解决了临床前关键技术和理论问题,进入了迈向临床验证的最后一公里,即将成为临床疾病治疗的新型“药物”和技术。但如何科学、合理、规范、循序渐进地推进UCMSC 向临床转化,是管理部门和研究者共同面临的问题。笔者在对UCMSC 进行系统性临床前研究的基础上,对UCMSC 治疗系统性损伤和自身免疫性疾病的临床技术及规范进行了探讨。 1 . UCMSC 治疗的临床适应证 UCMSC 制剂可在临床上用于涉及组织细胞损害(变性、坏死、缺失)、自身免疫和炎症反应引起的疾病的治疗,但在同种疾病的不同阶段、不同个体之间,疗效可能不尽相同,其原因在于UCMSC 来源、质量及临床实施方法的差异。根据UCMSC 的生物学特性及疾病治疗机制研究进展,UCMSC 的临床适应证主要有: (1)机械性创伤:包括武器、交通与意外伤害、自然灾害等导致的各种类型的组织器官损伤; (2)退变性疾病:如衰老、器官纤维化、骨质疏松、器官萎缩、动脉硬化等; (3)缺血性疾病:心脑血管意外、血管栓塞等; (4)中毒性疾病:如酒精、食物、药物、毒剂、环境等导致的肝、肾、神经中毒等; (5)自身免疫性疾病:系统性红斑狼疮,再生障碍性贫血、类风湿性关节炎、多发性硬化、自身免疫性肝病等; (6)炎症性疾病:慢性炎症、急性系统性炎症综合征等; (7)代谢性疾病:糖尿病、甲状腺功能异常、高血酯症、高血压等; (8)组织残缺性疾病:主要用于组织缺损的局部再生及人工组织构建与移植治疗。 总之,UCMSC 的适应范围很广,可通过多种机制发挥治疗作用,对并发多种疾病的患者有“一药治多病”的效应。
间充质干细胞培养方法 1. 间充质干细胞MSC基本形态 2. 干细胞应用与干细胞调控。 3. 间充质干细胞MSC生长过程 4. 间充质干细胞MSC培养的合适气体环境 5. 细胞培养板的选择 6. 如何选用细胞培养基 7. 如何维持培养液p H 8. 血清与干细胞的培养 9. 胎牛血清(F B S )是否需要灭活 10. 细胞的细菌、真菌污染及排除 11. 细胞培养污染的预防 12. 使用胰蛋白酶时加入E DTA的目的是什么 13. 胶原酶的种类和选型 14. 胶原酶V S胰酶 15. 干细胞的种类和表面标记 16. 间质干细胞培养原理概述 17. 间质干细胞成脂和成骨诱导分化 18. 干细胞老化的表现和处理 19. 细胞传代消化过程指导 20. 冷冻保护剂作用和选择 21. 细胞冻存指导 22. 干细胞冷冻和复 23. 移植细胞的基因修饰 1.间充质干细胞MSC基本形态 体外培养细胞根据它们在培养器皿是否能贴附于支持物上生长特征,可分为贴附型生长细胞,常表现为成纤维型细胞和上皮细胞。悬浮型细胞在培养中悬浮生长。 间充质干细胞MSC基本形态:形态与成纤维细胞类似,细胞在支持物表面呈梭形或不规则三角形生长,细胞中央有卵圆形核,胞质向外伸出2-3 厘米个长短不同的突起。可看到细胞成螺旋状生长。 2.干细胞应用与干细胞调控 干细胞的调控是指给出适当的因子条件,对干细胞的增殖和分化进行调控,使之向指定的方向发展。 2.1源性调控 干细胞自身有许多调控因子可对外界信号起反应从而调节其增殖和分化,包括调节细胞不对称分裂的蛋白,控制基因表达的核因子等。另外,干细胞在终末分化之前所进行的分裂次数也受到细胞调控因子的制约。 (1)胞蛋白对干细胞分裂的调控 干细胞分裂可能产生新的干细胞或分化的功能细胞。这种分化的不对称是由于细胞本身成分的不均等分配和周围环境的作用造成的。细胞的结构蛋白,特别是细胞骨架成分对细胞的发育非常重要。如在果蝇卵巢中,调控干细胞不对称分裂的是一种称为收缩体的细胞器,包含有许多调节蛋白,如膜收缩蛋白和细胞周期素A。收缩体与纺锤体的结合决定了干细胞分裂的部位,从而把维持干细胞性状所必需的成分保留在子代干细胞中。
间充质干细胞治疗小脑萎缩(山东干细胞网) 遗传性小脑共济失调,即遗传性小脑萎缩,是一组以共济运动障碍为突出表现的慢性进行性小脑变性疾病,发病年龄多在33—34岁,病情进行性加重。发病机理目前并不清楚,病变主要累及小脑,但脊髓、颅神经、基底节、脑干、大脑皮质等也可受累。遗传方式为常染色体显性遗传,因此,如果有本病家族史的人尽量不要生育。 患者:宋某,男性,40岁,患有遗传性小脑共济失调,即遗传性小脑萎缩。其具有明显的家族遗传性,其外公、姨、母亲、两个哥哥均患有该病。 入院时,患者口齿不清,行走经常跌倒 ,双手动作笨拙,症状逐渐加重,并出现双下肢无力,下蹲后不能自行站起。后经间充质干细胞移植成功治疗,基本恢复正常的生活。 目前采用的治疗方法是给予体外培养扩增的间充质干细注射,每周1次,共4次为一个疗程,同时给予系统功能锻炼。 干细胞治疗后在这位患者出院的时候,已经能行走稳健,未再出现跌倒情况,口齿清楚。后来,这位患者的两位哥哥也来做间充质干细胞治疗,恢复的效果也不错。 干细胞治疗重度颅脑外伤后遗症期 患者,男性,35岁。诊断:重度颅脑外伤后遗症期 重度颅脑外伤术后言语及肢体活动障碍8个月,拟行神经外科行颅骨修补和干细胞移植治疗。 干细胞移植治疗前: 四肢肌张力均高,以左侧为著,右上肢、右下肢活动较灵活,左侧肢体处于肌紧张状态,疼痛刺激后有屈曲。 影像学检查:双侧大脑见多发片状低密度区,CT值10-15Hu,边尚清。左侧侧脑室后部与左脑内低密度区贯通,脑内见引流管影。脑室系统略扩张,右侧脑室后角增大明显。右侧颅骨见巨大缺损区,左侧颅骨呈术后状态。[印象]双侧大脑多发软化灶、脑积水分流术后。 干细胞移植治疗后效果: 颅骨修补并干细胞脑内移植治疗后4天,患者左侧上肢肌张力明显降低,第二次干细胞移植后,次日患者左上肢肌张力进一步降低,左下肢肌力增强,达三级,屈伸自如(之前在强刺激下能才在水平面屈曲)。该患者再经过一阶段锻炼,有望下地行走。
(一)1.Sections of 8–10 cm of umbilical cords, which are routinely discarded, were internally washed with phosphate-buffered saline (PBS), supplemented with 3% penicillin/streptomycin (Invitrogen-Gibco, Grand Island, NY, https://www.doczj.com/doc/9b378889.html, ) and immediately immers ed in Dulbecco ’s modi fied Eagle ’s medium- low glucose (DMEM-LG; Invitrogen-Gibco) supplemented with 10% fetal bovine serum (FBS; Invitrogen-Gibco) and 3% penicillin/streptomycin (Invitrogen-Gibco). All samples were processed within 12 –15 h after collection. 2. UCs were fil led with 0.1% collagenase (Sigma-A ldrich, St. L oui s, https://www.doczj.com/doc/9b378889.html,/sigma-aldrich/home.h tml) in PBS and incuba ted at 37°C for 20 min. Each UC was washed wi th proli feration medium, and the detach ed cell s were harvested after gentl e mass age of the UC. Cells were centr ifuged at 300 g for 10 min, resus -pended in prolifera tion medium, and seeded in 25-cm^ 2 flasks at a densi ty of 5 × 10^7 cells per ml.After 24 h of incubation, non-adherent cells were removed, and culture medi um was replace d every 3 days. (二)HuMSCs were prepared as previously described.8 Wharton's jelly was processed within 24 hours of collection and cut into pieces of about 1 mm3 for culture. These pieces were placed in 24-well plates and cultured in DMEM supplemented with 10% fetal bovine serum (FBS), 5 ng/ml EGF, 5 ng/ml basic fibroblast growth factor, 100 U/ml penicillin and 100 mg/ml streptomycin, and 1 μg/ml amphoterin B. The culture plate was placed in an incubator with saturated humidity at about 37°C containing 5% (v/v) CO2. The medium was changed every three days and the cells were passaged when they reaching 70% confluence. Adherent cells were recovered by treatment with 0.25% trypsin for 3 to 5 minutes then centrifuged. (三) 脐带间充质干细胞的分离:脐带自手术台取下后,浸入含抗生素的生理盐水中,4 ℃保存,在操净台内取出脐带,用D-PBS冲洗净脐动脉和脐静脉内的残余血液,用止血钳和剪刀剔除上述血管,将脐带剪成1 mm^3大小的组织块后放入200 mL 蓝盖试剂瓶,加入质量/ 体积比为0.1%的Ⅱ型胶原酶30 mL,置于恒温振荡仪内持续消化6 h ,100 目筛网过滤收集细胞。加入D-Hank’s液冲洗细胞3 次,用含体积分数为10%胎牛血清的DMEM/F12重悬细胞,调整细胞密度为(4.8×10^3~1×10^4)/cm^2,接种于6 孔板内,于37 ℃、体积分数为5%的CO2孵箱内培养,24 h 后换液。 脐带间充质干细胞在不同培养体系中的体外扩增:待原代培养的脐带间充质干细胞贴壁后,在两个6 孔板中进行3 种培养体系的生长对比实验。第1 个6孔板中细胞密度为1×10^7 L^-1,采用连续适应法使细胞由原代培养时使用的DMEM/F12分别逐步过渡到低糖DMEM、MesenPRO RS?Medium 和STEMPRO?MSC SFM 3 种培养体系,即用含体积分数为10%胎牛血清的DMEM/F12培养基和相应的3种培养基按体积比1 ∶1 混合培养细胞,通过下列混合培养基的方式,连续几代减少当前培养基的量,即1 ∶2 ,1 ∶4 ,1 ∶16和100% 替代培养基,每次适应改变培养体系时,传代细胞一两次,其中孔 1 为原代培养时的DMEM/F12培养液,孔2为低糖DMEM,孔3 为MesenPRO RS?Medium ,孔4 为STEMPRO? MSC SFM。第2 个6孔板中细胞密度为2×10^7 L^-1,每孔培养液设置同上,目的是避免在不同时间消化传代间充质干细胞时出现实验操作上的误差。 (四)脐带间充质干细胞的体外分离培养 (1)脐带白手术台取下后,浸入含抗生素的0.9%生理盐水中,4"C保存; (2)在超净台内取出脐带,用生理盐水冲洗净脐动脉和脐静脉内的残余血液,用止血 钳和剪刀剔除上述血管,将脐带剪成1mm^3大小的组织块; (3)加入质量/体积比为0.1%的II型胶原酶至完全覆盖组织块,置于培养箱内持续消化
骨髓间充质干细胞的分离与培养 艾国平,粟永萍,闫国和,冉新泽,刘晓宏,罗成基,程天民(第三军医大学预防医学系防原医学教研室、全军复合伤研究所,重庆400038) 提要:目的摸索体外分离培养骨髓间充质干细胞的最佳条件,并观察其部分生物学活性。方法采用常规的细胞培养传代技术以及光、电镜技术和细胞增殖活性检测法,观察不同贴壁时间、不同浓度血清、不同种植密度对骨髓间充质干细胞生长、增殖、形态的影响,并观察培养细胞的部分生物学特性。结果以选用4~24h贴壁的有核细胞,加入5%~10%胎牛血清、种植密度(4~8)×104个/ml的培养条件为最适宜细胞生长;在此条件下,培养扩增的细胞仍具有干细胞多向分化性;其形态呈梭状,具有快速增殖的能力;培养细胞在3~4d进入对数生长期,随后进入平台期,分裂相细胞明显减少;光镜下细胞呈梭状或类成纤维状,2~10代的细胞呈均质状;超微结构显示为早期幼稚细胞形态。结论建立了骨髓间充质干细胞体外分离、培养的条件,探讨了骨髓间充质干细胞部分生物学特性,为进一步深入研究骨髓间充质干细胞的诱导分化和应用打下基础。 关键词:骨髓间充质干细胞;组织工程学 干细胞是近年来研究的热点,骨髓中除造血干细胞以外,还含有另一类干细胞—间充质干细胞(Mesenchymalstemcell,MSC),在不同的诱导条件下,具有向中胚层和神经外胚层组织细胞分化的能力,如向成骨细胞、成软骨细胞、脂肪细胞、成纤维细胞、内皮细胞、神经细胞及支持造血的基质细胞等分化的能力[1,2]。随着细胞工程学和组织工程学的发展,利用干细胞的多向分化性,选择合适的生物材料和有靶向性目的基因,已有报道MSC在骨、软骨、肌腱和神经胶质修复中的作用[3,4],国内在这方面的工作尚处于起步阶段。本实验旨在摸索体外分离培养骨髓间充质干细胞的最佳条件,为进一步研究骨髓间充质干细胞的诱导分化和应用打下基础。 1材料与方法 1.1骨髓MSC的分离从胸骨无菌抽取约1~2ml的骨髓,肝素化后,加入红细胞裂解液5ml,混匀,1200r/min,离心10min;弃上清,用0.01mol/L的PBS(pH7.2)洗2~3次,1200r/min,各离心10min;计数,以2×109/ml种入10%FBSα MEM培养基,青霉素100U/ml、链霉素100μg/ml,37℃,5%CO2孵箱中培养;不同时相点弃悬浮细胞,用0.01mol/LPBS(pH7.2)尽量轻轻洗去未贴壁的细胞,加入含10%FBSα MEM培养基。 1.2不同贴壁时间对MSC增殖的影响选用贴壁后1、2、3、4、6、8、12、24、48、72h的细胞进行传代培养,观察不同时间贴壁的细胞传代、增殖能力及形态学的变化。 1.3不同浓度胎牛血清(FBS)对MSC生长的影响细胞按4×104/ml种入96孔培养板中,分别加入以下FBS浓度的α MEM培养基:0%、1%、 2.5%、5%、7.5%、10%、12.5%、15%、17.5%、20%,每个浓度6孔;培养48h后,加入20μlMTT(5mg/ml二苯基四氮唑溴盐),37℃避光培养4h;尽量吸掉上清液,加入150μl二甲基亚砜,室温振荡10min,HT7000plus多孔读数仪490nm处读取D490值,以培养液作空白对照。 1.4比较不同种植密度对MSC生长的影响用含10%FBS的α MEM培养基;细胞按以下密度(×104/ml):0.3、0.6、1.0、 2.0、 3.0、 4.0、 5.0、 6.0、 7.0、 8.0、 9.0、10.0种入96孔培养板中,每一密度6孔;培养48h后,按上述方法测其D490值。 1.5培养细胞生长曲线细胞按0.5×104/ml种入24孔培养板,每孔培养液为1ml,每天取3孔测其D490值,连续测8d,绘出培养细胞生长曲线。 1.6培养细胞分裂指数曲线按检测细胞生长曲线的细胞密度接种于放有小盖玻片的24孔培养板中,每24h取出3块小玻片,连续8d;用95%酒精固定,HE染色、封片。对每一时间组细胞进行计数,算出1000个细胞中分裂相细胞的百分比。 1.7MSC的形态学观察在倒置显微镜下,直接观察第2、4、8代MSC的活体形态;并分别用光镜及透射电镜观察其形态结构。 1.8统计学分析用哈佛统计软件,进行单因素方差分析及均数间的显著性差异检验,用Microso
本刊特稿 1间充质干细胞及其临床应用中的几个问题☆郭子宽188《中国组织工程研究》杂志2012年投稿须知王莉莎,张楠,王蕾,赵萌11携带双报告基因真核表达载体pHSV1-TK-IRES2-EGFP 在小鼠骨髓间充质干细胞内的表达**★吴立川,杨昆,刘永哲,陈鹏,徐文贵175-乙炔基-2’ 脱氧尿嘧啶核苷标记大鼠骨髓间充质干细胞的有效性** ★史贵秀,孙丽华,张跃新22骨髓间充质干细胞条件培养液对H 2O 2损伤大鼠心肌细胞的保护★刘新宾,张红超,郭子宽27全骨髓直接贴壁分离人骨髓间充质干细胞的生物学特性****☆张颢,张斌,程梅,陶艳玲,扈江伟,徐曼,陈虎31人羊膜诱导人骨髓间充质干细胞向表皮样细胞的分化**☆撒亚莲,华映坤,高建梅,彭正国,董虹,严新民胚胎来源干细胞39CD271磁珠体外诱导人胚胎干细胞分化为成骨细胞的可行性*★江虹虹,张金丽,李付贵,王涛35胎源性非黏附骨髓基质细胞的特性*★肖龙艳,傅晋翔,张学光,陈秋,张宏,王盼君,孙谕,王明元,古彦铮脂肪来源干细胞51小鼠脂肪源干细胞分离培养和成骨诱导前后造血调控因子的表达**★郝丹,段显琳,毕晓娟,常相萍,马艳,曲建华,袁海龙,江明47小鼠脂肪干细胞的免疫原性及移植安全性*★ 梁爽,袁桂峰,钟毓娟,刘菁,陈森州 骨髓间充质干细胞的培养基国内外大量实验证明,通过长期培养后获得的骨髓间充质干细胞具有 非常广泛的分化潜能,形成的终末组 织包括脑、视网膜、肝、肠、脾、骨髓、血 液、皮肤、软骨等。一方面说明了骨髓 间充质干细胞具有跨胚层分化的能 力,另一方面说明在适当的培养环境 下,骨髓间充质干细胞能诱导向多种 细胞分化。 培养基是构成细胞体外培养环境 的重要因素,虽然基础培养基加少量 血清所配制的完全培养基可以满足大 部分细胞培养的要求,但对有些实验 却不适合,因此无血清培养基和无血 清培养成为当今细胞培养领域的一大 趋势。无血清培养基是不需要添加血 清就可以维持细胞在体外较长时间生 长繁殖的合成培养基。其工作基础是 用合适的激素、营养物和促贴壁物质 的组合置换培养基中的成分,在某些 培养方案中,细胞直接进入无血清培 养,可以消除来自血清的不均一性。 尽管无血清培养基是有化学限定 性的,但在培养过程中它仍有变动,培 养起始时可能有些物质缺乏,而后细 胞的产物可能积累,从而使培养基的 成分改变,这其实是有另一方面的好 处,即条件培养基的形成。条件培养基 是已经培养过某种细胞的培养液(内 含该细胞分泌的活性物质,包括少量 生长因子)与一定比例新鲜培养液混 合的培养液,其促分化作用与分泌的 细胞因子和生长因子密切相关。 目前关于间充质干细胞培养基的 专门研究并不多见,本期专题介绍的 10篇文章,主要观察无血清培养基及 条件培养基等培养条件对骨髓间充质 干细胞扩增与分化的影响,可供同道 研究者借鉴。更多内容详见本期102 页。Chinese Journal of Tissue Engineering Research 2012 ZHONGGUO ZUZHI GONGCHENG YANJIU 中国组织工程研究(原《中国组织工程研究与临床康复》)Http://www.CRTER.org Http://www.zglckf.com 周刊1997年1月创刊(总第521期)第16卷第1期2012年1月1日出版目次 骨髓来源干细胞研究与报告本期专题坚持“创新,科学,严谨,规范”的刊社精神,坚持创办“国际化、精品化、数字化”及学科专家喜欢阅读的专业期刊。高质量:每篇稿件均需小同行专家审稿1个月;高效率:优秀稿件3-4个月、一般稿件6个月出版。多元化:提供向SCI 收录杂志投稿的选刊建议和地道的语言翻译和润色服务等专业项目,详见https://www.doczj.com/doc/9b378889.html, 。
牙髓间充质干细胞生产 I.目的:建立牙髓间充质干细胞制品生产规程。 II.范围:适用于牙髓间充质干细胞的生产;适用于技术部和各中心技术组的所有技术人员。 III.职责: 1.生产主管负责本制度的执行和监督; 2.技术组的所有技术人员要严格按照本流程的要求进行操作; 3.监督员负责全程监督,并即时按要求填写《牙髓间充质干细胞生产记录》和《生产试剂耗材记录表》。 附表1 牙髓/骨髓/脂肪/胎盘/脐带间充质干细胞生产记录 附表2 生产试剂耗材记录表 IV.规程: 一、牙髓间充质干细胞原代操作 消化法: 1.仪器耗材 1)10ml移液管 2)培养皿 3)50ml离心管 4)100μm筛网 5)T75培养瓶 6)15ml离心管 2.试剂 1)生理盐水 2)培养基 3)胶原酶 3. 酶消化法操作流程 3.1 将浸在含1%双抗的生理盐水中的牙齿取出,吸取运输液4ml交给质检,并填写《样本取样单》,牙齿置于75%酒精中浸泡30min; 3.2 取出牙齿在含10ml生理盐水的培养皿中清洗2-3遍,用止血钳固定牙冠,
持骨钳夹碎牙根部,暴露出牙髓,用镊子取出牙髓并放入含有适量生理盐水的培养皿中; 3.3 用剪刀将牙髓组织块剪碎成1mm3,转移到50ml离心管中,加入生理盐水至30ml,再加入10ml 0.2%胶原酶; 3.4 置于37℃恒温摇床,180rmp消化30min ; 3.5 用100μm滤网过滤; 3.6 1200 rpm离心10min ,吸取洗涤液4ml交给质检,并填写《样本取样单》;附表3 样本取样单 3.7 弃剩余上清,调整细胞浓度为107/ml,置于75cm2培养瓶中,放入37℃,CO 2培养箱中进行培养。 4. 组织块法操作流程: 4.1 将浸在含1%双抗的生理盐水中的牙齿取出,吸取运输液4ml交给质检,并填写《样本取样单》,牙齿置于75%酒精中浸泡30min; 4.2 取出牙齿在含10ml生理盐水的培养皿中清洗2-3遍,用止血钳固定牙冠,持骨钳夹碎牙根部,暴露出牙髓,用镊子取出牙髓并放入含有适量生理盐水的培养皿中; 4.3 用剪刀将牙髓组织块剪碎成1mm3,将组织块均匀铺到T25培养瓶(用适量FBS润湿瓶底)瓶底; 4.6 倒置培养瓶,并加入5ml培养基,放入培养箱中培养; 4.7 12-24h后,将培养瓶轻轻翻转,将牙髓组织块浸入工作液中。 二、牙髓间充质干细胞换液 1.耗材 1)10ml移液管 2)15ml离心管 2.试剂 培养基 3. 操作流程 3.1 镜下观察状态细胞; 3.2 吸取上清液4ml交给质检,并填写《样本取样单》; 3.3 吸取上清液于50ml离心管中留作精华液(原代培养上清不留),并补充新的
1.间充质干细胞MSC基本形态 体外培养细胞根据它们在培养器皿是否能贴附于支持物上生长特征,可分为贴附型生长细胞,常表现为成纤维型细胞和上皮细胞。悬浮型细胞在培养中悬浮生长。 间充质干细胞MSC基本形态:形态与成纤维细胞类似,细胞在支持物表面呈梭形或不规则三角形生长,细胞中央有卵圆形核,胞质向外伸出2-3 厘米个长短不同的突起。可看到细胞成螺旋状生长。 2.干细胞应用与干细胞调控 干细胞的调控是指给出适当的因子条件,对干细胞的增殖和分化进行调控,使之向指定的方向发展。 2.1内源性调控 干细胞自身有许多调控因子可对外界信号起反应从而调节其增殖和分化,包括调节细胞不对称分裂的蛋白,控制基因表达的核因子等。另外,干细胞在终末分化之前所进行的分裂次数也受到细胞内调控因子的制约。 (1)胞内蛋白对干细胞分裂的调控 干细胞分裂可能产生新的干细胞或分化的功能细胞。这种分化的不对称是由于细胞本身成分的不均等分配和周围环境的作用造成的。细胞的结构蛋白,特别是细胞骨架成分对细胞的发育非常重要。如在果蝇卵巢中,调控干细胞不对称分裂的是一种称为收缩体的细胞器,包含有许多调节蛋白,如膜收缩蛋白和细胞周期素A。收缩体与纺锤体的结合决定了干细胞分裂的部位,从而把维持干细胞性状所必需的成分保留在子代干细胞中。 (2)转录因子的调控 在脊椎动物中,转录因子对干细胞分化的调节非常重要。比如在胚胎干细胞的发生中,转录因子Oct4 是必需的。Oct4 是一种哺乳动物早期胚胎细胞表达的转录因子,它诱导表达的靶基因产物是FGF-4 等生长因子,能够通过生长因子的旁分泌作用调节干细胞以及周围滋养层的进一步分化。Oct4 缺失突变的胚胎只能发育到囊胚期,其内部细胞不能发育成内层细胞团。另外白血病抑制因子(LIF)对培养的小鼠ES 细胞的自我更新有促进作用,而对人的成体干细胞无作用,说明不同种属间的转录调控是不完全一致的。又如Tcf/Lef 转录因子家族对上皮干细胞的分化非常重要。Tcf/Lef 是Wnt 信号通路的中间介质,当与 β-Catenin 形成转录复合物后,促使角质细胞转化为多能状态并分化为毛囊。 2.2外源性调控 除内源性调控外,干细胞的分化还可受到其周围组织及细胞外基质等外源性因素的影响。 (1)分泌因子 间质细胞能够分泌许多因子,维持干细胞的增殖,分化和存活。有两类因子在不同组织甚至不同种属中都发挥重要作用,它们是TGFβ家族和Wnt 信号通路。比如TGF 家族中至少有两个成员能够调节神经嵴干细胞的分化。最近研究发现,胶质细胞衍生的神经营养因子(GDNF)不仅能够促进多种神经元的存活和分化,还对精原细胞的再生和分化有决定作用。GDNF 缺失的小鼠表现为干细胞数量的减少,而GDNF的过度表达导致未分化的精原细胞的累积。Wnts 的作用机制是通过阻止β-Catenin 分解从而激活Tcf/Lef 介导的转录,促进干细胞的分化。比如在线虫卵裂球的分裂中,邻近细胞诱导的Wnt 信号通路能够控制纺锤体的起始点和内胚层的分化。 (2)膜蛋白介导的细胞间的相互作用 有些信号是通过细胞-细胞的直接接触起作用的。β-Catenin 就是一种介导细胞粘附连接的结构成分。除此之外,穿膜蛋白Notch 及其配体Delta 或Jagged 也对干细胞分化有重要影响。在果蝇的感觉器官前
牙髓间充质干细胞生产 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
牙髓间充质干细胞生产 I.目的:建立牙髓间充质干细胞制品生产规程。 II.范围:适用于牙髓间充质干细胞的生产;适用于技术部和各中心技术组的所有技术人员。 III.职责: 1.生产主管负责本制度的执行和监督; 2.技术组的所有技术人员要严格按照本流程的要求进行操作; 3.监督员负责全程监督,并即时按要求填写《牙髓间充质干细胞生产记录》和《生产试剂耗材记录表》。 附表1牙髓/骨髓/脂肪/胎盘/脐带间充质干细胞生产记录 附表2生产试剂耗材记录表 IV.规程: 一、牙髓间充质干细胞原代操作 消化法: 1.仪器耗材 1)10ml移液管 2)培养皿 3)50ml离心管 4)100μm筛网 5)T75培养瓶 6)15ml离心管 2.试剂 1)生理盐水 2)培养基 3)胶原酶 3.酶消化法操作流程 将浸在含1%双抗的生理盐水中的牙齿取出,吸取运输液4ml交给质检,并填写《样本取样单》,牙齿置于75%酒精中浸泡30min;
取出牙齿在含10ml生理盐水的培养皿中清洗2-3遍,用止血钳固定牙冠,持骨钳夹碎牙根部,暴露出牙髓,用镊子取出牙髓并放入含有适量生理盐水的培养皿中; 用剪刀将牙髓组织块剪碎成1mm3,转移到50ml离心管中,加入生理盐水至 30ml,再加入%胶原酶; 置于37℃恒温摇床,180rmp消化30min; 用100μm滤网过滤; 离心10min,吸取洗涤液4ml交给质检,并填写《样本取样单》; 附表3样本取样单 培养弃剩余上清,调整细胞浓度为107/ml,置于75cm2培养瓶中,放入37℃,CO 2 箱中进行培养。 4.组织块法操作流程: 将浸在含1%双抗的生理盐水中的牙齿取出,吸取运输液4ml交给质检,并填写《样本取样单》,牙齿置于75%酒精中浸泡30min; 取出牙齿在含10ml生理盐水的培养皿中清洗2-3遍,用止血钳固定牙冠,持骨钳夹碎牙根部,暴露出牙髓,用镊子取出牙髓并放入含有适量生理盐水的培养皿中; 用剪刀将牙髓组织块剪碎成1mm3,将组织块均匀铺到T25培养瓶(用适量FBS 润湿瓶底)瓶底; 倒置培养瓶,并加入5ml培养基,放入培养箱中培养; 后,将培养瓶轻轻翻转,将牙髓组织块浸入工作液中。 二、牙髓间充质干细胞换液 1.耗材 1)10ml移液管 2)15ml离心管 2.试剂 培养基 3.操作流程 镜下观察状态细胞; 吸取上清液4ml交给质检,并填写《样本取样单》;
文章编号(Article ID):1009-2137(2005)01-0158-06?综述?间充质干细胞在免疫治疗中的应用 廖联明,韩钦,赵春华 中国医学科学院基础医学研究所,北京,100730 摘要 近年来对间充质干细胞的研究越来越多,对于间充质干细胞的自我更新和体外扩增的能力及其多向分化的潜能已经被广泛认识。同时,间充质干细胞还具备低免疫原性以及免疫调节活性,使其非常适合用于细胞治疗。目前对间充质干细胞发挥免疫调节的作用机制还不完全了解。本文综述了间充质干细胞免疫调节机制的研究现状及其在免疫治疗中的应用前景。 关键词 间充质干细胞;免疫调节;免疫耐受 中图分类号 R39214;R730.51文献标识码 A Application of Mesenchymal Stem Cell in Immunotherapy———Review L IA O L ian2M i ng,HA N Qi n,ZHA O Chun2Hua Instit nte of Basic Medical Sciences,Chi nese Academy of Medical Sciences,Beiji ng100730,Chi na Abstract There has been an increasing interest in recent years on mesenchymal stem cell(MSC).It is well known that MSCs are capable of self2renewal and differentiating into many cell lineages.MSC can be expended to a large quantity that is required for clinical trans plantation.Recent studies show that MSC have potential application in immune diseases due to their unique immunologic characteristics,such as low immunogenicity and immunoregulatory function.But their immunoregulatory mechanism is not yet clear.This review discusses the advances in researches on the mechanism of MSCs′immunoregulatory function and potential clinical application in immune disease and organ transplantation. K ey w ords Mesenchymal stem cell;immune regulation;immune tolerance J Ex p Hem atol2005;13(1):158-163 免疫抑制剂在器官移植和自身免疫性疾病的临床治疗中起着举足轻重的作用。但是,免疫抑制剂的副作用,包括免疫抑制引起的感染、肿瘤发生率增加等,也一直困扰着临床医生。在器官移植中,诱导受者对异基因移植物的特异性免疫耐受,减少、甚至完全不用免疫抑制剂,一直是免疫学家和临床医生的一个梦想。这是理论上解决异基因移植排斥,骨髓移植中移植物抗宿主病等临床问题的最佳方案。 在器官或组织移植中,稳定嵌合与特异性耐受诱导密切相关1。已有报道,骨髓干细胞移植后在受者体内可检测到稳定的造血系嵌合,并能诱导对供者的特异性耐受2-4。但骨髓移植前预处理的毒性、移植失败的风险和移植后出现的急、慢性移植物抗宿主病等问题,使骨髓移植仍然局限于恶性肿瘤或严重免疫系统疾病的患者,不适合用于特异性免疫耐受的诱导。最近报道,在未作任何预处理的大鼠中,胚胎样干细胞移植后在其体内可建立造血嵌合,并能诱导对随后相同供者来源的心脏移植物的特异耐受5。这一发现对寻找理想的免疫耐受诱导方法的研究者是一个很大的鼓舞。但是,胚胎干细胞存在众所周知的伦理问题和导致胚胎瘤的潜在危险。因此,在器官移植特异性耐受诱导方面,除了骨髓干细胞和胚胎干细胞以外,寻找一个新的细胞群体是非常必需的。最近,我们以及其他实验室都观察到骨髓源的间充质干细胞(mesenchymal stem cell,MSC)具有免疫调节活性。在小鼠6和灵长类动物7中,输注MSC可以延长异基因皮肤移植物的存活。在造血系统恶性肿瘤患者接受骨髓干细胞移植的同时输注供者来源的MSC,观察到MSC移植组的移植物抗宿主病(GV HD)发生率明显低于未移植MSC组8。另一研究小组也报道了相近的实验结果9。虽然结果还只是初步的,但为MSC的免疫调节特性提供了直接的证据。目前,MSC对免疫系统影响还并不十分清楚,它们潜在的临床应用价值,包括诱导异基因移植物耐受和免疫调节作用,还有待于进一步的研究。 通讯作者:赵春华,教授,博士,组织工程中心主任.电话:(086)22-27210060.传真:(086)22-27210060.E2mail:chunhuaz@public. https://www.doczj.com/doc/9b378889.html, 2003-11-26收稿;2004-09-01接受 ? 8 5 1 ?中国实验血液学杂志 Journal of Ex perimental Hem atology2005;13(1):158-163
牙髓干细胞向神经细胞方向的诱导分化实验 贺慧霞;金岩;史俊南;罗玉庆;周艳妮;彭智;许玉和 【期刊名称】《华西口腔医学杂志》 【年(卷),期】2007(025)004 【摘要】目的探讨克隆化培养分离的人牙髓干细胞是否具有向神经细胞方向分化的潜能,并确定其诱导条件.方法克隆化培养的人牙髓干细胞预诱导24 h,然后换含一定浓度二甲基亚砜(DMSO)、丁羟基茴香醚(BHA)、forskolin、β-巯基乙醇(β-ME)和氢化可的松(hydrocortisone)的联合诱导液连续诱导4 d,对诱导细胞进行形态学观察,神经胶质酸性蛋白(GFAP)、非特异性酯酶(NSE)免疫组化染色和GFAP mRNA RT-PCR检测.同时,以未诱导细胞为对照.结果诱导12 h 时细胞形态开始改变,24 h时分化为较为典型的神经细胞样细胞,继续诱导分化细胞数量增多;诱导细胞表达神经元细胞特异性标志NSE和GFAP蛋白;RT-PCR 检测诱导细胞表达GFAP mRNA,而未诱导细胞均无上述改变和表达.结论人牙髓干细胞在一定的诱导条件下可横向分化为神经元样细胞. 【总页数】4页(331-334) 【关键词】牙髓干细胞;诱导;分化 【作者】贺慧霞;金岩;史俊南;罗玉庆;周艳妮;彭智;许玉和 【作者单位】第四军医大学口腔医院病理科,组织工程中心,陕西,西安,710032;武警甘肃总队医院,口腔科,甘肃,兰州,730050;第四军医大学口腔医院病理科,组织工程中心,陕西,西安,710032;第四军医大学口腔医院,牙体牙髓科,陕西,西安,710032;兰州军区临潼疗养院三区,门诊部,陕西,西安,710600;武警甘肃总队医院,口腔科,甘肃,兰州,730050;武警甘肃总队医院,口腔科,甘肃,兰州,730050;武