
西安市临潼区##中学2020-2021学年度上学期高二年级期中考试化学(理)试题
17小题,每小题3分,共51分,每小题只有一个
....选项符合题)
1.下列说法正确的是()
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应只能在加热的条件下才能进行
2.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中放热最少的是()
A.2A ( l ) + B ( l ) = 2C ( g ) ΔH1 B.2A ( g ) + B ( g ) = 2C ( g ) ΔH2
C.2A ( g ) + B ( g ) = 2C ( l ) ΔH3 D.2A ( l ) + B ( l ) = 2C ( l ) ΔH4
3.现有反应4NH3+5O2=4NO+6H2O,反应速率分别用v (NH3)、v (O2)、v (NO)、v (H2O)、
表示,其关系正确的是()
A.4v (NH3)=5(O2) B.4 v(NH3)=5 v(H2O)
C.4v(O2)=5 v(NO) D.4 v(NH3)=5 v(NO)
4.用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是()
A.对该反应体系加热B.滴加少量的CuSO4溶液
C.不用稀硫酸,改用98%浓硫酸D.不用铁片,改用铁粉
5.下列体系加压后,对化学反应速率没有影响的是()A.2SO2+O22SO3 B.CO+H2O(g)CO2+H2
.CO2+H2O H2CO3 D.H++OH-H2O
6.在一定条件下,发生CO(g)+NO2(g)CO2(g)+NO(g)ΔH <0的反
,达到平衡后,保持体积不变,降低温度,混合气体的颜色
.变深B.变浅C.不变D.无法判断
7.某反应2AB(g)C(g)+3D(g)在高温时能自发进行,其逆反应在低温时能自发进
ΔH、ΔS应为()
A.ΔH >0,ΔS>0 B.ΔH<0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH >0,ΔS<0
8.下列反应中,熵显著增加的反应是()
A.CO(g)+2H2(g)=CH3OH(g)
B.CaCO3+2HCl=CaCl2+CO2↑+H2O
C.C(s) +O2(g)=CO2(g)
D.2H2(g)+O2(g)=2H2O(l)
.在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间的关系
400℃和100℃下进行,所得曲线分别为Q与P,则正反应是
)
A. B C D
装
订
线
考
号
:
班
级
:
姓
名
:
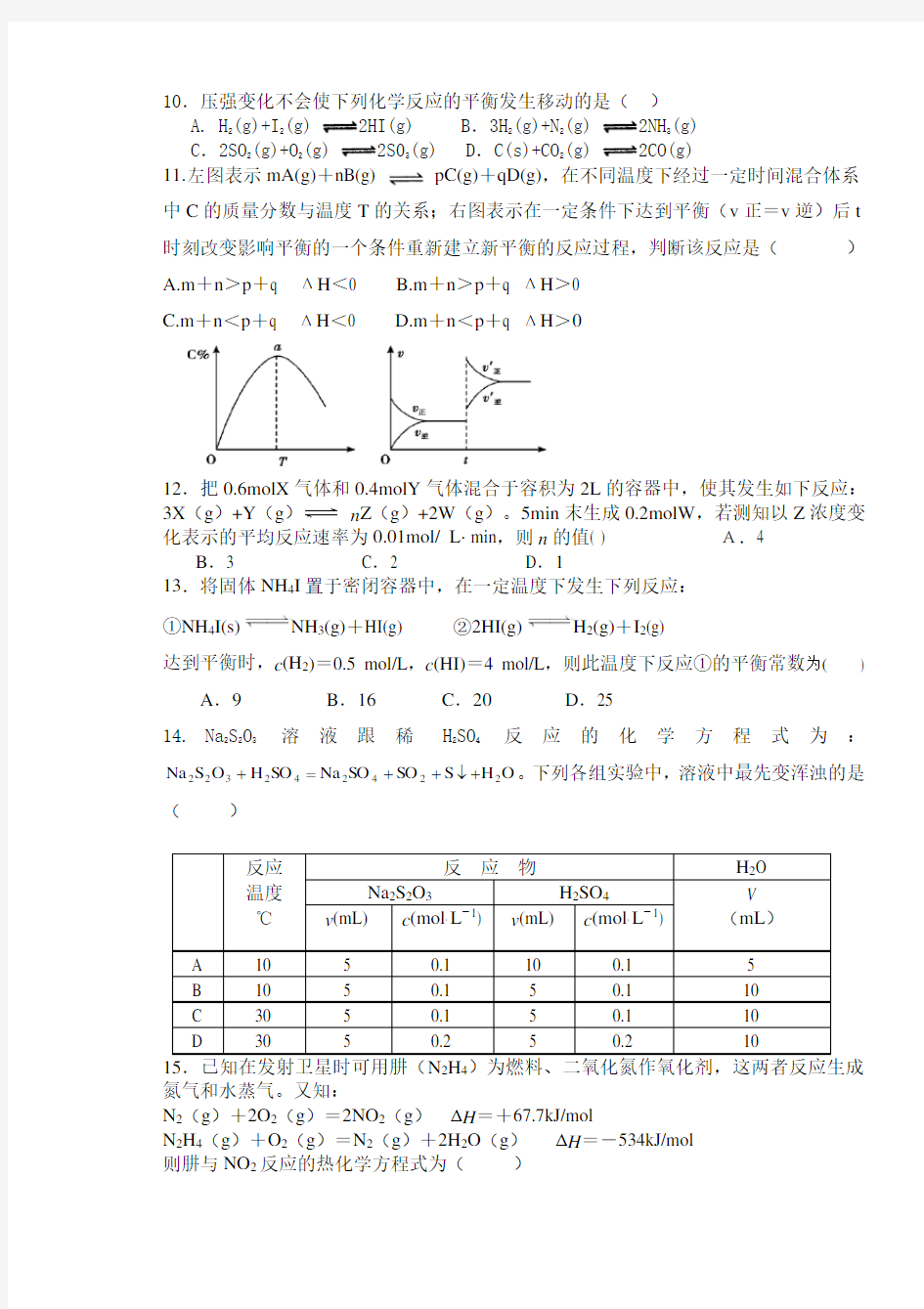
10.压强变化不会使下列化学反应的平衡发生移动的是( ) A. H 2(g)+I 2(g) 2HI(g) B .3H 2(g)+N 2(g) 2NH 3(g) C .2SO 2(g)+O 2(g) 2S03(g) D .C(s)+CO 2(g) 2CO(g) 11. 左图表示mA(g)+nB(g) pC(g)+qD(g),在不同温度下经过一定时间混合体系中C 的质量分数与温度T 的关系;右图表示在一定条件下达到平衡(v 正=v 逆)后t
时刻改变影响平衡的一个条件重新建立新平衡的反应过程,判断该反应是( ) A.m +n >p +q ΔH <0 B.m +n >p +q ΔH >0 C.m +n <p +q ΔH <0 D.m +n <p +q ΔH >0
12.把0.6molX 气体和0.4molY 气体混合于容积为2L 的容器中,使其发生如下反应:3X (g )+Y (g ) n Z (g )+2W (g )。5min 末生成0.2molW ,若测知以Z 浓度变化表示的平均反应速率为0.01mol/ L· min ,则n 的值( ) A.4 B .3 C .2 D .1
13.将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应: ①NH 4I(s)
NH 3(g)+HI(g) ②2HI(g)
H 2(g)+I 2(g)
达到平衡时,c (H 2)=0.5 mol/L ,c (HI)=4 mol/L ,则此温度下反应①的平衡常数为( )
A .9
B .16
C .20
D .25 14. Na 2S 2O 3
溶
液
跟
稀
H 2SO 4
反
应
的
化
学
方
程
式
为
:
O H S SO SO Na SO H O S Na 224242322+↓++=+。下列各组实验中,溶液中最先变浑浊的是
( ) 24氮气和水蒸气。又知:
N 2(g )+2O 2(g )=2NO 2(g ) ΔH =+67.7kJ/mol
N 2H 4(g )+O 2(g )=N 2(g )+2H 2O (g ) ΔH =-534kJ/mol 则肼与NO 2反应的热化学方程式为( )
反应 反 应 物
H 2O 温度 Na 2S 2O 3
H 2SO 4
V
℃
v (mL) c (mol ?L -1)
v (mL) c (mol ?L -1)
(mL )
A 10 5 0.1 10 0.1 5
B 10 5 0.1 5 0.1 10
C 30 5 0.1 5 0.1 10
D 30 5 0.2 5 0.2 10
A .N 2H 4(g )+NO 2(g )=2
3N 2(g )+2H 2O (g ) ΔH =+567.85kJ/mol
B .N 2H 4(g )+NO 2(g )=
23
N 2(g )+2H 2O (g ) ΔH =-567.85kJ/mol C .N 2H 4(g )+NO 2(g )=23
N 2(g )+2H 2O (l ) ΔH =+567.85kJ/mol
D .N 2H 4(g )+NO 2(g )=2
3
N 2(g )+2H 2O (l ) ΔH =-567.85kJ/mol
16.能提高单位体积内活化分子数,但不改变活化分子百分数的是( ) A .增大反应物的浓度 B .减少气体压强 C .升高温度 D .使用催化剂 17.反应2X(g)+Y(g) 2Z(g);△H <0。在不 同温度和压强下,产物Z 的物质的量(n 2)与反
应时间(t )的关系如图所示,下列判断正确的() A 、T 1<T 2,P 1<P 2 B 、T 1<T 2,P 1>P 2 C 、T 1>T 2,P 1>P 2 D 、T 1>T 2,P 1<P 2
二、非选择题(共49分)
18.(共7分)某温度时,在一个2L 的密闭容器中,X 、Y 、Z 三
种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:(1)该反应的化学方程式为_____________(2分) (2)反应开始至2min ,以气体Z 表示的平均反应速率为_____________(2分)。
(3)平衡时X 的转化率为___________(1分)。
(4)若X 、Y 、Z 均为气体,2min 后反应达到平衡,反应达平衡时:此时体系内压强是开始时压强的______倍(2分)。
19.(每空2分,共12分)下表是稀硫酸与某金属反应的实验数据:
实验
序号 金属
质量/g 金属状态
c (H 2SO 4) /mol·L -1
V (H 2SO 4) /mL 溶液温度/℃ 金属消失的时间/s 反应前 反应后 1 0.10 丝 0.5 50 20 34 500 2 0.10 粉末 0.5 50 20 35 50 3 0.10 丝 0.7 50 20 36 250 4 0.10 丝 0.8 50 20 35 200 5 0.10 粉末 0.8 50 20 36 25 6 0.10 丝 1.0 50 20 35 125 7 0.10 丝 1.0 50 35 50 50 8 0.10 丝 1.1 50 20 34 100 9
0.10
丝
1.1
50
20
44
40
(1)实验4和5表明, 对反应速率有影响, 反应速率越快(填影响因素),能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3
)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
20、(每空2分,共6分)为了提高煤热效率,同时减少煤燃烧时的环境污染,一般先将煤转化为洁净的燃料。将煤转化为水煤气是通过化学方法将煤转为洁净燃料的方法之一,主要化学反应为:C+H 2O =CO+H 2,
C(s)、CO(g)、H 2(g)燃烧的热化学方程式分别为: C(s)+ O 2(g)= CO 2(g) ΔH 1=―393.5 kJ/mol H 2(g)+2
1O 2(g)=H 2O(g) ΔH 2=―242.0 kJ/mol CO(g) +21 O 2 (g) = CO 2 (g) ΔH 3=-283.0kJ/mol
根据盖斯定律可得下列循环图: 试回答:(1)根据以上数据,请你写出C(s)与水蒸气反应的热化学方程 。 (2)比较反应热数据可知,1molCO(g)和1molH 2(g)完全燃烧放出的热量之和比1molC(g)完全燃烧放出的热量 (填“多”或“少”)。
(3)请你判断ΔH 1、ΔH 2、ΔH 3、ΔH 4之间的关系式 。
21、(每空2分,共14分)某科化学研小组研究在其他条件不变时,改变某一条件对反应化学平衡的影响[可用aA(g)+bB(g)cC(g)表示],得到如下图像(图中P 表示压强,n 表示物质的量,T 表示温度)
反应I 反应II 反应 III 反应IV 分析图像,回答下列问题:
(1)在图像反应I 中,若P 1
”或“<”或“=”),该正反应为 (填“吸热”或“放热”)反应。
(3)在图像反应III 中,T 2>T 1,则正反应为 (填“吸热”或“放热”)反应。 (4)在图像反应IV 中,T 1>T 2,则该反应是否能自发进行? (填“能”或“不能”)
22、(每空2分,共10分)
在一容积为2 L 的密闭容器内加入0.2 mol 的N 2和0.6 mol 的H 2,在一 定条件下发生如下反应:
C(s)+H 2O(g) + O 2(g)??
→??1
H CO 2(g) + H 2O(g) ΔH 4 CO(g) + O 2(g) +H 2(g)??→??2
H CO(g) + H 2O(g) +2
1O 2(g) ΔH 3
N2(g)+3H2(g)2NH3(g ) ΔH<0
反应中NH3的物质的量浓度的变化的
情况如下图:
(1)根据上图,计算从反应开始到平
衡时,平均反应速率v(NH3)为。
(2)该反应的化学平衡常数表达式K。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,
若改变反应温度,则NH3的物质的量浓度不可能为。
A.0.20 mol/L B.0.12 mol/L C.0.10 mol/L D.0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________(填“增大”、“减小”或“不变”)。
(3)__________(2分)
(4)__________(2分)
22、(每空2分,共10分)
(1)_______________________ (2分)(2)_____________________(2分)(3)_______________________ (2分)(4)_______________________(2分)
高二化学(理科)答案
题号 1 2 3 4 5 6 7 答案 C A C C D B A 题号8 9 10 11 12 13 14 答案 B A A A D C D 题号15 16 17
答案 B A C
二、非选择题(共5小题,共49分)
18、(7分)
(1)3X+Y2Z (2分)(2)0.05 mol·L-1·min-1(2分)(3)30% (1分)(4)0.9 (2分)
19、(共12分,每空2分)
(1)接触面积接触面积越大1、2
(2)3、4 或1、3或6、8
(3)温度6、7
20、(共6分,每空2分)
(1)C(s)+H2O(g)=CO(g)+H2(g) ΔH=131.5kJ/mol
(2)多
(3)ΔH 1=ΔH 2+ΔH 3+ΔH 4
21、(每空2分,共14分)
(1)放热a+b>c 低温
(2)T1>T2 放热(3)吸热(4)不能
22、(每空2分,共10分)
(1)0.025 mol/L·min
(2)略
(3)A、C
(4)向正反应方向不变
化学反应原理期末试题含答案 1.下列有关说法正确的是() A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 B.NH3(g)+HCl(g))=NH4Cl(s)室温下能自发进行,说明该反应的ΔH<0 C.N2(g)+3H2(g) 3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 D.水的离子积常数K w随着温度的升高而增大,说明水的电离是放热反应 2.下列说法正确的是 A.将纯水加热至较高温度,K w变大、pH变小、呈酸性 B.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 C.向0.1 mol〃L-1醋酸溶液中加入少量冰醋酸,溶液的pH减小,醋酸电离程度变大 D.等体积、pH都为3的酸HA和HB分别与足量的Zn反应,HA放出的H2多, 说明HA的酸性小于HB 3. 分析下列硫燃烧时的能量变化图,判断有关热 化学方程式和说法正确的是( ) A.S(s,单斜)+O2(g)===SO2(g) ΔH=+297.16 kJ〃mol-1 B.S(s,正交)===S(s,单斜) ΔH=-0.33 kJ〃mol-1 C.S(s,正交)+O2(g)===SO2(g) ΔH=-296.83 kJ〃mol-1 D.单斜硫的稳定性大于正交硫的稳定性 4. 在密闭容器中进行反应CH4(g)+H2CO(g)+3H2(g) ΔH>0,测得c(CH4)随 反应时间(t)的变化如图所示。下列判断中正确的是( ) A.10 min时,改变的外界条件可能是减小压强 B.0~5 min内,v(H2)=0.1 mol〃(L〃min)-1 C.恒温下,缩小容器体积,平衡后c(H2)减小 D.12 min时,反应达平衡时,气体的平均摩尔质量不 再变化 5. CH4-CO2催化重整反应为: CH4(g)+ CO2(g) = 2CO(g) + 2H2(g) 。 已知:①C(s)+2H2(g)=CH4(g) ΔH=-75 kJ〃mol?1 ②C(s)+O2(g)=CO2(g) ΔH=-394 kJ〃mol?1 ③C(s)+ 1/2O2(g)=CO(g) ΔH=-111 kJ〃mol?1 则该催化重整反应的ΔH等于 A.-580 kJ〃mol?1 B.247 kJ〃mol?1 C.208 kJ〃mol?1 D.-430kJ〃mol?1 6. 向某密闭容器中加入0.3 mol A、0.1 mol C 和一定量的B 三种气体,一定条件下 发生如下反应:3A(g) +2C(g),各物 质的浓度随时间变化如图所示[t0~t1阶段的 c(B)变化未画出]。下列说法中正确的是 A.若t1=15s, A 的浓度变化表示t0~t1阶段的 平均反应速率为0.09 mol〃L-1〃s-1 B.t0~t1阶段,此过程中容器放出a kJ热量,该 反应的热化学方程式为:3A(g) +2C(g) ΔH=-50a kJ〃mol-1
化学反应原理综合练习题 一、选择题 1.下列说法正确的是() A.反应热是指反应过程中放出的热量 B.1molH2SO4和1molBa(OH)2完全中和所放出的热量为中和热 C.相同条件下将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多D.物质发生化学变化都伴随着能量变化 2、用铂电极电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是() A、稀NaOH溶液 B、HCl溶液 C、NaCl溶液 D、酸性AgNO 3 3、用惰性电极电解下列溶液一段时间后,再加入一定量的某中纯净物(括号内物质),可使溶液恢复到原来的成分和浓度的是() A、AgNO3 (AgNO3) B、NaOH (NaOH) C、KCl (HCl) D、CuSO4 (Cu(OH)2) 4.已知31g红磷(P,固体)在氧气中燃烧生成P4O10固体放出738.5kJ热量,31g白磷(P4,固体)在氧气中燃烧生成P4O10固体放出745.8kJ热量。下列判断正确的是() A白磷在氧气中燃烧的热化学方程式P4(s)+5O2(g)=P4O10(s)△H=-745.8kJ·mol-1 B.红磷转化成白磷时放出热量 C.红磷比白磷稳定 D.31g红磷中蕴含的能量为738.5kJ 5.增大压强,对已达到平衡的下列反应产生的影响是()3X(g)+Y(g) 2Z(g)+2Q(s) A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 C.正、逆反应速率都增大,平衡向正反应方向移动 D.正、逆反应速率都没有变化,平衡不发生移动 6.在稀氨水中存在平衡:NH3·H2O NH4++OH-,要使用NH3·H2O和NH4+的浓度都增大,应采取的措施是( ) A.加NaOH溶液B.加NH4Cl固体C.加盐酸D.加NaCl溶液7.在密闭容器中,反应SO2+NO2NO+SO3(气),达到平衡后,若往容器中通入少量O2,此时将将会发生的变化是() A.容器内压强增大,平衡向正反应方向移动
高考化学化学反应原理综合考查-经典压轴题附详细答案 一、化学反应原理综合考查 1.过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为: CH3COOH(aq)+H2O2(aq)?CH3CO3H(aq)+H2O(l) △H=-13.7K J/mol (1)市售过氧乙酸的浓度一般不超过21%,原因是____ 。 (2)利用上述反应制备760 9 CH3CO3H,放出的热量为____kJ。 (3)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。 ①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间, v(CH3CO3H)=____ g/h(用含m的代数式表示)。 ②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是 _________。(写出2条)。 (4) SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40 nm和70 nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。 依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是______【答案】高浓度易爆炸(或不稳定,或易分解) 137 0.1m/6 温度升高,过氧乙酸分解;温度升高,过氧化氢分解,过氧化氢浓度下降,反应速率下降随着pH升高,SV-1的团簇粒径减小,与过氧化氢接触面积增大,反应速率加快 【解析】
初二(下)数学期中考试模拟试题 1、计算题(本大题共5小题,每小题4分,共20分) (1)解不等式组()314 2 1+15 2x x x x -<-???-+>?? ,并把解集在数轴上表示出来. (2)因式分解 32231212x x y xy -+ (3)因式分解 ()2 22224a b a b +- (4)化简 222x y xy x y y x x y --+-- (5 )解分式方程 11322x x x -=--- 2、(本题5分)化简求值:19)1(9 61222--?+÷++-a a a a a a ,其中27a =
3、(本题7分)如图,已知AD=,,2BC=3AC,B=40,D=110,a AC b =∠∠△ABC ∽△DAC (1)求AB 的长 (1)求DC 的长 (1)求BAD ∠的大小 4、(本题8分) 如图,ABC △中,D E 、分别是边BC AB 、的中点,AD CE 、相交于G . (1)求证:DE 1=AC 2 (2)求证:12 GD AG = 5、(本题6分)卫生活动中, “青年志愿队”决定义务清运一堆重达100吨的垃圾.开工后,附近居民主动参加到义务劳动中,使清运垃圾的速度比原计划提高了一倍,结果提前4小时完成任务,问“青年自愿队”原计划每小时清运多少吨垃圾? B A
6、(本题9分)李叔叔承包了50亩荒山.经过市场调查,预测水果上市后A种水果每年每亩可获利0.3万元,B种水果每年每亩可获利0.2万元,李叔叔决定在承包的山上种植 A、B两种水果.他了解到需要一次性投入的成本为:A种水果每亩1万元,B种水果每亩 0.9万元.设种植A种水果x亩,投入成本总共y万元. (1)求y与x之间的函数关系式; (2)若李叔叔在开发时投入的资金不超过47万元,为使总利润每年不少于11.8万元,应如何安排种植面积(亩数x取整数)?请写出获利最大的种植方案.
高二上学期教学检测题化学 第Ⅰ卷(选择题,共47分) 一、选择题(每题只有一项符合题意,每题2分,共14分) 1.下列物质中属于弱电解质的是() A.NH3B.BaSO4 C.CH3COOH D.CH3COONH4 2.下列溶液中导电性最强的是() A.5L 0.1mol / L NH3·H2O B.5L 0.1mol / L 盐酸 C.0.1L 0.1mol / L H3PO4溶液 D.0.1L 0.1mol / L Ba(OH)2溶液 3.能使水的电离平衡右移,且水溶液显酸性的微粒是( ) A.Al3+B.OH- C.H+D.HCO3- 4.已知:(1)Zn(s)+ 1/2O2(g)= ZnO(s),ΔH = -350 kJ·mol-1, (2)2Ag(s) + 1/2O2(g)= Ag2O(s),ΔH = -25 kJ·mol-1,则Zn(s)+ Ag2O(s) = ZnO(s) + 2Ag(s)的ΔH等于() A.-375 kJ·mol-1B.-325 kJ·mol-1 C.+375 kJ·mol-1D.+325 kJ·mol-1 5.下列有关问题,与盐的水解有关的是() ①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶 液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤Al2S3不能通过溶液中的反应制取 A.①②③B.②③④C.①④⑤D.①②③④⑤ 6.下列各组离子在溶液中能大量共存的是() A.Al3+、Na+、HCO3-、[Al(OH)4]- B.Ca2+、HCO3-、Cl-、K+
宁波高考化学专题题库∶化学反应原理的综合题 一、化学反应原理 1.为了证明化学反应有一定的限度,进行了如下探究活动: 步骤1:取8mL0.11mol L -?的KI 溶液于试管,滴加0.11mol L -?的FeCl 3溶液5~6滴,振荡; 请写出步骤1中发生的离子反应方程式:_________________ 步骤2:在上述试管中加入2mLCCl 4,充分振荡、静置; 步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.11mol L -?的KSCN 溶液5~6滴,振荡,未见溶液呈血红色。 探究的目的是通过检验Fe 3+,来验证是否有Fe 3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想: 猜想一:KI 溶液过量,Fe 3+完全转化为Fe 2+,溶液无Fe 3+ 猜想二:Fe 3+大部分转化为Fe 2+,使生成Fe (SCN )3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息: 信息一:乙醚比水轻且微溶于水,Fe (SCN )3在乙醚中的溶解度比在水中大。 信息二:Fe 3+可与46[()]Fe CN - 反应生成蓝色沉淀,用K 4[Fe (CN )6]溶液检验Fe 3+的灵敏度比用KSCN 更高。 结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A 、B 中,请将相关的实验操作、预期现象和结论填入下表空白处: 【答案】322222Fe I Fe I +-++=+ 若液体分层,上层液体呈血红色。 则“猜想一”不成立 在试管B 中滴加5-6滴K 4[Fe (CN )6]溶液,振荡 【解析】 【分析】 【详解】 (1) KI 溶液与FeCl 3溶液离子反应方程式322222Fe I Fe I +-++=+; (2)①由信息信息一可得:取萃取后的上层清液滴加2-3滴K 4[Fe (CN )6]溶液,产生蓝色沉淀,由信息二可得:往探究活动III 溶液中加入乙醚,充分振荡,乙醚层呈血红色,
2020-2021备战高考化学化学反应原理综合考查(大题培优 易错 难题)附答案 解析 一、化学反应原理综合考查 1.研究大气污染物SO 2、CH 3OH 与H 2O 之间的反应,有利于揭示雾霾的形成机理。 反应i :132241SO (g)+H O(g)=H SO (1)227.8kJ mol H -?=-? 反应ii :-133332CH OH(g)+SO (g)=CH OSO H(g)( ) -63.4kJ mol H ?=?硫酸氢甲酯 (1)CH 3OSO 3H 发生水解:332324CH OSO H(g)H O(g)CH OH(g)H SO (1)+=+△H=______kJ/mol 。 (2)T ℃时,反应ii 的CH 3OH(g)、SO 3(g)的初始浓度分别为 -8-1-9-1110mol L 210mol L ????、,平衡时SO 3转化率为0.04%,则K=_____________。 (3)我国科学家利用计算机模拟计算,分别研究反应ii 在无水和有水条件下的反应历程,如图所示,其中分子间的静电作用力用“…”表示。 ①分子间的静电作用力最强的是_____________(填“a ”、“b ”或“c ”)。 ②水将反应ii 的最高能垒由_____________eV 降为_____________eV 。 ③d 到f 转化的实质为质子转移,该过程断裂的化学键为____(填标号)。 A .CH 3OH 中的氢氧键 B .CH 3OH 中的碳氧键 C .H 2O 中的氢氧键 D .SO 3中的硫氧键 (4)分别研究大气中H 2O 、CH 3OH 的浓度对反应i 、反应ii 产物浓度的影响,结果如图所示。 ①当c(CH 3OH)大于10-11mol.L -1时,c(CH 3OH)越大,c(H 2SO 4)越小的原因是_____________。 ②当c(CH 3OH)小于10-11mol.L -1时,c(H 2O)越大,c(CH 3OSO 3H)越小的原因是_____________。 【答案】-164.4 4×104L· mol -1 a 20.93 6.62 ACD 反应i 和反应ii 为竞争反应,甲醇浓度增大,促进了甲醇和三氧化硫反应,抑制了三氧化硫和水的反应,硫酸的浓度减小 水的浓度越大,甲醇和三氧化硫碰撞几率越小,生成CH 3OSO 3H 越小,c(CH 3OSO 3H)越小 【解析】
七年级数学期中考试模拟试题 班级___________ 姓名______________ 分数_____________ 一、 选择题(30分) 1.下列各数中,最小.. 的数是 A .-2 B .-1 C .0 D .-π 2.-9的相反数是 A .(-3)2 B .-32 C .-33 D .(-3)3 3.在-32,-▏-2▏,(-1)3,-(-2),-4这五个数中,负数的个数是 A .1 个 B .2个 C .3个 D .4个 4.用四舍五入法按要求对5.01923分别取近似值,其中正确的是 A .5.0×105(精确到十分位) B .5.01(精确到百分位) C .5.02(精确到千分位) D .5.019(精确到0.001) 5.在-2,π,2a ,x +1, a xy 中,整式有 A .2个 B .3个 C .4个 D .5个 6.下列叙述中,错误.. 的是 A .-a 的系数是-1,次数是1 B .单项式ab 2c 3的系数是1,次数是5 C .2x -3是一次二项式 D .3x 2+xy -8是二次三项式 7.下列说法中正确的是 A .两个数的和必大于每一个加数 B .零减去一个数仍是这个数 C .零除以任何数都为零 D .互为相反数的两个数和为0 8.如果3)3(2=+-m x m 是关于x 的一元一次方程,则m 的值为 A .1 B .3 C .3或-3 D .-3 9.把一些图书分给某班学生,如果每人分3本,则余20本;如果每人分4本,则缺25本.设有x 名学生,则可列方程为( ) A .3x -20=4x +25 B .3x +20=4x -25 C .425320-=+x x D .4 25320+=-x x 10.a 、b 为任何非零有理数,则 ab ab b b a a ++的可能取值是 A .-3或1 B .3或1或-1 C .1或3 D .-1或3
题型1 化学反应原理综合试题解题策略 角度1化学能与热能、电能的相互转化综合判断与计算[题型解读]化学能与热能、电能的相互转化是高考的必考热点内容。试题形式常与能量图像,电化学装置图为背景进行综合考查,一般难度中档。 近几年高考的命题角度主要有①根据能量图像判断焓变ΔH;②结合盖斯定律进行ΔH计算或书写热化学方程式;③结合背景材料或装置图示进行原电池原理、电解原理的问题分析;④书写一定背景下的电极反应式;⑤一定条件的电化学计算等。预测2016年高考命题不会超出上述命题角度,特别是盖斯定律的应用和一定背景的电极反应式的书写仍会是命题的热点。 (1)(2015·菏泽一模)(3分)甲醇是重要的可再生燃料。已知在常温常压下: 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)ΔH=-1 275.6 kJ/mol 2CO(g)+O2(g)===2CO2(g)ΔH=-566.0 kJ/mol H2O(g)===H2O(l)ΔH=-44.0 kJ/mol 则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________________________________________。 (2)(2015·泰安二模)(19分)氧化还原反应与生产、生活、科技密切相关。请回答下列问题: ①银制器皿日久表面变黑是因为表面生成了Ag2S的缘故,该现象属于________腐蚀。如果加入一定浓度硝酸将发生反应3Ag2S+8HNO3===6AgNO3+3S↓+2NO↑+4H2O,同时Ag与硝酸反应生成AgNO3、NO、H2O,当生成22.4 mL的气体时,参加反应硝酸的物质的量为________。
2019年高考化学综合题分类练习卷:化学反应原理练习卷
化学反应原理练习卷 1.党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM 2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。 (1)汽车尾气中含有NO 和CO气体,可利用催化剂对CO、NO进行催化转化反应: 2CO(g) +2NO(g) N2(g) +2CO2(g) △H ①已知下列热化学方程式:N2(g) +O2(g) =2NO(g) △H1 = + 180.5kJ/mol,2C(s) +O2(g) =2CO(g) △H2=-2210kJ/mol ,C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol,则△H=_________。 ②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动 (填“向左”“向右”或“不”)。 (2)在相同温度下,两个体积均为1L 的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编 号起始物质的量 /mol 平衡物质的量 /mol N O C O N CO 2 CO2 I 0.2 0.2 0 0 a II 0.3 0.3 b 0.1 0.2 ①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。 ②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K 为________。 (3)汽车使用乙醇汽油并不能破少NO x的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO 催化转化进行研究。测得NO 转化为N 2的转化率随温度CO 混存量的变化情况如图所示。 ①在n(NO)/n(CO) =1条件下,最佳温度应控制在_______左右。 ②若不使用CO,温度超过775 K,发现NO的分解率降低,
化学反应原理大题练习 1.(16分)苯乙烯(C 6H 5CH =CH 2)是生产各种塑料的重要单体,其制备原理是: C 6H 5C 2H 5(g)C 6H 5CH =CH 2(g)+H 2 (g) △H =+125kJ·mol -1 (1)该反应的平衡常数表达式为K = __ _____________ 。随着温度的升高, K 值________(填“增大”、“减小”或“不变”,下同)。 (2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C 6H 5C 2H 5 的平衡转化率与水蒸气的用量、体系总压强关系如下图。 ①由上图可得出: 结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______; 结论二:__________________________________________________。 ②加入稀释剂能影响C 6H 5C 2H 5平衡转化率的原因是:_______________________。 (3)某些工艺中,在反应的中途加入O 2和特定的催化剂,有利于提高C 6H 5C 2H 5的平衡 转化率。试解释其原因:_______________________________________________。 2.(16分)科学研究发现纳米级的Cu 2O 可作为太阳光分解水的催化剂。 Ⅰ.四种制取Cu 2O 的方法 (a )用炭粉在高温条件下还原CuO 制备Cu 2O ; (b )用葡萄糖还原 悬浊液制备Cu 2O ; (c )电解法制备Cu 2O 。原理如右图所示,反应为:2Cu+H 2O=Cu 2O+H 2↑,则铜作为 极; (d )最新实验研究加热条件下用液态肼(N 2H 4)还原新制Cu(OH)2可制备纳米级Cu 2O , 同时放出N 2和水蒸气。该制法的化学方程式为 。 Ⅱ.用制得的Cu 2O 进行催化分解水的实验 平衡转化率/% 101kPa (900K ) 40 60 80 202kPa (900K ) n (H 2O) n (C 6H 5C 2H 5)
初一语文期中考试模拟试题 (分值:100分时间:120分钟) (一)33分 1.临摹下面这幅书法作品,尽量做到与其形体一致。(3分) 。 _________________________________ 2.用诗句或课文原文填空,其中(1)(2)分别写作者和篇名。(11分) (1)我寄愁心与明月,随君直到夜郎西。(_______《闻王昌龄左迁龙标遥有此寄》)(2)乡书何处达?归雁洛阳边。(王湾《_____________》)(3)黄河远上白云间,__________________。(王之涣《凉州词》)(4)__________________,蟋蟀们在这里弹琴。(鲁迅《从百草园到三味书屋》)(5)峨眉山月半轮秋,__________________。(李白《峨眉山月歌》)(6)__________________,落花时节又逢君。(杜甫《江南逢李龟年》)(7)遥怜故园菊,__________________。(岑参《行军九日思长安故园》)(8)____________,断肠人在天涯。(马致远《天净沙·秋思》)(9)转眼间,这学期已过去一半,不禁令人慨叹光阴易逝,正如《论语》中所说的:“__________________,__________________。” (10)“_____________________”,不错的,像母亲的手抚摸着你。(朱自清《春》)3.开学不久,为了让大家早点熟悉彼此,班上开了个关于交朋友的主题活动,下面是康棣华的部分自我介绍。 大家好!鄙人姓康名棣华。当初呢,我爸想给我起名单字“强”。可爷爷和他的想法有分qí,认为我爸性格粗犷,起名也太俗,于是想了很多文雅的名字,pái huái良久,才定下来。它来自于《诗经》里的句子:“常棣之华,鄂不韡韡。凡今之人,莫如兄弟。”希望我做个有担当的人,我的自豪感yóu然而生,好像我确实很有担当,你们看,不是吗?不过自豪主要在别人不会读我的名字。每当别人念错我的名字,我都会告之以正确的读音,还说:“棣字都不认识,看我知识多渊博!”。可是五年级的新班主任念对了,还问我这个字有几个读音,自然我回答不上来,这时同学们纷纷说:“知识真渊博!”……我喜欢读书,在初中开学前,我就买来了《朝花夕拾》,发现书中充满了温馨的回忆和理性的批判。我也很爱写作,爱积累好句子,“像母亲的手抚摸着你”“你不让我我不让你,都开满了花赶趟儿”“像牛毛,像花针,像细丝”这样的句子都会背下来,以备不时之需,正好今天也用到了。(1)如果让你给这次活动制作背景图,你会在背景上显示哪句话?说说你的理由。(2分)______________________________________________________________________________ (2)根据拼音写汉字,或者给加点的字注音。(4分) 分qí()粗犷.()pái huái ()yóu然而生()(3)“它来自于《诗经》里的句子”其中“里”字是表示________的名词。(1分) (4)康棣华同学在说到“棣字都不认识,看我知识多渊博”时,大概是图_____的表情。听到同学说“知识真渊博”时,康棣华最可能是图____的表情,(只写字母)会在“_____”字的后面停顿一下,重读“__________”。(4分) A B C D (5)试评价一下康棣华同学的自我介绍。(2分) ______________________________________________________________________________ (6)黄棣化发现《朝花夕拾》中充满了温馨的回忆和理性的批判,你能说说回忆了哪些往
化学反应原理期末测试题 测试时间:120分钟试卷满分:100分 第Ⅰ卷(选择题,共48分) 一、单项选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题) 1.废弃的电子产品称为电子垃圾,其中含铅、汞等有害物质、危害严重。下列对电子垃圾处理应予提倡的是() ①将电子垃圾掩埋地下②改进生产工艺,减少有害物质使用③依法要求制造商回收废旧电子产品④将电子垃圾焚烧处理 A.①③B.②④C.②③D.①④ 2.下列实验指定使用的仪器必须预先干燥的是() ①中和热测定中所用的小烧杯②中和滴定中所用的滴定管③配制一定物质的量浓度溶液中所用的容量瓶④喷泉实验中用于收集氨气的烧瓶 A.①②B.②③C.①④D.③④ 3.在一定温度下,可逆反应2A (g)+B (g) C (g)+D (g)达到平衡的标志是() A.C的生成速率和B的消耗速率相等 B.v正(A)=2v正(B) C.2v正(A)=v逆(B) D.反应混合物中A、B、C、D的浓度不再发生变化 4.某混合溶液中所含离子的浓度如下表,则M离可能为() 所含离子NO3-SO42-H+M 浓度/(mol·L-1) 2 1 2 1 A.Cl-B.Ba2+C.F-D.Mg2+ 5.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)==H2O ( l ) ΔH=-57.3 kJ / mol,分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是() A.ΔH1>ΔH2>ΔH3B.ΔH1>H3>ΔH2 C.ΔH1=ΔH2=ΔH2D.ΔH1<ΔH3<ΔH2 6.下列事实中,不能用勒夏特列原理解释的是() A.对熟石灰的悬浊液加热,悬浊液中固体质量增加 B.实验室中常用排饱和食盐水的方式收集氯气 C.打开汽水瓶,有气泡从溶液中冒出 D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 7.下列叙述中,正确的是() ①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀③电镀时应把镀件置于电解槽的阴极④冶炼铝时,把氧化铝加热成为熔融体后电解⑤钢铁表面常易腐蚀生成Fe2O3·n H2O A.①②③④⑤B.①③④⑤C.①③⑤D.②④ 8.2006年,科学家们发明了一种能够给电子设备提供动力的生物电池。该电池包括两个涂覆着酶的电极,它们
化学反应原理期末试 题含答案
化学反应原理期末试题含答案 1.下列有关说法正确的是() A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 B.NH3(g)+HCl(g))=NH4Cl(s)室温下能自发进行,说明该反应的ΔH<0 C.N2(g)+3H2(g) 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 D.水的离子积常数K w随着温度的升高而增大,说明水的电离是放热反应2.下列说法正确的是 A.将纯水加热至较高温度,K w变大、pH变小、呈酸性 B.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 C.向0.1 mol·L-1醋酸溶液中加入少量冰醋酸,溶液的pH减小,醋酸电离程度变大 D.等体积、pH都为3的酸HA和HB分别与足量的Zn反应,HA放出的 H2多, 说明HA的酸性小于HB 3. 分析下列硫燃烧时的能量变化图,判断有关热 化学方程式和说法正确的是( ) A.S(s,单斜)+O2(g)===SO2(g) ΔH=+297.16 kJ·mol-1 B.S(s,正交)===S(s,单斜) ΔH=-0.33 kJ·mol-1 C.S(s,正交)+O2(g)===SO2(g) ΔH=-296.83 kJ·mol-1 D.单斜硫的稳定性大于正交硫的稳定性 4. 在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断中正确的是( ) A.10 min时,改变的外界条件可能是减小压强 B.0~5 min内,v(H2)=0.1 mol·(L·min)-1 C.恒温下,缩小容器体积,平衡后c(H2)减小 D.12 min时,反应达平衡时,气体的平均摩尔质量不
2017--2018学年度高二第一学期期末考试 化学试题 说明: 1.本试卷分第I卷(1—4页)和第II卷(5—8页),全卷满分100分,考试时间90分钟。 2.可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Fe 56 Cu 64 第I卷(选择题共48分) 单项选择题:包括16小题,每小题3分,共计48分。每小题只有一个 ....选项符合题意。 1.下列说法正确的是 A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 C.在加热条件下发生的反应均为吸热反应 D.物质发生化学反应时不一定都伴随着能量变化 2.关于中和热的测定实验,下列说法正确的是 A.为了使反应充分,可以向酸(碱)中分次加入碱(酸) B.为了使反应进行的更完全,可以使酸或碱适当过量 C.中和热为一定值,实验结果与所用酸(碱)的用量和种类均无关 D.用铜丝代替玻璃棒搅拌,会使中和热测定值偏大 3.稀氨水中存在着下列平衡:NH 3? H2O NH4++OH- ,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是(忽略溶解热) ①NH4C1 固体②硫酸③NaOH 固体④水⑤加热 A.仅①②③⑤ B. 仅③⑤ C. 仅③ D. 仅①③ 4.下列叙述正确的是 ①原电池是把化学能转化成电能的一种装置 ②原电池的正极发生氧化反应,负极发生还原反应 ③不能自发进行的氧化还原反应,通过原电池的装置均可实现 ④碳棒不能用来作原电池的正极 ⑤反应Cu+2Ag+=2Ag+Cu2+,能以原电池的形式来实现 A.①⑤B.①④⑤C.②③④D.②⑤ 5.下列化学方程式中,不正确的是 A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
二年级数学上册期中卷 (时间:50分钟) 班级____________ 姓名______________ 一. 知识园 1. 我会算 (10分) 3×4= 6×6= 85-32= 3×6+11= 3+7= 3×4= 31-2= 9-2×2= 5×2= 2×5= 26+6= 5+5×4= 1×1= 3×5= 8+41= 9×9-80= 2.我会填(12分) (1)我的红领巾有( )个角。一把三角尺最多只有( )个直角。 教室的黑板表面有( )个角,它们都是( )角。 (2)姚明的身高是226( )。教室门的高度大约是2( )。 东方明珠电视塔高468( ),亚洲第一,世界第三。 (3)笔算加法和减法时都要把( )对齐,都从( )算起,加法个位上的数相加满( ),就向( )位进1,减法如果个位不够减,就从十位( )。 3.让我来判断(对的打√,错的打×)(5分) (1) 下面是线段的打√,不是的打×。 ( ) ( ) ( ) ( ) (2)角的两条边越长,角就越大。 ( ) (3)所有的直角都一样大。 ( ) (4)一块正方形,剪去一个角后只剩下三个角。 ( ) 4.我来数数角(6分) 有( )个角 有( )个角 有( )个角 有( )个角 有( )个角,其中( )个是直角 5.填口诀(8分) 二二( ) ( )得九 三六( ) ( )二十五 三五( ) ( )得六 三四( ) ( )二十 6分) 3×3 3+3 2+2+2+2 2×4 26+12 42-2 6×4 5×5 7.看图列式并计算(10分) (1) (2) 加法算式:________________ 加法算式:______________ 乘法算式:________________ 乘加算式:_______________ 或_________________ 乘减算式:_______________ (3) ( ) ×( ) =( ) 读作:_______________ 表示( )个( )相加是( ) 口诀:__________________ 8.列竖式计算(14分) 36+23= 29+56= 77-36+29= 62-17= 48-33= 19+48-36= 9.猜猜我是谁(4分)
试卷类型:A 化学反应原理期末试题 2014.1 考生注意: 本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共8页,满分100分,考试时间90分钟。 注意事项: 1.答卷前,考生将自己的姓名、准考证号、考试科目、试卷类型用2B铅笔涂写在答题卡上。 2.每小题选出答案后,用2B铅笔在答题卡上将对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。 3.考试结束,监考人员将答题卡收回。 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na: 23 Fe:56 Cu:64 第I卷(选择题共48分) 选择题(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意) 1.高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点中正确的是( ) A.放热反应在常温下均能自发进行 B.电解过程中,化学能转化为电能而“储存”起来 C.化学平衡常数的表达式与化学反应方程式的书写有关 D.强电解质溶液的导电能力一定强于弱电解质溶液 2.250℃和101 kPa时,反应2N2O5(g)= 4NO2(g)+ O2(g) ΔH = +56.76 kJ·mol-1,能自发进行的原因是( ) A.是吸热反应B.是放热反应 C.是熵减少的反应D.是熵增加的反应 3.下列说法正确的是( ) A.金属腐蚀的实质是金属被氧化 B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 C.为保护地下铁管不受腐蚀,将其与直流电源正极相连 D.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 4.用惰性电极电解饱和 ..Na2SO4溶液,若保持温度不变,则一段时间后( ) A.溶液pH变大
全国高考化学化学反应原理的综合高考真题汇总及答案 一、化学反应原理 1.硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2 实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示: (1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%?80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______ (2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条) (3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______ 实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。 资料:Fe3++3S2O32-?Fe(S2O3)33-(紫黑色) 装置试剂X实验现象 Fe2(SO4)3溶液混合后溶液先变成紫黑色,30s 后几乎变为无色 (4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象: _______ 实验Ⅲ:标定Na2S2O3溶液的浓度 (5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g?mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72- +14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______mol?L-1
2013—2014学年度第二学期期中学业水平检测 七年级生物试题 (本试题满分:100分,考试时间:90分钟) 叶子姐姐提示:亲爱的同学,欢迎你参加本次考试,祝你答题成功! 1.卷(I)的答案需要填在卷(II)上方的表格中,卷(II)的答案需要写在本试卷上。 2.请务必在本试卷密封线内填写自己的学校、姓名、考试号,指定位置填写座号! 卷(Ⅰ)现象·概念·结构·方法(本卷满分30分)@ 一、单项选择题(本题满分50分,共40个小题,前30小题每题1分,后10小题每题2分):下列各小题的四个选项中只有一个是正确的,请选出并将答案写在卷Ⅱ前的空格内 1.在显微镜下观察一滴河水,发现了一些能运动的绿色小颗粒。下列哪项不能作为判断这些小颗粒是生物的依据( ) A.有细胞结构B.能生长和繁殖C.体小且绿色D.能对环境的变化作出相应的反应 2. 含羞草受到刺激后作出反应,与下列哪一种生理现象相似( ) A.植物的光合作用B.人手被针刺后缩手C.植物秋天落叶D.母鸡下蛋 3. 生物圈的含义是( ) A.地球上的全部生物B.地球上一切适合生物生存的环境 C.地球上的全部生物及其生存的环境D.大气圈下层、岩石圈表面和水圈 4. 俗话说:“鱼儿离不开水。”对此最恰当的解释是( ) A.生物依赖环境B.生物适应环境C.生物改变环境D.生物影响环境 ) 5. 下列叙述中,属于生物因素对生物的影响的是( ) A“人间四月芳菲尽,山寺桃花始盛开” B.“南橘北枳” C.“雨露滋润禾苗壮” D.“草盛豆苗稀” 6. “橘生淮南则为橘,生于淮北则为枳”。就是说,淮南的橘子移种到淮北就不能结出甜美多汁的果实了。造成这一差异的主要环境因素是( ) A.光B.水C.温度D.病虫害 7. 在雅鲁藏布大峡谷,植物的分布随海拔高度的变化情况是:下层为热带雨林,中层为常绿阔叶林,上层为针叶林.顶层为高山草甸。决定该地区植物分布的主要非生物因素是( ) A.温度B.水分C.阳光D.海拔高度, 8. 海湾浅水处长绿藻,稍深处长褐藻,再深处长红藻。海洋植物的分层主要受哪种因素影响( ) A.阳光B.温度C.气体D.盐度 9. 下面的三幅图分别表示两种生物种群数量(咒)随时间(£)推移而发生的变化,那么甲、乙、丙三图表示的关系依次是( ) ) A.共生、捕食、竞争B.竞争、捕食、共生C.竞争、共生、捕食D.捕食、竞争、共生 10. 沙漠里的一种鼠白天躲在洞里并且将洞口封住,夜间才出来活动。正确解释这种现象的是( ) A.鼠类对外界刺激产生的一种本能反应 B.鼠类捕食行为的一种方式 C.鼠类白天在为繁殖工作做准备D.鼠类对沙漠环境的一种适应 11. 人们将一种叫“水葫芦”的植物引种到昆明滇池后,这种植物很快在滇池中蔓延,甚至威胁到其他生物的生存。这说明生物体( ) @ A.能适应环境B.与环境形成统一的整体C.不能适应环境D.既能适应环境.又能影响环境 12. 一片森林中,有土壤、水分、阳光、空气,生活着各种植物、动物、微生物,它们共同组成( ) A.生活环境B.环境因素C.生态系统D.生态平衡 13. 在生态系统中,能把有机物变成二氧化碳和水返回无机环境中的是( ) A.生产者B.消费者C.分解者D.以上都是 14. 下列食物链符合生物学原理的是( ) A.阳光→草→鼠→鹰B.草→野兔→狼C.草→田鼠→狐D.植物→蚜虫→瓢虫→细菌 15. 生态系统自动调节能力越强,则( ) ①生态系统中生物的种类越多②生态系统中生物的种类越少③食物链和食物网越复杂④食物链和食物网越简单⑤生态平衡容易被破坏⑥生态平衡不容易被破坏 A.①③⑤B.②④⑥C.②④⑤D.①③⑥ ! 16. DDT是一种不易分解的有机农药,人们并没有到南极大陆去喷洒DDT,而从来未离开南极的企鹅体内也积累了DDT,这个实例说明( ) A.DDT挥发性强B.考察队员把DDT带到南极C.从施药地区迁去的动物将DDT带到了南极D.DDT在生物圈中流动,生物圈是一个统一的整体 17.以下各项不属于生物对外界刺激作出反应的表现是() A、鱼生活在水中,用鳃呼吸 B、生物的生活需要营养 C、含蓄草的叶片被手触摸后闭合下垂 D、在有草履虫的培养液滴一端放一粒食盐,草履虫会立即游向另一端 18.“葵花朵朵向太阳”所表现出的生物的特征是( ) A.生物能排出身体内产生的废物B.生物的生活需要营养 C.生物能对外界刺激作出反应D.生物能进行呼吸 19. 有一种鸟的生活习性是:白天休息,夜晚觅食;秋天时从北方飞往南方越冬。影响鸟的这两种习性的生态因素依次是() > (A)空气、光照(B)温度、水分(C)水分、空气(D)光照、温度 20. 宋代诗人苏武在《惠崇春江晚景》中写道:“竹外桃花三两枝,春江水暖鸭先知。”这句诗描述的是哪一种非生物因素影响了鸭的生活() A.光B.水C.温度D.空气 座号