
2020年山东省新高考化学试卷
题号一二三总分
得分
一、单选题(本大题共12小题,共28.0分)
1.实验室中下列做法错误的是()
A. 用冷水贮存白磷
B. 用浓硫酸干燥二氧化硫
C. 用酒精灯直接加热蒸发皿
D. 用二氧化碳灭火器扑灭金属钾的燃烧
2.下列叙述不涉及氧化还原反应的是()
A. 谷物发酵酿造食醋
B. 小苏打用作食品膨松剂
C. 含氯消毒剂用于环境消毒
D. 大气中NO2参与酸雨形成
3.短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其
最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是()
A. 第一电离能:W>X>Y>Z
B. 简单离子的还原性:Y>X>W
C. 简单离子的半径:W>X>Y>Z
D. 氢化物水溶液的酸性:Y>W
4.下列关于C、Si及其化合物结构与性质的论述错误的是()
A. 键能C-C>Si-Si、C-H>Si-H,因此C2H6稳定性大于Si2H6
B. 立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C. SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D. Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-pπ
键
5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是()
A. 用甲装置制备并收集CO2
B. 用乙装置制备溴苯并验证有HBr产生
C. 用丙装置制备无水MgCl2
D. 用丁装置在铁上镀铜
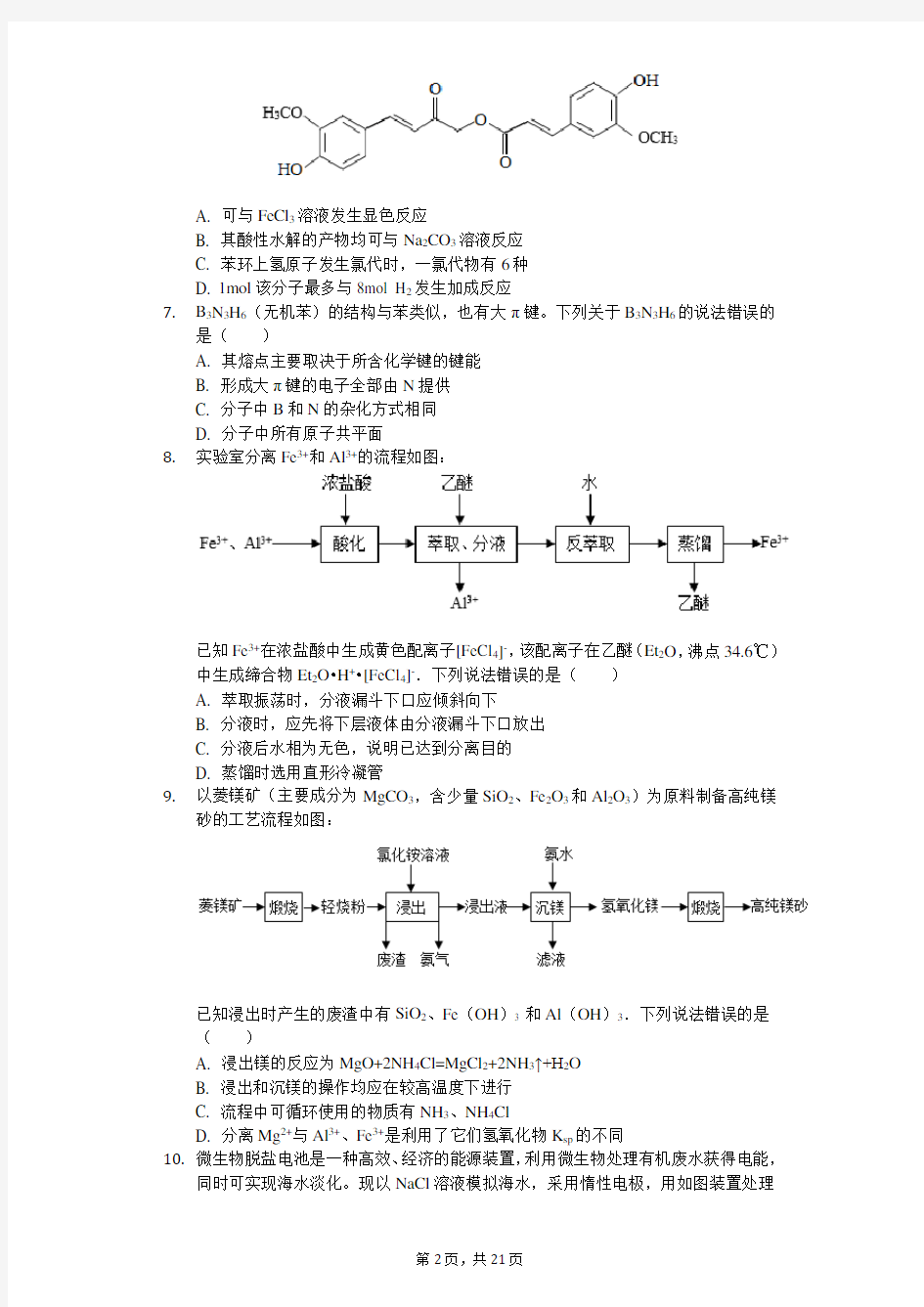
6.从中草药中提取的calebin A(结构简式如图)可用于治疗阿尔茨海默症。下列关于
calebin A的说法错误的是()
A. 可与FeCl3溶液发生显色反应
B. 其酸性水解的产物均可与Na2CO3溶液反应
C. 苯环上氢原子发生氯代时,一氯代物有6种
D. 1mol该分子最多与8mol H2发生加成反应
7.B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的
是()
A. 其熔点主要取决于所含化学键的键能
B. 形成大π键的电子全部由N提供
C. 分子中B和N的杂化方式相同
D. 分子中所有原子共平面
8.实验室分离Fe3+和Al3+的流程如图:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物Et2O?H+?[FeCl4]-.下列说法错误的是()
A. 萃取振荡时,分液漏斗下口应倾斜向下
B. 分液时,应先将下层液体由分液漏斗下口放出
C. 分液后水相为无色,说明已达到分离目的
D. 蒸馏时选用直形冷凝管
9.以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁
砂的工艺流程如图:
已知浸出时产生的废渣中有SiO2、Fe(OH)3 和Al(OH)3.下列说法错误的是()
A. 浸出镁的反应为MgO+2NH4Cl=MgCl2+2NH3↑+H2O
B. 浸出和沉镁的操作均应在较高温度下进行
C. 流程中可循环使用的物质有NH3、NH4Cl
D. 分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物K sp的不同
10.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,
同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理
有机废水(以含CH3COO-的溶液为例)。下列说法错误的是()
A. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
B. 隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C. 当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D. 电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
11.α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如图。下列关
于α-氰基丙烯酸异丁酯的说法错误的是()
A. 其分子式为C8H11NO2
B. 分子中的碳原子有3种杂化方式
C. 分子中可能共平面的碳原子最多为6个
D. 其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
12.采用惰性电极,以去离子水和氧气为原料通过电解法
制备双氧水的装置如图所示。忽略温度变化的影响,
下列说法错误的是()
A. 阳极反应为2H2O-4e-=4H++O2↑
B. 电解一段时间后,阳极室的pH未变
C. 电解过程中,H+由a极区向b极区迁移
D. 电解一段时间后,a极生成的O2与b极反应的
O2等量
二、双选题(本大题共3小题,共12.0分)
13.
目的操作
A除去苯中少量的苯酚加入适量NaOH溶液,振荡、静置、分液
B证明酸性:碳酸>苯酚将盐酸与NaHCO3混合产生的气体直接通入苯酚钠溶液
C 除去碱式滴定管胶管内的
气泡
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出
D
配制用于检验醛基的氢氧
化铜悬浊液
向试管中加入2mL 10% NaOH溶液,再滴加数滴
2%CuSO4溶液,振荡
A B C D
14.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离
子();第二步Br-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成
产物的比例分别为70:30和15:85.下列说法正确的是()
A. 1,4-加成产物比1,2-加成产物稳定
B. 与0℃相比,40℃时1,3-丁二烯的转化率增大
C. 从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D. 从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程
度
15.25℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol?L-1,lgc(CH3COOH)、
lgc(CH3COO-)、lgc(H+)和lgc(OH-)随pH变化的关系如图所示。K a为CH3COOH 的电离常数,下列说法正确的是()
A. O点时,c(CH3COOH)=c(CH3COO-)
B. N点时,pH=-lgK a
C. 该体系中,c(CH3COOH)=mol?L-1
D. pH由7到14的变化过程中,CH3COO-的水解程度始终增大
三、简答题(本大题共5小题,共60.0分)
16.用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的
工艺流程如图:
已知:MnO
物质Fe(OH)2Fe(OH)3Al(OH)3Mn(OH)2
K sp1×10-16.31×10-38.61×10-32.31×10-12.7
(1)软锰矿预先粉碎的目的是______,MnO2 与BaS溶液反应转化为MnO的化学方程式为______。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是______。
(3)滤液Ⅰ可循环使用,应当将其导入到______操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为______(填化学式),再使用氨水调溶液的pH,则pH的理论最小值为______(当溶液中某离子浓度c≤1.0×10-5mol?L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______。
17.CdSnAS2是一种高迁移率的新型热电材料,回答下列
问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成
SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型
为______,其固体的晶体类型为______。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为______
(填化学式,下同),还原性由强到弱的顺序为______,
键角由大到小的顺序为______。
(3)含有多个配位原子的配体与同一中心离子(或原
子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有______ mol,该螯合物中N的杂化方式有______种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAS2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标
x y z
原子
Cd000
Sn000.5
As0.250.250.125
一个晶胞中有______个Sn,找出距离Cd(0,0,0)最近的Sn______(用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有______个。
18.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、
H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.5 kJ?mol-1
Ⅱ.CO(g)+2H2(g)?CH3OH(g)△H2=-90.4 kJ?mol-1
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)△H3=______kJ?mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为______mol?L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为______。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
已知:CO2的平衡转化率=×100%
CH3OH的平衡产率=×100%
其中纵坐标表示CO2平衡转化率的是图______(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为______;图乙中T1温度时,三条曲线几乎交于一点的原因是______。
(4 )为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为______(填标号)。
A.低温、高压B.高温、低压C.低温、低压D.高温、高压
19.化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如图:
已知:Ⅰ.
Ⅱ.
Ⅲ.
Ar为芳基;X=Cl,Br;Z或Z′=COR,CONHR,COOR等。
回答下列问题:
(1 )实验室制备A的化学方程式为______,提高A产率的方法是______;A的某同分异构体只有一种化学环境的碳原子,其结构简式为______。
(2)C→D的反应类型为______;E中含氧官能团的名称为______。
(3)C的结构简式为______,F的结构简式为______。
(4)Br2和的反应与Br2和苯酚的反应类似,以和
为原料合成,写出能获得更多目标产物的较优合
成路线(其它试剂任选)。
20.某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是______;装置C中的试剂为______;装置A中制备Cl2的化学方程式为______。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是______。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入______(填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为______(填标号)。
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4?2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4?2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用cmol?L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液
V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4?2H2O(M=126g?mol-1)的质量分数表达式为______。
下列关于样品组成分析的说法,正确的是______(填标号)。
A.=3时,样品中一定不含杂质
B.越大,样品中H2C2O4?2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
答案和解析
1.【答案】D
【解析】解:A.白磷的着火点很低,能在常温下易与氧气发生氧化反应而自燃,所以放在冷水里。故A正确;
B.浓硫酸具有吸水性且不与二氧化硫反应,所以能用浓硫酸干燥二氧化硫,故B正确;C.蒸发皿可以直接加热,酒精灯外焰温度较高,加热时用酒精灯的外焰进行加热,故C正确;
D.金属钾燃烧:K+O2KO2,超氧化钾能与二氧化碳反应生成氧气助燃,反应为
4KO2+2CO2=2K2CO3+3O2,不用二氧化碳灭火器扑灭金属钾的燃烧,故D错误;
故选:D。
A.白磷的着火点低,易引起自燃;
B.浓硫酸具有吸水性且不与二氧化硫反应;
C.蒸发皿可直接用酒精灯加热;
D.K在空气中燃烧生成超氧化钾,超氧化钾与二氧化碳反应生成助燃物氧气。
本题考查了药品的存放、常见仪器的使用方法及注意事项,题目难度不大,注意积累相关的基础知识,试题培养了学生灵活应用基础知识的能力。
2.【答案】B
【解析】解:A.谷物发酵酿造食醋,是淀粉水解生成葡萄糖,葡萄糖在酶的作用下生成乙醇,乙醇氧化生成醋酸的过程,涉及氧化还原反应,故A不选;
B.小苏打用作食品膨松剂,是碳酸氢钠受热分解生成二氧化碳气体,不是氧化还原反应,故B选;
C.含氯消毒剂用于环境消毒,是次氯酸的强氧化性,涉及氧化还原反应,故C不选;D.大气中NO2参与酸雨形成,二氧化氮与水反应生成硝酸和一氧化氮,涉及氧化还原反应,故D不选。
故选:B。
氧化还原反应的特征是元素化合价的升降,若发生氧化还原反应,应存在元素化合价的变化,结合物质的性质解答该题。
本题考查氧化还原反应,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意从元素化合价的角度判断相关概念以及物质的性质,难度不大,注意相关知识的学习。
3.【答案】C
【解析】解:由上述分析可知,X为O、Y为F、Z为Na、W为Cl,
A.同一周期从左向右第一电离能总趋势为逐渐增大,同一主族从上到下第一电离能逐渐减小,故四种元素中第一电离能从大到小的顺序为F>O>Cl>Na,故A错误;B.非金属性越强,对应简单离子的还原性越弱,故简单离子的还原性为Cl->O2->F-,故B错误;
C.电子层数越多简单离子半径越大,相同结构的离子,原子序数越大半径越小,故四种元素中离子半径从大到小的顺序为Cl->O2->F->Na+,故C正确;
D.F元素的非金属性强于Cl元素,则形成氢化物后F原子束缚H原子的能力强于Cl 原子,在水溶液中HF不容易发生电离,故HCl的酸性强于HF,故D错误;
故选:C。
短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高
能级电子数的2倍,设若X为第二周期元素原子,则X可能为Be或O,若X为第三周期元素原子,则均不满足题意,Z与X能形成Z2X2的淡黄色化合物,该淡黄色固体为Na2O2,则X为O元素,Z为Na元素;Y与W的最外层电子数相同,结合Y的原子序数在O与Na之间,则Y为F元素,W为Cl元素,以此来解答。
本题考查原子结构与元素周期律,为高频考点,把握原子序数、元素化合物知识、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
4.【答案】C
【解析】解:A、原子半径越小、共价键键能越大,物质越稳定,原子半径:Si>C,所以键能C-C>Si-Si、C-H>Si-H,C2H6稳定性大于Si2H6,故A正确;
B、由于方型SiC是与金刚石成键、结构均相似的共价晶体,均为原子晶体,所以立方型SiC具有很高的硬度,故B正确;
C、SiH4中Si的化合价为+4,CH4中C的化合价为-4,碳的非金属性强于硅,则碳的氧化性强于硅,推出SiH4还原性大于CH4,故C错误:
D、Si的原子半径较大,原子间形成的σ键较长,p-p轨道重叠程度很小,难于形成π键,所以Si原子间难形成双键而C原子间可以,故D正确;
故选:C。
A、键能越大,物质越稳定;
B、原子晶体的熔点高、硬度大;
C、碳的非金属性强于硅,则碳的氧化性强于硅,则还原性较弱;
D、原子半径大,原子间形成的σ键较长,p-p轨道几乎不能重叠。
本题考查物质结构与性质,综合考查学生的分析和灵活运用能力,把握原子半径与键长、键能、物质性质的关系即可解答,题目难度不大。
5.【答案】C
【解析】解:A.碳酸氢钠加热有水生成,则试管口应略向下倾斜,且收集二氧化碳选向上排空气法,图中为向下排空气法,故A错误;
B.溴易挥发,溴及HBr均与硝酸银反应,则图中实验不能检验HBr的生成,故B错误;C.HCl可抑制镁离子水解,则在HCl气流中加热可制备无水MgCl2,故C正确;D.Fe与电源正极相连为阳极,而Cu为阴极,Cu不能失去电子,则不能镀铜,故D错误;
故选:C。
A.碳酸氢钠加热有水生成,二氧化碳的密度比空气密度大;
B.溴易挥发,溴及HBr均与硝酸银反应;
C.HCl可抑制镁离子水解;
D.Fe与电源正极相连为阳极,而Cu为阴极。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、电化学为解答的关键,侧重分析与实验能力的考查,注意选项B为解答的易错点,题目难度不大。
6.【答案】D
【解析】解:A.含酚-OH,与FeCl3溶液发生显色反应,故A正确;
B.含-COOC-,可在酸溶液中水解,且水解产物均含酚-OH,可与碳酸钠溶液反应,故B正确;
C.结构不对称,苯环上分别含3种H,苯环上氢原子发生氯代时,一氯代物有6种,故C正确;
D.苯环、碳碳双键、羰基与氢气发生加成反应,则1mol该分子最多与9mol H2发生加成反应,故D错误;
故选:D。
由结构可知,分子中含酚-OH、碳碳双键、-COOC-及醚键、羰基,结合酚、烯烃、酯等有机物的性质来解答。
本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大。
7.【答案】A
【解析】解:A、无机苯是分子晶体,其熔点取决于分子间作用力,与化学键的键能无关,故A错误;
B、B的价层电子对个数是3,B核外三个电子全部成键,则形成大π键的电子全部由N 提供,故B正确;
C、B3N3H6(无机苯)的结构与苯类似,B、N原子杂化方式都为sp2,故C正确;
D、苯分子中所有原子共平面,则B3N3H6(无机苯)中所有原子共平面,故D正确;故选:A。
无机苯(B3N3H6)与苯结构相似,结构式为、,其中B
的价层电子对个数是3,根据价层电子对互斥理论判断B原子杂化方式,共价单键为σ键,1个B3N3H6中σ键的数目12,所以氮提供电子形成大π键,由此分析解答。
本题考查原子杂化类型、空间结构等,难度中等,学生只要根据苯的结构进行分析就可以迅速解题,比较容易。
8.【答案】A
【解析】解:A.萃取振荡时,使分液漏斗上口朝下,使分液漏斗下口朝上,便于振荡混合、便于放气降低分液漏斗内气压,故A错误;
B.分液时避免上下层液体混合,先将下层液体由分液漏斗下口放出,故B正确;C.水相含铝离子,分液后水相为无色,说明已达到分离目的,故C正确;
D.蒸馏时选用直形冷凝管,便于馏分流出,防止残留在冷凝管中,故D正确;
故选:A。
由流程可知,先加浓盐酸酸化,Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,然后加乙醚萃取、分液分离出Al3+,然后加水反萃取,最后蒸馏分离出乙醚及Fe3+,以此来解答。本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意选项AD为解答的易错点,题目难度不大。
9.【答案】B
【解析】解:A.高温煅烧后Mg元素主要以MgO的形式存在,MgO可以与铵根水解产生的氢离子反应,促进铵根的水解,所以得到氯化镁、氨气和水,化学方程式为MgO+2NH4Cl=MgCl2+2NH3↑+H2O,故A正确;
B.一水合氨受热易分解,沉镁时在较高温度下进行会造成一水合氨大量分解,挥发出氨气,降低利用率,故B错误;
C.浸出过程产生的氨气可以回收制备氨水,沉镁时氯化镁与氨水反应生成的氯化铵又可以利用到浸出过程中,故C正确;
D.Fe(OH)3、Al(OH)3的K sp远小于Mg(OH)2的K sp,所以当pH达到一定值时Fe3+、Al3+产生沉淀,而Mg2+不沉淀,从而将其分离,故D正确;
故选:B。
菱镁矿煅烧后得到轻烧粉,其中MgCO3转化为MgO,加入氯化铵溶液浸取,浸出的废渣有SiO2、Fe(OH)3、Al(OH)3,同时产生氨气,则此时浸出液中主要含有Mg2+,加入氨水得到Mg(OH)2沉淀,煅烧得到高纯镁砂。
本题考查物质制备,涉及物质分离提纯、反应原理的分析及溶度积常数的应用等知识点,明确化学反应原理、元素化合物性质及其性质差异性是解本题关键,知道流程图中发生的反应及物质成分,题目难度不大。
10.【答案】B
【解析】解:该装置为原电池,有机废水中的CH3COO-发生失电子的氧化反应生成CO2,则a极为负极,b极为正极,正极上H+得电子生成H2,反应式为2H++2e-=H2↑,
A、该原电池中a极为负极,b极为正极,有机废水中的CH3COO-在负极失电子生成CO2,电极反应式为CH3COO-+2H2O-8e-=2CO2↑+7H+,故A正确;
B、原电池工作时,阴离子移向负极、阳离子移向正极,即NaCl溶液中的Na+通过阳离子交换膜移向b极、Cl-通过阴离子交换膜移向a极,达到海水淡化目的,所以隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,故B错误;
C、由于电子与Na+、Cl-所带电荷数相等,所以路中转移1mol电子时,通过离子交换膜的Na+、Cl-物质的量均为1mol,质量为1mol×58.5g/mol=58.5g,即模拟海水理论上除盐
58.5g,故C正确;
D、负极反应式为CH3COO-+2H2O-8e-=2CO2↑+7H+,正极反应式为2H++2e-=H2↑,转移8mole-电子时正极得到4molH2、负极得到2molCO2,即正、负极产生气体的物质的量之比为2:1,故D正确;
故选:B。
该装置为原电池,有机废水中的CH3COO-发生失电子的氧化反应生成CO2,则a极为负极,电极反应式为CH3COO-+2H2O-8e-=2CO2↑+7H+,b极为正极,酸性条件下,H+得电子生成H2,反应式为2H++2e-=H2↑,原电池工作时,阴离子移向负极、阳离子移向正极,即模拟海水NaCl溶液中的Na+通过阳离子交换膜移向b极、Cl-通过阴离子交换膜移向a极,则隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,据此分析解答。
本题考查原电池工作原理及其应用,明确各个电极上发生的反应、交换膜作用是解本题关键,侧重考查基础知识灵活运用能力,注意结合电解质特点书写电极反应式,题目难度不大。
11.【答案】C
【解析】解:A.由结构可知分子中含8个C、11个H、1个N、2个O,则分子式为
C8H11NO2,故A正确;
B.-CN中C为sp杂化,双键中C为sp2杂化,其它C均为sp3杂化,故B正确;C.碳碳双键、-CN、-COOC-均直接相连,且3个原子可确定一个平面,连接2个甲基的C为四面体结构,可能共平面的碳原子最多为7个,即只有1个甲基上C与其它碳原子不共面,故C错误;
D.2个双键、1个三键,不饱和度为4,含苯环的同分异构体中,苯环上侧链为含-NH2、-CHOHCH2OH或氨基、甲基、-OH等,可为1个侧链、2个侧链或多个侧链,苯环连5个取代基(2个-间位-CH3、1个-NH2在甲基的间位、2个-OH分被在甲基与氨基之间)时含H种类最少为4种,故D正确;
故选:C。
由结构可知分子式,分子中含碳碳双键、-CN、-COOC-,结合烯烃、酯等有机物的性质来解答。
本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大。
12.【答案】D
【解析】解:A、阳极发生氧化反应生成氧气,电极反应式为:2H2O-4e-=4H++O2↑,故A正确;
B、阳极产生氢离子,氢离子是阳离子,通过质子交换膜移向阴极,所以电解一段时间后,则阳极室的pH不变,故B正确;
C、电解池中阳离子向阴极移动,所以电解过程中,H+由a极区向b极区迁移,故C正确;
D、a极电极反应式为:2H2O-4e-=4H++O2↑,b极O2+2e-+2H+=H2O2,当转移4mol电子时b极消耗的氧气的量是a极产生氧气的2倍,故D错误;
故选:D。
A、阳极发生氧化反应生成氧气;
B、阳极产生氢离子,通过质子交换膜移向阴极;
C、电解池中阳离子向阴极移动;
D、根据转移电子的物质的量相等分析解答。
本题考查电解池的工作原理,明确电解电池概念、各个电极上发生的反应、交换膜作用是解本题关键,侧重考查基础知识灵活运用能力,难点是电极反应式的书写,注意结合电解质特点书写,题目难度不大。
13.【答案】BC
【解析】解:A.苯酚与NaOH反应后,与苯分层,然后分液可分离,故A正确;B.盐酸易挥发,盐酸与苯酚钠反应,则不能比较碳酸、苯酚的酸性,故B错误;C.将尖嘴斜向上,挤压胶管内玻璃球将气泡排出,操作不合理,故C错误;
D.在碱性溶液中检验-CHO,则向试管中加入2mL 10% NaOH溶液,再滴加数滴
2%CuSO4溶液,振荡,可配制用于检验醛基的氢氧化铜悬浊液,故D正确;
故选:BC。
A.苯酚与NaOH反应后,与苯分层;
B.盐酸易挥发,盐酸与苯酚钠反应;
C.将尖嘴斜向上;
D.在碱性溶液中检验-CHO,则碱应过量。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验操作、物质检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意选项C为解答的易错点,题目难度不大。
14.【答案】AD
【解析】解:A.能量越低越稳定,根据图象可看出,1,4-加成产物的能量比1,2-加成产物的能量低,即1,4-加成产物的比1,2-加成产物稳定,故A正确;
B.该加成反应不管生成1,4-加成产物还是1,2-加成产物,均为放热反应,则升高温度,不利用1,3-丁二烯的转化,即在40℃时其转化率会减小,故B错误;
C.从0℃升至40℃,正化学反应速率均增大,即1,4-加成和1,2-加成反应的正速率均会增大,故C错误;
D.从0℃升至40℃,对于1,2-加成反应来说,化学平衡向逆向移动,即1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度,故D正确。
故选:AD。
A.根据图象信息,1,4-加成产物的能量更低,即1,4-加成产物更加稳定;
B.注意观察坐标轴,纵坐标代表能量,反应物的能量均高于两种生成物;
C.温度升高,反应速率增大;
D.1,2-加成反应为放热反应,温度升高,化学平衡向逆向移动。
本题考查化学反应过程的能量变化、化学反应速率、化学平衡的移动等,还涉及有机化学的加成反应,需要学生仔细分析图象信息,根据图象判断反应物和生成物的稳定状态,题目难度中等。
15.【答案】BC
【解析】解:A.O点时c(H+)=c(OH-),故A错误;
B.N点为c(CH3COO-)=c(CH3COOH),N点时,Ka=c(H+),可知pH=-lgK a,故B正确;
C.体系中若c(CH3COOH)=mol?L-1,c(H+)c(CH3COOH)+c(CH3COOH)×Ka=0.1c(H+),即c(H+)c(CH3COOH)+×c(CH3COOH)=0.1c(H+),
然后等式两边均除以c(H+),满足c(CH3COOH)+c(CH3COO-)=0.1mol?L-1,故C 正确;
D.由图可知,pH=12时不存在醋酸,此后氢氧根离子可抑制水解CH3COO-的发生,故D错误;
故选:BC。
混合溶液中c(CH3COOH)+c(CH3COO-)=0.1mol?L-1,随pH的增大,发生
CH3COOH+OH-=CH3COO-+H2O,可知c(CH3COO-)增大、c(CH3COOH)减小,结合图可知N点为c(CH3COO-)=c(CH3COOH),M点时c(CH3COO-)=c(H+),O 点时c(H+)=c(OH-),P点时c(CH3COOH)=c(OH-),以此来解答。
本题考查酸碱混合,为高频考点,把握混合时离子浓度的变化、离子浓度的关系为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大。16.【答案】增大反应接触面积,充分反应,提高反应速率MnO2+BaS+H2O=Ba(OH)+MnO+S 过量的MnO2消耗了产生的Ba(OH)2蒸
2
发H2O2 4.9 Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O
【解析】解:(1)软锰矿预先粉碎可以增大反应物的接触面积,使反应更充分,提高反应速率;MnO2与BaS反应转化为MnO,Mn元素的化合价由+4价降低为+2价,根据元素价态规律可知-2价的S元素应被氧化得到S单质,则MnO2与BaS的系数比应为1:1,根据后续流程可知产物还有Ba(OH)2,结合元素守恒可得化学方程式为:
MnO2+BaS+H2O=Ba(OH)2+MnO+S,
故答案为:增大反应接触面积,充分反应,提高反应速率;MnO2+BaS+H2O=Ba(OH)
+MnO+S;
2
(2)根据题目信息可知MnO2为两性氧化物,所以当MnO2过量时,会消耗反应产生的Ba(OH)2,从而使Ba(OH)2的量达到最大值或会减小,
故答案为:过量的MnO2消耗了产生的Ba(OH)2;
(3)滤液I为结晶后剩余的Ba(OH)2饱和溶液,所以可以导入到蒸发操作中循环使用,
故答案为:蒸发;
(4)净化时更好的除去Fe元素需要将Fe2+氧化为Fe3+,为了不引入新的杂质,且不将Mn元素氧化,加入的试剂X可以是H2O2;根据表格数据可知,Fe(OH)3和Al(OH)3为同种沉淀,而Al(OH)3的K sp稍大,所以当Al3+完全沉淀时,Fe3+也一定完全沉淀,当c(Al3+)=1.0×10-5mol/L时,c(OH-)=10-9.1mol/L,所以c(H+)=10-4.9mol/L,pH=4.9,即pH的理论最小值为4.9,
故答案为:H2O2;4.9;
(5)碳化过程Mn2+和碳酸氢根电离出的碳酸根结合生成碳酸锰沉淀,促进碳酸氢根的电离,产生的氢离子和一水合氨反应生成铵根和水,所以离子方程式为
Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O。
软锰矿粉(主要成分为MnO2,含少量Fe3O4、Al2O3)加入硫化钡溶液进行反应,主要发生MnO2+BaS+H2O=Ba(OH)2+MnO+S,过滤得到Ba(OH)2溶液,经蒸发结晶、过滤、干燥得到氢氧化钡;滤渣用硫酸溶解,得到的滤液中主要金属阳离子有Mn2+、Fe2+、Fe3+、Al3+,得到的滤渣为不溶于稀硫酸的硫磺;之后向滤液中加入合适的氧化剂将Fe2+转化为Fe3+,然后加入氨水调节pH,使Fe3+、Al3+转化为沉淀除去,压滤得到的废渣为Fe(OH)3和Al(OH)3,此时滤液中的金属阳离子只有Mn2+,向滤液中加入碳酸氢铵、氨水,Mn2+和碳酸氢根电离出的碳酸根结合生成碳酸锰沉淀,过滤、洗涤、干燥得到高纯碳酸锰。
本题考查了制备方案的设计,为高频考点,题目难度中等,明确流程分析及混合物分离方法、发生的反应为解答的关键,试题知识点较多,充分考查了学生的分析能力及化学实验、化学计算能力。
17.【答案】正四面体分子晶体NH3、AsH3、PH3AsH3、PH3、NH3NH3、PH3、AsH3 6 1 4 (0.5,0,0.25)(0.5,0.5,0) 4
【解析】解:(1)Sn为第ⅣA族元素,价层电子对数=σ+(a-xb)=4+(4-4×1)=4+0=4,
空间构型为正四面体形;常温常压下SnCl4为无色液体,熔沸点较低的为:分子晶体,故答案为:正四面体形;分子晶体;
(2)组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越高;但NH3分子间可形成氢键,使熔沸点升高;所以三种物质的熔沸点由高到低的顺序为:NH3、AsH3、PH3;同主族非金属元素由上向下非金属性依次减弱,其相应离子的还原性越强,还原性由强到弱的顺序为:AsH3、PH3、NH3;同主族非金属元素由上向下电负性依次减小,成键电子对之间的斥力越小,键角越小,所以这三种氢化物的键角由大到小的顺序为:NH3、PH3、AsH3,
故答案为:NH3、AsH3、PH3;AsH3、PH3、NH3;NH3、PH3、AsH3;
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为整合物,螯合物是一种环状配合物,“'螯”指螃蟹的大钳;在螯合物结构中,一定有多个多齿配体提供多对电子与中心原子形成配位键;邻二氮菲为双齿配体,形成的配位键数为:6mol;邻二氮菲为平面结构,所以N原子的杂化方式都为:sp2,且只有1种,
故答案为:6;1;
(4)由部分Cd原子的分数坐标(0,0,0),可知8个Cd在晶胞的顶点,4个Cd在晶胞的面心,1个在晶胞的体心;部分Sn原子的分数坐标为(0,0,0.5),4个Sn在晶胞的棱上,6个Sn在晶胞的面心,部分As原子的坐标为(0.25,0.25,0.125),8
个As在晶胞的体心;所以一个晶胞中含有Sn的个数为:4×+6×=4;距离Cd(0,0,
0)最近的Sn是{0.5,0,0.25)、(0.5,0.5,0);由图可知,CdSnAs2晶体中与单个Sn键合的As有4个,
故答案为:4;(0.5,0,0.25)(0.5,0.5,0);4。
(1)根据价层电子对互斥理论,价层电子对数=σ+(a-xb),价层电子对数=4,空间
构型为正四面体形;熔沸点较低的为分子晶体;
(2)有氢键的物质熔沸点高,组成和结构相似的物质,相对分子质量越大,熔沸点越高;
同主族非金属元素由上向下非金属性依次减弱,其相应离子的还原性越强;
同主族非金属元素由上向下电负性依次减小,成键电子对之间的斥力越小,键角越小;
(3)配位数是直接与中心离子或原子配位的的离子或分子的数目;螯合N的杂化方式为:sp2;
(4)结合部分原子的的分数坐标,结合晶胞图,确定各原子在晶胞中的位置,找出相应原子。
本题考查学生对原子结构和性质的理解和掌握,题目难度中等,掌握常见的分子的空间构型、晶体类型、杂化方式、配位数、晶胞的计算等,明确原子杂化原理和晶胞的计算是解题关键。同时考查阅读题目获取新信息能力,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力。
18.【答案】+40.9 乙p1>p2>p3T1时以反应III为主,反应III前
后气体分子数相等,压强改变对平衡没有影响 A
【解析】解:(1)Ⅰ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.5 kJ?mol-1 Ⅱ.CO(g)+2H2(g)?CH3OH(g)△H2=-90.4 kJ?mol-1
根据盖斯定律反应I-反应II计算反应III:CO2(g)+H2(g)?CO(g)+H2O(g)的焓变△H3=-49.5kJ?mol-1-(-90.4kJ?mol-1)=+40.9J?mol-1,
故答案为:+40.9;
(2)根据C原子守恒计算n(CO2)平衡=1-n(CH3OH)-n(CO)=(1-a-b)mol,O原子守恒有n(H2O)=2[n(CO2)-n(CO2)平衡]-n(CH3OH)-n(CO)=2[1-
(1-a-b)]mol-amol-bmol=(a+b)mol,则c(H2O)=mol/L,H原子守恒得到n(H2)
平衡=[2n(H2)-4n(CH3OH)-2n(H2O)]=[3×2-4a-2(a+b)]mol=(3-3a-b)mol,由于反应III是气体体积不变化的反应,可将平衡时各物质的物质的量数值代入平衡常数表达式中计算K,即K==,
故答案为:;;
(3)反应III是气体体积不变化的反应,CO2的平衡转化率只与温度有关,由图乙可知,T1温度后纵坐标对应量的变化与压强无关(3条曲线重合)、只与温度有关,所以图乙对应纵坐标表示CO2平衡转化率,图甲表示CH3OH的平衡产率随温度的变化曲线,温度一定时,增大压强,反应I、II的平衡正向移动,CH3OH的平衡产率增大,即压强越大,CH3OH的平衡产率越大,由图可知相同温度下,p1时CH3OH的平衡产率最大,p3时CH3OH的平衡产率最小,所以压强:p1>p2>p3;由于反应III:CO2(g)+H2(g)?CO(g)+H2O(g)是气体体积不变化的吸热反应,T1温度时,体系中主要发生反应III,所以三条曲线几乎交于一点,
故答案为:乙;p1>p2>p3;T1时以反应III为主,反应III前后气体分子数相等,压强改变对平衡没有影响;
(4)该实验的目的是探究有利于提高CH3OH的产率的影响因素,则反应I为主反应,反应II、III为副反应,反应I正向是气体体积减小的放热反应,高压、低温均有利于主反应I的平衡正向移动,反应III受到抑制、反应III的抑制导致反应II也受到抑制,所以同时提高CO2的平衡转化率和CH3OH的平衡产率的反应条件为高压、低温,故A正确,
故答案为:A。
(1)根据盖斯定律反应I-反应II计算反应III的焓变△H3;
(2)根据C原子守恒计算平衡时n(CO2)=(1-a-b)mol,再根据O、H原子守恒计算平衡时n(H2O)=(a+b)mol、n(H2)=(3-3a-b)mol,结合反应III的平衡常数表达式计算反应Ⅲ的平衡常数K;
(3)由图乙可知,T1温度后纵坐标对应量的变化与压强无关(3条曲线重合)、只与温度有关,而反应III是气体体积不变化的反应,CO2的平衡转化率只与温度有关;温度一定时,增大压强,反应I、II的平衡正向移动,CO2的平衡转化率或CH3OH的平衡产率均增大,即压强越大,CO2的平衡转化率或CH3OH的平衡产率越大;
(4)该实验的目的是探究有利于提高CH3OH的产率的影响因素,则反应I为主反应,反应II、III为副反应,有利于反应I正向进行、副反应受到抑制的措施均能提高CO2的平衡转化率和CH3OH的平衡产率,结合化学平衡移动的影响因素分析解答。
本题考查化学平衡的计算,涉及化学平衡的影响因素、化学平衡常数的计算、图象分析以及盖斯定律的计算的应用等等知识,侧重考查学生分析能力和计算能力,把握化学平衡常数的计算、图象分析判断和化学平衡的影响因素是解题关键,注意原子守恒的计算应用,题目难度中等。
19.【答案】CH3COOH+CH3CH2OH CH3COOC2H5+H2O 及时蒸出产物(或增大乙酸或乙醇的用量)取代反应羰基、酰胺
基CH3COCH2COOH
【解析】解:(1)根据分析,有机物A为乙酸乙酯,在实验室中用乙醇和乙酸在浓硫酸的催化下制备,反应方程式为CH3COOH+CH3CH2OH CH3COOC2H5+H2O;该
反应为可逆反应,若想提高乙酸乙酯的产率需要及时的将生成物蒸出或增大反应的用量;A的某种同分异构体只有1种化学环境的C原子,说明该同分异构体是一个对称结
构,含有两条对称轴,则该有机物的结构为,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;及时蒸出产物(或增大乙酸或乙醇的用量);;
(2)根据分析,C→D为和SOCl2的反应,反应类型为取代反
应;E的结构,其结构中含氧官能团为羰基、酰胺基,
故答案为:取代反应;羰基、酰胺基;
(3)根据分析,C的结构简式为CH3COCH2COOH;F的结构简式
,
故答案为:CH3COCH2COOH;;
(4)以苯胺和H5C2OOCCH2COCl为原料制得目标产物,可将苯胺与溴反应生成2,4,6-三溴苯胺,再将2,4,6-三溴苯胺与H5C2OOCCH2COCl反应发生已知条件Ⅱ的取代反应,再发生已知条件Ⅲ的成环反应即可得到目标产物,反应的流程
故答案为。
根据B的结构和已知条件Ⅰ可知R=H、R'=CH2H5,故A为CH3COOC2H5(乙酸乙酯),
有机物B经过碱性条件下水解再酸化形成有机物C),有机物C与SOCl2作用通过已知条件Ⅱ生成有机物D),有机物
D与邻氯苯胺反应生成有机物E),有机物E经已知条件Ⅲ发生成环反应生成有机物F),据此分析。
(4)和Br2发生取代反应生成
,
和H5C2OOCCH2COCl发生已知的反应Ⅱ,
生成,然后在条件下,发生已知反
应Ⅲ,生成目标产物。
本题考查了有机物的推断,正确理解题给信息是解本题关键,采用正推的方法进行分析解答,注意结合题干所给的提示信息,难度中等。
20.【答案】平衡气压,使浓盐酸顺利流下NaOH溶液Ca(ClO)
+4HCl=CaCl2+Cl2↑+2H2O 在装置A、B之间加装有饱和食盐水的洗气瓶酸
2
式 C ×100% B、D
【解析】解:(1)装置A中a的作用是平衡气压,使浓盐酸顺利流下;装置C中的试剂为NaOH溶液、吸收尾气;装置A中制备Cl2的化学方程式为Ca(ClO)
+4HCl=CaCl2+Cl2↑+2H2O,
2
故答案为:平衡气压,使浓盐酸顺利流下;NaOH溶液;Ca(ClO)
+4HCl=CaCl2+Cl2↑+2H2O;
2
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是在装置A、B之间加装有饱和食盐水的洗气瓶,
故答案为:在装置A、B之间加装有饱和食盐水的洗气瓶;
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入酸式滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为大于(50.00-15.00)mL=35.00mL,可选C,
故答案为:酸式;C;
(4)由I可知样品中Fe2+、C2O42-、H2C2O4消耗的KMnO4溶液的体积为V1mL,KMnO4的物质的量为V1×10-3L×cmol/L=cV1×10-3mol,
由II可知Fe2+消耗的KMnO4溶液的体积为V2mL,KMnO4的物质的量为
V2×10-3L×cmol/L=cV2×10-3mol,
由电子守恒可知存在5Fe2+~MnO4-,5C2O42-~2MnO4-,可知H2C2O4消耗的高锰酸钾的物质的量为(cV1×10-3mol-3cV2×10-3mol),H2C2O4的物质的量为2.5
(cV1×10-3mol-3cV2×10-3mol),
样品中所含H2C2O4?2H2O(M=126g?mol-1)的质量分数表达式为
×100%=×100%,
A.=3时,样品中一定不含H2C2O4?2H2O杂质,可含Fe2(C2O4)3,故A错误;B.由H2C2O4?2H2O的质量分数表达式可知,越大,样品中H2C2O4?2H2O含量一定越高,故B正确;
C.若步骤Ⅰ中滴入KMnO4溶液不足,则II中消耗高锰酸钾偏大,可知测得样品中Fe 元素含量偏高,故C错误;
D.若所用KMnO4溶液实际浓度偏低,则消耗高锰酸钾的体积偏大,测得样品中Fe元素含量偏高,故D正确;
故答案为:×100%;B、D。
由实验装置及制备原理可知,漂白粉的有效成分为Ca(ClO)2具有强氧化性,A中漂白粉和浓盐酸发生归中反应产生Cl2,B中Cl2和K2MnO4反应产生KMnO4,反应不完的Cl2用C中NaOH溶液吸收。
(1)装置A中a的作用使分液漏斗内的液体顺利流下,C的作用是吸收反应不完的Cl2,装置A中发生Ca(ClO)2和浓盐酸反应产生Cl2,结合电子守恒和原子守恒写出反应的化学方程式;
(2)锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
3MnO42-+2H2O=2MnO4-+MnO2↓+4OH-,浓盐酸具有挥发性,应在AB之间加装饱和食盐水的洗瓶,吸收氯化氢;
(3)高锰酸钾具有强氧化性,应选酸式滴定管,滴定管的“0”刻度在上,规格为50.00mL的滴定管中实际的体积大于(50.00-15.00)mL;
2013年普通高等学校招生全国统一考试(山东卷) 理 科 数 学 参考公式:如果事件A 、B 互斥,那么()()+()P A B P A P B += 如果事件A 、B 独立,那么()()()=?P AB P A P B 。 第Ⅰ卷(共60分) 一、选择题:本大题共12小题。每小题5分共60分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1、复数z 满组(3)(2)5--=z i (z 为虚数单位),则z 的共轭复数z 为 (A) 2+i (B) 2-i (C) 5+i (D) 5-i 2、已知集合{}0,1,2=A ,则集合{} ,=-∈∈B x y x A y A 中元素的个数是 (A) 1 (B) 3 (C) 5 (D) 9 3、已知函数()f x 为奇函数,且当0>x 时,21 (),=+ f x x x 则(1)-=f (A) -2 (B) 0 (C) 1 (D) 2 4、已知三棱柱111-ABC A B C 的侧棱与底面垂直,体积为9 4 , 的正三角形,若P 为底面111A B C 的中心,则PA 与平面ABC 所成角的大小为 (A) 512π (B) 3π (C) 4π (D) 6 π 5、将函数sin(2)?=+y x 的图象沿x 轴向左平移 8 π 个单位后,得到一个偶函数的图象,则?的一个可能取值为 (A) 34π (B) 4 π (C) 0 (D) 4π- 6、在平面直角坐标系xOy 中,M 为不等式组220210,380, --≥?? +-≥??+-≤? x y x y x y 所表示的区域上一动点,则直线OM 的斜率的 最小值为 (A) 2 (B) 1 (C) 13- (D) 12 - 7、给定两个命题,.p q 若?p 是q 的必要不充分条件,则p 是?q 的 (A) 充分不必要条件 (B) 必要不充分条件 (C) 充要条件 (D) 既不充分也不必要条件 8、函数cos sin =+y x x x 的图象大致为 (A) (B) (C) (D) 9、过点(3,1)作圆2 2 (1)1-+=x y 的两条切线,切点分别为,A B ,则直线AB 的方程为
一文看懂山东新高考改革方案 继上海、浙江之后,山东省成为了第二批高考综合改革试点省市。因此山东近日公布的新高考改革方案备受关注。统考“语数外”、文理不分科、“学考”成绩记入高考……,此次山东出台的高考改革方案究竟说了些什么,中国教育在线整理8大重点带你看个明白。 1. 2020年整体实施新高考改革方案 根据方案,山东2017年启动高等学校考试招生综合改革试点,2020年整体实施,形成分类考试、综合评价、多元录取的高校考试招生模式。 2. 高考将采取3+3模式2020年只统考语数外 自2020年起,夏季高考统一考试科目为语文、数学、外语(含英语、俄语、日语、法语、德语、西班牙语)3个科目,不分文理科,外语考试分两次进行。 3. 取消文理分科 “3+3”模式中的第二个“3”是指3门选考科目,对于选考科目考生可以从思想政治、历史、地理、物理、化学、生物6门学科中任意选择3科进行等级考试。 这意味着,新高考后不再有目前文综和理综的固定科目组合,考生可以打破文理科的界限进行自由选择和组合,考试也由相同科目的竞争转换为了特长科目的竞争。 4. 高考总分750 由语数外+三门等级考试成绩构成 考生的高校招生录取总成绩由3门统一高考科目成绩和自主选择的3门普通高中学业水平等级考试科目成绩组成,总分为750分。等级考试科目包括思想政治、历史、地理、物理、化学、生物6个科目。条件成熟时,可纳入技术(信息技术、通用技术)等科目。 其中,统一高考科目语文、数学、外语的卷面满分分值均为150分,总分450分;考生自主选择的3门普通高中学业水平等级考试科目每科卷面满分分值均为100分,转换为等级分按满分100分计入,等级考试科目总分300分。
1 2020年山东省化学高考试题 一、单选题(每小题2分,共20分) 1.实验室中下列做法错误的是 A .用冷水贮存白磷 B .用浓硫酸干燥二氧化硫 C .用酒精灯直接加热蒸发皿 D .用二氧化碳灭火器扑灭金属钾的燃烧 2.下列叙述不涉及氧化还原反应的是 A .谷物发酵酿造食醋 B .小苏打用作食品膨松剂 C .含氯消毒剂用于环境消毒 D .大气中NO 2参与酸雨形成 3.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,基态X 原子的电子总数是其最高能级电子数的2倍,Z 可与X 形成淡黄色化合物Z 2X 2,Y 、W 最外层电子数相同。下列说法正确的是 A .第一电离能:W>X>Y>Z B .简单离子的还原性:Y>X>W C .简单离子的半径:W>X>Y>Z D .氢化物水溶液的酸性:Y>W 4.下列关于C 、Si 及其化合物结构与性质的论述错误的是 A .键能C C>Si Si —— 、C H>Si H —— ,因此C 2H 6稳定性大于Si 2H 6 B .立方型Si C 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4 D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p p π— 键 5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是
A.用甲装置制备并收集CO2 B.用乙装置制备溴苯并验证有HBr产生 C.用丙装置制备无水MgCl2 D.用丁装置在铁上镀铜 6.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于calebin A的说法错误的是 A.可与FeCl3溶液发生显色反应 B.其酸性水解的产物均可与Na2CO3溶液反应 C.苯环上氢原子发生氯代时,一氯代物有6种 D.1mol该分子最多与8molH2发生加成反应 7.B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是A.其熔点主要取决于所含化学键的键能 B.形成大π键的电子全部由N提供 C.分子中B和N的杂化方式相同 D.分子中所有原子共平面 8.实验室分离Fe3+和Al3+的流程如下:
绝密★启用并使用完毕前 2013年普通高等学校招生全国统一考试(山东卷) 理科数学 本试卷分第Ⅰ卷和第Ⅱ卷两部分。共4页,满分150分。考试用时150分钟.考试结束后,将本卷和答题卡一并交回。 注意事项: 1. 答题前,考试务必用0.5毫米黑色墨水签字笔将自己的姓名、座号、考生号、县区和科类在答题卡和试卷规定的位置上。 2. 第Ⅰ卷每小题选出答案后,用2B 铅笔把答题卡上对应题目答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,答案不能答在试卷上。 3. 第Ⅱ卷必须用0.5毫米黑色墨水签字笔作答,答案必须写在答题卡各题目指定区域内相应的位置,不能写在试卷上;如需改动,先划掉原来的答案,然后再写上新的答案;不能使用涂改液、胶带纸、修正带。不按以上要求作答的答案无效。 4. 填空题请直接填写答案,解答题应写出文字说明\证明过程或演算步骤. 参考公式:如果事件A ,B 互斥,那么P (A+B )=P(A)+P(B);如果事件A ,B 独立,那么P (AB )=P(A)*P(B) 第Ⅰ卷 (共60分) 一、选择题:本大题共12小题,每小题5分,满分60分.在每小题给出的四个选项中,只有一项是符合题目要求的. 1、复数z 满足i i z (5)2)(3(=--为虚数单位),则z 的共轭复数- z 为( ) (A )2+i (B )2-i (C )5+i (D )5-i 【解析】i i i z +=++=+-= 532325 ,所以i z -=5,故选D. 2、已知集合}2,1,0{=A ,则集合},|{A y A x y x B ∈∈-=中元素的个数是( ) (A )1 (B )3 (C )5 (D )9 【解析】{}2,1,0,2,1},|{--=∈∈-=A y A x y x B ,所以有5个元素,故选C. 3、已知函数)(x f 为奇函数,且当0>x 时,x x x f 1 )(2 + =,则)1(-f =( ) (A )-2 (B )0 (C )1 (D )2 【解析】()()211-=-=-f f ,故选A 。 4、已知三棱柱111C B A ABC -的侧棱与底面垂直,体积为4 9 ,底面是边长为3的正三角形,若P 为底面111C B A 的中心,则PA 与平面ABC 所成角的大小为( ) (A ) 125π (B )3π (C )4π (D )6 π 【解析】因为底面边长为3的正三角形,所以底面积为() 4 3 334 3 2 = = S ,
普通高等学校招生全国统一考试(山东卷) 理科综合能力测试化学部分 第I卷 7.下表中对应关系正确的是 CH3CH 3+Cl 2CH 3 CH2Cl+HCl CH2=CH2+HCl CH3CH2Cl 由油脂得到甘油 8 A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 B.核外电子排布相同的微粒化学性质也相同 C.Cl ̄、S2 ̄、Ca2+、K+半径逐渐减小 D.与得电子能力相同 与9.等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是A.FeO B. Fe2O3 C. FeSO4D、Fe3O4 10.下列实验操作或装置(略去部分加持仪器)正确的是 11.苹果酸的结构简式为HOOC CH CH2—COOH,下列说法正确的是A.苹果酸中能发生酯化反应的官能团有2种 B.1mol苹果酸可与3mol NaOH发生中和反应 C.1mol苹果酸与足量金属Na反应生成生成1mol H2 D.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体 12.下列有关溶液组成的描述合理的是 A.无色溶液中可能大量存在Al3+、NH4+、Cl ̄、S2 ̄ B.酸性溶液中可能大量存在Na+、ClO ̄、SO42 ̄、I ̄ OH
C.弱碱性溶液中可能大量存在Na+、K+、Cl ̄、HCO3 ̄ D.中性溶液中可能大量存在Fe3+、K+、Cl ̄、SO42 ̄ 13.已知某温度下CH3COOH和NH3?H2O 的电离常数相等,现向10mL浓度为0.1mol?L ̄1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中 A.水的电离程度始终增大 B.c(NH4+)/c(NH3?H2O)先增大再减小 C.c(CH3COOH)与c(CH3COO ̄)之和始终保持不变 D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO ̄) 29.(17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)K1?H < 0 (I) 2NO(g)+Cl2(g)2ClNO(g)K2?H < 0 (II) (1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。 (2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10- 3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条 件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2а1(填 “>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”。若要使K2减小,可 采用的措施是。 (3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L ̄1的 CH3COONa溶液,则两溶液中c(NO3 ̄)、c(NO2-)和c(CH3COO ̄)由大到小的顺序 为。(已知HNO2的电离常数K a=7.1×10-4mol?L ̄1,CH3COOH的电 离常数K a=1.7×10-5mol?L ̄1,可使溶液A和溶液B的pH相等的方法是。 a.向溶液A中加适量水b.向溶液A中加适量NaOH c.向溶液B中加适量水d.向溶液B中加适量NaOH 30.(16分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。 (1)钢制品应接电源的极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为。若改用AlCl3水溶液作电解液,则阴极产物为。 (2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为mol。 (3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有。
2012年山东省高考数学试卷(理科) 参考答案与试题解析 一、选择题:本大题共12小题,每小题5分,共60分,在每小题给出的四个选项中,只有一项是符合题目要求的. 2.(5分)(2012?山东)已知全集U={0,1,2,3,4},集合A={1,2,3},B={2,4},则 3.(5分)(2012?山东)设a>0且a≠1,则“函数f(x)=a x在R上是减函数”,是“函数g(x)3
4.(5分)(2012?山东)采用系统抽样方法从960人中抽取32人做问卷调查,为此将他们随机编号为1,2,…,960,分组后在第一组采用简单随机抽样的方法抽到的号码为9.抽到的32人中,编号落入区间[1,450]的人做问卷A,编号落入区间[451,750]的人做问卷B, 5.(5分)(2012?山东)设变量x,y满足约束条件,则目标函数z=3x﹣y的 B
( 6.(5分)(2012?山东)执行程序框图,如果输入a=4,那么输出的n的值为()
7.(5分)(2012?山东)若,,则sinθ=() B 解:因为 =﹣ , , = 8.(5分)(2012?山东)定义在R上的函数f(x)满足f(x+6)=f(x),当﹣3≤x<﹣1时,f(x)=﹣(x+2)2,当﹣1≤x<3时,f(x)=x.则f(1)+f(2)+f(3)+…+f(2012)=
9.(5分)(2012?山东)函数y=的图象大致为() .D. , ﹣ y=
10.(5分)(2012?山东)已知椭圆C:+=1(a>b>0)的离心率为,与双曲线x2﹣y2=1的渐近线有四个交点,以这四个交点为顶点的四边形的面积为16,则椭圆C的方程 +=1 B +=1 +=1 +=1 +=1.利用 :=1 +=1 11.(5分)(2012?山东)现有16张不同的卡片,其中红色、黄色、蓝色、绿色卡片各4张,从中任取3张,要求取出的这些卡片不能是同一种颜色,且红色卡片至多1张,不同取法的
最新山东省2020年新高考改革政策涉及了哪些重要问题 山东省2020年新高考改革政策涉及的重要问题有哪些 1、2020年山东省高等学校招生考试分哪些类型?夏季高考和春季高考可以兼报吗?兼报的如何录取? 答:2020年山东省高等学校考试招生类型分为春季高考和夏季高考两种,具体见《2020年山东省高等学校考试招生类型总览表》。 符合报名条件的考生可以兼报夏季高考和春季高考。兼报考生符合录取条件、且被春季高考和夏季高考双录取的考生,必须在规定的时间内确认就读学校,否则视为考生放弃当年高考录取资格。 2、哪些人员可以报名参加高考? 答:高中阶段学校毕业生或具有同等学力人员均可报名参加高考,包括取得高中阶段学校的毕业证书、结业证书或普通高中教育同等学力认定证明的人员。具有普通高中完整学习经历但学业水平合格考试有不合格科目的学生,可以获得学校颁发的结业证书,以同等学力身份报名参加高考。
3、夏季高考各科目考试时间是如何安排的? 答:夏季高考分为国家统一考试和普通高中学业水平等级考试两部分,时间安排如下: (1)国家统一高考 统一高考科目使用全国统一命题试卷,考试时间安排在6月7日全天和8日下午,其中语文考试时间150分钟,数学考试时间120分钟,外语(笔试)考试时间100分钟。外语(听力)考试安排在1月8日上午,连续组织两次,每次考试时长约20分钟,考试成绩取两次中的高分计入高考外语科目成绩。 (2)普通高中学业水平等级考试 普通高中学业水平等级考试由我省自主命题,考生从思想政治、历史、地理、物理、化学、生物等6个科目中选报3科参加考试。考试时间安排在6月9日至10日,每科考试时间90分钟。 4、夏季高考总成绩是怎样构成的?
2019 年高考试题—理综化学(山东卷)解析版 注意事项 :认真阅读理解,结合历年的真题,总结经验,查找不足!重在审题,多思考,多 理解! 无论是单选、多选还是论述题, 最重要的就是看清题意。 在论述题中, 问题大多具有委 婉性, 尤其是历年真题部分, 在给考生较大发挥空间的同时也大大增加了考试难度。 考生要 认真阅读题目中提供的有限材料, 明确考察要点, 最大限度的挖掘材料中的有效信息, 建议 考生答题时用笔将重点勾画出来, 方便反复细读。 只有经过仔细推敲, 揣摩命题老师的意图, 积极联想知识点,分析答题角度,才能够将考点锁定,明确题意。 7、以下与化学概念有关的说法正确的选项是 A 、化合反应均为氧化还原反应 B 、金属氧化物均为碱性氧化物 C 、催化剂能改变可逆反应达到平衡的时间 D 、石油是混合物,其分馏产品汽油为纯净物 【解析】此题考查化学基本概念。有单质参加的化合反应为氧化还原反应, A 项错误; Mn 2O 7 为酸性氧化物, Al O 为两性氧化物, B 项错误;催化剂能影响反应速率,改变可逆反应达到 2 3 平衡的时间, C 项正确;石油的分馏产物汽油为混合物, D 项错误。 答案: C 8、以下与含氯化合物有关的说法正确的选项是 A 、 HClO 是弱酸,所以 NaClO 是弱电解质 B 、向沸水中逐滴加入少量饱和 FeCl 3 溶液,可制得 Fe(OH)3 胶体 C 、 HCl 溶液和 NaCl 溶液均通过离子导电,所以 HCl 和 NaCl 均是离子化合物 D 、电解 NaCl 溶液得到 22.4LH 2 ( 标准状况 ) ,理论上需要转移 N 个电子 (N 表示阿伏加德 A A 罗常数 ) 【解析】 NaClO 属于盐, 为强电解质, A 项错误; 向沸水中滴加饱和 FeCl 3 制备 Fe(OH)3 胶体, B 项正确; HCl 属于共价化合物, C 项错误;根据电解 NaCl 溶液的阴极反应 :2H + +2e -2 =H ↑, 产生标准状况下 22.4LH 2,转移 2N A 个电子, D 项错误。 答案: B 9、以下关于原子结构、元素性质的说法正确的选项是 A 、非金属元素组成的化合物中只含共价键 B 、 IA 族金属元素是同周期中金属性最强的元素 C 、同种元素的原子均有相同的质子数和中子数 D 、Ⅶ A 族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 【解析】 NH 4Cl 全部由非金属元素组成,但含有离子键和共价键, A 项错误;同周期元素从 左到右金属性逐渐减弱,各周期中Ⅰ A 族元素的金属性最强, B 项正确;同种元素的原子的 质子数相同,但中子数不同, C 项错误;Ⅶ族元素的阴离子还原性越强,那么元素的金属性 越弱,其最高价氧化物对应水化物的酸性越弱, D 项错误。 答案: B 10、以下与有机物的结构、性质有关的表达正确的选项是 A 、苯、油脂均不能使酸性 KMnO,溶液褪色 B 、甲烷和 Cl 2 的反应与乙烯和 Br 2 的反应属于同一类型的反应 C 、葡萄糖、果糖的分子式均为 C 6H 12O 6,二者互为同分异构休 D 、乙醇、乙酸均能与 Na 反应放出 H 2,二者分子中官能团相同
省2020年普通高中学业水平等级考试 物理试题 注意事项: 1.答卷前,考生务必将自己的、考生号等填写在答题卡和试卷指定位置。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需 改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 一、单项选择题:本题共8小题,每小题3分,共24分。每小题只有一个选项符合题目要求。 1.一质量为m 的乘客乘坐竖直电梯下楼,其位移s 与时间t 的关系图像如图所示。乘客所 受支持力的大小用F N 表示,速度大小用v 表示。重力加速度大小为g 。以下判断正确的是 A .0~t 1时间,v 增大,F N >mg B .t 1~t 2 时间,v 减小,F N
2013年普通高等学校招生全国统一考试(山东卷) 理科数学 本试卷分第I 卷和第II 卷两部分,共4页。满分150分。考试用时120分钟,考试结束,务必将试卷和答题卡一并上交。 注意事项: 1.答题前,考生务必用直径0.5毫米黑色墨水签字笔将自己的姓名、准考证号、县区和科类填写在答题卡上和试卷规定的位置上。 2.第I 卷每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号,答案不能答在试卷上。 3.第II 卷必须用0.5毫米黑色签字笔作答,答案必须写在答题卡各题目指定区域内相应的位置,不能写在试卷上;如需改动,先划掉原来的答案,然后再写上新的答案;不能使用涂改液、胶带纸、修正带。不按以上要求作答的答案无效。 4.填空题请直接填写答案,解答题应写出文字说明、证明过程或演算步骤。 参考公式: 如果事件A ,B 互斥,那么P (A+B )=P (A )+P(B);如果事件A,B 独立,那么P (AB )=P (A )·P (B )。 第I 卷(共60分) 一、 选择题:本大题共12小题,每小题5分,共60分,在每小题给出的四个选项中,只有一项是符合题目要 求的。 (1) 若复数z 满足(z-3)(2-i)=5(i 为虚数单位),则z 的共轭复数z 为 (A ) 2+i (B ) 2-i (C ) 5+i (D ) 5-i (2) 已知集合A ={0,1,2},则集合B={x-y|x ∈A, y ∈A}中元素的个数是 (A ) 1 (B ) 3 (C ) 5 (D ) 9 (3)已知函数f(x) 为函数设且x >0时, f(x)= x 2 +x 1 ,则f(-1)= (A ) -2 (B ) 0 (C ) 1 (D ) 2 (4)已知三棱柱ABC-A 1B 1C 1的侧棱与底面垂直,体积为4 9 ,底面是边长为3的正三角形,若P 为底面A 1B 1C 1的中心,则PA 与平面ABC 所成角的大小为 (A ) 125π (B )3π (C )4π (D )6π (5)将函数y=sin(2x+Φ)的图象沿轴向左平移个单位后,得到一个偶函数的图象,则Φ的一个可能取值为 (A ) 43π (B )4π (C )0 (D )-4 π (6)在平面直角坐标系xOy 中,M 为不等式组0 83012022≤-+≥-+≥--y x y x y x ,所表示的区域上一动点,则直线OM 斜率的最小 值为
2020山东高考新政策 有关2019山东高考新政策,山东的高考政策新变化,编辑。 9月初国务院发布了中高考(微博)改革的顶层设计框架,相比于全国的改革,山东高考会有什么变化?考生和家长更为关注。山东省教育厅召开新闻通气会,发布了2019年高考改革的细节:明年山东省高考英语科目将启用全国卷,今年被取消的英语听力将重新回到高考行列中,艺术类考生提前批可以填报两个顺序志愿。 明年英语将用全国卷 9月4日,国务院正式印发了《关于深化考试招生制度改革的实施意见》,意见明确提出从2019年起增加使用全国统一命题试卷的省份。当时就有老师猜测我省明年高考可能会使用全国卷。 尽管山东卷有着鲜明的地域特色,但省教育厅相关负责人曾表示,虽然最近几年“山东卷”质量也比较高,但毕竟一个省的专家水平与全国专家水平还是有所差距的。 省教育厅在新闻通气会上明确表示,根据国家关于增加使用全国统一命题试卷省份的部署要求,结合我省实际,报请教育部批准后,2019年起夏季高考外语(含听力)科目使用全国试卷。 英语启用全国卷意味着去年退出高考行列的英语听力测试将重新恢复。作为高考一项重大改革,我省在2019年取消了高考外语听力考试,2019年高考英语试卷满分从现在的150分降到120分。 听力恢复有利于英语学习
记者采访了多名英语教师,对于英语试卷的调换老师们都有些吃惊。青岛市普教研英语教研员武继国表示,“英语听力恢复是个好事,毕竟作为一种语言工具,英语的听和说两项技能要比读和写重要。”武继国说,取消英语听力考试的时候,一线英语教师就认为用不了多长时间就会恢复。 青岛15中教导处副主任、英语教师杨睿也认为,恢复听力考试有利于英语的学习,“不考听力了,学生们对听力的重视程度就会下降,但学英语主要是为了交流,听不懂如何跟人交流?”杨睿说。 对于单项选择题的取消,武继国认为同样是一种引导,山东卷中的单项选择考查的多是独立的小语境以及语法记忆等,改用全国卷后将更多地考查英语知识在语境中的应用,“更加重视应用而不是死记硬背。”杨睿说,近年来山东卷中有一个阅读表达的题型,对绝大部分考生来说难度较大,“学生们知道不用全国卷了都很高兴,终于可以摆脱这个题型的困扰了。”杨睿说,不过全国卷中的改错题难度同样不小。 “无论是山东卷,还是全国卷,执行的教学大纲是一致的。”青岛58中副校长吴峰说,山东卷和全国卷相比,题型上可能会有些差异,个别内容也会有所偏重,但总体来看,考查的内容基本一致,考生也不必太惊慌。 春季高考高职继续扩招 发布的《关于2019年普通高校考试招生有关事项的通知》中明确提出,山东省普通高校考试招生继续实行春季高考和夏季高考分类
2020年山东省高考录取加分项目 一、下列考生在录取时可以享受增加分数或降低分数投档照顾: 1.烈士子女,其高考成绩总分低于高校调档分数线20分以内的,可以向高校投档,由高校审查决定是否录取。 2.自主就业的退役士兵,可在其高考成绩总分的基础上增加10 分投档,由高校审查决定是否录取。 3.在服役期间荣立二等功(含)以上或被大军区(含)以上单位授予荣誉称号的退役军人,可在其高考成绩总分的基础上增加20分投档,由高校审查决定是否录取。 4.归侨、华侨子女、归侨子女和台湾省籍考生,其高考成绩总分低于高校调档分数线10分之内的,可以向高校投档,由高校审查决 定是否录取。 5.山区、少数民族聚居地区的少数民族考生,其高考成绩总分低于省属高校调档分数线5分之内的,可以向省属高校投档,由省属 高校审查决定是否录取。 二、2015年1月1日前获得以下奖项的考生在录取时可以享受 增加5分或降低5分投档照顾: 1.按《中共中央办公厅国务院办公厅关于适应新形势进一步加强和改进中小学德育工作的意见》(中办发〔2000〕28号)和《教育部 关于学习贯彻〈中共中央办公厅国务院办公厅关于适应新形势进一 步加强和改进中小学德育工作的意见〉的通知》(教基〔2001〕1号)评选获得省级优秀学生称号的应届高级中等教育学校毕业生,在其 高考成绩总分的基础上增加5分投档,由高校审查决定是否录取。 2.受省、市人民政府表彰或受省综治委表彰的高级中等教育阶段见义勇为的应届毕业生,高考成绩总分低于高校调档分数线5分之 内的,可以向高校投档,由高校审查决定是否录取。见义勇为考生 的认定以政府颁发的证书为准。
3.在高级中等教育阶段,参加重大国际体育比赛集体或个人项目取得前6名;全国性体育比赛个人项目取得前6名;获国家二级运动 员(含)以上称号并参加省教育招生考试院组织的统一测试(测试项目 仅限田径、篮球、足球、排球、乒乓球、武术、游泳、羽毛球等8项)达到相应标准的应届毕业生考生,在其高考成绩基础上增加5分 向高校投档,由高校审查决定是否录取。 4.获省级以上表彰的先进劳模青年,高考成绩总分低于高校调档分数线5分之内的,可以向高校投档,由高校审查决定是否录取。 5.高级中等教育阶段获得下列奖项的应届毕业生,参加高考录取时在其高考成绩总分的基础上增加5分投档,由高校审查决定是否 录取。 (1)中国科学技术学会举办的全国中学生(数学、物理、化学、生物学、信息学)奥林匹克竞赛全国决赛一、二、三等奖获得者; (2)全国青少年科技创新大赛(含全国青少年生物和环境科学实践活动)、“明天小小科学家”奖励活动、全国中小学电脑制作活动一、二等奖获得者; (3)在国际科学与工程大奖赛、国际环境科研项目奥林匹克竞赛 中获奖者。 三、同一考生若符合上述多项增加分数或降低分数要求投档条件的,只能取其中最高一项分值加分或降分,不可重复计算。 各报名点及相关单位要加强对享受分数照顾考生的资格审查工作,认真审验各种证明材料。 四、下列考生在与其他考生同等条件下,高校应优先录取: 1.退出部队现役的。 2.平时荣获二等功或者战时荣获三等功以上奖励的军人的子女,一至四级残疾军人的子女,因公牺牲军人的子女。 3.驻国家确定的三类以上艰苦边远地区和西藏自治区,解放军总部划定的二类以上岛屿工作累计满20年的军人的子女,在国家确定
2013 山东高考数学试题 一、选择题:本大题共12小题,每小题5分,满分60分.在每小题给出的四个选项中,只有一项是符合题目要求的。 (1)复数z满足(z-3)(2-i)=5(i为虚数单位),则z的共轭复数为( D ) A. 2+i B.2-i C. 5+i D.5-i (2)设集合A={0,1,2},则集合B={x-y |x∈A, y∈A }中元素的个数是( C ) A. 1 B. 3 C. 5 D.9 (A)-2 (B)0 (C)1 (D)2 (6)在平面直角坐标系xOy中,M为不等式组: 2x y20 x2y10 3x y80 --≥ ? ? +-≥ ? ?+-≤ ? ,所表示的区域上一动点,则直线 OM斜率的最小值为 C (7)给定两个命题p、q,若﹁p是q的必要而不充分条件,则p是﹁q的 B (A)充分而不必条件(B)必要而不充分条件 (C)充要条件(D)既不充分也不必要条件
(8)函数y=xcosx + sinx 的图象大致为 D (A ) (B ) (C) (D) (9)过点(3,1)作圆(x-1)2+y 2=1的两条切线,切点分别为A ,B ,则直线AB 的方程为 A (A )2x+y-3=0 (B )2x-y-3=0 (C )4x-y-3=0 (D )4x+y-3=0 (10)用0,1,…,9十个数字,可以组成有重复数字的三位数的个数为 B (A )243 (B )252 (C )261 (D )279 的点M.若C 1在点M 处的切线平行于C 2的一条渐近线,则p= D (15)已知向量AB 与AC 的夹角为120 ,且||3,||2,AB AC ==若 ,AP AB AC λ=+ 且AP BC ⊥ ,则实数λ的值为 712 (16)定义“正对数”:0,01ln ln ,1x x x x +<>,则ln ()ln b a b a ++=
2018 年山东高考理综化学试题与解读 7、化学与生产和生活密切相关,下列说法正确的是 A.聚乙烯塑料的老化是因为发生了加成反应 B.煤经过气化和液化等物理变化可以转化为清洁能源 C.合成纤维、人造纤维及碳纤维都能属于有机高分子材料 D.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化的 过程过程糖 JP4ypUQ5mV 7、【答案】 D 8 、 W、X、 Y、 Z 四种短周期元素在元素周期表中的相对位置如图所示, W的气态氢化物可以与其W X最高价 氧化物反应生成离子化合物,由此可以YZ 知: JP4ypUQ5mV A.X、 Y、 Z、中最简单氢化物稳定性最弱的是Y B.Z 元素氧化物对应水化物的酸性一定强于Y C.X 元素形成的单核阴离子还原性大于Y D.Z 元素的单质在化学反应中只表现氧化性 8、【答案】 A 9、足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是 A. 氢氧化钠溶液 B.稀硫酸 C. 盐酸 D. 稀硝酸 9、【答案】 A
10、莽草酸可用于合成药物达菲,其结构简式如图,下列 关于莽草酸的说法正确的是 A. 分子式为 C7H6O5 B. 分子中含有 2 种官能团 C.可发生加成和取代反应 D.在水溶液中羧基和羟基均能电离出H+过程糖 JP4ypUQ5mV 10、【答案】 C 11、利用实验器材<规格和数量不限)能完成相应实验的一 项是 实验器材 <省略夹持装相应实验 置) A 烧杯、玻璃棒、蒸发皿CuSO4溶液的浓缩结晶 B 烧杯、玻璃棒、胶头滴用盐酸除去BaSO4中少量的 管、滤纸BaCO3 C 烧杯、玻璃棒、胶头滴用固体NaCl配制 管、容量瓶0.5mol · L-1 的溶液 D 烧杯、玻璃棒、胶头滴用溴水和CCl4除去NaBr溶 管、分液漏斗液中少量 NaI 11【答案】 D 12、对于反应CO 2013年普通高等学校招生全国统一考试(山东卷) 理科数学 第I卷(共60分) 一、选择题:本大题共12小题,每小题5分,共60分,在每小题给出的四个选项中,只有一项是符合题目要求的。 1.若复数z 满足(3)(2)5z i --=(i 为虚数单位),则z 的共轭复数z 为 (A) 2i + (B) 2i - (C )5i + (D)5i - 2. 已知集合A ={0,1,2},则集合B ={},x y x A y A -∈∈中元素的个数是 (A) 1 (B) 3 (C)5 (D)9 3.已知函数()f x 为奇函数,且当0x >时,21()f x x x =+,则(1)f -= (A) 2- (B) 0 (C ) 1 (D) 2 4.已知三棱柱111ABC A B C -的侧棱与底面垂直,体积为94 ,底面是边长为3的正三角形.若P 为底面111A B C 的中心,则PA 与平面ABC 所成角的大小为 (A) 512π (B) 3π (C)4π (D)6 π 5.将函数sin(2)y x ?=+的图象沿x 轴向左平移8π个单位后,得到一个偶函数的图象,则?的一个可能取值为 (A) 34π (B) 4 π (C)0 (D) 4π- 6.在平面直角坐标系xoy 中,M 为不等式组220,210,380,x y x y x y --≥??+-≥??+-≤?所表示的区域上一动点,则直线OM 斜率 的最小值为 (A)2 (B)1 (C)13- (D )12 - 7.给定两个命题p ,q .若p ?是q 的必要而不充分条件,则p 是q ?的 (A )充分而不必要条件 (B) 必要而不充分条件 (C )充要条件 (D ) 既不充分也不必要条件 8.函数cos sin y x x x =+的图象大致为 9.过点(3,1)作圆22(1)1x y -+=的两条切线,切点分别为A ,B ,则直线AB 的方程为 (A)230x y +-= (B)230x y --= (C)430x y --= (D )430x y +-= 10.用0,1,…,9十个数字,可以组成有重复数字的三位数的个数为 (A )243 (B ) 252 (C) 261 (D)279 11.已知抛物线1C :212y x p =(0)p >的焦点与双曲线2C :2213 x y -=的右焦点的连线交1C 于第一象 2013年普通高等学校招生统一考试(山东卷) 理科综合【化学部分】 一、选择题(共7小题,每小题4分,共28分,每题只有一个选项符合题意) 7.化学与生活密切相关,下列说法正确的是 A .聚乙烯塑料的老化是由于发生了加成反应 B .煤经过气化和液化等物理变化可以转化为清洁燃料 C .合成纤维、人造纤维及碳纤维都属于有机高分子材料 D .利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 解析:聚乙烯塑料的老化是因为被氧化所致,A 选项错;煤的气化是化学变化,B 错;碳纤维是碳的单质,C 错;用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都是化学变化。D 正确。 答案:D 8.W 、X 、Y 、Z 四种短周期元素在元素周期表中的相对位置如图所示,W 的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知 A .X 、Y 、Z 中最简单氢化物稳定性最弱的是Y B .Z 元素氧化物对应水化物的酸性一定强于Y C .X 元素形成的单核阴离子还原性强于Y D .Z 元素单质在化学反应中只表现氧化性 解析:因为W 的气态氢化物可与其最高价含氧酸生成离子化合物,这指的是铵盐,W 是N 元素,则X 、Y 、Z 依次是O 、S 、Cl 。则其氢化物中H 2S 最不稳定,A 正确;只有氯元素的最高价含氧酸才一定比Y 的含氧酸酸性强,B 错;阴离子还原性S 2->O 2-,C 错;Cl 2与水的反应中既表现氧化性,也表现了还原性,D 错。 答案:A 9.足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是 A .氢氧化钠溶液 B .稀硫酸 C .盐酸 D .稀硝酸 解析:首先硝酸与金属铝反应不生成氢气,根据生成物的化学式:Na[Al(OH)4]、Al 2(SO 4)3、AlCl 3,通过物料守恒可直接判断出等量的铝消耗NaOH 物质的量最少。 答案:A 10.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是 A .分子式为C 7H 6O 5 B .分子中含有两种官能团 C .可发生加成和取代反应 D .在水溶液中羟基和羧基均能电离出氢离子 解析:根据莽草酸的结构式可确定其分子式为:C 7H 10O 5,需要注意不存在苯环,A 错;有三种官能团:羧基、羟基、碳碳双键,B 错;碳碳双键可以被加成,羧基、羟基可发生酯化反应,C 正确;在水溶液中羧基可以电离出H +,羟基不能发生电离,D 错。 Z 山东省2020年普通高中学业水平等级考试 地理 一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。 图1为某区域滑坡与地貌演化关系示意图。读图完成1~2题。 1.推断图中滑坡体的滑动方向为 A.由北向南B.由西向东 C.由西北向东南D.由东北向西南 (C)冲沟的流向判断地势变化,由图可知,滑坡区域,地势西北高东南低,由此可得滑坡方向为由西北向东南 2.图中序号所示地理事象形成的先后顺序是 A.②③④①B.②①③④C.③①④②D.③②①④ (D)最先存在古河道;发生滑坡后,堵塞河道,掩埋了阶地;河道不通,形成堰塞湖;湖水溢出后,又形成新河道 家住北方某县的小王夫妇,效仿村里一些年轻人的做法,在自家5亩耕地上栽植了杨树后就外出打工了。八年后,小王夫妇将已成材的杨树出售,获利24000元。与原来种植粮食作物、蔬菜等相比,这些收入虽不丰厚,但他们还算满意。据调查,该县耕地上栽植杨树的面积约占耕地总面积的10%,这种“农地杨树化”现象引起了有关专家的高度关注。据此完成3~4题。3.当地“农地杨树化”的主要原因是 A.生态效益高B.木材销路好C.劳动投入少D.种树有补贴 (C)年轻人选择外出打工,说明打工比在家种地收益高,粮食蔬菜价格比木材高,但种植 耗时耗力,不能与外出打工兼顾,所以选择劳动投入少的树木 4.针对“农地杨树化”引起的问题,可采取的措施是 A.加大开荒力度B.增加木材进口C.增加粮食进口D.鼓励农地流转 (D)土地流转是指土地使用权流转。是指拥有土地承包经营权的农户将土地经营权(使用权)转让给其他农户或经济组织。土地流转是个新名词,也是当下农村土地利用的新形式,针对当前农村问题的新举措。外出务工收益更高;农业生产力提高,农村劳动力剩余,这些都导致青壮年大量外出。农村闲置土地大增,大量种树或者荒芜会影响到国家粮食安全,土地流转将闲置土地承包给个人或组织,建设大农业生产,保证粮食安全,提高农民收入,转让使用权者也可获得一定收益 同城化是指两个或两个以上相邻城市紧密联系、协调发展、共享发展成果的现象。公路客流能够反映城市间的日常人口流动方向和强度,是分析判断城市间关系的重要指标。图2示意安徽省2011年8月行政区划调整前的中心城市间公路客流状况。滁州的首位客运流向为南京,次位客运流向为合肥,两个方向的客流量相差很小。据此完成5—6题。 5.下列城市组合中,最适宜推进同城化的是 A.安庆—池州B.合肥—巢湖C.亳州—阜阳D.芜湖—铜陵 (B)同城化的条件一是相邻,二是关系密切,关系密切程度通过公路客流判断,符合条件的是淮北、宿州;合肥、巢湖 6.合肥虽为滁州的次位客运流向,但滁州发往合肥的客流量与发往南京的相差很小,其主要原因是 2013年山东高考数学试题 一、选择题:本大题共12小题,每小题5分,满分60分.在每小题给出的四个选项中,只有一项是符合题目要求的。 (1)复数z满足(z-3)(2-i)=5(i为虚数单位),则z的共轭复数为( D ) A. 2+i B.2-i C. 5+i D.5-i (2)设集合A={0,1,2},则集合B={x-y |x∈A, y∈A }中元素的个数是( C ) A. 1 B. 3 C. 5 D.9 (A)-2 (B)0 (C)1 (D)2 (6)在平面直角坐标系xOy中,M为不等式组: 2x y20 x2y10 3x y80 --≥ ? ? +-≥ ? ?+-≤ ? ,所表示的区域上一动 点,则直线OM斜率的最小值为 C (7)给定两个命题p、q,若﹁p是q的必要而不充分条件,则p是﹁q的 B (A)充分而不必条件(B)必要而不充分条件 (C )充要条件 (D )既不充分也不必要条件 (8)函数y=xcosx + sinx 的图象大致为 D (A ) (B ) (C) (D) (9)过点(3,1)作圆(x-1)2+y 2=1的两条切线,切点分别为A ,B ,则直线AB 的方程为 A (A )2x+y-3=0 (B )2x-y-3=0 (C )4x-y-3=0 (D )4x+y-3=0 (10)用0,1,…,9十个数字,可以组成有重复数字的三位数的个数为 B (A )243 (B )252 (C )261 (D )279 于第一象限的点M.若C 1在点M 处的切线平行于C 2的一条渐近线,则p= D (15)已知向量AB 与AC 的夹角为120,且||3,||2,AB AC ==若 ,AP AB AC λ=+且AP BC ⊥,则实数λ的值为 7122013山东高考数学理科试题及标准答案1
2013年山东高考化学试题及答案(全word版)
2020年新高考全国卷(山东)高考真题及解析
2013年高考真题——理科数学(山东卷)含答案