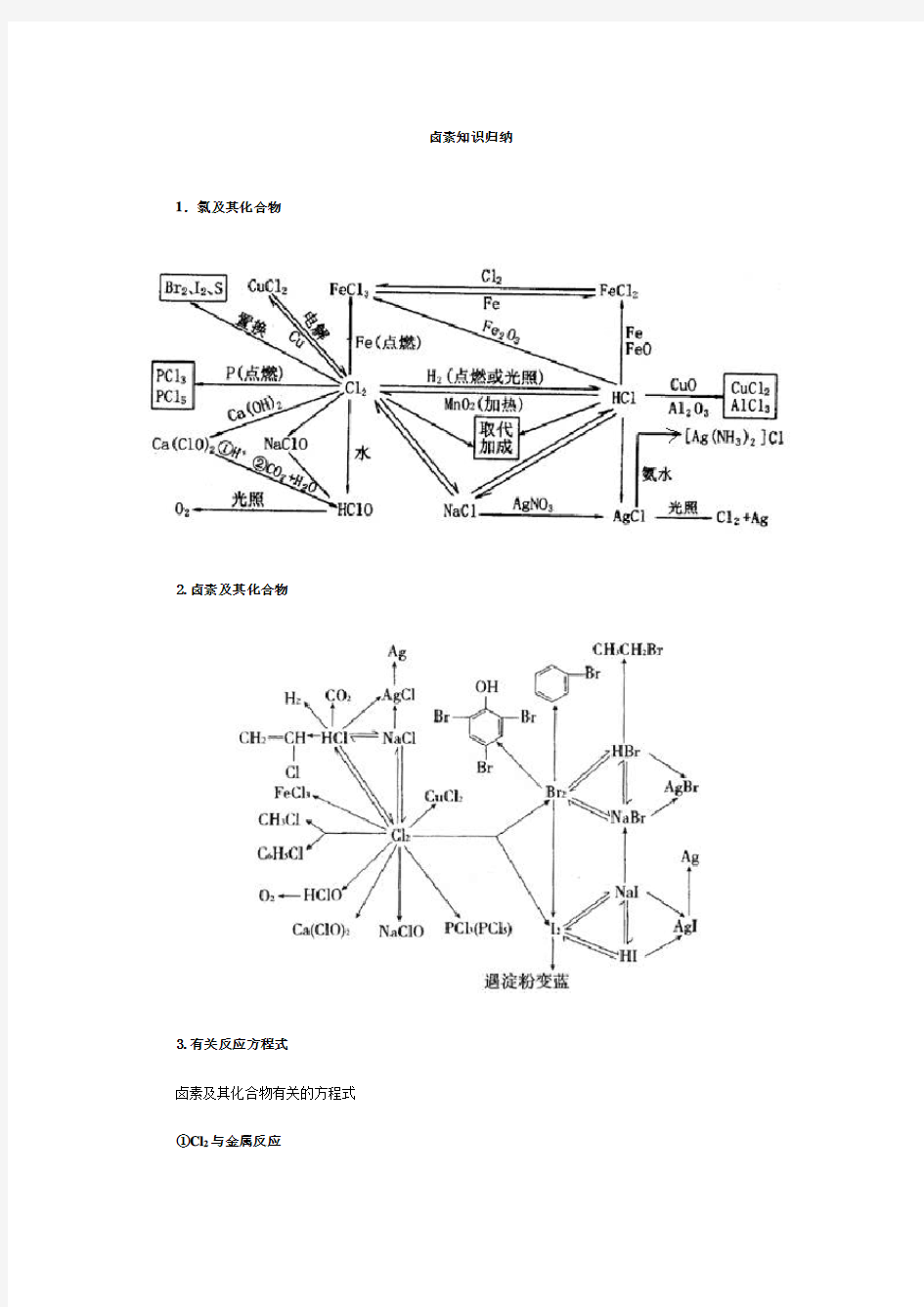

卤素知识归纳1.氯及其化合物
2.卤素及其化合物
3.有关反应方程式
卤素及其化合物有关的方程式
①Cl2与金属反应
②Cl2与非金属反应
③Cl2与水反应
④Cl2与碱反应
Cl2+2NaOH=NaCl+NaClO+H2O(尾气吸收)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(制漂白粉)
Ca(ClO2)+CO2+H2O=CaCO3↓+2HClO(日常漂白原理)
3Cl2+8NH3=6NH4Cl+N2
⑤Cl2与还原性化合物作用
Cl2+NaBr=2NaCl+Br2 Cl2+2KI=2KCl+I2 Cl2+2FeCl2=2FeCl3
3Cl2+6FeBr2=2FeCl3+4FeBr3 (少量Cl2) 3Cl2+2FeBr2=2FeCl3+2Br2(足量Cl2)Cl2+SO2+2H2O=H2SO4+2HCl Cl2+H2S=2HCl+S↓
⑥Cl2与有机物的作用
⑦Cl2制备
16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
14HCl(浓)+K2Cr2O7=2KCl+2CrCl3+3Cl2↑+7H2O
4HCl(浓)+Ca(ClO)2=CaCl2+Cl2↑+2H2O
⑧HCl的有关反应
Zn+2HCl=ZnCl2+H2↑ Al2O3+6HCl=2AlCl3+3H2O Al(OH)3+3HCl=AlCl3+3H2O CaCO3+2HCl=CaCl2+CO2↑+H2O
⑨氟、碘的有关方程式
2F2+2H2O=4HF+O2 2F2+Xe XeF4
Si+4HF=SiF4+2H2 4HF+SiO2=SiF4↑+2H2O
CaSiO3+6HF=CaF2↓+SiF4↑+3H2O
Fe+I2FeI2
碘与淀粉溶液变蓝色。
AgNO3+KI=AgI↓+KNO3
4.氯水的成分和性质
(1)成分:
氯水是氯气的水溶液,通常状况下,1体积能溶解约2体积氯气,形成淡绿色液体,溶解于水中的氯气能够部分与水反应生成盐酸和次氯酸.
Cl2+H2O=HCl+HClO
新制的氯水中只有约39%的氯气与水反应,余者以氯分子形式存在于溶液中,故氯水呈淡黄绿色.新制的氯水中主要含有Cl2、HClO、H2O、H+、Cl—、ClO—(HClO为弱酸,部分电离出少量H+、ClO—),以及水电离出来的少量OH—等。
通常所说的氯水就是指新制的氯水,须随配随用,保存在棕色瓶中。
久置的氯水由于次氯酸见光分解:2HClO=2HCl+O2↑,而变成很稀的盐酸,其中主要含有H+、Cl—、H2O、O2(少量).
(2)性质:
①新制的氯水可以代替氯气.如:
A.能使碘化钾淀粉试纸变蓝。
B.氯水和某些非金属阴离子的反应,向KI、Na2S、NaBr的溶液中加氯水。
C.氯水和某些还原性阳离子的反应,向FeCl2溶液中加氯水.
D.氯水和某些还原性氢化物的反应,向氯水中通H2S、HBr、HI等.
E.氯水和不饱和有机物的加成反应,向氯水中通入乙烯、乙炔等.
②氯水可体现H+、HClO的性质,如石蕊试液滴入氯水中,溶液先变红后褪色,变红是由于HCl电离产生的H+表现酸性,褪色是因为次氯酸具有强氧化性,能将有机色素氧化而使其褪色,氧化还原反应速率不如H+的反应速率快,故先变红后褪色.
③氯水还可单独表现出HClO的性质,例如用氯水消毒、杀菌、漂白,就是利用氯水中的HClO具有强氧化性杀死水中的细菌或氧化有机色素.
④氯水又可表现出Cl—的性质,如氯水滴入到AgNO3溶液中,产生不溶于稀HNO3的白色沉淀;用自来水配制AgNO3溶液时产生白色沉淀。
⑤氯水又能单独表现H+的特点,例如向Na2CO3溶液中滴加氯水,有大量气体(CO2)产生。
(3)氯水与液氯的区别:
氯水是混和物,而液氯是纯净物。
5.溴水褪色的种种反应
(1)能使溴水褪色的无机物
如:
H2S:Br2+H2S=2HBr+S↓(褪色且浑浊)
SO2:Br2+SO2+2H2O=H2SO4+2HBr
Na2SO3:Br2+Na2SO3+H2O=Na2SO4+2HBr
Mg粉(或Zn粉等):Br2+Mg=MgBr2
NaOH等强碱:Br2+2NaOH=NaBr+NaBrO+H2O
Na2CO3(或AgNO3等盐)
Br2+H2O=HBr+HBrO
2HBr+Na2CO3=2NaBr+CO2↑+H2O
(2)能使溴水褪色的有机物
①含C=C或叁键的物质
不饱和烃:如烯烃、炔烃、二烯烃、苯乙烯等
不饱和烃的衍生物,:如烯醇、烯醛、烯酯、卤代烯烃、油酸、油酸某酯、油等天然橡胶(聚异戊二烯)
②石油产品:如裂化气、裂解气、裂化汽油等
③苯酚及其同系物(发生取代反应,有沉淀产生)
④含醛基的化合物,如醛类、葡萄糖、甲酸、还原性糖等
注意:
①某些与溴不发生反应的有机物如卤代烃、四氯化碳、氯仿、溴苯、直馏汽油、苯及苯的同系物,液态环烷烃,低级酯、液态饱和烃、二硫化碳等能萃取溴,虽能使溴水层变无色,但油层变橙红色,一般来说使溴水褪色并不包括这类物质.
②溴水与碘化钾溶液作用后生成的I2的水溶液为深黄色至褐色,颜色加深而不是变浅.
6.卤素及其化合物性质递变规律
(1)卤素单质物理性质的递变规律
从F2→I2
①单质的颜色由浅变深;
②单质的状态:由气态到液态逐渐变成固态;
③单质的密度依次增大;
④单质的熔沸点逐渐升高;
(2)卤素单质的氧化性递变规律
由于卤原子最外层都为7个电子,易获得电子成为8电子稳定结构,是典型的非金属元素,都具有强氧化性.但从F→I随核电荷数递增,获得电子的能力递减,因此氧化性规律为F2>Cl2>Br2>I2。表现出的性质有:
①与H2反应:生成卤化氢的反应由易到难;卤化氢的稳定性由强到弱,即HF>HCl>HBr>HI。
②与金属化合生成金属卤化物:且除I2外,与可变价金属反应时生成高价卤化物。
③与还原性物质反应。
④F2与H2O反应,H2O做还原剂。
(3)卤素单质既有氧化性又有还原性规律
由于卤素的最低价态为—1价,最高价(F除外)为+7价,而卤素单质的价态为零价,处于中间价态.因此,当它与某些物质反应时表现出既有氧化性又有还原性:
①与H2O反应(除F2外)生成HX和HXO
②与强碱溶液反应(除F2外)生成卤化物和次卤酸盐
(4)卤素阴离子的还原性规律
易获得电子的物质,其得电子后失电子是较难的,即单质的氧化性越强,对应阴离子的还原性越弱,因此,X—还原性规律为:F—<Cl—<Br—<I—。
(5)卤化氢的酸性和还原性规律
HX在水溶液中能电离出H+和X—,但因F→I原子半径逐渐增大,其H—F到H—I的键能逐渐减小,所
卤族元素的代表:氯 卤族元素指周期系ⅦA族元素。包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。它们在自然界都以典型的盐类存在,是成盐元素。卤族元素的单质都是双原子分子,它们的物理性质的改变都是很有规律的,随着分子量的增大,卤素分子间的色散力逐渐增强,颜色变深,它们的熔点、沸点、密度、原子体积也依次递增。卤素都有氧化性,氟单质的氧化性最强。卤族元素和金属元素构成大量无机盐,此外,在有机合成等领域也发挥着重要的作用。 Halogen 卤素的化学性质都很相似,它们的最外电子层上都有7个电子,有取得一个电子形成稳定的八隅体结构的卤离子的倾向,因此卤素都有氧化性,原子半径越小,氧化性越强,因此氟是单质中氧化性最强者。 除F外,卤素的氧化态为+1、+3、+5、+7,与典型的金属形成离子化合物,其他卤化物则为共价化合物。卤素与氢结合成卤化氢,溶于水生成氢卤酸。卤素之间形成的化合物称为互卤化物,如ClF3、ICl。卤素还能形成多种价态的含氧酸,如HClO、HClO2、HClO3、HClO4。卤素单质都很稳定,除了I2以外,卤素分子在高温时都很难分解。卤素及其化合物的用途非常广泛。例如,我们每天都要食用的食盐,主要就是由氯元素与钠元素组成的氯化物。 卤素单质的毒性,从F开始依次降低。 从F到At,其氢化物的酸性依次增强。但氢化物的稳定性呈递减趋势。氧化性:F?> Cl?> Br?> I?> At?,但还原性相反。 氟 氟气常温下为淡黄色的气体,有剧毒。与水反应立即生成氢氟酸和氧气并发生燃烧,同时能使容器破裂,量多时有爆炸的危险。氟、氟化氢和氢氟酸对玻璃有较强的腐蚀性。氟是氧化性最强的元素,只能呈-1价。单质氟与盐溶液的反应,都是先与水反应,生成的氢氟酸再与盐的反应,通入碱中可能导致爆炸。水溶液氢氟酸是一种弱酸。但却是稳定性、腐蚀性最强的氢卤酸,如果皮肤不慎粘到,将一直腐蚀到骨髓。化学性质活泼,能与几乎所有元素发生反应(除氦、氖)。 氯 氯气常温下为黄绿色气体,可溶于水,1体积水能溶解2体积氯气。有毒,与水部分发生反应,生成HCl与次氯酸,次氯酸不稳定,分解放出氧气,并生成盐酸,次氯酸氧化性很强,
最新高考语文必看知识点梳理 高考语文必看知识点篇一 复习要点: ①落实近义词的区别,积累常见成语的意思和用法。 ②了解常见病句类型及判断方法。 复习措施: ①加强练习,能每天在课堂上完成一套基础知识小练习。做好错题小结,进行练习反思。 ②运用联想的方法,在比较中记忆、积累,将无序的字词有序化。 ③熟悉病句的六种类型。收集各种典型病句。 ④借助错题小结,反复训练常错的病句类型。 1、词语题(包括成语和熟语) 词语辨析: ①有相同和不同语素的,重点分析不同语素。 ②没有相同语素的,重点分析具体语境。 熟语:注意感情色彩、使用范围、使用对象。 2、病句辨析题 六种类型——语序不当、搭配不当、成分残缺或赘余、结构混乱、表意不明、不合逻辑。 方法:①检查句子主干,看是否成分残缺。 ②推敲词语运用,看是否搭配不当。 ③心里默读,看是否有句式混用或语序不当。 ④综合思考,看是否符合逻辑思维。 高考语文必看知识点篇二
语言运用题的考试内容有语段压缩、语句扩展、句子仿写、句式转换、图文转换、病句修改、句子排序、修辞手法等等。做题的技巧是审好题干,照章办事。 复习要点: ①复习语用的各种基本题型及解题要领。 ②收集近年来出现的语用新题型,预测题型变化的趋势。 复习措施: ①精选语用典型题目,在练习中掌握各种题型的解题要领。 ②加大“压缩语段”“句式变换”“语言连贯”“图文转换”等易错考点的练习力度,在练习中总结方法,提高能力。 ③多积累优美词句,以应对仿写、修辞等题型的考查。 高考语文必看知识点篇三 复习要点: ①落实高中必背篇目的背诵和默写。 ②收集常见名句,适度扩大积累范围。 复习措施: ①挖空填写,做到篇篇落实。 ②挑选重要名句,做到句句落实,字字落实。 ③收集常错句子,反复练习。 ④利用早读、周五下午的自习课,强化练习。 要求背诵的诗文,要不折不扣背诵。对有些“名句名篇”,不仅要熟练背诵,而且要准确默写。 高考语文必看知识点篇四 复习要点: ①落实120个常见实词、18个常考虚词的复习。
原命题 若p 则q 否命题若┐p 则┐q 逆命题若q 则p 逆否命题若┐q 则┐p 互为逆否互逆否互为逆否 互 互逆 否 互 高中数学必修+选修知识点归纳必修1数学知识点 第一章:集合与函数概念 1、集合三要素:确定性、互异性、无序性。 2、 常见集合:正整数集合:*N 或+N ,整数集合: Z ,有理数集合:Q ,实数集合:R . 3、并集.记作:B A Y .交集.记作:B A I . 全集、补集{|,}U C A x x U x A =∈?且 (C U A)∩( C U B) = C U (A ∪B) (C U A)∪( C U B) = C U (A ∩B);B B A =I A B ??; 简易逻辑: 或:有真为真,全假为假。 且:有假为假,全真为真。 非:真假相反 原命题:若P 则q ; 逆命题:若q 则p ;否命题:若┑P 则┑q ;逆否命题:若┑q 则┑p 。 常用变换: ①) () ()()()()(y f x f y x f y f x f y x f =-?=+. 证)()(])[()() () ()(y f y x f y y x f x f x f y f y x f -=+-=?= - ②)()()()()()(y f x f y x f y f x f y x f +=??-= 证:)()()()(y f y x f y y x f x f +=?= 4、设A 、B 是非空的数集,如果按照某种确定的对应关系f ,使对于集合A 中的任意一个数x ,在集合B 中都有惟一确定的数()x f 和它对应,那么就称B A f →:为集合A 到集合B 的一个函数,记作:()A x x f y ∈=,. 5、定义域1?? ??? 分母不等于零被开方大于等于零对数的幂大于零,底大于零不等于 值域:利用函数单调性求出所给区间的最 大值和最小值, 6、函数单调性: (1)定义法:设2121],,[x x b a x x <∈、那么 ],[)(0)()(21b a x f x f x f 在?<-上是增函数; ],[)(0)()(21b a x f x f x f 在?>-上是减函数. 步骤:取值—作差—变形—定号—判断 (2)导数法:设函数)(x f y =在某个区间内可导,若 0)(>'x f ,则)(x f 为增函数;若0)(<'x f ,则) (x f 为减函数. 7、奇偶性 ()x f 为偶函数:()()x f x f =-图象关于y 轴对称.
高一化学第一单元《卤素》知识点总 结 第一节氯气 一、氯原子结构:氯原子的原子结构示意图为______由于氯原子最外层有____个电子,容易___(得或失)___个电子而形面8个电子稳定结构,因此氯元素是活泼的非金属元素。 二、氯元素的性质 1、氯气是____色有_____气味的气体,___毒,可溶于水,密度比空气__。 2、氯气的化学性质:点燃与金属反应2Na+cl2===2Nacl 点燃cu+cl2===cucl2 点燃H2+cl2===2Hcl或光照 与非金属反应2P+3cl2===2Pcl3Pcl3+cl2===Pcl5 cl2+H2o===Hcl+Hclo 与化合物反应2cl2+2ca2===cacl2+ca2+2H2o (漂白粉,有效成份是____)
ca2+co2+H2o==caco3↓+2Hclo(这个反应证明Hclo 是弱酸的事实) cl2+2NaoH====Nacl+Naclo+H2o 氯气的用途:消毒、制盐酸、漂白粉、农药等AgBr用作感光片AgI用作人工降雨 练习:指出以上反应中氧化剂和还原剂,并用单线或双线桥表示电子转移情况。 三、氯气的制法 1、药品:浓盐酸和二氧化锰 2、原理:mno2+4Hcl===mncl2+2H2o+cl2↑ 3、装置类型:固+液―― 4、收集方法:用___排空气法或排饱和食盐水法收集。 5、检验:使湿润的kI淀粉试纸变蓝(思考其原因是什么 6、余气处理:多余的氯气通入____溶液中处理吸收,以免污染环境 第二节氯化氢
一、氯化氢的性质 1、物理性质:是一种___色有____气味的氯体,___溶于水(1:500体积比)密度比空气大。 2、化学性质:Hcl溶于水即得盐酸,盐酸是一种强酸,具有挥发性和腐蚀性。 3、氯化氢的实验室制法 药品:食盐(Nacl)和浓H2So4 原理:用高沸点(或难挥发性)酸制低沸点酸(或易挥发性)(与制硝酸的原理相同)微热Nacl+H2So4=====NaHSo4+Hcl↑ 强热总式:2Nacl+H2So4====Na2So4+2Hcl↑Nacl+NaHSo4====Na2So4+Hcl↑ (上述说明了条件不生成物不同,要注意反应条件) 装置类型:固+液――收集方法:用向上排空法收集检验:用湿润的蓝色石蕊试纸余气处理:将多余的气体通入水中即可 第四节卤族元素
卤族元素 [卤族元素] 简称卤素.包括氟(F)、氯(C1)、溴(Br)、碘(I)和放射性元素砹(At).在自然界中卤素无游离态,都是以化合态的形式存在(1)位置:VIIA (2)原子结构:相同点:最外层电子数均为7 不同点:F I电子层数逐渐增多,原子半径逐渐增大。 (3)相似性: ①单质均为双原子非极性分子 ②主要化合价为 -1价,最高正价为+7价(F除外) ③都具有强氧化性 [卤素单质的物理性质] 说明 (1)实验室里,通常在盛溴的试剂瓶中加水(即“水封”),以减少溴的挥发. (2)固态物质不经液态而直接变成气态的现象,叫做升华.升华是一种物理变化.利用碘易升华的性质,可用来分离、提纯单质碘. (3)Br2、I2较难溶于水而易溶于如汽油、苯、四氯化碳、酒精等有机溶剂中.医疗上用的碘酒,就是碘(溶质)的酒精(溶剂)溶液.利用与水互不相溶的有机溶剂可将Br2、I2从溴水、碘水中提取出来(这个过程叫做萃取). [卤素单质的化学性质] (1)卤素的原子结构及元素性质的相似性、递变性.
(2)卤素单质与氢气的反应. H 2 + F 2 = 2HF (冷暗处爆炸) H 2 +Cl 2 = 2HCl (光照爆炸,点燃) H 2 +Br 2 2HBr H 2 +I 2 2HI 长期加热并不断分解 卤化氢:易溶于水,在空气中形成白雾。 ①HCl
最新高考语文必考知识点梳理 高考语文必考知识点梳理一:古诗词 1.鹰击长空,鱼翔浅底,万类霜天竞自由。 指点江山,激扬文字,粪土当年万户侯。(毛泽东《沁园春长沙》) 2.人生易老天难老,岁岁重阳。今又重阳,战地黄花分外香。一年一度秋风劲,不似春光。胜似春光,寥廓江天万里霜。(毛泽东《采桑子重阳》) 3.东风不来,三月的柳絮不飞。你的心如小小的寂寞的城,恰若青石的街道向晚。跫音不响,三月的春帷不揭,你的心是小小的窗扉紧掩。(郑愁予《错误》) 4.层层的叶子中间,零星地点缀着些白花,有袅娜地开着的,有羞涩地打着朵儿的;正如一粒粒的明珠,又如碧天里的星星,又如刚出浴的美人。微风过处,送来缕缕清香,仿佛远处高楼上渺茫的歌声似的。 5.月光如流水一般,静静地泻在这一片叶子和花上。薄薄的青雾
浮起在荷塘里。叶子和花仿佛在牛乳中洗过一样;又像笼着轻纱的梦。 6.塘中的月色并不均匀;但光与影有着和谐的旋律,如梵婀玲上奏着的名曲。(朱自清《荷塘月色》) 7.越国以鄙远,君知其难也。焉用亡郑以陪邻?邻之厚,君之薄也。若舍郑以为东道主,行李之往来,共其乏困,君亦无所害。 8.夫晋,何厌之有?既东封郑,又欲肆其西封,若不阙秦,将焉取之?阙秦以利晋,唯君图之。 9.因人之力而敝之,不仁;失其所与,不知;以乱易整,不武。(《左传烛之武退秦师》) 10.今其地方千里,百二十城,宫妇左右莫不私王,朝廷之臣莫不畏王,四境之内莫不有求于王。由此观之,王之蔽甚矣! 11.群臣吏民,能面刺寡人之过者,受上赏;上书谏寡人者,受中赏;能谤讥于市朝,闻寡人之耳者,受下赏。 12.令初下,群臣进谏,门庭若市;数月之后,时时而间进;期年之后,虽欲言,无可进者。
2018年高考英语单词必考知识点总结归纳 一、一个星期七天 1. Monday 2. Tuesday 3. Wednesday 4. Thursday 5. Friday 6. Saturday 7. Sunday 二、一年十二个月 1. January 2. February 3. March 4. April 5. May 6. June 7. July 8. August 9. September 10. October 11. November 12. December 三、一年四季 1. spring 2. summer 3. autumn 4. winter 四、容易拼写错的数字 1. eighth第八 2. ninth第九 3. forty四十 4. twelfth第十二 5. twentieth第二十 四、亲属称呼 1. daughter (女儿) 2. niece (女性晚辈) 3. nephew (男性晚辈) 4. cousin (同辈兄弟姐妹) 5. aunt (女性长辈) 6. uncle (男性长辈) 五、以下动词加-ed或-ing要双写最后一个字母
1. regret (regretted, regretting) 后悔 2. control (controlled, controlling) 控制 3. admit (admitted, admitting) 承认 4. occur (occurred, occurring) 出现 5. prefer (preferred, preferring) 宁愿 6. refer (referred, referring) 提到 7. forget (forgetting ) 忘记 8. permit (permitted, permitting)允许 9. equip (equipped, equipping) 装备 注意:quarrel, signal, travel中的l可双写(英国英语)也可不双写(美国英语) 六、部分过去式和过去分词不规则变化的动词 1. broadcast (broadcast, broadcast) 广播 2. flee (fled, fled) 逃跑 3. forbid (forbade, forbidden) 禁止 4. forgive (forgave, forgiven) 原谅 5. freeze (froze, frozen) 结冰 6. hang (作“绞死”讲,是规则的;作“悬挂”讲,其过去式过去分词都是hung) 7. lie (作“说谎”讲时,是规则的;作“位于”讲时,其过去式是lay,过去分词是lain) 8. seek (sought, sought) 寻求 9. shake (shook, shaken) 发抖 10. sing (sang, sung) 唱歌
智能考点二十卤素及其化合物 Ⅰ.课标要求 1.通过实验了解氯气及其重要化合物的主要性质及在生产中的应用。 2.认识氯气及其重要化合物对生态环境的影响。 Ⅱ.考纲要求 1.了解氯气及其重要化合物的主要性质及在生产中的应用。 2.了解氯气及其重要化合物对环境质量的影响。 Ⅲ.教材精讲 一、氯气的性质及用途 1.物理性质:常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。 2.化学性质:氯气的化学性质很活泼的非金属单质。 (1)与金属反应(与变价金属反应,均是金属氧化成高价态) 如:①2Na+Cl2 2NaCl(产生白烟) ②Cu+Cl2CuCl2(产生棕黄色的烟) ③2Fe+3Cl22FeCl3(产生棕色的烟) 注:常温下干燥的氯气或液氯不与铁反应,所以液氯通常储存在钢瓶中。 (2)与非金属反应 如:①H2+Cl22HCl(发出苍白色火焰,有白雾生成)——可用于工业制盐酸H2+Cl22HCl(会发生爆炸)——不可用于工业制盐酸 ②2P+3Cl22PCl3(氯气不足;产生白雾) 2P+5Cl22PCl5(氯气充足;产生白烟) (3)与水反应:Cl2+H2O = HCl+HClO (4)与碱反应 Cl2+2NaOH = NaCl+NaClO+H2O(用于除去多余的氯气) 2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O(用于制漂粉精) Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO(漂粉精的漂白原理) (5)与某些还原性物质反应 如:①2FeCl2+Cl2 = 2FeCl3
通电 ②2KI +Cl 2 = 2KCl + I 2(使湿润的淀粉-KI 试纸变蓝色,用于氯气的检验) ③SO 2+Cl 2+2H 2O = 2HCl + H 2SO 4 (6)与某些有机物反应 如:①CH 4+Cl 2 CH 3Cl + HCl (取代反应) ②CH 2=CH 2+Cl 2 → CH 2ClCH 2Cl (加成反应) 3.氯水的成分及性质 氯气溶于水得黄绿色的溶液----氯水。在氯水中有少部分氯分子与水反应,Cl 2 + H 2O = HCl + HClO (次氯酸),大部分是以Cl 2分子状态存在于水中。 注意:(1)在新制的氯水中存在的微粒有:H 2O 、Cl 2、HClO 、H +、Cl -、ClO -、OH -;久置氯水则几乎是盐酸溶液 ① 一元弱酸,比H 2CO 3弱 (2)HClO 的基本性质 ② 不稳定,2HClO === 2HCl + O 2↑ ③ 强氧化性; ④ 漂白、杀菌能力,使色布、品红溶液等褪色。 (3)几种漂白剂的比较 漂白剂 HClO Na 2O 2(H 2O 2) SO 2 活性炭 漂白原理 氧化漂白 氧化漂白 化合漂白 吸附漂白 品红溶液 褪色 褪色 褪色 褪色 紫色石蕊 先变红后褪色 褪色 只变红不褪色 褪色 稳定性 稳定 稳定 不稳定 —— 4.氯气的制法 (1)实验室制法 药品及原理:MnO 2 + 4HCl (浓) MnCl 2 + 2H 2O + Cl 2↑ 强调:MnO 2跟浓盐酸在共热的条件下才反应生成Cl 2,稀盐酸不与MnO 2反应。 仪器装置:发生装置---收集装置---吸收装置 实验步骤:检密—装药—固定—加热—收集 收集方法:向上排空气法 (或排饱和食盐水法) 净化装置:用饱和食盐水除去HCl ,用浓硫酸干燥 尾气处理:用碱液吸收 (2)氯气的工业制法:(氯碱工业) 2NaCl + 2H 2O 2NaOH + H 2↑ + Cl 2↑ 二、氯化氢的性质和实验室制法 1.物理性质: 无色、有刺激性气味的气体;极易溶于水 (1:500)其水溶液为盐酸。 2.盐酸的化学性质: (挥发性强酸的通性) 3.氯化氢的实验室制法 (1)药品及反应原理: 加热
高考前重点知识回顾 第一章-集合 (一)、集合:集合元素的特征:确定性、互异性、无序性. 1、集合的性质:①任何一个集合是它本身的子集,记为A A ?; ②空集是任何集合的子集,记为A ?φ; ③空集是任何非空集合的真子集; ①n 个元素的子集有2n 个. n 个元素的真子集有2n -1个. n 个元素的非空真子集有2n -2个. [注]①一个命题的否命题为真,它的逆命题一定为真.否命题?逆命题. ②一个命题为真,则它的逆否命题一定为真. 原命题?逆否命题. 2、集合运算:交、并、补.{|,} {|}{,} A B x x A x B A B x x A x B A x U x A ?∈∈?∈∈?∈?I U U 交:且并:或补:且C (三)简易逻辑 构成复合命题的形式:p 或q(记作“p ∨q ” );p 且q(记作“p ∧q ” );非p(记作“┑q ” ) 。 1、“或”、 “且”、 “非”的真假判断 4、四种命题的形式及相互关系: 原命题:若P 则q ; 逆命题:若q 则p ; 否命题:若┑P 则┑q ;逆否命题:若┑q 则┑p 。 ①、原命题为真,它的逆命题不一定为真。 ②、原命题为真,它的否命题不一定为真。 ③、原命题为真,它的逆否命题一定为真。 6、如果已知p ?q 那么我们说,p 是q 的充分条件,q 是p 的必要条件。
若p ?q 且q ?p,则称p 是q 的充要条件,记为p ?q. 第二章-函数 一、函数的性质 (1)定义域: (2)值域: (3)奇偶性:(在整个定义域内考虑) ①定义:①偶函数:)()(x f x f =-,②奇函数:)()(x f x f -=- ②判断方法步骤:a.求出定义域;b.判断定义域是否关于原点对称; c.求)(x f -; d.比较)()(x f x f 与-或)()(x f x f --与的关系。 (4)函数的单调性 定义:对于函数f(x)的定义域I 内某个区间上的任意两个自变量的值x 1,x 2, ⑴若当x 1
一、苯的物理性质 色态: 无色 有特殊气味的液体 熔沸点:低 沸点 80.1℃ 熔点 5.5℃ 密度: 比水小,0.8765g/mL ,溶解性: 不溶于水 二、苯的结构 最简式: CH (1825年,法拉第) 分子式:: C6H6 结构式 : (1865 年,凯库勒) 结构简式: 苯分子结构小结: 1、苯的分子结构可表示为: 2、结构特点:分子为平面结构 键角 120 ° 键长 1.40×10-10m 3、它具有以下特点: ①不能使溴水和酸性高锰酸钾褪色 ②邻二元取代物无同分异构体 4、性质预测: 结构决定性质,苯的特殊结构具有哪些性质? 苯的特殊性质 三、苯的化学性质 1.苯的取代反应: 2.加成反应 3.氧化反应: 溴代反应 a 反应原理 b 、反应装置 c 、反应现象 d 、注意事项 氢原子的取代:硝化,磺化,溴代 加成反应:与H2,与Cl2
现象:①导管口有白雾,锥形瓶内产生浅黄色浑浊。 ②瓶底有褐色不溶于水的液体。 注意: ①铁粉的作用:催化剂(实际上是FeBr3),若无催化剂则苯与溴水混合发生的是萃取。 ②导管的作用:导气兼冷凝导管末端不可插入锥形瓶内液面以下,否则将发生倒吸。 ③产物:溴苯留在烧瓶中,HBr挥发出来因为溴苯的沸点较高,156.43℃。 ④纯净的溴苯:无色油状液体。呈褐色的原因:溴苯中含有杂质溴, 除杂方法:用稀NaOH溶液和蒸馏水多次洗涤产物,分液 (2)硝化反应 ①加液要求: 先制混合酸:将浓硫酸沿器壁缓缓注入浓硝酸中, 并不断振荡使之混合均匀,要冷却到50~60℃以下, 再慢慢滴入苯,边加边振荡,控制温度在50~60℃以下。 冷却原因:反应放热,温度过高,苯易挥发, 且硝酸也会分解,苯和浓硫酸在70~80℃时会发生反应。(图表示硝化反应装置) ②加热方式:水浴加热(好处:受热均匀、温度恒定)水浴:在100℃以下。油浴:超过100 ℃,在0~300 ℃沙浴:温度更高。 ③温度计的位置,必须放在悬挂在水浴中。 ④直玻璃管的作用:冷凝回流。浓硫酸的作用:催化剂和吸水剂 ⑤产物:纯净的硝基苯为无色,有苦杏仁味,比水重的油状液体,不溶解于水。不纯硝基苯显黄色原因:溶有NO2,(硝酸的保存)
第一章第二节主族元素碱金属和卤素 (一)碱金属元素: 1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,失电子能力逐渐,还原性(元素金属性)逐渐。从Li到Cs的金属性逐渐增强。 2.碱金属化学性质的相似性: 4Li + O2 Li2O 2Na + O2 Na2O2 点燃点燃 2 Na + 2H2O =2NaOH + H2↑ 2K + 2H2O =2KOH + H2↑ 2R + 2 H2O = 2 ROH + H2 ↑ ★★结论:碱金属元素原子的最外层上都只有___个电子,都显___ 价. 它们的化学性质相似。都能与水和氧气反应 ★★结论:1)原子结构的递变性导致化学性质的递变性。 ★★★2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强, 碱性:LiOH <NaOH <KOH < RbOH < CsOH 3.碱金属物理性质的相似性和递变性: 1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。2)递变性(从锂到铯):①密度逐渐增大(K反常)②熔点、沸点逐渐降低 ★★小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。 (二)卤族元素: 1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,得电子能力逐渐,氧化性(元素非金属性)逐渐。还原性(元素金属性)逐渐从F到I的非金属性逐渐减弱。 2.卤素单质物理性质的递变性:(从F2到I2) (1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高 3.卤素单质与氢气的反应:X2 + H2= 2 HX 卤素单质与H2的剧烈程度:依次减弱;生成的氢化物的稳定性:依次减弱生成的氢化物的稳定性:HF HCl HBr HI
2018年高考生物知识点归纳总结 一、要建立学科知识体系,抓住重点。 按教材顺序一起来梳理一下,希望同学们在梳理的过程中可找到自己的知识擅长处与薄弱处,抓住学习重点。 1.必修 1:分子与细胞 细胞是生物体结构和功能的基本单位,生物学当然要研究"细胞"了,所以第一本教材便紧紧围绕"细胞"这一中心。主要包括以下内容: (1)组成细胞的分子:此部分需掌握的内容主要为六大化合物的分布、结构、主要功能、及鉴定方法。 (2)细胞结构:细胞膜、细胞质(各种细胞器的结构及功能)、细胞核此部分需掌握各部分的结构和功能。 (3)细胞代谢(细胞中的各种生物化学反应统称细胞代谢) ①物质的跨膜运输:细胞代谢伴随着物质的输入与输出该部分需掌握三种跨膜运输方式的特点及实例。 ②atp:细胞代谢伴随着能量的释放或吸收,而细胞生命活动直接利用的能量形式是atp。 ③酶:细胞代谢需要酶的催化该部分包含的考点主要有酶的化学本质、酶的作用特点、影响酶促反应速率的因素。 ④两种重要的细胞代谢:光合作用与细胞呼吸 (4)细胞的生命历程:细胞的增殖、分化、衰老、凋亡、癌变 2.必修
2:遗传与进化 具有遗传现象是生物的重要特征,在遗传中又存在着变异,变异的积累使生物产生进化,第二本教材的内容设置主要围绕着遗传、变异、进化这三个主题,而其中的遗传部分是高考的重点也是难点,主要以非选择题的形式出现。 (1)遗传部分: ①孟德尔杂交实验的过程、结果及孟德尔两大遗传定律:基因分离定律和基因自由组合定律在解题中的应用 ②伴性遗传 ③遗传的细胞学基础:减数分裂 亲子代之间遗传物质的桥梁细胞为雌雄配子,遗传的细胞学基础便是可形成雌雄配子减数分裂。 ④遗传的分子基础--dna:主要包括dna的复制、dna上遗传信息的表达(转录、翻译),它们构成了体现生物遗传信息传递过程的中心法则。 (2)变异和育种:可遗传变异的类型及特点、各种育种方式的原理及优缺点 (3)生物的进化 3.必修 3:稳态与环境 这本教材中所讲的稳态既包括生物个体内环境的稳态及调节,又包括生物所生活的生态环境的稳态及调节。如今人们对自身健康及生态环境保护越来越重视,此部分内容所涉及的知识点在高考中出现的频率也越来越高,对其归纳如下:
氯 一、氯的化学性质 ①Cl2与金属反应 ②Cl2与水反应 ③Cl2与碱反应 Cl2+2NaOH=NaCl+NaClO+H2O(尾气吸收) 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(制漂白粉) Ca(ClO2)+CO2+H2O=CaCO3↓+2HClO(日常漂白原理) 3Cl2+8NH3=6NH4Cl+N2 ④Cl2与还原性化合物作用 Cl2+NaBr=2NaCl+Br2 Cl2+2NaI=2NaCl+I2 Cl2+2FeCl2=2FeCl3 3Cl2+6FeBr2=2FeCl3+4FeBr3 (少量Cl2) 3Cl2+2FeBr2=2FeCl3+2Br2(足量Cl2) Cl2+SO2+2H2O=H2SO4+2HCl Cl2+H2S=2HCl+S↓ ⑤Cl2制备 了解:16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O 14HCl(浓)+K2Cr2O7=2KCl+2CrCl3+3Cl2↑+7H2O 4HCl(浓)+Ca(ClO)2=CaCl2+Cl2↑+2H2O ⑥氟、碘的有关方程式 2F2+2H2O=4HF+O2 Si+4HF=SiF4+2H2 4HF+SiO2=SiF4↑+2H2O
CaSiO3+6HF=CaF2↓+SiF4↑+3H2O Fe+I2FeI2 碘与淀粉溶液变蓝色。 二.氯水的成分和性质 (1)成分: 形成淡绿色液体,溶解于水中的氯气能够部分与水反应生成盐酸和次氯酸. Cl2+H2O=HCl+HClO 新制的氯水中主要含有Cl2、HClO、H2O、H+、Cl—、ClO—(HClO为弱酸,部分电离出少量H+、ClO—),以及水电离出来的少量OH—等。 久置的氯水由于次氯酸见光分解:2HClO=2HCl+O2↑,而变成很稀的盐酸,其中主要含有H+、Cl—、H2O、O2(少量). (2)性质: ①新制的氯水可以代替氯气.如: A.能使碘化钾淀粉试纸变蓝。 B.氯水和某些非金属阴离子的反应,向KI、Na2S、NaBr的溶液中加氯水。 C.氯水和某些还原性阳离子的反应,向FeCl2溶液中加氯水. D.氯水和某些还原性氢化物的反应,向氯水中通H2S、HBr、HI等. E.氯水和不饱和有机物的加成反应,向氯水中通入乙烯、乙炔等. 三.溴水褪色的种种反应 (1)能使溴水褪色的无机物 H2S:Br2+H2S=2HBr+S↓(褪色且浑浊) SO2:Br2+SO2+2H2O=H2SO4+2HBr Na2SO3:Br2+Na2SO3+H2O=Na2SO4+2HBr NaOH等强碱:Br2+2NaOH=NaBr+NaBrO+H2O Br2+H2O=HBr+HBrO
高考英语复习知识点概要 1.a great/good many: a large number of许多。修饰可数名词复数。 I’m quite busy. I have a great many things to do. 我很忙,我有很多事要做。 若复数名词前有限定词或其修饰的为代词时,应加of . ①A great many of the books have been sold out. 已经卖了很多书了。 ②A great many of them are out of work.他们很多人失业了。 2.able(可以的,有能力的,可能的)①He is an able man.那人本事不小。 enable(v)使……能 ②We must learn more to enable us to face all the difficulties.我们要多学知识以便能面对各种困难。disable:有残疾的,不能干的;the disabled表示一类人(残疾人) able作词辍时 ①可以……的,值得……的(有被动含义)eatable可食用的,measurable可以测量、估计的;readable可读的 ②其他含义:conformable舒适的、安逸的;suitable 合适的,恰当的 3.above, over, on 三个词都可以表示“在……上“,但用法不同。On表示与某物体表面接触;over表示在某物体垂直的上方,含“布满、覆盖、跨越”之意,与under 相对;above表示位置高于,但不一定垂直,与below相对。注意:与数字、数量、长度词连用时,多用over,同more than。如:over10,000people一万多人;表示年龄、刻度多用above,如a man above fifty五十开外的人;above zero零度以上。 习惯用语:well above average远在一般以上;above sea-level海拔以上;the one above上面的一个;above all首先,尤其重要的是;over there 那边;all over 遍及;over again 再一遍;over and over 再三地 [应用]介词填空 ①There lay an umbrella_______the table and some raincoats _____it. ②The mother held an umbrella______the boy’s head so that the sun wouldn’t burn him. ③There seemed to be a war and many planes were flying____the city. ④The moon was______the trees in the east. Key:①on,under ②over ③over ④above above all 首先,特别是,最重要的是 after all 到底,毕竟 at all (用来加强语气)与not连用,表示“一点也不,完全不”。 in all 总共 all but 几乎,差点没(=almost,nearly) ①We have all but finished the work. ②The day turned out fine after all. ③Children need many things ,but above all they need love. ④He wasn’t at all tired. ⑤Do you feel ill at all(真的,确实)? ⑥There were twenty in all at the party. accident/event/ incident event一般指重大事件。accident多指意外或偶然发生的事故,特别是不幸的、有损害性的事故。incident相对于accident来说,显得不很重要,指“小事件”,它还可以用来表示“事变”,如叛乱、爆炸等。如: The broadcaster is broadcasting the news on current events.广播员正在播报时事新闻。 He was badly injured in the traffic accident.在那起交通事故中,他严重受伤。 There was an incident on the bus: a man fought with the conductor.那辆公共汽车上发生了一件事,有个人和售票员打了起来。 Have you heard of Xi’an Incident?你听说过“西安事变”吗? admit vt.①接纳,许可……进入(allow sb./sth.to enter) He was admitted to the school this year.Only two hundred boys and girls are admitted to our school every year. ②承认,后可接名词,doing、从句或复合结构。 I admit my fault. She admitted having read the letter. He admitted that his comprehension was weak. You must admit the task to be difficult. advice建议;劝告。是不可数名词,“一条建议”应用a piece of advice。常用结构。 give sb.advice(on)/give advice给某人提(关于……的)建议;忠告某人。 ask(sb.)for advice征求(某人的)意见。 ①Marx gave us some good advice on how to learn a
高中文言文知识梳理 第一册文言文知识梳理 《烛之武退秦师》 通假字 1.今老矣,无能为也已 已,通“矣”,语气词,了。 2.共其乏困 共,通“供”,供给。 3.夫晋,何厌之有 厌,通“餍”,满足。 4.若不阙秦,将焉取之 阙,通“缺”,侵损,削减。 5.秦伯说,与郑人盟 说,通“悦”,高兴。 6.失其所与,不知 知,通“智”,明智。 古今异义 1.贰于楚也 古:从属二主,动词; 今:“二”的大写,数词。 2.若舍郑以为东道主
古:东方道路上的主人; 今:泛指设宴请客的主人。 3.行李之往来,共其乏困 古:使者,出使的人; 今:指外出之人随身携带的物品。 4,微夫人之力不及此 古:那个人; 今:尊称一般人的妻子。 《勾践灭吴》 7.南至于句无句,通“勾”。 8.将帅二三子夫妇以蕃帅,通“率”,率领。 9.令壮者无取老妇取,通“娶”,娶妻。 10.将免者以告免,通“娩”,分娩。 11.三年释其政政,通“征”,征税。 12.而摩厉之于义摩厉,通“磨砺”,切磋。 13.无不铺也铺,通“哺”,给人食物吃。 14.无不歇也欼,通“啜”,给人水喝。 15.衣水犀之甲者亿有三千 有,通“又”,用于整数与零数之间。 5.然谋臣与爪牙之士,不可不养而择也 古:像爪和牙一样,指帮助者或得力助手; 今:比喻坏人的党羽。 6.将不可改于是矣古:对这种局面;今:连词,表示后一事紧接着前一事。7.以暴露百姓之骨于中原
古:原野;今:指黄河中下游地区。 8.丈夫二十不取古:男子;今:男女两人结婚后,男子是女子的丈夫。 《邹忌讽齐王纳谏》 16.徐公来,孰视之孰,通“熟”,仔细。 9,今齐地方千里古:土地方圆;今:指某一区域。 《触龙说赵太后》 17.少益耆食耆,通“嗜”,喜爱。 18.必勿使反反,通“返”,返回。 《季氏将伐颛臾》 19.无乃尔是过与与,通“欤”,句末语气词。 《寡人之子国也》 20.则无望民之多于邻国也无,通“毋”,不要。 21.颁白者不负戴于道路矣颁,通“斑”,花白。22.涂有饿莩而不知发涂,通“途”,道路。 《劝学》 23.虽有槁暴有,通“又”,又,再。 暴,通“曝”,晒。 24.则知明而行无过矣知,通“智”,才智。 25.君子生非异也生,通“性”,资质,禀赋。 《秋水》 26。泾流之大泾,通“径”,直。 27.不辩牛马辩,通“辨”,分辨。 《过秦论》 28.合从缔交
高考英语知识点归纳总结 听力 【常考点】①数字(涉及年代、日期、数量、价格等数字信息,以基数词、序数词、分数、小数、百分比等形式呈现);②地点(考查内容多以where开头); ③推断(不仅推断时间地点,还推断人物关系、身份、情感、态度、事情真相等); ④场景(涉及购物、问路、咨询天气、打电话等场景)。 【技巧点拨】领略主旨大意,概括对话的中心思想:领会弦外之音,揣测真正意图;捕捉细节,确认提到的具体信息;推测谈话背景,辨别角色关系。 【常见错误】听不懂;连音和吞音听不出来;语气、语调和重音辨别偏差;中外语言表达方式差异。 【常考点】①冠词、非谓语动词、主谓一致、时态和语态、情态动词、定语从句、倒装句、强调句和疑问句;②情景对话;③词组的辨析。 【技巧点拨】领略出题意图;分析句子结构i找关键信息词。 【常见错误】逻辑上受母语干扰;忽略关键信息词;忽略选项处前后的附加信息。 完形填空 【常考点】①同义、近义词词组辨析(动词、名词、形容词等);②固定搭配(动词和介词或副词、名词和介词、形容词和介词等);③语法(时态和语态、从句连接词等):④上下文逻辑关系。 【技巧点拨】跳过选项空格通读全文,领略主旨大意;做题时细读全文,结合选项含义及前后文关系、句子结构等,综合考虑作答:先做简单题,结合简单题找出的信息,进一步加深对文章的理解后再做难题:代入所选答案,再次通读全文,检查逻辑语义是否一致。 【常见错误】脱离上下文,只看选项所在单句;语法判断错误,词汇理解错误:缺少常见生活常识或文化背景造成理解偏差,选项误选。 阅读理解 【常考点】①常见文章体裁(记叙文、说明文、议论文);②常考开头或结尾(主题旬或中心句);③常考因果关系(because/so/SlFICe/for)④常考表示转折的语句;⑤常考比较关系;⑥常考数字信息(时间、数量等)。