
高级物理化学实验
实验项目名称:圆二色光谱原理、实验技术及应用
姓名: 张诗群学号:130420123 指导教师:吴舒婷老师成绩评定:评阅教师:
日期:2014 年7 月10 日
一、实验目的:
1 圆二色性;
2 圆二色谱的原理及应用;
3 圆二色谱的相关拓展知识;
4 圆二色谱的实验技术及操作;
二、实验原理:
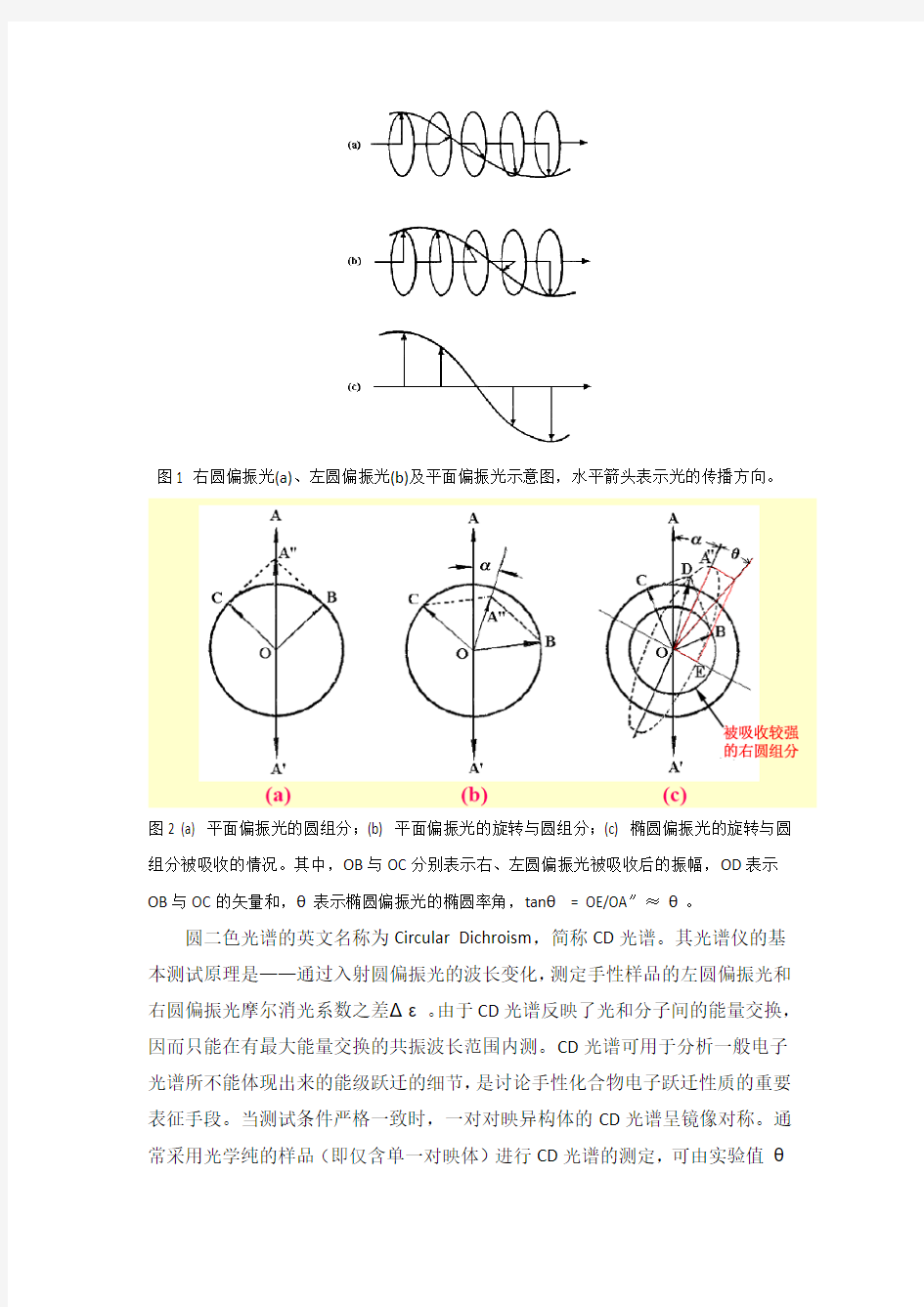
圆二色性是手性分子在光学上表现的一种特性。光可视为振动方向与传播方向垂直的电磁横波。当光波的电矢量方向以一个固定的角速度以传播方向为轴心匀速旋转时,称之为圆偏振光。根据圆偏振光电矢量旋转方向的不同,可以将其区分为左圆偏振光和右圆偏振光。一束平面偏振光可以看成是由两个振幅和速度相同而螺旋前进方向相反的圆偏振光叠加而成(图1)。两圆偏振光彼此对映,互为镜像。当手性物质在偏振光的波长范围内存在吸收的时候,其对左右圆偏振光的吸收程度,也就是摩尔吸光系数,是不同的。此时不但偏振光的偏振平面将被旋转,构成该偏振光的左右圆偏振光的振幅也将不再相等。组成出射光的左右圆偏振光的电矢量和将沿一个椭圆轨迹移动,此时的出射光就是椭圆偏振光(图2)。这种光学现象就称为手性物质所具有的圆二色性。对于纯手性物质,其椭圆偏振光的椭圆度θ在特定溶剂、浓度、温度和光程下,在特定波长处为定值。同时,在特定波长处的椭圆度θ与在该波长处对左右圆偏振光的摩尔吸光系数之差(Δε)成正比。将θ或Δε对波长作图,即得到圆二色光谱。
图1 右圆偏振光(a)、左圆偏振光(b)及平面偏振光示意图,水平箭头表示光的传播方向。
图2 (a) 平面偏振光的圆组分;(b) 平面偏振光的旋转与圆组分;(c) 椭圆偏振光的旋转与圆组分被吸收的情况。其中,OB与OC分别表示右、左圆偏振光被吸收后的振幅,OD表示OB与OC的矢量和,θ表示椭圆偏振光的椭圆率角,tanθ= OE/OA″≈θ。
圆二色光谱的英文名称为Circular Dichroism,简称CD光谱。其光谱仪的基本测试原理是——通过入射圆偏振光的波长变化,测定手性样品的左圆偏振光和右圆偏振光摩尔消光系数之差Δε。由于CD光谱反映了光和分子间的能量交换,因而只能在有最大能量交换的共振波长范围内测。CD光谱可用于分析一般电子光谱所不能体现出来的能级跃迁的细节,是讨论手性化合物电子跃迁性质的重要表征手段。当测试条件严格一致时,一对对映异构体的CD光谱呈镜像对称。通
常采用光学纯的样品(即仅含单一对映体)进行CD光谱的测定,可由实验值θ
根据浓度c、光程长l 求出该纯样的Δε。在严格相同的测试条件下,测定未知样品的CD光谱,可根据实验值求出未知样的Δε’。根据上述数据可估算未知样品的对映体过量值(Enantiomeric Excess,简称ee%)。当样品溶解性差、溶剂背景干扰、溶解过程中绝对构型发生变化时,固相CD光谱测试很有必要。通常对纯样进行CD光谱的测试,可在样品绝对构型与CD信号间建立关联。对同物质未知ee%值的样品,可通过CD光谱,简单判断其哪种对映体过量。此外,光谱还可结合其他结构表征手段用于关联确定手性化合物的绝对构型,或检测靶向分子与DNA等生物大分子的相互作用。
图3 圆二色光谱仪示意图
如图3所示,圆二色光谱仪由氙灯光源、单色系统、偏振系统、样品台、光电倍增管等部件组成。具体参数如下:
光源两种标配灯:150瓦氙灯及150瓦汞氙灯可同时装置。分离式光源置,205nm 以上测量不需使用氮气,波长205nm以下氮器使用量3升/每分钟。
单色器光栅:双光栅1200条/mm。波长设定范围:185至800 nm。
光学系统全反射消色差的光学系统, 氟化镁(MgF2 )偏振光学组件,具参比二极管检测器。
数据采集及数据分析
采样速率:10 微秒/每点-1000 秒/每点。
波长扫描速度:最高1200nm/min (0.05秒to 20秒/每点) 。
圆二色测量噪声:0.01 mdeg°(2nm, 1sec)。
基线稳定性:< 0.01 mdeg°/小时。
CD分辨率:最低达0.0006mdeg。
CD测量范围:最高达±6500mdeg。
三、仪器和药品:
(1)、药品:KCl (光谱纯)、纯手性试剂、无水乙醇(A.R.)。
(2)、仪器:MOS-450圆二色光谱仪,分析天平,压片机(包括压模等),玛瑙研钵。
四、实验步骤:
1 电源
依次打开ALX-250光源开关(先开光源盒背后开关,再开光源盒面板开关),MM-450电源开关,计算机电源,预热半小时。查看ALX-250面板显示功率,微调旋钮,将功率确定在150W。
2 制备样品
液相样品:选取洁净的比色皿,为减小实验误差,空白与试样宜采用同一比色皿。
固相压片样品:采用KCl压片法。以光谱纯KCl(需自备)为惰性介质。压制纯KCl片为空白样,待测样品与KCl混合物压片为试样片,二者质量宜相同,以确保厚度一致。压片越薄越透明越好。
3 开启程序
(1)点击电脑桌面上的“BioKine”图标,进入BioKine软件操作主界面。
(2)点击操作主界面的Device/Scanning Spectrometer,进入光谱扫描界面。
4 安放空白样
液相样品:将装有待测样品空白溶液(如水或缓冲盐)的石英比色皿放入样品仓,确保每次测试比色皿放置朝向相同,盖上盖子。
固相压片样品:取下光电倍增管,将带有纯KCl压片的模具置于样品台上,凹口向内垂直放置,将光电倍增管罩住固体压片模具,锁紧螺丝。
5 空白样扫描与扣除
(1) 根据样品的最大吸收波长,输入到操作界面下方的“Ex”处,回车。
(2) 点击按钮变为,然后点击,自动调整HV电压,然后再点击按钮,锁定此电压值。
(3) 点击主界面上方的按钮,进行测试参数的设置:
a) Acquisition mode:选择测量模式CD;
b) Begin(nm):扫描初始波长;
c) End(nm):扫描结束波长;
d) Scan Repeat :扫描次数;
e) Acquisition duration:每个nm的测量持续时间,范围0.05s-20s。此数值越长,则扫描时间越长,信噪比越优;
f) Shutter Automatic mode:选择Always open;
g) PM gain*10:当在非常低的信号测量,可选择此项,进行信号的增益。
h) CD parameters:CD的灵敏度,根据信号的振幅设置,有四个不同的选项,1000、300、100和30 mdeg。
上述选项,b), c) 项应根据试样的紫外可见吸收谱带选定,其他参数可选用默认值。以上参数都设置好后,点击OK按钮,参数设置完成,回到主界面。
(4) 点击主界面左方Blank spectrum区域的Record按钮,进行空白样的扫描。
(5) 扫描完成后,在第四步的操作区域内,选中Subtract复选框,将在随后进行的试样光谱测试中扣除空白值。
6 样品的测量
1 再点击Shutter按钮关闭挡板,点击HV on按钮变为HV off 。将空白样品替换成待测样品,放置方法与空白样相同。
2 这时再点击Shutter打开挡板,点击HV off按钮变为HV on,然后点击Auto,自动调整HV电压,然后再点击Auto按钮,锁定此电压值。
3 点击主界面Acquisition control区域的△按钮,进行待测样品的圆二色光谱扫描。
7 谱图数据的保持
选择主界面的File菜单下的Save As…。注意选中左下角的“Save As Text”复选框,则保存的bka文件可由记事本打开。
8仪器的关闭
光谱扫描完毕,务必先取出样品。关闭操作软件主界面,关闭MM-450电源开关,ALX-250光源开关(光源盒背后开关);关闭计算机,最后关闭外部电源。
五、注意事项
1. 每次更换测试样,请确认如下两点:
a) 光电倍增管处于关闭状态:软件主界面下方的电压提示处于“”状态;
b) 挡板处于关闭状态:软件主界面下方显示处于灰色的“”状态;
2. 对于固相样品测试,需移动光电倍增管的情况,光电倍增管需轻拿轻放,请避免剧烈振动。
3. 光谱扫描时,请避免实验台面的剧烈震动。
4. 实验结束后,固相样品的压片模具严禁在潮湿状态下装入模具盒。为避免模具生锈,应在清洗后红外灯下烘干。确认干燥后装入模具盒,置于干燥器中。
5. 实验数据请存放于“I:\Data\”目录下。为便于管理,建议以导师姓名为文件夹名称。
6. 每次实验需拷贝的数据,请将另存一份在电脑桌面,并将文件(或文件夹)名称填写于电脑桌面“需传递数据.xls”文档中。请注明数据归属者姓名,电子邮箱及联系方式。数据拷贝将由管理人员每周传递1~2次。
7. 请做好实验登记工作,如实登记所测样品名称,仪器运行情况,以及实验时间。
8. 如需进行上述实验内容以外的测试,敬请联系管理人员。
六、数据处理:
图1. 空白样圆二色谱图
图2. 样品的圆二色谱
图3. 波长随电压变化曲线图
因为波长在200nm至300nm时,电压大于600V,数据不准确,所以,当波长为200nm至300nm时,数据舍去不用。
图4. 舍弃数据后样品圆二色谱图
由上图我们可以看出谱图出现负峰,CD信号表明是右旋,负的CD信号表明左旋。在650nm至800nm处有负Cotton效应,由此可以判定该化合物有CD信号,初步断定为手性化合物,且为左旋。在300-780nm范围的峰主要是由于化合物的生色团引起的,对CD 的贡献来自含有金属离子的生色团,这一波段的CD谱对金属离子的氧化态、配位态及链-链相互作用均是敏感的。
查阅资料可知,由于样品中存在负的CD信号,所以样品中含有M(左手螺
0,他们所属的空间群分别为P6122与旋)构型的[Cu(succ)(4,4’-bpy)]·4H
2
P6522。
七、思考讨论:
1. 哪些物质需要收集CD光谱?CD光谱可以提供哪些信息?
CD光谱的测量条件:在给定波长范围内有较强的CD信号和合适吸收值的手性物质。
CD 光谱提供信息:圆二色谱在有机化合物结构鉴定中有着广泛的应用。可见及近紫外作为入射光源,这就要求被研究的手性分子要具有发色基团,通过对发色基团的研究来获得分子结构信息,因此它只能提供分子局部的结构信息。主要用于测定蛋白质的立体结构圆二色性R和L两种圆偏振光吸收程度不同的现象。圆二色谱是一种测定分子不对称结构的光谱法。在分子生物学领域中主要用于测定蛋白质的立体结构,也可用来测定核酸和多糖的立体结构。
2. 在CD光谱测试之前,需要哪些准备工作?
(1)圆二色谱反映光和分子间能量转换情况,这种相互作用只在短波范围内共振波长周围发生,并且在共振波长处产生最大能量交换,因此圆二色谱仅在这个区域可以被测量。理想情况下,紫外吸收谱图(UV)中吸收带λmax和CD的|Δε|max(在图中呈峰或谷)是重合的,但实际上两者是接近的。CD测试前进行UV测试,可找出其理想的测试光谱范围。
(2)理想的溶液中除样品分子具有吸收外,其他物质都不具有光学活性。但研究表明绝大部分物质在紫外区(尤其是250nm以下深紫外区)都有吸收,并且波长越短,吸收越强,测试光的强度越低。测试光强度太低时,则无法测试。因此,每种溶剂都有其测试截止波长。CD测试中应尽可能选用截止波长较短的溶剂,如水、环己烷、甲醇、乙醇、乙腈、二氧杂环已烷,避免截止波长较长的溶剂,如苯、甲苯等。此外,CD测试波长扫描时,应尽量避免深紫外区的扫描,减少溶剂以及其他物质的吸收干扰。
(3)根据比耳定律,选用光程较短的吸收池和浓度较大的溶液可以有效地减少溶剂吸收。虽然比耳公式表明CD信号与其浓度成线性关系,但并不是浓度越高,CD信号越好。浓度过高将导致吸收峰红移和扁平效应。此外,Δε值非常小,浓度过高可测光的强度减小,此时吸收所产生的微小变化则被测试噪音所覆盖,并且光强越小噪音越大。在波长确定的情况下,理想的浓度所对应的吸光度应在0.8左右。因此,CD测试前的UV测试,在找出其理想的测试光谱范围的同时,还可以确定其理想的浓度。
(4)有些样品需在一定的盐或缓冲液中才能稳定或接近其实际使用环境。但盐或缓冲溶液的使用通常又会带来吸收干扰,并且波长越短干扰越强。因此,盐和缓冲液也有其对应的CD测试截止波长。CD测试中应根据样品性质和所选波谱范围,选用合适的盐或缓冲溶液,避免吸收干扰。
(5)CD信号的质量受倍增电压值影响,理想的倍增电压(DV)为200V左右。当倍增电压高于500V时,CD噪音增加,测试信号减弱,所测结果不可靠。此时应适当稀释溶液或选用光程较短的样品池
(6)CD样品应尽可能为均相溶液且不含吸光干扰的杂质,如有不溶物则应过滤或离心去除。为避免纸屑影响,比色皿的擦拭须使用擦镜纸。此外,温度或溶剂
的变化常会引起溶液中气体溶解度的变化,析出气体滞留在溶液中就会产生气泡。进行温度或者滴定实验时,样品放入圆二光谱仪前,应先排除气泡干扰,必要时进行搅拌。通常样品(包括一些在可见光范围内没有光化学活性的样品)都存在着光化反应,从而导致CD信号随时间而变。光化反应的变化有时会被波长、温度或其他变化所掩盖,但通常都遵循以下规律:狭缝减半,光强减
为原来1/4时,光化反应的速率也减为原来的1/4。该规律常用在相同光照和缓冲条件下,区分光化反应和其他动力学反应。CD基线校正的条件应尽可能与样品条件相同,如相同的测试方法、吸收池、光路方向、缓冲体系,并尽可能缩短测试时间差,然后通过CD软件中的Math操作去除基线干扰。
3. 简述CD光谱对你今后科研工作发挥的作用。
圆二色谱在有机化合物结构鉴定中有着广泛的应用。可见及近紫外作为入射光源,这就要求被研究的手性分子要具有发色基团,通过对发色基团的研究来获得分子结构信息,因此它只能提供分子局部的结构信息。
但今后我工作的主要方向是进行直接乙醇燃料电池阳极催化剂的制备以及性能的研究,制备的一系列催化剂主要是无机化合物,不存在发色基团,主要还是需要通过BET,SEM,TEM,XRD的测试手段对样品进行表征,通过组装成三电极体系使用循环伏安法对样品的催化性能进行测试。所以在今后的科研工作中会比较少使用到CD光谱。
八、参考文献
[1] Nina Berova, Prasad L.Polavarapu, Koji Nakanishi, Robert W.Woody, COMPREHENSIVE CHIROPTICAL SPECTROSCOPY, Wiley, 2012.
[2] Electronic Circularly Dichroism Spectroscopy, Ferenc Zsila M.D., Ph.D., 2010.
[3] 章慧,《配位化学——原理与应用》,化工出版社,2009.
圆二色谱中文版
圆二色谱,判断黄酮类化合物绝对构型的重要手段1.简介: 手性化合物的旋光性是化合物分子的立体构型的不对称性对平面偏振光的作用。若对组成平面偏振光的左旋圆偏振光和右旋圆偏振光的吸收系数不同,即εL≠εR,,这种性质称为手性化合物的圆二色性。当测定的仪器接收透过手性化合物溶液的平面偏振光时,记录的是手性化合物溶液对左旋圆偏振光和右旋圆偏振光的吸收系数之差△ε,或化合物生色团吸收波长附近的摩尔椭圆度[θ]即可获得圆二色谱〔CD〕。 CD即圆二色谱,是以吸收系数之差或摩尔椭圆度[θ]为纵坐标,波长为横坐标记录的谱线,其中△ε=(d L-d R)/C×1,d L和d R为吸光度。C为溶液浓度,1为测定用池的池长;[θ]=ψ(λ)M/100LC其中ψ(λ)为所用测定池情况下的平面偏振光的椭圆度,C为溶液浓度,单位g/ml,1为池长,单位dm,M为分子量。它们之间的关系为[θ]=3300△ε,而△ε=θ/33×C·1。2.黄酮类: 多酚类是生物体内主要的二次代谢产物。根据他们的碳骨架能划分为几种主要种类。例如,黄酮类与酚酸类。黄酮类根据的氧化情况又可以分为许多种类。已知的黄酮类化合物中都具有的骨架形式,并常有羟基取代,甲氧基取代,苷化及其他修饰和组合。 虽然黄酮类化合物的绝对构型在50年代起已经通过旋光性和ORD方法进行解析了,但是更方便,更简易的CD谱方法却在60年代中期更为流行。CD 谱现已广泛用于具有旋光性的黄酮类化合物的解析,如:二氢黄酮类,二氢黄酮醇类,黄烷-3-醇类,黄烷-4-醇类,黄烷-3,4-二醇类,黄烷类,异黄烷类,二氢异黄酮类,类鱼藤同类,前花色素类和各种类型的双黄酮类。 3.二氢黄酮类 二氢黄酮类的两个结构特征在判定它们绝对构型时非常重要。一个是之间的单键,一个是位的手性中心,大多数天然二氢黄酮类化合物中在位具有苯基,其为α取向时,其绝对构型被定为S。 利用CD 或ORD连用NMR光谱数据判定二氢黄酮类化合物绝对构型始于Gaffield。 二氢黄酮类化合物的UV最大吸收在270----290处,320----330处有一弱峰,这是由于苯乙酮型和之间的相互转化产生的。八区律规则已经从判定α,β不饱和酮的手性及它们的长波CE图上扩展到了芳香酮。这样,二氢黄酮类化合物绝对构型为2S时,在构象上就具有杂环的P ----螺旋性和C2位芳基处于平伏键,并在CE谱上表现为正性的n---π※吸收带和负性的π---π※吸收带。 利用n---π※吸收带判定构型的优点是这种转变在芳香环取代系统中是独立的。虽然n---π※转变处于长波区趋于随构型相反对映体量的增加而消失。 杂环上的H2与H3之间的较大偶合常数(J2,3)表明所有天然二氢黄酮类在热力学稳定构象中C2芳香基处于平伏键(fig2)。这说明所有左旋的二氢黄酮类具有2S构型。 利用这个信息的例子在确定OBO---二氢黄酮A和二氢黄酮B构型可以清楚的发现。(fig.3 and table1)
圆二色光谱实验 一、实验目的 1、了解圆二色(CD)光谱的原理和使用方法。 2、学会用圆二色光谱检测蛋白质二级构象的基本原理和方法,并学会分析物质的手性。 3、了解圆二色光谱仪的基本构造,并学会使用。 二、实验原理 1.CD光谱的基本知识 圆二色性是研究分子立体结构和构象的有利手段。在一些物质的分子中,没有任意次旋转反映轴,不能与镜像相互重叠,具有光学活性。电矢量相互垂直,振幅相等,位相相差四分之一波长的左和右圆偏振光重叠而成的是平面圆偏振光。 平面圆偏振光通过光学活性分子时,这些物质对左、右圆偏振光的吸收不相同,产生的吸收差值,就是该物质的圆二色性。 圆二色性用摩尔系数系数差ΔεM来度量,且有关系式:ΔεM = εL –εR,其中,εL 和εR分别表示左和右偏振光的摩尔吸收系数。如果εL –εR >0,则ΔεM为“+”,有正的圆二色性,相应于正Cotton效应;如果εL –εR<0,则ΔεM为“-”,有负的圆二色性,相应于负Cotton效应。 由于这种吸收差的存在,造成了矢量的振幅差,因此从圆偏振光通过介质后变成了椭圆偏振光。圆二色性也可用椭圆度θ或摩尔椭圆度[θ]度量。[θ]和ΔεM之间的关系式:[θ]=3300*Δε 圆二色光谱表示的[θ]或ΔεM与波长之间的关系,可用圆二色谱仪测定。一般仪器直接测定的是椭圆度θ,可换算成[θ]和ΔεM:[θ] = 100θ/cl,ΔεM= θ/33cl 其中,c表示物质在溶液中的浓度,单位为mol/L;l为光程长度(液池的长),单位为cm。输入c和l的值,一般仪器能自动进行换算,给出所需要的关系。 2.定性分析原理 圆二色光谱仪需要将平面偏振调制成左、右圆偏振光,并用很高的频率交替通过样品,因而设备复杂,完成这种调制的是电致或压力致晶体双折射的圆偏振光发生器(也称Pocker池或应力调制器)。圆二色谱仪一般采用氙灯作光源,其辐射通过由两个棱镜组成的双单色器后,就成为两束振动方向相互垂直的偏振光,由单色器的出射狭缝排除一束非寻常光后,寻常光由CD调制器制成交变的左圆偏振光、
圆二色光谱(简称CD)是应用最为广泛的测定蛋白质二级结构的方法,是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法。它可以在溶液状态下测定,较接近其生理状态。而且测定方法快速简便,对构象变化灵敏,所以它是目前研究蛋白质二级结构的主要手段之一,并已广泛应用于蛋白质的构象研究中。 一.简介 圆二色谱是用于推断非对称分子的构型和构象的一种旋光光谱。光学活性物质对组成平面偏振光的左旋和右旋圆偏振光的吸收系数(ε)是不相等的,εL≠εR,即具有圆二色性。如果以不同波长的平面偏振光的波长λ为横坐标,以吸收系数之差Δε=εL-εR为纵坐标作图,得到的图谱即是圆二色光谱,简称CD。如果某手性化合物在紫外可见区域有吸收,就可以得到具有特征的圆二色光谱。由于εL≠εR,透射光不再是平面偏振光,而是椭圆偏振光,摩尔椭圆度[θ]与Δε的关系为:[θ]=3300Δε。圆二色谱也可以摩尔椭圆度为纵坐标,以波长为横坐标作图。由于△ε有正值和负值之分,所以圆二色谱也有呈峰的正性圆二色谱和呈谷的负性圆二色谱。在紫外可见光区域测定圆二色谱与旋光谱,其目的是推断有机化合物的构型和构象。 二.样品要求 1、样品必须保持一定的纯度不含光吸收的杂质,溶剂
必须在测定波长没有吸收干扰;样品能完全溶解在溶剂中, 形成均一透明的溶液。 2、氮气流量的控制 3、缓冲液、溶剂要求与池子选择:缓冲液和溶剂在配制溶液前要做单独的检查,看是否在测定波长范围内有吸收干扰,看是否形成沉淀和胶状;在蛋白质测量中,经常选择透明性极好的磷酸盐作为缓冲体系。 4样品浓度与池子选择 样品不同,测定的圆二色光谱范围不同,对池子大小(光径)的选择和浓度的要求也不一样。蛋白质CD光谱测量一般在相对较稀的溶液中进行。 三.谱带宽度 选为1 nm。对于高分辨率测量,要用较窄的狭缝宽度,此时光电倍增管的电压较高,谱的信噪比差。虽然对于正常测量最佳谱带宽度是1~2 nm,但是在下列情况下要牺牲分辨率而需要较宽的狭缝宽度。当样品的吸光度很高但CD信号很弱时,一方面要尽量保证测定CD峰所需要的足够浓度,另一方面要设置较宽的狭缝。不过此时要特别小心,因为样品在吸光度过高(A>2)的情况下可能存在荧光或杂散光引起的某些假象。另外,在固体CD光谱测试时也需要较大的狭缝宽度(一般要求> 2 nm)。 (2)椭圆率和摩尔椭圆率都依赖于测量条件。因此,温度、
3.3.9圆二色性(Circular dichroic,CD)测定 1%(w/w)的蛋清溶液调节到pH 4.0,6.0,10.0,在85oC加热不同时间,离心,取上清液,然后稀释至100~200μg/mL溶液。对照组为天然蛋清样品。用Jasco J-715光度计测定样品的CD谱。测定条件设定:测定波长范围190~250 nm,25oC,比色皿光径1 mm,分辨率0.2 nm,扫描速率100 nm/min,扫描5次。使用Jasco SSE软件确定样品的二级结构百分含量。 3.4.6蛋白质的二级结构对DH的影响 蛋白酶的水解反应还受到蛋白质的结构的影响,一般结构紧密的蛋白质提供的酶切位点少于结构松散的蛋白质。因此有必要研究蛋白质结构对DH的影响。蛋白质的热处理可能引起二级、三级和四级结构的变化。从二级结构看,α-螺旋结构表现蛋白质分子的有序性,而其结构如β-折叠、β-转角、无规卷曲等反映了蛋白质分子的松散性[26]。蛋白质分子的有序性差,越有利于蛋白酶的水解。目前,研究蛋白质构象最好的方法是x-射线衍射,但对结构复杂、柔性的生物大分子蛋白质来说,制备蛋白质单晶较为困难。二维、多维核磁共振技术能测出溶液状态下蛋白质分子的构象,可是对分子量较大的蛋白质的计算处理非常复杂。相比之下圆二色性是研究稀溶液中蛋白质分子构象的一种快速、简单、较准确的方法。圆二色性在紫外区段(190~240 nm),主要生色团是肽链,这一波长范围的CD谱包含着生物大分子主链构象的信息。在一般情况下,实验中得到的CD谱线是α-螺旋、β-折叠和无规卷曲构象的CD 谱的线性迭加[27]。图3-7显示天然蛋清的CD谱线a在222 nm处和208 nm处呈负峰,在190 nm附近有一正峰,这是存在部分α-螺旋构象的特征。谱线b、c、d、e在221 nm处的负谱带减弱,意味着α-螺旋的百分比减小。谱线b、c、d、e向短波长方向移动,即发生蓝移。由于发色团吸收光谱发生位移主要取决于它的微环境更加亲水或疏水的结果[28],因此谱线b、c、d、e蓝移的发生说明体系的亲水性降低,即疏水性增加。表3.3列出了天然蛋清和热处理蛋清的α-螺旋、β-折叠、β-转角和无规卷曲构象所占的比例。从表中可以看出,通过热处理,天然蛋清的α-螺旋比例下降,而β-折叠和无规卷曲的比例增加,说明蛋清蛋白分子结构的有序性降低,形成了以β-折叠和无规卷曲为主的二级结构。 图3-7天然和热处理的蛋清的CD光谱 a-天然蛋清;b-pH4,85oC加热36 min蛋清;c-pH6,85oC加热36 min蛋清;d-pH10,85oC 加热30 min蛋清;e-pH10,85oC加热60 min蛋清。 4.19圆二色谱分析动态超高压微射流均质对卵清蛋白二级结构的影晌
圆二色谱的介绍 圆二色性 circulardichroism 对R和L两种圆偏振光吸收程度不同的现象。这种吸收程度的不同与波长的关系称圆二色谱,是一种测定分子不对称结构的光谱法。在分子生物学领域中主要用于测定蛋白质的立体结构,也可用来测定核酸和多糖的立体结构。 光是一种电磁波。假如用电矢量来表示,光的前进就是由矢量端点在一特定的平面里沿正弦波运动的轨迹。对于自然光讲,正弦波振动的平面是随机的。如有一束光,它所有的电矢量的振动平面都是相互平行的,这种光称为平面偏振光。有一种特殊的情况,光前进的过程中电矢量绕前进轴转动,若电矢量的绝对值不变,则运动轨迹的投影是一个圆,这时就变成圆偏振。面对光前进的方向看去,电矢量端点的圆运动可以是顺时针方向的,也可以是逆时针方向的,因此圆偏振有R与L两种。 假如L与R两束圆偏振光在一起辐射,强度、速度、频率和位相都相同,它们就会叠合成一束平面偏振光。如波长λ的L光和R光的光强度相等,在光学各向异性物质中传播某一距离后,它们的综合光将变成椭圆偏振光,椭圆的长轴处于两个圆偏振的电矢量相叠合的地方。假如两个圆偏振的传播速度也不相同,而所经的途径与上述相同,则叠合的椭圆偏振光的长轴与上面所述的椭圆偏振光的长轴相夹θ角(图1)。 由不对称分子组成的物质是光学各向异性的,即L与R两束圆偏振光在这类物质中的传播速度不相等。假如光学各向异性物质在某一波长λ有吸收,那将在该时对L光和R光有不同的吸收,如该物质的吸光率是A,而对L光和R光的吸光率是AL和AR,AL和AR的差ΔA=AL-AR,称为圆二色性。 从(图2)可看出,因光吸收不同而产生的椭圆的形状与ΔA有直接的关系。θ称为椭圆值,也是一种定量描述圆二色性的单位。在条件相同的情况下,θ=3300ΔA。 在蛋白质分子中,肽链的不同部分可分别形成α-螺旋、β-折叠、β-转角等特定的立体结构。这些立体结构都是不对称的。蛋白质的肽键在紫外185~240纳米处有光吸收,因此它在这一波长范围内有圆二色性。几种不同的蛋白质立体结构所表现的椭圆值波长的变化曲线——圆二色谱是不同的。如(图3)所示,α-螺旋的谱是双负峰形的,β-折叠是单负峰形的,无规卷曲在波长很短的地方出单峰。蛋白质的圆二色谱是它们所含各种立体结构组分的圆二色谱的代数加和曲线。因此用这一波长范围的圆二色谱可研究蛋白质中各种立体结构的含量。 蛋白质含酪氨酸、色氨酸和苯丙氨酸,它们在240~350纳米处有光吸收,当它们处于分子不对称环境中时也表现出圆二色性。这一范围的圆二色性反映出在蛋白质分子中上述氨基酸残基环境的性质。 核酸中所含糖有不对称的结构,它们所含的双螺旋结构也是不对称的。它们在185~300纳米范围内也有特征的圆二色谱(图4)。这些谱与核酸的立体结构的关系虽不甚显著,但也可以用它研究某些立体结构。同时圆二色谱与核酸的碱基配对数有关系,因此也可用圆二色谱研究核酸的化学组成。 1.CD的安装与测量准备: 为避免CD强度随温度而发生变化的变化,CD应安装在空调室中.而且还需要
紫外圆二色谱分析蛋白结构 根据电子跃迁能级能量的大小,蛋白质的CD光谱分为三个波长范围: (1) 250nm以下的远紫外光谱区,圆二色性主要由肽键的电子跃迁引起; (2) 250~300nm的近紫外光谱区,主要由侧链芳香基团的电子跃迁引起; (3) 300~700nm的紫外-可见光光谱区,主要由蛋白质辅基等外在生色基团引起。 相应地,远紫外CD主要用于蛋白质二级结构的解析,近紫外CD主要揭示蛋白质的三级结构信息,紫外-可见光CD主要用于辅基的偶合分析。 远紫外CD谱: 在蛋白质或多肽的规则二级结构中,肽键是高度有规律排列的,二级结构不同的蛋白质或多肽,所产生CD谱带的位置、峰的强弱都不同。因此,根据所测得蛋白质或多肽的远紫外CD谱,能反映出蛋白质或多肽链二级结构的信息。 紫外区段(190-240nm),α-螺旋的CD谱在192nm附近有一正峰,在208nm、222nm处呈两个负的特征肩峰;β-折叠在216-218nm有一负峰,在185-200nm有一强的正峰;β-转角则在206nm附近有一正峰;无规则卷曲构象的CD谱在198nm附近有一负峰,在220nm附近有一小而宽的正峰。 近紫外CD光谱: 蛋白质中芳香氨基酸残基,如色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)及二硫键处于不对称微环境时,在近紫外区250~320nm表现出CD峰。研究表明:色氨酸在290及305nm处有精细的特征峰;酪氨酸在275及282nm有峰;苯丙氨酸在255、260及270 nm有弱的但比较尖锐的峰带;另外芳香氨基酸残基在远紫外光谱区也有CD信号;二硫键于195-200nm和250-260处有谱峰?。总的来说,在250~280nm之间,由于芳香氨酸残基的侧链的谱峰常因微区特征的不同而改变,不同谱峰之间可能产生重叠。 蛋白浓度与使用的光径厚度和测量区域有一定关系,测量远紫外区氨基酸残基微环境的蛋白,浓度范围在0.1~1.0mg/ml,则光径可选择在0.1~0.2cm之间,溶液体积则在200~500ul。而测量近紫外区的蛋白三级结构,所需浓度要至少比远紫外区的浓10倍方能检测到有效信号,且一般光径的选择均在 0.2~1.0cm,相应的体积也需增加至1~2mL。缓冲液可选50~100mmol Tris-HCl、PBS等,尽量除去EDTA。) 测蛋白二级结构的CD峰图中,在正常条件下,正峰或负峰都趋向于最大正/负峰值。图6中由于外界条件(温度)不断升高,导致蛋白的二级结构逐渐被破坏,峰值逐渐向0靠近,趋于平缓。
圆二色谱仪 使用手册 实验前请先阅读第一部分注意事项 2011年4月6日整编 河北大学理化中心
目录 一、注意事项 二、光源的选择 三、MOS 450波长的校正 四、电压的调节 五、MOS-450 圆二色光谱扫描操作规程 六、MOS 450-SFM 300动力学操作方法
一、注意事项 1、滴定及变温实验时,需要磁子搅拌。实验结束时首先拔掉搅拌电源。在样品池内无磁子的情况下搅拌器空转会烧毁控温元件。 2、光源(也就是氙灯或汞氙灯)不可频繁开关。举例而言,如果马上不用仪器,但半个小时后需要使用仪器,就不要为了节约光源寿命而将光源关闭。短时间内频繁开关光源反而会缩短光源寿命。 3、光电倍增管移动时(比如从圆二色模式换为荧光模式),注意用软件将Hv(高压)关闭。 4、扫描速度在0.5-5s/nm。使用手册上写的扫描速度有误,特别注意不要低于0.5秒/nm,过快的扫描速度易造成calibration移位。 5、如需用到emission单色器,就是那个需要用光纤连接的单色器,扫描速度要大于1s/nm,连0.5s/nm都不能用。 6、PMT的HV不要超过1000V. 7、使用控温附件进行变温实验时,一定要将地上的那个水浴恒温槽打开,水槽温度设为20度以下即可。 8、TCU上设置为remote; Power supply设置为ARC. 9、仪器运行过程中,更换样品时,shutter最好关闭。
二、光源的选择 1、电源: 图1中的Lamp power supply处有Xe(红色)、Xe(Hg)(红色)、零线(黑色)三个插孔。 零线插头为黑色,直接插到黑色的零线插孔中。 火线插头为红色,在做圆二色、紫外、荧光的光谱扫描时插在Xe(红色)插孔中,在做快速动力学测量的时候插在Xe(Hg)插孔中。 2、光源选择: 图2中的Vertical setting部位下方的底座上有Xe、Xe(Hg)两个标示前后排列。手动松开中间的大圆头Screws(图2中),可以拉出或推进Vertical setting。当Vertical setting的金属头通过前后移动到下方的哪个标示位置上,也就是那个标示所示的灯正对着光路,为测试用光源。做快速动力学测量的时候选Xe(Hg),做圆二色、紫外、荧光的光谱扫描时选Xe,最后再旋紧中间的大圆头Screws。 注:Xe(Hg)灯中的Hg元素有一些很强的特征谱线,加强了Xe元素发光的强度,对于动力学测量要求一个波长的光源能量要强,才能测量较为精确的谱图。而对于光谱扫描,单独的Xe元素谱线较为平滑,光源对扫描的影响较小。 图1 图2
圆二色谱实验总结 圆二色谱是用来表征蛋白的二级结构和三级结构的常用方法,在界面课题组主要用来表征肽自组装体的二级结构;通常对于三级结构不予考虑。这一方法的实验操作容易,与一般的光谱测量相同,但是形成的机制比较复杂。在此只能说我自己理解了的部分,对于不理解的部分还需要继续查文献进行了解。 1圆二色谱的原理 名称中虽有“色谱”两字,但是这一测量方法实际上是一光谱法,光谱法对应的即为电子的跃迁行为。同时,光谱法中必然存在的定量关系就是朗伯-比尔定律,圆二色谱的方法就是建立在这一光吸收过程上的光谱方法。 1.1预备知识 需要推演圆二色谱的原理用到的工具有数学工具和物理知识两个方面,分别叙述如下。 1.1.1 数学工具 在推演圆二色谱的数学表达形式时,需要用到一些数学知识,主要有圆的普通方程及参数方程、椭圆的普通方程及参数方程,相关的三角函数知识,这些数学知识基本都在高中阶段学过。 首先说明圆的普通方程和参数方程:圆的普通方程即为仅对圆上点的坐标关系进行描述的方程。圆上点的特点是对固定点(即圆心)的距离相等,设圆心的坐标为(x0, y0)半径为r,则圆的普通方程为 √(x?x0)2+(y?y0)2=r 通常用的是化简的形式,为讨论方便,将圆心设为原点,即得到 x2+y2=r2 利用同角三角函数关系,即sin2θ+cos2θ=1可将上述方程参数化,得到圆的参数方程 {y=r sinθ x=r cosθ使用同样的思路,可以得到椭圆的参数方程,即 {y=b sinθ x=a cosθ消去参数后,得到椭圆的标准方程,即 x2 a2+ y2 b2 =1 上述有关于椭圆的方程中均有a≠b。 1.2 物理预备知识 关于物理的预备知识是最基本的波动光学的观点。按照波动光学的观点,光是在空间中交替传播的电磁场,电场强度的方向与磁感应强度的方向垂直。从能量分布的角度来说,光的能量被认为主要以电场的形式传播,因而通常也将光的电场强度矢量方向定义为光矢量方向。以上即最基本的波动光学观点,下面解释光的偏振特点。 1.2.1 自然光和偏振光 自然光即任何光源发出的光,其特点为光矢量在垂直于传播方向的平面上均匀分布,但在传播方向上并不体现出规律性,如图1(a)所示,图中z轴的方向由纸面向外,以圆的半径表示光矢量的大小,对于一给定的自然光,光矢量的大小即光的强度是恒定不变的。光的偏振现象可理解为在传播方向上光矢量振动的不对称性。在圆二色谱的原理中,涉及到的偏振光有平面偏振光、圆偏振光和椭圆偏振光三类。
高级物理化学实验 实验项目名称:圆二色光谱原理、实验技术及应用 姓名: 张诗群学号:130420123 指导教师:吴舒婷老师成绩评定:评阅教师: 日期:2014 年7 月10 日 一、实验目的: 1 圆二色性; 2 圆二色谱的原理及应用; 3 圆二色谱的相关拓展知识; 4 圆二色谱的实验技术及操作; 二、实验原理: 圆二色性是手性分子在光学上表现的一种特性。光可视为振动方向与传播方向垂直的电磁横波。当光波的电矢量方向以一个固定的角速度以传播方向为轴心匀速旋转时,称之为圆偏振光。根据圆偏振光电矢量旋转方向的不同,可以将其区分为左圆偏振光和右圆偏振光。一束平面偏振光可以看成是由两个振幅和速度相同而螺旋前进方向相反的圆偏振光叠加而成(图1)。两圆偏振光彼此对映,互为镜像。当手性物质在偏振光的波长范围内存在吸收的时候,其对左右圆偏振光的吸收程度,也就是摩尔吸光系数,是不同的。此时不但偏振光的偏振平面将被旋转,构成该偏振光的左右圆偏振光的振幅也将不再相等。组成出射光的左右圆偏振光的电矢量和将沿一个椭圆轨迹移动,此时的出射光就是椭圆偏振光(图2)。这种光学现象就称为手性物质所具有的圆二色性。对于纯手性物质,其椭圆偏振光的椭圆度θ在特定溶剂、浓度、温度和光程下,在特定波长处为定值。同时,在特定波长处的椭圆度θ与在该波长处对左右圆偏振光的摩尔吸光系数之差(Δε)成正比。将θ或Δε对波长作图,即得到圆二色光谱。
图1 右圆偏振光(a)、左圆偏振光(b)及平面偏振光示意图,水平箭头表示光的传播方向。 图2 (a) 平面偏振光的圆组分;(b) 平面偏振光的旋转与圆组分;(c) 椭圆偏振光的旋转与圆组分被吸收的情况。其中,OB与OC分别表示右、左圆偏振光被吸收后的振幅,OD表示OB与OC的矢量和,θ表示椭圆偏振光的椭圆率角,tanθ= OE/OA″≈θ。 圆二色光谱的英文名称为Circular Dichroism,简称CD光谱。其光谱仪的基本测试原理是——通过入射圆偏振光的波长变化,测定手性样品的左圆偏振光和右圆偏振光摩尔消光系数之差Δε。由于CD光谱反映了光和分子间的能量交换,因而只能在有最大能量交换的共振波长范围内测。CD光谱可用于分析一般电子光谱所不能体现出来的能级跃迁的细节,是讨论手性化合物电子跃迁性质的重要表征手段。当测试条件严格一致时,一对对映异构体的CD光谱呈镜像对称。通 常采用光学纯的样品(即仅含单一对映体)进行CD光谱的测定,可由实验值θ
圆二色性光谱及其应用 (Circular Dichroism,CD) 光学活性分子对左、右圆偏光的吸收率的差值 1、自然光 光具有波、粒二象性,是横电磁波。只有横波才有偏振现象: 光矢量的振动方向与光的传播方向垂直, 在垂直于光传播方向的平面内, 有不同的振动方向。 电场矢量E和磁场矢量H互相垂直、位相相同。 由于感光作用都是E 引起的,因而,将E 作为光矢量。 振动面:E 与光传播方向组成的平面。
从统计规律上说,自然光的光振动: 在垂直于光速的平面上遍布所有方向, 沿各方向振动的光矢量呈对称分布, 相应光矢量的振幅(光强度)相等。 超高压短弧氙灯: 在高压纯净氙气中放电发光。 (1)高亮度的点光源; (2)日光色。色温接近6000K; (3)在可见光区连续光谱; (4)高显色性,显色指数>95; (5)在整个寿命期内维持光色特性; (6)高电弧稳定性; (7)热重启能力; (8)启动后即能达到接近最大光输出; (9)电弧光斑小、易聚光。
2、光的偏振 双折射现象: 一束光射入各向异性晶体后有两束折射光。 尼科耳棱镜。 在生物样品中,肌肉纤维、骨骼和牙齿等具有各向异性,淀粉粒、染色体和纺锤体等具有双折射性,因此被用于组织细胞的化学研究。
o光和e光:频率相同、振动方向相互垂直、平面偏振光 光的吸收和圆二色性(circular dichroism, CD) 化合物在正常情况下,处于低能的基态,电子占据所有的成键轨道(σ、π、n轨道)。如果电子吸收了外界的能量,它就从基态跃迁到激发态能 级。 如果所有的跃迁仅在基态的最低振动能级和第一激发态之间,吸收光谱将是很狭窄而不连续的谱线。 由于分子的价电子跃迁总伴随着振动和转动能级的跃迁,所以,紫外分光光度计测定物质的吸收光谱,虽然有一最大吸收峰值,但都是具有一定 波长宽度并相对平滑的曲线。
许多生物大分子都是手性分子。所谓手性就是具有不能重叠的三维镜像对应异构体。一般来说,凡具有手性的分子就具有旋光活性,这一点很早就认为人们所认识并广泛应用于研究分子的非对称性结构。振动方向在同一平面内的电磁波为平面偏振光。当一束平面偏光通过介质时,光学活性物质分子对左、右圆偏振光的吸收不同,其差值称为圆二色性。由于存在圆二色性,平面偏振光通过光学活性物质后,其两圆偏振光分量的强度将不同,它们合成的不再是平面偏振光,而是椭圆偏振光。吸收随波长的变化构成圆二色谱。圆二色谱仪利用这一原理,将平面偏振光调制成左圆偏振光和右圆偏振光,并以很高的频率交替通过样品,这两束圆偏振光通过样品产生的吸收差由光电倍增管接收检测。 圆二色谱是快速确定蛋白质和肽二级结构的方法。在紫外区段主要的生色团是肽链,这一范围的圆二色谱包含着肽主链的构象信息。在近紫外区占支配地位的生色基团是芳香氨基酸侧链,这一区域的圆二色谱能给出局域侧链间相互作用的信息。在波长大于300nm 的区域,包括可见光区,对圆二色谱的贡献主要来自含有金属离子的一类生色团,这一波段的圆二色谱对于金属的氧化态、配位体以及链一链相互作用均较敏感。不含非氨基酸发色团的肽和蛋白质在300nm 以上没有吸收或圆二色谱带。 通常由样品圆二色谱形状、谱峰位置、强度以及它们随时验条件的变化本身就可以得到很重要的结构信息。最主要的圆二色谱参量是谱峰位置及该处摩尔椭圆率。酰胺基是用圆二色谱观察肽和蛋白质
的最重要的发色团。已确定它的两种电子迁移方式。n-π迁移通常很弱,在220nm附近呈一个负带。它的能量对氢键的形成敏感。π-π迁移一般较强,在192nm附近出现一个正带,在210nm附近出现一个负带。 а-螺旋、β-折叠构象和不规则构象的比例可用圆二色谱确定。а-螺旋构象的特征是常在222nm和208nm处出现负带,在192nm 处为一正带。短肽在溶液中通常不形成稳定的螺旋,但已表明加入2,2,2-三氟乙醇能使大多数肽的螺旋成分增加。如前文所述,与а-螺旋相比,β-折叠具有不确定性,可以平行或反平行方式形成,它的特征性圆二色谱是在216nm处有一负带,在接近195nm处,有一个相当大的正带。不规则构象的圆二色谱通常在200nm以下有一个较强的负带。 虽然圆二色谱分析不像X线衍射分析那样能给出比较全面的绝对信息,并且它总是必须与标准相比较和利用X线衍射的结果。但它对构象变化灵敏,因此通过圆二色谱的观察和分析可以灵敏地检测一些反应引起的构象变化,并进一步进行半定量测定。由于常规圆二色谱仪所检测的光谱范围一般在200nm以上,丢失了200nm以下的重要信息,因此从远圆二色谱上一般得不到精确的结果。近10多年来,随着同步辐射光的出现,圆二色谱区的扩展已经成为现实。现在,利用同步辐射光作为光源,可以把圆二色谱区拓展到110-130nm,实现了真空紫外圆二色。此外,磁圆二色与振动圆二色的发展可以用来探测普通光谱学无法分辨的分子的多重跃迁及某些分子激发态的
一、实验目的 1. 圆二色性; 2. 圆二色光谱的原理与应用; 3. 圆二色光谱的相关拓展知识; 4. 圆二色光谱的实验技术与操作。 二、实验原理 圆二色性是手性分子在光学上表现的一种特性。光可视为振动方向与传播方向垂直的电磁横波。当光波的电矢量方向以一个固定的角速度以传播方向为轴心匀速旋转时,称之为圆偏振光。根据圆偏振光电矢量旋转方向的不同,可以将其区分为左圆偏振光和右圆偏振光。一束平面偏振光可以看成是由两个振幅和速度相同而螺旋前进方向相反的圆偏振光叠加而成(图1)。两圆偏振光彼此对映,互为镜像。当手性物质在偏振光的波长范围内存在吸收的时候,其对左右圆偏振光的吸收程度,也就是摩尔吸光系数,是不同的。此时不但偏振光的偏振平面将被旋转,构成该偏振光的左右圆偏振光的振幅也将不再相等。组成出射光的左右圆偏振光的电矢量和将沿一个椭圆轨迹移动,此时的出射光就是椭圆偏振光(图2)。这种光学现象就称为手性物质所具有的圆二色性。对于纯手性物质,其椭圆偏振光的椭圆度θ在特定溶剂、浓度、温度和光程下,在特定波长处为定值。同时,在特定波长处的椭圆度θ与在该波长处对左右圆偏振光的摩尔吸光系数之差(Δε)成正比。将θ或Δε对波长作图,即得到圆二色光谱。 图1 右圆偏振光(a)、左圆偏振光(b)及平面偏振光示意图,水平箭头表示光的传播方向。
图2 (a) 平面偏振光的圆组分;(b) 平面偏振光的旋转与圆组分;(c) 椭圆偏振光的旋转与圆组分被吸收的情况。其中,OB与OC分别表示右、左圆偏振光被吸收后的振幅,OD表示OB与OC的矢量和,θ表示椭圆偏振光的椭圆率角,tanθ= OE/OA″≈θ。 圆二色光谱的英文名称为Circular Dichroism,简称CD光谱。其光谱仪的基本测试原理是——通过入射圆偏振光的波长变化,测定手性样品的左圆偏振光和右圆偏振光摩尔消光系数之差Δε。由于CD光谱反映了光和分子间的能量交换,因而只能在有最大能量交换的共振波长范围内测。CD光谱可用于分析一般电子光谱所不能体现出来的能级跃迁的细节,是讨论手性化合物电子跃迁性质的重要表征手段。 当测试条件严格一致时,一对对映异构体的CD光谱呈镜像对称。通常采用光学纯的样品(即仅含单一对映体)进行CD光谱的测定,可由实验值θ根据浓度c、光程长l 求出该纯样的Δε。在严格相同的测试条件下,测定未知样品的CD光谱,可根据实验值求出未知样的Δε’ 。根据上述数据可估算未知样品的对映体过量值(Enantiomeric Excess,简称ee%)。当样品溶解性差、溶剂背景干扰、溶解过程中绝对构型发生变化时,固相CD光谱测试很有必要。通常对纯样进行CD光谱的测试,可在样品绝对构型与CD信号间建立关联。对同物质未知ee%值的样品,可通过CD光谱,简单判断其哪种对映体过量。此外,光谱还可结合其他结构表征手段用于关联确定手性化合物的绝对构型,或检测靶向分子与DNA等生物大分子的相互作用。
圆二色谱应用技术 一、实验目的 1、了解圆二色(CD)光谱的工作原理。 2、学会运用圆二色谱测氨基酸,蛋白质,DNA。 二、实验原理 对R和L两种圆偏振光吸收程度不同的现象。这种吸收程度的不同与波长的关系称圆二色谱,是一种测定分子不对称结构的光谱法。圆二色光谱是一种差光谱,样品在左旋偏振光照射下的吸收光谱与其在右旋吸收光谱照射下的偏振光之差。物质的吸收光谱决定物质的颜色。如果一个物质对左旋偏振光和对右旋偏振光的吸收不同,那么称该物质具有圆二色性(circulardi2chroism,简称CD)。同样,如果一个物质对于不同方向的线偏振光的吸收不同,那么该物质具有线二色性。很多各向异性的晶体具有线二色性;而很多生物大分子和有机分子具有圆二色性在分子生物学领域中主要用于测定蛋白质的立体结构,也可用来测定核酸和多糖的立体结构。 圆二色谱仪由光源、单色器、起偏器、圆偏振发生器、试样室和光电倍增管组成。 三、实验步骤 1.通高纯氮气45min后,开机
2.点亮氙灯:打开主机电源INSTRUMENTPOWER;打开氙灯电源XENONLMAPPOWER;等待LMAPready 灯亮;按红色IGNITELMAP 按钮 3.打开主板电源INSTRUMENTPOWER 4.打开Thermocubechiller(开关在冷却器左边) 5.打开软件,设置参数,选择数据保存设置;选择保存位置;开始实验,保存数据 6关软件TerminateCDSProgram 中关闭 7关氙灯电源XENONLMAPPOWER 8关闭Thermocubechiller 9等待10min 后关闭高纯氮气(可先行下述步骤) 10清洗比色皿、注射泵及其他附件 11光盘刻录数据 12关闭主机电源INSTRUMENTPOWER 四、试验结果和数据处 180200220240260280300-250 -200 -150-100 -50 050D e s c r i p t i o n Wavelength(nm)a 180200220240260280300 -10-5 51015 20 D e s c r i p t i o n Wanelength(nm)b
圆二色谱与结构预测 院系:生命科学学院 年级:2010学生姓名:王劲松 学号:2010212782 任课教师姓名:祁超、付子英完成时间:2013年1月13日
目录 一.摘要 (3) 二.关键字 (3) 三.引言 (3) 四.正文 (3) 1.手性 (3) 2圆二色谱的产生 (4) 3相关的计算 (5) 4圆二色谱的应用 (6) 4.1圆二色谱法区分重组蛋白成分 (6) 4.2.判断酶构象的变化 (6) 4.3.判断产物的生成 (7) 4.4.用于药物开发中药效的检测 (7) 5应用前景展望 (8) 6.致谢 (8) 五.参考文献 (8)
圆二色谱与结构预测 王劲松指导老师:祁超、付子英 (华中师范大学生命科学学院湖北武汉430079) 摘要:目前测定化合物空间结构的方法有很多,常用方法有:1)化学转化法;2)旋光比较法;3)旋光谱(ORD)和CD法;4)单晶X—射线衍射法;5)核磁共振法等。化学转变法是一种消耗性测定方法,样品用量大;旋光比较法准确度较低,重现性不好;单晶X一射线衍射法只能测定晶体化合物的立体结构;核磁共振法则需要用到昂贵的手性试剂。CD法与其他方法相比具有样品用量少、可回收,能测定非结晶性化合物的立体结构,操作简便、迅速等优点,因而在天然药物化学的研究中受到越来越广泛的应用【1】。 关键字:圆二色谱;手性分子;旋光;空间结构 当一束平面偏振光通过光学活性介质传播时,由于介质对二分量的消光系数εl和εr不等,即对左旋光和右旋光的吸收不同,一束平面偏振光通过该样品后,其左旋分量和右旋分量强度不再相同,它们的和就不再是平面偏振光而是椭圆偏振光,这种现象就叫做“圆二色(Circular dichroism)”,据此产生的谱带就是圆二色谱。圆二色谱是一种特殊的吸收光谱,它对手性分子的构象十分敏感,而正常生活状态的生物体所含有的生物大分子差不多都具有光学活性,因而圆二色谱是研究分子三维空间结构和不对称性的有效方法,可方便地对溶液中生物大分子进行研究。下面我们就什么是手型,圆二色谱产生的机理以及具体的计算,圆二色谱在生物研究上的应用和展望做进一步的介绍。 1.手性 手性是物质结构中的重要特征,即具有不能重叠的三维镜像对映异构体,它们的分子式完全相同,但其中原子或原子基团在空间的配置不同,互为镜像。凡手性分子都具有光学活性,即可使偏振光的振动面发生旋转。许多有机物和络合物都具有手性,它们的对映异构体物理化学性质(熔点、沸点、旋光度、溶解度、
圆二色谱法测蛋白二 级结构
精品资料 仅供学习与交流,如有侵权请联系网站删除谢谢2 圆二色谱法分析多肽二级结构 圆二色谱是一种特殊的吸收谱,它通过测量蛋白质等生物大分子的圆二色光谱,从而得到生物大分子的二级结构,简单、快捷,广泛应用在蛋白质折叠,蛋白质构象研究,酶动力学等领域。 圆二色谱紫外区段(190-240nm),主要生色团是肽链,这一波长范围的CD谱包含了生物大分子主链构象的信息。α-螺旋构象的CD谱在222nm、208nm处呈负峰,在190nm附近有一正峰。β-折叠构象的CD谱,在217-218nm处有一负峰,在195-198nm处有一强的正峰。无规则卷曲构象的CD谱在198nm附近有一负峰,在220nm附近有一小而宽的正峰。 蛋白浓度与使用的光径厚度和测量区域有一定关系,对于测量远紫外区德氨基酸残基微环境的蛋白而言,浓度范围在 0.1~1.0mg/ml,则光径可选择在0.1~0.2cm之间,溶液体积则在200~500ul。而测量近紫外区的蛋白质三级结构,所需浓度要至少比远紫外区的浓10倍方能检测到有效信号,且一般光径的选择均在0.2~1.0cm,相应的体积也需增加至1~2mL 缓冲液可选50~100mmol trs-HCl、PBS等,尽量除去EDTA。 远紫外 近紫外 二硫键一般都是不对称的,它在圆二色性光谱上,于195-200nm和250-260处有谱峰 色氨酸、酪氨酸、苯丙氨酸残基的侧链其谱峰在230-310nm之间,色氨酸残基侧链的谱峰一般集中在290- 310nm之间,但有时也会向短波长方向移动从而与酪氨酸残基侧链的谱峰重叠 在250-260nm之间,苯环的谱峰又与二流键的谱峰重叠 溶液度吸收的影响
圆二色谱,判断黄酮类化合物绝对构型的重要手段1.简介:手性化合物的旋光性是化合物分子的立体构型的不对称性对平面偏振光的作用。若对组成平面偏振光的左旋圆偏振光和右旋圆偏振光的吸收系数不同,即ε,这种性质称≠εR,L为手性化合物的圆二色性。当测定的仪器接收透过手性化合物溶液的平面偏振光时,记录的是手性化合物溶液对左旋圆偏振光和右旋圆偏振光的吸收系数之差△ε,或化合物生色团吸收波长附近的摩尔椭圆度[θ]即可获得圆二色谱〔CD〕。 CD即圆二色谱,是以吸收系数之差或摩尔椭圆度[θ]为纵坐标,波长为横坐标记录的谱线,其中△ε=(d-d)/C×1,d和d为吸光度。C为溶液浓度,1为测定用池的RLRL池长;[θ]=ψ(λ)M/100LC其中ψ(λ)为所用测定池情况下的平面偏振光的椭圆度,C为溶液浓度,单位g/ml,1为池长,单位dm,M为分子量。它们之间的关系为[θ]=3300。1C·ε=θ/33 ×△ε,而△2.黄酮类: 多酚类是生物体内主要的二次代谢产物。根据他们的碳骨架能划分为几种主要种类。例如,黄酮类与酚酸类。黄酮类根据的氧化情况又可以分为许多种类。已知的黄酮类化合物中都具有的骨架形式,并常有羟基取代,甲氧基取代,苷化及其他修饰和组合。 虽然黄酮类化合物的绝对构型在50年代起已经通过旋光性和ORD方法进行解析了,但是更方便,更简易的CD谱方法却在60年代中期更为流行。CD谱现已广泛用于具有旋光性的黄酮类化合物的解析,如:二氢黄酮类,二氢黄酮醇类,黄烷-3-醇类,黄烷-4-醇类,黄烷-3,4-二醇类,黄烷类,异黄烷类,二氢异黄酮类,类鱼藤同类,前花色素类和各种类型的双黄酮类。3.二氢黄酮类 二氢黄酮类的两个结构特征在判定它们绝对构型时非常重要。一个是之间的单键,一个是位的手性中心,大多数天然二氢黄酮类化合物中在位具有苯基,其为α取向时,其绝对构型被定为S。 利用CD 或ORD连用NMR光谱数据判定二氢黄酮类化合物绝对构型始于Gaffield。 二氢黄酮类化合物的UV最大吸收在270----290处,320----330处有一弱峰,这是由于苯乙酮型和之间的相互转化产生的。八区律规则已经从判定α,β不饱和酮的手性及它们的长波CE图上扩展到了芳香酮。这样,二氢黄酮类化合物绝对构型为2S时,在构象上就具※吸收带n---π,并在CE谱上表现为正性的C2有杂环的P ----螺旋性和位芳基处于平伏键※---π吸收带。和负性的π※利用n---π吸收带判定构型的优点是这种转变在芳香环取代系统中是独立的。虽然n---※π转变处于长波区趋于随构型相反对映体量的增加而消失。杂环上的H与H之间的较大偶合常数(J)表明所有天然二氢黄酮类在热力学稳定3322,构象中C芳香基处于平伏键(fig2)。这说明所有左旋的二氢黄酮类具有2S构型。2 构型可以清楚的发现。B和二氢黄酮A二氢黄酮OBO---利用这个信息的例子在确定 )(fig.3 and table14.二氢黄酮醇类 二氢黄酮醇类化合物中具有C2和C3两个手性中心,所以存在四种可能的立体异构体,(2R,3R)异构体在天然界中非常普遍,也有其他类异构体的相关报道。 判定二氢黄酮醇类的绝对构型分两步,第一步,通过NMR谱中H与H的偶合常数J232,C2和C3取代基的相对构型是反式或顺式。对于反式异构体,热力学稳定型构象为判定3H与H处于直立
用于推断非对称分子的构型和构象的一种旋光光谱。光学活性物质对组成平面偏振光的左旋和右旋圆偏振光的吸收系数(ε)是不相等的,εL≠εR,即具有圆二色性。如果以不同波长的平面偏振光的波长λ为横坐标,以吸收系数之差Δε=εL-εR为纵坐标作图,得到的图谱即是圆二色光谱,简称CD。如果某手性化合物在紫外可见区域有吸收,就可以得到具有特征的圆二色光谱。由于εL≠εR,透射光不再是平面偏振光,而是椭圆偏振光,摩尔椭圆度[θ]与Δε的关系为:[θ]=3300Δε。圆二色谱也可以摩尔椭圆度为纵坐标,以波长为横坐标作图。由于△ε有正值和负值之分,所以圆二色谱也有呈峰的正性圆二色谱和呈谷的负性圆二色谱。在紫外可见光区域测定圆二色谱与旋光谱,其目的是推断有机化合物的构型和构象 分子对接(molecular docking)使依据配体与受体作用的“锁-钥原理”(lock and key principle),模拟小分子配体与受体生物大分子相互作用。配体与受体相互作用是分子识别的过程,主要包括静电作用、氢键作用、疏水作用、范德华作用等。通过计算,可以预测两者间的结合模式和亲和力,从而进行药物的虚拟筛选[2] 。 分子对接首先产生一个填充受体分子表面的口袋或凹槽的球集,然后生成一系列假定的结合位点。依据受体表面的这些结合点与配体分子的距离匹配原则,将配体分子投映到受体分子表面,来计算其结合的模式和亲和力,并对计算结果进行打分,评判配体与受体的结合程度。 3 分子对接的种类 分子对接的种类主要包括: (1)刚体对接:指在对接过程中,研究体系(受体和配体)的构象不发生变化。适合考察比较大的体系,如蛋白质和蛋白质间以及蛋白质和核酸之间的对接。