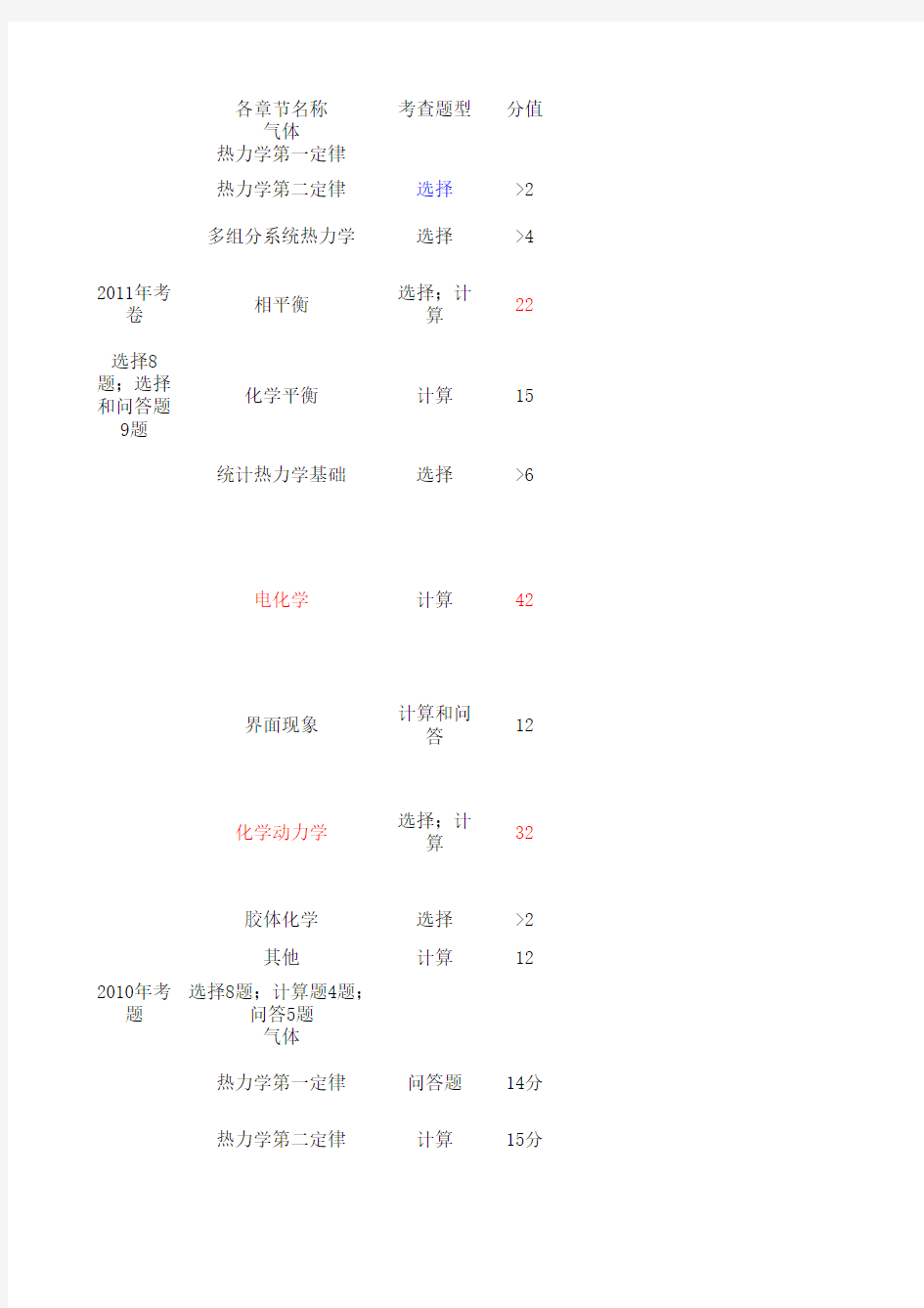

各章节名称考查题型分值气体
热力学第一定律
热力学第二定律选择>2多组分系统热力学选择>4
2011年考
卷相平衡
选择;计
算
22
选择8
题;选择
和问答题
9题
化学平衡计算15
统计热力学基础选择>6
电化学计算42
界面现象计算和问
答
12
化学动力学选择;计
算
32
胶体化学选择>2其他计算12
2010年考
题选择8题;计算题4题;
问答5题
气体
热力学第一定律问答题14分热力学第二定律计算15分
多组分系统热力学
相平衡问答题20分
化学平衡计算15统计热力学基础选择4分
电化学选择;计
算;问答
32分
界面现象选择;回
答;
22分
化学动力学选择;计
算;问
答;
34分
胶体化学选择2;
其他
2009年考研试题选择8题;计算5题;问
答题4题
气体问答题
热力学第一定律计算题;15分
热力学第二定律
多组分系统热力学
相平衡计算题15分
化学平衡计算题15分统计热力学基础选择;2;
电化学选择;计
算;
34分
界面现象选择2;
化学动力学选择;计
算题
31分
胶体化学
其他选择;问
答题
17分
2008年考研试题题量:选择8题;计算题
5题;问答题5分
气体
热力学第一定律问答题8分
热力学第二定律选择
2分;2
分;
多组分系统热力学选择2分相平衡问答题15分
化学平衡
统计热力学基础
电化学
选择;计
算;
29分界面现象
选择;问
答题;
10分
化学动力学选择;计
算;
56分;
胶体化学选择2分
其他选择;计
算;
17分
2007年考
题题量:选择8题;简答5
题;计算5题;
气体
热力学第一定律
热力学第二定律简答题7分多组分系统热力学
相平衡计算题15分
化学平衡计算题15分统计热力学基础选择;2分;
电化学
选择;简
答题;
17分界面现象选择;2分;
化学动力学
选择;简
答题;
49分
胶体化学
其他选择;2分;
2006年考研真题题量:选择10题;简答5
题;计算5题;
气体
热力学第一定律简答题6分
热力学第二定律
多组分系统热力学简答题6分相平衡问答题15分
化学平衡计算题15分统计热力学基础选择;
2分;2
分;
电化学
简答题;
计算;
6分;15
分;
界面现象选择;
2分;2
分;
化学动力学选择
2分;15
分;20
分;
胶体化学选择;2分;
其他选择;2分;
2005年考研真题题量:8个选择,5道填
空,5道计算题,2道问
答题
气体
热力学第一定律填空2分;
热力学第二定律
填空;计
算
2分;10
分;多组分系统热力学选择;
2分;20
分;
相平衡
选择;填
空;问
答;
2分;2
分;14
分;
化学平衡填空2分统计热力学基础选择;2分
电化学选择;2分;26分;14分;
界面现象选择;2分;2分;10分;
化学动力学选择;2分;
胶体化学选择;2分;
其他
2004年考
题
题量:9
气体
热力学第一定律
热力学第二定律
多组分系统热力学
相平衡
化学平衡
统计热力学基础
电化学
界面现象
化学动力学
胶体化学
2003年考
9题
研真题
气体
热力学第一定律
热力学第二定律
多组分系统热力学
相平衡
化学平衡
统计热力学基础
电化学
界面现象
化学动力学
胶体化学
2002年真
题量8
题
气体
热力学第一定律
热力学第二定律
多组分系统热力学
相平衡
化学平衡
统计热力学基础
电化学
界面现象
化学动力学
胶体化学2001考研
题量:8;
真题
气体
热力学第一定律
热力学第二定律
多组分系统热力学
相平衡
化学平衡
统计热力学基础
电化学
界面现象
化学动力学
胶体化学
理想气体PVT过程焓变的计算;标准摩尔生成吉布斯自由能 标准摩尔生成焓变(计算题)稀溶液的依数性(凝固点下降);活度,真实液态
化合物的性质
二组分真实液态混合物的气液平衡;等压相图中各相区的相态、自由度,绘制步冷曲线,指出步冷曲线上各段的自由度。
水合物能否和水溶液及冰共存需满足的条件压力平衡常数;基于浓度的标准平衡常数;温度、压力对化学反应平衡的影响,如何调整温度、压力使反应达到预定的平衡状态。反应平衡常数(柔和在电化学中考查的,计算题中的一小问)定域粒子体系和离域粒子体系的热力学函数与分子配分函数;平动熵和转动熵(比较相同温度和压力时CO和N2); 配分函数
分配系数,标准电极电势,电动势与温度的关系;求电解质浓度与电极电势之间的关系,及与平衡常数的关系;主要考察原电池;金属在阴极析出的顺序,及析出金属时对应的电压,第二种金属析出时,第一种的浓度;存在超电势时会发生什么化学反应。电解质溶液的性质、浓度与溶液电阻的关系,由离子摩尔电导率求相关非电解质水溶液的解离常数的求法。
人工降雨的原理,微小液滴的饱和蒸汽压,解释为什么会存在湿度大而不下雨的状况。液固界面,表面活性物质。界面张力。
单分子反应lindeman理论;速率方程的确定(微分形式);表观活化能,活化能与反应速率间的关系;表观活化能、标准摩尔反应焓及反应速率平衡常数三者之间可能存在何种关系;多相催化反应,催化反应的速率方程式;a A,速率常数,反应速率与温度、压强的关系。
MgSO4和Na2SO4聚沉能力比较
根据一些键能及标准摩尔反应焓计算某物质的
共振能。
范德华方程
绝热可逆膨胀过程、节流膨胀过程,对系统温度的影响;两者的P-T图的区别及在冷冻机的制冷
过程中是如何应用的。
相变焓;等效过程设计;相变过程中的热力学函变;吉布斯判据;亥姆霍兹判据;
各区的相态、自由度;绘制步冷曲线,并指出步冷曲线上各段的自由度;相图的应用
转化率;反应物产物浓度与热力学函数间(H、G)的关系式;温度、压强及惰性气体对反应平
衡的影响;
振动、转动、平动能级间隔大小比较;非理想气体的性质,全同粒子体系、相依粒子体系,独立可别粒子体系、定域可别粒子体系;
电极电势与电解质浓度间的关系;摩尔电导率的计算;摩尔电导率、电解质溶液浓度、溶液电阻三者间的关系;原电池和电解池的电极极化曲线),电阻超电势,电极极化的主要形式;如何降低极化引起的超电势;
相同温度下,水和冰表面张力的比较;弯曲液面的附加压力;界面张力;毛细管内的水向毛细管
的那一段移动。。
反应速率方程,中间产物浓度最大的时刻;提前因子与热力学函数间的关系;反应级数;速率常数与温度的关系;活化能值的求法;达到预定反应状态所需时间;半衰期、阿氏活化能与反应速率常数的关系;稳态法推导反应速率表达式;确定反应速率方程所需满足的条件;
对临界胶束浓度概念的理解;
分离提纯时,如何防止或减少物质的聚合作用;如何根据温度、压力和化学方程式来估算反应是
否可能发生;
范德华方程
由生成焓求反应热;热量计算的综合知识运用;若已知臭氧催化分解主要是在冰晶或固体水合物表面进行,试根据有关热力学原理说明为什么南极上的臭氧层空洞较其他地方多。。节流膨胀过程中的转换温度;当温度与转换温度满足不同关系时,对节流膨胀过程温差正负的影响。。标准摩尔反应吉布斯自由能变与温度的关系图,及与反应方程式存在的对应关系;标准摩尔反应吉布斯自由能的计算;标准摩尔生成焓变、熵变
的求法;
绘制合金相图,绘制步冷曲线,指出各段的相变情况,计算在其中某一段时液相固相的物质的量
之比;
连串反应达平衡时,中间物质的浓度比;反应平衡常数与焓变、熵变的关系;
配分函数概念的理解认识;
电池反应达平衡时电池的电动势;F;电池可逆放电产生的热效应;摩尔电导率,电阻,解离常数,解离度,电解质的浓度;保证金属沉淀和某阳离子氧化所需施加的最小电解电势;电极反应式的书写;阴阳极电极材料对电极反应的影响;朗缪尔吸附等温式(基于的假设);气相中有相
邻气泡将发生的变化;
Z M,双分子反应速率常数;催化剂(绝缘体催化剂、酶催化剂、金属催化剂、广义酸碱催化剂)上的活性中心;反应速率常数的应用;已知反应速率常数时,求中间物质浓度达最大时的时间,及此时中间物质的最大浓度;
三维平动子的平动能能级的简并度;永动机工作的原理和其不可能造成的原因。
相变焓、相变过程中的熵变;两者能否应用于过
程方向的判断
恒温条件下,可逆过程中系统对环境做最大功;最大功与吸收热的关系;体系经过一个不可逆过程对体系、环境熵的影响;
理想液体混合物;物质的量分数、质量分数与饱和蒸汽压的关系;拉乌尔定律;蒸气是理想气体与否,对溶剂标准吉布斯自由能变的影响;系统组分数;T、p时,系统中各相平衡共存;系统组分数、相数、自由度数的求法;三相线上的相平衡关系式;液态混合物冷却时能得到多少某
种纯组分;
电动势不能用伏特计测量而要用对消法的原因;离子活度积与原电池电势间的关系;在电解池中阴阳极析出或溶解的顺序,并需考虑超电势对它们可能产生的影响;正负离子迁移数的求法;根据离子浓度改变,求从系统析出的物质的组成;弯曲液面的附加压力;状态改变时,毛细管中水的行为变化;若毛细管的内壁涂一层石蜡,对液面会产生什么影响。若毛细管中间有一扩大部分,会对液面产生什么影响;
半衰期,反应进行到某一条件所需时间;根据反应机理和反应速率常数写出总的反应速率方程;确定反应级数所要求的反应速率常数间要满足的关系;表观速率常数与某物质浓度的关系确定;阿伦尼乌斯方程,及压强会对方程产生的影响。计算某一时刻不能核素间的物质的量比;衰变过
程放出的热量;
胶体结构式
残余熵;电离平衡;溶解平衡;气液界面;蒸发热;活化能;相对扩散速率;
TdS=CvdT+T[δp/δT]dV;试问两物质应以什么比例,能获得最大混合熵;标准摩尔生成吉布斯自由能的求法;标准摩尔反应焓变的求法;
各相区稳定时存在的相;绘三相线;三相线上的相平衡及相平衡间的关系;绘步冷曲线,注明各阶段的相变化和自由度;
压力对化学反应平衡的影响;压力反应平衡常
数;
摩尔平动熵最大的气体;
原电池的标准电动势与电极电势的关系;如何设计原电池,来通过测定电动势,求难溶盐的活度积;用极限摩尔电导率讨论电解质溶液电导能力的原因;电极电势与溶液离子浓度关系,及与溶
液PH间的关系;
气体在固体表面发生等温吸附过程,熵如何变化;在毛细管内装入润湿性液体,在毛细管一端加热,则管内液体将如何变化;若已知溶液表面张力与活度的关系,则溶液中溶质的表面过剩可能会与活度存在怎样的关系;利用毛细现象设计
永动机的可行性;
摩尔键焓、活化能;对连串反应,稳态渐进法成立的条件,在此条件下的各物质浓度-时间曲线;压力平衡常数的求法;德拜休克尔公式,与盐效应公式的联系;半衰期的应用;反应级数的确定;精确计算反应级数应如何设计实验;已知解离常数和反应级数,确定反应至某一阶段的时间;反应历程的理解;反应速率的求解;用热力学有关公式说明气体制冷的原理;用温-熵图定性表示绝热去磁制冷原理;
已知能级差,又知基态是二重简并,则第一激发态与基态上的原子数之比;
三种获得 低温的方法,比较优缺点;
水在真空容器中汽化的热力学函变;热力学函变
在生物化学中的应用;
用调节化学势的方法定性描述稀溶液的三种依数
性,可借助图形;
绘制二元相图;指出各平衡区的相态;绘制步冷曲线,并指出各段路径的相变化;
化学反应的摩尔焓变、摩尔熵变与化学反应方程式、平衡状态的关系;压力反应平衡常数的计算
方法;
离域子系统;最低平动能级和相邻能级的间隔;
N2和CO的摩尔熵比较;
电导、电导率、摩尔电导率三者之间有何联系,各自的单位;电极反应书写;超电势、分解电压;超电势对电极反应的影响;
朗缪尔吸附等温式;弯曲液面的附加压力;三种常见的亚稳态,“气泡室”的亚稳态原理;单原子分子间发生化学反应的机理;活化能、临界能、势垒间存在的关系;反应级数、活化能、速率常数与反应活化熵存在的关系;半衰期的应用考查;反应速率方程的推导及深刻理解;对反应过程具备基本的合理性判断;
胶团结构式;天空呈蔚蓝色和鲜红色的原因;受激物的磷光光谱产生的原因;对公式的掌握理解,总结形式相同的公式;
对确定过程的热力学函数变判断;热力学函数之间的计算;卡诺热机的应用-燃烧热转化为有用
功的计算;
对反应方向的判断;确定过程的热力学函数变计
算;
活度系数;蒸汽压下降;溶剂活度系数与稀溶液依数性间的关系;亨利常数的求法,已知PH;独立组分数的计算;自由度的判断;相图的应用,对某确定状态下,各组分间的物质的量之比;相图的应用,如利用相图提纯物质;
平衡温度;分解温度;稳定性判断;
基本振动频率;振动特征温度;
离子的摩尔电导率;阴阳离子迁移数;电极反应式、电池反应式的书写;电化学与热力学相联系的部分-燃料电池;电池的标准电动势的求解方法;分解电压;电解液电阻、电流密度、超电势与外加电压间存在的关系;
溶液表面张力与活度的关系;溶质的表面过剩与活度的关系;活化能;温度对链式化学反应的影响;表面张力,微小液滴的饱和蒸汽压公式、计
算方法;
反应的量子产率计算;光化学反应;平行反应反应速率的求法;化学反应速率方程中系数的求解;反应速率方程对反应机理的反应;催化剂表面上的吸附;设计确定反应速率方程的实验步骤;旋光度对反应速率方程的影响;在给定条件下反应级数的求解;半衰期与活化能的关系;
Michaelis机理,稳态渐进法;
胶粒带电性判断;
对公式、符号的考查;
压缩因子在等温下随压力的变化;超临界气体应
用的要求;
气体节流膨胀过程中的致冷致热效应判断;如何利用相图求解相变过程中的热力学函变;
热力学函数之间的运算,应熟悉它们之间的关系式,并掌握它们的应用条件;物质在特定热力学状态下的稳定性判断及能够平衡共存的温度;相图的应用,蒸馏法提纯;各相区相态;绘制步冷曲线,标出各段的相数、自由度;在某一确定温度下,固、液、气相的物质的量之比及某一相中各物质的物质的量浓度之比;
转化率;反应物产物浓度与热力学函数间(H、G)的关系式;温度、压强及惰性气体对反应平
衡的影响;
摩尔电导率与浓度的关系曲线上能反应的信息;淌度;电迁移率很小的情况下是如何满足电流传导任务的;电极反应与电池反应的书写;电动势与电解质溶液中离子迁移速度的关系;
张力与摩尔蒸发焓的关系;微小液体的摩尔蒸发
焓
设计实验步骤确定速率方程中的反应级数;提前因子、双分子基元反应、提前因子、过渡态的性
状(线性、非线性);
可逆过程、恒压过程、恒温过程中的热力学函
变;
热力学函数之间的运算,应熟悉它们之间的关系式,并掌握它们的应用条件;物质在特定热力学状态下的稳定性判断及能够平衡共存的温度;相
变过程;
温度、溶解度与活度系数的关系;
各相区稳定时存在的相;绘三相线;三相线上的相平衡及相平衡间的关系;绘步冷曲线,注明各阶段的相变化和自由度;相态数与自由度的判
断;
总配分函数表达式;某一激发态上的最概然分布的分子数占总分子数的百分数;
电极反应和电池反应的书写;电池反应中的热力学函变;溶度积常数与电动势的关系;
确定反应速率方程中反应系数;Michaelis常数及获得最大反应速率需满足的条件;催化动力学,强吸附;反应速率与吸附平衡常数、浓度的
关系;
相变过程的热力学函变;
判断过程方向可以用哪些热力学函数,判据式的
依据;恒温过程;
活度;化学势;溶液蒸汽压;溶液中和纯溶剂中
的吉布斯自由能变;
相绘制步冷曲线;相图中各相区相态,指定曲线上的相态、自由度;在某一指定相态下的各组分
的物质的量浓度比;
极限摩尔电导率;电解质溶液中的极限迁移率;极限淌度;如何根据化学反应方程式设计原电池;分解温度(常常考查物质平衡临界点处的温
度);
确定反应级数;压力反应速率常数和基于浓度的反应速率常数;稳态渐进法推导速率方程;确定速率方程在哪些条件下可认为是一级反应,一级反应的表观速率常数;半衰期;过渡态构型的形状(线性或非线性);空间因子;简单碰撞理论;指前因子;配分函数;
摩尔单原子理想气体状态变化过程中的热力学函
变计算;
热力学函数之间的运算,应熟悉它们之间的关系式,并掌握它们的应用条件;物质在特定热力学状态下的稳定性判断及能够平衡共存的温度;各相区的相态;绘制步冷曲线,并指明各线段的
自由度数值;
电池电动势的计算;电池可逆操作的热效应;电池的温度系数;难溶物质的分解压力;电解沉积法;活度系数;超电势;阳极或阴极上的离子反应顺序,某一种金属析出时其它离子的残留浓度;残留浓度;电化学反应顺序判断;
半衰期;化学反应速率与反应时间计算;压强对速率方程的贡献;反应速率方程;时间变化率;压强反应速率常数;反应活化能;从反应机理求证一级反应;判断反应机理是否正确;