
第30卷第11期中国电机工程学报V ol.30 No.11 Apr.15, 2010
56 2010年4月15日Proceedings of the CSEE ?2010 Chin.Soc.for Elec.Eng.
文章编号:0258-8013 (2010) 11-0056-06 中图分类号:TK 227 文献标志码:A 学科分类号:470?10 CO对碱金属凝结特性影响的试验研究
邱朋华,王文杰,焦广亮,吴少华,秦裕琨
(哈尔滨工业大学能源科学与工程学院,黑龙江省哈尔滨市 150001)
Experimental Research on the Effect of CO on Alkali Metals’ Condensation Characteristics QIU Peng-hua, WANG Wen-jie, JIAO Guang-liang, WU Shao-hua, QIN Yu-kun (School of Energy Science and Engineering, Harbin Institute of Technology, Harbin 150001, Heilongjiang Province, China)
ABSTRACT: Integrated gasification combined cycle (IGCC) is one of the trends of clean coal power generation technology. However, that alkali metal vapors contained in the syngas which are generated from coal gasifier easily deposit on the surfaces of convectional syngas cooler (CSC) will not only lead to slagging, but also will cause high-temperature corrosion of gas turbine blades. An experimental facility was built to study the condensation characteristics of high temperature alkali metals contained in the syngas of the IGCC, and the effects of syngas and alkali metal components on the concretion process were obtained. The results show that the concreted temperature of alkali metal is between 620~720℃ in the reductive atmosphere; the steam in the syngas has no effect on this concreted temperature; the higher the concentration of CO in the syngas, the lower the concreted temperature; if the concentration of CO keeps invariable, and the ratio of [Na+]/[K+] is lower, the concreted temperature is lower when both Cl? and SO42? exists than the case only Cl? exists.
KEY WORDS: integrated gasification combined cycle (IGCC); coal gasification; alkali metal; condensation characteristics; syngas
摘要:整体煤气化联合循环(integrated gasification combined cycle,IGCC)发电技术是洁净煤发电新技术的发展方向之一,但煤气化释放出的碱金属蒸气易在对流废锅中形成污垢,而且会引起燃气轮机叶片的高温腐蚀。该文建立了IGCC 系统高温合成气中碱金属凝结特性研究试验台,进行IGCC 合成气的碱金属凝结特性试验,研究合成气成分、碱金属盐种类对碱金属蒸气凝结特性的影响,得出以下结论:在还原性气氛下碱金属蒸气的凝结温度在620~720℃之间;水蒸
基金项目:国家高技术研究发展计划项目(863计划)(2007AA- 05Z246)。
The National High Technology Research and Development Program of China (863 Program)(2007AA05Z246).气对碱金属蒸气的凝结温度影响不大;随着CO浓度的增加,碱金属蒸气的凝结温度降低;相同的CO浓度下,当Na+、K+的浓度比较小,碱金属盐为氯盐和硫酸盐时的凝结温度要比碱金属盐仅为氯盐时低。
关键词:整体煤气化联合循环;煤气化;碱金属;凝结特性;合成气
0 引言
整体煤气化联合循环发电(integrated gasific- ation combined cycle,IGCC)系统是将高效的联合循环总能系统和洁净的燃煤技术结合起来的先进的发电系统,它具有高效、清洁、节水及综合利用等诸多优点,被认为是21世纪最有发展前景的洁净煤发电方式,已引起全世界能源界的重视[1-3]。在IGCC 系统中,煤中的碱金属在气化过程中会部分释放,并以碱金属蒸气和附着在煤灰颗粒中的形式存在于高温合成气中,这些碱金属会加速换热面污垢的形成,大大降低设备的利用率,同时引起燃气轮机叶片的高温腐蚀,极大地影响其安全运行[4-5]。因此,燃气轮机生产商规定气体中碱金属蒸气的浓度≤0.024ppm(μL/L)[6];但燃烧或气化过程产生的高温合成气中碱金属蒸气的浓度往往比许可值高出几个数量级[7],此外,高温煤气中碱金属蒸气对设备高速碰撞和与材料的化学反应等也会造成严重危害,是造成IGCC废热锅炉积灰的主要原因[8]。国内外对含碱金属蒸气的研究大多集中在碱金属蒸气的脱除方面,而对碱金属蒸气凝结特性方面的研究较少。
本文主要通过试验手段研究Na、K等碱金属蒸气在还原性气氛下不同气体比例以及不同碱金属成分时的凝结特性,主要包括凝结温度、凝结物表面形貌及成分等,为IGCC系统中废热锅炉的设计及IGCC系统的设计和运行优化提供参考。
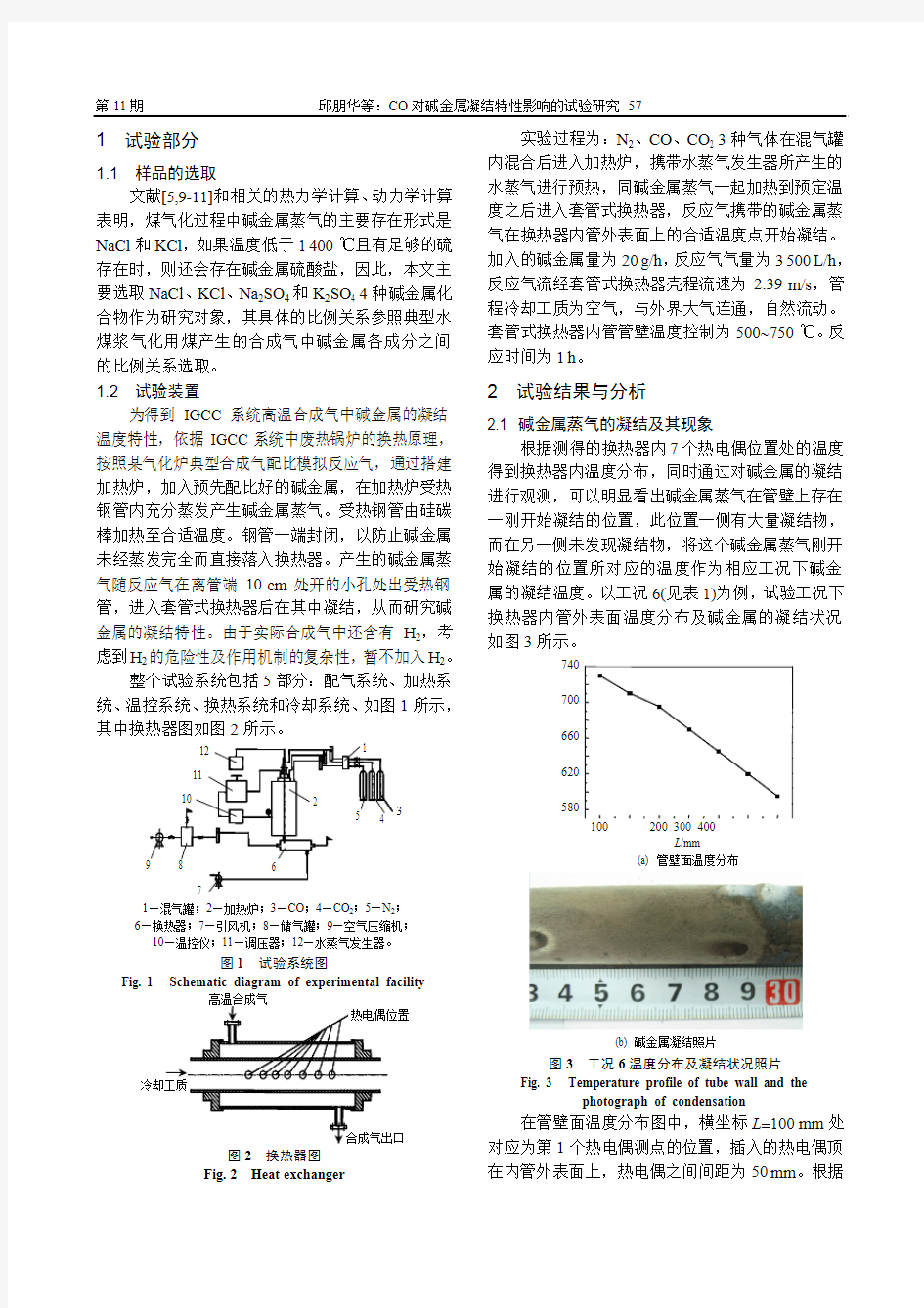
第11期邱朋华等:CO对碱金属凝结特性影响的试验研究 57
1 试验部分
1.1 样品的选取
文献[5,9-11]和相关的热力学计算、动力学计算表明,煤气化过程中碱金属蒸气的主要存在形式是NaCl和KCl,如果温度低于1400℃且有足够的硫存在时,则还会存在碱金属硫酸盐,因此,本文主要选取NaCl、KCl、Na2SO4和K2SO4 4种碱金属化合物作为研究对象,其具体的比例关系参照典型水煤浆气化用煤产生的合成气中碱金属各成分之间的比例关系选取。
1.2 试验装置
为得到IGCC系统高温合成气中碱金属的凝结温度特性,依据IGCC系统中废热锅炉的换热原理,按照某气化炉典型合成气配比模拟反应气,通过搭建加热炉,加入预先配比好的碱金属,在加热炉受热钢管内充分蒸发产生碱金属蒸气。受热钢管由硅碳棒加热至合适温度。钢管一端封闭,以防止碱金属未经蒸发完全而直接落入换热器。产生的碱金属蒸气随反应气在离管端10cm处开的小孔处出受热钢管,进入套管式换热器后在其中凝结,从而研究碱金属的凝结特性。由于实际合成气中还含有H2,考虑到H2的危险性及作用机制的复杂性,暂不加入H2。
整个试验系统包括5部分:配气系统、加热系统、温控系统、换热系统和冷却系统、如图1所示,其中换热器图如图2所示。
3
1—混气罐;2—加热炉;3—CO;4—CO2;5—N2;
6—换热器;7—引风机;8—储气罐;9—空气压缩机;
10—温控仪;11—调压器;12—水蒸气发生器。
图1 试验系统图
Fig. 1 Schematic diagram of experimental facility
图2换热器图
Fig. 2 Heat exchanger
实验过程为:N2、CO、CO2 3种气体在混气罐内混合后进入加热炉,携带水蒸气发生器所产生的水蒸气进行预热,同碱金属蒸气一起加热到预定温度之后进入套管式换热器,反应气携带的碱金属蒸气在换热器内管外表面上的合适温度点开始凝结。加入的碱金属量为20g/h,反应气气量为3500L/h,反应气流经套管式换热器壳程流速为2.39m/s,管程冷却工质为空气,与外界大气连通,自然流动。套管式换热器内管管壁温度控制为500~750℃。反应时间为1h。
2 试验结果与分析
2.1 碱金属蒸气的凝结及其现象
根据测得的换热器内7个热电偶位置处的温度得到换热器内温度分布,同时通过对碱金属的凝结进行观测,可以明显看出碱金属蒸气在管壁上存在一刚开始凝结的位置,此位置一侧有大量凝结物,而在另一侧未发现凝结物,将这个碱金属蒸气刚开始凝结的位置所对应的温度作为相应工况下碱金属的凝结温度。以工况6(见表1)为例,试验工况下换热器内管外表面温度分布及碱金属的凝结状况如图3所示。
740
700
660
620
580
L/mm
(a) 管壁面温度分布
温
度/
℃
(b) 碱金属凝结照片
图3工况6温度分布及凝结状况照片
Fig. 3 Temperature profile of tube wall and the
photograph of condensation
在管壁面温度分布图中,横坐标L=100mm处对应为第1个热电偶测点的位置,插入的热电偶顶在内管外表面上,热电偶之间间距为50mm。根据
58 中 国 电 机 工 程 学 报 第30卷
碱金属蒸气的凝结位置与换热器内管外表面的温度分布对应关系,即可得到碱金属蒸气的凝结温度。碱金属蒸气的凝结位置如图3(b)所示。各工况下碱金属蒸气凝结温度如表1所示。
表1 试验工况及凝结温度表
Tab. 1 Test conditions and Condensation temperature list
各成分占碱金属物质的量比
工况
空气体积 浓度/%
?(CO)/%?(CO 2)/% ?(N 2)/% ω(H 2O)/(g/h)
NaCl KCl Na 2SO 4
K 2SO 4
凝结 温度t /℃
1 100 0 0 0 0 0.7
2 0.28 0.00 0.00 700 2 100 0 0 0 0 0.57 0.22 0.12 0.09 680
3 0 43.80 22.63 33.57 0 1.00 0.00 0.00 0.00 720
4 0 43.80 22.63 33.57 0 0.72 0.28 0.00 0.00 680
5 0 43.80 22.63 33.57 0 0.67 0.2
6 0.0
7 0.00 640 6 0 43.80 22.63 33.57 0 0.57 0.22 0.12 0.09 655 7 0 50.00 20.13 29.87 0 0.72 0.2
8 0.00 0.00 670 8 0 50.00 20.13 29.87 0 0.57 0.22 0.12 0.0
9 640 9
55.56 17.89 26.55 0
0.57 0.22 0.12 0.09 620
10 0 50.00 20.13 29.87 578.1 0.57 0.22 0.12 0.09 640
2.2 CO 浓度与碱金属蒸气凝结温度的关系
在碱金属成分及各成分物质的量比保持不变时,在空气气氛下,以及在还原性气氛下(保持CO 2和N 2的体积之比不变),CO 浓度由43.80%升高到55.56%的过程中,可以看到碱金属蒸气凝结温度由680 ℃单调下降到620 ℃左右,如图4所示。
t /℃
?(CO)/%
图4 CO 浓度与碱金属蒸气凝结温度的关系
Fig. 4 Relationship between concentration of CO and condensation temperature of alkali metal vapors
从工况8和工况10的凝结温度及其凝结状态可以看出,碱金属蒸气凝结温度都为640 ℃,水蒸气对碱金属凝结温度影响不大;如图5所示,从碱
不加入水蒸气
加入水蒸气
t /℃
图5 水蒸气与碱金属蒸气凝结温度的关系 Fig. 5 Relationship between water vapor and condensation temperature of alkali metal vapors
金属凝结物的形态和组成可以看出,在水蒸气存在与否的情况下,通过扫描电镱(scanning electron microscope ,SEM)和X–射线衍射(X-ray diffracto- meter, XRD)检测分析,没有明显区别。 2.3 碱金属成分与碱金属凝结温度的关系
分别考察了[Na +]/[K +],碱金属盐的种类对碱金属蒸气凝结温度的影响。如图6所示,可以看出在CO 浓度相同的情况下,当[Na +]/[K +]较大,同时碱金属盐仅为氯盐时的凝结温度要比碱金属盐为氯盐和硫酸盐时的高。
?(CO)/%
t /℃
680620
700660640碱金属盐仅为氯盐,[Na +]/[K +]=2.547:1
碱金属盐为氯盐和硫酸盐,[Na +]/[K +]=2.026:1
图6 Na +
、K +
比和碱金属盐种类 对碱金属蒸气凝结温度的影响
Fig. 6 Influence of condensation temperature of alkali metal vapors on the species of alkali metal and
the ratio of Na + and K +
2.4 SEM 检测结果
采用SEM 对碱金属蒸气凝结物表面形貌进行研究,取刚开始凝结处凝结物,发现在空气组分下,加入的碱金属盐成分为NaCl 和KCl 时,凝结物表面有明显的规则晶体形貌,如图7(a)所示。
在还原性气氛下,所有样品均无明显的晶体形貌,从图7(b)可以看出,即使加入的碱金属盐成分仅为NaCl 时,也不能看出有规则的晶体形貌。通
第11期 邱朋华等:CO 对碱金属凝结特性影响的试验研究 59
过对图7(a)~(d)比较可以发现,在还原性气氛下,当加入碱金属化合物为氯盐时或者为氯盐和硫酸盐混合物时,即使放大到2 000倍,也很难看出是否存在晶体,但对样品的XRD 测量,发现其存在碱金属化合物,部分工况存在铁的氧化物。
(a) 工况1(500倍) (b) 工况3(2 000倍
)
(c) 工况5(2 000倍) (d) 工况7(2 000倍)
图7 部分工况的SEM 照片
Fig. 7 SEM images of some cases
2.5 XRD 检测结果
通过对凝结物做XRD 分析可知,当加入的碱金属盐仅为碱金属氯盐时,凝结的碱金属化合物有碱金属氯化物,还含有部分铁的氧化物。选取工况4检测结果,如图8(a)所示,此条件下各相应工况
2θ/(°)
(a) 加入的碱金属为NaCl ,KCl
衍射强度/(次/s )
工况4
400 100 500 300 200
20 40 60 80
3
1
3
3
2 1
2
3
3 3
1
3 3 3 2 1
1—NaCl 衍射峰
2—KCI 衍射峰
3—Fe 2O 3衍射峰
2θ/(°)
(b) 加入的碱金属为NaCl ,KCl ,Na 2SO 4,K 2SO 4
衍射强度/(次/s )
工况6
1 500 500
2 000 1 000 0
20 40 60 80
2
1
1 2 1 2
1 1
2
2 2
1
1—NaCl 衍射峰
2—KCI 衍射峰
图8 凝结物XRD 谱图
Fig. 8 XRD Pattem of coagulation
对应检测结果与工况 4 差别不大。在还原性条件下,当加入的碱金属盐为碱金属氯盐和碱金属硫酸盐时,凝结物中只检测出了碱金属氯化物,选取工况6检测结果,如图8(b)所示,此条件下各相应工况对应检测结果与工况6 差别不大。
3 碱金属凝结机制分析
3.1 理论分析
在本次试验中,通过各个工况的对比研究,结合熔体的凝固原理[12-13],可以认为影响碱金属蒸气凝结的主要因素为凝结气氛和碱金属成分。
由晶体理论可知,晶体分子是规则排列的,晶体在开始熔化之前,通过吸热获得的能量主要转变成分子动能。当到达一定温度即熔点后,吸热获得的能量主要用来克服分子间的引力做功,增大分子间距,使分子离开原来的平衡位置,这样分子有规律的排列被破坏,即形成了熔化这一现象。
由于多组分的存在,包括加入的多组分碱金属,同时由于是在不锈钢管表面凝结,因此不可避免的会有部分铁的化合物参与凝结过程,并且凝结过程是在一定气氛下进行的,这些多组分的存在往往会使分子间的作用力比融合前要小,促进晶格更快地定向,分子间作用力变小,则分子势能变小,因此会使混合物的凝固温度降低[12-14]。
通过文献[15]可知,本文所用的碱金属化合物凝固温度都在768 ℃以上,但混合后在本次试验工况下,可以发现其混合物凝结温度在620~720 ℃之间。 3.2 CO 浓度与碱金属蒸气凝结温度的关系
随着CO 浓度的增加,还原性气氛增强,一方面由于存在多种组分,由前面分析可以看出,这些多组分的存在会使混合物的凝结温度下降;另一方面,在还原性气氛下,并同时存在CO 2时,会使碱金属硫酸盐分解生成含硫化合物[16],这些含硫化合物在碱金属硫酸盐、铁和铁的化合物共同作用下会生成复杂的低熔点化合物,如可能生成复杂的复合式硫酸盐和焦硫酸盐,其中焦硫酸盐还会进一步生成复合式硫酸盐,生成的复合式硫酸盐的熔点较低,为600 ℃左右[17],而焦硫酸盐的熔点更低,为400 ℃左右[18]。随着还原性气氛的进一步增强,发生的反应会更完全,从而进一步生成低熔点化合物,这样会使混合物凝结温度进一步降低。笔者推测,由于生成化合物的复杂性,很可能其以非晶体的形式存在,因此通过XRD 很难检测出其具体的存在形式,需要借助其他仪器做进一步分析。
60 中国电机工程学报第30卷
此外,在还原性气氛下,熔体的表面张力较氧化性气氛下大,由于表面张力的增大,熔体表面趋于收缩,这样便不断促使新的液体到达表面而起到混合搅拌的作用。随着还原性气氛的增强,这种搅拌作用愈加明显,有利于促进反应的进行,从而有利于低熔点物质的生成和增加熔体的无序度,对降低熔体的凝结温度有一定的促进作用。
3.3 碱金属成分与碱金属凝结温度的关系
碱金属氯盐在未经变成硫酸盐时不会与管壁发生腐蚀反应[17],随着硫酸盐的加入,由上面分析可以看出,会发生复杂的反应,这些反应的结果,会使混合物的凝结温度降低。
与此同时,由碱金属的配比可以看出碱金属氯盐的含量大于碱金属硫酸盐,并结合XRD的检测结果可知,碱金属氯盐对凝结温度的影响占据主导地位,同时由于NaCl晶体的晶格能较KCl晶体大[16],其离子键更牢固,故其晶体也愈稳定,NaCl 晶体熔化所需要的温度水平更高,因此,随着[Na+]/ [K+]的降低,其混合物熔化所需要的温度水平会降低,故其混合物的凝结温度会降低。
3.4 SEM检测结果
在空气气氛下,碱金属氯盐(NaCl、KCl)在加热炉中蒸发,随气流进入到换热器中,然后再凝结在换热器管壁面上。由于在这个过程中,凝结过程受外界影响不大,碱金属化合物本身组分并未发生变化,因此仍能保持原物相凝结下来,故凝结下来的仍为NaCl、KCl晶体,通过SEM检测可以清晰地看到规则的晶体形貌,通过XRD检测可以发现其中含有NaCl和KCl。
在还原性气氛中,当加入的碱金属盐为NaCl 和KCl时,搅拌作用能促使碱金属盐和一些含铁物质在高温时熔融在一起,这种熔融物在合适的温度便以一种高度混合的状态凝结下来,通过SEM观察可以看到凝结物表面并无规则晶体形貌存在,但通过XRD分析可知其中存在NaCl、KCl以及部分铁的氧化物。
在还原性气氛中,当加入的碱金属盐同时包括氯盐和硫酸盐时,除了上述机制外,由于加入了硫酸盐(Na2SO4和K2SO4),在高温时由于各种组分的共同作用,同时还由于存在CO2,通过前面分析可知会发生复杂的反应,各物质不断熔融并发生化学反应,生成多种复杂化合物,在合适温度时,各物质同样会以一种高度混合的状态呈现。通过SEM 观察可以看到凝结物表面并无规则形貌存在,但通过XRD分析可知其中存在NaCl、KCl。
3.5 XRD检测结果
由上述分析结果可以知道,当仅加入碱金属氯盐时,未发生化学反应,因此凝结在其中的碱金属氯盐仍能通过XRD检测出来。同时由于碱金属蒸气是在金属换热管表面凝结的,凝结物中必然存在部分铁的氧化物,因此当加入为碱金属氯盐时,XRD可以检测出NaCl、KCl和部分铁的氧化物。
在还原性气氛下,当加入碱金属氯盐和碱金属硫酸盐的混合物时,由上述分析可知,会发生复杂的反应,生成多种复杂化合物,在此反应中认为绝大部分碱金属硫酸盐都参与了反应并生成其他物质,同时在此反应中也消耗了熔体中绝大部分铁的氧化物,由于量的关系、PDF卡片的有限性及非晶体难以检测等XRD检测的局限性,无法测出生成物具体存在的物相,但反应剩余凝结下来的碱金属氯盐仍能检测出来,此时XRD检测出了NaCl、KCl,其他非晶体及微量物质则不能检测出来。
4 结论
本文建立了整体煤气化联合循环发电系统高温合成气中碱金属凝结特性试验台,自行设计搭建了可拆卸式换热器,并利用建成的试验台进行了IGCC合成气中碱金属凝结特性试验,获得了反应气氛和碱金属成分对凝结过程的影响规律,得出了以下结论:
1)由换热器内的温度分布和碱金属蒸气凝结位置对照可以看出,在还原性气氛下,碱金属蒸气的凝结温度在620~720℃之间。
2)当碱金属成分相同,在空气组分和CO浓度分别为43.80%、50%、55.56%时,碱金属蒸气的凝结温度分别为680、655、640、620℃,由此可知随着CO浓度的增加碱金属蒸气的凝结温度随之降低,还原性气氛可以降低碱金属蒸气的凝结温度。
3)当合成气中加入水蒸气时,碱金属蒸气的凝结温度与未加入水蒸气时没有变化都为640℃,可以看出水蒸气对碱金属蒸气凝结温度影响不大。
4)在CO浓度相同的情况下,当[Na+]/[K+]较小,同时碱金属盐为氯盐和硫酸盐时的凝结温度要比碱金属盐仅为氯盐时低。
5)SEM检测结果显示,在还原性气氛下,碱金属蒸气的凝结物表面并无规则晶体形貌存在,各物质以一种高度混合的状态呈现。
6)XRD检测结果表明在还原性气氛下,凝结
第11期邱朋华等:CO对碱金属凝结特性影响的试验研究 61
下来的碱金属化合物有NaCl和KCl,各相应工况下均未检测出Na2SO4和K2SO4。
7)由碱金属蒸气凝结的温度可以得出,对于IGCC系统的废热锅炉而言,辐射式废热锅炉的出口温度设定在620℃以上时,碱金属蒸气将有可能会进入对流废锅进而在对流废锅里面凝结,从而会促进对流废锅中密集的对流受热面管束区积灰。
参考文献
[1] 许慎启,周志杰,杨帆,等.神府煤焦与CO2的气化反应动力学
分析[J].中国电机工程学报,2009,29(9):41-42.
Xu Shenqi,Zhou Zhijie,Yang Fan,et al.Analysis on gasification reaction kinetics of shenfu char gasified by CO2[J].Proceedings of the CSEE,2009,29(9):41-42(in Chinese).
[2] 乌晓江,张忠孝,朴桂林,等.高灰熔点煤高温下煤焦CO2/水蒸
气气化反应特性的实验研究[J].中国电机工程学报,2007,27(32):24-25.
Wu Xiaojiang,Zhang Zhongxiao,Piao Guilin,et al.Experimental study on gasification reaction characteristics of Chinese high ash fusion temperature coal with CO2 and steam at elevated temperature [J].Proceedings of the CSEE,2007,27(32):24-25(in Chinese).[3] 邓世敏,危师让,林万超.IGCC系统专用单元模型研究[J].中国
电机工程学报,2001,21(3):34-36.
Deng Shimin,Wei Shirang,Lin Wanchao.Study on modeling typical parts of IGCC system[J].Proceedings of the CSEE,2001,21(3):34-36(in Chinese).
[4] Luthra K L,Shores D A.Mechanism of Na2SO4 induced corrosion at
600~900[J]
℃.Journal of Electrochem Society: Solid-State Science and Technology,1980,127(10):2202-2210.
[5] 申文琴,熊利红,沙兴中.热煤气中碱金属蒸汽的形成及清除方
法[J].煤气与热力,1998,18(6):3-6.
Shen Wenqin,Xiong Lihong,Sha Xingzhong.Formation and removal of gaseous alkali metal of hot gas[J].Gas & Heat,1998,18(6):3-6(in Chinese).
[6] Lee S H D,Swift M W.A fixed granular-bed sorber for measurement
and control of alkali vapors in pfbc[C].Proceedings of the Eleventh Fluidized Bed Combustion Conference Montreal,Quebec,Canada,1991.
[7] Steffin C R.Freisetzung und einbindung von alkalien bei der
verbrennung und vergasung von kohle unter druck[D].Deutsohland:Dissertation der Universitat Gesamthochschule Essen,1998.
[8] 李依丽,吴幼青,高晋生.几种天然矿物脱除高温气体中碱蒸气
研究[J].燃料化学学报,2003,31(1):44-48.
Li Yili,Wu Youqing, Gao Jinsheng.Removing alkali vapor at high temperature by natural minerals[J].Journal of Fuel Chemistry and Technology,2003,31(1):44-48(in Chinese).
[9] 李依丽,吴幼青,高晋生.高温气体中碱蒸气吸附剂的研究[J].煤
炭学报,2003,28(2):17-18.
Li Yili,Gao Jinsheng,Wu Youqing.Study on alkali vapor removing sorbent in high temperature gas[J].Journal of China Coal Society,2003,28(2):17-18(in Chinese).
[10] 申文琴,豆彬林,邢嵘,等.热煤气中碱金属蒸气的脱除[J].煤
气与热力,2000,20(6):403-404.
Shen Wenqin,Dou Binlin,Xing Rong,et al.Removal of alkali metal
vapor from hot coal gas[J].Gas & Heat,2000,20(6):403-406(in Chinese).
[11] 李依丽,吴幼青,高晋生.高温气体中碱金属蒸气的脱除[J].华
东理工大学学报,2003,29(2):162-163.
Li Yili,Wu Youqing,Gao Jinsheng.Removing of alkali vapor in high temperature gas[J].Journal of East China University of Science and Technology,2003,29(2):162-163(in Chinese).
[12] 陆佩文.无机材料科学基础[M].武汉:武汉工业大学出版社,1996:
269-270.
Lu Peiwen.Fundamentals of inorganic materials science[M].Wu han:Wuhan University of Technology Press,1996:269-270(in Chinese).[13] 马建丽.无机材料科学基础[M].重庆:重庆大学出版社,2008:
309-310.
Ma Jianli.Fundamentals of inorganic materials science[M].Chonging:Chongqing University Press,2008:309-310(in Chinese).[14] 李守富,白润玲,张玉兰.熔点测定浅析[J].山西化工,1996(2):
32-33.
Li Shoufu,Ba Runling,Zhang Yulan.Determination of melting point analysis[J].Shanxi Chemical Industry,1996(2):32-33(in Chinese).[15] 《常用化学手册》编写组.常用化学手册[M].北京:地质出版社,
1997:55-106.
Common Chemistry Handbook Compiling Group.Common chemistry handbook[M].Beijing:Geological Publishing House,1997:55-106(in Chinese).
[16] 郭培民,张临峰,赵沛.碳气化反应的催化机制研究[J].钢铁,
2008,43(2):28-29.
Guo Peimin,Zhang Linfeng,Zhao Pei.Study on catalytic mechanism of boudouard reaction[J].Iron and Steel,2008,43(2):28-29(in Chinese).
[17] 撒应禄.锅炉受热面外部过程[M].北京:水利水电出版社,1994:
16-17,139-141.
Sa
Yinglu.Boiler heating surface external process[M].Beijing:China Water Power Press,1994:16-17,139-141(in Chinese).
[18] 钱觉时,吴传明,王智.粉煤灰的矿物组成(上)[J].粉煤灰综合利
用,2001(1):28-29.
Qian Jueshi,Wu Chuanming,Wang Zhi.The mineral composition of fly ash(I)[J].Fly Ash Comprehensive Utilization,2001(1):28-29(in Chinese).
收稿日期:2009-08-13。
作者简介:
邱朋华(1973—),男,工学博士,副教授,主
要从事煤的清洁燃烧、整体煤气化联合循环方面的
研究,qiuph@https://www.doczj.com/doc/8612371760.html,;
王文杰(1985—),男,硕士研究生,主要从事
煤的清洁燃烧、整体煤气化联合循环方面的研究;
焦广亮(1983—),男,硕士研究生,主要从事
整体煤气化联合循环方面的研究;
吴少华(1952—),男,教授,博士生导师,主
要从事清洁煤燃烧、污染控制技术等方面的研究;
秦裕琨(1933—),男,教授,博士生导师,中
国工程院院士,主要从事清洁煤燃烧、污染控制技
术等方面的研究。
邱朋华
(责任编辑王庆霞)
一、课题:碱金属元素课型:预习+展示课 使用时间:2014-7-9 主备人:韩艳荣 二、教学目标: 1、知识目标: ①在掌握钠的性质的基础上使学生了解锂、钾、铷、铯的性质。 ②使学生了解碱金属的物理性质、化学性质和原子结构,并能运用碱金属性质上的差异及递变性,分析其原子结构的差异及相同之处。 2、能力目标: ①通过实验对比,培养学生认真观察实验现象,并透过现象看本质的能力。 ②通过对碱金属元素结构、性质的对比,培养学生比较、分析、归纳问题的能力。 3、情感目标: ①通过实验及问题的讨论,激发学生求知欲和学习的兴趣,培养学生热爱化学的情感。 ②培养学生认识“量变引起质变”,“本质决定现象”等辩证唯物主义的思想。 三、教学重点: ①碱金属的原子结构特点和性质的递变规律 ②碱金属的化学性质 教学难点:碱金属元素化学性质的相似性和递变性。
教学方法:探究法、启发法等 四、教学过程: 1、自主学习内容 (一)碱金属元素的原子结构及特点(见ppt) 思考问题1:通过观察碱金属的原子结构示意图,你能发现碱金属元素的原子结构有什么共同之处吗?有什么递变规律吗? 温馨提示:(1)相同点:最外层电子数都是1。 (2)递变性:从Li→Cs核电荷数依次增大,电子层数依次增多,原子半径依次增大 (二)思考问题2:碱金属元素原子结构的递变性对碱金属的性质有什么影响? 温馨提示:随着核电荷数的增加,原子核对外层电子的引力逐渐减弱,最外层电子越来越易失去,性质越来越活泼。 (三)碱金属物理性质的递变性(见ppt) 思考问题3:从表中你可以总结出碱金属的物理性质有什么相似及递变规律吗? 温馨提示:(1)相似性:色(铯略带金色)、软、轻、低、导 (2)递变性:从锂到铯硬度减小;ρ增大(K与Na反常);熔、沸点降低 2、小组探究与讨论 (一)钠、钾与O2反应的比较
磁场中的原子复习要 点及答案
第六章 在磁场中的原子 基本练习 (1)在正常塞曼效应中,沿磁场方向观察时将看到几条谱线: A .0; B.1; C.2; D.3 (2)正常塞曼效应总是对应三条谱线,是因为: A .每个能级在外磁场中劈裂成三个; B.不同能级的郎德因子g 大小 不同; C .每个能级在外场中劈裂后的间隔相同; D.因为只有三种跃迁 (3)B 原子态2P 1/2对应的有效磁矩(g =2/3)是 A. B μ33; B. B μ3 2; C. B μ32 ; D. B μ22. (4)在强外磁场中原子的附加能量E ?除正比于B 之外,同原子状态有关的因子有: A.朗德因子和玻尔磁子 B.磁量子数、朗德因子 C.朗德因子、磁量子数M L 和M J D.磁量子数M L 和M S (5)塞曼效应中观测到的π和σ成分,分别对应的选择定则为: A ;)(0);(1πσ±=?J M B. )(1);(1σπ+-=?J M ;0=?J M 时不出现; C. )(0σ=?J M ,)(1π±=?J M ; D. )(0);(1πσ=?±=?S L M M (6)原子在6G 3/2状态,其有效磁矩为: A . B μ3 15; B. 0; C. B μ25; D. B μ215- (7)若原子处于1D 2和2S 1/2态,试求它们的朗德因子g 值:
A.1和2/3; B.2和2/3; C.1和4/3; D.1和2 (8)由朗德因子公式当L=S,J≠0时,可得g值: A.2; B.1; C.3/2; D.3/4 (9)由朗德因子公式当L=0但S≠0时,可得g值:】 A.1; B.1/2; C.3; D.2 (10)如果原子处于2P1/2态,它的朗德因子g值: A.2/3; B.1/3; C.2; D.1/2 (11)某原子处于4D1/2态,若将其放于弱磁场中,则能级分裂为: A.2个; B.9个; C.不分裂; D.4个 (12)判断处在弱磁场中,下列原子态的子能级数那一个是正确的: A.4D3/2分裂为2个; B.1P1分裂为3个; C.2F5/2分裂为7个; D.1D2分裂为4个 (13)如果原子处于2P3/2态,将它置于弱外磁场中时,它对应能级应分裂为: A.3个 B.2个 C.4个 D.5个 (14)态1D2的能级在磁感应强度B的弱磁场中分裂多少子能级? A.3个 B.5个 C.2个 D.4个 (15)钠黄光D2线对应着32P3/2→32S1/2态的跃迁,把钠光源置于弱磁场中谱线将如何分裂: A.3条 B.6条 C.4条 D.8条 (16)碱金属原子漫线系的第一条精细结构光谱线(2D3/2→2P3/2)在磁场中发生 塞曼效应,光谱线发生分裂,沿磁场方向拍摄到的光谱线条数为
第17章碱金属和碱土金属习题1.选择题 17-1下列氢化物中,稳定性最强的是…………………………………………..( ) (A) RbH (B) KH (C) NaH (D) LiH 17-2下列关于锂和镁性质上的相似性的说法错误的是……………………….( ) (A) 锂和镁的氢氧化物受热时,可分解为相应的氧化物 (B) 锂和镁的氟化物、碳酸盐和磷酸盐都难溶于水 (C) 锂和镁的氯化物都能溶于有机溶剂 (D) 锂和镁的固体密度都小于1g/cm3,熔点都很低 17-3下列各组化合物中,均难溶于水的是……………………………………...()(A) BaCrO4,LiF (B) Mg(OH)2,Ba(OH)2 (C) MgSO4,BaSO4(D) SrCl2,CaCl2 17-4下列氯化物在有机溶剂中溶解度最大的是……………………………….()(A) LiCl (B) NaCl (C) KCl (D) CaCl2 17-5下列碳酸盐的热稳定性顺序正确的是……………………………………. ( ) (A) BeCO3>MgCO3>CaCO3>SrCO3>BaCO3(B) BaCO3>CaCO3>K2CO3 (C) BaCO3>SrCO3>CaCO3>MgCO3>BeCO3(D) Li2CO3>NaHCO3>Na2CO3 17-6下列各金属在空气中燃烧生成的氧化物仅为普通氧化物的是…………( ) (A) K (B) Na (C) Li (D) Rb 17-7 已知Na +H2O == NaOH(aq) + 1/2H2Δr H m?=-185.77kJ·mol-1 NaH + H2O == NaOH(aq) + H2Δr H m?=-132.21 kJ·mol-1 则NaH 的生成热为………………………………………………………….( ) (A) –317.98 kJ·mol-1(B) +317.98 kJ·mol-1 (C) –53.56 kJ·mol-1(D) +53.96 kJ·mol-1 17-8下列各碳酸盐中溶解度最小的是………………………………………..( ) (A) NaHCO3(B) Na 2CO3 (C) Li2CO3(D) K2CO3 17-9 NaNO3和LiNO3都在1000K左右分解,其分解产物……………………( ) (A) 都是亚硝酸盐和O2(B) 都是氧化物和O2 (C) 都产生N2O和O2(D) 除了都有氧气外,其余产物均不同
元素周期律碱金属元素性质总结 I.元素周期律 1.周期表位置IA族(第1纵列),在2、3、4、5、6、7周期上均有分布。元素分别为锂(Li)-3,钠(Na)-11,钾(K)-19,铷(Rb)-37,铯(Cs)-55,钫(Fr)-87。 2.碱金属的氢氧化物都是易溶于水, 苛性最强的碱, 所以把它们被称为为碱金属。 3.碱金属的单质活泼,在自然状态下只以盐类存在,钾、钠是海洋中的常量元素,其余的则属于轻稀有金属元素,在地壳中的含量十分稀少。钫在地壳中极稀少,一般通过核反应制取。 4.保存方法:锂密封于石蜡油中,钠。钾密封于煤油中,其余密封保存,隔绝空气。 II.物理性质 II.1物理性质通性(相似性) 1.碱金属单质皆为具金属光泽的银白色金属(铯略带金黄色),但暴露在空气中会因氧气的氧化作用生成氧化物膜使光泽度下降,呈现灰色。常温下均为固态。 2.碱金属熔沸点均比较低。摩氏硬度小于2,质软。.导电、导热性、延展性都极佳。 3.碱金属单质的密度小于2g/cm3,是典型轻金属,锂、钠、钾能浮在水上。 4.碱金属单质的晶体结构均为体心立方堆积,堆积密度小。 II-2.物理性质递变性 随着周期的递增,卤族元素单质的物理递变性有: 1.金属光泽逐渐增强。 2.熔沸点逐渐降低。 3.密度逐渐增大。钾的密度具有反常减小的现象。 II.3.物理性质特性 1.铯略带有金色光泽,钫根据测定可能为红色,且具有放射性。 2.液态钠可以做核反应堆的传热介质。 3.锂密度比没有小,能浮在煤油中。 4.钾的密度具有反常现象。 钾的密度反常变化的原因:根据公式:ρ=A r/V原子,可知相对原子质量的增大使密度增加,而电子层的增加又使原子体积增大使得密度减小。即单质的密度由相对原子质量和原子体积两个因素决定。对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的影响,结果钾的密度反而比钠小。 II.5焰色反应 1.碱金属离子及其挥发性化合物在无色火焰中燃烧时会显现出独特的颜色,这可以用来鉴定
碱 金 属 第Ⅰ卷 (选择题 共60分) 一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意) 1.钠着火燃烧时,可用下列哪种物质灭火( ) ①泡沫灭火器 ②干粉灭火器 ③水 ④沙土 A .①② B .④ C .②③ D .①②③ 2.在下列反应中,22O Na 只表现出强氧化性的是( ) A .2322 222 2O CO Na CO O Na ++ B .42222 MnO Na MnO O Na + C .↑+++2 242422222 2O O H SO Na SO H O Na D .O H O Mn Na H MnO O Na 22242285210 1625+↑+++++++- 3.通常情况下,下列物质有固定熔点的是 A .烧碱 B .聚乙烯 C .漂白粉 D .氯化铵 4.下列各项中的“黄色”,不属于因化学反应而产生的现象的是( ) A .无色试剂瓶中的浓硝酸呈黄色 B .用玻璃片靠近在玻璃导管口燃着的硫化氢的火焰,玻璃片上附有的固体呈现黄色 C .久置的碘化钾溶液呈黄色 D .食盐在无色的火焰上灼烧时,火焰呈黄色 5.我国著名的化工专家候德榜在20世纪20年代所创立的“候氏制碱法”誉满全球,“候氏制碱法”中的碱是指下列的( ) A .NaOH B .32CO K C .32CO Na D .3NaHCO 二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分) 6.为提高农作物产量,改善农作物品质,有一种向温室内定期施放2CO 的方法是:将工业废稀42SO H 按1:4用水稀释后,盛放在塑料桶内悬挂于1.2米的高处,每天向桶内加入适量的某物质。下列物质中最适宜加入的是( ) A .粉末3CaCa B .32CO Na 粉末 C .34HCO NH D .3BaCO 粉末 7.下列反应的离子方程式正确的是( ) A .氯化铁溶液中加入铁粉:+++232 Fe Fe Fe B .漂白粉溶液中通 入过量二氧化碳:
第一章第二节主族元素碱金属和卤素 (一)碱金属元素: 1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,失电子能力逐渐,还原性(元素金属性)逐渐。从Li到Cs的金属性逐渐增强。 2.碱金属化学性质的相似性: 4Li + O2 Li2O 2Na + O2 Na2O2 点燃点燃 2 Na + 2H2O =2NaOH + H2↑ 2K + 2H2O =2KOH + H2↑ 2R + 2 H2O = 2 ROH + H2 ↑ ★★结论:碱金属元素原子的最外层上都只有___个电子,都显___ 价. 它们的化学性质相似。都能与水和氧气反应 ★★结论:1)原子结构的递变性导致化学性质的递变性。 ★★★2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强, 碱性:LiOH <NaOH <KOH < RbOH < CsOH 3.碱金属物理性质的相似性和递变性: 1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。2)递变性(从锂到铯):①密度逐渐增大(K反常)②熔点、沸点逐渐降低 ★★小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。 (二)卤族元素: 1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,得电子能力逐渐,氧化性(元素非金属性)逐渐。还原性(元素金属性)逐渐从F到I的非金属性逐渐减弱。 2.卤素单质物理性质的递变性:(从F2到I2) (1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高 3.卤素单质与氢气的反应:X2 + H2= 2 HX 卤素单质与H2的剧烈程度:依次减弱;生成的氢化物的稳定性:依次减弱生成的氢化物的稳定性:HF HCl HBr HI
碱金属(复习课) 备课人:黄军备课时间:2012-2-18 第四章碱金属 一、考纲要求 1.掌握钠的重要性质,了解钠的保存和重要用途. 2.掌握钠的氧化物的性质,钠的重要化合物的用途及Na2CO3与NaHCO3的联系与区别. 3.掌握碱金属的性质,理解碱金属原子结构与性质递变规律,掌握用焰色反应检验金属钠和钾及其离子的操作技能. 二、知识结构
三、知识点、能力点提示 1.通过钠的化学性质的学习,能正确分析钠长久露置于空气中发生的一系列变化的现象和原 理. 2.通过钠与水反应的现象及实质的学习,能正确分析钠与酸溶液、盐溶液、碱溶液反应时的现象及实质. 3.通过Na 2O 2的结构和性质的学习,能正确分析Na 2O 2在化学反应中的电子得失及所起的作用. 4.通过Na 2O 2、NaHCO 3、NaOH 的性质的学习,掌握有关Na 2O 2与NaHCO 3混合加热 、NaOH 与NaHCO 3.混合加热类型习题的计算. 四、能力训练 1.下列叙述中,正确的是( ) A.钠元素在自然界中,主要以化合态形式存在,其中最多的是碳酸钠 B.运用钠蒸气放电发光的性质,制造的高压钠灯能发出强烈的白炽光,其射程远,穿透力强 ,可作航船的探照灯. C.单质钠是一种很强的还原剂,可以把钛、锆、铌、钼等金属从它们的化合物中氧化出来. D.钠着火后,可用砂子灭火,不能用水,也不能用泡沫灭火器灭火. 知识点:钠在自然界中存在.钠的化学性质和钠的用途. 能力点:再现能力、辨别能力、知识迁移能力. 2.将一块金属钠投入到饱和的澄清石灰水中,看到的现象是:( ) A.置换出金属钙而有固体析出 B.置换出氢气单质 C.反应比在水中剧烈、引起燃烧 D.溶液变浑浊,并放出气体 知识点:钠与水反应的现象和原理、平衡移动的条件、化学反应速率、晶体析出的条件能力点:再现能力、迁移能力、综合分析推理能力. 3.在某温度下,NaOH 的溶解度为ag ,该温度下,用bg 水溶解一定量的Na 2O 2形成饱和溶液,需加入Na 2O 2的质量为( )克。 A.a ab 9400039+ B. a ab 9400039- C.100ab D.400039ab 知识点:过氧化钠和水反应的化学性质以及溶解度概念理解。 能力点:再现能力、计算推理能力 4. 2.1g 平均相对分子质量为7.2的CO 与H 2组成的混合气体与足量的O 2充分燃烧后,立即通入足量的Na 2O 2固体中,固体的质量增加( ) A.2.1g B.3.6g C.7.2g D.无法计算 知识点:CO 、H 2、Na 2O 2的化学性质 能力点:阅读理解能力、综合分析能力、计算推理能力. 5.锂是一种活泼金属,它在工业上的用途有( ) ①作光电材料 ②化工生产中的催化剂 ③原子反应堆的导热剂 ④制取高强度玻璃 ⑤制热核反应的材料 A.①④ B.②③⑤ C.②④⑤ D.①③⑤ 知识点:考查锂的物理性质。 能力点:发散思维能力以及知识再现能力。 6.Na 2O 2与NaHCO 3混合后,在密闭容器中充分加热,排出气体物质后冷却,残留的固体物质不可能是( ) A.Na 2O 2、Na 2CO 3 B.Na 2CO 3 C.Na 2CO 3、NaOH D.Na 2CO 3、Na 2O 2、NaOH 知识点:Na 2O 2、NaHCO 3的化学性质 能力点:综合推理能力 7.下列关于钾、钠、铷、铯的说法中,不正确的是:( ) A.原子半径随核电荷数的增大而增大 B.单质的密度均小于1 C.其氢氧化物中,碱性最强的是CsOH D.氧化能力最强的是钠原子 知识点:碱金属元素随着原子序数的递增性质递变规律. 能力点:再现能力,分析比较能力、推理能力. 8.用洁净的铂丝,蘸取某无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,下列说法正确的是:( ) A.该溶液只含钾元素的化合物 B.该溶液中一定含钠离子 C.该溶液可能含有钠离子,但一定含有钾离子 D.该溶液可能含有钾离子,但一定含有钠离子 知识点:焰色反应. 能力点:辨别能力、推理能力 9.碱金属如锂、钠、钾、铷等)溶于汞可形成良好的还原剂“汞齐”,取7g 碱金属的汞齐与 水作用得到 2.24L 氢气(标况),并得1L 密度为ρg/cm 3 的溶液,则溶液中溶质的质量分数可以是( ) A.% 8 .0ρ B. % 48 .0ρ C. % 32 .0ρ D. % 7 .0ρ 知识点:碱金属、汞的化学性质、质量分数的计算. 能力点:综合分析能力、计算推理能力 10.超氧化钾(KO 2)常用于急救,它能吸收CO 2生成碳酸盐和氧气.若用156g 金属钾在一定条件下与O 2充分反应生成KO 2,用此KO 2完全吸收CO 2,则生成的O 2在标准状况下的体积是( ) A.11.2L B.22.4L C.44.8L D.67.2L 知识点:气体摩尔体积 能力点:发散思维能力、阅读理解能力、计算推理能力. 11.工业上生产Na 、Ca 、Mg 都用电解其熔化的氯化物,但钾却不能用电解KCl 熔化物的方法制得,因金属钾易溶于熔化的KCl 中而有危险.现在生产钾是用金属钠和熔化的KCl 反应制取 .有关数据如下: 熔点(℃) 沸点(℃) 密度(g/cm 3 ) Na 97.8 883 0.97 K 63.7 774 0.86 NaCl 801 1413 2.165 KCl 770 1500升华 1.984 工业上生产金属钾的化学方程式和条件是:KCl+Na 850℃ NaCl+K
第17章 碱金属和碱土金属 2. 以食盐为原料,如何制备下列物质?写出反应方程式。 Na NaOH Na 2O 2 Na 2CO 3 Na 2SO 3 Na 2S 2O 3 答:(1)电解熔融NaCl-CaCl 2混合物制备金属Na : 2 NaCl(l) ==== 2 Na(l) + Cl 2(g) (2)电解NaCl 饱和溶液制备NaOH : 2 NaCl + 2H 2O==== 2 NaOH + H 2(g) + Cl 2(g) (3)由步骤(1)中制备的 Na 在过量O 2中燃烧制备Na 2O 2 : 2Na + O 2 ==== Na 2O 2 (4)用NaCl 饱和溶液吸收NH 3和CO 2析出NaHCO 3,煅烧NaHCO 3即得到Na 2CO 3: + CO 2 ===== NaHCO 3↓+ NH 4Cl NH 3 + NaCl + H 2O ===== Na 2CO 3 + H 2O ↑+ CO 2↑ 2NaHCO 3 也可用步骤(2)制备的NaOH 溶液吸收CO 2制备Na 2CO 3: 2 NaOH + CO 2 ==== Na 2CO 3 + H 2O (5)用步骤(2)制备的NaOH 溶液吸收SO 2制备Na 2SO 3 : 2 NaOH + SO 2 ==== Na 2SO 3 + H 2O (6) 用步骤(5)制备的Na 2SO 3溶液与S 粉共煮制备Na 2S 2O 3 : 电解 Na 2SO 3 + S ==== Na 2S 2O 3 3. 碱土金属碳酸盐的热分解反应如下: MCO 3(s) === MO(s) + CO 2(g) 根据下表中分解反应的热力学数据,计算它们的分解温度,总结碱土金属碳酸盐热稳定性的变化规律并简要说明原因。 碳酸盐 MgCO 3 CaCO 3 SrCO 3 BaCO 3 Δr H o (298 )/kJ ?mol -1 117 176 238 268 Δr S o (298 )/J ?mol -1?K -1 168 148 168 168 解:根据 Δr G o(T)=Δr H o(298) - T ?Δr S o(298) = 0 得 T =Δr H o(298)/Δr S o(298) 将表中数据带入上式求得各碱土金属碳酸盐的分解温度T 如下: 燃烧 电解 加热 加热
碱金属卤族元素练习题 1.下列叙述中错误的是() A.随着电子层数增多,碱金属元素的原子半径逐渐增大 B碱金属单质具有还原性,形成的离子具有强氧化性 C碱金属单质熔、沸点随着核电荷数的增大而降低 D碱金属元素在自然界中都是以化合态存在的 2.关于铯及其化合物的以下各种说法中不正确的是() A.氢氧化铯是一种强碱,比KOH勺碱性强 B.铯与水或酸溶液反应剧烈,都生成氢气 C.Cs的还原性比Na强,故的氧化性大于Cs+ D.AI的金属性大于铯的金属性 3.下列说法中正确的是() A.碱性:LiOH > NaOH > KOH > RbOH B.金属性:Rb > K > Na > Li C.和酸反应时1个Fe能失去2电子,1个Na失去1个电子,所以
Fe的金属性强于Na D.Rb不易与水反应放出H 4.已知金属钾有如下性质: 钾的密度比水小钾的熔点低钾与水反应时放出热 量④钾与水反应后溶液呈碱性 某学生将一小块金属钾投入滴有酚酞溶液的水中,以上实验能证明上述四点性质中的() A.①④ B. ①②④ C.①③④ D. ①②③④ 5.下列各组物质性质比较的表示中,正确的是() A.还原性:HF > HCI> HBr > HI B.稳定性:HF < HCI < HBr Br 2 > I 2> F 2 D.密度:F2< Cl 2< Br 2< I 2 6.卤素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是() A.卤素单质的最外层电子数都是7 B.从上到下,卤素原子的电子层数依次增多,半径依次减小 C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子 的得电子能力依次减弱 D.卤素单质与f化合由易到难顺序为F2< Cl 2< Br 2< I 2 7.X、Y是元素周期表第叫A族中的两种元素,下列叙述能说明X
第四章 碱金属原子和电子自旋 (1)单个f 电子总角动量量子数的可能值为: A. j =3,2,1,0; B .j=±3; C. j= ±7/2 , ± 5/2; D. j= 5/2 ,7/2 (2)单个d 电子的总角动量投影的可能值为: A.2 ,3 ; B.3 ,4 ; C. 235, 2 15; D. 3/2, 5/2 . (4)锂原子光谱由主线系.第一辅线系.第二辅线系及柏格曼系组成.这些谱线系中全部谱线在可见光区只有: A.主线系; B.第一辅线系; C.第二辅线系; D.柏格曼系 (5)锂原子主线系的谱线在不考虑精细结构时,其波数公式的正确表达式应为: A.nP S -=2~ν ; B. S nP 2~→=ν; C .nP S →=2~ν; D .S nP 2~-=ν (6)碱金属原子的光谱项为: A.T=R/n 2; B .T=Z 2R/n 2; C .T=R/n *2; D. T=RZ *2/n *2 (7)锂原子从3P 态向低能态跃迁时,产生多少条被选择定则允许的谱线(不考虑精细结构)? A.一条 B.三条 C.四条 D.六条 (8)已知锂原子光谱主线系最长波长为6707埃,辅线系线系限波长为3519埃,则Li 原子的电离电势为: A .5.38V B.1.85V C.3.53V D.9.14V (9)钠原子基项3S 的量子改正数为1.37,试确定该原子的电离电势: A.0.514V; B.1.51V; C.5.12V; D.9.14V (10)碱金属原子能级的双重结构是由于下列哪一项产生: A.相对论效应 B.原子实的极化 C.价电子的轨道贯穿 D.价电子的自旋-轨道相互作用 (11)产生钠的两条黄谱线的跃迁是: A.2P 3/2→2S 1/2 , 2P 1/2→2S 1/2; B. 2S 1/2→2P 1/2 , 2S 1/2→2P 3/2; C. 2D 3/2→2P 1/2, 2D 3/2→2P 3/2; D. 2D 3/2→2P 1/2 , 2D 3/2→2P 3/2 (12)若已知K 原子共振线双重成分的波长等于7698.98埃和7664.9埃,则该原子4p 能级的裂距为多少eV ? A.7.4×10-2; B .7.4×10-3; C .7.4×10-4; D .7.4×10-5. (13)对锂原子主线系的谱线,考虑精细结构后,其波数公式的正确表达式应为: A.ν~= 22S 1/2-n 2P 1/2 ν~= 22S 1/2-n 2P 3/2 B. ν~= 22S 1/2→n 2P 3/2 ν~= 22S 1/2→n 2P 1/2 C. ν~= n 2P 3/2-22S 1/2 ν~= n 2P 1/2-22S 3/2 D. ν~= n 2P 3/2→n 2P 3/2 ν~= n 2P 1/2→n 21/2 (14)碱金属原子光谱精细结构形成的根本物理原因: A.电子自旋的存在 B.观察仪器分辨率的提高 C.选择定则的提出 D.轨道角动量的量子化 (15)已知钠光谱的主线系的第一条谱线由λ1=5890埃和λ2=5896埃的双线组成,则第二辅线系极限的双线间距(以电子伏特为单位): A.0; B.2. 48?10-3; C.2.07?10-3; D.3.42?10-2 (16)考虑电子自旋,碱金属原子光谱中每一条谱线分裂成两条且两条线的间隔随波数增加而减少的是什么线系? A.主线系; B.锐线系; C.漫线系; D.基线系
第五讲碱金属元素 1.复习重点 碱金属元素的原子结构及物理性质比较,碱金属的化学性质,焰色反应实验的操作步骤; 原子的核外电子排布碱金属元素相似性递变性 2.难点聚焦 (1)碱金属元素单质的化学性质: O、1)相似性:碱金属元素在结构上的相似性,决定了锂、钠、钾、铷、铯在性质上的相似性,碱金属都是强还原剂,性质活泼。具体表现在都能与 2 Cl、水、稀酸溶液反应,生成含R+(R为碱金属)的离子化合物;他们的氧化物对应水化物均是强碱; 2 O 2)递变性:随着原子序数的增加,电子层数递增,原子半径渐大,失电子渐易,还原性渐强,又决定了他们在性质上的递变性。具体表现为:①与 2 H O反应越来越剧烈,③随着核电荷数的增强,其最高价氧化物对应的水化物的碱性增强:反应越来越剧烈,产物越来越复杂,②与 2 CsOH RbOH KOH NaOH LiOH >>>>; (2)实验是如何保存锂、钠、钾:均是活泼的金属,极易氧化变质甚至引起燃烧,它们又都能与水、水溶液、醇溶液等发生反应产生氢气,是易燃易
爆物质,存放它们要保证不与空气、水分接触;又因为它们的密度小,所以锂只能保存在液体石蜡或封存在固体石蜡中,而将钠、钾保存在煤油中; (3)碱金属的制取:金属Li 和Na 主要是用电解熔融氯化物的方法制取;金属K 因为易溶于盐不易分离,且电解时有副反应发生,故一般采用热还原法用Na 从熔融KCl 中把K 置换出来(不是普通的置换,而是采用置换加抽取的方法,属于反应平衡);铷和铯一般也采用活泼金属还原法制取。 (4).焰色反应操作的注意事项有哪些? (1)所用火焰本身的颜色要浅,以免干扰观察. (2)蘸取待测物的金属丝本身在火焰上灼烧时应无颜色,同时熔点要高,不易被氧化.用铂丝效果最好,也可用铁丝、镍丝、钨丝等来代替铂丝.但不能用铜丝,因为它在灼烧时有绿色火焰产生. (3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无色,以除去能起焰色反应的少量杂质. (4)观察钾的焰色时,要透过蓝色的钴玻璃片,因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤去黄色火焰,以看清钾的紫色火焰. 3. 例题精讲 例1 已知相对原子质量:Li 6.9,Na 23,K 39,Rb 85。今有某碱金属M 及其氧化物2M O 组成的混合物10.8 g ,加足量水充分反应后,溶液经蒸发和干燥得固体16 g ,据此可确定碱金属M 是[ ] A 、Li B 、Na C 、K D 、Rb 解析 设M 的相对原子质量为A ,当设混合物全是碱金属或全是碱金属氧化物时有如下关系: 22222M H O MOH H +=+↑ 222M O H O MOH += 10.8 g →10.8×[(A +17)/A]g 10.8 g →10.8×[2(A +17)/(2A +16)]g 但实际上该混合物中碱金属及其氧化物都存在,则可建立不等式:[10.8(17)/]16[10.8(17)/(8)]A A A A ?+>>?++。 解得:35.3>A >10.7,从碱金属的相对原子质量可知该碱金属只能是钠。 答案 B 例2 为了测定某种碱金属的相对原子质量,有人设计了如图所示的实验装置。该装置(包括足量的水)的总质量为ag 。将质量为bg 的某碱金属单质放入水中,立即塞紧瓶塞,完全反应后再称量此装置的总质量为cg 。
高考化学复习碱金属元素知识点总结 碱金属都是银白色的金属(铯略带金色光泽),密度小,熔点和沸点都比较低。以下是碱金属元素知识点,请大家掌握。 1.碱金属元素 碱金属包含锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素.由于钫是人工放射性元素,中学化学不作介绍. 2.碱金属元素的原子结构 相似性:碱金属元素的原子最外层都只有1个电子,次外层为8个电子(其中Li原子次外层只有2个电子).所以在化学反应中,碱金属元素的原子总是失去最外层的1个电子而显+1价. 递变性:Li、Na、K、Rb、Cs等碱金属元素的原子核外电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的吸引力逐渐减弱,失电子能力逐渐增强,元素的金属性逐渐增强. 3.碱金属的物理性质及其变化规律 (1)颜色:银白色金属(Cs略带金色光泽). (2)硬度:小,且随Li、Na、K、Rb、Cs,金属的硬度逐渐减小.这是由于原子的电子层数逐渐增多,原子半径逐渐增大,原子之间的作用力逐渐减弱所致.碱金属的硬度小,用小刀可切割. (3)碱金属的熔点低.熔点最高的锂为180.5℃,铯的熔点是28.4℃.随着原子序数的增加,单质的熔点逐渐降低. (4)碱金属的密度小.Li、Na、K的密度小于水的密度,且锂的
密度小于煤油的密度.随着原子序数的增大,碱金属的密度逐渐增大.但钾的密度小于钠的密度,出现反常现象.这是由于金属的密度取决于两个方面的作用,一方面是原子质量,另一方面是原子体积,从钠到钾,原子质量增大所起的作用小于原子体积增大的作用,所以钾的密度反而比钠的密度小. 4.碱金属的化学性质 碱金属与钠一样都是活泼的金属,其性质与钠的性质相似.但由于碱金属原子结构的递变性,其金属活泼性有所差异,化合物的性质也有差异. (1)与水反应 相似性:碱金属单质都能与水反应,生成碱和氢气. 2R+2H2O=2ROH+H2(R代表碱金属原子) 递变性:随着原子序数的增大,金属与水反应的剧烈程度增大,生成物的碱性增强. 例如:钠与冷水反应放出热量将钠熔化成小球,而钾与冷水反应时,钾球发红,氢气燃烧,并有轻微爆炸.LiOH是中强 碱,CsOH是最强碱. (2)与非金属反应 相似性:碱金属的单质可与大多数非金属单质反应,生成物都是含R+阳离子的离子化合物. 递变性:碱金属与氧气反应时,除锂和常温下缓慢氧化的钠能生成正常的氧化物(R2O)外,其余的碱金属氧化物是复杂氧化
第15章碱金属与碱土金属 教学要求 1.掌握碱金属、碱土金属单质的性质,了解其结构、制备、存在及用途与性质的关系。 2.掌握碱金属、碱土金属氧化物的类型及重要氧化物的性质及用途。 3.了解碱金属、碱土金属氢氧化物溶解性和碱性的变化规律。 4.掌握碱金属、碱土金属重要盐类的性质及用途,了解盐类热稳定性、溶解性的变化规律。 教学时数4学时 15-1 碱金属和碱土金属的通性 碱金属元素原子的价电子层结构为ns1。因此,碱金属元素只有+1氧化态。碱金属原子最外层只有一个电子,次外层为8电子(Li为2电子),对核电荷的屏蔽效应较强,所以这一个价电子离核校远,特别容易失去,因此,各周期元素的第一电离能以碱金属为最低。与同周期的元素比较,碱金属原子体积最大,只有一个成键电子,在固体中原子间的引力较小,所以它们的熔点、沸点、硬度、升华热都很低,并随着Li一Na—K一Rb一Cs的顺序而下降。随着原子量的增加(即原子半径增加),电离能和电负性也依次降低,见表17—1。 碱金属性质的变化一般很有规律,但由于锂原子最小,所以有些性质表现特殊。事实上,除了它们的氧化态以外,锂及其化合物的性质与本族其它碱金属差别较大,而与周期表中锂的右下角元素镁有很多相似之处。 碱金属元素在化合时,多以形成离子键为特征,但在某些情况下也显共价性。气态双原子分子,如Na2、Cs2等就是以共价键结合的。碱金属元素形成化合物时,锂的共价倾向最大,铯最小。 与碱金属元素比较,碱土金属最外层有2个s电子。次外层电子数目和排列与相邻的
碱金属元素是相同的。由于核电荷相应增加了一个单位,对电子的引力要强一些,所以碱土金属的原子半径比相邻的碱金属要小些,电离能要大些,较难失去第一个价电子。失去第二个价电子的电离能约为第一电离能的一倍。从表面上看碱土金属要失去两个电子而形成二价正离子似乎很困难,实际上生成化合物时所释放的晶格能足以使它们失去第二个电子。它们的第三电离能约为第二电离能的4—8倍,要失去第三个电子很困难,因此,它们的主要氧化数是+2而不是+1和+3。由于上述原因,所以碱土金属的金属活泼性不如碱金属。比较它们的标准电极电势数值,也可以得到同样的结论。在这两族元素中,它们的原了半径和核电荷都由上而下逐渐增大,在这里,原子半径的影响是主要的,核对外层电子的引力逐渐减弱,失去电子的倾向逐渐增大,所以它们的金属活泼性由上而下逐渐增强。 碱金属和碱土金属团体均为金属晶格,碱土金属由于核外有2个有效成键电子,原于间距离较小,金属键强度较大,因此,它们的熔点、沸点和硬度均较碱金属高,导电性却低于碱金属。碱土金属的物理性质变化不如碱金属那么有规律,这是由于碱土金属晶格类型不是完全相同的缘故。碱金属皆为体立方晶格,碱土金属中,Be、Mg为六方晶格,Ca、Sr为面心立方晶格,Ba为体立方晶格。 这两族元素的离子各有不同的味道特征,如Li+离子味甜;K+、Na+离子味咸;Ba+离子味苦。 Li+离子的极化力是碱金属中最强的,它的溶剂化作用和形成共价的趋势异常的大,有人提出有“锂键”的存在,类似于氢键,如H—F···Li—F和(LiF2)2。 15-2 碱金属和碱土金属的单质 15-2-1 存在和制备 一、存在 由于碱金属和碱土金属的化学性质很活泼,所以它们只能以化合状态存在于自然界中。在碱金属中,钠和锂在地壳中分布很广,两者的丰度都为2.5%。主要矿物有钠长石Na[AlSi3O8]、和钾长石K[A1Si3O8],光卤石KCl·MgCl2·6H 20及明矾石K2SO4·A12(SO4)3·24H2O等。海水中氯化钠的含量为2.7%,植物灰中也含有钾盐。锂的重要矿物为锂辉石Li2O·A1203 4SiO2,锂、铷和铯在自然界中储量较少且分散,被
碱金属和卤素综合复习题精编 一、填空题 1、碱金属元素(放射性元素除外)包括,其中金属性最强的是,原子半径最小的是,密度最大的是,它们在自然界中都是以形式存在,他们原子结构的特点是,它们通常显价,与水反应的剧烈程度由大到小的,与氧气反应的剧烈程度由大到小的是。 2、钠是一种固体,它的焰色反应呈色,钾的焰色反应呈色,需要透过去观察,是为了避免混有的干扰。 3、钠很容易和空气中的、等物质反应,通常将钠保存在中。 4、钠与水反应的现象用五个字来概括、、、、。 5、卤素包括的五种元素,它们都是分子,在自然界中,它们是以形式存在,密度最小的是元素,熔沸点最低的是元素,它们共同的原子结构特点是,这导致它们很容易得到电子,具有性,其中这种性质最强的是元素,它们与氢气化合的难易程度由大到小是,形成氢化物的稳定性由大到小是,在卤素中,只有一种单质能和水反应产生氧气,这种物质是,反应的化学方程式是,卤素都能溶于苯和四氯化碳等有机溶剂,溴溶于有机溶剂后,显色,碘溶于有机溶剂后,显色(补充知识点:四氯化碳密度比水大,苯的密度比水小)。 6、氯气呈色,密度比空气,毒有刺激性气味的气体。 7、氯水是物,新氯水制呈,是因为里面含有的缘故,紫色石蕊试纸遇到氯水后,颜色变化是,这是因为氯水里面含有的缘故。氯水久置后,发生的颜色变化是,产生的无色气体是气,该反应的化学方程式是。 8、碘单质加热易,遇到淀粉会变。 9、碱金属单质具有性,卤素单质具有性。 二、选择题 1、钠着火时,采用哪种灭火方式最好() A. 水 B. 煤油 C. 泡沫灭火器 D. 砂子 2、下列关于碱金属元素叙述中正确的是()
A. 锂是碱金属中最不活泼并可以在自然界中以游离态存在的元素 B. 锂原子的半径比其他碱金属原子的半径都要大 C. 碱金属只有钠需要保存在煤油或石蜡中 D. 碱金属的单质都可以通过人工的方法从其他化合物中获得 3、鉴别苏打(碳酸钠)和小苏打(碳酸氢钠)溶液最好的试剂是() A.盐酸 B. 石蕊试液 C. 酚酞试液 D. 氯化钙 4、下列各组物质中不能反应的是() A.钠和水 B. 钠和氧气 C. 钠和二氧化碳 D. 过氧化钠和二氧化碳 5、将一小块钠放到潮湿的空气中,最终形成的产物是() A.过氧化钠 B. 氯化钠 C. 碳酸钠 D. 氢氧化钠 6、做焰色反应时,使用的铂丝每次都要用试剂洗净,这种试剂指的是()A.NaOH溶液B.碳酸钠溶液C.稀盐酸D.硫酸溶液 7下列说法正确的是() A、在化学反应中某元素由化合态变为游离态,该元素一定被还原了 B、失电子能力难的原子获得电子的能力一定强 C、金属单质在反应中只作为还原剂 D、非金属单质在反应中办作为氧化剂 8、卤素(从氟到碘),下列递变规律正确的是()。 A、单质的密度逐渐减小,颜色逐渐加深,熔、沸点逐渐降低 B、单质的氧化性逐渐增强 C、卤素离子的还原性逐渐增强 D、气态氢化物的稳定性逐渐增强 9、下列能发生反应的是() A. 氯气和溴单质 B. 氯气和溴化钾 C. 溴化钠和碘化钠 D. 溴化钠和碘单质 10、将氯水滴入KI溶液中,用力振荡,再注入CCl4,振荡后静置,看到的现象为( ) A.液体呈紫红色B.液体分两层,上层为紫色,下层接近无色 C.液体分两层,上层接近无色,下层紫色 D.液体无色 11.证明某白色固体中含有Cl-的正确操作方法是( ) A.加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成 B.溶于水后加入AgNO3溶液,看是否有白色沉淀生成 C.加入Ba(NO3)2溶液,看是否有白色沉淀生成
《碱金属元素》 【高考考点】1 ?碱金属元素原子结构、性质的比较 2. 从原子核外电子排布理解碱金属元素 (单 质、化合物)的相似性核递变性 3. 焰色反应(Na 、K ) 【知识要点】 一.碱金属 1 .结构 碱金属在周期表中位于 _________ 族,其最外电子层上都只有一个电子,随着核电荷数的增 多,它们的电子层数逐渐 _______________ ,原子半径逐渐 ____________ ,原子核对最外层电子的引力 逐渐 __________ ,原子失去最外电子层中电子的能力逐渐 ______________________ ,导致它们的金属性逐 渐 ____________ 。 2 .性质 ⑴物理性质(单质) 二.焰色反应 __________________________________________________________________________ 的现象,叫焰色反应。 1. 步骤 ⑴干烧将铂丝烧至无色; ⑵蘸烧 蘸取待测物进行灼烧,观察火焰颜色; ⑶洗烧 每次实验后都要用 _________________ 洗净铂丝,灼烧至无色。 2 .一些金属或金属离子的焰色反应的颜色 ⑵焰色反应是原子或离子的外围电子被激发跃迁而产生各种颜色光的过程。 与气体物质燃 烧时产生各色火焰有本质区别,它利用的是元素的物理性质。
⑶一般只有少数金属才能发生焰色反应。
【高考试题】 1. NaH是一种离子化合物,它跟水反应的方程式为: 6. 将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量( n)和通入 7. 钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为 Na (l) + KCl (I) NaCl (l) + K (g); △ H> 0 各物质的沸点与压强的关系见下表。 压强(kPa) 13.3353.32101.3 K的沸点(O590710770 Na的沸点(O700830890 KCl的沸点(O1437 NaCl的沸点(O1465 ⑴在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ____________ ,而反应 的最高温度应低于__________________ 。 ⑵在制取钾的过程中,为了提高原料的转化率可以采取的措施是__________________________________ < &已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置 进行实验。 主要步骤如下: ①按图组装仪器,并检查装置的气密性 NaH + H 20 = NaOH + H 2?,它也能 跟液氨、乙醇等发生类似的反应,并都产生氢气。 A .跟水反应时,水作氧化剂 C.跟液氨反应时,有NaNH2生成 2. 下列物质中属于离子化合物的是 A .苛性钾B.碘化氢 3. 下列物质中不会因见光而分解的是 A. NaHCO3 B. HNO3 4. 下列有关碱金属铷(Rb)的叙述中,正确的是 A .灼烧氯化铷时,火焰有特殊颜色 C.在钠、钾、铷三种单质中,铷的熔点最高 5. 在医院中,为酸中毒病人输液不应采用 A. 0.9%氯化钠溶液 C. 1.25 %碳酸氢钠溶液 F列有关NaH的叙述错误的是 B. NaH中H「半径比Li +半径小 D .跟乙醇反应时,NaH被氧化 C. 硫酸 D .醋酸 C. Agl D. HClO B. 硝酸铷是离子化合物,易溶于水 D .氢氧化铷是弱碱 B. 0.9 %氯化铵溶液 D. 5%葡萄糖溶液 C D A B