
初二数学期末复习讲义(第三章)
一、课前导学(知识点在报纸上整理)
1.下列给出的条件中,能判定四边形ABCD为平行四边形的是()A.AB=CD,CD=DA;B.AB∥CD,AD=BC;
C.AB∥CD,∠A=∠C;D.∠A=∠B,∠C=∠D.
2. 给出下列判断:①一组对边平行,另一组对边相等的四边形是平行四边形.②对角线相等
的四边形是矩形.③对角形互相垂直且相等的四边形是正方形.④有一条对角线平分一个内角的平行四边形为菱形.其中,不正确的有()
(A) 1个(B) 2个(C) 3个(D) 4个
3.□ABCD的周长为60cm,其对角线交于O点,若△AOB的周长比△BOC的周长多10cm,AB= ,BC=
4.□ABCD中,对角线AC和BD相交于O,AC=12、BD=10、AB=m,那么m的取值范围是______
5.在矩形ABCD中,AB=3cm,BC=4cm,则对角线BD的长为_______;点A到对角线BD的距离为_______.
6.若菱形的周长为20,一条对角线长为6,则菱形的面积为________。
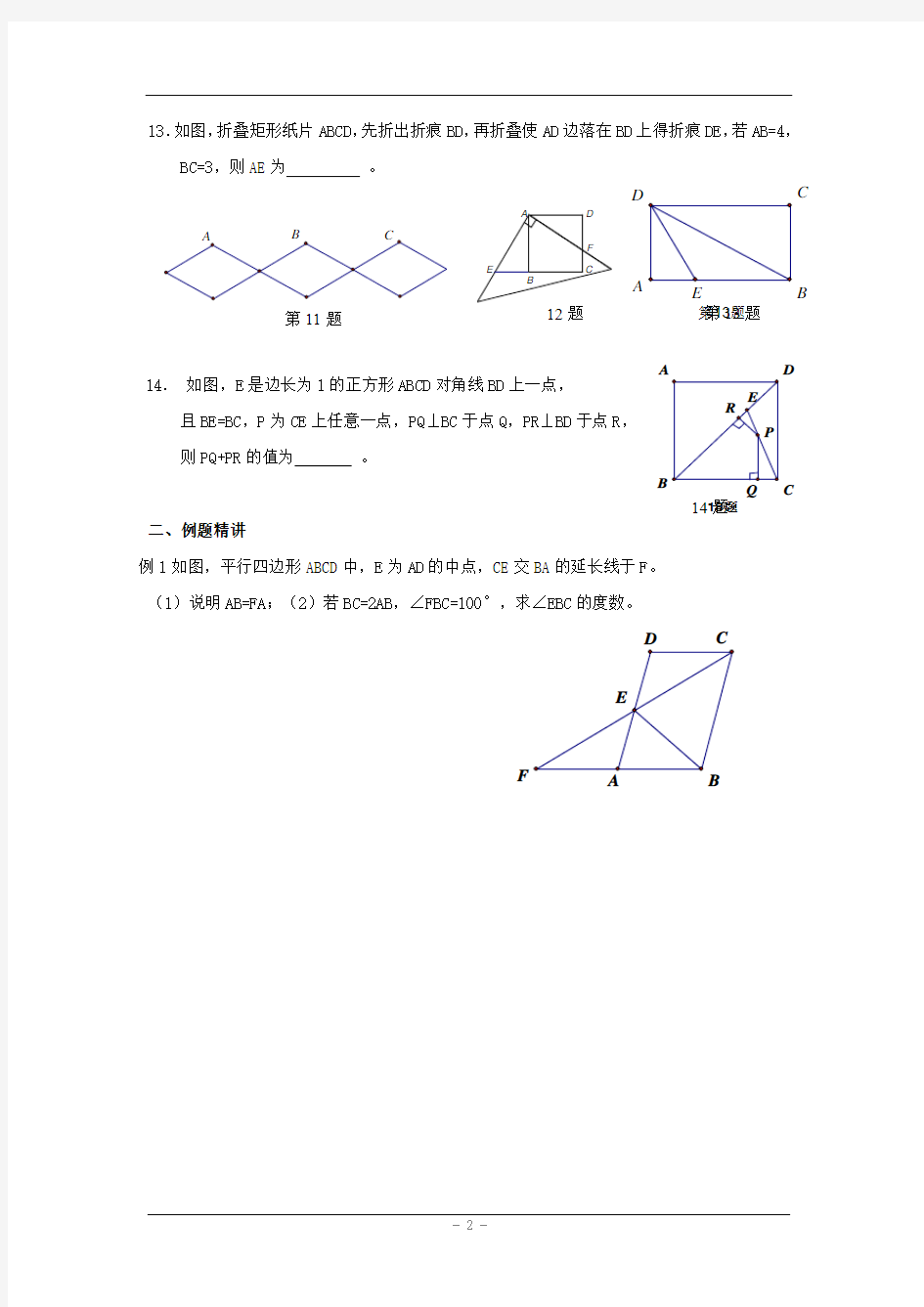
7.菱形的周长为16,两邻角的度数之比为2:1,则该菱形的面积是.8.如果△ABC的三条中位线分别为3cm,4cm,6cm,那么△ABC的周长为cm 9.一个等腰梯形的周长是80cm,高是12cm,并且腰长与中位线长相等,则这个梯形的
cm。
面积是2
10.四边形的两条对角线长分别为24cm和32cm,顺次连接其各边中点所得的四边形是,它的周长是 cm。
11.如图是一个利用四边形的不稳定性作的菱形晾衣架。已知其中每个菱形的边长为20cm,墙上悬挂晾衣架的铁钉A、B之间的距离为203cm,则∠1等于。
12.如图,有一块边长为4的正方形塑料模板ABCD,将一块足够大的直角三角板的直角顶点落在A点,两条直角边分别与CD交于点F,与CB延长线交于点E.则四边形AECF 的面积是.
13.如图,折叠矩形纸片ABCD ,先折出折痕BD ,再折叠使AD 边落在BD 上得折痕DE ,若AB=4,
BC=3,则AE 为 。
14. 如图,E 是边长为1的正方形ABCD 对角线BD 上一点,
且BE=BC ,P 为CE 上任意一点,PQ ⊥BC 于点Q ,PR ⊥BD 于点R , 则PQ+PR 的值为 。
二、例题精讲
例1如图,平行四边形ABCD 中,E 为AD
的中点,CE 交BA 的延长线于F 。 (1)说明AB=FA ;(2)若BC=2AB ,∠FBC=100°,求∠EBC 的度数。
A B
C
D E
F
12题
F
E
D C
A B
第13题E
B
D
C
A
第13
题 第11题
C
B
A
18题Q R
E D
A
B
C
P
14题
例2.如图在△ABC 中,O 是AC 上的一个动点,过O 点作直线MN//BC ,设MN 交∠BCA 的平分线于点E ,交∠BCA 的外角平分线于点F 。 (1)试说明:OE=OF 。
(2)当O 点运动到何处时,四边形AECF 是矩形?并证明你的结论。 (3)若AC 边上存在点O ,使四边形AECF 是正方形且2
6
BC AE ,则∠B =___________ (只写答案,不写解题过程)
例3.在直角梯形ABCD 中,∠B=90°,AD ‖BC,且AD=4cm,AB=6cm,DC=10cm 。若动点P 从A 点出发,以每秒4cm 的速度沿线段AD 、DC 向C 点运动;动点Q 从C 点出发以每秒5cm 的速度沿CB 向B 点运动. 当Q 点到达B 点时,动点P 、Q 同时停止运动. 设点P 、Q 同时出发,并运动了t 秒, (1)直角梯形ABCD 的面积为 cm 2.
(2)当t = 秒时,四边形PQCD 成为平行四边形? (3)当t = 秒时,AQ =DC ;
(4)是否存在t ,使得P 点在线段DC 上且PQ ⊥DC ? 若存在,求出此时t 的值,若不存在,说明理由.
A
B
C
D
P Q
A N
F
C
O
E B
M
高一化学必修一第三章化学方程式归纳 一、钠及其化合物 1.钠与氧气:常温: 点燃: 2.钠与水反应: 离子方程式: 3.钠与硫酸反应: 4.氧化钠与水反应: 5.过氧化钠与二氧化碳反应: 6.过氧化钠与水反应: 离子方程式: 7.NaOH溶液中通入少量CO2: 离子方程式: NaOH溶液中通入过量CO2: 离子方程式: 8.①向碳酸钠溶液中滴入少量稀盐酸: 向稀盐酸中滴入少量碳酸钠溶液: ②除去碳酸氢钠溶液中混有的碳酸钠: ③碳酸钠与氢氧化钙: ④碳酸氢钠与盐酸: ⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: 少量氢氧化钙溶液滴入碳酸氢钠溶液中: ⑥除去碳酸钠溶液中的碳酸氢钠: ⑦除去碳酸钠固体中的碳酸氢钠:
⑧鉴别碳酸钠和碳酸氢钠溶液: 二、铝及其化合物 1.铝与氧气的反应: 2.铝与氧化铁反应(铝热反应): 3.铝和稀盐酸: 离子方程式: 4.铝和NaOH溶液: 离子方程式: 5.氧化铝和稀硫酸: 离子方程式: 6.氧化铝和NaOH溶液: 离子方程式: 7.氢氧化铝和盐酸: 离子方程式: 8.氢氧化铝和NaOH溶液: 离子方程式: 9.氢氧化铝受热分解: 10.硫酸铝与氨水反应: 离子方程式: 11.AlCl3溶液中加入少量NaOH溶液: AlCl3溶液中加入过量NaOH溶液:12.往偏铝酸钠溶液中通入少量CO2:
往偏铝酸钠溶液中通入足量CO2: 13.电解氧化铝: 三、铁及其化合物 1.铁与氧气反应: 铁与硫反应: 2.铁与盐酸反应: 离子方程式: 铁与CuSO4溶液: 离子方程式: 3.铁和水蒸气: 4.氧化亚铁与盐酸反应: 离子方程式: 5.氧化铁与盐酸反应: 离子方程式: 6.CO还原氧化铁: 7.氯化铁与氢氧化钠溶液: 离子方程式: 8.硫酸亚铁与氢氧化钠溶液: 离子方程式: 9.氢氧化铁加热分解: 10.氢氧化亚铁被氧化成氢氧化铁: 11.除去FeCl2中的FeCl3: 离子方程式: 12.FeCl2和Cl2反应: 离子方程式:
8年级下学期数学讲义05 ( 第九章中心对称图形) 知识点: 9.1 图形的旋转 1.一个图形和它经过旋转所得到的图形中,对应点到旋转中心距离相等,两组对应点分别与旋转中心连线所成的角相 等。 9.2 中心对称和中心对称图形 2.成中心对称的两个图形中,对应点的连线经过对称中心,且被对称中心平分。 9.3 平行四边形 3.平行四边形的对边相等、对角相等、对角线互相平分。 4.一组对边平行且相等的四边形是平行四边形;两组对边分别相等的四边形是平行四边形;对角线互相平分的四边形 是平行四边形。 9.4 矩形、菱形、正方形 5.矩形的四个角都是直角,对角线相等。三个角是直角的四边形是矩形;对角线相等的平行四边形是矩形。 6.菱形的四条边相等,对角线互相垂直。四边相等的四边形是菱形;对角线互相垂直的平行四边形是菱形。 7.有一组领边相等的矩形是正方形;有一个角是直角的菱形是正方形。 9.5 三角形的中位线 8.三角形的中位线平行于第三边,并且等于第三边的一半。 9.1 图形的旋转 试题 1.(2013?南昌)如图,将△ABC绕点A逆时针旋转一定角度,得到△ADE.若∠CAE=65°,∠E=70°,且 AD⊥BC,∠BAC的度数为() 2.(2013?河池)如图(1),已知两个全等三角形的直角顶点及一条直角边重合.将△ACB绕点C按顺时针方向旋转到△A′CB′的位置,其中A′C交直线AD于点E,A′B′分别交直线AD、AC于点F、G,则在图(2)中,全等三角形共有() 3.(2011?哈尔滨)如图,在Rt△ABC中,∠BAC=90°,∠B=60°,△AB′C′可以由△ABC绕点A顺时针旋转90°得到(点B′与点B是对
2015.12 必修一第三章测试题 化学 相对原子质量:Na 23 Al 27 Fe 56 Cu 64 H 1 O 16 C 12 S 32 Cl 35.5 一、选择题(每小题只有一个选项符合题意,每题3分,共54分) 1错误!未指定书签。.在实验室中,通常将金属钠保存在() A.水中B.煤油中C.四氯化碳中D.汽油中 2.人的胃液是一种强酸性液体,pH在0.9~1.5之间,氢氧化铝是一种治疗胃液过多的胃药的主要成分.目前这种胃药已不常用,原因主要是() A.长期摄人铝元素不利于人体健康B.它不能中和胃液 C.它不易溶于胃液D.它的疗效太差 3.向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是()A.Cl-B.H+C.OH-D.HCO3- 4.将一小粒钠投入下列溶液中,能产生气体和沉淀的是() A.NaCl B.BaCl2C.H2SO4D.CuCl2 5.将Na2O2投入FeCl2溶液中,可观察到的实验现象是() A.有白色沉淀生成B.有红棕色沉淀生成 C.没有沉淀生成D.既有红褐色沉淀生成又有无色气体产生6.将钠、镁、铝各0.3mol 分别放入100mL 1 mol/L 的盐酸中,同温同压下产生的气体体积比是() A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1 7.分别与FeCl2、CuSO4、NaCl、Fe2(SO4)3、MgSO4等溶液混合时产生的现象各不相同的是( ) A.盐酸 B.氨水 C.氯化钡溶液 D. 硫酸钠溶液 8.相同条件下将干燥的88g CO2通过装有Na2O2的干燥管后,气体质量变为60g,则反应后的气体中CO2的质量为() A.24g B.34g C.44g D.54g 9. 将锌、铁、铝、镁四种金属中的两种组成的混合物10g与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是() A.锌B.铁C.铝D.镁 10.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是() ①NaHCO3 ②Al2O3 ③Al(OH)3④Al A.③④B.②③④C.①③④D.全部 11.下列离子方程式书写正确的是()
中心对称及中心对称图形专题讲义 一、基本概念: 1.图形的旋转: ⑴.定义:在平面内,将一个图形绕一个定点旋转一定的角度,这样的图形变换称为图形的旋转。 这个定点称为旋转中心。 旋转的角度称为旋转角。 如果图形上的点P经过旋转变为P',那么这两点叫做这个旋转的对应点。 2.性质: 由实验还可得出如下结论: ①.旋转前、后的图形全等。 ②.对应点到旋转中心的距离相等。 ③.每一对对应点与旋转中心的连线所成的角彼此相等。 例1.已知线段AB和点O,画出AB绕点O逆时针旋转100°后的图形。 3. 中心对称: 把一个图形绕着某一个点旋转180°,如果它能够与另一个图形重合,那么就说这两个图形关于这个点对称或中心对称,这个点叫做对称中心. 这两个图形中的对应点叫做关于中心的对称点。 关于中心对称的两个图形是全等形。 4.中心对称的性质: 有一个对称中心点;成中心对称的两个图形,对称点的连线都经过对称中心,并且被对称中心平分;中心对称的两个图形具有(一般地)旋转的一切性质。5.中心对称图形: 平面内,如果把一个图形绕着某一点旋转180°后能与自身重合,那么这个图形叫做中心对称图形。这个点就是它的对称中心。. 6.中心对称图形: 中心对称图形上的每一对对应点所连成的线段都被对称中心平分。 7.中心对称与中心对称图形之间的关系: 区别: (1)中心对称是指两个图形的关系,中心对称图形是指具有某种性质的图形。(2)成中心对称的两个图形的对称点分别在两个图形上,中心对称图形的对称点在一个图形上。 联系: 若把中心对称图形的两部分看成两个图形,则它们成中心对称;若把中心对称的两个图形看成一个整体,则成为中心对称图形。 8.轴对称图形与中心对称图形:
中心对称图形(一)知识点 一.图形旋转 1.图形旋转的有关概念:图形的旋转、旋转中心、旋转角; 在平面内,将一个图形一个定点转动一定的角度,这样的图形运动称为图形的旋转。这个定点称为旋转中心,旋转的角度称为旋转角。 注意点:旋转角通常与旋转方向有关,因此在写旋转角时通常要说明旋转方向。 2.旋转图形的性质: (1)旋转前、后的图形全等。 (2)对应点到旋转中心的距离相等。 (3)每一对对应点与旋转中心的边线所成的角彼此相等。 二.中心对称 1.中心对称的有关概念:中心对称、对称中心、对称点 把一个图形绕着某一点旋转180°,如果它能够与另一个图形重合,那么称这两个图形关于这点对称,也称这两个图形成中心对称,这个点叫做对称中心,两个图形中的对应点叫做对称点。 2.中心对称的基本性质: (1)成中心对称的两个图形具有图形旋转的一切性质。 (2)成中心对称的两个图形,对称点连线都经过对称中心,并且被对称中心平分。 三.中心对称图形 1.中心对称图形的有关概念:中心对称图形、对称中心 把一个平面图形绕某一点旋转180°,如果旋转后的图形能够和原来的图形互相重合,那么这个图形叫做中心对称图形。这个点就是它的对称中心。 2.中心对称与中心对称图形的区别与联系 如果将成中心对称的两个图形看成一个图形,那么这个整体就是中心对称图形;反过来,如果把一个中心对称图形沿着过对称中心的任一条直线分成两个图形,那么这两个图形成中心对称。 3.图形的平移、轴对称(折叠)、中心对称(旋转)的对比 1.定义: 两组对边分别平行的四边形叫做平行四边形。 2.性质:(边、角、对角线) (1)平行四边形的对边相等。 (2)平行四边形的对角相等。 (3)平行四边形的对角线互相平分。 3.判定: (1)两组对边分别平行的四边形是平行四边形。 (2)一组对边平行并且相等的四边形是平行四边形。 (3)两条对角线互相平分的四边形是平行四边形。 (4)两组对边分别相等珠四边形是平行四边形。 五.矩形 1.定义:
金属及其化合物 前言: 1.金属元素在元素周期表中的位置在左边以及左下方; 2.金属元素最外层电子数一般小于4,比同一周期非金属元素原子半径大。 3.主要化合价为+1 +2 +3少数为+4 4.通常只能失去电子不能得到电子(还原剂) 分类1.黑色金属有色金属。黑色:铁锰铬 2. 轻金属重金属。密度cm3为界限。 ¥ 3.常见金属和稀有金属(锆) 金属中唯一的液态金属:汞。 一、钠及其化合物 1、(1)钠的物理性质:银白色、质软、比水轻、熔点低 (2)钠的化学性质: 与非金属反应:2Na+Cl2点燃 2NaCl (白烟) 2Na+S==Na2S 与O2反应:缓慢氧化:4Na+O2== 2Na2O (白色固体) ! 剧烈燃烧:2Na+O2== Na2O2(淡黄色固体) 与H2O 反应:2Na+2H2O==2NaOH+H2↑ (2Na+2H2O==2Na++2OH―+H2↑) 与酸反应:2Na+2H+==2Na++H2↑ 与盐溶液反应:(先与水作用生成NaOH,NaOH再与盐发生复分解反应) 2Na+2H2O+CuSO4 ==C u(O H)2↓+Na2SO4 +H2↑ 6Na+6H2O+2FeCl3==2F e(O H)3↓+6NaCl+3H2↑ 2Na+2NH4Cl===2NaCl+2NH3↑+H2↑ 《 与熔融盐:4Na+TiCl4△ 4NaCl+Ti 钠与氢气的反应:2Na + H2 == 2NaH。NaH + H2O == NaOH + H2 ↑;NaH是强的还原剂。 2、氧化钠与过氧化钠
3、碳酸钠钠的盐
(3)工业制钠:电解熔融的NaCl,2NaCl(熔融) == 2Na + Cl2↑。 (4)钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等; ②钠钾合金是快中子反应堆的热交换剂; ③钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强 注意几个实验的问题: 1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。 2、Na2CO3溶液与稀HCl的反应①向Na2CO3溶液中滴加稀HCl,先无气体,后有气体,如果n(HCl)小于n(Na2CO3)时反应无气体放出。发生的反应:先①Na2CO3 + HCl == NaCl + NaHCO3,后②NaHCO3 + HCl == NaCl + H2O +CO2 . ②向稀HCl中滴加Na2CO3溶液,先有气体,反应是:Na2CO3 + 2HCl == 2NaCl + H2O + CO2. 如果用2mol的Na2CO3和的稀HCl反应,采用①方法放出CO2是;采用②方法放出CO2为。希望同学们在解题时要留意。 3、Na2CO3溶液和NaHCO3溶液的鉴别:取两种试液少量,分别滴加CaCl2或BaCl2溶液,有白色沉淀的原取溶液为Na2CO3,另一无明显现象的原取溶液为NaHCO3。 4、侯氏制碱法 反应式:NaCl + NH3 + CO2 + H2O == NaHCO3 ↓+ NH4Cl. 注意:在生产中应先在饱和的NaCl溶液中先通入NH3,后通入CO2,NaHCO3晶体析出过滤,在滤液中加入NaCl细末和通NH3析出NH4Cl晶体为副产品。NH4Cl晶体析出后的母液进行循环试用,提高原料的利用. ! 二、镁及其化合物 1、镁的性质 (1)物理性质:镁是银白色金属,质较软,密度cm3,是轻金属,硬度小。
高中化学必修一(第三章)知识点全归纳 第三章金属及其化合物 第一节金属的化学性质 1.金属的物理通性有哪些? (1)金属在常温下的状态 除汞是液体外,其他在常温下是固体。 (2)金属的颜色、光泽 绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。 (3)良好的导电、导热性。 (4)延展性 延性:拉成细丝的性质。展性:压成薄片的性质。 2.化学通性有哪些? (1)化合态金属元素只有正化合价 (2)金属单质易失电子,表现还原性 (3)易与氧气反应,得到氧化物 (4)活动性排在氢前的金属元素与酸反应得到盐和氢气 (5)与盐反应,置换出活动性弱的金属单质 3.金属钠的性质有哪些? (1)物理性质有哪些? 钠银白色、质软、熔点低、密度比水的小但比煤油的大。★ (2)化学性质有哪些? ①很活泼,常温下:4Na + O2=2Na2O★(新切开的钠放在空气中容易变暗) ②加热条件下:2Na+O2 Na2O2
★(先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体Na 2O 2。) 钠在空气中的变化过程:Na―→Na 2O―→NaOH―→Na 2 CO 3 ·10H 2 O(结晶)―→Na 2 CO 3 (风化),最终得到是一种白色粉末。一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴 (NaOH易潮解),最终变成白色粉未(最终产物是Na 2CO 3 )。 ③钠与水的反应与H 2 O反应 2Na+2H2O=2NaOH+H2↑★离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平) 实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。“浮——钠密度比水小;游——生成氢气; 响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。 知识拓展: a:将钠放入硫酸铜溶液中,能否置换出铜单质? 不能,2Na + 2H2O = 2NaOH + H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出 K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应 b:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应? 2Na+2HCl=2NaCl+H2↑ 钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应。 一般规律: 钠与酸溶液反应时,钠直接与溶液中的酸反应,但当钠与其它溶液反应时,一般是钠先与水反应生成氢氧化钠和氢气,然后再看生成的氢氧化钠是否与原溶液中的溶质反应! (3)钠的保存方法是什么?
中心对称及中心对称图 形专题讲义 TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-
中心对称及中心对称图形专题讲义 一、基本概念: 1.图形的旋转: ⑴.定义:在平面内,将一个图形绕一个定点旋转一定的角度,这样的图 形变换称为图形的旋转。 这个定点称为旋转中心。 旋转的角度称为旋转角。 如果图形上的点P经过旋转变为P',那么这两点叫做这个旋转的对应 点。 2.性质: 由实验还可得出如下结论: ①.旋转前、后的图形全等。 ②.对应点到旋转中心的距离相等。 ③.每一对对应点与旋转中心的连线所成的角彼此相等。 例1.已知线段AB和点O,画出AB绕点O逆时针旋转100°后的图形。 3. 中心对称: 把一个图形绕着某一个点旋转180°,如果它能够与另一个图形重合,那 么就说这两个图形关于这个点对称或中心对称,这个点叫做对称中心.这两个图形中的对应点叫做关于中心的对称点。 关于中心对称的两个图形是全等形。 4.中心对称的性质: 有一个对称中心点;成中心对称的两个图形,对称点的连线都经过对称中心,并且被对称中心平分;中心对称的两个图形具有(一般地)旋转的一切性质。 5.中心对称图形: 平面内,如果把一个图形绕着某一点旋转180°后能与自身重合,那么这个图形叫做中心对称图形。这个点就是它的对称中心。 6.中心对称图形: 中心对称图形上的每一对对应点所连成的线段都被对称中心平分。 7.中心对称与中心对称图形之间的关系: 区别: (1)中心对称是指两个图形的关系,中心对称图形是指具有某种性质的图形。(2)成中心对称的两个图形的对称点分别在两个图形上,中心对称图形的对称 点在一个图形上。 联系:
八年级数学《中心对称图形一》复习学案 班级 姓名 一、知识点回顾: (一)图形的旋转 (二)中心对称与中心对称图形 (三)中心对称的性质:1、成中心对称的两个图形 。 2、成中心对称的两个图形,对称点连线都经过 ,并且 被 。 (四)轴对称与中心对称的区别: 1、轴对称是指一个图形沿某 对折,如果它能和另一个图形重合,那么称这两个图形成轴对称。 中心对称是指一个图形绕某 旋转 ,如果它能和另一个图形重合,那么称这两个 图形成中心对称图形。 2、轴对称图形有对称 ,中心对称图形有对称 。 (五)轴对称与中心对称作图题: 二、例题:请在下图中作出△关于x 轴的对称图形△A1B1C1,再作出△关于原点的对称图形△A2B2C2,问△A1B1C1与△A2B2C2有怎样的位置关系? y C A B
三、常见中心对称图形的定义、性质及判定: (一)平行四边形 1、平行四边形的定义:叫做平行四边形。 2、平行四边形的性质:①平行四边形的边之间的关系:对边位置关系:对边数量关系: ②平行四边形的角之间的关系:对角,邻角。 ③平行四边形的对角线之间的关系:。④平行四边形的对称性:平行四边形是对称图形,不是对称图形,对称中心是。⑤平行四边形的面积计算方法:(1)底×高(2)一条对角线分平行四边形所得的两三角形的面积之和,分得的两三角形关系是。(3)两条对角线分平行四边形所得的四个三角形的面积之和,分得的这四个三角形的面积关系是。 3、平行四边形的判定: (1)从边之间的关系考虑:①从两组对边之间位置关系考虑: 的四边形是平行四边形。②从两组对边之间数量关系考虑: 的四边形是平行四边形。
高一化学必修一第三章单元练习题 、选择题 1.将金属钠投入 AICI 3溶液中,下列有关叙述一定正确的是 ( ) A ?最后一定有沉淀生成,且有气体放出 B ?溶液最后一定澄清,且有气体放出 C . 一定有气体放出 D .一定无气体放出 2?将钠和碳分别置于如图所示的两个盛满足量氧气的集气瓶中燃烧完毕后,同时打开 装置中的两个止水夹,这时观察到 ( ) A .水进入左瓶 B .水进入右瓶 C .水同时进入两瓶 D .水不进入任何一瓶 3?向含有下列离子的溶液中加入一小块金属钠,引起离子数目减少的是 A . C03 一 B . C 「 C . OH 一 D . HCO 3 4. 向500 mL 1 mol/L FeCI 3溶液中加 入铁粉,完全反应后,除去多余的铁粉,加入足量 的NaOH 溶液,搅拌,充分反应后,所得沉淀的物质的量是 ( ) B . 1 mol D .不能确定 5. 镁、铝、铜三种金属粉末混合物,加入过量盐酸充分 反应,过滤后向滤液中加入过 量烧碱溶液,再过滤,滤液中存在的离子有 ( ) 2 + B . Cu 2 2 + D . Mg 2 KSCN 溶液,显红色的是( ) B .过量的铁粉与氯化铜溶液 D .过量铁粉与三氯化铁溶液 7.能分别将含有Cu 2+ > Fe 3*、Al 3: Mg"、Fe 2 + > NH 4、Na + 等离子的七种溶液一次 性鉴别开来 的试剂是( ) A . NaHCO 3 溶液 C . KSCN 溶液 D . NH 3 H 2O &可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是 A . 0.5 mol C . 0.75 mol A . AIO 2 3+ C . Al 6.下列各组物质反应后,滴入 A .过量的铁与稀盐酸 C .过量氯水与氯化亚铁溶液 B . NaOH 溶液
第三章复习 一. 金属的物理性质: 钠:银白色,有金属光泽,质软,密度小于水,大于煤油,熔点低,电和热的良导体。 铝:银白色,有金属光泽,质软,有良好的延展性,是热和电的良导体。 铁:纯铁是银白色的有金属光泽的固体,有磁性,可以被磁铁吸引,有延展性,是电和热的良导体。 考点:1.钠与氧气反应;钠与水反应离子方程式、现象。 2. 铝与酸碱的反应离子方程式、计算。 3. 铁与水蒸气反应、实验。 典型例题:1、将Na、Mg、Al各0.3mol分别放入100ml1mol/L 的盐酸中,同温同压下产生的气体体积比是(C )
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1 解析:钠与稀硫酸、盐酸等非氧化性酸反应时,首先是钠直接跟 H + 反应,过量的钠再与水反应。 2. 金属钠露置在空气中最后生成什么物质?用图表示之。 提示: Na 2CO 3。 Na ――→O 2Na 2O ――→H 2O NaOH 溶液――→CO 2 Na 2CO 3·10H 2O ―→Na 2CO 3 3、在盛有5mL 饱和石灰水的试管中放入一小块块钠,不可能观察到的现象是 (C ) A.钠熔成小球并在液面上游动 B.有气体生成 C.试管底部有银白色物质生成 D.溶液变浑浊 4. 相同质量的铝,分别与足量的强酸、强碱反应,产生氢气体积比为 1:1 . 5. 某无色溶液中放入铝片后有氢气放出,则下列离子在该溶液中肯定可以大量共存的是( A ) A.Na + B.Mg 2+ C.S 2- D.HCO 3- 6. 如图在玻璃管中放入还原铁粉和石 棉绒的混合物.加热并通入水蒸气.用试管收集产生的经干燥的气体,并靠近火焰点火。 (1)所观察到的现象是点火时听到爆鸣声 ,有关反应的化学方程式是 3Fe+4H 2O===Fe 3O 4+4H 2 。 (2) 干燥管内可装入的试剂是CaCl 2,其作用是干燥氢气。干燥管还可用U 形管(装置)代替。 (3) 玻璃管中石棉绒的作用是作载体,增大铁粉与水蒸气接触面 积 。实验开始时应先点燃酒精灯 ,实验结束时,应先熄灭
高中化学必修一第三章知识点 ,,,xx金属及其化合物是高中化学必修一第三章的知识点,你都掌握了吗?接下来我为你整理了,一起来看看吧。第一节金属的化学性质一、钠 Na1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。2、单质钠的化学性质:①钠与O2反应常温下:4Na + O2=2Na2O 新切开的钠放在空气中容易变暗加热时:2Na + O2==Na2O2 钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2。Na2O2中氧元素为-1价,Na2O2既有氧化性又有还原性。 2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2Na2O2是呼吸面具、潜水艇的供氧剂,Na2O2具有强氧化性能漂白。②钠与H2O反应2Na+2H2O=2NaOH+H2↑离子方程式:2Na++2H2O=2Na++2OH-+H2↑注意配平实验现象:“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。③钠与盐溶液反应如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH 与H2,再和CuSO4溶液反应,有关化学方程式: 2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=CuOH2↓+Na2SO4总的方程式: 2Na+2H2O+CuSO4=CuOH2↓+Na2SO4+H2↑实验现象:有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应④钠与酸反应:2Na+2HCl=2NaCl+H2↑反应剧烈离子方程式:2Na+2H+=2Na++H2↑3、钠的存在:以化合态存在。 4、钠的保存:保存在煤油或石蜡中。 5、钠在空气中的变化过程:
第三章金属及其化合物 第一节金属的化学性质 【学习导引】 一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。 二、金属的化学性质: 【学习导引】 认真观察反应,记录现象,分析整理得到金属的性质。 1.(1)钠常常保存在__________或__________中。取一小块金属钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,可以看到钠表面呈现__________。很快,钠表面生成__________,化学方程式为____________________________________。 (2)把这一小块钠放在坩埚中加热。钠受热后,与氧气________________,发出 ___________,生成___________,化学方程式为_______________________________。2.通过前面的学习,我们已经知道________________在空气中易与氧气反应,表面生成一层氧化物。其中有的氧化膜致密,例如镁、铝表面的氧化膜,可以保护______不被继续氧化。因此,铝具有很好的抗腐蚀性能。 3.(1)分析学过的金属与氧气反应的化学方程式,找出其中的氧化剂和还原剂。 (2)分析上述反应,可以发现金属单质表现出______,这是因为金属元素的______,______, 当遇到______时,就会发生氧化还原反应。 (3)因此,除了能被氧气氧化外,金属还能被______等具有氧化性的物质所氧化。 【同步练习】 1.从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是( ) A.Na B.NaCl C.NaOH D.Na2O 2.实验室中常用的保存少量Na的方法是( ) A.保存在水中B.保存在煤油中 C.直接放置在空气中D.铝箔密封,保存在广口瓶中 3.取一块金属钠放在燃烧匙里加热,下列实验现象描述正确的是( ) ①金属很快熔化②燃烧后得白色固体③燃烧时火焰为黄色④燃烧后生成浅黄色固 体物质 A.①②③B.①③④C.②③D.①②③④ 4.铝在空气中能够稳定存在的原因是( ) A.铝的活泼性差B.铝的熔点高 C.铝与氧气不反应D.铝表面有氧化膜 5.下列物质中,一般不能与铁反应的是( ) A.硫B.氯气C.氧气D.氢气 6.下列说法中不正确的是( ) A.钠的熔点较低 B.钠在发生化学反应时化合价升高 C.钠在空气中燃烧生成氧化钠,并发出黄色火焰
中心对称与轴对称 内容分析 理解两个图形关于某一点中心对称的意义.能够区分中心对称与中心对称图形.掌握轴对称、轴对称图形的概念,知道轴对称与轴对称图形区别,会利用有关性质画出已知图形关于某一条直线对称的图形.重点理解相关概念,能够判断出图形特点. 知识结构 模块一:中心对称 知识精讲 1、中心对称的概念 把一个图形绕着一个定点旋转180°后,和另一个图形重合,那么叫做这两个图形关于这点对称,也叫做这两个图形成中心对称,这个点叫做对称中心,这两个图形中的对应点叫做关于中心的对称点. 2、中心对称图形的特征 中心对称是旋转对称的特例,关于中心对称的两个图形能完全重合.关于中心对称的两个图形,对称点的连线都经过对称中心并且被对称中心平分,关于对称中心的两个图形,对应线段平行(或在一条直线上)且相等;反过来,如果两个图形的对应点连接成的线段都经过某一点并且被该点平分,那么这两个图形一定关于这点成中心对称,这给我们提供了判断某两个图形是否成中心对称的方法.
2/ 23 3、中心对称与中心对称图形的区别与联系 中心对称是两个图形而言的,指两个图形间的关系;而中心对称图形是对一个图形而言的,指一个图形的两个部分之间的关系.成中心对称的两个图形的对称点分别在两个图形上,中心对称图形的对称点在一个图形上.若把中心对称图形的两个部分看成两个图形,则它们成中心对称,若把中心对称的两个图形看作一个整体,则成中心对称图形. 【例1】下列图案都是由字母“m”经过变形、组合而成的.其中不是中心对称图形的是(). A B C D 【难度】★ 【答案】B 【解析】根据中心对称图形的概念可知,D C A、 、均是中心对称图形. 【总结】本题考查了中心对称图形的定义. 【例2】在下列四个汽车标志图案中,是中心对称图形的是() A B C D 【难度】★ 【答案】B 【解析】根据中心对称图形的概念可知,中心对称图形是图形沿对称中心旋转 180后与原图重合,故选B. 【总结】本题考查了中心对称图形的定义. 例题解析
高一化学必修一第三章单元测试题(含答案及解析) 一、选择题 1.(2010年东北师大附中期末考试)将金属钠投入AlCl3溶液中,下列有关叙述一定正确的是() A.最后一定有沉淀生成,且有气体放出 B.溶液最后一定澄清,且有气体放出 C.一定有气体放出D.一定无气体放出 2.将钠和碳分别置于如图所示的两个盛满足量氧气的集气瓶中燃烧完毕后,同时打开装置中的两个止水夹,这时观察到() A.水进入左瓶B.水进入右瓶 C.水同时进入两瓶D.水不进入任何一瓶 3.向含有下列离子的溶液中加入一小块金属钠,引起离子数目减少的是() A.CO2-3B.Cl- C.OH-D.HCO-3 4.向500 mL 1 mol/L FeCl3溶液中加入铁粉,完全反应后,除去多余的铁粉,加入足量的NaOH溶液,搅拌,充分反应后,所得沉淀的物质的量是() A.0.5 mol B.1 mol C.0.75 mol D.不能确定 5.镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有() A.AlO-2B.Cu2+ C.Al3+D.Mg2+ 6.下列各组物质反应后,滴入KSCN溶液,显红色的是() A.过量的铁与稀盐酸B.过量的铁粉与氯化铜溶液 C.过量氯水与氯化亚铁溶液D.过量铁粉与三氯化铁溶液 7.能分别将含有Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH+4、Na+等离子的七种溶液一次性鉴别开来的试剂是() A.NaHCO3溶液B.NaOH溶液 C.KSCN溶液D.NH3·H2O 8.可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是() A.加热时无气体放出 B.滴加盐酸时有气泡放出 C.溶于水后滴加稀BaCl2溶液有白色沉淀生成 D.溶于水后滴加澄清石灰水有白色沉淀生成 9.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是() ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中 A.②③①④B.③②①④ C.③①②④D.①②③④ 10.把4.6 g钠放入200 mL 0.1 mol/L AlCl3溶液中,待其充分反应后,下列叙述中错误的是() A.Cl-的浓度几乎不变B.溶液变浑浊 C.溶液中存在Al3+D.溶液中存在最多的离子是Na+
平行四边形 重点: 1、以中心对称为主线,研究平行四边形的性质; 2、能运用平行四边形的性质解决实际问题 3、在探索问题、解决问题的过程中,发展探究意识和有条理的表达问题的能力。 1、已知□ABCD ,分别以BC 、CD 为边向外等边△BCE 和△DCF ,则△AEF 是( ) A 、等腰三角形 B 、等边三角形 C 、直角三角形 D 、不等边三角形 2、已知A 、B 、C 三点不在同一条直线上,则以这三点为顶点的平行四边形共有( ) A 、1个 B 、2个 C 、3个 D 、4个 3、□ABCD 中,AC 、BD 相交于点O ,则图中共有全等三角形( ) A 、1对 B 、2对 C 、3对 D 、4对 4、如图,已知点E 为□ABCD 的BC 边上的任意一点,则S △ADE :S □ABCD 的值为( ) A 、 21 B 、31 C 、 4 1 D 、51 5、在□ABCD 中,若∠A=3∠B ,则∠A= ;∠D= 。 若∠A=∠B+∠D ,则∠A= ,∠B= 。 6、如图,在□ABCD 中,AE ⊥BC ,AF ⊥CD ,垂足分别是E 、F ,∠ABE=60°,BE=2cm ,DF=3cm ,则各内角的度数为 ,各边的长为 。 7、如图,点P 是四边形ABCD 边DC 上的一个动点。当四边形满足 时,△PBA 的面积始终不变 8、如图,在□ABCD 中,两邻边AB 、BC 的长度之比是1:2,M 点是大边AD 的中点,则∠ BMC= 。 (第6题) (第7题) (第8题) P D C B A F E D C B A M D C B A E D C B A
高一化学必修一第三章化学方程式总结 一、钠及其化合物 1.钠与氧气:常温: 点燃: 2.钠与水反应: 离子方程式: 3.钠与硫酸反应: 4.氧化钠与水反应: 5.过氧化钠与二氧化碳反应: 6.过氧化钠与水反应: 离子方程式: 7.NaOH溶液中通入少量CO2: 离子方程式: NaOH溶液中通入过量CO2: 离子方程式: 8.①向碳酸钠溶液中滴入少量稀盐酸: 向稀盐酸中滴入少量碳酸钠溶液: ②除去碳酸氢钠溶液中混有的碳酸钠: ③碳酸钠与氢氧化钙: ④碳酸氢钠与盐酸: ⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: 少量氢氧化钙溶液滴入碳酸氢钠溶液中: ⑥除去碳酸钠溶液中的碳酸氢钠: ⑦除去碳酸钠固体中的碳酸氢钠: ⑧鉴别碳酸钠和碳酸氢钠溶液: 1
二、铝及其化合物 1.铝与氧气的反应: 2.铝与氧化铁反应(铝热反应): 3.铝和稀盐酸: 离子方程式: 4.铝和NaOH溶液: 离子方程式: 5.氧化铝和稀硫酸: 离子方程式: 6.氧化铝和NaOH溶液: 离子方程式: 7.氢氧化铝和盐酸: 离子方程式: 8.氢氧化铝和NaOH溶液: 离子方程式: 9.氢氧化铝受热分解: 10.硫酸铝与氨水反应: 离子方程式: 11.AlCl3溶液中加入少量NaOH溶液: AlCl3溶液中加入过量NaOH溶液: 12.往偏铝酸钠溶液中通入少量CO2: 往偏铝酸钠溶液中通入足量CO2: 13.电解氧化铝: 2
三、铁及其化合物 1.铁与氧气反应: 铁与硫反应: 2.铁与盐酸反应: 离子方程式: 铁与CuSO4溶液: 离子方程式: 3.铁和水蒸气: 4.氧化亚铁与盐酸反应: 离子方程式: 5.氧化铁与盐酸反应: 离子方程式: 6.CO还原氧化铁: 7.氯化铁与氢氧化钠溶液: 离子方程式: 8.硫酸亚铁与氢氧化钠溶液: 离子方程式: 9.氢氧化铁加热分解: 10.氢氧化亚铁被氧化成氢氧化铁: 11.除去FeCl2中的FeCl3: 离子方程式: 12.FeCl2和Cl2反应: 离子方程式: 13.FeCl3和Cu反应: 离子方程式: 14.氯化铁与硫氰化钾溶液反应: 3
平移、旋转、对称复习与练习 知识点1:平移:指在平面内,将一个图形上的所有点都按照某个方向作相同距离的移动,这样的图形运动叫做图形的平移运动,简称平移。平移可以不是水平的。 特征:经过平移,对应线段,对应角分别相等, 对应点所连的线段平行且相等(或共线且相等)。 关键:平移变换不改变图形的形状、大小和方向 ..,平移前后的两个图形是全等形。 平移二要素:平移的方向、距离。 例题: 1.在下列现象中,是平移现象的是() ①方向盘的转动②电梯的上下移动③保持一定姿势滑行④钟摆的运动 A、①② B、②③ C、③④ D、①④ 2.如图,O是正六边形ABCDEF的中心,下列图形中可由△OBC平移得到的是() A、△OCD B、△OAB C、△OAF D、△OEF 知识点2:旋转:在平面内,把一个图形绕点O旋转一个角度的图形变换叫做旋转,点O 叫做旋转中心,旋转的角叫做旋转角。 性质:性质:①对应点到旋转中心的距离相等。②对应点与旋转中心所连线段的夹角等于旋转角。③旋转前、后的图形全等。 旋转三要素:旋转的中心、方向、角度。(注意:三要素中只要任意改变一个 ......,图形就会不一样。) 例题: 1. 将等腰直角△ABC绕直角顶点A按逆时针方向旋转60°后,使点C到点E,点B到点D, 得到△ADE,且AB=1。则EC的长是。 2. 边长为4㎝的正方形ABCD绕它的顶点A旋转180°,顶点B所经过的路线长为 ㎝。 3.如图,已知点O是正三角形ABC三条高的交点,现将△AOB绕点O旋转,使其和△BOC重 合,则至少应旋转() A、60° B、120° C、240° D、360° 知识点3.轴对称、中心对称、中心对称图形及图案的设计 定义:(1)轴对称:如果一个图形沿着一条直线对折,直线两侧的图形能够完全重合,这个图形就是轴对称图形。对称轴:折痕所在的这条直线叫做对称轴。 (2)中心对称:把一个图形绕着某一点旋转180°,如果它能与另一个图形重合,那么就说这两个图形关于这个点对称或中心对称,这个点叫做对称中心,这两个图形的对应点叫做关于中心的对称点。 (3)中心对称图形:把一个平面图形绕某一点旋转180°,如果旋转后的图形能够和原来的图形互相重合,那么这个图形叫做中心对称图形。这个点就是它的对称中心。 ●中心对称 ......之间的关系: ....与中心对称图形 区别:(1)中心对称是指两个图形 ....的关系,中心对称图形是指具有某种性质的图形。(2)成中心对称的两个图形的对称点分别在两个图形上,中心对称图形的对称点在一个图形上。联系:若把中心对称图形的两部分看成两个图形,则它们成中心对称;若把中心对称的两个图形看成一个整体,则成为中心对称图形 . 特征:(1)轴对称:连结对应点的线段被对称轴垂直平分;(2)中心对称图形(针对一个图形)的对称点连线通过对称中心,且被对称中心平分;(3)中心对称的两个图形的对称点连
第三章重点题型剖析 二、本章典型题剖析——滴加顺序不同,实验现象不同 1、 稀Na 2CO 3溶液与稀盐酸间的反应 向Na 2CO 3溶液中逐滴加入稀盐酸,开始时无气体产生,达到一定量后才有气泡冒出,由少到多的过程中依次发生下列反应: Na 2CO 3+HCl==NaCl+NaHCO 3 NaHCO 3+HCl==NaCl+CO 2 ↑+H 2O 向稀盐酸中逐滴加入稀Na 2CO 3溶液立即有气泡冒出,由少到多只发生下列反应: 2HCl+Na 2CO 3==2NaCl+CO 2 ↑+H 2O 2、 稀AlCl 3溶液与稀NaOH 溶液间的反应 向AlCl 3溶液中滴加NaOH 溶液直至过量时发生的反应依次为: Al 3+ +3OH ―==A l (O H )3 ↓ A l (O H )3+OH ―==AlO 2―+2H 2O 现象:白色沉淀逐渐增多,继续加NaOH 溶液沉淀逐渐溶解,直至完全消失。 向NaOH 溶液中滴加AlCl 3溶液至过量时发生的反应依次为: Al 3++4OH ―==AlO 2―+2H 2O Al 3++3AlO 2―+6H 2O ==4A l (O H )3 ↓ 现象:开始时无沉淀,接着产生沉淀,继续滴加AlCl 3溶液,沉淀量不变。 3、 稀NaAlO 2溶液与稀盐酸间的反应: 向盐酸溶液中滴加NaAlO 2溶液,直至过量时发生的反应依次为: 4H + +AlO 2―==Al 3++2H 2O Al 3++3AlO 2―+6H 2O ==4A l (O H )3↓ 现象:开始无沉淀,接着产生白色沉淀,逐渐增多至达到最大值,继续加入NaAlO 2溶液,沉淀量不变。 向NaAlO 2溶液中滴加盐酸直至过量时发生的反应依次为: AlO 2―+H + +H 2O==A l (O H )3↓ A l (O H )3+3H +==Al 3++3H 2O 现象:白色沉淀逐渐增多至最大值,继续加盐酸,沉淀逐渐减少,最后完全消失。 三、本章专题――-有关金属及其化合物的有关计算 1、基本计算方法 (1) 代数方程组法------解决混合物问题的基本方法 例1 将70克由Na 2O 2和Na 2O 组成的混合物跟98克H 2O 充分反应后,所得NaOH 溶液中溶质的质量分数为50%,试分别写出Na 2O 2和Na 2O 跟H 2O 反应的化学方程式,并计算原混合物中Na 2O 2和Na 2O 的质量。 解:设混合物中有Na 2O 2 的物质的量为x mol,Na 2O 的物质的量为y mol 2Na 2O 2+2H 2O==4NaOH+O 2 ↑ 2 4 1 x 2x 0.5x Na 2O + H 2O === 2NaOH y y 2y 由题意可得,78x+62y=70 %50%100*x 5.0*329870)y 2x 2(*40==-++ 解得,x= 0.5 mol y=0.5 mol
D B 旋转 1、旋转的定义:把一个平面图形绕平面内 转动 就叫做图形的旋转。 旋转的三要素:旋转 ;旋转 ;旋转 旋转的基本性质: (1)对应点到 的距离相等。 (2)每一组对应点与旋转中心所连线段的夹角相等都等于 (3)旋转前后的两个图形是 2、 旋转作图基本步骤: ○ 1明确旋转三要素:______________、______________、_______________ ○ 2找出原图形中的各顶点在新图形中的对应点的位置。 ○ 3按原图形中各顶点的排列规律,将这些对应点连成一个新的图形。 3、中心对称:把一个图形绕着某一个点旋转?180,如果它能够与 重合, 那么就说 关于这个点对称或中心对称。这个点叫做对称中心。 性质:(1)中心对称的两个图形,对称点所连线段都经过 ,而且被对称中心 。 (2)中心对称的两个图形是 图形。 4、中心对称图形:把一个图形绕着某一个点旋转?180,如果旋转后的图形能够与 完全重合,那么这个图形叫做中心对称图形。 中心对称、中心对称图形是两个不同的概念,它们既有区别又有联系。 区别:中心对称是针对 图形而言的,而中心对称图形指是 图形。 联系:把中心对称的两个图形看成一个“整体”,则成为 。把中心对称图形的两个部分看成“两个图形”,则它们 。 5、 利用尺规作关于中心对称的图形: ○ 1明确对称中心的位置 ○ 2利用“对应点的连线被对称中心平分”的特性,分别找出原图形中各个关键点的对应点 ○ 3按原图形中各点的次序,将各对应点连接起来 6、点(x ,y )关于x 轴对称后是( , )
点( , )关于y 轴对称后是(-x ,y ) 点(x ,y )关于原点对称后是( , ) 第二部分:例题剖析 例题1、如图,根据要求画图. (1)把△ABC 向右平移5个方格,画出平移的图形. (2)以点B 为旋转中心,把△ABC 顺时针方向旋转90 度,画出旋转后的图形. 例题2、如图,已知P 是正方形ABCD 内一点,PA=1,PB=2, PC=3,以点B 为旋转中心,将△ABP 沿顺时针方向旋转, 使点A 与点C 重合,这时P 点旋转到G 点. (1)请画出旋转后的图形,并说明此时△ABP 以点B 为旋转中心旋转了多少度? (2)求出PG 的长度; (3)请你猜想△PGC 的形状,并说明理由. 第三部分:典型例题 例题1、如图,在画有方格图的平面直角坐标系中,△ABC 的三个顶点均 在格点上. (1)填空:△ABC 是 ________三角形,它的面积等于_______平方单 位; (2)将△ACB 绕点B 顺时针方向旋转90°,在方格图中用直尺画出旋转 后对应的△A′C′B ,则A′点的坐标是(, ),C′点的坐标是( , ). 【变式练习】 1、如图,在平面直角坐标系中,△ABC 的三个顶点坐标分别为A (-2,-1)、 B (-1,1)、 C (0,-2). (1)点B 关于坐标原点O 对称的点的坐标为_______ (2)将△ABC 绕点C 顺时针旋转90°,画出旋转后得到的△A 1B 1C ; (3)求过点B 1的反比例函数的解析式. 2、如图,在由边长为1的小正方形组成的方格纸中,有两个全等的 三角形,即111A B C △和222A B C △. (1)请你指出在方格纸内如何运用平移、旋转变换,将111A B C △重 合到222A B C △上; (2)在方格纸中将111A B C △经过怎样的变换后可以与222A B C △成 中心对称图形?画出变换后的三角形并标出对称中心. 例题2、如图,在Rt △ABC 中,∠ABC=90°,点D 在BC 的延长线上,且BD=AB ,过点B 作BE ⊥AC ,