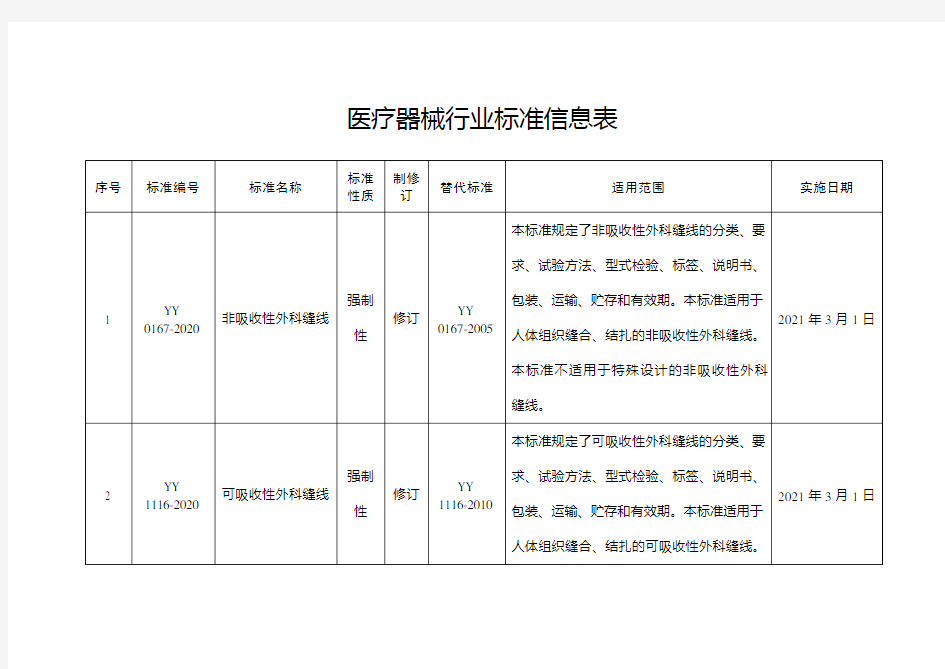
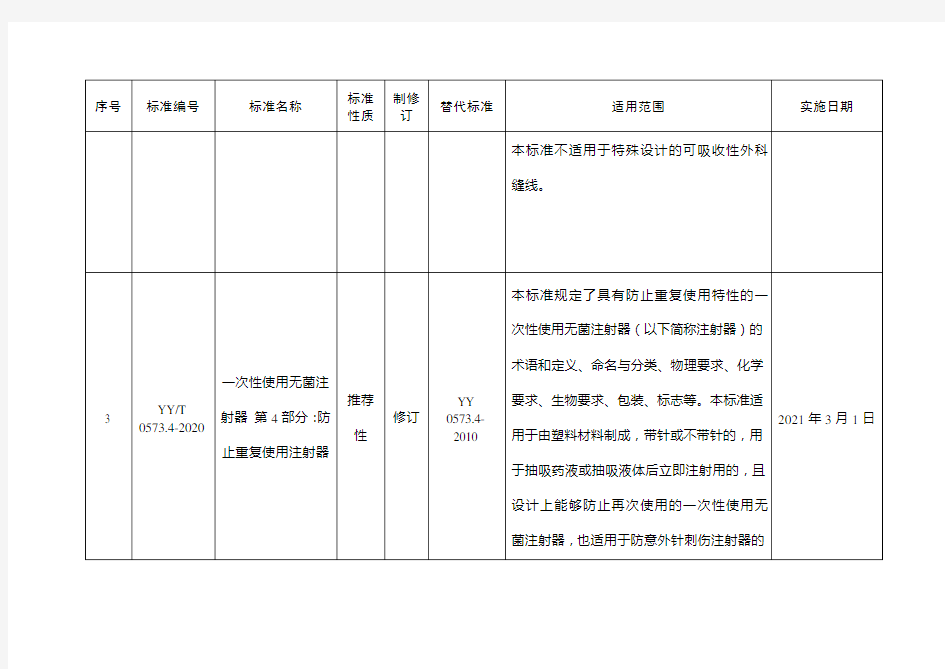
医疗器械行业标准信息表
1、6822-1(验光师、配镜师资格证)、6840(主管检验师1名、初级职称2名)、6846(1名销售人员医学相关专业)。 2、除第一条以外的只需3名有学历人员(大专以上)医疗器械专业,质量负责人、质管员、验收员;零售的(眼镜店、药店)至少一个质量负责人,专营医疗器械至少2名有学历的人员质量负责人、验收员。(如果有学历要求的人员,必须去学信网进行学历认证) 3、6822所有企业都不能选(眼镜店选6822-1),如果选的话必须6822-1除外。 面积 批发企业经营场所最低不低于60平方,库房面积不低于100平方(6815、6840、6846均无,库房面积不低于60平方)零售经营场所最低不低于50平方,可以没有库房(眼镜店、药店大于30平方,可以不到50平方)。 租赁协议 必须标注面积,必须是公司承租的。 离职证明 如果原单位是外地企业需附医疗器械经营许可证复印件,必须是经营公司、生产企业的,医院的不行。必须是在原单位从事质量工作的。
营业执照 个体工商户不受理,经营范围必须有医疗器械的销售。 仓库和办公平面图(必须标注长、宽、高,面积) 仓库至少5区(合格、不合格、发货、待验、退货、有效期产品区、包装物料区) 办公平面图必须和组织机构一致,有多少人员有多少办公桌。 如果设立分公司,经营范围不能超出总公司的经营范围。合理缺项申请表没有体外诊断试剂的,一般项都是10条。 变更的必须提供变更信息表、公司章程、股东会决议。 行政许可申请书必须填满(无委托人的除外),理由不能一句带过。 重复受理的按原来的号不变。大厅受理通知书改成20日。与原件一致姓名日期由哪个部门XX收集复印。 行政许可申请书后边附上: 身份证(法人或委托代理人)复印件,营业执照复印件。 卫生材料、口腔材料可以不设阴凉库。
医疗器械行业标准 关于发布实施YY 0001-2008《体外引发碎石设备技术要求》等73项医疗器械行业标准的通知 国食药监械[2008]192号 2008年04月25日发布 各省、自治区、直辖市食品药品监督管理局(药品监督管理局),各医疗器械标准化技术委员会及归口单位: YY 0001-2008《体外引发碎石设备技术要求》等73项医疗器械行业标准已经审定通过,现予以发布。其标准编号、名称及实施日期如下: 一、强制性行业标准1.YY 0001-2008《体外引发碎石设备技术要求》(代替YY 0001-1990)2.YY 0053-2008《心血管植入物和人工器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》(代替YY 0053-1991)3.YY 0068.1- 2008《医用内窥镜硬性内窥镜第1部分:光学性能及测试方法》(部分代替YY 0068-1992)4.YY 0070-2008《食管窥镜》(代替YY 0070-1992)5.YY 0071-2008 《直肠、乙状结肠窥镜》(代替YY 0071-1992)6.YY 0267-2008《心血管植入物和人工器官血液净化装置的体外循环血路》(代替YY 0267-1995)7.YY 0286.5- 2008《专用输液器第5部分:一次性使用吊瓶式和袋式输液器》8.YY 0315-2008《钛及钛合金人工牙种植体》(代替YY 0315-1999)9.YY 0319-2008《医用电气设备第2部分:医疗诊断用磁共振设备安全专用要求》(代替YY 0319- 2000)10.YY 0620-2008《牙科学铸造金合金》11.YY 0621-2008《牙科金属烤瓷修复体系》12.YY 0622-2008《牙科树脂基窝沟封闭剂》13.YY 0623-2008《牙科材料可溶出氟的测定方法》14.YY 0624-2008《牙科学正畸产品:正畸弹性体附件》15.YY 0625-2008《牙科学正畸产品:正畸丝》16.YY 0626-2008《贵金属含量25%-
医疗器械知识培训资料 《医疗器械监督管理条例》中规定医疗器械是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件;其用于人体体表及体内的作用不是用药理学、免疫学或者代谢的手段获得,但是可能有这些手段参与并起一定的辅助作用;其使用旨在达到对疾病的预防、诊断、治疗、监护、缓解;对损伤或者残疾的诊断、治疗、监护、缓解、补偿;对解剖或者生理过程的研究、替代、调节;妊娠控制等预期目的。因此,医疗器械同药品一样,是防病治病的武器,是关系人体生命安全的特殊商品,其安全性和有效性必须严格加以控制。自《医疗器械监督管理条例》和《一次性使用无菌医疗器械监督管理办法》颁布实施以来,食品药品监管部门加强对医疗机构使用医疗器械的监管,医疗机构使用医疗器械的行为得到了有效规范。但是由于医疗机构使用医疗器械品种多,进货渠道复杂,尤其是农村医疗机构分布广,监管难度大,加上医疗器械监管法规尚不健全,一些基层医疗机构在医疗器械的管理和使用上还存在一些问题。 一、医疗机构涉械人员认识不到位,存在重药品轻器械思想,对有关医疗器械监督管理的法律、法规、规章等知识了解不全面,尤其是对医疗器械产品的说明书、标签和包装标识在认识和理解上不准确。2005年,县局查获一起案件,某医疗机构涉械人员在购进一次性阴道扩张器时,验收马虎,竞没有发现其标识上注册号码有误,造成了损失。
二、重复使用一次性无菌医疗器械的行为时有发生。在农村卫生室,一方面受患者经济条件限制,人员素质不高,一些患者为了省钱,主动提出对自己使用后的注射器或输液器重复使用;还有一些乡村卫生室、个体诊所受利益驱动,重复使用一次性无菌注射器的现象时有发生,尤其是重复使用作皮试用的注射器和配制大输液所用的注射器,个别的甚至重复使用一次性使用输液器。这种形为给人民群众的健康带来了隐患。 三、有些医疗机构进货渠道混乱,使用无产品注册证、无合格证明的医疗器械。在乡镇以下医疗机构主要存在购进医疗器械无记录,不能提供供货单位的合法证明资质,有的医疗机构相互代购,甚至从私人手中采购一次性使用无菌医疗器械,使用无产品注册证或无合格证明的卫生材料和一次性使用无菌器械。药监部门在日常的监督中发现,不能提供或者伪造、变造医疗器械产品注册证和合格证明的现象时有发生。究其原因:一是医疗机构采购制度不健全,采购人员的疏忽,给不法供应商提供了机会;二是采购人员忽视审查供应商及产品的合法性;三是医疗器械销售利润空间大,存在不正当竞争行为。在县级以上医疗机构,部分医疗机构外科,在购进贵重医疗器械时,直接与厂家销售代表联系,边购进边使用,这样就存在着购进验收不严格,容易导致事故的发生。 四、销毁制度不健全。《医疗器械监督管理条例》和《一次性使用无菌医疗器械监督管理办法》中明确规定:医疗机构应建立无菌器械使
企业质量考核所需备案之各医疗器械标准 1.医用电气设备第一部分:安全通用要求-GB 9706.1-1995 2.医用电气设备第一部分:安全通用要求 1.并列标准:医用电气系统安全要求-GB 9706.15-1999 3.医用有机硅材料生物学评价试验方法-GB/T 16175-1996 4.医疗器械生物学评价第1部分:评价与试验-GB/T 16886.1-2001 5.编写和使用医用电气设备教材的导则-GB/Z 17994-1999 6.管理、医疗、护理人员安全使用医用电气设备导则-GB/T 17995-1999 7. 医疗保健产品灭菌生物指示物第1部分:通则-GB 18281.1-2000 8. 最终灭菌医疗器械的包装-GB/T 19633-2005 9. .医疗器械产品图样及设计文件的术语-YY/T 0047-91 10. 医疗器械产品工作图样的基本要求-YY/T 0048-91 1 1. 医疗器械产品图样及设计文件格式-YY/T 0049-91 12医疗器械产品图样及设计文件编号原则-YY/T 0050-91 13. 医疗器械产品图样及其主要设计文件的完整性-YY/T 0051-91 14. 医疗器械产品图样及设计文件的更改办法-YY/T 0052-91 15. 医疗仪器设备用产品铭牌-YY/T 0083-92 16. 质量体系医疗器械GB/T 19002-ISO 9002应用的专用要求-YY/T 0288-1996 17. 医疗器械风险管理对医疗器械的应用-YY/T 0316-2003 18. 医疗器械用于医疗器械标签、标记和提供信息的符号-YY 0466-2003 19. 医疗器械保障医疗器械安全和性能公认基本原则的标准选用指南-YY/T 0467-2003 20. 命名用于管理资料交流的医疗器械命名系统规范-YY/T 0468-2003
废止行业标准清单 序 废止标准旧标准号被替代标准号被替代标准 号 1通信设备安装抗震设计暂行规定YD 2003-1992 2电信专用房屋设计规范YD 5003—1994YD/T 5003-2005 电信专用房屋设计规范 3NO.7信令网工程设计暂行规定YD 5005-1994 4本地电话网用户线路工程设计规范YD 5006—2003YD 5137-2005 本地通信线路工程设计规范 5本地电话网用户线线路工程设计规范YD 5006-1995 6本地电话网通信管道与通道工程设计规范YD 5007-1995 7光缆线路对地绝缘指标及测试方法YD 5012-1995 YD 5102-2005 长途通信光缆线路工程设计规范 8卫星通信地球站设备安装工程施工及验收技术规范YD 5017—1996YD/T5017—2005国内卫星通信地球站设备安装工程验收规范 9海底光缆数字传输系统工程设计规范YD 5018—1996YD 5018-2005 海底光缆数字传输系统工程设计规范 10同步数字系列(SDH)微波接力通信系统工程设计暂行规定YD 5019-1996 11数字同步网工程设计暂行规定YD 5020-1996 YD/T 5089-2005 数字同步网工程设计规范 12同步数字系列(SDH)长途光缆传输工程设计暂行规定YD 5021-1996 13用户接入网工程设计暂行规定YD 5023-1996 14本地电话网局间中继同步数字系列(SDH)光缆传输工程设计规范YD 5024-1996YD/T 5024-2005 SDH本地网光缆传输工程设计规范 15长途通信光缆塑料管道工程设计暂行技术规定YD 5025-1996YD 5025-2005 长途通信光缆塑料管道工程设计规范 16长途通信传输机房铁架槽道安装设计标准YD 5026—1996YD/T 5026-2005 电信机房铁架安装设计标准 17通信电源集中监控系统工程设计暂行规定YD 5027—1996YD/T 5027-2005 通信电源集中监控系统工程设计规范 18国内卫星通信小型地球站 VSAT 通信系统工程设计暂行规定YD 5028—1996YD/T 5028-2005 国内卫星通信小型地球站( VSAT )通信系统工程设计规范19集群通信工程设计暂行规定YD 5034—1997YD/T 5034-2005 数字集群通信工程设计暂行规定 20集群通信设备安装工程验收暂行规定YD 5035—1997YD/T 5035-2005 数字集群通信设备安装工程验收暂行规定 21通信电源设备安装设计规范YD 5040—1997YD/T 5040-2005 通信电源设备安装工程设计规范 22长途通信光缆塑料管道工程验收暂行规定YD 5043—1997YD 5043-2005 长途通信光缆塑料管道工程验收规范 23同步数字系列( SDH )光缆传输设备安装工程验收暂行规定YD 5044—1997YD 5044-2005 SDH 长途光缆传输系统工程验收规范 24光缆通信工程无人值守电源设备安装设计暂行规定YD 5046—1997YD/T 5040-2005 通信电源设备安装工程设计规范 25本地网通信线路工程验收规范YD 5051—97YD/T 5138-2005 《本地通信线路工程验收规范》(YD/T5138—2005) 26邮电通信建筑抗震设防分类标准YD 5054—1998YD 5054-2005 电信建筑抗震设防分类标准 27海底光缆数字传输系统工程验收规范YD 5056—1998YD/T 5056-2005 海底光缆数字传输系统工程验收规范 28通信电源集中监控系统工程验收暂行规定YD 5058—1998YD/T 5058-2005 通信电源集中监控系统工程验收规范 29通信设备安装抗震设计规范YD 5059—1998YD 5059-2005 电信设备安装抗震设计规范 30光缆线路自动监测系统工程设计暂行规定YD 5066—1998YD/T 5066-2005 光缆线路自动监测系统工程设计规范 32电信楼建筑安装工程施工监理暂行规定YD 5073—1998YD 5073-2005 电信专用房屋工程施工监理规范 33本地电话网 DXC 工程设计暂行规定YD 5075—1998YD/T 5024-2005 SDH本地网光缆传输工程设计规范 34通信电源设备安装工程验收规范YD 5079—1999YD 5079-2005通信电源设备安装工程验收规范
医疗器械行业ISO13485:2003标准简介 医疗器械行业过去一直使用ISO13485标准(我国等同标准号为YY/T 0287)作为质量管理体系认证的依据。过去这个标准是在ISO9001:1994标准基础上增加医疗器械行业特殊要求而制定的。因此满足ISO1 3485也就符合ISO9001:1994的要求。自从ISO9001:2000标准颁布以后,ISO/TC210反复讨论,于2003年颁布了新的ISO13485:2003国际标准,新标准与旧标准相比有较大的改动,它有了许多医疗器械行业的特点。 ISO13485是一份独立的标准,不是ISO9001标准在医疗器械行业中的实施指南,两者不能兼容。 这从新标准的标题看出来,ISO13485:2003国际标准的名称是:“医疗器械质量管理体系用于法规的要求”。新标准特别强调的是满足法律法规的要求。该标准在总则中说:“本标准的主要目的是便于实施经协调的质量管理体系的法规要求。因此,本标准包含了一些医疗器械的专用要求,删减了ISO900 1中不适于作为法规要求的某些要求。由于这些删减,质量管理体系符合本标准的组织不能声称符合ISO9 001标准,除非其质量管理体系还符合ISO9001中所有的要求。” ISO13485标准是对产品技术要求的补充 这一点,在标准引言的总则中明确指出:“……值得强调的是,本标准所规定的质量管理体系要求是对产品技术要求的补充。” ISO13485标准没有过程模式图 在标准的0.2过程方法一节中,该标准只做简要说明,没有过程模式图。 ISO13485标准中关于删减的规定 这在该标准的1.2节“应用”中有较详细的规定。本标准的所有要求是针对提供医疗器械的组织,不论组织的类型或规模。如果法规要求允许对设计和开发控制进行删减,则在质量管理体系中删减它们可认为是合理的。这些法规能够提供另一种安排,这些安排要在质量管理体系中加以说明。组织有责任确保在符合本标准的声明中反映出对设计和开发控制的删减。 ISO13485标准强调“保持其有效性” 在ISO9001标准条文中许多“持续改进”之处在ISO13485标准中均改为“保持其有效性”,这是因为当前法规的目标是质量管理体系的有效性,以持续生产安全有效的产品。 ISO13485标准更强调法规要求 新标准强调法规要求,许多地方不过分强调顾客要求。这是因为顾客满意不适合于作为医疗器械的法规目标,这与全世界管理体系法规的协调目标是一致的。 根据医疗器械行业的特点,ISO13485标准对形成文件程序要求之处增多。
中华人民共和国医药行业标准 质量体系医疗器械 GB/T 19001—ISO 9001应用的专用要求 Quality system—Medical devices—Particular requirements for the application of GB/T 19001—ISO 9001 前言 本标准等同采用ISO/FDIS 13485:1996《质量体系——医疗器械——ISO 9001应用的专用要求》。 与本标准配套使用的国家标准是GB/T 19001—1994《质量体系设计、开发、生产、安装和服务的质量保证模式》。 本标准“生产者”的概念是指自然人或法人,负责器械的设计、制造、包装及上市前标贴生产者名称等工作,不管这些工作由其亲自完成或由其委托第三方完成。对已经上市的产品进行组装或调整以满足个别患者的需要,则不应视为生产者。 本标准由国家医药管理局提出。 本标准由全国医疗器械质量管理和通用要求标准化技术委员会归口。 本标准起草单位:国家医药管理局医用光学、激光、冷疗设备质量检测中心,国家医药管理局医疗器械行政监督司,中国医疗器械质量认证中心。 本标准主要起草人:任晓莉、陈宇红。 ISO前言 ISO(国际标准化组织)是由各国标准化团体(ISO成员团体)组成的世界性的联合会。制定国际标准的工作通常由ISO的技术委员会完成,各成员团体若对某技术委员会确立的标准项目感兴趣,均有权参加该委员会的工作。与ISO保持联系的各国际组织(官方的或非官方的)也可参加有关工作。在电工技术标准化方面,ISO与国际电工委员会(IEC)保持密切合作关系。 由技术委员会正式通过的国际标准草案提交各成员团体表决,国际标准需取得至少75%参加表决的成员团体的同意才能正式通过。
废止标准目录 一、工程建设国家标准 房屋建筑制图统一标准GBJ1-86 砌体结构设计规范GBJ3-86 建筑地基基础设计规范GBJ7-89 建筑结构荷载规范GBJ9-87 混凝土结构设计规范GBJ10-89(公告2) 建筑抗震设计规范GBJ11-89(公告1) 冷弯薄壁型钢结构技术规范GBJ18-87 岩土工程勘察规范GB50021-94 供水水文地质勘察规范GBJ27-88 城镇燃气设计规范GB50028-93(公告13) 压缩空气站设计规范GBJ29-90 工业企业采光设计标准GB50033-91 工业与民用35千伏及以下架空电力线路设计规范GBJ61-83 制冷设备安装工程施工及验收规范GBJ66-84 汽车库设计防火规范GBJ67-84 建筑结构设计统一标准GBJ68-84 冷库设计规范GBJ72-84 洁净厂房设计规范GBJ73-84 普通混凝土拌合物性能试验方法GBJ80-85 普通混凝土力学性能试验方法GBJ81-85 建筑结构设计通用符号、计量单位和基本术语GBJ83-85 自动喷水灭火系统设计规范GBJ84-85 锚杆喷射混凝土支护技术规范GBJ86-85 民用爆破器材工厂设计安全规范GBJ89-85 铁路线路设计规范GBJ90-85 铁路车站及枢纽设计规范GBJ91-85 沥青路面施工及验收规范GBJ92-86 球形储罐施工及验收规范GBJ94-86 水文测验术语和符号标准GBJ95-86 住宅建筑设计规范GBJ96-86 人民防空工程设计防火规范GBJ98-87 总图制图标准GBJ103-87 建筑制图标准GBJ104-87 建筑结构制图标准GBJ105-87 给水排水制图标准GBJ106-87 地下工程防水技术规范GBJ108-87(公告15) 采暖通风与空气调节制图标准GBJ114-88 火灾自动报警系统设计规范GBJ116-88 土工试验方法标准GBJ123-88
YY/T 0809.10-2014《外科植入物半髋和全髋关节假体第10部分:组合式股骨头抗静载力测定》 YY/T 0956-2014《外科植入物矫形用U型钉通用要求》 YY/T 0924.2-2014《外科植入物部分和全膝关节假体部件第2部分:金属、陶瓷和塑料关节面》 YY/T 0966-2014《外科植入物金属材料纯钽》 YY/T 0964-2014《外科植入物生物玻璃和玻璃陶瓷材料》 YY/T 0917-2014《神经外科植入物可塑型预制颅骨板》 YY/T 0928-2014《神经外科植入物预制颅骨板》 YY/T 0965-2014《无源外科植入物人工韧带专用要求》 0640-2008《无源外科植入物通用要求》 YY/T 0919-2014《无源外科植入物关节置换植入物膝关节置换植入物的专用要求》 YY/T 0920-2014《无源外科植入物关节置换植入物髋关节置换植入物的专用要求》 YY/T 0924.1-2014《外科植入物部分和全膝关节假体股骨和胫骨部件第1部分:分类、定义和尺寸标注》YY/T 0963-2014《关节置换植入物肩关节假体》 YY/T 0663.1-2014《心血管植入物血管内装置第1部分:血管内假体》 YY/T 0942-2014《眼科光学人工晶状体植入系统》 YY/T 0946-2014《心脏除颤器植入式心脏除颤器用DF‐1连接器组件尺寸和试验要求》 无菌医疗器械行业标准 YY/T 0681.11-2014《无菌医疗器械包装试验方法第11部分:目力检测医用包装密封完整性》 YY/T 0681.12-2014《无菌医疗器械包装试验方法第12部分:软性屏障膜抗揉搓性》 YY/T 0681.13-2014《无菌医疗器械包装试验方法第13部分:软性屏障膜和复合膜抗慢速戳穿性》 YY/T 0506.7-2014《病人、医护人员和器械用手术单、手术衣和洁净服第7部分:洁净度-微生物试验方法》 体外诊断试剂医疗器械行业标准 YY/T 1222-2014《总三碘甲状腺原氨酸定量标记免疫分析试剂盒》 YY/T 1223-2014《总甲状腺素定量标记免疫分析试剂盒》 YY/T 1224-2014《膀胱癌细胞相关染色体及基因异常检测试剂盒(荧光原位杂交法)》 YY/T 1225-2014《肺炎支原体抗体检测试剂盒》 YY/T 1226-2014《人乳头瘤病毒核酸(分型)检测试剂(盒)》 YY/T 1227-2014《临床化学体外诊断试剂(盒)命名》 YY/T 1228-2014《白蛋白测定试剂(盒)》 YY/T 1229-2014《钙测定试剂(盒)》 YY/T 1230-2014《胱抑素C测定试剂(盒)》 YY/T 1231-2014《肌酐测定试剂(盒)(肌氨酸氧化酶法)》
江西省《医疗器械经营企业许可证》现场检查验收标准 一、总则 1、依据《医疗器械监督管理条例》、《医疗器械经营企业许可证管理办法》等的有关规定,结合本省实际,制定本标准。 2、本标准适用于江西省行政区域内企业申办《医疗器械经营企业许可证》、换证及《医疗器械经营企业许可证》许可事项变更的现场审查。 3、经营企业现场审查按江西省《医疗器械经营企业许可证》现场检查验收标准进行, 检查验收标准分为3个部分,其中否决项12项,总分为300 分,各部分内容和分值为: 1)机构与人员50分 2)场地与环境100分 3)制度与管理150分 4、合格标准: “否决项”合格且各部分的得分率均达到80%以上为合格; “否决项”一项不合格,或者“否决项”合格而各部分的得分率未达到80%,即为本次审查不合格。 二、评分方法
1、按现场检查验收标准中审查方法评分:扣分时,最多至本条分数扣完为止。 2、按评分通则评分:评分不宜量化的条款,按评分通则打分。实得分等于每条规定满分乘以得分系数。 得分系数及含义: 1.0 全面达到规定要求; 0.8 执行较好,但仍需改进; 0.7 基本达到要求; 0.6 基本到达要求,个别存在差距; 0.5 基本达到要求,部分执行较好; 0.3 已执行,但尚有一定差距; 0.0 未开展工作。 3、缺项的处理: 缺项指由于经营产品管理类别等原因而出现的合理缺项。缺项不记分,计算得分率时,从该项标准总分中减去缺项应得分。计算公式为: 得分率=实得分/(该部分总和-缺项分)×100% 4、现场检查验收标准评分表中未说明评分标准的项目均按通则的得分系数评分。
三、审查结论 现场审查时,审查人员应如实记录现场审查情况。审查结束后,填写《江西省医疗器械经营企业现场审查报告》,审查人员、企业负责人均应在现场审查报告上签字并加盖企业公章(如有)和组织审查的食品药品监督管理部门公章。 四、其它 1、开办企业的审查项目:1.1至1.7,2.1至2.7,3.1至3.3,3.8、3.11、3.16、3.17。 2、具有独立法人地位的医疗器械生产企业或经营企业设立分支机构经营医疗器械,如能提供保证其分支机构经营的产品均由持证法人单位统一采购、质量管理、仓储和售后服务的承诺,现场审查时,可减免审查项1.2、1.4、1.5,2. 3、2. 4、2.6、2.7,3. 5、3. 6、3. 7、3.10、3.14。 3、换证的审查项目为全部项目。 4、国家、省食品药品监督管理部门另有规定的,按其规定执行。 5、现场检查验收标准评分表分为三个部分,12个关键项,22个一般项,总分为300分。第一部分:人员与机构50分;第二
第二部分:对产品的销售方法的选择,例如,经销商模式,直销, 为什么会选择这种模式,或者使用混合模式第三部分:在模式选定后,可以操作的步骤,例如如何选择经销商等等 选好经销商后,如何与经销商保持信息通畅。 第四部分是销售的其他方面,例如广告和品牌的建立和促销等 ■如何写外贸销售计划书: (1)外贸业务做为一个长久不衰的行业,有着得天独厚的优势.我通常把业务分为以下 几个阶段: 阶段一:.熟悉产品好的业务员有着精湛的以下标准清单仅做参考,以最新版本为准. 标准编号标准名称 实施日 期备注 GB/T1.1-2000标准化工作导 则第一部分结 构和编写规则 2001-6- 1 国 家 标 准 GB 1.2-2002标准化工作导 则第二部分结 构和编写规则 2003-1- 1 国 家 标 准
第二部分:对产品的销售方法的选择,例如,经销商模式,直销, 为什么会选择这种模式,或者使用混合模式第三部分:在模式选定后,可以操作的步骤,例如如何选择经销商等等 选好经销商后,如何与经销商保持信息通畅。 第四部分是销售的其他方面,例如广告和品牌的建立和促销等 ■如何写外贸销售计划书: (1)外贸业务做为一个长久不衰的行业,有着得天独厚的优势.我通常把业务分为以下 几个阶段: 阶段一:.熟悉产品好的业务员有着精湛的 GB/T20001.1-2001 标准编写规则 第一部分术语国家标准 GB/T20001.2-2001 标准编写规则 第二部分符号国家标准 GB/T20001.3-2001标准编写规则 第三部分信息 分类 国 家 标
第二部分:对产品的销售方法的选择,例如,经销商模式,直销, 为什么会选择这种模式,或者使用混合模式第三部分:在模式选定后,可以操作的步骤,例如如何选择经销商等等 选好经销商后,如何与经销商保持信息通畅。 第四部分是销售的其他方面,例如广告和品牌的建立和促销等 ■如何写外贸销售计划书: (1)外贸业务做为一个长久不衰的行业,有着得天独厚的优势.我通常把业务分为以下 几个阶段: 阶段一:.熟悉产品好的业务员有着精湛的 准 GB/T20001.4-2001标准编写规则 第四部分化学 分析 国 家 标 准 GB/T1.22-1993标准化工作导 则第二部分标 准内容的确定 国 家 标 准 GB228-2002 金属材料室温 拉伸试验2002-1- 1 国 家
医疗器械生产质量管理规范检查管理办法(试行)第一章总则第一条为了加强对《医疗器械生产质量管理规范(试行)》检查工作的管理,根据《医疗器械监督管理条例》以及有关规定,制定本办法。第二条国家食品药品监督管理局主管全国医疗器械生产质量管理规范检查工作,负责制定医疗器械生产质量管理规范、分类实施细则和检查评定标准并监督实施,负责建立医疗器械生产质量管理规范检查员库及其管理工作,负责部分高风险第三类医疗器械生产质量管理规范检查工作。国家食品药品监督管理局药品认证管理中心(以下简称认证管理中心)受国家局委托,承担部分高风险第三类医疗器械生产质量管理规范检查工作。第三条省、自治区、直辖市食品药品监督管理部门负责本辖区内第二类和除认证管理中心承担的部分高风险第三类医疗器械之外的其他第三类医疗器械(以下简称其他第三类医疗器械)生产质量管理规范检查工作,部分高风险第三类医疗器械生产质量管理规范检查申报资料的形式审查工作,医疗器械生产企业质量管理体系的日常监督管理工作。第二章申请和资料审查第四条第一类医疗器械生产企业应当按照医疗器械生产质量管理规范的要求建立质量管理体系,保持有效运行,并保存相关记录。第二类、第三类医疗器械生产企业应当按照医疗器械生产质量管理规范的要求建立质量管理体系并组织自查,符合要求后,向所在地省、自治区、直辖市食品药品监督管理部门提出医疗
器械生产质量管理规范检查的申请。第五条申请医疗器械生产质量管理规范检查的生产企业,应当提交以下资料:(一)《医疗器械生产质量管理规范检查申请表》(附表1),同时附申请表电子文本;(二)《医疗器械生产企业许可证》副本和营业执照副本复印件;(三)生产企业组织机构图;(四)生产企业负责人、生产、技术和质量管理部门负责人简历,学历和职称证书复印件;(五)申请检查产品的医疗器械注册证书复印件(如有)、拟注册产品标准;(六)生产企业总平面布置图、工艺流程图、生产区域分布图;(七)主要生产设备和检验设备目录;(八)生产无菌医疗器械的,应当提供由有资质的检测机构出具的一年内的生产环境检测报告。生产企业应当对其申报材料内容的真实性负责。第六条省、自治区、直辖市食品药品监督管理部门收到生产企业申请后,对申报资料进行形式审查。符合要求的,对于第二类和其他第三类医疗器械生产企业,应当在10个工作日内完成资料审查,并填写《医疗器械生产质量管理规范检查资料审查表》(附表2);对于部分高风险第三类医疗器械生产企业,应当在《医疗器械生产质量管理规范检查申请表》上签署意见,并在 5个工作日内转寄国家局认证管理中心。对于第二类和其他第三类医疗器械生产企业申请资料不符合要求的,应当一次性要求生 产企业进行补充。生产企业未在2个月内提交补充材料并无正
中华人民共和国医药行业规范 质量体系医疗器械 GB/T 19001—ISO 9001应用的专用要求 Quality system—Medical devices—Particular requirements for the application of GB/T 19001—ISO 9001 前言 本规范等同采用ISO/FDIS 13485:1996《质量体系——医疗器械——ISO 9001应用的专用要求》。 与本规范配套使用的国家规范是GB/T 19001—1994《质量体系设计、开发、生产、安装和服务的质量保证模式》。 本规范“生产者”的概念是指自然人或法人,负责器械的设计、制造、包装及上市前标贴生产者名称等工作,不管这些工作由其亲自完成或由其委托第三方完成。对已经上市的产品进行组装或调整以满足个别患者的需要,则不应视为生产者。 本规范由国家医药经管局提出。 本规范由全国医疗器械质量经管和通用要求规范化技术委员会归口。 本规范起草单位:国家医药经管局医用光学、激光、冷疗设备质量检测中心,国家医药经管局医疗器械行政监督司,中国医疗器械质量认证中心。 本规范主要起草人:任晓莉、陈宇红。 ISO前言 ISO(国际规范化组织)是由各国规范化团体(ISO成员团体)组成的世界性的联合会。制定国际规范的工作通常由ISO的技术委员会完成,各成员团体若对某技术委员会确立的规范工程感兴趣,均有权参加该委员会的工作。与ISO保持联系的各国际组织(官方的或非官方的)也可参加有关工作。在电工技术规范化方面,ISO与国际电工委员会(IEC)保持密切合作关系。 由技术委员会正式通过的国际规范草案提交各成员团体表决,国际规范需取得至少75%参加表决的成员团体的同意才能正式通过。 国际规范ISO13485是由ISO/TC 210医疗器械的质量经管和通用要求技术委员会制定的。
前言 主要给出下列信息: 1、说明与对应的国家标准、行业标准或国际标准的一致性程度; 2、说明本标准编写格式符合GB/T 1.1的要求 3、说明本标准与其它标准或前版标准的关系或代替情况(如有); 4、必要时,说明本标准中的附录的性质。 5、目前该产品尚无国家标准、行业标准,为规范产品的技术特性,确 保产品的安全有效,特制订本注册产品标准,作为生产质量控制的依据。(此条款在无相应国家标准和行业标准时描述) 举例如下: 医用电气设备前言的描述 XXXXXXXXXXXXXXXXX是本公司生产的产品。根据《医疗器械监督管理条例》、《医疗器械标准管理办法》特制订本注册产品标准作为该产品生产、检验的质量依据。 本标准的内容遵循了国家及行业的有关XXXXXXXXXX的标准规定,标准主要技术参数的设定依据了XXXXX《XXXXXXXXXXXXX》和XXXXXXXXXX《XXXXXXXXXXX》等标准。安全要求符合GB 9706.1-2007《医用电器设备第一部分: 安全通用要求》、XXXXXXXXXXXXXXXXXXXXXXX等标准;相关参数值的确定参考了XXXXXXXXX 参数。本标准的格式符合GB/T 1.1-2009《标准化工作导则第1部分:标准的结 构和编写规则》的要求。 本标准的附录A为规范性附录。 本标准由XXXXXXXXXXXXX提出。 本标准起草单位:XXXXXXXXXXXXXXXXXXXXXXXX起草。 本标准主要起草人:XX、XXX。
本标准于XXXX年X月XXX日首次发布。 产品名称 范围 本注册标准适用于XXXX(产品名称)。 本注册标准规定了XXXX(产品名称)的产品分类(如有)、要求,试验方法,检验规则,标志、包装、运输、贮存等内容。 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 引用标准顺序:国家标准、行业标准、国际标准。标准的排列原则:按标准编号由小到大排列。 举例如下: GB/T 191-2008 包装储运图示标志 GB/T 10151-2008 医用诊断X射线设备高压电缆插头、插座技术条件GB 9706.1-2007 医用电气设备第一部分:安全通用要求 GB 9706.11-1997 医用电气设备第二部分:医用诊断X射线源组件和X 射线管组件安全专用要求 GB 9706.12-1997 医用电气设备第一部分:安全通用要求 三、并列标准诊断X射线设备辐射防护通用要求 注:凡是有明确日期的标准必须标出日期,不得省略。 分类与命名
世界各国医疗器械认证标准列表汇总 医疗器械标准 这些医疗器械标准已被许多国家广泛采用。
医疗器械指令列表 欧盟 欧盟指令中涵括许多基本保健及安全规定,以及评估产品符合规定程度的订定程序。每项指令在区域性标准制订机构所订定的调和欧洲标准中均会具体说明详细的基本规定。 因此,相关产品的制造商、进口商及配销商都必须明显标示,产品完全符合每项指令在“基本规定”所列出的保健及安全规定。 形成“新方法”基础的指令,包含了广泛的产品类别(横向指令)或某种特定的产品类别(纵向指令)。 所有进入欧盟市场的产品,企业必须具有表示自我符合声明的CE标志,以说明产品符合欧盟制定的相关指令。 医疗器械需要满足的指令有: 《有源植入性医疗器械指令》(AIMDD, 90/385/EEC)、《医疗器械指令》(MDD,93/42/EEC)、体外诊断器械指令(IVDD, 98/79/EC) 医疗器械指令(MDD),MDD指令适用于大多数进入欧盟销售的医疗设备。它根据不同的要求共分为6个等级,供认证机构评估。 北美 在美国,食品和药物管理局(FDA)是监督和管理获准向消费者进行销售的食物,药物,化妆品和医疗器械的法定机构。器械及放射线健康中心(CDRH),作为FDA的一个分支,专管医疗器械。其对医疗器械按不同等级进行不同程度的监管(医疗器械分为I级,II级或III级,I级作为低风险范畴,而III级属高风险范畴):
大多数属于I级或II级的医疗器械,需要获得510(k)或称上市通告,只有低风险的I级器械,可以豁免510(k)。FDA要求准备上市的医疗器械必须具有和已被肯定的器械(指已获准在市场销售的器械)等同的安全性和效力。因此制造商需提供报告说明其产品与市场上同类产品的详细比较情况。 制造商有责任获取和验证已被肯定的器械的相关信息,比如目录,使用说明书和510(k)其它要求的资料信息。 通常,有三种情况需要申请510(k): ①传统审核,适用于推介新器械,申请时需递交适用的性能报告。 ②特殊审核,适用于依照设计控制程序作了较小修改的器械。 ③简化审核,由制造商提交,制造商必须确保并声明其产品符合现有FDA认可的标准。 FDA 510(k)审查 从2002年10月1日起,审查需直接向FDA缴纳用户费。经过FDA的初次审查,申请人将收到FDA出示的产品缺陷报告或声明,这个过程通常需时90天。经过改正和/或其它资料的补充后,FDA随后还将再进行为期90天的复审。 要缩短510(k)审查的周期,并减少工作量,第三方510(k)审查是完成审核的另一选择。如您选择诸如UL这样的第三方评审机构,那么整个审查可在四周内完成。 加拿大 在加拿大方面,加拿大医疗器械认证认可机构(CMDCAS)要求医疗器械厂商提前获得经CMDCAS认可的第三方机构,如UL的质量体系审查,证明其质量系统符合CMDCAS的ISO13485/ISO13488标准。对CMDCAS认证的了解对于完成FDA的质量系统注册(QSR)非常有帮助,因为如上所述的QSR是以ISO 9001和ISO 13485标准为基础的。 亚洲 亚洲的医疗设备市场是发展潜力最大的市场之一,随着生活质量和保健意识的提高,亚洲的消费者比以前更愿意在保健产品上消费。 医疗设备在日本、中国和韩国拥有最大的消费市场。仅日本,2001年医疗设备的销售额高达230亿美元。 日本
专题讨论意见。 医疗器械的分类管理 一、现行制度的分析: 分类目录的调整变化过快,没有严格按照分类原则实施,三类产品范围过大。事实上,过多的产品被划分为Ⅲ类高风险产品进行管理,既给生产者带来沉重的经济负担,又造成政府管理上的高成本和低效率。 二、借鉴的经验: 美国和欧洲大约8%~10%的医疗器械被划分为高风险产品管理(III类);而我国III 类产品的比例过大。欧盟企业按照分类原则自行确定产品的类别。美国则有较为系统的专家小组对已上市和申报的产品按照分类原则进行系统的评估,以分类目录的形式发布。 三、修改建议: 修订和完善分类管理方法, 采取现有的“分类原则”和“产品目录”相结合的方式,依据产品机理,风险程度和技术的成熟程度制定可操作的分类原则。使得企业可以按照分类原则自行分类并最终由政府认可。对于成熟的产品以分类目录的形式予以公布。 医疗器械的命名原则 一、现行制度的分析 目前,医疗器械还没有明确的命名原则,由此带来在注册管理和市场监督方面不一致的系列问题。
二、国际通行的命名原则 国际上以注册的商品名和产品通用名称并用。 产品通用名代表产品的特性。除了商品名之外,产品还有一个主要的大类。之外包括附属的命名,如一些描述性的命名以及同产品本身相关的命名。在产品名下包括相关的型号规格……model/model number。 三、修改建议 1、按照产品大类来分小类。分类不应过细,掌握几个关键词, 2、命名排列顺序:功能、结构、机理。 3、区分产品的通用名称和商品名称。 医疗器械的生产和经营管理 一、现行制度的分析 目前针对医疗器械生产和经营企业的开办均按照国家的相关规定通过现场审查进行,国家已发布统一标准,但医疗器械经营企业的检查验收标准各省在执行和实施时标准不统一。对于体外诊断试剂,分属于药品和器械的管理范畴,企业在生产和经营此类产品时,既要办理药品经营许可证,又要办理医疗器械生产经营企业许可证,而且两种证书的审查标准不统一,给企业造成不必要的负担。 纵观《条例》,医疗器械生产企业在取得“医疗器械生产企业许可证”后方能从事医疗器
医疗器械(行业)标准制修订工作规范 为了加强对医疗器械标准制修订工作的管理,建立公开透明、高效的医疗器械(行业)标准制修订运行机制,保证制修订医疗器械标准的质量,促进医疗器械产业的发展,根据《中华人民共和国标准化法》、《医疗器械监督管理条例》和《医疗器械标准化管理办法(试行)》,制定本工作规范。 一、医疗器械行业标准的立项 (一)医疗器械标准制修订计划项目实行全年公开征集制度。任何单位和个人均可根据医疗器械标准计划立项条件,向医疗器械专业标准化技术委员会或国家食品药品监督管理局提出标准立项申请。 (二)医疗器械标准制修订计划项目立项应符合下列条件: 1.符合国家现行的法律法规和标准化工作的有关规定; 2.符合医疗器械标准立项范围和指导原则; 3.对规范市场秩序、提高社会和经济效益有支持和推动作用; 4.医疗器械监督管理和医疗器械技术发展需要; 5.符合国家采用国际标准或国外先进标准的政策; 6.同现行的医疗器械标准及立项的标准计划没有交叉、重复; 7.属于申报单位的专业范围;
8.提交医疗器械标准草案或技术大纲(不包括修订的标准和采用国际标准及国外先进标准); 9.完成期限不超过三年。 (三)标准制修订立项前应依次进行下列工作: 1.标准草案或提要(范围和主要技术内容); 2. 确定制修订标准的原则和内容; 3. 必要性论证; 4. 可行性论证;
5. 编制工作大纲。 (四)专业标准化技术委员会或归口单位对符合医疗器械标准制修订计划项目立项条件的项目,提出医疗器械标准制修订计划项目立项建议。 单位和个人向国家食品药品监督管理局提出的医疗器械标准制修订项目提案,由国家食品药品监督管理局委托有关技术委员会、分技术委员会或归口单位提出医疗器械标准制修订计划项目立项建议,提案单位或个人可做为起草单位或起草人参加该项目。 (五)国家食品药品监督管理局对医疗器械标准制修订计划项目进行初审,并对拟开展的计划项目在本行业内公开征求意见。 (六)国家食品药品监督管理局经审查和协调各方意见,确定医疗器械标准制修订计划项目,并正式下达和公布。行业标准计划项目没有对应的技术委员会、归口单位或对应、归口有交叉的,由国家食品药品监督管理局指定的专业技术委员会承担。 (七)国家食品药品监督管理局每年下达一次计划项目,急需项目可随时立项下达和公布。 (八)专业标准化技术委员会或归口单位接到国家食品药品监督管理局下达的医疗器械标准制修订计划项目后,应及时转发到项目起草单位,并做好器械标准制标准修订计划项目执行的监督检查和技术
医疗器械标准管理规定试 行局令第号 Prepared on 21 November 2021
《医疗器械标准管理办法》(试行)(局令第31号) 国家药品监督管理局局令 第31号 《医疗器械标准管理办法》(试行)于2001年11月19日经国家药品监督管理局局务会审议通过,现予发布。本办法自2002年5月1日起施行。 二○○二年一月四日 医疗器械标准管理办法 (试行) 第一章总则 第一条为了加强医疗器械标准工作,保证医疗器械的安全、有效,根据《医疗器械监督 管理条例》,制定
本办法。 第二条凡在中国境内从事医疗器械研制、生产、经营、使用和监督管理的单位或者个人, 应遵守本办法。 第三条医疗器械标准分为国家标准、行业标准和注册产品标准。 (一)国家标准或行业标准是指需要在全国范围内统一技术要求的标准。 (二)注册产品标准是指由制造商制定,应能保证产品安全有效,并在产品申请注册时,经 设区的市级以上药品监督管理部门依据国家标准和行业标准相关要求复核的产品标准。 第四条国家对医疗器械标准工作实行奖励制度。 第二章标准工作的管理机构和职能 第五条国务院药品监督管理部门履行下列职责:
(一)组织贯彻医疗器械标准工作的法律、法规,制定医疗器械标准工作的方针、政策和管 理办法; (二)组织制定和实施医疗器械标准工作规划和计划。指导、监督全国医疗器械标准工作; (三)组织起草医疗器械国家标准。组织制定、发布医疗器械行业标准。依据国家标准和行 业标准的相关要求复核进口医疗器械的注册产品标准及境内生产的第三类医疗器械注册产品标 准; (四)监督实施医疗器械标准; (五)管理各医疗器械专业标准化技术委员会; (六)组织转化国际标准,开展对外标准工作交流; (七)负责医疗器械标准工作的表彰和奖励。管理标准工作经费。 第六条国务院药品监督管理部门设立医疗器械标准化技术委员会,负责全国医疗器械标 准化工作的技术