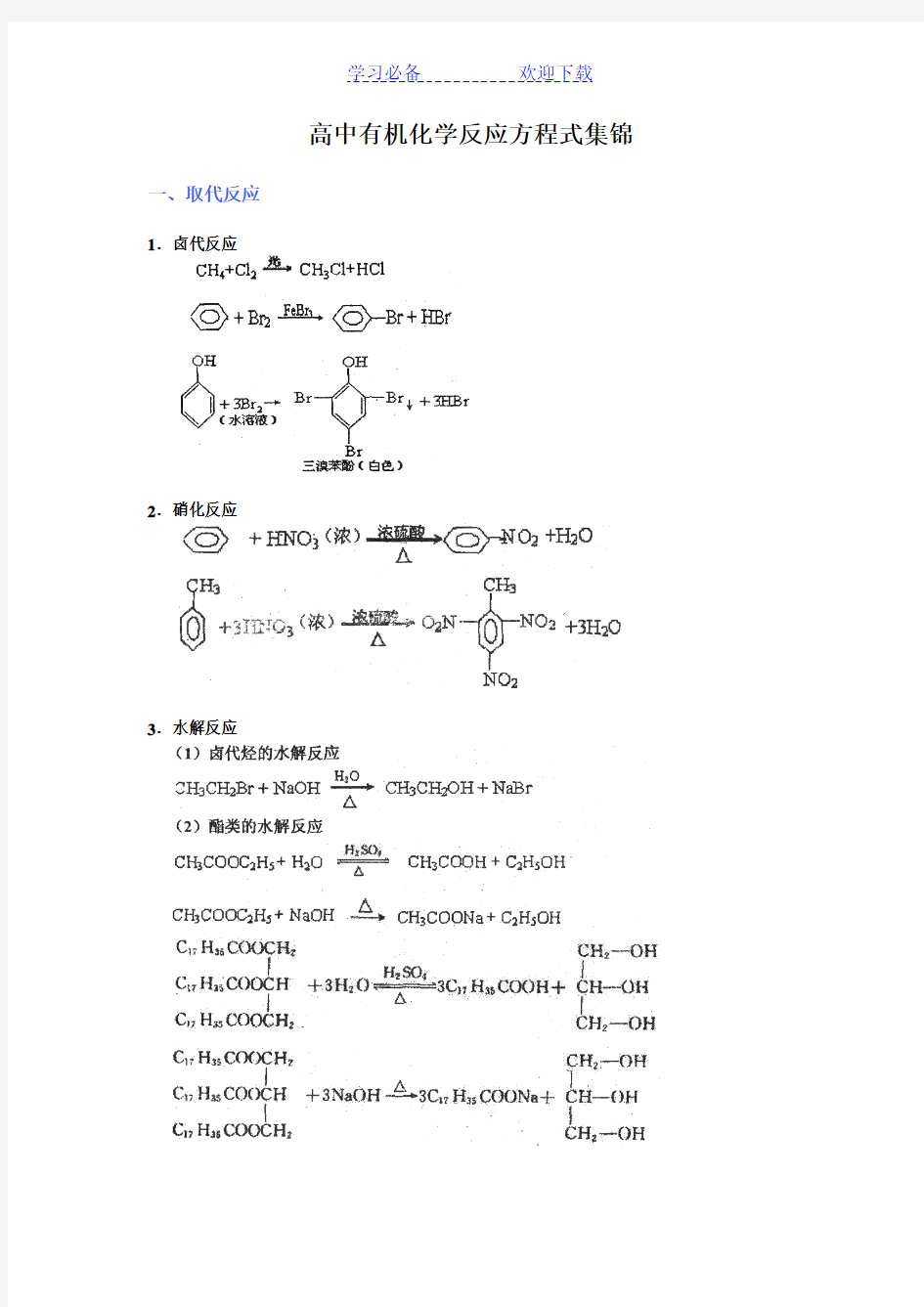

高中有机化学反应方程式集锦一、取代反应
1.卤代反应
2.硝化反应
3.水解反应
4.酯化反应
5.其他取代反应
二、加成反应
1.烯烃、炔烃与H2、X2、HX、H2O等加成
2.苯及其同系物与H2加成
3.醛、酮与H2、HCN加成
三、消去反应
1.卤代烃的消去反应
2.醇的消去反应
四、氧化反应(加O去H)
1.燃烧反应
2.醇、醛的催化氧化
3.醛被银氨溶液、新制Cu(OH)2悬浊液等弱氧化剂氧化
4.烯烃、炔烃、苯的同系物、醇、醛等被酸性KMnO4溶液等强氧化剂氧化
五、还原反应(加H去O)
1.烯烃、炔烃、苯及其同系物与H2加成
2.醛、酮与H2加成
3.硝基化合物的还原
六、聚合反应1.加聚反应
2.缩聚反应
七、中和反应
八、显色反应
九、其他反应
高中化学所有化学反应方程式 一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H) 1、氧化性: F2+H2===2HF (阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2 (水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 ) Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2 Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-) Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2 Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I2 3Cl2(过量)+2KI+3H2O===6H Cl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓ Cl2+H2S===2HCl+S↓(水溶液中:Cl2+H2S=2H++2Cl–+S↓ Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl– Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O2 2O2+3Fe Fe3O4O2+K===KO2 S+H2H2S 2S+C CS2S+Zn ZnS S+Fe FeS (既能由单质制取,又能由离子制取) S+2Cu Cu2S (只能由单质制取,不能由离子制取) 3S+2Al Al2S3 (只能由单质制取,不能由离子制取)
高中有机化学方程式总结 一、烃 1.甲烷 烷烃通式:C n H 2n -2 (1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。 (2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯 乙烯的制取:CH 3CH 2OH H 2 烯烃通式:C n H 2n (1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2(2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 点燃 光 光 光 光 浓硫酸 170℃ 高温 催化剂 △ 图1 乙烯的制取
乙烯加聚,生成聚乙烯:n H 2 3.乙炔 乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CH B r CHBr=CHBr+Br 2 CHBr 2—CHBr 2 与氢气加成:HC ≡CH+H 2 H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2 n CH n 4.苯 苯的同系物通式:C n H 2n-6 (1)氧化反应 苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。 CH 2-CH 2 点燃 图2 乙炔的制取 催化剂 △ Br CH 2—CH Cl CH=CH 点燃
大学有机化学反应方程式总 结(较全) -标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH -
【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】 2 C H 33H 32 3H 32 CH CH 2C H 3H BH 2 CH CH=CH (CH 3CH 2CH 2)3 - H 3CH 2CH 2C 22CH 3 CH 2O CH 2CH 2CH 3 H 3CH 2CH 2C 2CH 2CH 3 + O H - O H B - OC H 2CH 2CH 3CH 2CH 2CH 3 H 3CH 2CH 2B OC H 2CH 2CH 3 CH 2CH 2CH 3H 2CH 2CH 3 HOO -B(OCH 2CH 2CH 3)3 B(OCH 2CH 2CH 3)3 + 3NaOH 3NaOH 3HOC H 2CH 2CH 33 + Na 3BO 3 2 【例】 CH 3 1)BH 32)H 2O 2/OH -CH 3H H OH 3、X 2加成 C C Br /CCl C C Br Br 【机理】
化学反应原理 第一章化学反应与能量 第一节化学反应与能量的变化 第二节燃烧热能源 第三节化学反应热的计算 归纳与整理 第二章化学反应速率和化学平衡 第一节化学反应速率 第二节影响化学反应速率的因素第二节影响化学反应速率的因素 第三节化学平衡 第四节化学反应进行的方向 归纳与整理 第三章水溶液中的离子平衡 第一节弱电解质的电离 第二节水的电离和溶液的酸碱性 第三节盐类的水解 第四节难溶电解质的溶解平衡 归纳与整理 第四章电化学基础 第一节原电池 第二节化学电源 第三节电解池 第四节金属的电化学腐蚀与防护 归纳与整理 化学选修4化学反应与原理 章节知识点梳理 第一章化学反应与能量 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0 ☆常见的放热反应:①所有的燃烧反应②酸碱中和反应 ③大多数的化合反应④金属与酸的反应 ⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl ②大多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。
《钠》和《钠的化合物》常用化学方程式(要求熟记) 4Na+O2====Na2O 2Na+O2====Na2O2 2Na+Cl2====2NaCl(常温下也反应) 2Na+S====Na2S(可能爆炸) 2Na+2H2O====2NaOH+H2↑ 2Na+2HCl====2NaCl+H2↑ 2NaOH+CuSO4====Na2SO4+Cu(OH)2 4Na+TiCl4====Ti+4NaCl Na2O+H2O====2NaOH Na2O+2HCl====2NaCl+H2O Na2O+CO2====Na2CO3 2Na2O2+2H2O====4NaOH+O2 2Na2O2+2CO2====2Na2CO3+O2 Ca(OH)2+CO2(少量)====CaCO3↓+H2O Ca(OH)2+2CO2(过量)====Ca(HCO3)2 CaCO3+CO2+H2O====Ca(HCO3)2 2NaOH+CO2(少量)====Na2CO3+H2O NaOH+CO2(过量)====NaHCO3 Na2CO3+H2O+CO2====2NaHCO3 Na2CO3+2HCl====H2O+CO2+2NaCl NaHCO3+HCl====H2O+CO2+NaCl Na2CO3+Ca(OH)2====2NaOH+CaCO3↓ Na2CO3+CaCl2====CaCO3↓+2NaCl NaHCO3+NaOH====Na2CO3+H2O 2NaHCO3+Ca(OH)2(少量)====Na2CO3+CaCO3↓+H2O NaHCO3+Ca(OH)2(过量)====NaOH+CaCO3↓+H2O 2NaHCO3====Na2CO3+H2O+CO2 ·1·
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
高一化学反应与能量知识点总结 一、在化学反应过程中,化学键的断裂需要吸收外界的能量,化学键的形成会向外界释放出能量,因此在化学反应中,参与反应的物质会伴随着能量的变化。 1、化学变化中能量变化的本质原因 ①当化学键键能越大,断开时所需的能量就越多,形成时所释放出的能量也越多。 ②化学反应中,反应物中的化学键(总键能E1)断裂时,吸收能量E1,在形成化学键变成生成物(总键能E2)时,放出能量E2。整个过程中,反应体系从外界吸收的能量为 ΔE=E1-E2 . 2、有的化学反应会吸收能量,有的化学反应会放出能量。 据图可知,一个化学反应是吸收能量 还是放出能量,决定于反应物总能量 与生成物总能量的相对大小。 3、任何化学反应除遵循质量守恒外,同样也遵循能量守恒。反应物与生成物的能量差若以热量形式表现即为放热反应(化学能转化成热能)或吸热反应(热能转化成化学能)。 (E反:反应物具有的能量;E生:生成物具有的能量): 4、放热反应和吸热反应 表现形式放热反应吸热反应 键能变化生成物总键能大于反应物总键能生成物总键能小于反应物总键能 由1、2联系得键能越大,物质能量越低,越稳定;反之键能越小,物质能量越高,越不稳定, 图示
5、常见的放热反应和吸热反应 ☆常见的放热反应: ①所有的燃烧与缓慢氧化。②酸碱中和反应。③金属与酸反应制取氢气。 ④大多数化合反应(特殊:C+CO2△ 2CO是吸热反应)。 注意:有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。某些常见的热效应:放热:①浓硫酸溶于水②NaOH溶于水③CaO溶于水,其中属于放热反应的是③ ☆常见的吸热反应:①以C、H2、CO为还原剂的氧化还原反应如: C(s)+H2O(g)△ CO(g)+H2(g)。 ②铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O ③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。 [思考]一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明。 点拔:这种说法不对。如C+O2=CO2的反应是放热反应,但需要加热,只是反应开始后不再需要加热,反应放出的热量可以使反应继续下去。Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,但反应并不需要加热。 二、化学反应中化学能除了可以转化为热能,还可以转化为电能,因此,可以将化学反应用于电池中电能的生产源,由此制备将化学能转化为电能的装置------原电池。 1、原电池原理 (1)概念:把化学能直接转化为电能的装置叫做原电池。 (2)原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。(3)构成原电池的条件:①两种活泼性不同的电极 ②电解质溶液(做原电池的内电路,并参与反应) ③形成闭合回路 ④能自发地发生氧化还原反应 (4)电极名称及发生的反应: 负极:较活泼的金属作负极,负极发生氧化反应, 电极反应式:较活泼金属-ne-=金属阳离子 负极现象:负极溶解,负极质量减少。 正极:较不活泼的金属或石墨作正极,正极发生还原反应,
光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 催化剂 △ 催化剂 △ 催化剂 催化剂 催化剂 催化剂 △ 催化剂 催化剂 浓硫酸 △ △ 高中有機化學方程式匯總 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2 Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n 13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 21. + Br 2 Br + HBr 22. + HO -NO 2 NO 2 +H 2O 23. + HO -SO 3H SO 3H+H 2O
常见有机化学方程式归纳 物质类别性质反应方程式 一、烷烃 1、燃烧 CH4 + 2O2CO2 + 2H2O 2、取代反应 CH4 + Cl2CH3Cl + HCl CH3Cl + Cl2CH2Cl2 + HCl(或CH4 + 2Cl2CH2Cl2 + 2HCl) CH2Cl2 + Cl2CHCl3 + HCl(或CH4 + 3Cl2CHCl3 + 3HCl) CHCl3 + Cl2CCl4 + HCl(或CH4 + 4Cl2CCl4 + 4HCl) CH3CH3 + Br2CH3CH2Br + HBr 3、高温分解CH4 C + 2H2↑ 二、烯烃 1、燃烧 C2H4 + 3O22CO2 + 2H2O 2、加成反应
3、加聚反应 4、氧化反应 三、炔烃 1、燃烧 2C2H2 + 5O24CO2 + 2H2O 2、加成反应 四、芳香烃 1、卤代 2、硝化
3、加成 4、氧化 五、醇 1、与活泼金属反应2CH3CH2OH +2 Na2CH3CH2ONa + H2↑ 2、消去反应 3、脱水成醚 4、取代反应 5、氧化
6、酯化反应 六、醛1、氧化 2C2H4O + 5O24CO2 + 4H2O
2、还原 七、酮1、加氢还原 八、羧酸 1、酸性 2CH3COOH + 2Na = 2CH3COONa + H2↑ CH3COOH + NaOH = CHCOONa + H2O 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑ CH3COOH + NaHCO3 = CH3COONa + H2O + CO2↑ 2、酯化反应参考醇的性质 九、酯1、水解 十一、卤代烃 1、水解反应 2、消去反应 十二、酚1、弱酸性
高中化学反应方程式大全 一、非金属单质(F2 ,Cl2 、O2 、S、N2 、P 、 C 、Si) 1.氧化性: F2 + H2 === 2HF F2 + 2NaCl === 2NaF + Cl2 F2 + 2NaBr === 2NaF + Br2 F2 + 2NaI === 2NaF + I2 Cl2 + H2 === 2HCl Cl2 + 2FeCl2 === 2FeCl3 2Cl2 + 2NaBr === 2NaCl + Br2 Cl2 + 2NaI === 2NaCl + I2 Cl2 + Na2S === 2NaCl + S Cl2 + H2S === 2HCl + S S + H2 === H2S N2 + 3H2 === 2NH3 P2 + 6H2 === 4PH3 2.还原性 S + O2 === SO2 N2 + O2 === 2NO 4P + 5O2 === 2P2O5 C + 2Cl2 === CCl4 2C + O2(少量) === 2CO C + O2(足量) === CO2 C + CO2 === 2CO C + H2O === CO + H2(生成水煤气) 2C + SiO2 === Si + 2CO(制得粗硅) Si(粗) + 2Cl2 === SiCl4 (SiCl4 + 2H2 === Si(纯) + 4HCl) Si + C === SiC(金刚砂) Si + 2NaOH + H2O === Na2SiO3 + 2H2
3(碱中)歧化 Cl2 + H2O === HCl + HClO (加酸抑制歧化,加碱或光照促进歧化) Cl2 + 2NaOH === NaCl + NaClO + H2O 2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O 3C + CaO === CaC2 + CO 3C + SiO2 === SiC + 2CO 二、金属单质(Na,Mg,Al,Fe)的还原性 2Na + H2 === 2NaH 4Na + O2 === 2Na2O 2Na2O + O2 === 2Na2O2 2Na + O2 === Na2O2 2Na + S === Na2S(爆炸) 2Na + 2H2O === 2NaOH + H2 Mg + Cl2 === MgCl2 Mg + Br2 === MgBr2 2Mg + O2 === 2MgO Mg + S === MgS Mg + 2H2O === Mg(OH)2 + H2 2Mg + CO2 === 2MgO + C Mg + H2SO4 === MgSO4 + H2 2Al + 3Cl2 === 2AlCl3 4Al + 3O2 === 2Al2O3(钝化) 2Al + Fe2O3 === Al2O3 + 2Fe 2Al + 3FeO === Al2O3 + 3Fe 2Al + 6HCl === 2AlCl3 + 3H2 2Al + 3H2SO4 === Al2(SO4)3 + 3H2 2Al + 6H2SO4(浓) === Al2(SO4)3 + 3SO2 + 6H2O (Al、Fe在冷、浓的H2SO4、HNO3中钝化)
有机反应方程式书写竞赛 一.写出下列反应的方程式(注明反应条件,配平物质系数,有机物用其结构简式表示) (一).加成反应 1. 催化剂 加压 CH +CHCHCH 2CCH 2OCCOOH CHO O O H 2 2. + Br 2(发生1,4加成) 3. +H 2 (二).取代反应 1.甲苯侧链的溴代反应 + Br 2蒸气 2.甲苯苯环的溴代反应 + 液Br 2 3.甲苯的硝化反应 4.苯酚的溴代反应 5. 6. C CH 2OH OH O 7. COOH +CH 2OH CH 3 | +3HNO 3 浓硫酸 —OH + 3Br 2 光照 CH 3FeBr 3 CH 3 —CHO CHO
(三).消去反应 1.醇的消去反应 2.卤代烃的消去反应 (1). 与氢氧化钠的醇溶液共热反应 (2). 与氢氧化钠的醇溶液共热反应 (3).与氢氧化钠的醇溶液共热反应 (四)氧化反应 1醛基的氧化反应 (1)写出下列物质与银氨溶液和新制的氢氧化铜悬浊液共热的方程式 ①.CH CHO CHO ②. ③. 2.醇的催化氧化 (五)加聚反应 1.n (六)缩聚反应 1. 浓H2SO4 n HOCH2CH2OH+n HOOC-COOH 2.n 3. —Cl 催化剂 H3C CH浓H2SO
二.写出下列物质与相关物质反应的化学方程式 1. .足量氢氧化钠溶液共热反应 2. 3. 足量氢氧化钠溶液共热反应 足量氢氧化钠溶液共热反应 4. . 足量氢氧化钠溶液共热反应 5. 足量氢氧化钠溶液共热反应 6. 丁子香酚( )与溴水反应的方程式: 7. 8. 足量氢氧化钠的乙醇溶液共热反应 9. 足量氢氧化钠的乙醇溶液共热反应 -CH ―CH ―COOH Br Br —O —C —H HOOC — O +NaHCO 3 → ——OH HO — C H 2 CH 2CH OCH 3 OH 催化剂 HO C O CH 2CH OH C O O CH 22Br |OH
《化学反应与能量的变化》教学设计 知道反应热与化学键的关系。 知道反应热与反应物、生成物总能量 第一章化学反应与能量
第一节化学反应与能量的变化(第1课时) 1.焓变 ①概念:焓(H)是与内能有关的。在一定条件下,某一化学反应是吸热反应还是放热反应,由 生成物与反应物的即焓变(ΔH)决定。 ②常用单位:。 焓变与反应热的关系:恒压条件下,反应的热效应等于焓变。因此,我们常用表示反应热。2.1 mol H2分子中的化学键断裂吸收436 kJ的能量,1 mol Cl2分子中的化学键断裂吸收243 kJ的能量, 2 mol HCl分子中的化学键形成释放862 kJ的能量,则H2(g)+Cl2(g)===2HCl(g)的反应放出的热量 为。 3.ΔH的正、负和吸热、放热反应的关系 (1)放热反应:ΔH 0(填“<”或“>”),即ΔH为 (填“+”或“-”)。 (2)吸热反应:ΔH 0(填“<”或“>”),即ΔH为 (填“+”或“-”)。 4.△H计算的表达式: 合作探究 一、探究: 1、对于放热反应:能量如何转换的?能量从哪里转移到哪里? 体系的能量如何变化?升高还是降低? 环境的能量如何变化?升高还是降低? 规定放热反应的ΔH 为“-”,是站在谁的角度?体系还是环境? 2、由课本P2 中H2+Cl2=2HCl反应热的计算总结出用物质的键能计算反应热的数学表达式 △H= 3、△H<0时反应热△H > 0时反应热 4、如何理解课本P3中△H =-184.6kJ/mol中的“/mol 5、由课本P3 中图1-2 总结出用物质的能量计算反应热的数学表达式 二、反思总结 1、常见的放热、吸热反应分别有哪些? ①常见的放热反应有 ②常见的吸热反应有: 2、△H<0时反应热△H > 0时反应热 3、反应热的数学表达式:△H= 【小结】焓变反应热 在化学反应过程中,不仅有物质的变化,同时还伴有能量变化。 1.焓和焓变 焓是与物质内能有关的物理量。单位:kJ·mol-1,符号:H。
高中化学全部反应公式汇总 编辑:徐淑贤2012-11-13 13:53:00来源:中国教育在线一、非金属单质(F2,Cl2、O2、S、N2、P、C、Si 1.氧化性: F2+H2===2HF F2+Xe(过量===XeF2 2F2(过量+Xe===XeF4 nF2+2M===2MFn(表示大部分金属 2F2+2H2O===4HF+O2 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 F2+Cl2(等体积===2ClF 3F2(过量+Cl2===2ClF3 7F2(过量+I2===2IF7 Cl2+H2===2HCl 3Cl2+2P===2PCl3 Cl2+PCl3===PCl5 Cl2+2Na===2NaCl
3Cl2+2Fe===2FeCl3 Cl2+2FeCl2===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2+2NaI===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2+Na2S===2NaCl+S Cl2+H2S===2HCl+S Cl2+SO2+2H2O===H2SO4+2HCl Cl2+H2O2===2HCl+O2 2O2+3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3
N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N N2+6Rb===2Rb3N P2+6H2===4PH3 P+3Na===Na3P 2P+3Zn===Zn3P2 2.还原性 S+O2===SO2 S+O2===SO2 S+6HNO3(浓===H2SO4+6NO2+2H2O 3S+4HNO3(稀===3SO2+4NO+2H2O N2+O2===2NO 4P+5O2===P4O10(常写成P2O5 2P+3X2===2PX3(X表示F2,Cl2,Br2 PX3+X2===PX5 P4+20HNO3(浓===4H3PO4+20NO2+4H2O C+2F2===CF4 C+2Cl2===CCl4
高中化学反应方程式总结 化学方程式离子方程式 1.4Na+O2=2Na2O———————— ————————2.2Na+O 2Na2O2 ————————3.4Li+O 22Li2O 4.2Na+2H2O=2NaOH+H2↑2Na+2H2O=2Na++2OH-+H2↑ 5.2K+2H2O=2KOH+H2↑2K+2H2O=2K++2OH-+H2↑ 6.2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4Na++4OH-+O2↑ 7.2Na2O2+2CO2=2Na2CO3+O2———————— ————————8.2NaHCO 3Na2CO3+H2O+CO2↑ 9.Na2CO3+2HCl=2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑ 10.NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑ 11.Na2CO3+CaCl2=2NaCl+CaCO3↓CO32-+Ca2+= CaCO3↓ 12.NaHCO3+NaOH=Na2CO3+H2O OH-+HCO3-=H2O+CO32- 13.Na2SO4+BaCl2=2NaCl+BaSO4↓SO42-+Ba2+= BaSO4↓ 14.2NaCl(熔融) 2Na+Cl2↑———————— 15.2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al+2OH-+2H2O=2AlO2-+3H2↑ 16.2Al+6HCl=2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑ 17.Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O 18.Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O 19.Al2(SO4)3+6NH3·H2O=3(NH4)2SO4+2Al(OH)3↓Al3++3NH3·H2O=3NH4++Al(OH)3↓ 20.Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4Al3++3OH-=Al(OH)3↓ 21.Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O 22.Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O ————————23.2Al(OH) 3 Al2O3+3H2O ————————24. 2Al2O3(熔融) 4Al+3O2↑ 25.AlCl3 + 4NaOH =NaAlO2 + 3NaCl+2H2O Al3+ + 4OH- = AlO2- + 2H2O 26.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl Al3++3AlO2-+6H2O=4Al(OH)3↓ ————————27. 3Fe+4H2O(g)Fe3O4+4H2
有机化学基础反应方程式汇总 1. 甲烷(烷烃通式:C n H 2n +2) 甲烷的制取:CH 3CaO △ 2CO 3+CH 4↑ (1)氧化反应 甲烷的燃烧:CH 4+2O 2点燃2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。 (2)取代反应 CH 4+Cl 光照3Cl(一氯甲烷)+HCl CH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HCl CH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿) CHCl 3+Cl 光照 4(四氯化碳)+HCl (3)分解反应 甲烷分解:CH 高温2 2. 乙烯(烯烃通式:C n H 2n ) 乙烯的制取:CH 3CH 2浓硫酸2=CH 2↑+H 2O(消去反应) (1)氧化反应 乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br 与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O 催化剂CH 3CH 2OH (3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2 催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3? Cl CH -? Cl CH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3? Cl CH CH 3 图2 乙烯的制取 图1 甲烷的制取
第二章化学反应速率和化学平衡 一、化学反应速率 课标要求 1、掌握化学反应速率的含义及其计算 2、了解测定化学反应速率的实验方法 要点精讲 1、化学反应速率 (1)化学反应速率的概念 化学反应速率是用来衡量化学反应进行的快慢程度的物理量。 (2)化学反应速率的表示方法 对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。 某一物质A的化学反应速率的表达式为: 式中——某物质A的浓度变化,常用单位为mol·L-1。 ——某段时间间隔,常用单位为s,min,h。 υ——物质A的反应速率,常用单位是mol·L-1·s-1,mol·L-1·s-1等。 (3)化学反应速率的计算规律 ①同一反应中不同物质的化学反应速率间的关系 同一时间内,用不同的物质表示的同一反应的反应速率数值之比等于化学方程式中各物质的化学计量数之比。 ②化学反应速率的计算规律 同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。 (4)化学反应速率的特点 ①反应速率不取负值,用任何一种物质的变化来表示反应速率都不取负值。 ②同一化学反应选用不同物质表示反应速率时,可能有不同的速率数值,但速率之比等于化学方程式中各物质的化学计量数之比。 ③化学反应速率是指时间内的“平均”反应速率。 小贴士:①化学反应速率通常指的是某物质在某一段时间内化学反应的平均速率,而不是在某一时刻的瞬时速率。 ②由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯液体或纯固体来表示化学反应速率。其化学反应速率与其表面积大小有关,而
有机化学反应类型全总结一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应. 取代反应的类型很多, 中学化学中主要有下面几类: 1.卤代反应烷烃、芳香烃、苯酚等均能发生卤代反应如: 。 2.硝化反应苯及其同系物、苯酚、烷烃等均能发生硝化反应如:
3.磺化反应苯、苯的衍生物, 几乎均可磺化.如: ; (邻、对位产物为主) 4. 酯化反应 (1)羧酸和醇的反应.如: (2)无机含氧酸和醇的反应.如: 5.水解反应: 卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应.如: , 6. 与活泼金属的反应: 醇、酚、羧酸等均能与活泼金属如钠反应生成氢气.如:
, 7.醇与卤化氢(HX)的反应.如: 8.羧酸或醇的分子间脱水.如: 二、加成反应 定义有机物分子里不饱和的碳原子跟其它原子或原子团直接结合, 生成别的物质的反应, 叫加成反应分子结构中含有双键或叁键的化合物, 一般能与H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子物质起加成反应. 如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等. 说明: 1.羧基和酯基中的碳氧双键不能发生加成反应。 2.醛、酮的羰基只能与H2发生加成反应。 3.共轭二烯有两种不同的加成形式。 1.和氢气加成. — 2.和卤素加成
3.; 4.和卤化氢加成 5.和水加成 三、消去反应 定义:有机化合物在适当条件下, 从一个分子相邻两个碳原子上脱去一个小分子(如H2O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除反应发生消去反应的化合物需具备以下两个条件: (1)是连有一OH(或一X)的碳原子有相邻的碳原子; — (2)是该相邻的碳原子上还必须连有H原子. 1.醇的消去反应.如: 2.卤代烃的消去反应.如: 四、聚合反应 定义:由许多单个分子互相结合生成高分子化合物的反应叫聚合反应. 聚合反应有两个基本类型:加聚反应和缩聚反应. 1.加聚反应. 由许多单个分子互相加成, 又不缩掉其它小分子的聚合反应称为加成聚合反应简称加聚反应. ! 烯烃、二烯烃及含的物质均能发生加聚反应.如:
光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 △ 催化剂 有机化学方程式汇总 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 23 12. nCH 2 = CH 2 ] n 13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2O
NaOH H 2 O 醇 △ 催化剂 △ 浓硫酸 170℃ 浓硫酸 140℃ 催化剂 △ 24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr 29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O 30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 3 37 38. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O 41CH 3O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑
§选修四-化学反应原理 化学反应与能量 一.知识解读 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0 ☆常见的放热反应:①所有的燃烧反应②酸碱中和反应 ③大多数的化合反应④金属与酸的反应 ⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl ②大多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示)
③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热 1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101 kPa ②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1 mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 四、中和热 1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。 2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为: H+(aq) +OH-(aq) =H2O(l) ΔH=-57.3kJ/mol 3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。 4.中和热的测定实验 五、盖斯定律 1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。