化学竞赛、自招考试材料——原子簇合物之三
过渡金属元素为骨架的原子簇合物
胡征善
一、过渡金属多核原子簇化合物[M a L z]±c
过渡金属多核原子簇化合物除少数外[如Cr2(CO)10(μ2-CO)2],金属原子间均存在单键或多重键(双键、三键、四键)。
1.过渡金属元素多核原子簇的构型Ps:Ps=(va+x—12a±c)/2。
式中v为金属原子价电子数,x为z个配体L提供的总电子数,±c 为所带电荷数,阳离子用“—”,阴离子用“+”;12为骨架过渡金属原子有9个原子轨道只能有3个轨道6个e—参与骨架成键,余下的6个轨道只容纳12个e—(非骨架成键电子)。
簇单位[ML z/a]±c′,Ps=[(v+x—12)±c′]/2,x为z/a个配体L提供的总电子数。
骨架成键电子对数Ps=aPs′。
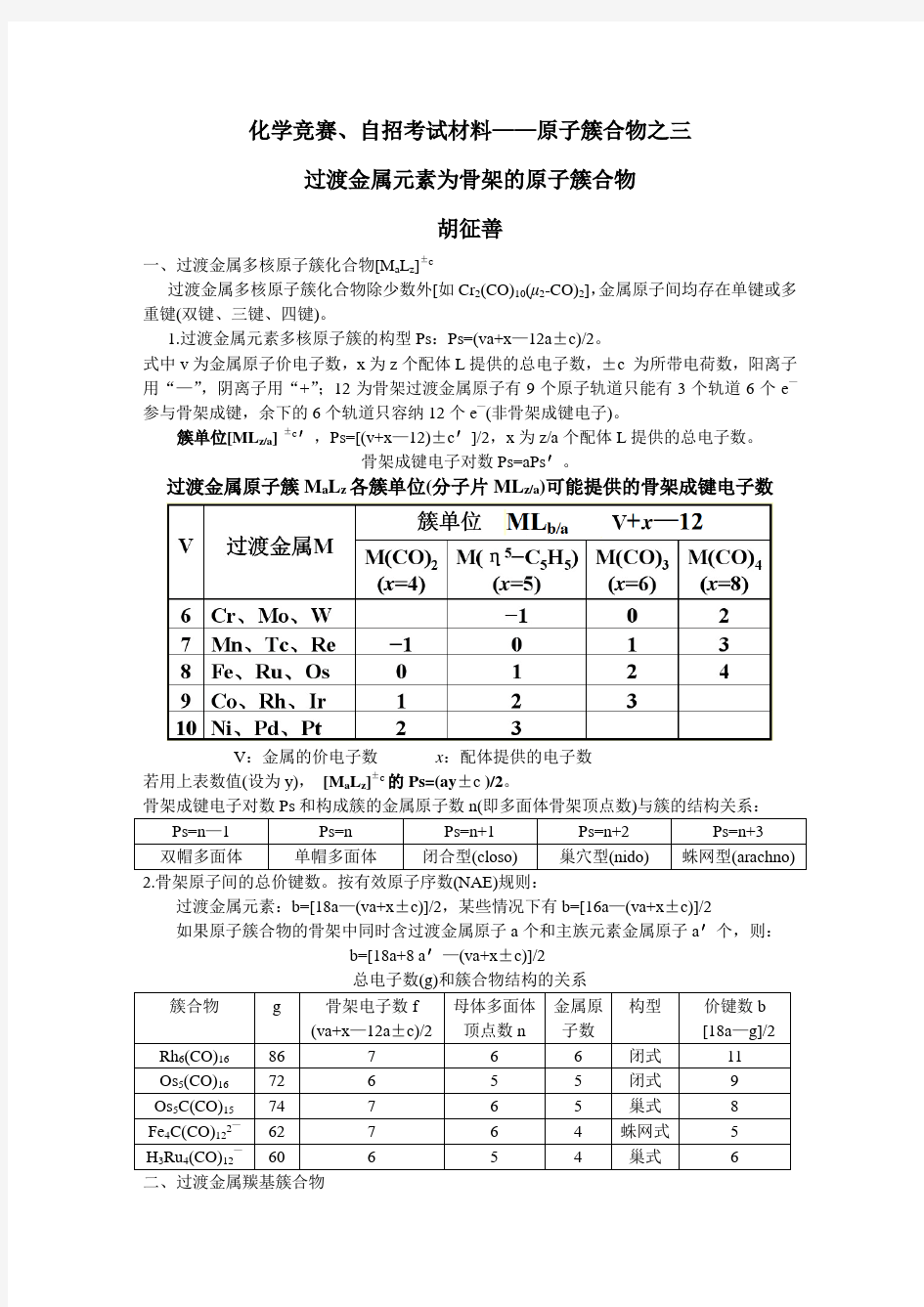
过渡金属原子簇M a L z各簇单位(分子片ML z/a)可能提供的骨架成键电子数
V:金属的价电子数x:配体提供的电子数
若用上表数值(设为y),[M a L z]±c的Ps=(ay±c )/2。
骨架成键电子对数Ps和构成簇的金属原子数n(即多面体骨架顶点数)与簇的结构关系:
2.骨架原子间的总价键数。按有效原子序数(NAE)规则:
过渡金属元素:b=[18a—(va+x±c)]/2,某些情况下有b=[16a—(va+x±c)]/2
如果原子簇合物的骨架中同时含过渡金属原子a个和主族元素金属原子a′个,则:
b=[18a+8 a′—(va+x±c)]/2
二、过渡金属羰基簇合物
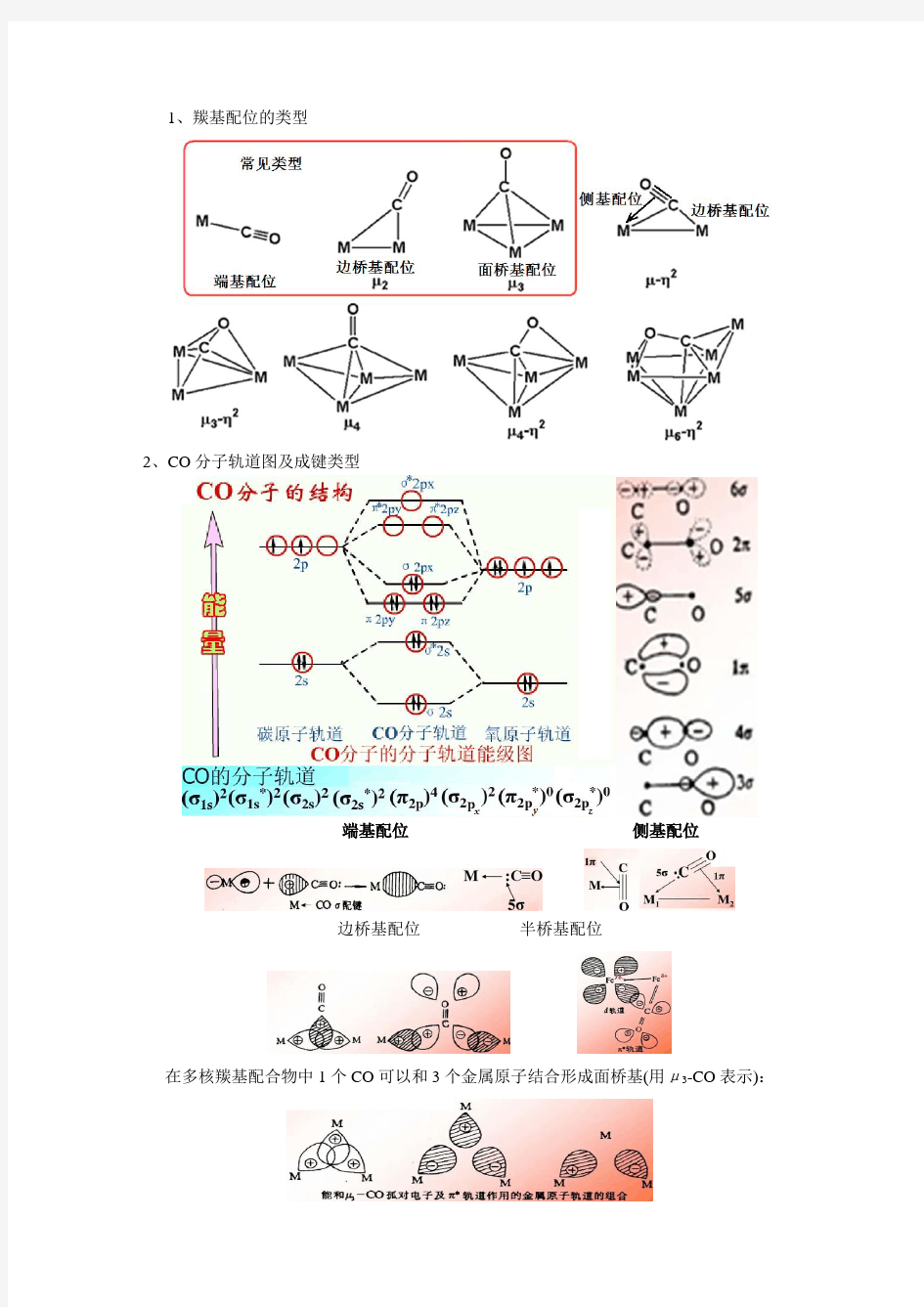
1、羰基配位的类型
2、CO分子轨道图及成键类型
端基配位侧基配位
边桥基配位半桥基配位
在多核羰基配合物中1个CO可以和3个金属原子结合形成面桥基(用μ3-CO表示):
3、簇合物的构型
注:“冠”亦称“帽”
例如:Os6(CO)18中6个Os按双帽四面体排布,每个Os连接3个CO
4、例题
用Wade规则判断簇合物的构型,用NAE规则判断簇合物骨架中原子间的价键。
【例1】Re4(CO)162—
Wade规则:写作[Re(CO)4]42—],f{[Re(CO)4]42—}=[4×(7+8—12)+2]/2=7=4+3,属蛛网式。NAE规则:4Re满足18e—需72e—,而4Re提供28e—,16CO提供32e—,缺72—28—32—2= 10e—,4个Re原子间需共用5对电子(Re—Re金属键)。Re4(CO)162—结构如图所示。
【例2】Ni5(CO)122—
Wade规则:f{[Ni5(CO)12]2—}=[5×10+24+2—5×12]/2=8=5+3,属蛛网式。
NAE规则:5Ni满足18e—需90e—,而5Ni提供50e—,12CO提供24e—,c=2,缺90—50—24—2=14e—,5个Ni原子间需共用7对电子(Ni—Ni金属键)。Ni5(CO)122—结构如图所示(CO 略去)。
【例3】Fe5(CO)15C
Wade规则:写作[Fe(CO)3]5C,f{[Fe(CO)3]5C}=[5×(8+6—12)+4]/2=7=5+2,属开(巢)式。NAE规则:5Fe满足18e—需90e—,而5Fe提供40e—,15CO提供30e—,C提供4e—,缺90—40—30—4=16e—,5个Fe原子间需共用8对电子(Fe—Fe金属键)。Fe5(CO)15C结构如图
所示(CO略去)。
【例4】Ru6(CO)17C
Wade规则:写作[Ru(CO)3]5Ru(CO)2]C,f{[Ru(CO)3]5Ru(CO)2]C}=[5×(8+6—12)+(8+4—12)+4]/2=7=6+1,属闭式。
NAE规则:6Ru满足18e—需108e—,而6Ru提供48e—,17CO提供34e—,C提供4e—,缺108—48—34—4=22e—,6个Ru原子间需共用11对电子(Ru—Ru金属键)。Ru6(CO)17C实为[Ru(CO)3]4[Ru (CO)2]2(μ2-CO),其结构如图所示(CO略去)。
Fe5(CO)15C Ru6(CO)17C
【例5】Os7(CO)21
Wade规则:写作[Os(CO)3]7,f{[Os(CO)3]7}=[7×(8+6—12)]/2=7=7+0,属单帽八面体。NAE规则:7Os满足18e—需126e—,而7Os提供56e—,21CO提供42e—,缺126—56—42= 28e—,7个Os原子间需共用14对电子(Os—Os金属键)。Os7(CO)21结构如图所示(CO略去)。【例6】Ru6(CO)18H2
Wade规则:写作[Ru(CO)3]6]H2,f{[Ru(CO)3]6H2]}=[6×(8+6—12)+2]/2=7=6+1,属闭式。NAE规则:6Ru满足18e—需108e—,而6Ru提供48e—,18CO提供36e—,2个H提供2e—,缺108—48—36—2=22e—,6个Os原子间需共用11对电子(Os—Os金属键)。Os6(CO)18H2结构如图所示(CO略去)。
Os7(CO)21Ru6(CO)18H2
【例7】
Ir4(CO)12Re4(CO)162—Os4(CO)16
总电子数g 36+24=60 28+32+2=62 32+32=64
构型Ps [4(9+6—12)]/2=6 [4(7+8—12)+2]/2=7 [4(8+8—12)]/2=8 闭型4+3(网式) 4+4(敞网式)
价键数b (72—60)/2=6 (72—62)/2=5 (72—64)/2=4 【例8】
[Mo6(μ3-Cl)8Cl6]2—[Nb6(μ2-Cl)12Cl6]4—Mo6(μ3-CO)4(CO)12
总电子数g:36+8×5+6+2=84 30+12×3+6+4=76 54+4×2+24=86
价键数b:(108—84)/2=12 (108—76)/2=16 (108—86)/2=11
骨架原子成键:12个2c-2e—Mo-Mo键8个3c-2e—键3个2c-2e—Rh-Rh键
4个3c-2e—键
注:(1)μ3-Cl提供1个单e—μ2-Cl提供1个单e—μ3-CO提供3个轨道2 个e—和2对e—和1对e—(共3 e—)
(2)6个Nb原子共享32e—6个Mo原子共享22e—
三、过渡金属非羰基簇合物
1、含Cl簇合物——μ1-Cl键、氯桥μ2-Cl键、氯面桥μ3-Cl键
(1)分析W2Cl93—(W原子间距241 pm,抗磁性。金属键:274 pm)、Cr2Cl93—(Cr原子间距312 pm,顺磁性。金属键:251 pm)结构:Cr、W同属ⅥB族元素,价电子组态(n—1)d5ns1,阳离子(Ⅲ)为(n—1)d3。在Cr2Cl93—中,Cr原子间距大(312 pm)且具有顺磁性,说明Cr原子间没有形成Cr—Cr金属键,2个Cr原子通过3个氯桥键(μ4-Cl)连接(下图中2个M共面的3个Cl—),每个Cr再各与3个Cl—连接(图中2个八面体非共点的3个顶点),Cr原子价电子数=3+6+6=15e—,有单电子。在W2Cl93—中,W原子间距短241 pm且具有抗磁性,说明W 原子间有金属键且比金属键长短了33 pm,故W原子间有三键,W原子价电子数为18e—。
(2)Re3Cl123—:3个Re过程三角骨架,含9个μ1-Cl键、3个氯桥μ2-Cl键。
(3)(M6X8)4+(M=Mo、W)型的(Mo6Cl8)4+:[Mo6(μ3-Cl8)]4+
(Mo6Cl8)4+中Mo的价电子数:Mo612+=6×6—12=24,8Cl—=16,总数40,每个Mo分摊40/6。很难用18e—或16 e—规则说明。6个Mo原子构成一个八面体,在八面体的每个面正上方有一个Cl—以面桥基配位(μ3-Cl)。若把8个Cl—取走,Mo612+=24e—,八面体的棱边正好是12个Mo—Mo键。
(4)(M6X12)2+型(M=Nb、Ta)的(Nb6Cl12)2+:[Nb6(μ2-Cl12)]2+
(Nb6Cl12)2+中Nb的价电子数:Nb614+=6×5—14=16,12Cl—=24,总数40,每个Nb分摊40/6。同样道理很难用18e—或16 e—规则说明。若把12个Cl—取走,Nb614+=16e—,八面体的每个面
分摊2e—,正好形成8个3c-2 e—()键。
Re3Cl123—[Mo6(μ3-Cl8)]4+ [Nb6(μ2-Cl12)]2+ Re—Re间距247.7 pm Mo—Mo间距261 pm Nb—Nb间距282 pm
金属中Re—Re间距275 pm 金属中Mo—Mo间距273 pm金属中Nb—Nb间距285 pm 键级2,Re=Re 键级1,Mo—Mo 键级2/3,
(5)[Re2Cl8]2—:每个Re与4个Cl配位,4个Cl大致为平面正方形。Re高出此平面50 pm。
Re—Cl的成键方式:
Re(Ⅲ)的大致组态d4,每个Re原子:dx2—y2、s、p x、p y原子轨道形成4个近似与dsp2杂化轨道,与4个Cl—形成σ-配键。
Re原子间的成键方式:
2个Re采用余下4个d轨道dxy、dxz、dyz、dz2一一对应形成σππδ四重键(沿z轴)。
[Re2Cl8]2—共有7×2+8+2=24e—,其中16个用于Re—Cl键,8个填入σππδ四重轨道中,其
结构为[Cl4Cl4]2—。
上述轨道能级图中,得1e —或2 e —进入δ※轨道、失去δ轨道中的1e —或2 e —
,键级均变为3.5级或3级。 多重键簇合物:
1,7-Re 2(PR 3)2Cl 6 1,3,6,8-Re 2(PR 3)4Cl 4 1,2,7,8-Re 2(PR 3)4Cl 4
σ2π4δ2 (四重键) σ2π4δ2δ※2(3级重键)
1,2,7-Re 2(PR 3)3Cl 5 1,3,6-Re 2(PR 3)3Cl 5
σ2π4δ2δ※1 (3.5级重键)
(6)过渡金属簇合物的组成与结构
5/3
Re Re,291“
(b)(c)(d)(e)(f)(g)(e)(b)(c)(d)(e)(f)(g)
Cl62—
484 12 12 (a)
(a)
(a)
(b)(c)(d)(e)(f)(g)
4/3
(b ) (c ) (d ) (e ) (f )
近二十多年来合成的高核簇合物:Au 55(Pph 3)12Cl 6、Na 6{Mo 120O 366(H 2O)48H 12[Pr(H 2O)5]6}、Pt 309(phen ′)36O 30±106,Pd 561(phen)36O 195±5,(phen 为菲咯啉,phen ′为其衍生物) (2)含S 等簇合物
1、Fe 4S 4(NO)4:黑色晶体。空气中很稳定。4个Fe 构成四面体,4个S 位于四面体正上方的桥面位置。Fe 原子间距离265.1 pm ,12根Fe —S 键长在220.8~222.4 pm 。
2、(5η-C 5H 5)4Co 4S 4:Co 和S 原子相间占据立方体的8个顶点。Co 原子间无化学键。此种类型的还有M 2S 2、M 3S 4、M 3S 6。
【练习】预测[Rh 7(CO)16]3—
、Os 4(CO)12H 3I 、Re 3Cl 3(CH 2SiMe 3)6、Fe 3(CO)12、(CpCo)3(CO)3、
Os 3H 2(CO)10、Fe 3(CO)9S 2、Os 10(CO)24C 2—和[Fe 4(CO)13H]—
的构型。 【答案】
1、[Rh 7(CO)16]3—
:Ps=[7×9+32—12×7)+3]/2=7=7+0,单帽八面体;
b=[18×7—(7×9+32+3)]/2=14。
2、Os 4(CO)12H 3I :{4[Os(CO)3]H 3I},Ps=[4(8+6—12)+3+3]/2 =7=5+2,巢穴式;b=[18×4+8—(4×8+24+3+3)]/2 =9,存在3个氢桥键。
3、Re 3Cl 3(CH 2SiMe 3)6:Ps=[7×3+9—12×3)+6]/2=0,b=[18×3—(7×3+3×3+6×1)]/2=9,存在3个μ3-Cl 键。
4、Fe 3(CO)12:3[Fe(CO)4],Ps=[3(8+8—12)]/2=6=3+3,蛛网式;[18×3—(8×3+24)]/2=3,存在2个羰桥键。
5、(CpCo)3(CO)3:3[CoCp(CO)],Ps=[3(9+5+2—12)]/2=6=3+3,蛛网式;3[18—(9+5+2)]/2=3,存在3个μ2-CO 羰桥键和3个η5-Cp 。
6、Os 3H 2(CO)10:[18×3—(8×3+2+20)]/2=4,存在2个氢桥键
7、Fe 3(CO)9S 2:3[Fe(CO)3]S 2,Ps=[3(8+6—12)+8]/2=7=5+2,巢穴式;[18×3+2×8—(8×3+18+2×4)]/2=10,存在μ4-S 键。
8、[Os 10(CO)24C]2—:{4[Os(CO)3]6[Os(CO)2]C]}2—
,Ps=(4×2+0+4+2)/2=7=10—3,四帽闭式; b=[18×10—(10×8+48+4+2)]/2=14。
9、[Fe 4(CO)13H]—:{4[Fe(CO)3]( CO)H}—
,Ps=[4(8+6—12)+2+2+1+1]/2=7=6+1,闭式; b=[18×4+2+2—(4×8+24+1+1)]/2=9,存在μ4-CO 键(C 原子面桥键和CO π配键。
R=CH2SiMe3
Os4(CO)12H3I Re3Cl3(CH2SiMe3)6Fe3(CO)12
(CpCo)3(CO)3 Os3H2(CO)10、Fe3(CO)9S2、
[Os10(CO)24C]2—[Fe4(CO)13H]—
金属原子簇化学 金属原子簇(MetalClustersCompounds)指的是金属原子之间相互成键形成的多核化合物,这个定义比较老旧,不过也接近现在的定义(对于Clusters的定义,Cotton指出:“A group of the same or similar elements gathered oroccurringclosely together)。有据可查的最早的金属原子簇合物的合成是1858年的 Roussin`ssalt,即K[Fe4S3(NO)7]和K[Fe2S2(NO)4],这一全新的化合物被以其合成者的名字命名,为陆森黑盐和陆森红盐。这种盐是通过一锅法合成的。不过当时的研究尚不充分,也比较冷门,长久以来都未能搞清楚其结构。后来,卢嘉锡和林慰桢指出,黑盐阴离子是由红盐阴离子作为一个蔟单元的生成后二倍缩聚形成的。转入1935年,Brosset报道了一种钨簇合物,其阴离子为W2Cl9(3-),阳离子为K+,W—W 键长为240pm,略小于W的金属原子半径之和(W单质中W—W键为275pm)。1938年,合成了Fe2(CO)9,经测定其结构来说铁原子间距小于铁原子半径之和。后来进入二十世纪六十年代,F·A·Cotton和T·E·Haos 对金属原子簇合物的定义是:“含有直接而明显键合的两个或以上的金属原子的化合物”。美国化学文摘CA 的索引中提出,原子簇化合物是含有三个或三个以上互相键合或极大部分互相键合的金属原子的配位化合物。这个阶段,原子簇合物终于开始了重视性的研究。 如图是三种四核过渡金属簇合物的键价和结构
对金属原子簇合物的合成,在这个阶段也取得了较大的进步。如以很一般的底料,通入常见的保护气如氮气、氢气等,就可以达到一个魔幻化的合成效果。这个合成馆长也说过。以Rh4(CO)12为底物在异丙醇中转化为了两种不同保护气氛下的产物。两个产物的产率都在50%左右。 还有诸如一些含羰基的多核化合物的合成,这些化合物往往是随着核数增加相应增加电子的不定域性,呈现出各种色彩。羰基簇中的羰基一般来说可以有两种不同的方式与金属相结合:其一是CO分子以碳原子端基方式,其二是CO分子以桥基方式、面桥基方式与两个或更多个金属相联。奇异的是,在很多金属羰基簇中,羰基的位置和配位形态可以交换转化,不得不说是科学的奇妙。如下图。 如图,是五核心的金属羰基簇。(a)的金属核是Ni,(b)的金属核是Fe。黑色小球代表金属原子,白色代表羰基。灰色带线条小球代表碳原子。(a)向大家展示了一种多核镍羰基簇合物阴离子的结构。(b)则是一种铁羰基簇合物Fe5(CO)15C。 羰基簇的金属核数目不断被后人所累加上去,这种庞大的团簇分子展示出一种磅礴的美感,其结构上的完美协调和对价键轨道的巧妙运用让人无不叹为观止。下图就是七核心和八核心的羰基簇合物。
—————————— 基金项目:中山大学第六届化学院创新化学研究基金,基金编号:200601 作者简介:覃连敬,中山大学化学与化学工程学院02级化学专业 两个四核过渡金属簇合物的合成、结构 与性质研究 覃连敬 周爱菊 童明良* (中山大学化学与化学工程学院 广州 510275) 摘要 功能多核簇合物是近年来金属配合物研究的热点。在本研究中,合成和表征了两个四核过渡金属簇合物。其组成分别为:[Fe 4(edto)2(N 3)4(CH 3CN)2]·(CH 3CN) (1)和[Ni 4(H 4edto)3(oda)(H 2oda)](OH)2·4.5(H 2O) (2)。单晶X -射线结构分析表明配合物 1 和 2 分别为含缺陷双立方烷 (defect dicubane) 核或含有Y 型排列的四核过渡金属簇合物。另外我们还测定了配合物 2 的磁性,磁性数据表明它是一个核间具有弱反铁磁耦合作用的簇合物。 关键词 纳米簇合物,铁,镍,单分子磁体,磁性 1 前言 设计和合成具有特定结构和物理功能的分子材料是近年来化学研究的一个重要方向。这类材料在高新技术中有着广泛的应用前景[1]。分子磁体的研究受到人们广泛的重视,例如高温有序磁体[2-5]和自旋交叉配合物[6-9]的研究。从材料科学观点来看,当其研究对象是由化学键结合在一起的原子集合体所形成的单一分子时,例如纳米大小的簇合物 [Mn 12O 12(O 2CMe)16(H 2O)4] (简记为Mn 12Ac) [10-12]。我们称它为纳米簇合物材料 (nanocluster materials)。 在纳米簇合物材料中,单分子磁体扮演着重要的角色。目前单分子磁体簇合物合成中关键是选择端基使氧化物粒子周边不至于无限生长,或者使聚氧金属盐含非活性的 M=O 的基团。单分子磁体大多为 Mn ,Fe ,Cr ,V, Ni 等金属的氧化物或氰化物的簇合物。已经合成了一系列高核金属簇合物[13]。 H 4edto O O N N O O H H H H H 4oda (a) (b) Scheme I 配体H 4edto (a)和H 4oda (b)的结构示意图 本论文选择了含有多个配位点的配体 H 4edto (N, N, N’, N’-四羟乙基乙二胺)及两种辅助配体叠氮钠和乙二酰二异羟肟酸(H 4oda),与可溶性Fe 盐和Ni 盐在有机溶剂中反应,期待得到
化学竞赛、自招考试材料——原子簇合物之三 过渡金属元素为骨架的原子簇合物 胡征善 一、过渡金属多核原子簇化合物[M a L z]±c 过渡金属多核原子簇化合物除少数外[如Cr2(CO)10(μ2-CO)2],金属原子间均存在单键或多重键(双键、三键、四键)。 1.过渡金属元素多核原子簇的构型Ps:Ps=(va+x—12a±c)/2。 式中v为金属原子价电子数,x为z个配体L提供的总电子数,±c 为所带电荷数,阳离子用“—”,阴离子用“+”;12为骨架过渡金属原子有9个原子轨道只能有3个轨道6个e—参与骨架成键,余下的6个轨道只容纳12个e—(非骨架成键电子)。 簇单位[ML z/a]±c′,Ps=[(v+x—12)±c′]/2,x为z/a个配体L提供的总电子数。 骨架成键电子对数Ps=aPs′。 过渡金属原子簇M a L z各簇单位(分子片ML z/a)可能提供的骨架成键电子数 V:金属的价电子数x:配体提供的电子数 若用上表数值(设为y),[M a L z]±c的Ps=(ay±c )/2。 骨架成键电子对数Ps和构成簇的金属原子数n(即多面体骨架顶点数)与簇的结构关系: 2.骨架原子间的总价键数。按有效原子序数(NAE)规则: 过渡金属元素:b=[18a—(va+x±c)]/2,某些情况下有b=[16a—(va+x±c)]/2 如果原子簇合物的骨架中同时含过渡金属原子a个和主族元素金属原子a′个,则: b=[18a+8 a′—(va+x±c)]/2 二、过渡金属羰基簇合物
1、羰基配位的类型 2、CO分子轨道图及成键类型 端基配位侧基配位 边桥基配位半桥基配位 在多核羰基配合物中1个CO可以和3个金属原子结合形成面桥基(用μ3-CO表示):