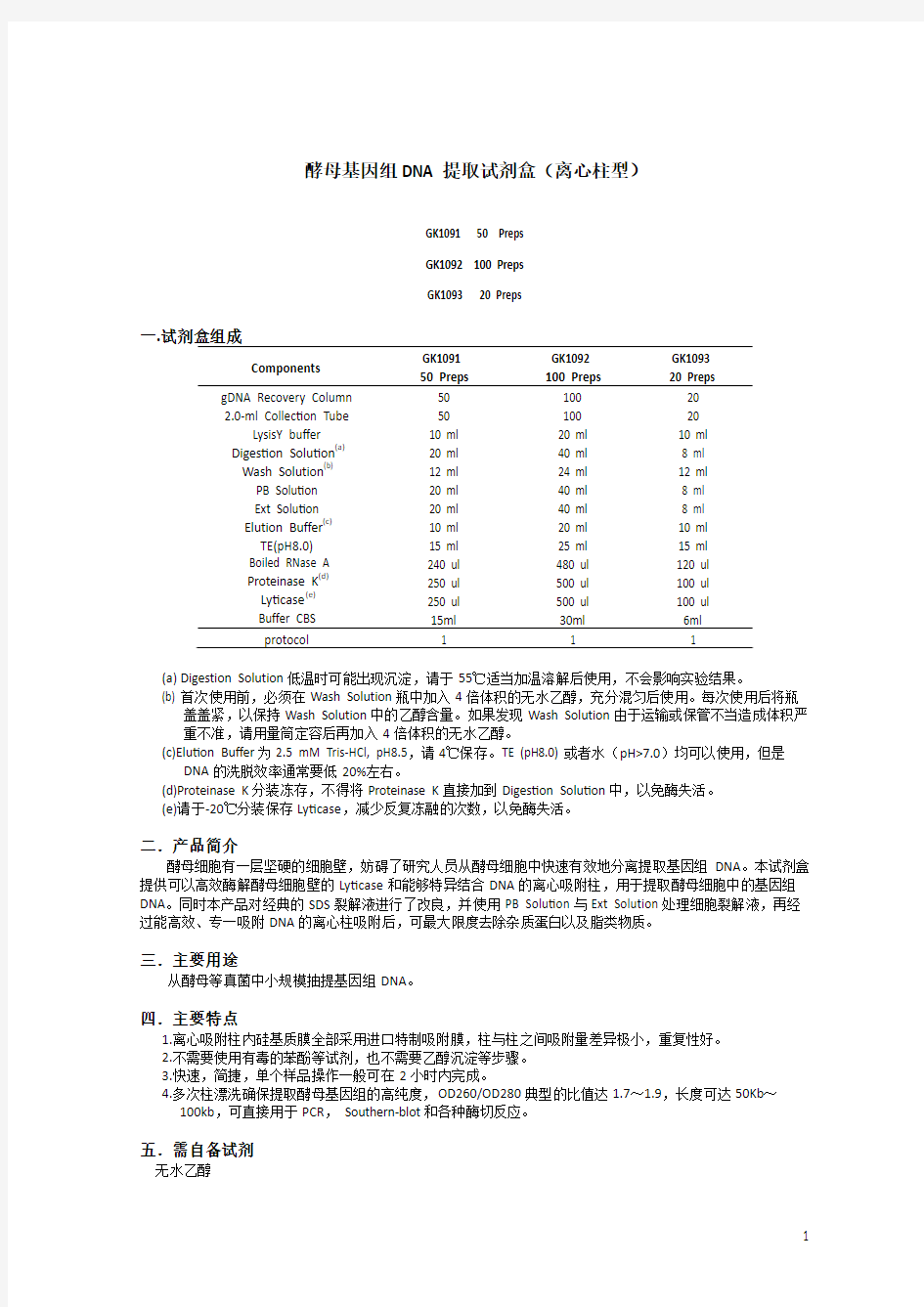

酵母基因组DNA提取试剂盒(离心柱型)
GK1091 50 Preps
GK1092 100 Preps
GK1093 20 Preps
一.试剂盒组成
Components GK1091
50 Preps
GK1092
100 Preps
GK1093
20 Preps
gDNA Recovery Column 2.0-ml Collection Tube
LysisY buffer Digestion Solution(a)
Wash Solution(b)
PB Solution
Ext Solution
Elution Buffer(c)
TE(pH8.0)
Boiled RNase A
Proteinase K(d)
Lyticase(e)
Buffer CBS
50
50
10 ml
20 ml
12 ml
20 ml
20 ml
10 ml
15 ml
240 ul
250 ul
250 ul
15ml
100
100
20 ml
40 ml
24 ml
40 ml
40 ml
20 ml
25 ml
480 ul
500 ul
500 ul
30ml
20
20
10 ml
8 ml
12 ml
8 ml
8 ml
10 ml
15 ml
120 ul
100 ul
100 ul
6ml
protocol 1 1 1
(a)Digestion Solution低温时可能出现沉淀,请于55℃适当加温溶解后使用,不会影响实验结果。
(b) 首次使用前,必须在Wash Solution瓶中加入4倍体积的无水乙醇,充分混匀后使用。每次使用后将瓶
盖盖紧,以保持Wash Solution中的乙醇含量。如果发现Wash Solution由于运输或保管不当造成体积严重不准,请用量筒定容后再加入4倍体积的无水乙醇。
(c)Elution Buffer为2.5 mM Tris-HCl, pH8.5,请4℃保存。TE (pH8.0) 或者水(pH>7.0)均可以使用,但是
DNA的洗脱效率通常要低20%左右。
(d)Proteinase K分装冻存,不得将Proteinase K直接加到Digestion Solution中,以免酶失活。
(e)请于-20℃分装保存Lyticase,减少反复冻融的次数,以免酶失活。
二.产品简介
酵母细胞有一层坚硬的细胞壁,妨碍了研究人员从酵母细胞中快速有效地分离提取基因组DNA。本试剂盒提供可以高效酶解酵母细胞壁的Lyticase和能够特异结合DNA的离心吸附柱,用于提取酵母细胞中的基因组DNA。同时本产品对经典的SDS裂解液进行了改良,并使用PB Solution与Ext Solution处理细胞裂解液,再经过能高效、专一吸附DNA的离心柱吸附后,可最大限度去除杂质蛋白以及脂类物质。
三.主要用途
从酵母等真菌中小规模抽提基因组DNA。
四.主要特点
1.离心吸附柱内硅基质膜全部采用进口特制吸附膜,柱与柱之间吸附量差异极小,重复性好。
2.不需要使用有毒的苯酚等试剂,也不需要乙醇沉淀等步骤。
3.快速,简捷,单个样品操作一般可在2小时内完成。
4.多次柱漂洗确保提取酵母基因组的高纯度,OD260/OD280典型的比值达1.7~1.9,长度可达50Kb~
100kb,可直接用于PCR, Southern-blot和各种酶切反应。
五.需自备试剂
无水乙醇
六.保存方法及注意事项
试剂盒于常温运输,Proteinase K 、Lyticase 以及Boiled RNase A 请于-20℃保存,其它组分室温(15-25℃)保存,有效期为一年。
Digestion Solution中含有刺激性的化合物,操作过程中应穿上实验服,戴好乳胶手套,避免沾染皮肤。眼睛和衣服,防止吸入口鼻。沾染皮肤或眼睛后,请立即用清水或生理盐水冲洗,必要时寻求医生的帮助。
七.操作步骤
1. 取1-2ml过夜培养的酵母菌液,加入至1.5ml离心管中,室温8,000rpm离心1分钟,尽量吸除上清,收
集菌体。
2. 在gDNA Recovery Column加入200μl Buffer CBS , 10,000rpm离心1分钟,弃透过液,备用。
3. 向菌体中加入200ul LysisY Buffer,加入5ul Lyticase, 充分混匀,30℃温育30min。
4. 8,000rpm离心5min,弃上清,收集沉淀。
注意:以上为5×107酵母细胞的Lyticase用量,实验时应根据酵母的菌株和酵母细胞的数量的不同,对Lyticase的浓度和温育时间进行适当调整。
5. 向沉淀中加入200ul TE溶液重悬沉淀,充分混匀。
6. 在200ul TE悬浮样品中,加入300ul Digestion Solution,混匀;加入4ul RNase A混匀,55℃保温10分
钟;再加入4μl Proteinase K, 55℃保温10~30分钟。
注意:(1)应按次序加入,不得将Proteinase K先加入Digestion Solution,再加到样品中。
(2)保温时间取决于样品的类型。对于细胞样品,55℃保温10分钟足以使细胞裂解,释放出
基因组DNA。降解完全的样品应是透明粘稠液体。
7. 依次加入300ul Ext溶液和300ul PB溶液,充分摇动混匀,12000rpm室温离心5分钟,溶液将分为上下两
层,上层溶液为蓝色,基因组DNA存在于下层溶液中,两层中间可能会有一些沉淀物。然后用1ml Tip头伸到下层,将下层中溶液全部转移到套放于2ml收集管内的gDNA Recovery Column,注意尽量不要吸到上层溶液和中间层沉淀。
注意:此步骤加入Ext和PB溶液后,一定要充分摇匀,否则后面离心时杂质不容易分层。
8. 8,000rpm室温离心1分钟。取下gDNA Recovery column,弃去收集管中的废液。
9. 将gDNA Recovery Column放回收集管中,加入500ul Wash Solution,8,000rpm,室温离心1分钟。取下
gDNA Recovery Column,弃去收集管中的废液。
10. 重复步骤8一次。
11. 将gDNA Recovery Column放回收集管中,12,000rpm,室温离心1分钟,以去除残留的Wash Solution。
注意:此步骤高速空离是为了去尽残留的乙醇,请勿省略,否则可能因所纯化的核酸中残留有乙醇而影响后续的实验效果。
12. 将gDNA Recovery Column放入新的洁净的1.5ml离心管中,在gDNA Recovery Column中央加入50~
100ul Elution Buffer,室温或37℃放置2分钟。
注意:(1)为提高洗脱效率,可以将Elution Buffer预热到55~80℃。
(2)如果样品中基因组DNA含量很低,用30ul Elution Buffer洗脱可以提高洗脱液的样品浓
度,但产率有所下降。
13. 12,000rpm,室温离心1分钟。离心管中的液体即为基因组DNA。根据用途,样品可以4℃或-20℃保存。
注意:重复步骤11~12,将洗脱液再次加入到吸附膜上,重新洗一次,可以提高产率10%~20%。
八. DNA浓度及纯度检测
得到的基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。回收得到的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。
DNA应在OD260处有显著吸收峰,OD260值为1相当于大约50ug/ml双链DNA、40ug/ml单链DNA。
OD260/OD280比值应为1.7-1.9,如果洗脱时不使用本试剂盒提供的Elution Buffer,而去使用去离子水,比值会偏低,因为pH值和离子存在会影响光吸收值,但并不表示纯度低。
Product Use Limitation:
This product is developed, designed and sold exclusively for research purpose and in vitro use only.
【篇一】人类基因组计划随着人类基因组计划的完成 随着人类基因组计划的完成,人类对自身遗传信息的了解和掌握有了前所未有的进步。与此同时,分子水平的基因检测技术平台不断发展和完善,使得基因检测技术得到了迅猛发展,基因检测效率不断提高。从最初第一代以Sanger 测序为代表的直接检测技术和以连锁分析为代表的间接测序技术,到2005 年,以Illumina 公司的Solexa技术和ABI 公司的SOLiD 技术为标志的新一代测 序(next-generation sequencing,NGS) 的相继出现,测序效率明显提升,时间明显缩短,费用明显降低,基因检测手段有了革命性的变化。其技术正向着大规模、工业化的方向发展,极大地提高了基因检测的检出率,并扩展了疾病在基因水平的研究范围。2009 年3 月,约翰霍普金斯大学的研究人员在《Science》杂志上发表了通过NGS外显子测序技术,发现了一个新的遗传性胰腺癌的致病基因PALB2,标志着NGS 测序技术成功应用于致病基因的鉴定研究。同年,《Nature》发表了采用NGS 技术发现罕见弗里曼谢尔登综合征MYH3 致病基因突变和《Nat Genet》发表了遗传疾病米勒综合征致病基因。此后,通过NGS 技术,与遗传相关的致病基因不断被发现,NGS 技术已成为里程碑式的进步。2010 年,《Science》杂志将这一技术评选为当年“十大科学进展”。近两年,基因检测成为临床诊断和科学研究的热点,得到了突飞猛进和日新月异的发展,越来越多的临床和科研成果不断涌现出来。同时,基因检测已经从单一的遗传疾病专业范畴扩展到复杂疾病和个体化应用更加广阔的领域,其临床检测范
题目:质粒DNA的提取及检测 一.实验目的: 1.学习碱裂解法提取质粒的原理和方法; 2.学习DNA琼脂糖凝胶电泳的原理和方法。 二.实验原理 1. 质粒 (Plasmid): 一种染色体外的稳定遗传因子,大小从1-200kb不等,为双链、闭环的DNA分子,并以超螺旋状态存在于宿主细胞中。主要发现于细菌、放线菌和真菌细胞中,常常编码一些对宿主有利的酶的基因,这些基因的表型包括抗生素抗性,产生抗生素、限制酶、修饰酶等。 2.载体(Vector): 要把一个有用的外源基因通过基因工程手段,转化到细胞中去进行繁殖和表达,需要运载工具,携带外源基因进入受体细胞的这种工具就叫载体。目前除了大肠杆菌中的质粒、λ噬菌体、M13噬菌体、噬菌粒外,还有酵母人工染色体载体以及动、植物病毒载体等。 3.分离质粒DNA: (1)培养细菌使质粒扩增; (2)收集和碱裂解细菌; (3)分离和纯化质粒DNA。 4.碱裂解法 (1)溶液Ⅰ:50mmol/L葡萄糖,10mmol/EDTA-Na,25mmol/LTris-HCl 作用:分散细胞,螯合金属离子使酶失活,防止DNA的降解
(2)溶液Ⅱ:L NaOH,2% SDS,临用前1:1配制 作用:细胞在NaOH和SDS溶液中裂解时,蛋白质与染色体DNA发生变性 (3)溶液Ⅲ:5mol/L 醋酸钾60ml,冰醋酸,双蒸水 作用:酸性条件上质粒DNA复性,留在上清液。大肠杆菌DNA和蛋白质-SDS复合物等发生沉淀。 5.电泳 带电荷的物质,在电场中的趋向运动称为电泳。DNA的琼脂糖凝胶电泳可以分离长度为200bp至近50kb的DNA分子。DNA的迁移率(U)的对数与凝胶浓度(T)之间存在反平行线 性关系。因此,要有效地分离不同大小的DNA片段,选用适当的琼脂糖凝胶浓度是非常重要的。 6.提取质粒 在质粒提取的过程中,由于操作原因,提取的质粒可能有三种:线性DNA、开环DNA 、 闭环超螺旋DNA 。当提取的质粒DNA电泳时,同一质粒 DNA泳动速度:闭环超螺旋〉线状〉 开环。但有时也有也会出现相反情况,因为与琼脂糖浓度、电流强度、离子强度及核酸染料 含量有关。 三.实验材料及设备 1.实验材料: (1)含质粒pUC18大肠杆菌,塑料离心管,EP管架,微量取液器和取液器吸头,常用玻璃器皿(如三角瓶、量筒、试剂瓶等); (2)提取的pUC18,琼脂糖,锥形瓶,一次性手套,胶铲,封口膜,剪刀,取液器吸头。实验设备:
组织基因组DNA提取试剂盒(离心柱型) 储存条件 该试剂盒置于室温(15-25℃)干燥条件下,可保存12个月,更长时间的保存可置于2-8℃。2-8℃保存条件下,若溶液产生沉淀,使用前应将试剂盒内的溶液在室温放置一段时间,必要时可在37℃水浴中预热10 min,以溶解沉淀。 注意事项 1.第一次使用前应按照试剂瓶标签的说明先在缓冲液GD和漂洗液PW中加入无水乙醇。2.样品应避免反复冻融,否则会导致提取的DNA片段较小且提取量也下降。 3.若缓冲液GA或GB中有沉淀,可在37℃水浴中重新溶解,摇匀后使用。 4.所有离心步骤均为使用台式离心机,室温下离心。 操作步骤 使用前请先在缓冲液GD和漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。 1. 处理材料 用干烤过的镊子和剪刀剪取一定量的冰冻组织,体积约两个绿豆大小,放入DNAase-free的1.5ml EP中。向EP管中加入等体积的磁珠,以及加入200 μl缓冲液GA,振荡悬浮。置于组织破碎仪中运行5mins/次,共3次。每破碎一次,需将含组织的EP管放入离心机中短暂离心来沉淀组织和磁珠,使其在下次破碎时更好的接触。可根据观察匀浆的效果来决定匀浆的次数,目标是“碾磨均匀”,不能有较大体积的组织块(>2mm的组织块)。 如果需要去除RNA,需加入4 μl RNaseA(100 mg/ml)溶液(客户自备,目录号:RT405-12),振荡15 sec,室温放置5 min。 2. 加入20 μl Proteinase K溶液,混匀。提取组织基因组时,加入Proteinase K混匀后,在56℃放置1~3 h,直至组织溶解,每小时颠倒混合样品2-3次,用水浴振荡器也可。放入10,000rpm (~11,500×g) 的离心力高速离心1mins来沉淀未碾碎的组织和磁珠。将上清转移至新的EP管中。 3. 加入200 μl缓冲液GB,充分颠倒混匀,70℃放置10 min,溶液应变清亮,简短离心以去除管盖内壁的水珠。注意:加入缓冲液GB时可能会产生白色沉淀,一般70℃放置时会消失,不会影响后续实验。如溶液未变清亮,说明细胞裂解不彻底,可能导致提取DNA量少和提取出的DNA不纯。 4. 加人200 μl 无水乙醇,充分振荡混匀15 sec,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。 5. 将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12,000 rpm (~13,400×g)离心30 sec,倒掉废液,将吸附柱CB3放回收集管中。 6. 向吸附柱CB3中加入500 μl缓冲液GD (使用前请先检查是否已加入无水乙醇),12,000 rpm (~13,400×g)离心30 sec,倒掉废液,将吸附柱CB3放入收集管中。 7. 向吸附柱CB3中加入600 μl 漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm (~13,400×g)离心30 sec,倒掉废液,将吸附柱CB3放入收集管中。 8. 重复操作步骤7。
1 快速微量提取法A.取1.5ml菌体培养物于一灭菌Ep管中,12000rpm离心1min, 丢去上清夜,收集菌体。 B.加入400ul裂解液(40mMTris-醋酸,20mM醋酸钠,1mMEDTA,1%SDS,pH7.8)混匀,置于37oC水浴1hr。C.然后加入200ul5mol/L的氯化钠溶液,混匀后于13000rpm离心15min。D.取上清液,用苯酚抽提2次,氯仿抽提1次。E.加两倍体积无水乙醇,1/10体积醋酸钾(3M ,pH8.0),-20度保存1小时后,13000rpm离心15min,弃上清液,沉淀用70%乙醇洗2次;置于室温干燥后,溶于50ulTE 溶液中,置4oC保存备用。 2 蛋白酶/SDS法制备先用10ml含适当抗生素的GBM过夜培养Delftia sp.,第二天4000rpm离心10min收集菌体,用Washing TE (50mmol/LTris-HCl pH8.0,10mmol/LEDTA pH8.0)洗菌体2次,之后将菌体充分悬浮在5ml 1×TE缓冲液中,先后加入0.5ml 5mg/L的蛋白酶、0.5ml 10% SDS,轻轻混匀后50℃放置3h~5h,接着用等体积的Tris饱和苯酚抽提2次,苯酚/氯仿/异戊醇抽提一次,氯仿抽提一次后,乙醇沉淀DNA,用自动移液器吸管头将絮状DNA沉淀块吸附到Ep管中,70%乙醇洗2次,干燥后溶于适当1×TE或ddH2O中。 3 1) 细菌培养:细菌接种于5ml 液体培养基中,37℃摇床(300rpm)培养过液。2) 细菌收集:取1ml培养物于1.5ml EP 管中,室温8000rpm离心5min,弃上清,沉淀重新悬浮于1ml TE(pH8.0)中(用ddH2O 也行)。3) 菌体裂解:加入6μl 50mg/ml的溶菌酶,37℃作用2h。再加2mol/LNaCl50μl,10%SDS 110μl,20mg/ml的蛋白酶K 3μl,50℃作用3h或37℃过夜。(此时菌液应为透明粘稠液体)4) 抽提:菌液均分到两个1.5ml EP管,加等体积的酚∶氯仿∶异戊醇(25∶24∶1),混匀,室温放置5-10min。12000rpm离心10min。抽提两次。(上清很粘稠,吸取时应小心,最好枪头尖应剪去)5) 沉淀:加0.6倍体积的异丙醇,混匀,室温放置10min。1 2000rpm离心10min。6)洗涤:沉淀用75%的乙醇洗涤。7) 抽(凉)干后,溶于50μl ddH2O中,取2-5μl电泳。作PCR模板用。
质粒DNA的提取 一、原理 采用碱变性发抽提取质粒DNA。该法是基于染色体DNA与质粒DNA的变性预复性的差异而达到分离目的的。在PH大于12的碱性条件下,染色体DNA的氢键断裂,双螺旋结构解开变性。质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状结构的两条互补链不会完全分离,当以pH5.2的乙酸钠高盐缓冲液调节其pH至中性时,变性的质粒DNA又恢复到原来的构型,保存在溶液中。而染色体DNA不能复性而形成缠连的网状结构。通过离心,染色体DNA与不稳定的大分子RNA,蛋白质-SDS复合物等一起沉淀下来而被除去。 二、方法 1.挑取一环在LB固体培养基平板上生长的含PUC57质粒的大肠杆菌,接在含有100μ g/ml氨苄青霉素(Amp)的LB液体培养基(5ml/15ml试管)中,37℃震摇培养过夜。 2.将1.5ml菌液加入微离心管中,14000r/min,离心10秒,其取上清液。反复数次,收 集全部菌体。 3.倾去上清,滤纸吸干。 4.加30μlTE缓冲液(10mmol/L Tris—HCl,1mmol/L EDTA,pH8.0),振荡起菌体。 5.加30μlTENS溶液(10mmol/L Tris—HCl, pH8.0,1mmol/L EDTA,0.1mol/L NaOH,0.5%SDS),震荡10秒至溶液变粘稠。 6.加150μl 3.0mol/LnaAC,震荡3—5S,14000r/min,离心3分钟,沉淀细胞碎片及染 色体DNA。 7.上清液转移至另一微离心管中,甲等体积胞和酚,混匀,12000r/min,离心2分钟。 8.上层水相转移至另一位离心管,加2倍量冷水乙醇,14000r/min,离心20分钟。9.倾去乙醇,加入7o%冷乙醇淋洗。 10.倾去乙醇,滤纸吸于,真空抽吸2~3分钟。 lI.加人50μlTE缓冲液,溶解DNA。 12,加入1μl核糖核酸酶(10mg/m1),14000r/min,离心2s,使核糖核酸酶与管底液体混匀。 13.37℃水浴30min。 14.样品放一20℃冰箱保存备用。 三、试剂 1.TE缓冲液(10mmol/L Tris—HCl,1mmol/L EDTA,pH8.0) 配制方法: Tris 1.211g EDTA.Na 0.037g 用800ml重蒸水溶解,用分析纯盐酸调整pH至8.0,加重蒸水定容至1000ml。2.TENS溶液:(10mmol/L Tris—HCl, pH8.0,1mmol/L EDTA,0.1mol/L NaOH,0.5%SDS)
酵母DNA提取方法 方法一: 石英砂法 1、5000rpm×5min 收集过夜培养的菌体(5ml左右),于200μL 裂解液(50 mmol/ L Tris-HCl pH 8.0 , 180 mmol/ LEDTA pH 8.0 , 1 % SDS , 现配)中,加入3/10 总体积石英砂在涡流混合器上振荡13min,每隔4min 将离心管取出用力甩几下,然后65℃水浴10min。 2、加入200μL 5mol/L KAc,冰浴8min; 3、12000rpm×5min 转移上清至新的离心管中; 4、加入 3 mol/L NaAc 35μl,加入异丙醇200μL混匀后冰浴8min,12000rpm×5min收集沉淀; 5、200μL TE 溶解,加入RNase10μL,65℃水浴10min; 6、加入200μL 氯仿-异戊醇(24:1),抽提; 7、温柔地取上清150μL ,加入20μL 3 mol/L NaAc 及375μL 无水乙醇,混匀后 12000rpm×8min 收集DNA; 8、70% 乙醇洗涤沉淀,吹干后TE 溶解,-20℃保藏。 方法二: 蜗牛酶法 1. 接种于5 ml的YEPD培养基中在25℃-28℃振荡培养12-16 h。 2. 3500 rpm离心5min沉淀细胞,用1ml 的无菌水洗涤一次,再加0.5ml solution Ⅰ(1M 山梨醇,0.1M EDTA, pH=7.5)重悬。 3. 转移细胞至1.5 ml 的离心管中,加入0.1蜗牛酶(30mg/ml)溶液,37℃保温30-60min, 以获得原生质体。 4. 最大转速离心1min以沉淀细胞,用500ulsolutionⅡ(50mMTris-HCl, 20mM EDTA,pH=7.4)溶液悬浮,然后加入50μl 10% SDS, 混合65℃保温30min。 5. 加入200μl 5M 醋酸钾,放于冰上30 min。 6. 最大转速离心15min,转移上清液至新的离心管中,用等体积的异丙醇沉淀DNA。 7. 室温下放置5min,离心10min,用70%的乙醇洗涤一次,真空干燥,用50ul pH=7.4 TE溶液溶解。
人类基因组计划 HGP(Human Genome Projects) 1、HGP简介 ?人类基因组计划是由美国科学家于1985年率先提出、于1990年正式启动的。美国、英国、法国、德国、日本和我国科学家共同参与了这一价值达30亿美元的人类基因组计划。这一计划旨在为30多亿个碱基对构成的人类基因组精确测序,发现所有人类基因并搞清其在染色体上的位置,破译人类全部遗传信息。 ?诺贝尔奖获得者Renato Dulbecco于1986年发表短文 《肿瘤研究的转折点:人类基因组测序》(Science, 231: 1055-1056)。 ?文中指出:如果我们想更多地了解肿瘤,我们从现在起必须关注细胞的基因组。…… 从哪个物种着手努力?如果我们想理解人类肿瘤,那就应从人类开始。……人类肿瘤研究将因对DNA 的详细知识而得到巨大推动。” 什么是基因组(Genome) ?基因组就是一个物种中所有基因的整体组成 ?人类基因组有两层意义: ——遗传信息 ——遗传物质 ?从整体水平研究基因的存在、基因的结构与功能、基因之间的相互关系。 人类染色体 HGP的诞生 ?1984年12月Utah州的Alta,White R受美国能源部的委托,主持召开了一个小型会议,讨论DNA重组技术的发展及测定人类整个基因组的DNA序列的意义。 ?1985年6月,在美国加州举行了一次会议,美国能源部提出了“人类基因组计划”的初步草案。?1986年6月,在新墨西哥州讨论了这一计划的可行性。随后美国能源部宣布实施这一草案。?1987年初,美国能源部与国家医学研究院(NIH)为“人类基因组计划”下拨了启动经费约550万美元,1987年总额近1.66亿美元。同时,美国开始筹建人类基因组计划实验室。 ?1989年美国成立“国家人类基因组研究中心”。诺贝尔奖金获得者J.Waston出任第一任主任。?1990年,历经5年辩论之后,美国国会批准美国的“人类基因组计划”于10月1日正式启动。美国的人类基因组计划总体规划是:拟在15年内至少投入30亿美元,进行对人类全基因组的分析。 HGP诞生过程中的质疑 ?计划的必要性问题 ?计划的现实性问题 ?科学研究领域的选择问题 ?为什么不选择基因组小的或有经济意义的生物 ?认为?°制图?±是在沙漠里建公路,?°测序?±是把?°垃圾?±分类,选择?°模式动物?±是拼凑?°诺亚方舟?±。
质粒抽提 一、溶液及培养基配制: 1、LB液体培养基 (1)配方: 酵母提取物(Yeast extract)5g/L 胰蛋白胨(Tryptone)10g/L (2)配制: A、称量:称取培养基各成分所需量,置于烧杯中。 B、溶化:加入所需水量2/3的蒸馏水于锥形瓶中,搅拌使药品全部溶化。 C、定容。 D、加塞、包扎。 F、高压灭菌121 C, 30min ,灭菌后室温保存备用。若要分装需要在超净台内。 G、培养基完全溶解,降至室温后,加氨苄霉素(AMP )。先将AMP用三蒸水配制为 100mg/ml母液,而后每1ml母液加至1000ml培养基。(可以多配制一些,分装为1ml/管)2、LB固体培养基 (1)配方: 酵母提取物(Yeast extract)5g/L 氯化钠(NaCl)5g/L 胰蛋白胨(Tryptone)10g/L 氨苄青霉素溶液100^g/ml (终浓度)(即100mg溶于1ml超纯水或生理 盐水或PBS,再加入1000ml培养基) 琼脂粉15g/L (2)配制: A、称量:称取培养基各成分所需量,置于烧杯中。 B、溶化:加入所需水量2/3的蒸馏水于烧杯中,搅拌使药品全部溶化。 C、5mol/L NaOH 溶液调pH 到7.4。 D、定容。 E、分装、加塞、包扎。 F、高压灭菌121 C, 30min。 G、火菌后,将融化的LB固体培养基置与55 C的水浴中(或室温),待培养基温度降到55 C时(手可触摸)加入抗生素,(免温度过高导致抗生素失效),并充分摇匀。 (3)倒板: 一般20ml倒1块板,培养基倒入培养皿后,打开盖子,水分晾干后盖上盖子并用封口膜封口,4 C保存备用,使用前提前拿出,防止水蒸气滴入板中。 首要检查是否有足够的固体和液体LB培养基,基本上每个质粒需要一块固体培养基,小摇 的2ml和大摇的250ml LB培养基。小摇的可以在一个50ml离心管中预备着,每次直接取 用。转化所需L形玻璃棒需确认已灭菌摇菌器申请,张评浒老师,王雪师姐; 注意:考虑到多种东西需要灭菌,可以在转化之前或者小摇大摇那天一起灭菌。所有需要提前灭菌的东西有:足量液体LB培养基灭菌后加入AMP蓝黄白枪头至少个一盒,备用; 1.5ml doff 管;Beckman离心机专用离心管;锡箔纸;250ml锥形瓶,500或者1000ml锥形瓶;电动移液器所用移液管(可以考虑用5ml移液枪,则先灭菌5ml枪头);超纯水和TE
中量全血基因组DNA提取试剂盒 目录号:DN03 目录编号包装单位 DN0301 20次×3ml DN0302 50次×3ml 适用范围: 适用于快速提取各种动物全血基因组DNA 试剂盒组成、储存、稳定性: 试剂盒组成保存20次×3ml 50次×3ml 10×红细胞裂解液室温20 ml 45ml 细胞核裂解液室温60 ml 150 ml 蛋白沉淀液室温20 ml 50 ml DNA溶解液室温10 ml 20 ml 本试剂盒在室温储存18个月不影响使用效果。 储存事项: 1.环境温度低时细胞核裂解液中某些去污剂成份会析出出现浑浊或者沉淀,可在 37℃水浴加热几分钟,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。 2.蛋白沉淀液可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,如果不 能完全溶解,也不影响使用效果,直接取用上层溶液即可。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时 盖紧盖子。 产品介绍: 本试剂盒根据全血特点采用几个快速步骤提取基因组DNA。首先红细胞裂解液裂解去除不含DNA的红细胞,细胞核裂解液裂解白细胞释放出基因组DNA, 然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重溶解于DNA 溶解液。 产品特点: 1.从十几个配方中优选出的红细胞裂解液配方,裂解快速完全。 2.不需要使用有毒的苯酚等试剂。 3.快速,简捷,单个样品操作一般可在1小时内完成。 4.结果稳定,产量高(典型的产量3ml全血可提取出50-150μg),OD260/OD280典 型的比值达 1.7~1.9,长度可达50Kb-150kb,可直接用于构建文库、PCR、Southern-blot和各种酶切反应。 注意事项 1.所有的离心步骤均在室温完成,使用转速可以达到2,500 x g,并配备容纳15ml离 心管转头的传统台式离心机。 2.用户需自备异丙醇和70%乙醇。 3.典型的产量3ml全血可提取出75-150μg基因组DNA(不同样品尤其疾病样品中中 白细胞数量差异可能非常大,因此产量的个体差异也可能非常大)。 4.本试剂盒为溶液型,可以很容易的按照比例扩大或者缩小每次处理的全血量
收稿日期:2003-03-29 修回日期:2003-07-20 作者简介:姚建国(1960 ),男,江西贵溪人,讲师,从事医学教学管理;雷锦程(1964 ),男,江西东乡人,副教授,主要从事医学伦理与法 律研究。 人类基因组研究的几个伦理问题 姚建国,雷锦程 (江西医学院,江西南昌 330006) 摘 要:人类基因组研究伴生诸多伦理问题。个人或家族的基因隐私权是不受他人侵犯的自然权利;基因歧视侵犯了人的基本权利和基本自由,社会应运用立法来防止基因歧视;对基因功能的认识属于科学发现的范畴,不应有基因专利;基因决定论以及在此基础上的 优生学 会导致伦理灾难;对基因技术的运用,伦理学评价应置于优先地位。 关键词:基因隐私权;基因歧视;基因专利;基因决定论;伦理 中图分类号:B82-057 文献标识码:A 文章编号:1006-0448(2003)05-0031-04 在当代高科技中,生物技术具有最诱人的前景,诸如细胞工程、基因工程、克隆技术、人类基因组计划等,仿佛给人类展现出十分美好的未来。无怪乎许多科学家和技术官员都欢欣鼓舞地宣称:21世纪是生物科学的世纪。然而,正当科学家信心百倍地向生物技术深入挺进时,伦理学家和社会学家却忧心忡忡。生物技术比人类历史上拥有过的任何技术都更为深入地侵扰、干预了自然秩序,人类正面临着前所未有的伦理挑战。在诸多的生物技术中,人类基因组研究被誉为人类生命科学史上最伟大的工程,它可与人类登月计划和曼哈顿计划相媲美。由于不可估量的商业价值和技术本身诱惑力的驱动,人类基因组研究正飞速发展,相关伦理问题已引起了生命伦理学界和全世界的高度关注。本文试图从基因隐私权及知情权、基因组图谱的信息使用与人的社会权利、基因专利与资源争夺、基因决定论与优生学、基因组研究成果应用的不可预测性等角度来谈谈人类基因组研究中存在的伦理问题。 一 个人及家族遗传信息的权利归属问题 人类基因组计划的一个主要目标是绘制遗传链锁图。研究者在利用不同来源的基因资源绘制遗传 链锁图时,可能获得对某些家族或个人来说有意义的预警信号 该家族对某一种疾病具有易感性,患该种疾病的几率相对较大。这时就会产生问题:涉及该家族特有遗传信息的信息权利归属于谁?是归属于提供基因资源来源的个人或其家族?抑或归属于研究者?个人或家族对自身的信息有否知情权?知情权如何实现?研究者是否应当像医生尊重病人的隐私权一样充分尊重该家族的遗传信息隐私权并履行保密义务?研究者是否应向该家族发出预警信号,甚至采取保护性、预防性措施呢?有论者认为应该以实行隐私权为主,只有当医学上确定会出现严重的、不可避免的疾病时,才可解除保密,告知当事家族。 笔者以为,有关个人或家族特有遗传信息,特别是涉及某些遗传性疾病的信息,其信息所有权应当归属于个人或家族,这是人的自然权利的一种 基因隐私权。研究者所做的工作仅仅是揭示了这些信息的含义。这和医生在治病过程中了解到病人的病情与病人的隐私一样,医生不因此而获得病人病情信息的所有权。研究者作为生物医学专家,他有能力理解并揭示遗传信息的含义,并不等于他就此拥有了这些信息并有权随意处置这些信息。人类社会生活中存在这样的情形,一个有文化的人帮助一 第34卷第5期2003年9月南昌大学学报(人社版) JOU RN AL OF N AN CHA NG U NI VERSIT Y Vol.34No.5Sep.2003
利用海砂提取酵母基因组 1、挑GS115单菌落接种于50mL三角瓶6mLYPD培养基中,摇两瓶。将30℃,200r/min,培养过夜(16~18h)的酵母细胞分别吸取1.5mL菌液放在1.5mL EP 管中,共8管,12000r/min,5min,离心收集细胞; 2、用无菌水将细胞悬浮(借助10uL枪头),洗细胞,12000r/min,5min,离心;再次用无菌水洗细胞,只洗表面,去上清; 3、加入200uL(0.275g)海砂,200uL裂解液,200uL酚氯仿(25:24),将细胞悬浮(借助10uL枪头),然后涡旋震荡1min,放在冰上1min,重复四次; 4、12000r/min,5min,离心,吸取上清液(260uL),两管合一管,共4管,每管520uL,加入等体积的酚氯仿(酚265uL,氯仿255uL),颠倒混匀,去蛋白,12000r/min,5min,离心; 5、吸取上清液(500uL),加入等体积的酚氯仿(酚255uL,氯仿245uL),颠倒混匀,去蛋白,12000r/min,5min,离心; 6、吸取上清液(480uL),加入等体积的酚氯仿(酚245uL,氯仿235uL),颠倒混匀,去蛋白,12000r/min,5min,离心; 7、吸取上清液(460uL),加入2倍体积(920uL)的无水乙醇,放在—80℃,30min; 8、12000r/min,5min,离心,去上清,加入400uL体积的70%乙醇,用手弹起沉淀,洗涤,12000r/min,5min,离心,去上清,再次加入400uL体积的70%乙醇,只洗表面,去上清,将DNA自然晾干; 9、用20uL的超纯水溶解DNA,加入1uLRNaseA,37℃,消化30min; 10、取5uLDNA溶液,用1%琼脂糖凝胶跑电泳。 试剂配方: 1、1M Tris-Hcl(pH 8.0):配50mL Tris碱:6.06g 水:50mL 用浓盐酸约2.1mL调pH至8.0, 2、0.5M EDTA(pH 8.0):配50mL
酵母基因组DNA 快速提取试剂盒 目录号:DN20 适用范围: 适用于快速提取各种酵母基因组DNA 试剂盒组成、储存、稳定性: 试剂盒组成 保存 50次 平衡液 室温 5 ml 缓冲液YB 室温 20 ml 结合液CB 室温 11 ml 抑制物去除液IR 室温 25 ml 漂洗液WB 室温 15 ml 第一次使用前按说明加指定量乙醇 洗脱缓冲液EB 室温 15 ml Lytic Enzyme -20℃ 2.5 ml 蛋白酶K 粉(可选)20mg/ml -20℃ 20mg 吸附柱AC 室温 50个 收集管(2ml ) 室温 50个 本试剂盒在室温储存12个月不影响使用效果。 储存事项: 目录编号 包装单位 DN2001 50次 DN2031 50次(带蛋白酶K ,带Lytic Enzyme )
1.结合液CB或者抑制物去除液IR低温时可能出现析出和沉淀,可以在37℃水浴 几分钟帮助重新溶解,恢复澄清透明后冷却到室温即可使用。 2.为避免降低活性,方便运输,提供蛋白酶K为冻干粉状(20mg),收到后,可短 暂离心后,加入1毫升灭菌水溶解配制成20mg/ml溶液,因为反复冻融可能会降低酶活性,因此溶解后立即按照每次使用量分装冻存,-20℃保存。 3.Lytic Enzyme为蜗牛酶甘油储液,因此比较粘稠,请小心取用,-20℃保存。蜗 牛酶是从蜗牛的嗦囊和消化道中制备的混合酶,它含有纤维素酶,果胶酶,淀粉酶,蛋白酶等20多种酶。适合破碎溶解各种酵母的细胞壁。 4.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时 盖紧盖子。 产品介绍: 该试剂盒采用DNA吸附柱和独有的溶液系统,适合于从多种来源的酵母培养物中快速简单地提取基因组DNA。约3ml处于指数生长期的酵母培养液一般一次抽提可纯化出10-15μg的高质量的基因组DNA。纯化DNA产物可直接用于PCR、酶切和杂交等实验。酵母细胞经lytic Enzyme处理去除细胞壁后,独特的结合液/蛋白酶K迅速裂解细胞和灭活细胞内核酸酶,然后基因组DNA在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤,抑制物去除液和漂洗液将细胞代谢物,蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净基因组DNA从硅基质膜上洗脱。 产品特点: 1.离心吸附柱内硅基质膜全部采用进口世界著名公司特制吸附膜,柱与柱之间吸附 量差异极小,可重复性好。克服了国产试剂盒膜质量不稳定的弊端。 2.不需要使用有毒的苯酚等试剂,也不需要乙醇沉淀等步骤。 3.快速,简捷,单个样品裂解后操作一般可在30分钟内完成。
人类基因组计划的重要性 “以破解人类遗传和生老病死之谜,解决人类健康问题为目的的人类基因组计划,对人类自身的生存和发展具有重要的意义。其旨在通过测定人类基因组DNA约3×109对核苷酸的序列,探寻所有人类基因并确定它们在染色体上的位置,明确所有基因的结构和功能,解读人类的全部遗传信息,使得人类第一次在分子水平上全面认识自我。” 基因作为掌控人类自身性状、特征和遗传的根本因子,以其简单的双螺旋结构、复杂的排列方式,使全世界范围内的每一个人类都有着相同的本质和不同的特质。基因的轰动范围极为广泛,我们身上的每一处体态特征几乎都由基因所决定,大到一个人的身高、外貌,小到一颗牙形的状,甚至是一根头发的直径都与基因有着密不可分的联系。众所周知,基因由五种碱基对以庞大的数量按一定顺序排列组合而成,其本质是核糖核苷酸和脱氧核糖核苷酸。在一个活跃的细胞内,特定的基因通过解旋、转录、翻译等一系列过程,来实现RN A、蛋白质等相应物质的合成,这些数以万计的不同形态不同功能的RN A、蛋白质在细胞内外发挥出他们自身的作用,从而达到控制人类机体、完善结构功能、协调组织器官运作的神奇效果。 由以上的事实我们可以看出,要想解开人类自身的秘密,就要从破解基因的密码做起。 人类基因组计划便应运而生了。该计划是由美国科学家于1985年率先提出,于1990年正式启动的。美国、英国、法兰西共和国、德意志联邦共和国、日本和我国科学家共同参与了这一预算达30亿美元的人类基因组计划。按照这个计划的设想,在2005年,要把人体内约10万个基因的密码全部解开,同时绘制出人类基因的谱图。换句话说,就是要揭开组成人体4万个基因的30亿个碱基对的秘密。人类基因组计划与曼哈顿原子弹计划和阿波1罗计划并称为三大科学计划。 “HDP(人类基因组计划)的目的是解码生命、了解生命的起源、了解生命体生长发育的规律、认识种属之间和个体之间存在差异的起因、认识疾病产生的机制以及长寿与衰老等生命现象、为疾病的诊治提供科学依据。”
质粒抽提,实验室必备技能之一 质粒 质粒存在于许多细菌以及酵母菌等生物中,是细胞染色体外能够自主复制的很小的环状DNA 分子。 质粒抽提 从细菌中分离质粒DNA的方法包括3个基本步骤:培养细菌使质粒扩增;收集和裂解细菌;分离和纯化质粒DNA。采用强碱液、加热或溶菌酶(主要针对革兰氏阳性细菌)可以破坏菌体细胞壁,十二烷基磺酸钠(SDS)和 TritonX-100(一般很少使用)可使细胞膜裂解。经溶菌酶和SDS或 Triton X-100处理后,细菌染色体DNA会缠绕附着在细胞碎片上,同时由于细菌染色体DNA比质粒大得多,易受机械力和核酸酶等的作用而被切断成不同大小的线性片段。当用强热或酸、碱处理时,细菌的线性染色体DNA变性,而共价闭合环状DNA(Covalently closed circular DNA,简称cccDNA)的两条链不会相互分开。当外界条件恢复正常时,线状染色体DNA片段难以复性,而是与变性的蛋白质和细胞碎片缠绕在一起,而质粒DNA双链又恢复原状,重新形成天然的超螺旋分子,并以溶解状态存在于液相中。 质粒抽提最常用的方法是碱裂解法,它具有得率高、适用面广、快速和纯度高等特点。当然,碱裂解法也有缺陷:容易导致不可逆的变性。要降低不可逆的变性,就要控制好碱裂解的时间。 碱裂解法抽提质粒需要用到以下三种溶液 溶液Ⅰ 50 mmol/L 葡萄糖,25 mmol/L Tris-Cl(pH 8.0),10 mmol/L EDTA(pH 8.0),在15 psi 压力下蒸汽灭菌15 min,4℃保存。 溶液Ⅱ 0.2 mmol/L NaOH(从10 mmol/L 贮存液中现用现稀释),10 g/L SDS(室温保存)。 溶液Ⅲ
类基因组计划的成果(一) 谁来当“亚当”---人类基因组多样性与个体医学已在进行的人类基因组计划,可以说是“代表性个体”人类基因组计划。在美国,现在用于用于绘制人类DNA序列的DNA 来自于几个“无名氏”的男性。这在当时还曾有过争论,谁可以做“亚当”?这个问题也重要也不重要。人类的所有个体、所有的人,在遗传上都是平等的。所有的人类基因组不管是在基因组中的位置,即基因位点,还是每一个基因的结构都是很相似的,绝对不存在好坏优劣之分。不管从哪一个人身上分离到的一个位点上的DNA片段,可以用于任何种族任何个体的这一位点的研究,这一位点致病等位基因的鉴定,将来可能的基因诊断与基因治疗。因此,我们说人类只有一个基因组,不存在黄种人基因组、白种人的基因组之分。一个基因被鉴定、分离了,进而被专利,就是全人类的这一基因组被专利了,我们不能说你专利的是白种人的基因,我们再来专利一个黄种人或中国人的基因。但人与人是不同的,这就是人类在“同一性”的前提下的“多样性”,多样性体现在每个人身上,称为“基因多样性”或“个体特异性”,一般每个人之间5%位点的等位基因不同有0.1%的序列不同。体现在黄种人棗白种人这一人种族差异上,可称为“种族多样性”,体现在民族(遗传上称为“族群”)上,称为“族群多样性”。将来的某一天,如果需要每一个人的全基因的全核苷酸序列也许能不费多少钱就测定了,并且记录在一个光盘上,要诊断疾病就方便啦。医生先把这个光盘装进计算机,检查几个有关的“候选基因”,看看要注意什么,譬如说,某种药物,有人用灵验,有人不灵验,这就是个体差异。这一差异很多是基因决定的,也就是“多样性”决定的,这对医生诊病很有帮助。当然,也许不需要了解一个人的整个基因组棗大家都大同小异,而把重要区域、重要基因、重要位点的“多样性”较高的区域搞清就行了。“全基因组”信息非同小可,表达了每一个人有关生、老、病、死的重要信息,它是一个人全部隐私中的最重要的隐私,可不是一个人一般生理指标,如身高、体重、胸围、血型等等,因此,它的使用可得慎之又慎。
植物基因组D N A提取试剂盒(北京天根)
植物基因组DNA提取试剂盒 1 取植物新鲜组织约100 mg或干重组织约30 mg,加入液氮充分研磨。 2 将研磨好的粉末迅速转移到预先装有700 μL 65℃预热缓冲液GP1的离心管中(实验前在预热的GP1中加入巯基乙醇,使其终浓度为0.1%),迅速颠倒混匀后,将离心管放在65℃水浴20 min,水浴过程中颠倒离心管以混合样品数次。 3 加入700 μL氯仿,充分混匀,12,000 rpm(~13,400×g)离心5 min。 注:若提取富含多酚或淀粉的植物组织,可在第3步前,用酚:氯仿/1:1进行等体积抽提。 4 小心的将上一步所得水层上相转入一个新的离心管中,加入700 μL缓冲液GP2,充分混匀。 5 将混匀的液体转入吸附柱CB3中,12,000 rpm(~13,400×g)离心30 s,弃掉废液。(吸附柱容积为700μL左右,可分次加入离心。) 6 向吸附柱CB3中加入500 μL缓冲液GD(使用前请先检查是否已加入无水乙醇),12,000 rpm(~13,400×g)离心30 s,倒掉废液,将吸附柱CB3放入收集管中。 7 向吸附柱CB3中加入600 μL漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm(~13,400×g)离心30 s,倒掉废液,将吸附柱CB3放入收集管中。 8 重复操作步骤7。 9 将吸附柱CB3放回收集管中,12,000 rpm(~13,400×g)离心2 min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂
洗液。 注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中的乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。 10 将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200 μL洗脱缓冲液TE,室温放置2-5 min,12,000 rpm(~13,400×g)离心2 min,将溶液收集到离心管中。 注意:洗脱缓冲液体积不应少于50 μL,体积过小影响回收率。洗脱液的PH值对于洗脱效率有很大影响。若用水做洗脱液应保证其pH值在7.0-8.5范围内(可以用NaOH将水的pH值调到此范围),pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。为增加基因组DNA的得率,可将离心得到的溶液再加入吸附柱CB3中,室温放置2 min,12,000 rpm (~13,400×g)离心2 min。
实验六印记基因 一.实验目的 学习印记基因的鉴定方法。 二.实验原理 (一)背景知识 基因组印记是指组织或细胞中,基因的表达具有亲本选择性的现象,即只有一个亲本的等位基因表达,而另一亲本的等位基因不表达或很少表达,相应的基因则称为印记基因。只表达父本而不表达母本等位基因的印记基因称为母本印记基因;只表达母本而不表达父本等位基因的印记基因称为父本印记基因。 B830012L14Rik是一个非编码RNA基因,位于12号染色体上的印记基因簇中,目前该基因功能尚不明确。在该基因的第一外显子序列中存在一个SNP位点,在B6小鼠中该位点为A(AA),在ICR小鼠中则为碱G(GG)。而B6与ICR小鼠的子代杂交个体中则为AG。 若该基因非印记表达,则在子代个体的cDNA基因型为AG。而该基因若印记表达,则在子代杂合个体的cDNA基因型为OA或OG。通过对比父本或母本的基因型,便可判断该印记基因的表达模式。 (二)技术原理: 1. PCR 聚合酶链式反应(Polymerase chain reaction,PCR)是一种分子生物学技术,用于体外扩增特定的DNA片段。 PCR技术主要过程是,通过人类合成的一小断单链DNA片段(叫做引物)与模板DNA特定的区域特异性结合,进而以四种dNTP为底物,通过DNA聚合酶沿着引物和模板形成的双链部分的3’端聚合形成DNA片段实现DNA体外扩增的过程。其中,最重要的是热稳定的DNA聚合酶,由于该酶在97度以上的高温也能保持稳定,所以我们可以通过94~97度这个温度范围内处理DNA形成单链,然后降温(根据引物不同而有差异,一般为50-55度)直至适量的引物结合到模板上。最后温度提升至72度,聚合酶聚合形成双链DNA。
试剂盒组成、储存、稳定性: 试剂盒组成保存50次100次200次 酵母裂解液室温15 ml 30 ml 60 ml 蛋白沉淀液室温 5 ml 10 ml 20 ml DNA溶解液室温 5 ml 5 ml 10 ml 本试剂盒在室温储存12个月不影响使用效果。 储存事项: 1.环境温度低时酵母裂解液中某些去污剂成份会析出出现浑浊或者沉淀,可在37℃ 水浴加热几分钟,轻轻旋摇,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。 2.蛋白沉淀液可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,如果不 能完全溶解,也不影响使用效果,直接取用上层溶液即可。 3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时 盖紧盖子。 产品介绍: 本试剂盒用于快速的从酵母中提取基因组DNA。在针对酵母细胞特点配制的酵母裂解液作用下,酵母细胞被裂解释放出基因组DNA,然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重溶解于DNA溶解液。 产品特点: 1.不需要使用有毒的苯酚、氯仿等试剂。 2.快速,简捷,整个过程可在1个小时内完成。
3.结果稳定,产量高(比离心柱型的产量高一倍以上),OD260/OD280典型的比值 达1.7~1.9,长度可达50Kb-150kb,可直接用于PCR,Southern-blot和各种酶切反应以及文库构建。 操作步骤:(实验前请先阅读注意事项) 1.吸取1.5ml 酵母培养物到一个1.5ml离心管;12,000rpm离心2分钟,尽可能弃 上清,必要时候可以用枪吸去。 2.高速涡旋振荡,打散重悬酵母细胞团。 3.加入300μl酵母裂解液,涡旋振荡混匀,或者用1毫升的枪头反复吹打混匀。 酵母细胞的重悬分散对下一步裂解非常重要,必须充分分散重悬。 4.将裂解物放置在70℃水浴15-30分钟。 如果产量低,可以适当提高水浴温度和延长水浴时间,中间可以涡旋振荡混匀几次帮助裂解。 5.冰上至少5分钟使回复到室温。 6.在回复到室温的裂解物内加入100μl蛋白沉淀液后,在涡旋振荡器上高速连续振 荡混匀20秒。混匀后可能见到一些小的蛋白团块。冰浴5分钟。 7.13,000rpm离心5-10分钟。这时应该可以见到管底蛋白沉淀,也可能见到一些蛋 白沉淀漂浮在液体表面。 8.小心缓慢吸取上清到一个新的1.5ml离心管中,不要吸到沉淀。 吸取上清时,注意不要吸到管底的和漂浮在液体表面的蛋白沉淀。如果不小心将蛋白沉淀转入新的离心管中,可再次离心2分钟后取上清。 9.加入等体积的室温异丙醇(约400μl),颠倒30次混匀或者直到出现絮状DNA沉 淀(或者白色浑浊沉淀)。
QIAGEN试剂盒提取DNA步骤 缓冲液AP1和AP3/E可能在储藏过程中沉淀,使用前检查,必要时65摄氏度预热溶解(注意加完乙醇后就不能再加热) 缓冲液APW和AP3/E第一次使用时要加入适量乙醇(96%-100%) 1.研磨前擦拭工作台。 2.研钵里加入液氮,预冷。研磨材料,加3-5次材料,充分研磨。液氮预冷离心管后 加入材料,加至1/2或2/3处。若暂时不加缓冲液,就放入至液氮冷冻,用时拿出。拿出后立即轻轻开盖,防止材料喷出。 3.加入440l缓冲液AP1(必须为预热好的),。盖好后使劲颠倒混匀材料和缓冲液。 4.加4lRNase后,剧烈涡旋,使管底的材料也与液体混合。 5.将混合物在65摄氏度下温浴15min,每5min中上下轻轻颠倒试管2-3次。准备冰盒。 6.加入130l缓冲液AP2,上下颠倒混匀,在冰上放置5Min。 7.14000rpm/min离心5min. 8.仔细缓慢将上层液体(500l)置于QIAshredder Mini Spin Colum(柱)中(紫色)。 14000rpm/min离心2min. 9.将上步中的滤液(450l)缓慢吸至一新的离心管(自己准备的Axygen离心管)中, 注意别吸到管底细胞碎片小球。 10.在溶解清液中仔细缓慢加入倍体积(675l)的缓冲液AP3/E。一定要仔细,慢慢抽 吸至两者充分混匀。 11.将上步中650l混合液(包括形成的沉淀)加入Dneasy Mini Spin Colum(柱)中(白色), 其余的混合液留着,用于再次抽提。8000rpm/min(一般用14000rpm/min)离心1Min,丢弃废液。准备灭菌的去离子水于65摄氏度水浴锅中预热。 12.剩余的混合液继续加入上一步的Dneasy Mini Spin Colum(柱)中,8000rpm/min(一 般用14000rpm/min)离心1Min,丢弃废液和收集管。 13.将Dneasy Mini Spin Colum(柱)下置试剂盒提供的2ml离心管(取时手不要伸进去,隔 着塑封袋捏出离心管)。加入500l缓冲液AW,放置3-5min,8000rpm/min(一般用14000rpm/min)离心1Min,丢弃废液,收集管再用一次。 14.Dneasy Mini Spin Colum(柱)中加入500l缓冲液AW,放置3-5min,14000rpm/min 离心3Min,丢弃废液, 收集管再用一次。 15.Dneasy Mini Spin Colum(柱)中加入500l无水乙醇,放置3-5min,14000rpm/min离 心3Min,丢弃废液和收集管 16.在Dneasy Mini Spin Colum(柱)下置或2ml离心管(自己准备的Axygen离心管),吸取 100l灭菌的去离子水(必须为预热的)加到Dneasy膜上。65摄氏度水浴5min。 8000rpm/min(一般用14000rpm/min)离心1min洗提DNA。