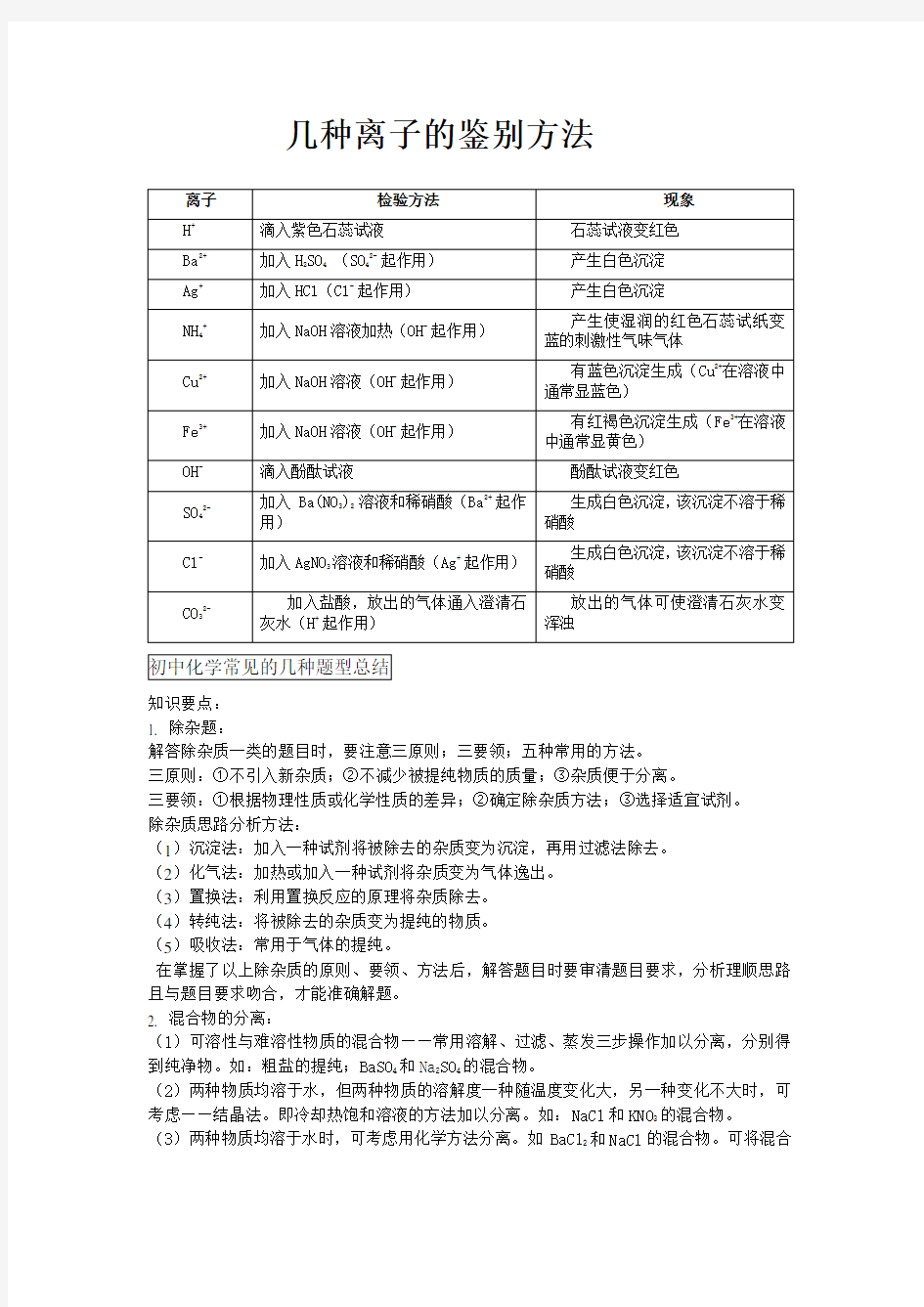

几种离子的鉴别方法
知识要点:
1. 除杂题:
解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
除杂质思路分析方法:
(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。
2. 混合物的分离:
(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。即冷却热饱和溶液的方法加以分离。如:NaCl和KNO3的混合物。
(3)两种物质均溶于水时,可考虑用化学方法分离。如BaCl2和NaCl的混合物。可将混合
物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。BaCl2+ Na2CO3=BaCO3↓+2NaCl。将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。BaCO3+2HCl =BaCl2+H2O+CO2↑。最后分别将NaCl溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和] BaCl2固体。
注意:用化学方法或用物理方法进行混合物分离时,要区别除杂质与分离物质的不同点是:除杂质时只要求把杂质除掉、保留原物质即可;而混合物分离是几种物质用一定的方法分开,原混合物中各成分都必须保留。
3. 物质的鉴别:
鉴别是通过化学实验将几种不同特性的物质区别开来。如鉴别两瓶无色溶液哪瓶是NaCl或KNO3。我们只要把NaCl溶液中的Cl-检验出来,即可认定NaCl溶液,另一瓶则溶液.(1)常见离子鉴别的特效试剂
H+和OH-:紫色石蕊试液或pH试纸。
OH-:无色酚酞试液(可鉴别碱性溶液)——变红。
Cl-:AgNO3溶液和稀HNO3——有白色沉淀。
SO42-:BaCl2溶液和稀HNO3——有白色沉淀。
CO32-:稀HCl和石灰水——有CO2↑。
NH4+:强碱溶液(NaOH)——有NH3↑。使湿润红色石蕊试纸变蓝。
(2)特征离子关系图
(3)物质鉴别的原则
①操作简便:能用物理方法鉴别的不用化学方法。能用一种试剂鉴别的不用多种试剂。
②现象明显:使待检物质的现象对比度较大。
③防止干扰:鉴别Cl-和SO42-时,只能用BaCl2溶液不能用AgNO3溶液。
(4)物质鉴别的思路和方法
①气体鉴别:一看颜色,二用试纸,三用火点,四加试剂。
②固体、液体鉴别:一看颜色,二看气体,三辨沉淀。
③一种试剂的鉴别:
A. 几种溶液含不同阳离子时,常选用Ba(OH)2溶液或NaOH溶液做鉴别试剂。
B. 几种溶液含不同阴离子时,常选用强酸做鉴别试剂。
C. 几种溶液酸碱性不同时,常选用紫色石蕊做鉴别试剂。
D. 几种物质是金属或金属氧化物时,常选用稀强酸做鉴别试剂。
E. 一种试剂与四种溶液反应时,应是现象对比度大。多数是有沉淀、有气体,既有沉淀又有气体、沉淀颜色不同,无明显现象。
F. 当给定的一种试剂不能鉴别出被检物时,可从已鉴别出的物质中找出一种试剂再鉴别。
④不同试剂的鉴别:
A. 观察法:根据物理性质中颜色、气味、状态、溶解性等进行鉴别。
B. 热分解法:根据不同物质的热稳定性,利用产物的不同性质特征进行鉴别。
C. 相互作用法:根据两两混合后的不同现象进行鉴别。
4. 物质的鉴定:
鉴定是根据待检物质的特性,通过不同的实验将物质的各组分逐一检验出来,从而确定某物质。鉴定与“用实验方法确定或证明”等用语意义相同。如:用化学方法证明某白色固体是硫酸铵。在鉴定时不但要用化学实验检验白色固体是否是铵盐(含NH4+),还要检验它是否是硫酸盐(含SO42-)。从而确定此白色固体是(NH4)2SO4。
5. 推断题:
物质的推断是根据给出的实验步骤和现象,运用物质的特性,经过分析、推理作出正确的判断,以确定所给的未知物是什么物质,不可能是什么物质;确定混合物里或溶液里肯定有什么物质,肯定不含有什么物质,可能含有什么物质。
推断题是考查化学知识的综合分析能力的一种题型。常见的有文字叙述、图表式、链条式三种形式推断题,无论哪种形式推断都必备的知识有反应规律、物理性质、化学性质、实验现象、溶解性等。在题目分析过程中,注意关键字的分析,如某物质溶于水是“生成”还是“得到”,“生成”是反应产物,“得到”既可能有反应产物,也可能有原物质。加酸沉淀溶解时有气体生成,一般有CO32-。沉淀溶解但无气体生成时,一般有OH-。部分溶解时,一定有BaSO4或AgCl等。
解推断题应注意:
(1)推理分析要紧扣实验现象,思考时要层次分明。判断的结论要准确,既要明确的肯定,又要明确的否定。
(2)一般情况下,与试题叙述的现象完全吻合的是“一定存在”。与现象不吻合的或有某种物质的存在使现象不正确的物质是“一定不存在”。有某种物质的存在不影响其它反应的现象或自始至终没有参与任何反应的物质是“可能存在”。
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色。(包括Fe(OH))注意:沉淀物中AgCl和BaSO4不溶于稀硝酸,
2
其他沉淀物能溶于酸。如:Mg(OH)2 CaCO3 BaCO3 Ag2 CO3等
转基因玉米的鉴别方法 转基因玉米的鉴别方法 判断转基因食品的几个标准: 1、个头。按照传统,西红柿也有一定个头的,比如:像大拇指头那么一点大的小西红柿绝对是转基因。再比如大豆,也叫黄豆,就是做豆腐,豆浆那种豆子,形状应该像动物内脏:腰的样子,有点扁,可现在的大豆,全是圆圆的、大不少、就像豌豆一样的大豆,产量很高,就是转基因。 2、色彩。与传统的不一样的绝对是转基因,比如彩色棉花、彩色辣椒。 3、产量。转基因作物一般在开始几年,其产量要比传统作物高不少。 4、季节。除了大棚蔬菜外,其它的反季节食品容易是转基因的。 5、害虫。凡是害虫喜欢光顾的作物就是没转基因的,凡是害虫害怕,也就是没有害虫,或很少害虫的作物,就是转基因。 甜玉米是转基因玉米吗 甜玉米的不同之处在于,它的胚乳中可不只有淀粉,还有相对含量很高的水溶性多糖,这就赋予了其不同于普通玉米的甜味。究其背后的原因,是在甜玉米控制淀粉合成的一系列基因中,有一个或几个基因发生了自然的突变,处于纯合隐性状态,切断了部分还原性糖向淀粉转化的过程。这点小缺陷反而促成了甜玉米可口的味道。 甜玉米并不是最近才有的新作物,它的真正起源时间虽然无法考究,但有文献记载的最早的甜玉米品种是1779年欧洲殖民者从美洲的易洛魁人那里收集到的Papoon玉米,据此可以肯定甜玉米的出现时间还要更早。要知道,那时候可还压根没有转
基因这一说。 现在的甜玉米品种虽然和几百年前的不完全相同,但它同样不是转基因的产物,而是在自然突变的甜玉米品种的基础之上,通过传统育种技术选育自交系、组配杂交种的办法培育出的新的甜玉米品种。 最近几年,与甜玉米有关的几个基因序列和与其关联的分子标记都已经被找到,育种家还可以依靠分子标记辅助选择技术来加快育种进程。此外,还有利用花药组织培养技术来加快隐性基因的纯合进程的选育方法,也开始受到育种家的重视。 这些育种技术并没有涉及到单个或少数几个结构和功能已知的目的基因的插入,也没有对基因进行修饰、敲除、屏蔽等的改变(这些是我们常说的转基因技术手段)。通过这些方法培育出来的甜玉米都不是转基因玉米。很多人因为甜玉米的甜味不同于普通玉米,就认为甜玉米是转基因技术培育的,这其实是没有想到玉米自己的基因突变也会产生不一样的性状。 分辨转基因食品的方法 专家指出,按我国相关立法,若产品的主要原料中含转基因成分,应当在包装上加以注明,如果消费者不想购买转基因食品,一定要认真阅读食品标签,如买大豆油时,往往会看到小字标注原料是转基因大豆。 但若加工食品中含有转基因产品配料,却没有规定必须注明。如美式快餐店里的薯条,用的大都是转基因马铃薯品种;点心里的油脂,饭店里的烹调油,往往是转基因油。 所以在外就餐、购买加工食品时,遇到转基因食品成分的机会较大。相比之下,买国产果蔬(除番木瓜)、用花生油等来做烹调,几乎没有吃进去转基因成分的可能。多吃中国的杂粮杂豆,如小米、红豆等,也不会遇到转基因成分,而且其营养价值高。
陌生氧化还原反应离子方程式的书写技巧总结! 高中化学涉及的反应是以氧化还原反应为主题,又经常以离子方程式的形式来体现,在高考题中经常涉及的一些复杂氧化还原反应离子方程式的书写,对于高三学生来讲往往是一道不可逾越的墙,究竟有没有一种可行有效的方法解决这个问题呢?笔者通过对众多氧化还原反应的离子方程式书写的体验中找到了一种行之有效的方法,并把这个方法称之为分解法。 1.必须掌握的元素及其形成的 具有强氧化性和强还原性的物质或离子(1)高中新课程教材中所涉及的元素有:Na、Al、Fe、Cu、Si、N 、O、S、Cl、Br、I (2)元素形成具有强氧化性和强还原性的物质或离子的归纳:强氧化性物质或离子:Na2O2、Fe3+、 Fe(OH)3、Fe2O3、Fe3O4、NO、NO2 、HN03(浓)、 HN03(稀)、02、03、H2O2、H2SO4(浓)、Cl2、HClO、NaClO、Ca(ClO)2、Br2、I2、KMnO4(H+) 、K2Cr207(H+) 强还原性物质或离子:Fe2+、Fe0、Fe304、Fe(0H)2、FeS、FeS2、FeBr2、FeI2、CuS、Cu2S、Cu20、CuH、S02、H2S03、Na2S03、NaHS03、H2S、Na2S、NaHS、 Na2S203、NaI (3)下表是你必须掌握的转化关系:转化关系图2.复杂的氧化还原反应离子 方程式的书写方法——分解法分解法 3.典型例题分析例题:Ca(ClO)2 和SO2 反应的离子方程式;
【解析】(1)写出Ca(ClO)2 和SO2 反应的离子方程式:第一步:找出发生氧化还原反应的粒子:ClO- 和SO2 第二步:合理地预测产物:ClO-+SO2 ——Cl-+SO42- 第三步:配电子,由于CIO- T Cl-是得到2e- ; SO2^SO42 -是失去2e- ,因此,得失电子已经相等了第四步:配电荷,实际SO2是被氧化为H2SO4,写离子方程式时,H2SO4是要拆的,因此写成SO42- 形式,因此该反应所产生的溶液是呈酸性的,用H+来配电荷,显然是加在生成物的一边,并且得加2 个H+,即CIO-+SO2 ——Cl-+SO42-+2H+ 第五步:配原子,反应是遵循质量守恒定律的,因此反应前后,相应原子个数要相等的,显然反应物的一边要加1个H2O,即CIO- +SO2+H2O ——CI-+SO42-+2H+ 。这样就将该化学方程式配平了。最终的结果是:CIO-+SO2+H2O ——CI-+SO42-+2H+ 。【练习】书写下列反应的离子方程式:(2)写出碱性条件下 CI2 和Na2S2O3 反应的离子方程式;(3)写出碱性条件下NaCIO 和FeSO4 反应的离子方程式;(4)写出酸性条件下NO2 和 FeSO4 反应的离子方程式;(5)写出HNO3( 稀)和FeSO4反应的离子方程式;(6)写出酸性条件下KMnO4和FeSO4反应的离子方程式;(7)写出酸性条件下K2Cr2O7和FeS04反应的离子方程式;(8)写出HN03(稀)和FeS反应的离子方程式;(9)写出HN03(稀)和Cu2S反应的离子方程式;(10)写出酸性条件下H2O2和FeS04反应的离子方程式。 【解析】(2)写出碱性条件下Cl2 和Na2S2O3 反应的离子方程
离子反应先后顺序的确定方法 请看下面一组题目 1.写出在含有x mol的溶液中,通入的物质的量为ymol,当 ①②各反应的离子方程式。 2.在的溶液中,逐滴加入NaOH溶液,请写出各阶段的离子方程式。 3.在的混合溶液中,逐滴加入NaOH溶液,请写出各阶段的离子 方程式。 4.在的混合溶液中,逐滴加入盐酸,请写出各离子方 程式。 从以上的题目中可以看出,要准确完成以上各题,必须弄清楚各离子反应的先后顺序。根据离子反应规律可总结以下方法: 1.在氧化还原反应中,多种氧化剂遇到一种还原剂,或者多种还原剂遇到一种氧化剂,根据强者优先的原则予以确定反应先后。 如在第1小题中由于还原性大小为,故反应,该题的正 确答案为 ① ② 2.根据反应后生成物的稳定程度来判断,生成物越稳定的离子优先反应。 如在第2小题中与均与结合生成比生 成要稳定,故先与反应。 3.根据反应后生成物的溶解度来判断,生成物溶解度越小的离子优先反应。 如在第3小题中均与反应生成和,由于 的溶解度比的溶解度小,故先与反应。 4.根据反应后生成物的电离程度来判断,生成物电离程度越小的离子优先反应。如在第4小题中,、均能与反应生成、,但是由于电离程度大小为,故 先与反应,然后是,最后是
高考热点—离子反应先后次序的探究 离子方程式的书写与离子共存是近年各省高考题中的热点及难点,几乎成为必考题类,此类题看似容易,可得分率并不高。究其原因,有相当一部分失误在离子反应的先后问题上,此为学生在离子反应知识上的一个盲目点所在。如何解决此类问题,不仅牵涉复分解离子反应条件,也牵涉到氧化还原反应及电离平衡等知识点。 近年来高考考查的离子反应的先后问题,主要集中在两个考点:复分解离子反应先后问题及氧化还原型离子反应的先后问题。笔者对此类问题经过认真探讨,仔细推敲,总结出了解决此类问题的基本原则及思路,在教学中推广,效果较好,现拿出来与大家一起分享。 1复分解型离子反应的先后次序问题 此类问题的溶液中有多个不同离子与同一个离子均可发生复分解反应(如:多个阴离子与同一阳离子反应;多个阳离子与同一阴离子反应;不同阴、阳离子与同一离子的反应,如NH4HCO3与NaOH),这些离子有无先后反应问题?若有它将遵循什么原则? 例1:在CH3COONa,NaHCO3,C6H5ONa的混合溶液中,逐滴加入盐酸,请依次写出各步离子方程式。 解析:根据离子反应条件,生成沉淀、气体、难电离的物质方可发生离子反应,CH3COO-,HCO3-,C6H5O-均可与H+生成难电离的弱电质而发生反应,由于HCl是逐滴滴入的,所以H+浓度逐渐增大,只有最弱的电解质酸根C6H5O-最先与溶液中H+达到电离平衡开始生成弱电解质,所以生成的电解质越弱、越难电离,则该离子反应最先发生。由于酸性顺序是:CH3COOH>H2CO3>C6H5OH,三个离子反应的顺序应为: ①C6H5O-+H+=C6H5OH ②HCO3-+H+=H2CO3 ③CH3COO-+H+=CH3COOH 同理,可解析NH4HCO3与NaOH反应时,应为HCO3-先反应,NH4+后反应,原因: HCO3-+OH-=CO32-+H2O NH4++OH-=NH3·H2O 由于生成的H2O比NH3·H2O更难电离,所以HCO3-与OH-优先反应。 故有,NaOH少量时:HCO3-+OH=CO32-+H2O NaOH过量时:NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O 所以复分解型离子反应的先后原则为:生成的电解质越弱越优先反应,同理,生成的沉淀溶解度越小,越优先反应,但有时也要考虑离子共存(例如双水解)的影响。比如: 例2:在含有NH4+、Al3+、H+、Mg2+溶液中逐滴滴入NaOH,请依次写出各步离子方程式。 解析:根据离子反应条件,上述离子均能与OH-反应生成难电离的物质及沉淀而反应。但有先后问题,由于H2O是极弱的电解质,是高中化学所学最弱的电解质(且H+与Mg(OH)2及Al(OH)3不共存),故H+优先于其他离子与OH-反应,Mg2+与Al3+优先于NH4+反应,因为更难电离或者可解释为NH4+生成的NH3·H2O又可与Mg2+及Al3+反应后变成NH4+,由于Al(OH)3更弱更难溶,所以Al3+优先于Mg2+反应,Mg2+优先NH4+反应,此时除了剩下的NH4+可与OH-反应外,还有生成的Al(OH)3也可与OH-反应,哪一个优先反应呢?可借助双水解判断。假设Al(OH)3 先反应,则生成的AlO2-与NH4+又发生水解而不能共存,重新生成Al(OH)3及NH3·H2O,所以NH4+先反应,Al(OH)3后反应。故先后发生的离子反应依次为: ①H++OH-=H2O ②Al3++3OH-=Al(OH)3↓ ③Mg2++2OH-=Mg(OH)2↓ ④NH4++OH-=NH3·H2O
第二节离子反应 ( 第一课时 ) 教学目标 1.了解电解质的概念;知道酸、碱、盐在溶液中能发生电离 2.通过对酸、碱、盐电离情况的分析,培养学生归纳、概括能力,训练学生的科学方法 3.体验科学探究的艰辛与喜悦,树立辩证唯物主义世界观 教学重点、难点 重点:让学生讨论酸、碱、盐的电离情况,从电离的角度认识酸碱盐的本质 难点:电解质的概念
巩固练习 1.下列状态的物质,既能导电又属于电解质的是( ) A.氯化镁晶体 B. 氯化钠溶液 C. 液态氯化氢 D. 熔融氢氧 化钾 2.下列物质中导电性能最差的是( ) A.石墨棒 B. 固体氧化钾 C. 盐酸 D. 熔融氢氧化钠 3.下列物质在一定条件下能够导电,但不是电解质的是( ) A. 铝 B. 食盐 C. 硫酸 D. 蔗糖 4.仅能在水溶液中导电的电解质是( ) A. KOH B. KNO3 C. NH4HCO3 D. 酒精 5.下列物质的水溶液中存在溶质分子的是( ) A. HCl B. NaOH C. Na2CO3 D. 蔗糖 6.下列电离方程式不正确的是( ) A.H2SO4=2H++SO42- B.NH4NO3=NH4++NO3- C.Na2CO3=Na2++CO32- D. Ba(OH)2=Ba2++2OH- 7.下列关于电解质的判断中,正确的观点是() A.在熔融状态下能够导电的物质 B. 在熔融或溶液中能够导电的物质 C. 在熔融或溶液中能够导电的化合物 D. 在熔融和溶液中都能导电的化合物 8.下列电离方程式中,正确的是( ) A.Ca(OH)2=Ca2++2(OH-) B. FeCl3=Fe2++3Cl- B.H2SO4=H2++SO42- D. Al2(SO4)3=2Al3++3SO42-
药物分析鉴别题简答题参考答案 第二章 五、问答题 56. 答:鉴别试验是根据药物的分子结构、理化性质,采用化学、物理化学或生物方法来判断药物的真伪。它是药物质量检验工作的首项任务,只有在药物鉴别无误的情况下,进行药物的杂质检查、含量测定等分析才有意义。 57. 答:药典收载的物理常数包括相对密度、馏程、熔点、凝点、比悬度、折光率、粘度、酸值、皂化值、羟值、碘值、吸收系数。 58. 答:(1)有摩尔吸收系数和百分吸收系数两种表示方法; (2)百分吸收系数是中国药典收载的方法。 60. 答:(1)TLC一般采用对照品(或标准品)比较法,要求供试品斑点的Rf值应与对照品斑点的一致。 (2)HPLC和GC用于鉴别时,一般规定按供试品含量测定下的HPLC色谱条件进行试验,要求供 试品和对照品色谱峰的保留时间一致。含量测定方法为内标法时,可要求供试品溶液和对照品溶液色谱图中药物峰的保留时间与内标物峰的保留时间比应相同。 61. 答:系用分辨率为2cm-1的条件绘制;基线一般控制在90%透光率以上;供试品取样量一般控制在使其最强吸收峰在10%透光率以下。 63. 答:就是在与供试品鉴别试验完全相同的条件下,除不加供试品外,其他试剂均同样加入而进行的试验。 65. 答:(1)常用的鉴别方法有化学法、光谱法、色谱法和生物学法。 (2)药物的鉴别方法要求专属性强、重现性好、灵敏度高以及操作简便、快速等特点。
第五章四、鉴别题96. 答: ① ② (一) 黄色①为苯巴比妥褪色②为司可巴比妥 97. 答: ①②(一)2+ 黑色沉淀①为硫喷妥钠褪色②为司可巴比妥钠 五、含量测定题 98. 答:本品为苯巴比妥钠。 原理:分子结构中含有丙二酰脲基团,在碳酸钠介质中可与硝酸银定量反应。 根据消耗硝酸银的量可计算出苯巴比妥钠的含量。 主要条件: ①甲醇做溶剂。 ②加新配制的无水碳酸钠溶液后滴定。 ③用电位法指示终点。 ④滴定剂为0.1mol/L硝酸银滴定液。 99. 答:本品为司可巴比妥钠。 原理:分子结构中含有不饱和取代基,可与溴定量的发生加成反应,故可以采用溴量法测定其含量,其测定原理可用下列反应式表示:
中国市场上的转基因食品及鉴别方法 国内市场上的转基因食品清单 一、我国转基因作物有哪些? 1、已批准安全证书的有棉花、水稻、玉米和番木瓜,只有棉花、番木瓜批准商业化种植 “截至目前,我国批准了转基因生产应用安全证书并在有效期内的作物有棉花、水稻、玉米和番木瓜。”中国农科院植保所副研究员谢家建介绍说。 “目前,转基因水稻和转基因玉米尚未完成种子法规定的审批,没有商业化种植。”谢家建表示,“我国已经进行商业化种植的转基因作物只有棉花和番木瓜。” 我国批准进口用作加工原料的转基因作物有大豆、玉米、油菜、棉花和甜菜。这些食品必须获得我国的安全证书。 2、目前市售圣女果、彩椒、小南瓜、小黄瓜都不是转基因食品 网上流传一份转基因食品名单,包括“圣女果、大个儿彩椒、小南瓜、小黄瓜”。对此专家并不认同。 中国农科院生物所研究员王志兴说,小番茄也叫圣女果、樱桃番茄,是自古就有的番茄品种,只是因为个头小、采摘不便、产量低,最早仅作为观赏用,后来发现食
用方便,口味经过改良后逐渐流行。个头小是天生的基因差异,不是转基因的结果。 中国农科院油料所副研究员吴刚说,小南瓜和小黄瓜也不是转基因食品,仅仅是未充分成熟的南瓜和黄瓜。如果继续在田间种植,小南瓜和小黄瓜最终会生长成普通的大南瓜和老黄瓜。 关于大个儿彩椒,吴刚表示,大个儿彩椒含有不同类型的花青素,表现为更丰富的颜色。花青素的变异在植物中很常见,像鲜花同一个品种就有不同颜色,萝卜也有红萝卜、绿萝卜、白萝卜等。“我国曾经批准过抗病毒甜椒的商业化种植,但与常规甜椒相比,转基因甜椒并没有明显优势,因此被市场自然淘汰。” 3、我国市场转基因食品主要是大豆油和木瓜 中国农业大学食品工程与营养科学院院长罗云波介绍,目前中国市场上的转基因食品主要有两种,一种是转基因食用油,就是我们所说的大豆色拉油,来源主要是从美洲,尤其是从美国、阿根廷、巴西等国家进口的大豆所生产出来的食用油。 还有一种就是转基因木瓜,因为木瓜容易得一种农药很难治的病,用基因的技术能够控制,转基因木瓜也是我们能够吃到的转基因食品。除此之外,我国很少能够见得转基因种类的食品。
高考化学离子反应知识 第一片:概述 1.概念:有离子参加或生成的反应 2.环境:水溶液或熔融状态下中学很少涉及。 3.分类:①复分解反应,②氧化还原反应,③双水解反应,④络合反应 4.实质:有离子的浓度发生改变具体到最常见的复分解反应体现为:生成难溶、难电离、易挥发性物质 5.应用: 第一片:离子共存 通常指的是大量共存,发生离子反应就不能共存,不能发生离子反应就可以共存。其考查方式一般有判断和推断。解决该问题需注意: ⑴首先看清楚题第一要求: 是“能”还是“不能”、是“一定”还是“可能”。 ⑵颜色要求: 通常是要求无色,有色离子MnO4-、Cu2+、Fe3+及Fe2+不能大量存在I-、Br-无色。 ⑶反应类型要求: 如要求是因氧化还原反应、双水解反应、生成沉淀、生成气体等等。一般以要求氧化还原反应为多。 ⑷酸碱性要求 ①酸性环境含有大量H+,能与H+反应的所有弱酸的酸根离子和酸式酸根离子生成弱酸、OH-离子中和、S2O32-歧化均不能大量存在。 ②碱性环境中含有大量OH-,凡能与之反应生成弱碱的金属阳离子、NH4+及所有酸式酸根离子、H+中和,都不能大量存在。 ③加入铝产生氢气及由水电离的H+或OH-非常小水的电离被强烈抑制,可能是强酸性环境,也可能是强碱性环境。 ④附:常见题给提示的溶液酸碱性情况
A.直接点明、 B.溶液的PH值、 C.H+或OH-的浓度、 D.使酸碱指示剂变色情况、 E.Kw与H+或OH-比值大小、 F.H+与OH-比值大小、 G.由水电离的H+或OH-的大小。 ⑸其他题意要求:加入某粒子的反应情况、已经含有某离子的情况等。 ⑹常见的: A.因氧化还原反应不能大量共存的氧化性的:MnO4-、ClO-、Fe3+、NO3-H+与还原性 的I-、S2-、HS-、SO32-、HSO3-、Fe2+等; B.因双水解不能大量共存的:Al3+与CO32- 、HCO3-、S2-、HS-、HSO3-、AlO2-,Fe3+与CO32-、 HCO3-; C.因络合反应不能大量共存的:Fe3+和SCN-、苯酚,NH3和Ag+、Cu2+、Ca2+等。 第二片:离子方程式 用来表示离子反应的方程式。遵循电子守恒、电荷守恒、质量守恒,三大守恒。考查 方式通常有判断正误和书写两种方式,是化学考试的重点和热点。 ⑴必须符合反应的客观事实:如Fe和稀硫酸或稀盐酸只能生成Fe2+而不会生成Fe3+、稀硝酸和活泼金属反应不会生成氢气、Al3+和过量的氨水不会生成 AlO2-等等相同的反应 物因相对量的不同,产物不相同的书写。这个问题我们后面单独讨论。 ⑵电子守恒:若是发生的氧化还原反应,氧化剂得电子总数一定等于还原剂失电子总数。 ⑶电荷守恒:反应物所带正负电荷代数和总数等于生成物所带正负电荷代数和总数。 ⑷质量守恒:参加反应的各元素原子总数前后相等。 ⑸相关物质的书写要正确,即通常所说的“拆”与“不拆”的问题。为了方便应用, 记住一句话就行:只有可溶性强电解质在水溶液中才能拆开写。即:单质、氧化物、非电 解质、弱电解质、难溶、易挥发均不能拆开。
常见的十对离子反应和两类反应:(作用——使复分解反应具备了生成条件) 生成沉淀: (1)Ag+ + Cl-→AgCl↓ 白色 如:AgNO3 + HCl= AgCl↓+HNO3; AgNO3 + NaCl= AgCl↓+NaNO3 (2)Ba2+ + SO42-→BaSO4↓白色 如:H2SO4+ Ba(NO3)2 =BaSO4↓+ 2HNO3; Na2SO4+ BaCl2 =BaSO4↓+ 2 NaCl (3) Mg2+ + OH-→Mg(OH)2↓白色 如:MgCl2 + 2NaOH = Mg(OH)2↓+2NaCl ; Mg(NO3)2 + 2NaOH = Mg(OH)2↓+2NaNO3 (3)Ca2+ + CO32-→CaCO3↓白色 如:Ca (OH)2 +Na2CO3= CaCO3↓ +2NaOH ; CaCl2 +K2CO3= CaCO3 ↓ +2KCl (4)Ba2+ + CO32-→BaCO3↓白色 如:BaCl2+K2CO3= BaCO3↓+2KCl ; Ba(NO3)2+Na2CO3= BaCO3↓+2NaNO3 (5)Cu2++OH-→Cu(OH)2↓蓝色 如:CuCl2+2KOH= Cu(OH)2↓+2KCl ;CuSO4+2NaOH= Cu(OH)2↓+Na2SO4 (6)Fe3+ + OH-→Fe(OH)3↓红褐色 如:Fe(NO3)3 + 3KOH = Fe(OH)3↓+3KNO3;FeCl3 + 3NaOH = Fe(OH)3↓+3NaCl 生成气体: (7)H+ + CO32-→H2O+CO2↑ 如:2HCl+CaCO3=CaCl2+H2O+CO2↑;H2SO4+Na2CO3=Na2SO4+H2O+CO2↑ (8)NH4+ + OH-→H2O+ NH3↑ 如:NH4Cl+NaOH=NaCl+ H2O+ NH3↑;NH4NO3+KOH=KNO3+ H2O+ NH3↑ 生成水: (9)H+ + OH-→H2O 如:HCl + NaOH = NaCl +H2O H2SO4 + 2KOH = K2SO4 +2H2O (10)非金属氧化物+ 碱→ 盐+水 CO2 +Ca(OH)2==CaCO3↓+H2O 、2NaOH + CO2 =Na2CO3 + H2O (11)金属氧化物+酸→ 盐+水 Fe2O3+6HCl==2FeCl3+3H2O、CuO + H2SO4 = CuSO4 + H2O 1 / 4
第二章药物的鉴别试验第二章药物的鉴别试验
4、熔点: 1、固体---->液体的温度 2、熔融同时分解的温度 3、初熔-全熔的一段温度 5、ChP收载方法 第一法:测定易粉碎的固体药品 第二法:测定不易粉碎的固体药品 第三法:测定凡士林或其他类似物 6、要求报告初熔和终熔 7、比旋度: 在一定波长(589.3nm)与温度(20°C)下,偏振光透过长1dm,含旋光性物质1g/1mL 的溶液时测得的旋光度a,称为比旋度。 [a]t D = 是手性药物特性及其纯度的主要指标。 8、吸收系数 在给定波长、溶剂和温度等条件下,吸光物质在单位浓度(C)、单位液层厚度(L)时的吸收度,称为吸收系数( E1%1cm或e)。 E1%1cm = A / C×L C= 1%或1mol/L,L= 1cm 一般鉴别试验(general identification test) 依据某一类药物的化学结构或理化性质的特征,通过化学反应来鉴别药物的真伪。 有机药物:官能团反应。 无机药物:阴、阳离子的反应 阴、阳离子的特殊反应 例钠盐、钾盐、钙盐的焰色反应 铵盐鉴别方法
氯化物 鉴别——供试液+硝酸+硝酸银→白色↓白色↓+氨试液→沉淀溶解+硝酸→白色↓ 硫酸盐 鉴别——供试液+氯化钡→白色↓白色↓+硝酸(盐酸)→沉淀不溶 有机药物——典型的官能团反应。包括:丙二酰脲类、托烷生物碱类、芳香第一胺类、有机氟化物类、水杨酸盐、枸橼酸盐、乳酸盐等鉴别。 例有机氟化物鉴别 样品经氧瓶燃烧法破坏,被碱性溶液吸收成为无机氟化物,与茜素氟蓝、硝酸亚铈在pH4.3溶液中形成篮紫色络合物。 反应原理如下: 由上可知,一般鉴别试验只能证实是某一类药物,而不能证实是哪一种药物。 专属鉴别试验(specific identification test) 是证实某一种药物的依据。 根据每一种药物化学结构的差异及其所引起的物理化学特性不同,选用某些特有的灵敏的定性反应,来鉴别药物的真伪。 例巴比妥类药物含有共同母核,区别在于5,5-位取代基和2-位取代基的不同:苯巴比妥---苯环 司可巴比妥---双键 硫喷妥钠---硫原子 又如甾体激素类药物含有环戊烷并多氢菲母核,主要差别在A环和D环的取代基不同,可利用这
化学高考一轮复习《离子反应及离子方程式》质量评估试题 (考试时间:45 分钟满分:100 分) 一、单项选择题:本题包括 10 小题,每小题 5 分,共 50 分。 1.与氢硫酸反应有沉淀生成的电解质是( ) A.硫酸铜 B.氢氧化钠 C.硫酸亚铁 D.二氧化硫 答案:A 解析:A 项,CuSO4是盐,属于电解质,加入氢硫酸,会发生反应:CuSO4+H2S===CuS↓+H2SO4,产生黑色沉淀,正确;B 项,氢氧化钠是碱,属于电解质,与氢硫酸发生反应:2NaOH +H2S===Na2S+2H2O,产生的 Na2S 是可溶性的物质,没有沉淀产生,错误;C 项,硫酸亚铁是盐,属于电解质,由于酸性:硫酸>氢硫酸,属于二者不能发生反应,无沉淀产生,错误;D 项,二氧化硫与硫化氢会发生反应:SO2+2H2S===3S↓+2H2O,产生沉淀,但是 SO2是非电解质,错误。 2.为防止流感病毒的传播,许多公共场所都注意环境消毒,以下消毒药品属于强电解质的是( ) 答案:B 解析:A 项为混合物,酒精为非电解质,醋酸为弱电解质。 3.某未知溶液可能含Cl-、CO23-、Na+、SO24-、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( ) A.一定有Cl-B.一定有SO24- C.一定没有Al3+D.可能有CO23- 答案:B 解析:本题考查离子共存、检验。溶液滴在蓝色石蕊试纸上,试纸变红,说明溶液呈 酸性含有 H + ,则;取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀 生成,一定有 SO2-4;在上层清液中滴加硝酸银溶液,产生白色沉淀,可以为 Ag2SO4,无法判断是否含有 Cl-,所以选 B。
收稿日期:2010-03-13 基金项目:国家“863”计划项目(2006AA10Z440);国家自然科学基金项目(30800770); 国家转基因生物新品种培育重大专项(2008ZX08012-001) 作者简介:许文涛(1979—),男,副教授,博士,研究方向为食品安全。E-mail :cau xwt@y ah https://www.doczj.com/doc/7f18338460.html, *通信作者:黄昆仑(1968—),男,教授,博士, 研究方向为食品安全。E-mail :hkl009@https://www.doczj.com/doc/7f18338460.html, 转基因玉米59122品系的特异性检测 许文涛1,2,杨 蓉2,陆 姣1,张 南1,2,罗云波1,何 景1,2,黄昆仑1,2,* (1.中国农业大学食品科学与营养工程学院食品安全实验室,北京 100083; 2.农业部转基因产品检验监督测试中心(北京),北京 100083) 摘 要:使用反向聚合酶链式反应(PCR)技术克隆了转基因玉米59122的外源基因与玉米基因组之间的两段侧翼序列,并据其左侧侧翼序列设计了具品系特异性的引物,运用半巢式PCR 技术建立了59122的品系特异性二重PCR 检测方法,扩增片段100b p ,横跨p a t 终止子与转基因玉米侧翼基因之间。以转基因玉米59122、MO N863、MON810、GA21、NK603,转基因大豆Roundup Ready 和转基因油菜GT73等为材料,证明本方法与其他转基因作物具有高特异性。本方法在检测59122时,确定出连接体系中线性DNA 的最佳质量浓度为1ng/μL 左右,检出限达到0.1%,灵敏度为38个单倍体基因组拷贝数。因此可准确、快速、高效地检测转基因玉米及其产品,或作为常规PCR 定性检测后的验证方法。 关键词:转基因作物;品系特异性检测;半巢式聚合酶链式反应;反向聚合酶链式反应;二重聚合酶链式反应 Event-specific Transgenic Detection of Genetically Modified Maize 59122 with Flanking Sequence XU Wen-tao 1,2,YANG Rong 2,LU Jiao 1,ZHANG Nan 1,2,LUO Yun-bo 1,HE Jing 1,2,HUANG Kun-lun 1,2,* (1. Food Safety Laboratory, College of Food Science and Nutritional Engineering, China Agricultural University,Beijing 100083, China ;2. Supervision, Inspection and Testing Center of Genetically Modified Organisms (Beijing), Ministry of Agriculture, Beijing 100083, China) Abstract :We report the cloning of two flanking sequence of the integrated gene construct of genetically modified maize 59122by inverse PCR method and the design of even-specific primers based on the left flanking sequence with the aim of developing of a duplex PCR assay for the event-specific transgenic detection of genetically modified maize 59122 using semi-nested PCR,result ing in an amplification fragment of 100 bp in length stretching from the terminator of the pat gene to the 59122 flanking genes.This assay has been successfully applied to detect genetically modified maizes 59122, MON863, MON810, GA21, NK603,genetically modified Roundup Ready soybeans and genetically modified oilseed rape GT73, with high specificity. The optimum concentration of linear DNA in a connection system for detecting genetically modified maize 59122 by this assay was around 1ng/μL, which exhibited a limit of detection of 0.1% and a sensitivity of 38 copies of haploid genome. Therefore, the developed PCR assay is applicable to detect genetically modified maize and its derivates accurately, fast and efficiently, and can serve to verify routine PCR qualitative detection. Key words :genetically modified crop ;event-specific transgenic detection ;semi-nested polymerase chain reaction ;inverse polymerase chain reaction ;duplex polymerase chain reaction 中图分类号:Q789;S513 文献标识码:A 文章编号:1002-6630(2011)04-0139-04 随着转基因作物的不断商业化,新型转基因食品的安全性问题逐渐成为公众关注的焦点。为此,各国都加强了管理[1]。除了向公众公布相关信息、增加透明度外,关键问题是建立相应的科学检测方法来分析鉴别转 基因产品。 目前,转基因产品的检测技术[2]很多,分为基于核酸水平的检测技术、基于蛋白水平的检测技术以及其他检测技术。在定性检测中基于蛋白水平的检测[3]不能区
高中化学离子反应的优秀教案 篇一:《离子反应》优秀教案 高xx级化学《离子反应》教案 (第一课时)(李季全) 一.教学目标 1.知识与技能目标 (1)让学生了解电解质和非电解质、强弱电解质的概念。 (2)让学生掌握电离方程式的书写,并从电离的角度理解酸、碱、盐的本质。 (3)通过设计探究性实验得到离子反应的实质和离子反应条件,并能分析离子共存的问题。 2.过程与方法目标 (1)通过探究实验和设想验证得到离子反应的条件,体验科学探究过程,从实验现象出发探寻反应本质。 (2)通过分析离子共存问题,让学生形成从现象到本质再到运用的思维意识。3.情感态度与价值观目标 (1)通过探究讨论活动激发学生的学习兴趣,提高学习质量。 (2)通过本节内容的学习,对于发展学生的科学素养起了非常重要的作用,是奠定高中阶段化学学习的重要基础。二.教学重点、 难点 电解质的概念、离子反应及其条件、离子的共存问题。三.教学方法
讨论+探究+实验四.教学过程 〔引入〕前面,我们在学习溶液中离子的物质的量浓度的计算时,简单介绍了酸碱盐在水溶液中的电离,生成了离子的知识。那么,请问:是不是所有的酸碱盐都能在水溶液中发生电离呢?哪些物质能发生电离呢?这节课,我们一起来解决这些问题。今天,我们学习新知识——离子反应。要学习离子反应的知识,我们首先要了解什么是电解质的问题。 〔讨论〕什么是电解质?什么是非电解质?一、酸、碱、盐在水溶液中的电离(一)电解质和非电解质 概念:电解质:凡是在水溶液中或熔融状态下能导电的化合物。 非电解质:凡是在水溶液中和熔融状态下都不能导电的化合物。分析:1.强调关键字。2.强调化合物,单质和混合物(溶液)既不是电解质也不是非电解质。讨论1:下列物质中哪些是电解质,那些是非电解质? 稀硫酸、氯化氢气体、氯化钠固体、氢氧化钠固体、碳酸钙、铜、石墨、氧化镁固体、甲烷、蔗糖、酒精、葡萄糖。小结:化合物: 1、电解质:(常见的电解质)酸、碱、盐和许多金属氧化物。 2、非电解质:(常见的非电解质)大多数非金属氧化物;大多数有机物,如蔗糖、酒精等。 讨论2:二氧化碳、氨气是否电解质?强调电解质必须自身电离而导电。 讨论3:BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质?
氧化性,还原性强弱的判断方法 (一)根据化学方程式判断 (1)氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物 氧化剂----还原产物 得电子,化合价降低,被还原,发生还原反应 还原剂---氧化产物 失电子,化合价升高,被氧化,发生氧化反应 氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 (2)可根据同一个反应中的氧化剂,还原剂判断 氧化性:氧化剂>还原剂 还原性:还原剂>氧化剂 (二)根据物质活动性顺序比较 (1)对于金属还原剂来说,金属单质的还原性强弱一般与金属活动性顺序相一致,即越位于后面的金属,越不容易失电子,还原性越弱。 还原性:K>Ca>Na>Mg>Al>Mn>Zn>Cr>Fe>Ni>Sn>Pb>(H)>Cu>Ag>Pt>Au (2)金属阳离子氧化性的顺序 K+
药物分析模拟题3 一、A型题(最佳选择题)每题的备选答案中只有一个最佳答案。 D1. 中国药典正确的表达为 A. Ch.P B.中国药典 C. C.P (2005) D. 中国药典(2005年版) E. 中华人民共和国药典 A2. 四氮唑比色法可用于哪个药物的含量测定 A. 氢化可的松乳膏 B. 甲基睾丸素片 C. 雌二醇凝胶 D. 黄体酮注射液 E. 炔诺酮片 E3. 以下哪种药物中检查对氨基酚 A. 盐酸普鲁卡因 B. 盐酸普鲁卡因胺 C. 阿司匹林 D. 对乙酰氨基酚 E. 对氨基水杨酸钠 E4. 药物中的亚硫酸氢钠对下列哪种含量测定方法有干扰 A. 非水溶液滴定法 B. 紫外分光光度法 C. 酸碱滴定法 D. 汞量法 E. 碘量法 B5. 有氧化产物存在时,吩噻嗪类药物的鉴别或含量测定方法可选择 A. 非水溶液滴定法 B. 紫外分光光度法 C. 荧光分光光度法 D. 钯离子比色法 E. 酸碱滴定法 C6. 在碱性溶液中被铁氰化钾氧化生成硫色素的药物是 A. 维生素A B. 维生素E C. 维生素B1 D. 维生素C E. 维生素D B7. 片剂含量均匀度检查中,含量均匀度符合规定是指 A. A+1.80S>15.0 B. A+1.80S≤15.0 C. A+S>15.0 D. A+1.80<15.0 E. A+1.80=15.0 C8. 检查硫酸阿托品中莨菪碱时,应采用 A. 色谱法 B. 红外分光法 C. 旋光度法 D. 显色法 E. 直接检查法 E9. 酸碱溶液滴定法测定乙酰水杨酸原料药含量时,所用的溶剂为:
A. 水 B. 氯仿 C. 乙醚 D. 无水乙醇 E. 中性乙醇 D10. 坂口反应用以鉴别哪种药物 A. 红霉素 B. 硫酸庆大霉素 C. 盐酸氯丙嗪 D. 硫酸链霉素 E. 青霉素钠 E11. 杂质限量是指 A. 杂质的最小量 B. 杂质的合适含量 C. 杂质的最低量 D. 杂质检查量 E. 杂质的最大允许量 D12. 中国药典(2005年版)采用以下哪种方法测定维生素E的含量? A. 酸碱滴定法 B. 氧化还原法 C. 紫外分光光度法 D. 气相色谱法 E. 非水滴定法 B13. 双相滴定法可适用的药物为 A. 阿司匹林 B. 对乙酰氨基酚 C. 水杨酸 D. 苯甲酸 E. 苯甲酸钠 B14. 硫喷妥钠与铜盐的鉴别反应生成物为 A. 紫色 B. 绿色 C. 蓝色 D. 黄色 E.紫茧色 B15. 精密度是指 A. 测得的测量值与真实值接近的程度 B. 测得的一组测量值彼此符合的程度 C. 表示该法测量的正确性 D. 在各种正常试验条件下,对同一样品分析所得结果的准确程度 E. 对供试物准确而专属的测定能力 C16. 在紫外分光光度法中,供试品溶液的浓度应使吸收度的范围在 A. 0.1-0.3 B. 0.3-0.5 C. 0.3-0.7 D. 0.5-0.9 E. 0.1-0.9 二、B型题(配伍选择题)备选答案在前面,试题在后。每组题均对应同一组备选答案,每题只有一个正确答案。每个备选答案可重复选用,也可不选用。问题1~5可用于检查的杂质为 A. 氯化物 B. 砷盐 C. 铁盐 D. 硫酸盐 E. 重金属 D1. 在酸性溶液中与氯化钡生成浑浊液的方法 C2. 在酸性溶液中与硫氰酸盐生成红色的方法 E3. 在实验条件下与硫代乙酰胺形成均匀混悬溶液的方法 E4. Ag-DDC法
人教版化学必修1《离子反应》教学设计人教版化学必修1《离子反应》教学设计 一、教材分析 “离子反应”是人教版化学必修1第一章《化学物质及其变化》第二节内容,是高中化学课程中的核心概念,是学生微粒观、变化观形成的重要载体。在《普通高中化学课程标准(20xx年版)》中,“主题2:常见的无机物及应用”对电离与离子反应的要求为:“认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。通过实验认识离子反应及其发生的条件,了解常见离子的检验。”具体内容包括电离、电解质、离子反应等关键概念和电离方程式书写、离子方程式书写、离子反应的发生条件、离子反应的本质等核心知识,也包括离子反应相关知识在解决实际问题中的应用。 在本章第一节“物质的分类及转化”中,学生已经初步认识到从微观角度认识物质更加深入,更接近事物的本质。而本节的内容更加深入系统地将宏观与微观结合起来,真正使学生从微粒的视角认识溶液和溶液中的反应,可让学生初步建立基于微粒及微粒间相互作用认识物质结构与变化的观
念和能力,提升“宏观辨识与微观探析”“变化观念”“证据推理与模型认知”等学科素养。同时,本节内容也将为后续化学反应原理部分研究微粒在水溶液中的行为打下坚实的基础。 《标准(20xx版)》还指出,学生应通过实验探究和联系实际的方式学习上述知识。因此,以学生的已有经验为背景,设计联系实际、以综合问题解决为核心任务的教学活动,有助于将上述不同素养进行整合培养,有助于教学目标的高效落实。 二、学情分析 离子反应的概念能够帮助学生从微观角度认识物质在水溶液中的反应实质,发展微粒观,使其从微粒的视角认识溶液和溶液中的反应;作为一种重要的反应类型,离子反应又能够发展学生对化学反应的分类视角和认识水平。在初中阶段学生已经学习过酸、碱、盐,并且能从宏观物质角度认识复分解反应。但其认识水平较低,缺乏微观意识,难从微观的角度去理解酸、碱、盐在溶液中的行为,因此学生需要建立一个新的认识视角,认识物质,认识反应,将原有的宏观、孤立、定性的认识角度提升至微观、联系、定量的层面。 因此分析学生的障碍点: 1.认识停留在宏观层面:未建立电离、电解质等概念,难以准确理解电解质在溶液中形成离子的过程,也难以用符号表达。只能从宏观物质的角度认识酸、碱、盐之间的反应。