
Synergy of electrochemical oxidation using boron-doped diamond (BDD)electrodes and ozone (O 3)in industrial wastewater treatment
M.A.García-Morales a ,G.Roa-Morales a ,?,Carlos Barrera-Díaz a ,Bryan Bilyeu b ,M.A.Rodrigo c
a Centro Conjunto de Investigación en Química Sustentable,UAEM-UNAM,Carretera Toluca-Atlacomulco,Km 14.5,Campus San Cayetano,C.P.50200,Toluca Estado de México,Mexico
b Department of Chemistry,Xavier University of Louisiana,New Orleans 70125,LA,USA
c
Department of Chemical Engineering,Facultad de Ciencias Químicas,Universidad de Castilla-La Mancha,Campus Universitario s/n 13071Ciudad Real,Spain
a b s t r a c t
a r t i c l e i n f o Article history:
Received 9October 2012
Received in revised form 22October 2012Accepted 23October 2012
Available online 27October 2012Keywords:
Electrooxidation Ozone BDD
Wastewater COD
O 3-BDD coupled process
This work evaluates the coupling of electrochemical oxidation and ozonation to reduce the high organic load of industrial wastewater quickly and effectively.Ozonation alone is shown to only reduce the COD of waste-water by about 45%.Electrochemical oxidation using boron-doped diamond electrodes reduces the COD by 99.9%,but requires over 2h per 0.7L batch.However,when the two processes are coupled,the COD is re-duced by 99.9%along with most color and turbidity in about an hour.The coupled process practically elimi-nates the COD,color,and turbidity without the addition of chemical reagents or changing the pH and doesn't generate any sludge,so it is both effective and environmentally friendly.
?2012Elsevier B.V.All rights reserved.
1.Introduction
Industrial ef ?uents are dif ?cult to treat using traditional biological systems due to the high variations in their compositions.Unlike munic-ipal wastewater,industrial sources have higher organic load,color,and pH which ?uctuate [1,2].While traditional biological reactors are very effective in digesting the organic matter in municipal wastewater into carbon dioxide and water,the effectiveness drops considerably when treating industrial wastewater.Biological reactors typically only reduce 50%of the biochemical oxygen demand (BOD 5)and 35%of the chemical oxygen demand (COD)[3,4].
Due to the limitations of biological reactors,industrial wastewater is typically pretreated using physical –chemical processes such as co-agulation –?occulation.However,these processes generate large quantities of sludge and usually require pH adjustments and chemical reagents,all of which create their own environmental issues [5,6].Co-agulation –?occulation is not ef ?cient in the removal of dissolved (persistent)chemical pollutants.
In recent works we have shown that combining electrocoagulation and ozone produces synergistic effects in wastewater treatment [7,8].However,the use of electrooxidation with boron-doped diamond (BDD)electrodes in conjunction with ozone for treating industrial ef ?u-ents has not yet been reported.
Both electrooxidation and ozonation are advanced oxidative pro-cesses based on the generation of hydroxyl radicals (OH ?),which have high oxidation potential and degrade of a wide range of contam-inants.In particular,BDD electrodes have high anodic stability,a wide working potential window,and low stable voltammetric background current in aqueous media [9,10].Therefore,the electrochemical be-havior of BDD electrodes have been investigated with the goal of de-veloping applications for wastewater treatment [11,12].On the other hand,ozonation is an ef ?cient and powerful oxidizing process well known for its degradation of organic compounds.The limitations to these processes are the time required for electrooxidation and the ef-fectiveness of ozonation,so neither alone is truly industrially practical.
Thus,this study evaluates the synergy of the two processes com-pared to the ef ?ciency and effectiveness of the individual ones.The effectiveness is evaluated in terms of color,turbidity and chemical ox-ygen demand (COD)reduction.The in ?uence of operating parame-ters such as time of treatment,current density,and initial pH is also evaluated.
2.Materials and methods 2.1.Wastewater samples
Wastewater samples were collected from the treatment plant of an industrial park,which receives the discharge of 144different facil-ities.Therefore,the chemical composition of this ef ?uent is rather
Electrochemistry Communications 27(2013)34–37
?Corresponding author.Tel.:+527222173890;fax:+527222175109.E-mail address:groam@uaemex.mx (G.
Roa-Morales).1388-2481/$–see front matter ?2012Elsevier B.V.All rights reserved.
https://www.doczj.com/doc/7c174696.html,/10.1016/j.elecom.2012.10.028
Contents lists available at SciVerse ScienceDirect
Electrochemistry Communications
j o ur n a l h o m e p a g e :w w w.e l s e v i e r.c o m /l o c a t e /e l e c o m
complex.Samples were collected in plastic containers and cooled down to4°C,then transported to the laboratory for analysis and treatment.The pH of the raw wastewater is8.24and all treatment and testing were done at this value.
2.2.Electrooxidation reactor
A batch cylindrical electrochemical reactor was set up for the elec-trochemical process.The reactor cell contains a pair of BDD electrodes (BDD?lm supported on a niobium substrate),each electrode was 20.0cm by2.5cm with a surface area of50cm2.Batch volumes of 0.70L were treated in the1.00L reactor.A direct-current power source supplied the system with0.5,1.0,and1.5A,corresponding to current densities of10,20,and30mA/cm2.
2.3.Ozonation reactor
The ozone experiments were conducted in a1.5L glass reactor at
18°C.Ozone was supplied by a Paci?c Ozone Technology generator. The gas was fed into the reactor through a porous plate situated at the reactor bottom.The ozone concentration at the gas inlet and out-let of the reactor was measured by redirecting the?ow to a series of ?asks containing0.1M potassium iodide.The mean concentration of ozone in the gas phase was5±0.5mg/L and was measured imme-diately before each run.Ozonation experiments were carried out at the pH of raw wastewater and samples were taken at regular inter-vals to determine COD.
2.4.Synergy of electrooxidation/O3process
For the combined system the pair of BDD electrodes from the electrooxidation reactor was installed in the ozone reactor.Ozone was introduced at the same rate and the BDD electrodes were given the same current densities as in the individual reactors.Treated sam-ples were taken at the same intervals and were analyzed in the same way.
2.5.Methods of analysis
The initial evaluations of the electrochemical,ozonation,and inte-grated treatments were determined by analysis of the COD(mg/L), color(Pt–Co scale),and turbidity(NTU scale).COD was determined by the open re?ux method according to the American Public Health Association(APHA).Following this method,samples are re?uxed with potassium dichromate and sulfuric acid for2h.Once the opti-mal conditions were found the raw and treated wastewater samples were analyzed using the standard methods for the examination of water and wastewater procedures.[13].
3.Results and discussion
3.1.Electrooxidation treatment
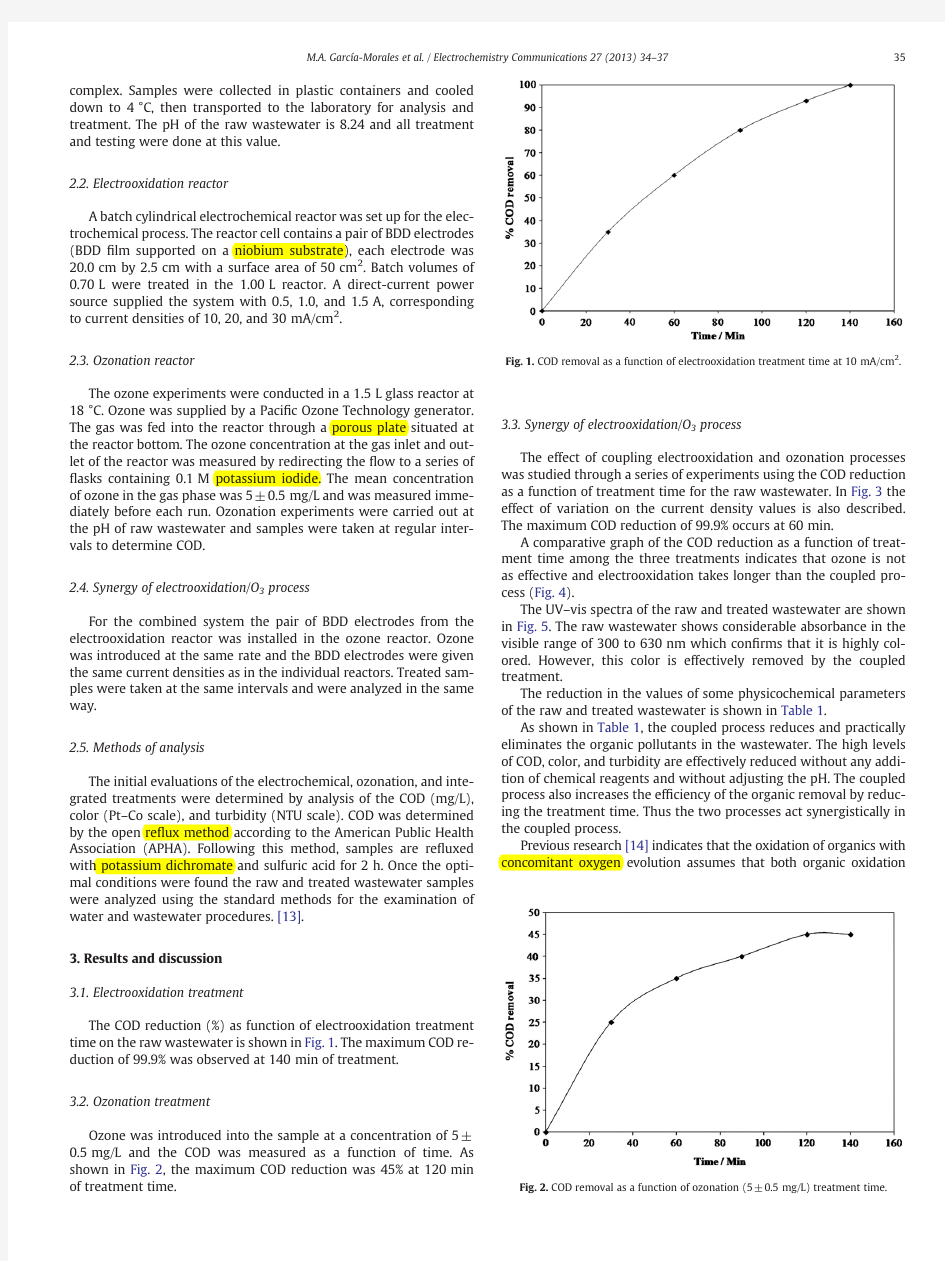
The COD reduction(%)as function of electrooxidation treatment time on the raw wastewater is shown in Fig.1.The maximum COD re-duction of99.9%was observed at140min of treatment.
3.2.Ozonation treatment
Ozone was introduced into the sample at a concentration of5±0.5mg/L and the COD was measured as a function of time.As shown in Fig.2,the maximum COD reduction was45%at120min of treatment time.3.3.Synergy of electrooxidation/O3process
The effect of coupling electrooxidation and ozonation processes was studied through a series of experiments using the COD reduction as a function of treatment time for the raw wastewater.In Fig.3the effect of variation on the current density values is also described. The maximum COD reduction of99.9%occurs at60min.
A comparative graph of the COD reduction as a function of treat-ment time among the three treatments indicates that ozone is not as effective and electrooxidation takes longer than the coupled pro-cess(Fig.4).
The UV–vis spectra of the raw and treated wastewater are shown in Fig.5.The raw wastewater shows considerable absorbance in the visible range of300to630nm which con?rms that it is highly col-ored.However,this color is effectively removed by the coupled treatment.
The reduction in the values of some physicochemical parameters of the raw and treated wastewater is shown in Table1.
As shown in Table1,the coupled process reduces and practically eliminates the organic pollutants in the wastewater.The high levels of COD,color,and turbidity are effectively reduced without any addi-tion of chemical reagents and without adjusting the pH.The coupled process also increases the ef?ciency of the organic removal by reduc-ing the treatment time.Thus the two processes act synergistically in the coupled process.
Previous research[14]indicates that the oxidation of organics with concomitant oxygen evolution assumes that both organic
oxidation Fig.1.COD removal as a function of electrooxidation treatment time at10mA/cm2
.
Fig.2.COD removal as a function of ozonation(5±0.5mg/L)treatment time.
35
M.A.García-Morales et al./Electrochemistry Communications27(2013)34–37
and oxygen evolution take place on a BDD anode surface via intermedi-ation of hydroxyl radicals,generated from the reaction with water shown in Eqs.(1)and (2):BDD tH 2O →BDD eOH ?
TtH t
te
?
e1TBDD eOH ?
TtR →BDD tmCO 2tnH 2O :
e2T
Reaction (2)is in competition with the side reaction of hydroxyl radical conversion to O 2without any participation of the anode sur-face as indicated in Eq.(3)
BDD eOH ?
T→BDD t1=2O 2tH t
te ?
:
e3T
The ozone contribution can be attributed to the electrophilic na-ture of the direct attack by O 3molecules (Eq.(5))and the indirect at-tack via OH ?radicals in the ozonation process (Eq.(6)).
According to Tomiyasu et al.[15]the ozonation effect may be ini-tiated by the following reactions:O 3tH 2O →2HO ?
tO 2
e4T
O 3tOH →O ?2?tHO ?
2
e5T
O 3tOH ?
→HO ?
2tO 2:
e6T
According to the literature,the pH value of the solution signi ?-cantly in ?uences ozone decomposition in water since basic pH causes an increase of ozone decomposition.At pH b 3hydroxyl radicals do not in ?uence the decomposition of ozone.For 7b pH b 10,the typical half-life of ozone is 15to 25min.[16].
4.Conclusions
The combination of electrooxidation and ozonation processes re-sults in a synergy that greatly enhances the rate and extent of remov-al of COD,color,and turbidity from a chemically complex industrial ef ?uent.Electroxodiation alone reduces the COD to less than 1%of the initial,but requires a relatively long time of 140min.On the other hand,ozonation alone only reduces it to 45%.When the coupled electrooxidation –ozonation process is used a maximum 99.9%of COD is removed in only 60min under the optimal conditions:pH 8.24,with 5±0.5mg/L of ozone concentration,and 30mA/cm 2of current density.While electrooxidation ef ?ciency usually increases with in-creasing current density,the coupled process is more ef ?cient at a rel-atively low (mA/cm 2)current density.
Acknowledgments
The authors wish to acknowledge the support given by the Centro Conjunto de Investigación en Química Sustentable,UAEM-UNAM,and ?nancial support from the CONACYT through the projects 168305and 153828is greatly
appreciated.
Fig.3.COD removal when coupling electrooxidation and ozonation processes at three different current densities (▲)30mA/cm 2(○)20mA/cm 2(?)10mA/cm 2
.
Fig.4.COD removal as a function of treatment time of (?)coupled,(Δ)electrooxidation and (■)ozone
treatment.
Fig.5.UV –vis spectra of the (——)raw and (----)treated industrial wastewater.The parameters of the coupled treatment were 30mA/cm 2and 5±0.5mg/L of ozone.
Table 1
Physicochemical parameters of the raw and treated industrial wastewater.Parameter Raw wastewater Treated wastewater COD/mg L ?1
534b 1Color/Pt –Co units 880b 50Turbidity/NTU
52
b 5
36M.A.García-Morales et al./Electrochemistry Communications 27(2013)34–37
References
[1] C.A.Martinez,E.Brillas,Applied Catalysis B:Environmental87(2009)105.
[2] C.Barrera-Díaz,F.Ure?a-Nu?ez,E.Campos,M.Palomar-Pardavé,M.Romero-Romo,
Radiation Physics and Chemistry67(2003)657.
[3]V.Agridiotis,C.Forster,C.Balaboine,C.Wolter,C.Carliell-Marquet,Water Envi-
ronment Journal20(2006)141.
[4] C.J.Van der Gast,B.Jefferson,E.Reid,T.Robinson,M.J.Bailey,S.J.Judd,I.P.
Thompson,Environmental Microbiology8(6)(2006)1048.
[5] F.Hana?,O.Assobhei,M.Mountadar,Journal of Hazardous Materials174(2010)
807.
[6] C.Barrera-Díaz,I.Linares-Hernández,G.Roa-Morales,B.Bilyeu,P.Balderas-
Hernández,Industrial and Engineering Chemistry Research48(2009)1253. [7]L.A.Bernal-Martinez, C.Barrera-Díaz, C.Sólis-Morelos,R.Natividad-Rangel,
Chemical Engineering Journal165(2010)71.
[8]M.A.García-Morales,G.Roa-Morales,C.Barrera-Díaz,P.Balderas-Hernández,
Journal of Environmental Science and Health,Part A47(2012)22.
[9]J.Sun,H.Lu,L.Du,H.Lin,H.Li,Applied Surface Science257(2011)6667.
[10] F.L.Migliorini,N.A.Braga,S.A.Alves,https://www.doczj.com/doc/7c174696.html,nza,M.R.Baldan,N.G.Ferreira,Journal
of Hazardous Materials192(2011)1683.
[11]M.Panizza,P.A.Michaud,G.Cerisola,https://www.doczj.com/doc/7c174696.html,ninellis,Electrochemistry Communi-
cations3(2001)336.
[12] A.Morao,A.Lopes,M.T.Pessoa de Amorim,I.C.Goncalves,Electrochimica Acta49
(2004)1587.
[13]APHA,AWWA,Standard Methods for the Examination of Water and Wastewater,
16th edition American Public Health Association,Washington DC,1995.
[14] A.Kapalka,G.Fóti,https://www.doczj.com/doc/7c174696.html,ninellis,Electrochimica Acta53(2007)1954.
[15]H.Tomiyasu,H.Fukutomi,G.Gordon,Inorganic Chemistry24(1985)2962.
[16] B.Kasprzyk,M.Ziolek,J.Nawrocki,Applied Catalysis B:Environmental46(2003)
639.
37
M.A.García-Morales et al./Electrochemistry Communications27(2013)34–37
臭氧层小知识(一) 众所周知,太阳辐射的紫外线对生物有很强的杀伤力。幸运的是,距地球表面 25 —50 公里处有一臭氧层。臭氧是地球大气层中的一种微量气体,它是由三个氧原子(O3)结合在一起的蓝色、有刺激性的气体。尽管臭氧层在地球表面并不太厚,若在气温0℃ 时,将地表大气中的臭氧全部压缩到一个标准大气压时,臭氧层的总厚度才不过 3 毫米左右,但它却能吸收太阳辐射出的 99% 的紫外线。就像地球的一道天然保护屏障,使地球上的万物免遭紫外线的伤害。因此,臭氧层也被誉为是地球的“保护伞”。1985 年,英国科学家法尔曼等人在南极哈雷湾观测站发现:在过去 10 —15 年间、每到春天南极上空的臭氧浓度就会减少约 30%,有近 95% 的臭氧被破坏。从地面上观测,高空的臭氧层已极其稀薄,与周围相比像是形成一个“洞”,直径达上千公里,“臭氧洞”由此而得名。卫星观测表明,此洞覆盖面积有时比美国的国土面积还要大。到 1998 年臭氧空洞面积比 1997 年增大约 15%,几乎相当于三个澳大利亚大。前不久,日本环境厅发表的一项报告称,1998 年南极上空臭氧空洞面积已达到历史最高记录,为 2720 万平方公里,比南极大陆还大约 1 倍。美、日、英、俄等国家联合观测发现,近年来,北极上空臭氧层也减少了 20%。在被称为是世界上“第三极”的青藏高原,中国大气物理及气象学者的观测也发现,青藏高原上空的臭氧正在以每 10 年 2.7% 的速度减少。根据全球总臭氧观测的结果表明,除赤道外,1978 — 1991 年总臭氧每 10 年间就减少 1% — 5%。自 30 年代以来,氟氯碳被广泛用作冰箱、冷冻机。空调等设备的制冷剂,聚氨醋泡沫和聚乙烯/聚苯乙烯泡沫中的发泡剂,气雾剂制品中的推进剂,电子线路板、精密金属零部件等的清洗剂及烟丝的膨胀剂等。哈龙则主要用作灭火器中的灭火剂。上述化学物质非常稳定,排到大气中可存留数一年,甚至 100 年左右,因此最终会破坏臭氧层。关闭窗口 臭氧层小知识(二) 大气平流层中距地面 20-40 公里的范围内有一圈特殊的大气层,这一层大气中臭氧含量特别高。大气平均臭氧含量大约是 0.3ppm,而这里的臭氧含量接近 10ppm,高空大气层中 90% 的臭氧集中在这里,所以叫它臭氧层。臭氧层在保护地球方面具有特别的功能:对于太阳光中与生物无害的可见光和 A 段紫外线,将它们大部分吸收,小部分放行,让它们到达地面杀菌消毒,又不至于对人体健康造成危害。所以说臭氧层是保护地球的无缝天衣。空调、电冰箱用的制冷剂氯氟烃其商品名叫氟里昂。氯氟烃在低层大气中稳定,游荡 10 年左右的时间进入同温层,直至穿出臭氧层。穿出臭氧层后,在强烈紫外线的作用下,氯氟烃迅速分解,产生氯原子,氯原子极为活泼,专门拆散臭氧分子,使臭氧层逐渐变薄,出现空洞。人类已经把 1500 万吨以上的氯氟烃排放到大气中。进入大气中的氯氟烃,只有一部分参与臭氧层破坏作用,大部分还在大气中游荡,因而,虽然现在很多地方已停止生产和使用氯氟烃,臭氧层仍然会继续遭到破坏。何况,除了氯氟烃外,工业废气、汽车和飞机的尾气、核爆炸产物、氨肥的分解物,其中可能含有氮氧化物、一氧化碳、甲烷等几十种化学物质,都是破坏臭氧层的因素。
臭氧是怎么产生的? 臭氧(ozone,O3) 常温下为无色气体,有一股特殊的草腥味,有极强的氧化能力,稳定性极差,常温下可自行分解为氧,通常以稀薄的状态混合于大气中。 由于臭氧是一种不稳定的气体,不能储存运输,因而臭氧必须在使用现场发生制备. 臭氧的制取主要有:电化学法、光化学法及电晕放电法。 【电化学法】 电化学法是利用直流电源电解含氧电解质(纯净水)产生臭氧的方法。这种发生器能制取高浓度的臭氧水,制造成本低,使用和维修简单。但由于有臭氧产量无法做大、电极使用寿命短、臭氧不容易收集等方面的缺点,其用途范围受到限制。 目前这种发生器只是在一些特定的小型设备上或某些特定场所内使用,不具备取代高压放电式发生器的条件。但在医疗、食品加工、养殖业及家庭应用等方面具有广泛前景。 【光化学法】 光化学法实质是仿效大气层上空紫外线促使氧分子分解并聚合成臭氧的方法,即用人工产生的紫外线促使氧分子分解并聚合成臭氧的方法。此种方法产生出波长λ185nm(10-9m)的紫外光谱,这种光最容易被O2吸收而达到产生臭氧的效果,在美国称之为臭氧灯。 此种方法产生臭氧的优点是对温度、湿度不敏感,具有很好的重复性;同时,可以通过灯功率线型控制臭氧浓度、产量。这些特点对于臭氧用于人体治疗及作为仪器的臭氧标准原是非常合适的。缺点是能耗较高、产量低,不适合大规模使用。 【电晕放电法】(目前普高采用的臭氧发生技术,展坤建议使用方式) 电晕放电法是模仿自然界雷电产生臭氧的方法,通过人为的交变高压电场在气体中产生电晕,电晕中的自由高能离子离解O2分子,经碰撞聚和为O3分子。 这种臭氧发生器具有技术成熟、工作稳定、使用寿命长、臭氧产量大(单机可达1Kg/h)等优点,所以是国内外相关行业使用最广泛的臭氧发生器。世界上现在单机产量最高的达300Kg/h。衣物三期三刘玲三益另留
臭氧知识 臭氧(O?)又称为超氧,是氧气(O?)的同素异形体,在常温下,它是一种有特殊臭味的淡蓝色气体。臭氧主要分布在10~50km 高度的平流层大气中,极大值在20~30km高度之间。 1840年德国C.F.舍拜恩在电解稀硫酸时,发现有一种特殊臭味的气体释出,因此将它命名为臭氧。在常温常压下,稳定性较差,可自行分解为氧气。臭氧具有青草的味道,吸入少量对人体有益,吸入过量对人体健康有一定危害。不可燃,纯净物。氧气通过电击可变为臭氧。 臭氧可用于净化空气,漂白饮用水,杀菌,处理工业废物和作为漂白剂。 基本信息 ?中文名称臭氧, 英文名ozone ,化学式O?,熔点-192℃ ?沸点-111℃ ,水溶性, 1体积水溶解0.494体积臭氧, ?密度2.14g/L(0°C,0.1MP),外观常温下蓝色气体,应用用于医学、农业、餐饮业、杀菌等. ?工作场所安全限值0.15ppm 一、基本概述
3个氧原子。大气中90%以上的臭氧存在于大气层的上部或平流层,离地面有10~50千米,能对阻挡紫外线,对人类有保护作用。 二、发现过程 英文臭氧(Ozone)一词源自希腊语ozon,意为“嗅”。 1840年德国C.F.舍拜恩在电解稀硫酸时,发现有一种特殊臭味的气体释出,因此将它命名为臭氧。当大气层中的氧气发生光化学作用时,便产生了臭氧,因此,在离地面垂直高度15~25千米处形成臭氧层,它的浓度为0.2ppm。臭氧的气体明显地呈蓝色,液态呈暗蓝色,固态呈蓝黑色。它的分子结构呈三角形。臭氧不稳定,在常温下慢慢分解,200℃时迅速分解,它比氧的氧化性更强,能将金属银氧化为过氧化银,将硫化铅氧化为硫酸铅,它还能氧化有机化合物,如靛蓝遇臭氧会脱色。臭氧在水中的溶解度较氧大,0℃,一标准大气压时,一体积水可溶解0.494体积臭氧。臭氧能刺激粘液膜,它对人体有毒,长时间在含0.1ppm臭氧的空气中呼吸是不安全的。臭氧层能吸收大部分波长短的射线(如紫外线),起着保护人类和其他生物的作用。 臭氧可用于净化空气,漂白饮用水,杀菌,处理工业废物和作为漂白剂。
臭 氧 知 识 综 述 作者:张学志2005年10月10日
一.臭氧知识 (3) 1.什么是臭氧 (3) 2.臭氧基础知识 (3) 臭氧的制备 (4) 3.臭氧的性质 (5) 臭氧的物理性质 (10) 臭氧的化学性质 (11) 4.臭氧的用途 (12) 臭氧的应用 (12) 臭氧与其它消毒技术的比较 (13) 二.臭氧制造技术 (14) 1.光化学法–紫外线臭氧发生器 (14) 2.电化学法–电解纯水臭氧发生器 (15) 3.电晕放电法–臭氧发生器 (15) 三.臭氧投加装置 (17) 1.塔式鼓泡反应器 (17) 2.池式鼓泡反应器 (21) 3.尼可尼混合泵 (31) 四.臭氧分解装置 (32) 1.基本情况 (32) 2.各种分解方法 (32) 五.臭氧检测 (38) 1.检测的必要性 (38) 2.检测方法 (39) 六.臭氧系统 (43) 1.标准臭氧系统 (43) 2.气源处理系统 (43) 3.冷却系统 (44) 4.电源系统 (44) 5.合成系统 (45) 七.臭氧应用 (47) 1.自来水应用 (47) 2.净水处理 (51) 3.游泳池臭氧应用 (53) 4.空间消毒 (55) 5.工业氧化 (56) 八.名词解释 (58)
一.臭氧知识 1.什么是臭氧 人类发现臭氧已经有一百年的历史。在距离地球表面15-25公里的高空,因受太阳紫外线照射的缘故,形成了包围在地球外围空间的臭氧层,这厚厚的臭氧层正是人类赖以生存的保护伞。这就是大多数人对臭氧的全部认识。 1840年德国科学家舒贝因发现,他在电解和火花放电试验过程中曾闻到有一种特殊的气味,同时,他还指出在闪电过后也闻到同样的气味。舒贝因将此异味确定为O3,命名为OZONE(臭氧),取自希腊语“Ozein”一词,意为“难闻”。 臭氧,又名三原子氧,因其类似鱼腥味的臭味而得名。其分子式为O3 ,是氧气的同素异形体,具有它自身的独特性质: 1.在自然条件下,它是淡蓝色的气体; 2.它有一种类似雷电后的腥臭味; 3.在标准压力和常温下,它在水中的溶解度是氧气的13倍; 4.臭氧比空气重,是空气的1.658倍; 5.臭氧有很强的氧化力,是已知最强的氧化剂之一; 6.正常情况下,臭氧极不稳定,容易分解成氧气; 7.臭氧分子是逆磁性的,易结合一个电子成为负离子分子; 8.臭氧在空气中的半衰期一般为20-50分钟,随温度与湿度的增高而加快; 9.臭氧在水中半衰期约为35分钟随水质与水温的不同而异; 10.臭氧在冰中极为稳定,其半衰期为2000年。 2.臭氧基础知识 概述 : 臭氧的称谓同它的独特气味最早记载于荷马( Homer) 的长诗 " 伊里亚德和奥德赛”( Iliad and Odyssey) 里,他注意了伴随雷电产生的这种气味,并把他的印象写了进去。因此在圣经第12 章奥德赛第 417 节里,有丘比特( Jupiter) 用雷电击船,船内“完全充满了硫黄臭味”。 1785 年德国物理学家冯·马鲁姆( Van Marum) 用他的大功率电机进行试验时发现,当空气流过一串电火花时,就产生一种特殊的气味。克鲁伊克仙克( Cruikshank)1801 年观察到水电解过程中在阳极产生同样气味的气体。 1840 年荷兰的科学家舒贝因( Schonbein) 向慕尼黑科学院提交的一份备忘录中宣告了臭氧的发现,他在电解和火花放电试验过程中曾闻到一种独特的气味,他还指出,在闪电过后亦可闻到同样的气味。舒贝因断定这是一种新物质产生的气味,他把它命名为“Ozone”( 臭氧 ) ,取自希腊字“Ozein”一词,意为“难闻”。 1845 年,德·拉·里韦( De La Rive) 和马里亚斯( Marignac) 通过用纯氧电火花作用获得了臭氧。 1848 年亨特( Hunt) 根据当时所了解的臭氧的性质得出他的判断,预言臭氧为三个原子氧。1860 年安德鲁( Andrew) 和泰特( Tait) 发现氧气在转化为臭氧的过程中体积减少。然而当臭氧转化为氧气时恢复到原有的体积,同时还发现少量的汞或金属银具有分解臭氧的能力。 1866 年索雷特( Soret) 利用通过电解得到臭氧和氧的混合气体进行试验,断定臭氧的密度是氧的 1.5 倍。为验证此结论,索雷特测定了臭氧向空气中扩散的速率,并将其与同一方法测定得的二氧化碳扩散速率相比。估算出臭氧与二氧化碳的密度比,发现它存在着与 CO2: O3 = 44:48 完全一致的关系。 1857 年,冯·西门斯( Von Siemens) 研制出了臭氧发生管,臭氧技术有了很大进步。这种类型的臭氧发生器,成为当时大量应用的放电臭氧发生器的原型。西门斯第一台臭氧发生器基本上是由两根玻璃管构成的,外管外壁和内管内壁均用锡箔覆盖,空气原料气流从环状空间通过。内管内壁和外管外壁的金属表面联结到电感线圈或电机接线柱上。用这种装置,干燥氧气的 3 %~ 8 %可能转化为臭氧。布罗迪( Brodie) 和伯塞乐( Bertholet) 采用此种设备的改型,他们都用电解液取代金属电极给臭氧发生过程起到一定的冷却作用。
图片简介: 本技术提供了一种硼掺杂类金刚石薄膜电极的制备方法。该方法选用硼作为掺杂元素,将线性离子源沉积技术与磁控溅射沉积技术相结合,以硼靶为溅射靶,再通入含碳气源,利用线性离子源沉积碳膜的同时溅射沉积硼元素,得到硼掺杂类金刚石薄膜,然后连接导线,得到硼掺杂类金刚石薄膜电极。与现有技术相比,该方法绿色环保,工艺简单,成本低,制得的电极具有良好的电化学性能,因此具有良好的应用前景。 技术要求 1.一种硼掺杂类金刚石薄膜电极的制备方法,其特征是:采用线性离子源 沉积技术与磁控溅射沉积技术相结合的方法制备,具体制备过程如下: 步骤1、将基体清洗后进行表面刻蚀处理; 步骤2、设定线性离子源电流为0.1A~0.3A,通入含碳气源;溅射靶为硼靶, 调整溅射靶的工作电流为0.2A~1.5A,通入氩气进行溅射;设定基片偏压为 -50V~-250V;打开线性离子源、溅射靶电源和偏压,在基体前表面进行薄膜沉 积,得到硼掺杂类金刚石薄膜; 步骤3:将步骤2处理后的基体与导线连接,然后将其四周和背表面用环氧 树脂包覆,未包覆的薄膜作为电极表面,得到硼掺杂类金刚石薄膜电极。
2.根据权利要求1所述的硼掺杂类金刚石薄膜电极的制备方法,其特征是: 所述的步骤1中,基体为导体。 3.根据权利要求1所述的硼掺杂类金刚石薄膜电极的制备方法,其特征是: 所述的步骤1中,基体的表面刻蚀为离子刻蚀,具体过程为:将基体放入腔体,对腔体抽真空处理,然后通入惰性气体,打开线性离子源和偏压,利用惰性气体离子束对基体进行刻蚀。 4.根据权利要求3所述的硼掺杂类金刚石薄膜电极的制备方法,其特征是: 所述的步骤1中,基片偏压为-50V~-200V,线性离子源电流0.1A~0.3A,刻蚀时间为5min-40min。 5.根据权利要求1所述的硼掺杂类金刚石薄膜电极的制备方法,其特征是: 所述的步骤2中,含碳气源包括甲烷与乙炔。 6.根据权利要求1所述的硼掺杂类金刚石薄膜电极的制备方法,其特征是: 所述的步骤2中,基体偏压为-100V,线性离子源电流为0.2A,沉积时间20~30 min。 7.根据权利要求1所述的硼掺杂类金刚石薄膜电极的制备方法,其特征是: 所述的步骤3中,首先在硼掺杂类金刚石薄膜表面镀金属微电极,然后在该金属微电极表面连接导线。 8.根据权利要求1所述的硼掺杂类金刚石薄膜电极的制备方法,其特征是: 所述的步骤3中,导线连接在基体背表面。 说明书 一种硼掺杂类金刚石薄膜电极的制备方法 技术领域 本技术涉及类金刚石薄膜电极技术领域,具体涉及一种硼掺杂类金刚石薄膜 电极的制备方法
臭氧相关知识 一、臭氧的性质 臭氧(O3)是一种具有刺激性特殊气味的不稳定气体, 是氧气(O2)的同素异形体。它可在地球同温层内光化学 合成,但是在地平面上仅以极低浓度存在。其在常态下为 蓝色气体,但通常情况下,由于其浓度很低,稳定性较差, 可自行分解为氧气而颜色并不明显。臭氧具有青草的味 道,吸入少量对人体有益,吸入过量对人体健康有一定危 害,其在自然钟存在主要为雷雨天下时,大气层中的氧气 受到电击的高能催化或辐射而转化。由于臭氧反应活性极 强,极易分解,很不稳定,在常温下会逐渐分解为氧气, 其性质比氧活泼,比重为一般空气之倍。会因光、热、水分、金属、金属氧化物以及其他的触媒而加速分解为氧。 二、臭氧的作用 臭氧得氧化能力极强,其氧化还原电位仅次于F2,在常温下即可将各类金属氧化,使多种有机色素褪色,对橡胶和纤维破坏性很大,很容易氧化有机不饱和化合物。 同时对于空气和水体中的细菌病毒等微生物也有非常显著的杀灭效果,能够能对各类细菌、微生物的细胞体直接氧化,即破坏细菌的DNA、病毒的RNA等遗传物质,使细菌的新陈代谢受到破坏;氧化分解细菌内部葡萄糖所需的酶,使其灭活死亡;透过细胞膜组织,侵入细胞内,作用于外膜的脂蛋白和内部的脂多糖,使细菌发生通透性畸变而溶解死亡。 ¥ 还能够对各种毒性物质具有一定的氧化作用,降低其毒性。 由于其作为气体,同时分解较快,因而具有杀菌彻底,无残留和死角,脱色快速,去味无污染的环保绿色效果。 传统消毒、氧化方法的特点与臭氧的对比 紫外线无残留和污染、投资少,广泛被食品和饮料等行业所采用。 但杀菌能力较弱,无穿透能力,易被阻隔,灯管寿命短,更换过于频繁,运行费用较高。 试剂有高锰酸钾、甲醛、次氯酸钠等。其运输、存储不便,易变性或对人体和其他物质产生危害。
家用臭氧机知识问答 问:臭氧是什么? 答:臭氧是由三个氧原子所构成,是天然的强力氧化剂、杀菌剂。臭氧在臭氧层吸收太阳光的有害紫外线,保护地表的生物。臭氧工业所制造的高纯度臭氧,则是取代氯消毒,广泛应用于自来水处理、包装水、医药/食品制程用水、表面杀菌、管线内杀菌,游泳池、冷却水塔、养殖循环水净化、专业空气净化。或是氧化难生物分解有机物、废气氧化处理、化妆品级高岭土漂白、纸浆漂白、清洗衣物等领域。在2001年6月美国FDA 正式核准臭氧可以和食品接触作生物抑制剂,臭氧在食品工业的用途更加广阔。不好的臭氧:在都会地区,大量汽车排放的氮氧化物,经过阳光中的紫外线照射产生的臭氧是骯脏有害的臭氧。这种混杂于光化学烟雾内的臭氧,并不受控制,而且对人体的呼吸道有强的刺激性,与臭氧工业使用的高纯度臭氧绝然不同。 问:臭氧的使用简要历史 答:1840 年,臭氧被发现,且因其独特气味而命名。 1906 年,法国尼斯市是设立全球第一座臭氧净水厂。 1937 年,美国出现第一座使用臭氧处理的商业游泳池。 1940 年,美国印第安纳州首度使用臭氧净水处理。 1975 年,全美超过1000 臭氧除臭装置被安装在污水处理场。 1982 年,瓶装水开始使用臭氧杀菌。 1984 年,所有奥运的竞赛泳池全部以臭氧处理。 1989 年,美国环保署颁布地表水处理法规(The Surface Water Treatment Rules) 纳入臭氧杀菌CT值规范。 2000 年,全美约有300座自来水厂使用臭氧辅助处理水质。 2001 年,美国FDA正式核准臭氧可以和食品接触,作为微生物抑制剂。 问:臭氧是都会区烟雾污染的凶手吗? 答:臭氧是净化者,并非污染者。臭氧是由三个氧原子构成,别无杂物。人类及动物不能在没有臭氧及氧气情况下存活,位于地表15~40公里平流层内的臭氧层具有吸收来自太阳的有害紫外线,保护地表的生物。许多大都会区经常错误报导臭氧浓度高达3~5ppm。 科学家已证实在污染空气中最高的臭氧浓度仅有1.0ppm,通常不会超过0.3ppm。所以将臭氧浓度报导成与来自汽车废气产生的氮氧化物(光化学烟雾)具有相同的浓度是错误的。 问:如何制造臭氧? 答:将空气或其它含有氧气的气体暴露于高能量环境,如高压电场、UV 辐射,氧分子就会分裂成两个高能氧原子,氧原子再和氧分子碰撞,结果产生臭氧。典型的高电压放电,也就是电晕放电(corona discharge),它所产生出的臭氧浓度比UV 辐射高数倍以上。因为臭氧性质非常活泼,会衰减成氧气,故它必须在现场制造及使用,市面上也买不到臭氧气体钢瓶。 问:使用臭氧安全吗? 答:1997年水品质协会(WQA)出版一本“Ozone for Point-of-Use, Point-of-Entry and Small Water System Water Treatment Applications:A Reference Manual”记载,人类使用臭氧的100 年来,并没有因为臭氧造成的永久性伤害及死亡的案例报导,但是使用臭氧作为空气净化剂,还是需要谨慎处理。职业安全与健康管理处(OSHA),食品及药物管制局(the FDA),环保署(the EPA)对于臭氧的暴露剂量,已建立安全值的规范,应随时注意。 在旅馆客房使用臭氧作为除臭剂,是一个很大的市场,然而产品的使用说明书内,应说明使用臭氧机时,必须没有人或动物在场。 水及废水处理系统应用臭氧时,也可能会产生臭氧尾气排放的问题,至必须在设计时就予以考量。 有关臭氧在空气中的安全浓度如下: FDA规范室内医疗设备臭氧输出浓度不得高于0.05 ppm。 OSHA规定劳工在作业场所8小时所暴露的平均臭氧浓度不可高于0.10 ppm。 NIOSH建议臭氧的浓度在任何时候都不应超过0.10 ppm。 环保署(EPA)的周界空气品质国家标准规定户外臭氧8小时的平均浓度最大为0.08 ppm。 问:臭氧比氯及其它化学药剂的优点在哪里? 答:这要看您是将臭氧用在何处。大致上的优点如下: 1. 臭氧可以杀死的微生物总模拟氯还要多。(特别是抗氯力强的梨型虫胞囊,只有使用臭氧才能杀死) 2. 杀菌速率比氯快,因而可以降低接触时间,减少反应槽体积,增大处理量。 3. 臭氧在完成氧化、消毒后,臭氧会自行还原成氧气。而氯仍会残留于水中,需要后续处理才能消除它。 4. 臭氧不会产生有致癌风险的消毒副产物。而氯消毒会产生氯胺类、三卤甲烷类的消毒副产物。而法规对于自来水、废水的消毒 副产物管制将越趋严格,臭氧将会取代大部分的氯。 5. 臭氧无法储存,必须现场制造立刻使用。因此不像氯气有发生运输泄漏的风险,也没有储存问题。 6. 臭氧机只要买一次,就可以持续制造臭氧。而加氯系统,则需要持续购买氯。 问:可以使用臭氧水来清洗食物及流理台吗? 答:2001年6月美国食品及药物管理局(FDA) 同意食品工业应用臭氧与食物直接接触以及作为生物抑制剂,同时臭氧水已经证实可以控制食物以及与食物接触的表面上的微生物密度。 使用臭氧水清洗流理台、切菜板、刀具、碗盘的好处有:降低细菌数量(包括致病性的沙门氏菌属Salmonella、李斯特氏菌Listeria、大肠杆菌E.coli、志贺氏菌属Shigella),这样可以减少食物的交互污染,使食物更安全。 降低细菌的另一个好处是:降低引起食物腐败的细菌。换句话说,容易腐败的食物(新鲜水果与蔬菜)以臭氧水清洗可以降低引起腐败的微生物数量,使得食物可以保存更久。 问:家居使用臭氧有什么好处? 答:这要看您将臭氧用于何处。臭氧对于室内空气的净化有显著的功效。 1. 臭氧经经被证实可以氧化霉菌、酵母菌、真菌。 2. 臭氧可以有效的消除雪茄、香烟的烟臭味。 3. 臭氧甚至可以氧化由地毯、油漆、家俱释出的污染物。
什么是臭氧?臭氧有哪些作用?什么是臭氧水?臭氧水的作用是什么?臭氧有哪些应用?臭 氧是污染元凶吗?臭氧对人体和环境有何影响?臭氧处理的牛肉为何口感酥烂?如果您想了解,就请仔细阅读下面的文章...... [医用臭氧造福人类带来美好生活] 1.何谓臭氧:臭氧又称富氧、三氧、超氧、活性氧。雷电过后,有时人们可以闻到它的气味。 臭氧在常温下可以自行还原为氧气。 2.臭氧有何作用: 臭氧是已知可利用的最强的氧化剂之一,在实际使用中,臭氧呈现出突出 的杀菌、消毒、降解农药的作用,是一种高效广谱杀菌剂。臭氧可使细菌、真菌等菌体的蛋 白质外壳氧化变性,可杀灭细菌繁殖体和牙胞、病毒、真菌等。常见的大肠杆菌、粪链球菌、金黄色葡萄球菌等,杀灭率在 99% 以上。臭氧还可以杀灭肝炎病毒、感冒病毒等,臭氧在 室内空气中弭漫快而均匀,消毒无死角。臭氧能杀死病毒细菌,而健康的细胞具有强大的平 衡系统,因而臭氧对健康细胞无害。臭氧可对空气进行杀菌、净化,预防疾病交叉感染,清 除卧室、客厅、厨房、卫生间等处的异味。臭氧气体对室内的被褥、衣物、地毯、衣柜、鞋柜、钱币等具有杀菌、消毒、防霉、除尘的功效。我国有些地区阳光日照时间少,湿度大, 空气污染较严重,更能显示出它的特殊作用。 3.何谓臭氧水 :臭氧最适宜的方式是将臭氧溶解于水中,形成所谓“臭氧水”。欧美一些发达国 家将“臭氧水”称为“万能水”。它的杀菌速度比氯快许多倍。 4.臭氧水有何作用 :臭氧水可对妇女、儿童使用的内衣、内裤、尿布、包被等进行杀菌消毒处理,能起到特别明显的保健作用。臭氧水可对瓜果蔬菜、海产品、肉类进行杀菌消毒,防腐 保鲜,清除异味。同时具有降解瓜果、蔬菜表面残留含磷农药的功能。利用臭氧水,可以清 洁皮肤、保养皮肤,减轻化妆品对皮肤的刺激。利用臭氧水冷敷、浸泡烫伤、割伤、撞伤, 可加速伤口愈合,防止感染。利用臭氧水洗泡,可以防止皮肤病及真菌引起的脚气类疾病, 同时还可以利用臭氧水洗头,可以清除头发毛细孔处的污垢,减少掉发。 5.臭氧具体应用 :臭氧产品可广泛用于:家庭、医院、宾馆、饭店、美容美发、公共卫生间、 食品加工业、学校、幼儿园、敬老院、金融、证券、办公室、娱乐场所、部队、工业、农业、渔业、养殖业、环保等领域。 6. 臭氧水知识问答 1、问:大自然产生臭氧的方式是如何? 答:大自然产生臭氧的地方除了臭氧层外,就是瀑布区、海边、森林区最多,产生的方法是 太阳光的紫外线被小水滴聚光后,将水滴内的氧气转变为臭氧或在下雨天打雷时,也会产生 臭氧。 2、问:空气污染的地方也会产生臭氧吗? 答:汽、机车排气时所含的氮化物、一氧化碳等,在紫外线的照射下会产生协同作用将部分 氧气转为臭氧。在空气污染的环境下产生的臭氧,可以将一氧化碳溶于水,并可将一氧化 碳转化为稳定的二氧化碳,是大自然的解毒过程。 3、问:民众何以会误认为臭氧为空气污染的元凶? 答:一般环保单位都以臭氧的浓度作为空气污染程度的指标,令民众误认为臭氧是空气污染 的元凶,让臭氧蒙受不白之冤。
臭氧发生器原理及基础知识说明书 1.什么是臭氧 臭氧,又名三原子氧,因其类似鱼腥味的臭味而得名。其分子式为O3,是氧气的同 素异形体,具有它自身的独特性质: ①在自然条件下,它是淡蓝色的气体;②它有一种类似雷电后的腥臭味; ③在标准压力和常温下,它在水中的溶解度是氧气的13 倍;④臭氧比空气重,是空气的 1.658 倍; ⑤臭氧有很强的氧化力,是已知最强的氧化剂之一(仅次于氟);⑥臭氧的密度是 2.14g·l(0°C,0.1MP)。沸点是-111°C,熔点是-192°C,正常情况下,臭 氧极不稳定,容易分解成氧气; ⑦臭氧分子是逆磁性的,易结合一个电子成为负离子分子; ⑧臭氧在空气中的半衰期一般为20-50 分钟,随温度与湿度的增高而加快;⑨臭氧在水中半衰期约为35 分钟随水质与水温的不同而异;⑩臭氧在冰中极为稳定,其半衰期为2000 年。 2.臭氧的制取 臭氧是一种不稳定的气体,不能储存运输,一般臭氧采用现场制作。根据制取的工作原理和原料的不同,分类如表一: 表一:臭氧制取方法分类 产生方法工作原理原料应用范围放电法放电电解(ED)
空气或氧气实验室到实际工程电化学法电解 高纯度水 需要纯水的实验室和小型工程光化学法辐射(吸收电子) 空气(氧气)饮用水或高 纯水新技术,适用于实验室到实际 工程 辐射化学法 X光,γ线高纯水不常用,仅用于实验热法 光电弧电离 水 不常用,仅用于实验 电晕放电合成臭氧是目前世界上应用最多的臭氧制取技术,此技术能够使臭氧产量单台达500kg/h以上。它的主要分类如下: 表二:电晕放电合成臭氧技术分类 分类方式 类别 组成及特点 构造 板式(亦称奥托托板式)由平板式电机和介电体,仅用于少数小型臭氧发生器管式 卧管式(内玻璃管式、 外玻璃管式)由特种玻璃管为介电体和不锈钢管作电极组成放电单
免费咨询电话:4006-828-820 QQ 群:141422077网址:https://www.doczj.com/doc/7c174696.html, QQ 号:415396100 三氧的本质 三氧(O3)——氧的同素异构体,是一种具有特殊臭味的气体,故又称“臭氧”。由于有了额外的电子,成为氧气的高能量形式。三氧与氧气相比具有更强的氧化性。因此,在一般情况下比氧气可以氧化更多的不易被氧化的物质。在地球表面上方20公里至30公里的平流层里,存在一个三氧层。它几乎吸收了太阳光中全部紫外线辐射(<290nm),从而防止了紫外线对人体的损害。日照条件下,三氧来自工业生产、车辆尾气、肥料蒸发、闪电、热带地区生物体燃烧中的氮氧化物释放衍生物,在生活环境中,是一种由光电化学烟雾组成的酸性混合物,对粘膜可形成刺激,如果与碳氢化合物或汽车以及工厂等排出的氮氧化物混合就会成为有害物质。 三氧具有两面性:在平流层是防护性的,在对流层则有毒;对肺有毒,而对于血管和感染疾病则有治疗价值;在高浓度时具有破坏价值,在低浓度时能产生有益的激发作用。 大量证据表明,三氧对呼吸道粘膜是有毒性的,而哮喘病人比正常个体有更大的风险(Harch,1991;Bayrametal.,2001)。然而由于科学界过分关注直接吸入三氧的害处,以至于三氧的医学作用过去被完全忽略了。 三氧的理化性质 三氧一词源于希腊语δεω,原意是“发出一种气味”。三氧是一种淡蓝色气体,在0.0005-0.01ppmv 的浓度时,可觉察到刺激性酸味。三氧分子(O 3)由三个氧原子组成,分子量为48.00。红外光谱吸收表明,三氧分子具有环状结构,氧原子间距是1.26?。 三氧分子通过吸热过程来合成: 3O2?—?2O3-68.400卡
Synergy of electrochemical oxidation using boron-doped diamond (BDD)electrodes and ozone (O 3)in industrial wastewater treatment M.A.García-Morales a ,G.Roa-Morales a ,?,Carlos Barrera-Díaz a ,Bryan Bilyeu b ,M.A.Rodrigo c a Centro Conjunto de Investigación en Química Sustentable,UAEM-UNAM,Carretera Toluca-Atlacomulco,Km 14.5,Campus San Cayetano,C.P.50200,Toluca Estado de México,Mexico b Department of Chemistry,Xavier University of Louisiana,New Orleans 70125,LA,USA c Department of Chemical Engineering,Facultad de Ciencias Químicas,Universidad de Castilla-La Mancha,Campus Universitario s/n 13071Ciudad Real,Spain a b s t r a c t a r t i c l e i n f o Article history: Received 9October 2012 Received in revised form 22October 2012Accepted 23October 2012 Available online 27October 2012Keywords: Electrooxidation Ozone BDD Wastewater COD O 3-BDD coupled process This work evaluates the coupling of electrochemical oxidation and ozonation to reduce the high organic load of industrial wastewater quickly and effectively.Ozonation alone is shown to only reduce the COD of waste-water by about 45%.Electrochemical oxidation using boron-doped diamond electrodes reduces the COD by 99.9%,but requires over 2h per 0.7L batch.However,when the two processes are coupled,the COD is re-duced by 99.9%along with most color and turbidity in about an hour.The coupled process practically elimi-nates the COD,color,and turbidity without the addition of chemical reagents or changing the pH and doesn't generate any sludge,so it is both effective and environmentally friendly. ?2012Elsevier B.V.All rights reserved. 1.Introduction Industrial ef ?uents are dif ?cult to treat using traditional biological systems due to the high variations in their compositions.Unlike munic-ipal wastewater,industrial sources have higher organic load,color,and pH which ?uctuate [1,2].While traditional biological reactors are very effective in digesting the organic matter in municipal wastewater into carbon dioxide and water,the effectiveness drops considerably when treating industrial wastewater.Biological reactors typically only reduce 50%of the biochemical oxygen demand (BOD 5)and 35%of the chemical oxygen demand (COD)[3,4]. Due to the limitations of biological reactors,industrial wastewater is typically pretreated using physical –chemical processes such as co-agulation –?occulation.However,these processes generate large quantities of sludge and usually require pH adjustments and chemical reagents,all of which create their own environmental issues [5,6].Co-agulation –?occulation is not ef ?cient in the removal of dissolved (persistent)chemical pollutants. In recent works we have shown that combining electrocoagulation and ozone produces synergistic effects in wastewater treatment [7,8].However,the use of electrooxidation with boron-doped diamond (BDD)electrodes in conjunction with ozone for treating industrial ef ?u-ents has not yet been reported. Both electrooxidation and ozonation are advanced oxidative pro-cesses based on the generation of hydroxyl radicals (OH ?),which have high oxidation potential and degrade of a wide range of contam-inants.In particular,BDD electrodes have high anodic stability,a wide working potential window,and low stable voltammetric background current in aqueous media [9,10].Therefore,the electrochemical be-havior of BDD electrodes have been investigated with the goal of de-veloping applications for wastewater treatment [11,12].On the other hand,ozonation is an ef ?cient and powerful oxidizing process well known for its degradation of organic compounds.The limitations to these processes are the time required for electrooxidation and the ef-fectiveness of ozonation,so neither alone is truly industrially practical. Thus,this study evaluates the synergy of the two processes com-pared to the ef ?ciency and effectiveness of the individual ones.The effectiveness is evaluated in terms of color,turbidity and chemical ox-ygen demand (COD)reduction.The in ?uence of operating parame-ters such as time of treatment,current density,and initial pH is also evaluated. 2.Materials and methods 2.1.Wastewater samples Wastewater samples were collected from the treatment plant of an industrial park,which receives the discharge of 144different facil-ities.Therefore,the chemical composition of this ef ?uent is rather Electrochemistry Communications 27(2013)34–37 ?Corresponding author.Tel.:+527222173890;fax:+527222175109.E-mail address:groam@uaemex.mx (G. Roa-Morales).1388-2481/$–see front matter ?2012Elsevier B.V.All rights reserved. https://www.doczj.com/doc/7c174696.html,/10.1016/j.elecom.2012.10.028 Contents lists available at SciVerse ScienceDirect Electrochemistry Communications j o ur n a l h o m e p a g e :w w w.e l s e v i e r.c o m /l o c a t e /e l e c o m
我国GMP条例对药品生产(特别是无菌产品)有着极其严格的要求。在GMP验证过程中人们大力推荐臭氧灭菌方法。与各种传统灭菌方法相比,臭氧灭菌有许多特点,因此,臭氧灭菌在药品生产中具有广泛的用途。目前应用比较广泛的有:①对管道容器的灭菌;②利用中央空调净化系统对洁净区的灭菌;③对原辅助材料和工作器具的灭菌;④对密闭空间的灭菌;⑤对药厂用水和灭菌处理。GMP验证和国家GMP认证给臭氧技术带来了前所未有的机遇。臭氧灭菌技术也给制药企业进行GMP验证和接受国家GMP认证提供了有力的武器。 美国食品药品管理局于1962-1963年制定和颁发了第一部《药品生产质量管理规范》(GMP)至今,美国实施GMP已有近40年的历史并在实践中做了几次修订。我国卫生行政部门在1985年实施《药品管理法》以后,于1988年根据《药品管理法》规定,晌郎 孔橹 泄刈 移鸩莶 洳剂宋夜 谝桓觥禛MP》条例,即《药品生产管理规范》作为正式法规。然而,这个《规范》比较原则。又于1990年卫生部又组织了有关专家起草了《实施细则》。于1990年,决定将《规范》和《实施细则》合并,编成《药品生产质量规范》修订本,并于1992年12月28日颁布。最近,根据多年来在我国推行GMP和药品监督的实践,加上国际上实施GMP 在建立统一组织机构执法方面经验,我国于1998年根据国务院指示,改革并统一了药品监督的机构,新组建了国家药品监督管理局。该局安全监督司又专门设立了药品生产监督处,该处具体负责GMP执法工作。同时国家药品监督管理局又于1999年新颁布了《药品生产质量管理规范(GMP1998年版)》并制定了附录。该局又印发了《药品GMP认证管理办法》和《药品GMP认证工作程序》。GMP是我国药品生产企业管理的基本法则。目前我国不同剂型的药品生产企业在规定时间内未达到国家GMP认证要求者就要被淘汰,就不能继续进行该药品生产。所以,当前企业越来越重视GMP的国家认证,也越来越要在认证之前,做好按国家规定的验证工作。在我国GMP中臭氧灭菌是被推荐的重要灭菌方法之一。当前的实际形势给臭氧灭菌的应用带来了前所未有的机遇。为了做到药品的菌检合格: ①要求药品生产和环境是合格的,不同剂型的药品生产车间洁净区应划分下列不同的洁净级别(表1) ② 1998版GMP附录中对GMP的验证规定了尘粉和微生物的具体要求(表2) ③ GMP对无菌药品的具体要求(表3) 表1 不同剂型及工序的洁净度要求 洁净级别适用剂型及工序 100级不灭菌药品的灌封、分装、冻干、压塞、内包材处理;无菌原料药精
硼硫共掺杂金刚石薄膜的研究! 李荣斌!胡晓君!沈荷生!何贤昶 !上海交通大学金属基复合材料国家重点实验室"上海$’’’%’# 摘"要!"利用微波等离子体化学气相沉积")C._S#技术!以丙酮为碳源!用二甲基二硫和三氧化二硼作掺杂源!在硅衬底上制备了硼与硫共掺杂的金刚石薄膜$用俄歇谱分析金刚石薄膜中硫的含量!用傅里叶红外光谱"O]M X#分析了薄膜表面键结构!用扫描电子显微镜"!^)#观测薄膜的表面形貌!j射线衍射"j X S#和喇曼"X4@4,#光谱表征膜层的结构$结果表明%微量硼的加入促进硫在金刚石中的固溶度!使硫在金刚石中的掺杂率提高了近=’Y&随着薄膜中硫含量的增加!薄膜的导电性增加!当薄膜中硫含量达到’A&=Y"原子分数#时其导电激活能为’A%:*_$ 关键词!"共掺杂"化学气相沉积"金刚石薄膜 中图分类号!"#;T;A&"#((""""文献标识码!2 文章编号!&’’&1:(%&#$’’;$’&1’’;:1’% &"引"言 化学气相沉积!._S#法制备的金刚石薄膜具有很多优异的物理和力学性能$&%"在电子器件的应用得到人们的广泛关注& ._S方法可以得到硼掺杂的L型半导体金刚石薄膜$$%"并已成功地应用于f_探测器以及极端条件下的电化学电极!比如高酸溶液#&然而制备高质量的,型金刚石薄膜还存在困难"主要是未能找到较合适的施主杂质原子&C’#及2+的原子半径比.原子半径大得多"不易进入金刚石晶体中(氮虽然可以在._S生长过程中掺入金刚石薄膜"但由于其较深的施主能级!&A(*_#及低的载流子浓度而不适宜于作电子器件(C掺杂的金刚石薄膜表现为,型半导体特征$%%"但由于这种薄膜的低导电性也不适合作电子器件$T%& 采用离子注入工艺将施主元素!5"’\4’C等#注入金刚石来获得,型半导体的方法也未取得成功$;%&D4+*K4[4等人$=%将硫离子注入到._S同质外延!&’’#金刚石薄膜后"D477效应测量表明其具有,型导电性"以及Q4-6*-和‘4-6-/,K$9%采用热丝化学气相沉积法!D O._S#"用氢气稀释.! $ 成功地制得了金刚石薄膜"但是没有进行电学性能的测量&他们的工作激发了人们以硫为掺杂剂来制备,型._S半导体金刚石薄膜的兴趣&近年来"已有关于硫掺杂得到,型金刚石的报道$(%"但是测量结果表明该样品中含有其它杂质而表现为L型$T%&事实上"由于尺寸较大的硫原子进入金刚石晶体后会产生晶格畸变"限制了杂质在金刚石中的掺杂浓度和载流子浓度&合适的共掺杂可以降低因杂质原子和基体原子半径之间的差别而引起的晶格畸变"提高杂质在基体的溶解度"共掺杂原子之间由于库仑作用而复合进入晶格改变了杂质能级在禁带中的位置"从而降低了电 离的活化能&基于这些理论"已成功得到了难以单独进行L型掺杂的N4\’d,#等材料&理论计算认为$:%在金刚石中Q1!是较合适的共掺杂原子对& 本文采用微波等离子体化学气相沉积法!)C._S#将少量的比碳原子半径小的受主杂质原子Q与比碳原子半径大的施主杂质原子!同时掺入金刚石&用扫描电子显微镜!!^)#’俄歇谱仪!2^!#’喇曼光谱!X4@4,#’傅里叶红外谱!O]M X#以及j 射线衍射仪!j X S#分析共掺杂金刚石薄膜的表面形貌和组织结构& $"实验方法 共掺杂在)C._S系统中进行"见图&&D $ 为载体"丙酮 !.D %.#.D% #为碳源"将二甲基二硫!. $D9!$ #单独以及与三氧 化二硼!Q $#% #同时溶于丙酮溶液"二甲基二硫浓度约为=Z &’W%"Q)!原子的比率为’A$"Q).为’A’’&&衬底为’A=@@厚,型抛光!&’’#!"片"为了提高._S金刚石薄膜的形核率"衬底在沉积前用’A=%@的金刚砂研磨&=@","然后在丙酮溶液中用超声波清洗$’@",&反应室本底真空度为’A=Z&’W$C4"不同气源的生长条件相同如表& & 图&")C._S系统 O"K&)"8-/[4G*L74+@414++"+F*33*L/+"F"/,+H+F*@ 表&"硼硫共掺杂金刚石薄膜的生长条件 ]467*&]0*K-/[F08/,3"F"/,/E3"4@/,3E"7@+ 反应气体 .D%.#.D%’.$D9!$’D$或 .D%.#.D%’.$D9!$’Q$#%’D$ 碳源浓度’A=G/7Y .$D9!$浓度=Z&’W% 气流速度:’+88@ 反应室压力$=’’C4 微波功率:’’U 衬底温度=;’i 生长时间&$0 ""用!^)!D M]2.D M"!1=$’#观察金刚石薄膜的表面形貌"用j射线衍射仪!X"K4><1S)@4R1-.".