
从卤素键能来理解稳定性和活泼性
化学上常涉及“活泼性”和“稳定性”这两个非常重要的概念,例如:“金属(或非金属)的活泼性”;“气态氢化物的稳定性”、“酸的稳定性”等等。在必修课的学习中我们没有进行仔细区分,但是选修3关于共价键参数中给了一系列键能数据,特别是卤素单质的键能数据,不追究还真就糊涂了。
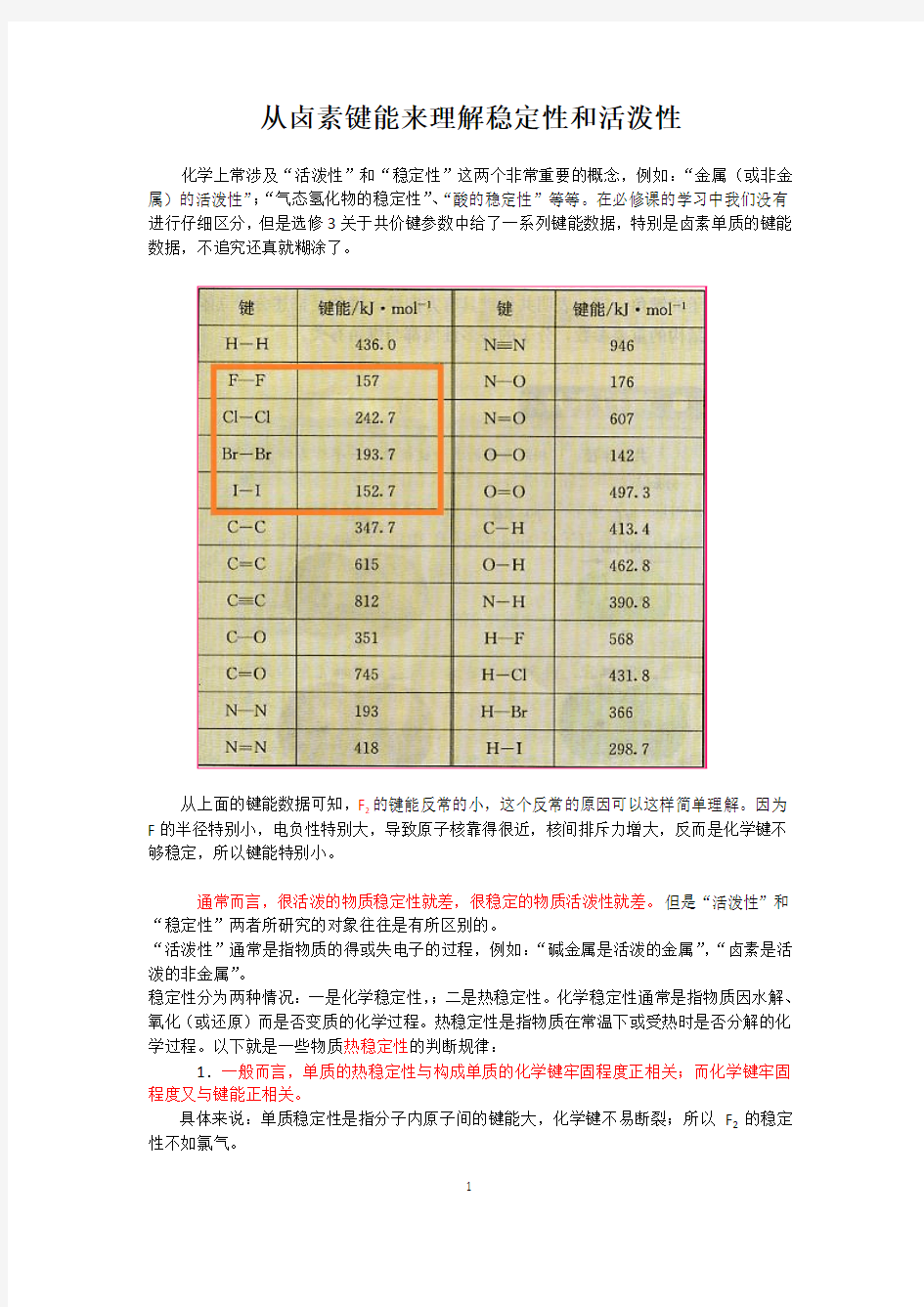
从上面的键能数据可知,F
的键能反常的小,这个反常的原因可以这样简单理解。因为
2
F的半径特别小,电负性特别大,导致原子核靠得很近,核间排斥力增大,反而是化学键不够稳定,所以键能特别小。
通常而言,很活泼的物质稳定性就差,很稳定的物质活泼性就差。但是“活泼性”和“稳定性”两者所研究的对象往往是有所区别的。
“活泼性”通常是指物质的得或失电子的过程,例如:“碱金属是活泼的金属”,“卤素是活泼的非金属”。
稳定性分为两种情况:一是化学稳定性,;二是热稳定性。化学稳定性通常是指物质因水解、氧化(或还原)而是否变质的化学过程。热稳定性是指物质在常温下或受热时是否分解的化学过程。以下就是一些物质热稳定性的判断规律:
1.一般而言,单质的热稳定性与构成单质的化学键牢固程度正相关;而化学键牢固程度又与键能正相关。
具体来说:单质稳定性是指分子内原子间的键能大,化学键不易断裂;所以F2的稳定性不如氯气。
活泼性是指分子发生化学反应的容易与否。不过单质的稳定性很少单独使用,不能单纯的因为稳定性高低来判断反应活性。因为单质参与反应的过程实际分两个步骤,一是吸收键断裂所需的能量,将分子分解为原子(体现键能——稳定性),二是将不同原子重新结合形成新物质(体现非金属性)。由于一般反应中供应的能量都很大,很少存在能量不够一个分子反应的情况,当所供应的能量都足够的时候,毫无疑问由非金属性强弱决定反应的容易与否。意思是非金属性越强,反应活性越高。例如:对于卤素来说,虽然其键能递减(除F2,因为F半径很小,斥力很大则使得键能反常减小),分子越来越不稳定,断裂成原子越来越容易。但是由于卤素原子吸引电子的能力减弱,反应就越难,最终表现为化学性质越不活泼,与非金属性减弱相一致,而与稳定性无关。因此,氟氯溴碘单质反应剧烈程度下降。相反,对于N2,由于三键的存在,键能很大,一般不能满足断键的条件,即使氮电负性较大也不发生反应,所以N2的稳定性决定了不活泼性。
2.气态氢化物的热稳定性:元素的非金属性越强,键能越大,形成的气态氢化物就越稳定(最有规律也最常用)。同主族的非金属元素,从上到下,随核电荷数的增加,非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱;同周期的非金属元素,从左到右,随核电荷数的增加,非金属性逐渐增强,气态氢化物的稳定性逐渐增强。
3.氢氧化物的热稳定性:金属性越强,碱的热稳定性越强(碱性越强,热稳定性越强)。
4.含氧酸的热稳定性:绝大多数含氧酸的热稳定性差,受热脱水生成对应的酸酐。一般地:
①常温下酸酐是稳定的气态氧化物,则对应的含氧酸往往极不稳定,常温下可发生分解。
②常温下酸酐是稳定的固态氧化物,则对应的含氧酸较稳定,加热时才分解。
③某些含氧酸分解是发生氧化还原反应,得不到对应的酸酐。例如硝酸、次氯酸。
5.含氧酸盐的热稳定性:
①酸不稳定,对应的盐也不稳定;酸较稳定,对应的盐也较稳定。例如硫酸盐和磷酸盐比较稳定。
②同一种酸的盐,热稳定性顺序是正盐>酸式盐>酸。
③同一酸根的盐的热稳定性顺序是碱金属盐>过渡金属盐>铵盐。
④同一成酸元素,高价含氧酸比低价含氧酸稳定,相应含氧酸盐的稳定性顺序也是如此。
一、比较非金属性强弱的九条依据 【1】.元素在周期表中的相对位置 ①同周期元素,自左向右,元素的非金属性依次增强,如F>O >N>C>B;Cl>S>P>S i等。 ②同主族元素自上而下,非金属性依次减弱,如F>Cl>Br>I;O >S>Se;N>P>As等。 【2】.非金属单质与氢气化合的越容易,非金属性越强 如F2、Cl2、Br2、I2与H2化合由易到难,所以非金属性F>Cl>Br>I 【3】.气态氢化物的越稳定,非金属性越强 如稳定性:HF>H2O>HCl>NH3>HBr>HI>H2S>PH3, 所以非金属性:F>O>Cl>N>Br>I>S>P。 【4】 如酸性:HClO4>H2SO4>H3PO4>H2CO3>H4SiO4, 则非金属性:Cl>S>P>C>Si。 【5】 如2F2+2H2O=4HF+O2↑;O2+4HCl=2H2O+2Cl2(地康法制Cl2);Cl2+2NaBr=2NaCl+Br2;3Cl2+2NH3=N2+6HCl;Cl2+H2S=S+2HCl。【6】.非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。电解时,在阳极先产生的单质为非金属性弱的单质。 常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。 【7】.与变价金属反应时,金属所呈价态越高,非金属性越强如Cu+Cl2 →CuCl2;2Cu+S→Cu2S,说明非金属性Cl>S。【8】.几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱 如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。 【9】、能量:非金属元素原子得电子放热,放热越多离子越稳定,非金属越强。
边坡稳定性影响因素 边坡稳定性影响因素: (1)坡底中结构面对边坡稳定性的影响.破底的稳定性直接影响整个山体的稳定性 (2)外力对边坡的影响。例如:爆破,地震,水压力等自然和认为因素,而导致边坡破坏。 (3)边坡外形对边坡稳定性的影响。比如,河流、水库及湖海的冲涮和淘涮,使得岸坡外形发生变化,从而使这些边坡发生破坏,这主要由于侵蚀切露坡体底部的软弱结构面使坡体处于临空状态,或是侵蚀切露坡体下伏到软弱层,从而引起坡体失去平衡,最后导致破坏。(4)岩体力学性质恶化对边坡稳定性的影响。比如风化作用对边坡稳定性的影响,这主要是由于风化作用使坡体强度减小,坡体稳定性降低,加剧斜坡的变形与破坏,而且风化越深,斜坡稳定性越差,稳定坡角就越小。 边坡稳定性相关延伸: 边坡稳定性控制技巧 边坡防护设计的主要原则 1、安全第一.质量保证 边坡的防护直接影响到交通的安全,目前,我国的防护工作主要是由边坡起防护作用,对自然灾害和人为因素造成的塌方、陷落等起到很好的防护作用,对交通设施的安全顺畅运行,对车辆行使的安全,起
着巨大的作用。因此,在设计边坡时,首先要考虑的是边坡的质量问题,要在保证边坡防护设施自身的质量过硬的情况下,考虑防护设施起到的安全作用,要以防护坡的安全系数为设计的首要考虑因素。要从设计上保证边坡防护设施的防护质量,以安全作为防护的第一要素,确保边坡的防护能在实际中起到防护的作用。为安全使用、交通的顺畅起到应有的作用。 2、考虑地理环境,因地制宜 随着我国交通设施的进一步完善,穿越范围越来越广,所处的地形地貌多种多样,各有特点,各不相似。因此,就给边坡防护的设置带来了许多复杂的问题,在不同的地方因为地质情况的差异、气候情况的不同、环境的差别等,公路边坡的建设情况也不一样。一般边坡崩塌所遇到的问题可以归为3类,即落石型、滑坡型、流动型,而这3种坍塌形式是由于不同的地质地理环境造成的。比如落石型一般是发生在较陡的岩石边坡,因为在一定的条件下岩石边坡的岩层会产生裂缝、渗水,经过长时间的风化和外力作用,裂缝会逐渐扩大,在雨水侵蚀下,裂缝中充满水,产生侧向静水压力作用,造成崩坍。在设计时,就必须注意对岩石裂缝产生进行控制,采取积极的防水措施。所以因为所面临的防护问题不一致,因此在设计边坡的防护设施时,必须因地制宜,在充分了解工程所在地区的地理和环境及气候等具体的情况下,对所面临的各种潜在隐患进行预测,进而根据防护的需要,设计出与该地区相匹配的防护手段。绝对不能教科书式的照搬照抄,就把
柔性直流配电系统稳定性及其控制关键问题 摘要:经济的发展,城市化进程的加快,人们对电能的需求也逐渐增加。相比 于传统的交流配电系统,柔性直流配电系统包含了换流阀、直流变压器等大量可 控的电力电子设备,呈现电力电子化的特征。直流配电系统故障特征、故障发展 过程、故障隔离及供电恢复过程都与换流阀等电力电子器件控制策略密切相关。 在直流配电系统中,保护原理的选择、保护整定值的选取、保护动作出口时间的 设置都需要考虑与换流阀控制策略的协同配合。通过控制与保护的相互协同实现 故障准确识别与供电快速恢复,在保证直流配电系统高可靠性的同时有效降低直 流配电网投资建设成本,是直流配电系统研究与发展的重要思路。本文就柔性直 流配电系统稳定性及其控制关键问题展开探讨。 关键词:柔性直流配电;稳定性;随机性 引言 随着城市用电负荷密度不断增大,城市电网面临着多重难题:一方面要扩大 城市配电网容量以适应城市经济发展的需求,另一方面要接纳太阳能、风能等可 再生清洁能源以减轻环境污染的压力。在该背景下,直流配电系统(DCS)是基 于电压源换流器提供直流电力且具有先进能源管理系统的智能化配电系统,因其 输送容量更大、供电质量更优、易于接纳分布式能源(DER)、可控性更高[2]等 优势而受到关注。 1DCS的主要性能特点 (1)DCS的稳定性。随着大量DER和柔性电力电子设备的接入,DCS的稳定 性问题也逐渐成为学术界和工业界的关注热点。特别是对于可以孤岛运行的直流 微电网来说,其电源和负荷电力电子化带来的动态特性,改变了以同步发电机为 主的传统电力系统的稳定性特征。目前,国内外已有相关学者通过DCS或微电网 的小信号稳定性分析,利用阻抗匹配等系统稳定分析理论,对电力电子化配电系 统中DER的并网动态特性进行了探究,但大部分研究仍然集中于单个并网逆变器 或级联型逆变器。因此,需要深入开展电力电子化DCS的稳定性分析理论和方法 的研究,并提出相应的稳定性提升策略,保障DCS的安全可靠运行。(2)低压DCS的安全性。中国广泛采用220V交流低压供电,超过了人体耐受的安全低压 水平,人身触电造成伤亡事件屡屡发生,在城市暴雨后内涝引发的群众触电事故 更是时有发生。全国每年触电死亡数千人,触目惊心,引起了广泛的关注。如果 低压系统对多数家电采取±48V直流安全电压供电,将在很大程度上降低人身触电事故发生的概率,这也将是直流配电技术在低压系统领域应用的主要优势。不过,由于电压等级较低,且DCS设备占地面积大,其能量密度和功率密度将受到影响,因此可以考虑采用±375V和±48V直流组合供电,其中,户级配电采用±375V以提 高能量密度(在珠海示范工程中验证了该电压等级的价值),非高功率用电设备 级供电采用±48V以减少非安全电压与人们接触的机会。(3)DCS的稳定性。随 着大量DER和柔性电力电子设备的接入,DCS的稳定性问题也逐渐成为学术界和 工业界的关注热点。特别是对于可以孤岛运行的直流微电网来说,其电源和负荷 电力电子化带来的动态特性,改变了以同步发电机为主的传统电力系统的稳定性 特征。 2直流配电系统保护原理 直流配电网保护可分为非单元式保护和单元式保护。非单元式保护不依赖保 护装置之间的通信,当保护装置采集的故障测量值达到动作设定值时即开始动作。
常见物质的氧化性还原性强弱顺序 一、顺序的由来及依据 学过氧化还原反应的强弱律之后,我们可以根据下列反应 ①2FeCl2+Cl2=2FeCl3②2FeCl3+2HI=I2+2FeCl2+2HCl ③I2+K2S=S+2KI 判断氧化剂的氧化性由强到弱的顺序为Cl2>Fe3+>I2>S 同样可以得出还原性由弱到强的顺序为Cl- +H2SO4可得,还原性I- 2.推测能否反应及产物 如①Fe3+与I-可反应但不能与Cl-,Br-反应; ②浓H2SO4能干燥HCl但不能干燥HBr、HI、H2S; ③Fe与Cl2,Br2能生成FeCl3,FeBr3但与I2,S只能生成FeI2,FeS; ④能把Fe氧化成Fe3+的有Cl2,HNO3,浓H2SO4,Br2但I2,S都只能把Fe 氧化成+2价。 ⑤HNO3能氧化HBr,HI,H2S但不能氧化HCl 3.推测反应顺序 ①如少量Cl2通入到FeBr2,FeI2中的离子方程式就不同; ②把Fe投入到Fe2(SO4)3+H2SO4+CuSO4混合液中时相继发生的反应顺序。 4.判断氧化还原产物及书写氧化还原方程式 如书写KMnO4与SO2的方程式,应生成Mn2++SO42-然后结合元素守恒判断出其它产物。 5.需要说明的问题: 第二章第3节氧化还原反应(第3课时教案) 一、教学目标: 1、掌握物质氧化性和还原性强弱的判断; 2、理解氧化还原反应的规律。 二、教学重点难点: 教学重点:物质氧化性和还原性强弱的判断。 教学难点:氧化还原反应的规律。 三、教学过程: 【新课导入】 氧化性→得电子性,得到电子越容易→氧化性越强 还原性→失电子性,失去电子越容易→还原性越强 由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以, 一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。 【整理归纳】一、物质氧化性和还原性强弱的判断 1、根据氧化还原方程式进行判断 对于反应: 氧化性:氧化剂>氧化产物; 还原性:还原剂>还原产物。 例如:Fe+CuSO4=FeSO4+Cu,则有: 氧化性:CuSO4>FeSO4;还原性:Fe>Cu 2、根据物质活动性顺序进行判断 (1)根据金属活动性顺序判断 (2)根据非金属活动性顺序判断 3、根据产物的价态判断 一种氧化剂将还原剂氧化的价态越高,其氧化性越强。 如:2Fe +Cl 2=====点燃2FeCl 3 Fe +I 2=====△ FeI 2 氧化性:Cl 2>I 2 4.依据反应条件来判断 与同一种还原剂(氧化剂)发生反应,其反应越困难(即要求条件越高),其氧化性(还原性)越弱。 如:2KMnO 4+16HCl(浓)=2KCl +2MnCl 2+5Cl 2↑+8H 2O MnO 2+4HCl(浓)=====△ MnCl 2+Cl 2↑+2H 2O 【小结】 (1)氧化性、还原性的强弱取决于物质得、失电子的难易程度,而与得、失电子数目的多少无关。 (2)元素的化合价处于最高价态时,具有氧化性,但不一定具有强氧化性,如Na + 。处于最低价态时具有还原性,但不一定有强还原性,如F -。 【例题分析】1.根据下面两个化学方程式判断Fe 2+、Cu 2+、Fe 3+氧化性由强到弱的顺序是( ) ①2FeCl 3+Cu=2FeCl 2+CuCl 2, ②CuCl 2+Fe=FeCl 2+Cu A .Fe 3+>Fe 2+>Cu 2+ B .Fe 2+>Cu 2+>Fe 3+ C .Cu 2+>Fe 3+>Fe 2+ D .Fe 3+>Cu 2+>Fe 2+ 【解析】由反应①可得出氧化性:Fe 3+>Cu 2+;由反应②可得出氧化性:Cu 2+>Fe 2+;故综合可知:Fe 3+>Cu2+>Fe 2+ ,选D 。 【整理归纳】二、氧化还原反应的规律 常见物质的氧化性还原性强弱顺序 一、顺序的由来及依据 学过氧化还原反应的强弱律之后,我们可以根据下列反应 ①2FeCl 2+Cl 2=2FeCl 3 ②2FeCl 3+2HI =I 2+2FeCl 2+2HCl ③I 2+K 2S =S+2KI 判断氧化剂的氧化性由强到弱的顺序为 Cl 2>Fe 3+>I 2>S 同样可以得出还原性由弱到强的顺序为 Cl - (1)注意各微粒中元素的价态 (2)由氧化性顺序可得还原性顺序,氧化剂的氧化性越强,其对应的还原产物还原性越弱。 (3)强氧化剂可氧化弱氧化剂的还原产物生成弱氧化剂,此之谓“前氧后低”即前面的物质可氧化后面物质的低价态。 四、应用举例 1.推测物质可能发生的氧化还原反应(见下表) 2.推测能否反应及产物 如①Fe3+与I-可反应但不能与Cl-,Br-反应; ②浓H 2SO 4 能干燥HCl但不能干燥HBr、HI、H 2 S; ③ Fe与Cl 2,Br 2 能生成FeCl 3 ,FeBr 3 但与I 2 ,S只能生成FeI 2 ,FeS; ④能把Fe氧化成Fe3+的有Cl 2,HNO 3 ,浓H 2 SO 4 ,Br 2 但I 2 ,S都只能把Fe氧化成+2价。 ⑤HNO3能氧化HBr,HI,H2S但不能氧化HCl 3.推测反应顺序 ①如少量Cl 2通入到FeBr 2 ,FeI 2 中的离子方程式就不同; ②把Fe投入到Fe 2(SO 4 ) 3 +H 2 SO 4 +CuSO 4 混合液中时相继发生的反应顺序。 4.判断氧化还原产物及书写氧化还原方程式 如书写KMnO 4与SO 2 的方程式,应生成Mn2++SO 4 2-然后结合元素守恒判断出其它产物。 5.需要说明的问题: ①Cu2++S2-错误!未找到引用源。CuS↓而不是氧化还原,类似的Ag++(S2-,Br-,I-)也不是氧化还原。 ②2HI+H2SO4(浓)错误!未找到引用源。I2+SO2+2H2O; I2+SO2+2H2O错误!未找到引用源。2HI+H2SO4 说明浓度不同,氧化性或还原性也有所不同 ③Cl2+2KBr错误!未找到引用源。2KCl+Br2 Br2+2KClO3错误!未找到引用源。2KBrO3+Cl2 都可以发生,是因为前者氧化性Cl2>Br2而后者是还原性Br2>Cl2,二者并不矛盾。 ④2C+SiO2错误!未找到引用源。2CO+Si 淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、硝基苯(溶有NO2)灰黄色:Mg3N2 棕黄色:FeCL3溶液、碘水(深黄--褐) 棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕) 常见微溶物: Ag2SO4、CaSO4、Ca(OH)2、MgCO3 Ag+ 与Cl-、Br-、I-、SO42- Ca2+ 与CO32-、SO32- Ba2+ 与CO32-、SO32-、SO42- H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、S2-、F-、ClO-、CH3COO-、C6H5O-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等) OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Zn2+、Cu2+、Fe2+、Fe3+ 等)以及弱酸的酸式根离子。 Fe3+与S2-、SO32-、HSO3-、I-、HS-、CO32-、HCO3-、AlO2- SO32-(H+)与S2- MnO4-(H+)、Cr2O72-、ClO-与Cl-、I-、S2-、Fe2+、HS-、SO32-、HSO3- NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I- Al3+与CO32-、HCO3-、S2-、HS-、AlO2- NH4+与AlO2- 还原;K、Ca、Na、Mg、Al,Zn、Fe、Sn、Pb、(H),Cu、Fe3+、Hg、Ag、Pt、Au 氧化: F2>O2>Cl2>Br2>Fe3+>I2>SO2>S 还原: Fe- 影响结构强度和稳定性的因素通过今年发生的雪灾和地震图片资料让学生感受到结构被破坏 的情景,提出我们如何理解“结实”这个词的含义,并对结构的强度的描述进行探究,加深学生对结构强度的理解;接下来结合学生熟悉的、身边的生活事例,借助于多媒体演示、小试验等方法引导学生探究影响结构强度主要因素。 课堂中引入学案,目的是更加突出以学生为主体,教师为主导的教学方式,使学生真正成为课堂的主人。 四、教学过程 第一环节情景导入 首先利用多媒体播放今年1月我国南方地区遭受雪灾袭击及5月汶川地震的图片资料,灾难过后很多结构受到破坏,让学生感受到结构被破坏的情景,引出课题——影响结构强度的因素。 然后给出本节课的学习目标,让学生明确学习目标是:了解材料、形状和连接方式是如何影响结构的强度的。 第二环节知识构建 一、结构强度的含义 1、结构强度含义 通过结构内力的计算和进行应力计算(课本26页)引出容许应力含义并引出结构强度的定义: 结构的强度是指结构具有的抵抗被外力破坏的能力。 小实验:绳子和粉笔的变形能力和结实程度 对课本给出的定义进行质疑,引导和说明结构强度与是否被破坏有关。最终得出结构的定义是:抵抗破坏的能力 第三环节合作探究 实践与体验:每三位同学一张A4纸,如何能让它承受最大的重量(有的组有浆糊和双面胶,一些组没有进行对比) 通过是同学们的动手实践和思考,理解影响结构的强度的因素主要有:材料、形状和连接方式 并提出:除此之外还有那些因素会影响结构的强素呢? 二、知识点拓展 (一)工业用型材的截面形状 首先通过图片资料让学生了解工业上常用各种型材的截面形状教师引导:我们已知道用于结构材料的截面尺寸大小直接影响受力的大小,对于同种材料来说,截面积越大承载能力越强。那么我们现在进一步研究另一种情况:两个截面面积相等,但形状不同的截面中,究竟哪一种截面更有利于结构的强度? 通过实际生产生活中常用的典型结构--------圆形截面、矩形截面和工字形梁的截面形状来进行分析,工字形梁的截面更有利于减轻材 物质氧化性、还原性强弱的比较,实质上是物质得失电子难易程度的比较。即物质越易夺得电子,则其氧化性越强,越难夺得电子则其氧化性越弱;反之,物质越易失去电子,则其还原性越强,越难失去电子,则其还原性越弱。 一、利用化合价,比较物质氧化性、还原性强弱 由同种元素形成的不同价态物质的氧化性和还原性的强弱规律是:元素的最高价态只具有氧化性,元素的最低价态只具有还原性,元素的中间价态既有氧化性又有还原性。 例1.对铁元素组成的物质而言: 氧化性:Fe<二价铁盐<三价铁盐 还原性:Fe>二价铁盐>三价铁盐 二、利用元素活泼性的不同,比较物质氧化性、还原性的强弱 1.对金属而言,金属越活泼(金属性越强),其单质的还原性越强,其金属阳离子的氧化性越弱。 例2.对金属活动性顺序表而言: K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au 活泼性(金属性)————→减弱 其单质还原性:K>Ca>Na>Mg>Al>…Hg>Ag>Pt>Au 其离子氧化性:K+<Ca2+<Na+<Mg2+<Al3+<…<Hg2+<Ag+<Pt2+<Au+ 例3.对同主族的金属元素,从上到下活泼性依次增强。如对ⅡA族金属元素:Be Mg Ca Sr Ba 活泼性(金属性)————→增强 其单质还原性: Be<Mg<Ca<Sr<Ba 其阳离子氧化性: Be2+>Mg2+>Ca2+>Sr2+>Ba2+ 例4.对同周期金属而言,从左到右其金属活泼性(金属性)依次减弱。如对第3周期金属而言: Na Mg Al 活泼性(金属性)————→减弱 其单质还原性:Na>Mg>Al 其阳离子氧化性:Na+<Mg2+<Al3+ 氧化剂 概述 英文名:strong oxidant 具有强烈的物质。 在标准顺序中的位置越靠后,标准电位值越正,在中越易获得,则这类物质(如、或)就是越强的。 如三价、过硫酸盐、、、、氧酸盐、等,都是强氧化剂。 常见的氧化剂是在化学反应中易得电子被还原的物质。 (1)典型的非金属单质如F、O、Cl、Br、I、S等(其氧化性强弱与基本一致)。 (2)含有变价元素的高价化合物,如KMnO4 KClO H2SO HNO MnO 等。 (3)金属阳离子如:Fe+、Cu+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO=FeSO+Cu中,实质上是Cu+离子氧化Fe原子,Cu+作氧化剂,Fe是还原剂) 常见氧化剂: 1. 氟气(F)是淡黄色的气体,强氧化性,有特殊难闻的臭味,剧毒。-188℃以下,凝成黄色的液体。在-223℃变成黄色结晶体。在常温下,氟几乎能和所有的元素化合:大多数金属都会被氟腐蚀,碱金属在氟气中会燃烧,甚至连黄金在受热后,也能在氟气中燃烧。许多非金属,如硅、磷、硫等同样也会在氟气中燃烧。 2. 臭氧(分子式O)是氧的同素异形体,有强氧化性。在常温下,它是一种有特殊臭味的蓝色气体。臭氧主要存在于距地球表面20公里的同温层下部的臭氧层中。它吸收对人体有害的短波紫外线,防止其到达地球。气态臭氧厚层带蓝色,有特殊臭味,浓度高时与氯气气味相像;液态臭氧深蓝色,固态臭氧紫黑色。 3.氯气 氯单质为黄绿色气体,有窒息性臭味;熔点°C,沸点°C,气体密度克/升,20°C时1体积水可溶解体积氯气。氯相当活泼,湿的氯气比干的还活泼,具有强氧化性。除了氟、氧、氮、碳和惰性气体外,氯能与所有元素直接化合生成氯化物;氯还能与许多化合物反应,例如与许多有机化合物进行取代反应或加成反应。 4. 硝酸(nitric acid)分子式HNO,是一种有强氧化性、强腐蚀性的无机酸,酸酐为五氧化二氮。硝酸的酸性较硫酸和盐酸小(PKa=),易溶于水,在水中完全电离,常温下其稀溶液无色透明,浓溶液显棕色。硝酸不稳定,易见光分解,应在棕色瓶中于阴暗处避光保存,严禁与还原剂接触。硝酸在工业上主要以氨氧化法生产,用以制造化肥、炸药、硝酸盐等,在有机化学中,浓硝酸与浓硫酸的混合液是重要的硝化试剂。 5. 网络量化反馈控制系统的稳定性及控制策略研究网络控制系统(Networked Control Systems,NCSs)是一种通过网络进行数据传输和交换的闭环实时分布式控制系统。与传统的控制系统相比,NCSs在带来很多优点的同时也带来了许多问题,诸如网络诱导时延、数据包丢失和错序以及对网络带宽限制约束,再加上系统中的建模不确定性和外部干扰等,使得这类组合系统的分析和综合变得极其困难。 另外由于一些信号不易被编码,因此需要引入量化器,这就不可避免的引入量化误差的影响。这些问题都会导致系统控制性能的下降,因此对于网络量化控制系统理论的研究就有着重要意义。 究。充分考虑网络诱导时延、量化、外界干扰以及带宽约束等问题,建立系统模型,采用李雅普诺夫(Lyapunov)稳定性理论和线性矩阵不等式(Linear Matrix Inequality,LMI)等技术来分析研究系统的性能、稳定性以及控制器设计。 具体研究内容如下:一、考虑网络时延及系统不确定性的情况下,对系统进行建模,采用对数量化器分别对控制系统的状态信号和控制信号进行量化,并将量化误差转化为扇区有界形式,随后利用转移概率已知的马可夫链(Markov chain)来描述网络时延的随机变化规律,将控制系统建模成Markov跳变系统。通过构建Lyapunov-Krasovskii泛函,应用LMI方法得到系统随机稳定且具有H_?性能指标?的充分条件,并给出了量化反馈控制器的设计方法。 二、随后进一步针对外界干扰和网络时延对于控制系统的影响,研究了基于观测器的量化输出反馈控制问题。分别考虑外界干扰不存在和外界干扰存在时,构建新的网络系统模型,应用Lyapunov稳定性原理和LMI不等式方法,给出了网 氧化性:F2>Cl2>Br2>Fe3+>I2>SO2>S 高锰酸钾溶液的酸性越强,氧化性越强。 还原性:S2->SO3(2-)>I->Fe2+>Br->Cl->F- 推荐: 常见的氧化剂有:1活泼的金属单质,如X2(卤素)、O2、O3、S等 2高价金属阳离子,如Cu2+,Fe3+等或H+ 3高价过较高价含氧化合物,如MnO2、KMnO4、K2Cr2O7、HNO3、H2SO4(浓)、KClO3、HClO等 4过氧化物,如Na2O2、H2O2等 常见的还原剂有 1活泼或较活泼的的金属,如K,Na,Mg,Al,Zn,Fe等 2低价金属阳离子,如Fe3+,Sn2+等 3非金属阳离子,如Cl-,B-,I-,S2-等 4某些非金属单质,如H2,C,Si 在含可变化合价的化合物中,具有中间价态元素的物质(单质或化合物)即可作氧化剂,又可做还原剂,例如 Cl2,H2O2,Fe2+,H2SO3等既具有氧化性,又具有还原性。 (1)根据化学方程式判断氧化性、还原性的强弱 氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 (2)根据物质活动顺序判断氧化性、还原性的强弱 1金属活动顺序 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 原子还原性逐渐减弱,对应阳离子氧化性逐渐增强。 (金属还原性与溶液有关,如在稀盐酸,稀硫酸中Al比Cu 活泼,但在浓硝酸中Cu比Al活泼 2非金属活动顺序 F Cl Br I S 原子(或单质)氧化性逐渐减弱,对应阳离子还原性逐渐增强。 (3)根据反应条件判断氧化性和还原性的强弱 当不同的氧化剂作用于同一还原剂时,若氧化剂价态相同,可根据反应条件的高、低来进行判断,例如: 16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2(1) 4HCl+MnO2=(加热)MnCl2+2H2O+Cl2(2) 4HCl+O2=(CuCl2,500摄氏度)2H2O+2Cl2(3) 上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl2,而氧化剂分别是KMnO4,MnO2,O2,(1)式中KMnO4常温下就可以把浓盐酸中的氯离子氧化成氯原子,(2)式 氧化还原反应(氧化性还原性强弱比较) A.基础训练 1.在3Cl2 +8NH3 =6NH4Cl +N2反应中,还原性最强的物质是( ) A、Cl2 B、NH3 C、NH4Cl D、N2 2.在反应KI +5KIO3 +3H2S =3I2 +3K2SO4 +3H2O 中,被氧化的碘元素和被还原的碘元素的质量比是 A、1:5 B、5:1 C、6:1 D、1:6 3.下列变化中,需加入氧化剂才能进行的是( ) A、Br-→Br2 B、Cr2O72-→Cr3+ C、S2-→HS- D、NO3-→NO 4.已知:2BrO3-+Cl2=Br2 +2ClO3-;5Cl2 +I2 +6H2O =2HIO3 +10HCl;ClO3-+5Cl-+6H+ =3Cl2+3H2O判断下列物质氧化能力强弱顺序为( ) A、ClO3->BrO3->IO3->Cl2 B、BrO3->Cl2>ClO3->IO3- C、BrO3->ClO3->Cl2>IO3- D、Cl2>BrO3->ClO3->IO3- 5.已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是 A、2NaW + Z2= 2NaZ + W2 B、2NaX + Z2 = 2NaZ + X2 C、2NaY + W2 = 2NaW + Y2 D、2NaZ + X2= 2NaX + Z2 6.用KClO3制氧气和用KMnO4制氧气,若制得相同质量的氧气,上述反应中转移的电子数之比为( ) A、1:1 B、1:2 C、2:1 D、2:3 7.在xR2++y H++O2 =m R3++n H2O 的离子反应中,m 的值为( ) A、2x B、4 C、y/2 D、2n 8.元素从化合物中被置换成单质时,该元素( ) A、一定被氧化 B、一定被还原 C、可能被氧化,也可能被还原 D、既不被氧化,也不被还原 B.提高训练9.下列反应需要加入氧化剂才能实现的( ) A、SO3→SO42- B、HCl →Cl2 C、HCO3-→CO2↑ D、Cl2→C l O- 10.根据硫元素的化合价判断,下列既有氧化性、又有还原性的物质是( ) A、SO2 B、H2S C、H2SO4 D、SO3 11.在3S+6KOH =2K2S +K2SO3 +3H2O 的反应中,被氧化的硫与被还原的硫的质量比( ) A、1∶3 B、3∶4 C、2∶1 D、1∶2 12.已知在某温度时发生如下3个反应:①C+CO2 =2CO;②C+H2O =CO +H2; ③CO +H2O =CO2 +H2,由此可判断在该温度下,C、CO、H2的还原性强弱顺序是( ) A、CO >C>H2 B、CO>H2>C C、C>H2>CO D、C>CO>H2 13.下列反应中,水作氧化剂,且该反应属于置换反应的是( ) A、2Na + 2H2O = 2NaOH +H2↑ B、2F2 +2H2O = 4HF + O2 C、H2O+Cl2 =HCl =HClO D、2H2O2H2↑ +O2↑ 14.由相同条件下的三个反应:2A +B2 =2B +A2;2C +A2 =2A +C2;2B +D2 =2D +B2;可判断( ) A、氧化性:A2>B2>C2>D2 B、还原性:C->A->B->D- C、2A-+D2 =2D-+A2可进行 D、2C-+B2 =2B-+C2不能进行 15.对于反应14CuSO4 +5FeS2 +12H2O =7Cu2S +5FeSO4 +12H2SO4来说,下列结论正确的是( ) A、FeS2既是氧化剂,又是还原剂 B、只有CuSO4作氧化剂 C、被氧化的硫和被还原的硫质量比是3:7 D、被氧化的硫和被还原的硫质量比是1:1 16.现有下列三个反应:①2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+CL2=2FeCl3 ③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2 +8H2O 若FeCl2溶液中含有I-杂质,氧化除去I-杂质可加入试剂( ) A、Cl2 B、盐酸 C、KMnO4 D、FeCl3 基于汽车稳定性控制系统的侧翻控制策略 摘要:随着汽车产业的迅速发展,人们对汽车各方面性能要求的不断提升,特别是针对汽车安全性的高度关注和需求,从而不断的促使着汽车产业在汽车安全行驶方面寻求技术改进和突破。为了提高汽车在行驶过程中的安全性能系数,基于汽车电子稳定性控制系统(Electronic Stability Program,ESP)的侧翻控制策略,针对汽车的主动转向控制建立了以汽车2自由度为参考模型建立了8自由度的汽车动力学模型的侧翻控制策略,主要采用改变转向轮的转向角度,从而减小汽车的侧向加速度,提高汽车的侧翻控制能力。其次,根据汽车在行驶过程中制动系统以及悬架的变化情况建立了10自由度整车侧翻动力学模型,应用车辆动力学和轮胎力耦合特性,提出车辆侧翻控制策略。通过制动矩的差动调节和半主动悬架阻尼力的适时匹配,实现对车辆侧翻的有效控制。通过对转向系统和制动系统及悬架的控制研究,大大提高汽车在行驶过程中的稳定性。 关键词:汽车稳定性,悬架控制,转向控制,车辆侧翻,制动控制。 Rollover control strategy based on vehicle stability control system Abstract: With the rapid development of automobile industry, car performancerequirements of all aspects, especially in automotive safety attention and demand, and constantly push the car industry for technical improvement and breakthrough in the field of automotive safety driving. In order to improve the car driving in the process of safety coefficient, based on automobile Electronic Stability control system (Electronic Stability Program, ESP) of the lateral control strategy, in automotive active steering control is established by car 2 degrees of freedom for the reference model of 8 degrees of freedom vehicle dynamics model is established of the rollover control strategy, mainly USES the change of steering wheel steering Angle, thus reduce the lateral acceleration of the car, improve vehicle rollover control. Secondly, based on automobile brake system in the process of driving and the change of suspension set up 10 degrees of freedom vehicle lateral dynamics model, application of vehicle dynamics and tire force coupling characteristics of vehicle rollover control strategy is put forward. Through differential braking torque regulation and timely match the semi-active suspension damping force, to achieve the effective control of vehicle rollover. Through to the steering system and brake system and suspension control research, greatly improve the stability in the process of car on the road. Key words: Control stability, suspension, steering control, vehicle, braking control. 氧化性还原性强弱的判 断方法 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988) 氧化性,还原性强弱的判断方法 (一)根据氧化还原反应的方向判断? 氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物? 氧化剂--得电子--化合价降低--被还原--发生还原反应--还原产物? 还原剂--失电子--化合价升高--被氧化--发生氧化反应--氧化产物? 氧化性:氧化剂>氧化产物? 还原性:还原剂>还原产物? 氧化性:氧化剂>还原剂还原性:还原剂>氧化剂 (二)根据元素活动性顺序比较? (1)金属活动顺序: K>Ca>Na>Mg>Al>Mn>Zn>Cr>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au? 从左到右,金属还原性逐渐减弱,对应阳离子氧化性逐渐增强 (2)非金属活动性顺序(常见元素)?:F---Cl---Br---I---S? 从左到右,原子(或单质)氧化性逐渐减弱,对应阴离子还原性增强? 氧化性:F 2>Cl 2 >Br 2 >Fe3+>I 2 >SO 2 >S 还原性:S2->SO 3 2->I->Fe2+>Br->Cl->OH->含氧 酸根>F- (三)根据反应条件判断,当不同氧化剂分别于同一还原剂反应时,如果氧化产物价态相同,可根据反应条件的难易来判断。反应越容易,该氧化剂氧化性就强。? (四)根据氧化产物的价态高低来判断? 当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱。 (五)根据元素周期表判断? (1)同主族元素(从上到下)? 非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强。? 氧化性、还原性强弱比较练习题 1.(2014?浦东新区一模)反应Cu2++Zn→Cu+Zn2+可在溶液中进行完全,由该反应可判断Cu2+的氧化性强于() A.Zn B.Cu C.Zn2+ D.Fe3+ 2.(2011?松江区模拟)在复杂体系中,确认化学反应先后顺序有利于解决化学问题.已知溶液中阳离子氧化性顺序为:Ag+>Fe3+>Cu2+>H+>Fe2+>Na+,下列离子反应方程式错误的是() A.2Ag++Fe→2Ag+Fe2+ B.2Fe3++Cu→Cu2++2Fe2+ C.2Fe3++3Zn→3Zn2++2Fe D.Cu2++2Na→Cu+2Na+ 3.下列对递变规律的描述正确的是() A.氧化性:Na+<K+<Rb+<Cs+ B.卤素氢化物的稳定性随核电荷数的递增依次增强 C.在卤素的氢化物中,HI的还原性最强 D.碱金属元素随核电荷数的递增,熔沸点依次升高 4.以下进行性质比较的实验,不合理的是() A.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中 B.比较氯、溴单质的氧化性:溴化钠溶液中通入氯气 C.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液 D.比较碳、硫非金属性:测定同条件同物质的量浓度的Na2CO3、Na2SO4溶液的pH 5.已知反应:①2BrO3-+Cl2=Br2+2ClO3-②ClO3-+5Cl-+6H+=3Cl2+3H2O下列物质氧化能力强弱顺序正确的是() A.ClO3->BrO3->Cl2 B.BrO3->Cl2>C1O3- C.BrO3->ClO3->Cl2 D.Cl2>BrO3->C1O3- 6.依据2Fe2++Cl2=2Fe3++2Cl,HClO+HCl=Cl2+H2O,2Fe3++Cu=2Fe2++Cu2+,Fe+Cu2+=Fe2++Cu 判断下列氧化剂的氧化性强弱顺序正确的是() A.Fe3+>HClO>Cl2>Fe2+>Cu2+ B.HClO>Cl2>Fe3+>Cu2+>Fe2+ C.Cl2>HClO>Fe3+>Cu2+>Fe2+ D.Fe3+>Cu2+>Cl2>HClO>Fe2+ 7.已知:①2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3,则下列微粒还原能力由大到小的顺序正确的是() A.Fe2+>Cl->I- B.I->Fe2+>Cl- C.I->Cl->Fe2+ D.Cl->I->Fe2+ 8.Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余依此类推.向NaBr、NaI的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得 【化学】物质氧化性、还原性强弱比较规律总结 方法归纳: 物质氧化性、还原性强弱的比较,实质上是物质得失电子难易程度的比较。即物质越 易得到电子,则其氧化性越强,越难得到电子则其氧化性越弱;反之,物质越易失去电子, 则其还原性越强,越难失去电子,则其还原性越弱。 ★越易失电子的物质,失后就越难得电子;越易得电子的物质,得后就越难失去电子。 一. 利用化合价,比较物质氧化性、还原性的强弱 由同种元素形成的不同价态物质的氧化性和还原性的强弱 规律:元素的最高价态只具有氧化性,元素的最低价态只具有还原性,元素的中 间价态既具有氧化性又具有还原性,但主要呈现一种性质。 二、依据元素周期表 1.同周期,如:Na、Mg、Al、Si、P、Cl从左到右,还原性逐渐减弱,氧化性逐渐增强。 2.同主族,从上到下,还原性逐渐增强(如:Li、Na、K、Rb、Cs),氧化性逐渐减弱(如:F、Cl、Br、I、At)。 三、利用元素活泼性的不同,比较物质氧化性、还原性的强弱 1. 对金属而言,金属越活泼(金属性越强),其单质的还原性越强,其金属阳离子的氧化性越弱。 如:对金属活动性顺序表而言:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au,其活泼性(金属性)依次减弱;单质的还原性 K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H2)>Cu> Hg>Ag>Pt>Au;离子的氧化性:K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe2+<Sn2+<Pb2+<(H+)<Cu2+<Hg2+<Ag+<Pt2+<Au+ 2.对非金属而言,非金属越活泼(非金属性越强),其非金属单质的氧化性越强,其阴离子的还原性越弱。 如:对一般的非金属活动性顺序而言:F、Cl、Br、I、S,其活泼性(其金属性)依次减弱;其单质的氧化性: F2?Cl2?Br2?I2?S;其阴离子的还原性:F-<Cl-<Br-<I-<S2-。 四、利用氧化还原反应比较物质氧化性、还原性的强弱 对一般的氧化还原反应,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。 五、根据反应条件判断 是否加热、有无催化剂及反应温度高低和反应物浓度氧化还原反应氧化性还原性强弱判断 教案
氧化还原性强弱顺序
氧化还原性强弱顺序
影响结构强度和稳定性的因素
氧化剂、还原剂强弱的比较
常见氧化剂及氧化性排序
网络量化反馈控制系统的稳定性及控制策略研究
高中常见的化学物质(分子,离子)的氧化性,还原性强弱排列
氧化性还原性强弱比较习题
基于汽车稳定性控制系统的侧翻控制策略
氧化性还原性强弱的判断方法
氧化性、还原性强弱比较练习题
【化学】物质氧化性、还原性强弱比较规律总结