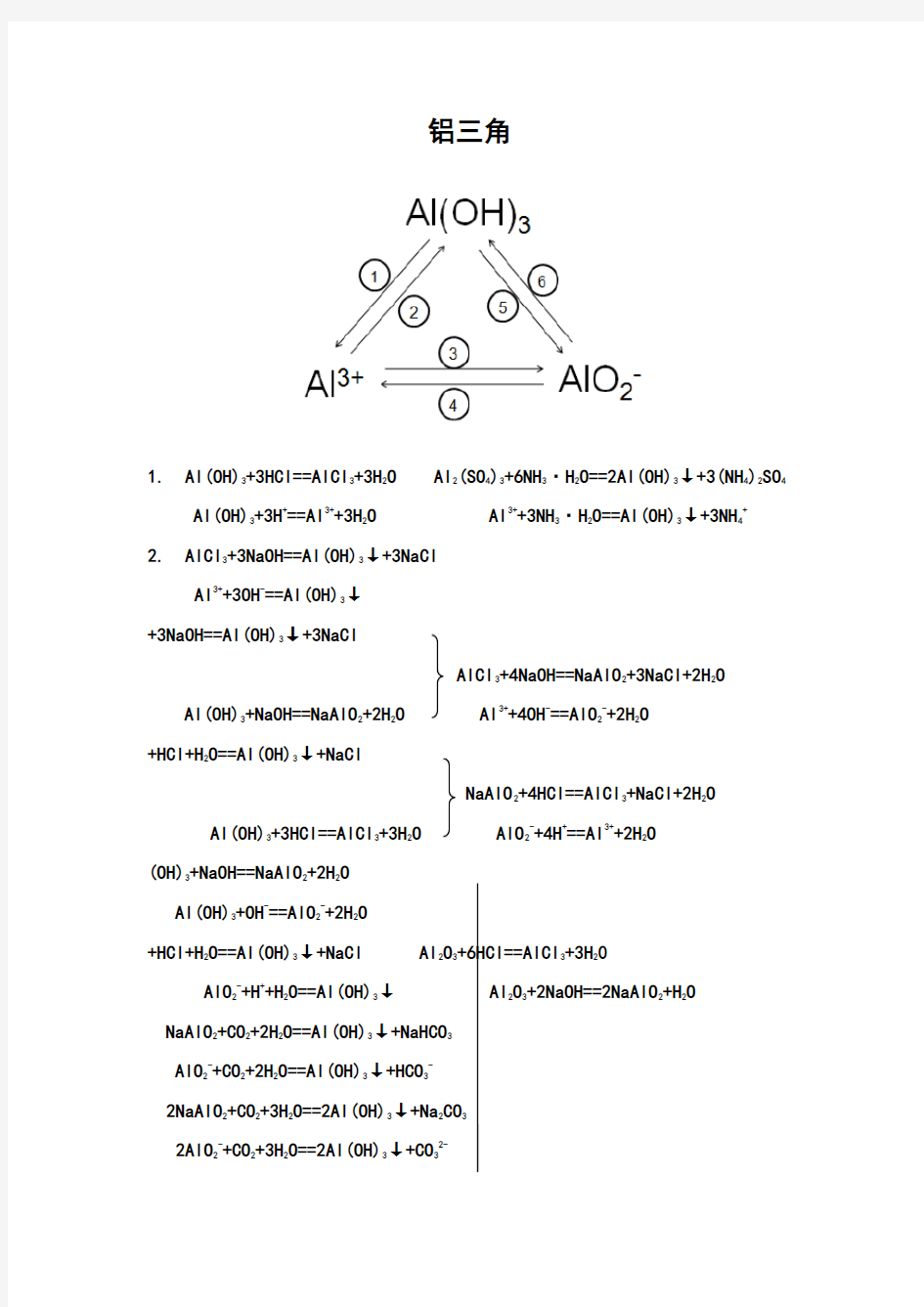

铝三角
1. Al(OH)
3+3HCl==AlCl
3
+3H
2
O Al
2
(SO
4
)
3
+6NH
3
·H
2
O==2Al(OH)
3
↓+3(NH
4
)
2
SO
4
Al(OH)
3+3H+==Al3++3H
2
O Al3++3NH
3
·H
2
O==Al(OH)
3
↓+3NH
4
+
2. AlCl
3+3NaOH==Al(OH)
3
↓+3NaCl
Al3++3OH-==Al(OH)
3
↓
+3NaOH==Al(OH)
3
↓+3NaCl
AlCl
3+4NaOH==NaAlO
2
+3NaCl+2H
2
O
Al(OH)
3+NaOH==NaAlO
2
+2H
2
O Al3++4OH-==AlO
2
-+2H
2
O
+HCl+H
2O==Al(OH)
3
↓+NaCl
NaAlO
2+4HCl==AlCl
3
+NaCl+2H
2
O
Al(OH)
3+3HCl==AlCl
3
+3H
2
O AlO
2
-+4H+==Al3++2H
2
O
(OH)
3+NaOH==NaAlO
2
+2H
2
O
Al(OH)
3+OH-==AlO
2
-+2H
2
O
+HCl+H
2O==Al(OH)
3
↓+NaCl Al
2
O
3
+6HCl==AlCl
3
+3H
2
AlO
2-+H++H
2
O==Al(OH)
3
↓Al
2
O
3
+2NaOH==2NaAlO
2
+H
2
O
NaAlO
2+CO
2
+2H
2
O==Al(OH)
3
↓+NaHCO
3
AlO
2-+CO
2
+2H
2
O==Al(OH)
3
↓+HCO
3
-
2NaAlO
2+CO
2
+3H
2
O==2Al(OH)
3
↓+Na
2
CO
3
2AlO
2-+CO
2
+3H
2
O==2Al(OH)
3
↓+CO
3
2-
铁三角
+2HCl==FeCl
2+H
2
↑2Na+2H
2
O==2NaOH+H
2
↑
Fe+2H+==Fe2++H
2↑3Fe+4H
2
O(g ) 高温Fe
3
O
4
+4H
2
+Zn==ZnCl
2+Fe Na投入到FeCl
3
溶液中
Fe2++Zn==Zn2++Fe 2Na+2H
2O==2NaOH+H
2
↑
+Cl
2==2FeCl
3
3NaOH+FeCl
3
==Fe(OH)
3
↓+3NaCl
2Fe2++Cl
2==2Fe3++2Cl- 6Na+6H
2
O+2FeCl
3
==2Fe(OH)
3
↓+6NaCl+3H
2
↑
+Fe==3FeCl
2 2Na
2
O
2
+2H
2
O == 4NaOH+O
2
↑
2Fe3++Fe==3Fe2+ 2Na
2O
2
+2CO
2
==2Na
2
CO
3
+O
2
+3Cl
2 点燃2FeCl
3
2Na
2
O
2
+4HCl==4NaCl+2H
2
O+O
2
↑
+3CO ==2Fe+3CO
2 2Al+2NaOH+2H
2
O==2NaAlO
2
+3H
2
↑
Na
2O+H
2
O==2NaOH
Na
2O+CO
2
==Na
2
CO
3
FeCl
3+3NaOH==Fe(OH)
3
↓+3NaCl Na
2
O+2HCl==2NaCl+H
2
O
FeSO
4+2NaOH==Fe(OH)
2
↓+Na
2
SO
4
2NaHCO
3
== Na
2
CO
3
+H
2
O+CO
2
↑
4Fe(OH)
2+O
2
+2H
2
O==4Fe(OH)
3
NaHCO
3
+HCl==NaCl+H
2
O+CO
2
↑
2Fe(OH)
3 ==Fe
2
O
3
+3H
2
O Na
2
CO
3
+2HCl==2NaCl+H
2
O+CO
2
↑
Fe
2O
3
+6HCl==2FeCl
3
+3H
2
0 Na
2
CO
3
+H
2
O+CO
2
==2NaHCO
3
Fe
3O
4
+8HCl==2FeCl
3
+FeCl
2
+4H
2
O NaHCO
3
+NaOH==Na
2
CO
3
+H
2
O
Na
2CO
3
+CaCl
2
==CaCO
3
↓+2NaCl
Na
2CO
3
+BaCl
2
==BaCO
3
↓+2NaCl
铁、铝化学方程式整理
一、铁
1.与O 2反应:3Fe+2O 2??→?点燃
Fe 3O 4 2.与Cl 2反应:2Fe+3Cl 2??→?点燃
2FeCl 3 3.与Br 2反应:2Fe+3Br 2??→?点燃
2FeBr 3 4.与I 2反应:Fe+I 2??→?点燃
FeI 2
5.与S 反应:Fe+S ?→?
?
FeS +Q 6.加热下与浓H 2SO 4反应:2Fe+6H 2SO 4(浓)?→?
?
2Fe 2(SO 4)3+3SO 2↑+6H 2O 7.加热下与稀HNO 3反应:Fe+4HNO 3?→?
?
Fe(NO 3)3+NO ↑+2H 2O 8.高温下与水蒸气反应:3Fe+4H 2O(g)??→?高温
Fe 3O 4+4H 2↑ 二、铁的氢氧化物 (一)Fe(OH)2
8.被氧气氧化:4Fe(OH)2+O 2+2H 2O →4Fe(OH)3 9.制取:FeSO 4+2NaOH →Na 2SO 4+Fe(OH)2↓ (二)Fe(OH)3
10.受热分解:2Fe(OH)3?→?
?
Fe 2O 3+3H 2O 11.制取:Fe 3++OH —
→Fe(OH)3↓
三、铁盐和亚铁盐 (一)Fe 2+
12.和Cl 2反应:Fe 2++ Cl 2→2Fe 3++2Cl — 13.和H 2O 2反应:2H ++2Fe 2++H 2O 2→2Fe 3++2H 2O
(二)Fe 3+
14.和Fe 反应:2Fe 3+
+Fe →3Fe 2+
15.和Cu 反应:Fe 3++Cu →Cu 2++Fe 2+ 16.和I —反应:2Fe 3++2I —→2Fe 2++I 2 17.和SCN —反应:Fe 3++3SCN —?Fe(SCN)3 四、铝
18.与Cl 2反应:2Al+3Cl 2??→?点燃
2AlCl 3
19.与S 反应:2Al+3S ?→?
?
Al 2S 3 20.与O 2反应:4Al+3O 2→2Al 2O 3(常温下生成氧化膜) 2Al+3O 2??→?点燃
2Al 2O 3(纯氧中剧烈燃烧) 21.毛刷实验:2Al+3Hg(NO 3)2→2Al(NO)3+3Hg ,4Al+3O 2→2Al 2O 3 22.与水反应:2Al+6H 2O →2Al(OH)3+3H 2↑
23.与浓HNO 3反应:Al+6HNO 3(浓)?→?
?
Al(NO 3)3+3NO 2↑+3H 2O 24.与NaOH 反应:2Al+2NaOH+2H 2O →2NaAlO 2+3H 2↑
25.铝热反应:2Al+Fe 2O 3??→
?高温
Al 2O 3+2Fe 五、氧化铝
26.与HCl 反应:Al 2O 3+6HCl →2AlCl 3+3H 2O 27.与NaOH 反应:Al 2O 3+2NaOH →2NaAlO 2+H 2O (以上相应的离子方程式对应系数相同) 六、氢氧化铝
28.酸、碱式电离:H 2O+ AlO 2—+H +?Al(OH)3?Al 3++3OH — 29.与HCl 反应:Al(OH)3+3HCl →AlCl 3+3H 2O
30.与NaOH反应:Al(OH)3+NaOH→NaAlO2+2H2O
(以上相应的离子方程式对应系数相同)
??Al2O3+3H2O
31.受热分解:2Al(OH)3?→
32.制备方法:
(1)Al3+与碱(NH3·H2O)反应:AlCl3+3NH3·H2O→Al(OH)3↓+3NH4Cl
(2)AlO2—与酸(CO2+H2O)反应:(CO2少量)2NaAlO2+CO2+3H2O→Na2CO3+2Al(OH)3↓
(CO2过量)NaAlO2+CO2+2H2O→NaHCO3+Al(OH)3↓(3)双水解反应(Al3++AlO2—):AlCl3+3NaAlO2+6H2O→4Al(OH)3↓+3NaCl
七、铝盐
33.明矾净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+
34.AlCl3与NaOH反应:
(1)向AlCl3中加NaOH:AlCl3+3NaOH→Al(OH)3↓+3NaCl(少量)
Al(OH)3+NaOH→NaAlO2+2H2O(过量)
总反应:AlCl3+4NaOH→NaAlO2+2H2O+3NaCl
(2)向NaOH中加AlCl3:AlCl3+4NaOH→NaAlO2+2H2O+3NaCl(少量)
AlCl3+3NaAlO2+6H2O→4Al(OH)3↓+3NaCl(过量)
八、偏铝酸盐
35.偏铝酸盐的水解:AlO2—+2H2O→Al(OH)3 +OH—
36.与HCl反应:
(1)向NaAlO2加HCl:NaAlO2+HCl+H2O→Al(OH)3↓+NaCl(少量)
Al(OH)3+3HCl→AlCl3+3H2O(过量)
总反应:NaAlO 2+4HCl →AlCl 3+2H 2O+NaCl
(2)向HCl 加NaAlO 2:NaAlO 2+4HCl →AlCl 3+2H 2O+NaCl (少量) AlCl 3+3NaAlO 2+6H 2O →Al(OH)3↓+3NaCl (过量) 37.总结:Al 3+?碱
强酸
Al(OH)3?强碱
酸
AlO 2—
高 中 化 学 重 要 知 识 点 一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2
和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。石炭酸:苯酚蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6果糖:C6H12O6蔗糖:C12H22O11麦芽糖:C12H22O11淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。 二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。Fe2+——浅绿色Fe3O4——黑色晶体Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀Fe (SCN)3——血红色溶液 FeO——黑色的粉末Fe (NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体 铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O ——蓝色Cu2 (OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液 BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉淀 Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色 Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀 AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体 SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体 三、现象: 1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的; 2、Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红) 3、焰色反应:Na 黄色、K紫色(透过蓝色的钴玻璃)、Cu 绿色、Ca砖红、Na+(黄色)、K+(紫色)。 4、Cu丝在Cl2中燃烧产生棕色的烟; 5、H2在Cl2中燃烧是苍白色的火焰; 6、Na在Cl2中燃烧产生大量的白烟; 7、P在Cl2中燃烧产生大量的白色烟雾; 8、SO2通入品红溶液先褪色,加热后恢复原色; 9、NH3与HCl相遇产生大量的白烟;10、铝箔在氧气中激烈燃烧产生刺眼的白光; 11、镁条在空气中燃烧产生刺眼白光,在CO2中燃烧生成白色粉末(MgO),产生黑烟; 12、铁丝在Cl2中燃烧,产生棕色的烟;13、HF腐蚀玻璃:4HF + SiO2 =SiF4 + 2H2O 14、Fe(OH)2在空气中被氧化:由白色变为灰绿最后变为红褐色; 15、在常温下:Fe、Al 在浓H2SO4和浓HNO3中钝化; 16、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色;苯酚遇空气呈粉红色。 17、蛋白质遇浓HNO3变黄,被灼烧时有烧焦羽毛气味; 18、在空气中燃烧:S——微弱的淡蓝色火焰H2——淡蓝色火焰H2S——淡蓝色火焰 CO——蓝色火焰CH4——明亮并呈蓝色的火焰S在O2中燃烧——明亮的蓝紫色火焰。 19.特征反应现象: 20.浅黄色固体:S或Na2O2或AgBr 21.使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色) 22.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色) 有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3] 黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)蓝色[Cu(OH)2] 黄色(AgI、Ag3PO4)白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3] 有色气体:Cl2(黄绿色)、NO2(红棕色) 四、考试中经常用到的规律:
高中化学高中化学三角 关系总结 文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-
中学化学中的三角关系 中学化学中的三角形关系比较多,掌握这些三角形关系有助于我们对化学知识有一个系统的认识,有助于对物质之间的转化记忆。现对中学化学中出现的三角形关系总结如下,供大家参考。 一、 元素周期表中的“构-位-性”三角关系: 知道原子结构决定元素性质,元素性质反映原子结构;由原子结构可推出元素在周期表中的位置,知道元素在周期表中的位置也可以画出原子结构示意图;知道元素在周期表中位置关系可推测元素性质的递变规律,知道元素性质的递变规律,也可推测元素在周期表中位置关系。 二、 化学计算中几个物理量之间的关系: 三、 物质之间的三角形转化关系: 1、 钠及其化合物之间的转化 2Na + O 2 点燃 Na 2O 2 2Na + 2H 2O == 2NaOH + H 2↑ 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ 2NaOH +CO 2 ==Na 2CO 3 + H 2O NaOH +CO 2==NaHCO 3 NaHCO 3 +Ca(OH)2 ==CaCO 3↓+ NaOH + H 2O 2NaHCO 3 △ Na 2CO 3 + H 2O Na 2CO 3 + H 2O + CO 2==NaHCO 3 Na 2CO 3 + Ca(OH)2 == 2NaOH + CaCO 3↓ 2、 钙的化合物之间的转化
Ca(OH)2 + CO 2 == CaCO 3↓+ H 2O CaCO 3 高温 CaO + CO 2↑ CaO + CO 2 ==CaCO 3 CaO + H 2O== Ca(OH)2 3、 铝及其化合物之间的转化 2Al + 6H + == 2Al 3+ + 3H 2↑ 2Al + OH - + H 2O== 2AlO 2- + 3H 2↑ Al 3+ +4OH -== AlO 2- + 2H 2O Al 3+ +3OH -== Al(OH)3↓ AlO 2- + 4H + == Al 3+ + 2H 2O AlO 2- + H + + H 2O == Al(OH)3↓ Al(OH)3 + 3H + == Al 3+ + 3H 2O Al(OH)3 + OH - == AlO 2- + 2H 2O Al(Ⅲ)的三种形态在水中存在的量与溶液的pH 的关系如图所示: 4、 碳及其化合物之间的转化关系: Ca(OH)2 CaCO 3 CaO 7 Al AlO 2 - Al(OH ) Al 3+ 14 3
铁三角化学方程式专项练习 1.铁在氯气中燃烧; 2.铁在氧气中燃烧______________________________________________; 3.铁和稀盐酸反应; 4.氯化亚铁溶液中通入氯气; 5.氯化铁溶液加入铁粉; 6.铜粉投入氯化铁溶液中; 7.铝和氧化铁发生铝热反应; 8.铁和水蒸气____________________________________________________________ 9.铁在空气中腐蚀_______________________________________________________ 10.氢氧化铁胶体的制备____________________________________________________ __________________________________________________________________________ 11.铁和浓硫酸____________________________________________________________ _________________________________________________________________________ 12.浓硝酸和氧化亚铁_____________________________________________________ _________________________________________________________________________
“ 铝 三 角” 的 图 像 分 析 及 计 算 知识点一、铝三角 1、三角关系:A|3+、AI(0H )3与AIO 2—相互转化的关系 Al * AO 2、铝三角的应用 ① 制取AI(OH )3 常用弱碱与可溶的铝盐反应: A|3+ + 3NH 3 ? HO == AI(OH) 3; +3NM 也可以用偏铝酸盐与弱酸反应: AIO 2- + CQ + 2H 20 == AI(OH) 3 ; + CQ 2- 知识点二、铝的化合物的有关图象 1、基本图象 ①向铝盐溶液中逐滴滴加强碱性溶液直至过量 水又是怎样的图像? 现象:先产生沉淀,后沉淀消失。 AI 3+ + 30H - = AI(OH) 3; 离子方程式: AI(OH) 3 + OH = AIO 2- +2HO 如若将强碱性溶液换成氨水又是怎样的图像? ③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量 通入CO )又是怎样的图像? 现象: 离子方程式: 2、基本图象的拓展 ①过量O H ②过量H + ⑥0H AI(OH) 3 如若将强碱性溶液换成氨 现象: 将强酸溶液换成弱酸(如 现象: 离子方程式:
①若AICI 3溶液中混有MgC 2,向此溶液中逐滴滴加NaOH 溶液直至过量,发生了什么 反应?图象是怎样的? 现象:开始产生沉淀,之后沉淀部分溶解 写出涉及的离子方程式: M 6+ + 2OH 丄 Mg (OH )2; AI + 3OH — = AI(OH) 3; AI(OH) 3 + OH — = AIO 2— +2HO ② 若AICI 3溶液中除混有外 MgC 2,还混有盐酸,向此 溶液中逐滴滴加NaOH 溶液直至过量,发生的反应有何 不同,图象有什么样的变化? 现象:开始无沉淀,之后产生沉淀,之后沉淀部 分溶解 Mf + 2OH — = Mg (OH )2; AI 3+ + 3OH — = AI(OH) 3; AI(OH) 3 + OH — = AIO 2— +2HO ③ 若AICI 3溶液中除混有MgC 2和盐酸外,还混有NHCI ,向此溶液中逐滴滴加NaOH 溶液直至过量,发生的反应又有何不同,图象又有什么样的变化? 加适量水溶解,再加入KOH 容液,析出 现象: 离子方程式: Mc j + + 2OH — = Mg (OH )2; H + + OH — = H O f W
无机框图推断题剖析 [题型示例] [20XX年全国卷II28题15分]以下一些氧化物和单质 之间可发生如右图所示的反应:其中,氧化物(Ⅰ)是红 棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是 气体。 ⑴氧化物(Ⅰ)的化学式(分子式)是。 氧化物(Ⅱ)的化学式(分子式)是。 ⑵反应①的化学方程式是。 反应②的化学方程式是。 反应③的化学方程式是。 [考况简析] 框图推断题,是高考的必考题。考得最多的一年是1995年,考查了2个无机框图推断和1个有机框图推断,共计19分,其余每年都考了1-2个框图推断题,分值都在6-16分左右。 [考查目标] 既考查了以元素及其化合物知识为主要载体的有关基础知识,又考查了学生的基本概念、基本理论、化学实验及化学计算等基础知识,同时也考查了学生的观察、阅读、归纳、分析、推理等综合能力。 [解答方法] 信典倒顺法 第一步——分析信息:析准、析全题中的所有信息。涉及物质性质或结构的信息,要能以元素周期表为线索搜索出物质或物质范围,如既不溶于水也不溶于稀HNO3的白色沉淀有ⅦA-AgCl、ⅪA-BaSO4、ⅣA-H4SiO4;涉及化学反应的要弄清楚旧键的断裂和新键的形成,并注意把握住反应条件和转化的关系。 第二步——抓住典型:抓住典型已知物或典型已知条件或典型转化关系或典型定量数据等,并以其为突破口。 第三步——倒顺推断:在突破口的基础上或倒推或顺推,以推断出有关物质。 第四步——扣问作答:在推断结果的基础上紧扣题问进行作答。 [例题解析] 第一步——分析信息:氧化物(Ⅰ)是红棕色固体==> Ⅰ为Fe2O3;氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下(高温)都是气体==> Ⅱ、Ⅲ、Ⅳ为SO2、SO3、NO、NO2、CO、CO2、H2O 第二步——抓住典型:Ⅰ- Fe2O3 第三步——倒顺推断:顺推:氧化物Ⅰ(Fe2O3)+ 氧化物Ⅱ→ 单质Ⅰ+ 氧化物Ⅳ ==> 氧化物Ⅱ- CO、单质Ⅰ- Fe、氧化物Ⅳ- CO2;顺推:氧化物Ⅱ(CO)+ 氧化物Ⅲ→ 单质Ⅱ+ 氧化物Ⅳ(CO2) ==> 氧化物Ⅲ- H2O、单质Ⅱ- H2;倒推:单质Ⅱ(H2)+ 氧化物Ⅱ(CO)← 氧化物Ⅲ(H2O)+ 单质Ⅲ ==> 单质Ⅲ- C 第四步——扣问作答:⑴氧化物(Ⅰ)的化学式(分子式)是Fe2O3;氧化物(Ⅱ)的化学式(分子式)是CO 。⑵反应①:Fe2O3 + 3CO 高温2Fe + 3CO2;反应②:CO + H2O 高温CO2 + H2;反应③:C + H2O 高温CO + H2。 [归纳小结] ①熟练解题方法;②熟悉元素及其化合物知识;③在搜索物质范围时一定要以元素周期表为线索进行系统搜索;④有的考题的信息会在提问里面,所以,考生要注意通读试题后再来做题更好,不要急于求成。 [规律总结] 一、特征结构
2Al+3O2=2Al2O3 点燃 2Al+3Cl2 =2AlCl3 点燃 2Al+3Br2=2AlBr3 2Al +2NaOH +2H2O =2NaAlO2+3H2 2Al+Fe2O3=Al2O3+2Fe 高温 4Al+3MnO2=2Al2O3 +3Mn 高温 2Al+3H2SO4=Al2(SO4)2+3H2 2Al+6HCl =3AlCl3+3H2 4Al2O3=4Al +3O2 通电 Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3+2NaOH=2NaAlO2+H2O Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+NaOH =NaAlO2+2H2O Al2(SO4)3+=2Al(OH)3+3(NH4)2SO4 2Al(OH)3=Al2O3+3H2O Δ NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3 NaAlO2+4HCl=AlCl3+2H2O NaAlO2 +HCl +H2O =NaCl +Al(OH)3 NaAlO2+NaHCO3+H2O =Na2CO3 +Al (OH)3 AlCl3+3NaAlO2+6H2O =4Al(OH)3+3NaCl Al2(SO4)3+6NaHCO3 =2Al(OH)3 +6CO2 +H2O+3Na2SO4 注:NaAlO2有的版本写为:Na[Al(OH)4];生成物有气体而反应物无气体的要标上气标。也很好改写,需注意的是Al2O3、Al、气体等难溶物不能拆成离子形式参考资料:部分修改自百度贴吧 【铝三角】 ①AlCl3 -> Al(OH)3 AlCl3 + 3NaOH == Al(OH)3↓ + 3NaCl Al(3+) + 3OH- == Al(OH)3↓ ②Al(OH)3 -> AlCl3 Al(OH)3 + 3HCl == AlCl3 +3H2O Al(OH)3 + 3H+ == Al(3+) + 3H2O ③Al(OH)3 -> NaAlO2 Al(OH)3 + NaOH == NaAlO2 + H2O Al(OH)3 + OH- == AlO2(-) + H2O ④NaAlO2 -> Al(OH)3 NaAlO2 + HCl +H2O == NaCl + Al(OH)3↓ AlO2(-) + H+ + H2O == Al(OH)3↓ ⑤Al(OH)3 -> Al2O3
高三化学总复习――金属及其化合物知识点总结 5.18一.金属的通性 1.位置:金属元素位于周期表的左下角,最外层电子数大部分少于4个。 2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。 3.化学性质:易失电子,被氧化,金属表现还原性。 4.钠、铝、铁、铜单质的重要性质 钠铝铁铜 与非金属单质O24Na+O2=2Na2O O2+2Na Na2O2 4Al+3O22Al2O33Fe+2O2Fe3O42Cu+O2 2CuO Cl22Na+Cl22NaCl 2Al+3Cl22AlCl32Fe+3Cl22FeCl3 Cu+Cl2 CuCl2 S 2Na+S Na 2 S 2Al+3S Al2S3Fe+S FeS 2Cu+S Cu2S H2O 2Na+2H2O=2NaOH+H2↑2Al+6H 2 O 2Al(OH)3+3H2↑3Fe+4H2O Fe3O4+4H2 不反应 HCl溶液2Na+2HCl=2NaCl+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑不反应NaOH溶液与水反应2Al+2NaOH+2H2O= 2NaAlO2+3H2↑ 不反应不反应 CuSO4溶液2Na+2H2O+CuSO4= Na2SO4+Cu(OH)2↓+H2↑ 较复杂较复杂不反应 制备 2NaCl 2Na+Cl2↑2Al2O34Al+3O2↑Fe2O3+3CO 2Fe+3CO2 CuO+CO Cu+CO2 二.钠及其化合物 1.钠 ⑴钠的物理性质 状态颜色硬度密度熔点导电、导热性 固体银白色较小(比水大)较小(比水小)较低(用酒精灯加热,很快 熔化) 是电和热的良导体 ⑵钠的化学性质 ①钠与非金属单质的反应 A:与氧气:4Na+O2=2Na2O(变暗);O2+2Na Na2O2(燃烧生成淡黄色固体) B:与氯气:2Na+Cl22NaCl; C:与S:2Na+S Na2S ②钠与水的反应(水中先滴入酚酞) 2Na+2H2O=2NaOH+H2↑ 现象概述现象描述原因浮浮在水面钠的密度比水小 游四处游动钠与水反应产生气体 熔融化成银白色小球钠的熔点较低,且该反应放出大量热响发出咝咝的响声钠与水反应剧烈 红溶液由无色变为红色生成了碱性物质
高中化学选修3知识点总结 二、复习要点 1、原子结构 2、元素周期表和元素周期律 3、共价键 4、分子的空间构型 5、分子的性质 6、晶体的结构和性质 (一)原子结构 1、能层和能级 (1)能层和能级的划分 ①在同一个原子中,离核越近能层能量越低。 ②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。 ③任一能层,能级数等于能层序数。 ④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。 ⑤能层不同能级相同,所容纳的最多电子数相同。 (2)能层、能级、原子轨道之间的关系 每能层所容纳的最多电子数是:2n2(n:能层的序数)。 2、构造原理 (1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。 (2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。 根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。 (5)基态和激发态 ①基态:最低能量状态。处于最低能量状态的原子称为基态原子。 ②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。 ③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。 3、电子云与原子轨道 (1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们用“电子云”模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的概率密度分布,是核外电子运动状态的形象化描述。 (2)原子轨道:不同能级上的电子出现概率约为90%的电子云空间轮廓图称为原子轨道。s电子的原子轨道呈球形对称,ns能级各有1个原子轨道;p电子的原子轨道呈纺锤形,n p能级各有3个原子轨道,相互垂直(用p x、p y、p z表示);n d能级各有5个原子轨道;n f能级各有7个原子轨道。 4、核外电子排布规律 (1)能量最低原理:在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。 (2)泡利原理:1个原子轨道里最多只能容纳2个电子,且自旋方向相反。 (3)洪特规则:电子排布在同一能级的各个轨道时,优先占据不同的轨道,且自旋方向相同。 (4)洪特规则的特例:电子排布在p、d、f等能级时,当其处于全空、半充满或全充满时,即p0、d0、f0、p3、d5、f7、p6、d10、f14,整个原子的能量最低,最稳定。 能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。 电子数 (5)(n-1)d能级上电子数等于10时,副族元素的族序数=n s能级电子数 (二)元素周期表和元素周期律 1、元素周期表的结构 元素在周期表中的位置由原子结构决定:原子核外的能层数决定元素所在的周期,原子的价电子总数决定元素所在的族。 (1)原子的电子层构型和周期的划分 周期是指能层(电子层)相同,按照最高能级组电子数依次增多的顺序排列的一行元素。即元素周期表中的一个横行为一个周期,周期表共有七个周期。同周期元素从左到右(除稀有气体外),元素的金属性逐渐减弱,非金属性逐渐增强。 (2)原子的电子构型和族的划分 族是指价电子数相同(外围电子排布相同),按照电子层数依次增加的顺序排列的一列元素。即元素周期表中的一个列为一个族(第Ⅷ族除外)。共有十八个列,十六个族。同主族周期元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。 (3)原子的电子构型和元素的分区 按电子排布可把周期表里的元素划分成5个区,分别为s区、p区、d区、f区和ds区,除ds区外,区的名称来自按构造原理最后填入电子的能级的符号。 2、元素周期律
序号①②③④⑤⑥其他 铝三角 ③ Al3+ +4OH — AlO2- +4H + + + 3H+ ⑥ + H ①② ⑤④ +3OH —+OH — Al(OH) 3 化学方程式离子方程式AlCl 3+3NaOH==Al(OH) 3↓ +3NaCl Al 3++3OH -==Al(OH) 3↓ Al (SO ) +6NH ·H O==2Al(OH)↓ +3(NH)SO Al3++3NH·H O==Al(OH)+ 2 4 332 3 4 243234 Al(OH) 322 O Al(OH) 3-2 - 2 +NaOH==NaAlO+2H+OH ==AlO+2H O AlCl 3+4NaOH==NaAlO 2+3NaCl+2H 2O Al 3++4OH -==AlO 2-+2H 2O NaAlO 2 +HCl+H 23 ↓ +NaCl AlO 2-+23 O==Al(OH)+H+H O==Al(OH)↓ 22(足量) +2H 2 O==Al(OH) 3 ↓ 3 AlO 2 - +CO 2 +2H 2 O==Al(OH) 33 -NaAlO +CO+NaHCO↓ +HCO 2NaAlO 2+CO 2(不足) +3H 2O==2Al(OH) 3↓ +Na2CO32AlO - +CO 2+3H 2O==2Al(OH) 2- 23 ↓+CO3 Al(OH) 3+3HCl==AlCl 3+3H2O Al(OH)3+3H+==Al3++3H2O NaAlO 232 O AlO 2 - +4H + ==Al 3+2 +4HCl==AlCl+NaCl+2H+2H O Al 2 O3+6HCl==AlCl3+3H 2O Al 2O3+6H + == 2Al 3+ +3H 2O Al 2O3+2NaOH==2NaAlO2+H2O Al 2O3+2OH - ==2AlO 2-+H2 O AlCl 3 +3NaAlO 223 ↓Al 3+2 - +6H 2 O==4Al(OH) 3 ↓+6H O==4Al(OH)+3AlO
铝三角涉及反应 (1) 2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2 (2) 4Al + 3O2 === 2Al2O3(条件:点燃) [2Al + Fe2O3 === Al2O3 + 2Fe(条件:高温)] (3) 2Al2O3 === 4Al + 3O2↑(条件:电解) (4) 2Al + 3Cl2 === 2AlCl3(条件:点燃) [2Al + 6HCl === 2AlCl3 + 3H2↑] (5) Al2O3 + 2NaOH === 2NaAlO2 + H2O (6) Al2O3 + 6HCl === 2AlCl3 + 3H2O (7) NaAlO2 + HCl + H2O === NaCl + Al(OH)3 ↓ (8) Al(OH)3 + NaOH === NaAlO2 + 2H2O (9) 2Al(OH)3 === Al2O3 + 3H2O(条件:加热) (10)Al(OH)3 + 3HCl === AlCl3 + 3H2O (11)AlCl3 + 3NH3.H2O === Al(OH)3 ↓+ 3NH4Cl [AlCl3 + 3NaOH === Al(OH)3 ↓ + 3NaCl]
(12) NaAlO2 + 4HCl(过) === AlCl3 + NaCl + 2H2O (13)AlCl3+ 3 NaAlO2+ 6 H2O====4 Al(OH)3↓+3NaCl (14)Al2(SO4)3+ 6 NaHCO3==== 2 Al(OH)3↓+ 3 Na2SO4+ 6 CO2↑ (15)2NaAlO2+ CO2(少量)+ 3 H2O ==== 2 Al(OH)3↓+ N a2CO3 (16)NaAlO2+ CO2(过量)+ 2H2O ==== Al(OH)3↓+ NaHCO3 离子方程式: 1 Al3+ + 3OH- = Al(OH)3 ↓ 2 Al(OH) 3 + 3H+ = Al3+ + 3H2O 3 Al(OH)3 + OH- = AlO2- + 2H2O 4 AlO2- + H+ + H2O = Al(OH)3 ↓ 5 Al3+ + 4OH- = AlO2- + 2H2O 6 AlO2-+ 4H+ = Al3+ + 2H2O 2Al+3O2=2Al2O3 点燃 2Al+3Cl2 =2AlCl3 点燃 2Al+3Br2=2AlBr3
化学中的三角关系 中学化学中的三角形关系比较多,掌握这些三角形关系有助于我们对化学知识有一个系统的认识,有助于对物质之间的转化记忆。现对中学化学中出现的三角形关系总结如下,供大家参考。 一、 元素周期表中的“构-位-性”三角关系: 知道原子结构决定元素性质,元素性质反映原子结构;由原子结构可推出元素在周 期表中的位置,知道元素在周期表中的位置也可以画出原子结构示意图;知道元素在周期表中位置关系可推测元素性质的递变规律,知道元素性质的递变规律,也可推测元素在周期表中位置关系。 二、 化学计算中几个物理量之间的关系: 三、 物质之间的三角形转化关系: 1、 钠及其化合物之间的转化 c n V m N ÷M ×M ÷(M·V aq ) ×(M·V aq ) ×V aq ÷V aq ÷V m ×V m ÷N a ÷N a V aq ×M÷V m ÷M×V m ×N a V aq ÷V m ×N a ×V m ÷N a ×N a
2Na + O 2 点燃 Na 2O 2 2Na + 2H 2O == 2NaOH + H 2↑ 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ 2NaOH +CO 2 ==Na 2CO 3 + H 2O NaOH +CO 2==NaHCO 3 NaHCO 3 +Ca(OH)2 ==CaCO 3↓+ NaOH + H 2O 2NaHCO 3 △ Na 2CO 3 + H 2O Na 2CO 3 + H 2O + CO 2==NaHCO 3 Na 2CO 3 + Ca(OH)2 == 2NaOH + CaCO 3↓ 2、 钙的化合物之间的转化 Ca(OH)2 + CO 2 == CaCO 3↓+ H 2O CaCO 3 高温 CaO + CO 2↑ CaO + CO 2 ==CaCO 3 CaO + H 2O== Ca(OH)2 3、 铝及其化合物之间的转化 2Al + 6H + == 2Al 3+ + 3H 2↑ 2Al + OH - + H 2O== 2AlO 2- + 3H 2↑ Al 3+ +4OH -== AlO 2- + 2H 2O Al 3+ +3OH -== Al(OH)3↓ AlO 2- + 4H + == Al 3+ + 2H 2O AlO 2- + H + + H 2O == Al(OH)3↓ Al(OH)3 + 3H + == Al 3+ + 3H 2O Al(OH)3 + OH - == AlO 2- + 2H 2O Ca(OH)2 CaCO 3 CaO Al AlO 2- Al(OH)3 Al 3+
镁、铝及其化合物知识点整理 Ⅰ.课标要求 1.通过海水制镁的事例了解镁及化合物的性质. 2.通过合金材料了解铝及化合物的性质. 3.能列举合金材料的重要应用. Ⅱ.考纲要求 1.掌握镁铝及化合物的性质. 2.了解镁铝及化合物在生活.生活中的应用. Ⅲ.教材精讲 一.Mg、Al的化学性质 1.与非金属反应 (1)与O2反应:常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、 铝都有抗腐蚀的性能。镁能在空气中燃烧:2Mg+O 22MgO ,铝在纯氧中燃烧:4Al+ 3O 22Al2O3 (2)与卤素单质、硫等反应:Mg+ Cl 2MgCl2 2Al+ 3Cl 22AlCl3 2Al+ 3S Al2S3 (用于工业制备)Mg+ S MgS [特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。镁在空气中燃烧时有三个反应发生:2Mg+O 22MgO 3Mg+N 2Mg3N22Mg+CO 22MgO+C ②燃烧时都放出大量的热,发出耀眼的白光。利用镁的这种性质来制造照明弹。 ③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。 2.与H2O反应
Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气 Mg+2H 2O(沸水)Mg(OH)2+H2↑2A1+6H2O2A1(OH)3+3H2↑ 3.与酸反应置换出H2 Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2SO4,冷浓硝酸中发生钝化现象。所以可用铝制容器贮存冷的浓硫酸或浓硝酸。 4.与某些氧化物反应 (1)镁与二氧化碳反应:2Mg+CO 22MgO+C [特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。 (2)铝热反应:2Al+ Fe2O32Fe+ Al2O3 铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。 [特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、MnO2等。 ②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。 ③要使用没有氧化的铝粉,氧化铁粉末要烘干。 ④KClO3作为引燃剂,也可以用Na2O2代替。实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。 5.与碱反应 镁不与碱反应,铝与碱液反应:2Al+2NaOH+6H 2O2NaAlO2+4H2O+3H2↑ 简写:2Al+2NaOH+2H 2O2NaAlO2+3H2↑ 二.氢氧化铝 1.物理性质:A l(O H)3是几乎不溶于水的白色胶状固体,具有吸附性。 2.化学性质
① 过量OH — ②过量H + ③H + ④OH — ⑤H + ⑥OH — “铝三角”的图像分析及计算 知识点一、铝三角 1、三角关系:Al 3+、Al(OH)3与AlO 2— 相互转化的关系 2、铝三角的应用 ①制取Al(OH)3 常用弱碱与可溶的铝盐反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+ 也可以用偏铝酸盐与弱酸反应:AlO 2- + CO 2 + 2H 2O == Al(OH)3↓+ CO 32- 知识点二、铝的化合物的有关图象 1、基本图象 ①向铝盐溶液中逐滴滴加强碱性溶液直至过量 如若将强碱性溶液换成氨水又是怎样的图像? 现象:先产生沉淀,后沉淀消失。 现象: Al 3+ + 3OH - = Al(OH)3↓ 离子方程式: Al(OH)3 + OH - = AlO 2- +2H 2O 如若将强碱性溶液换成氨水又是怎样的图像? ③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量 将强酸溶液换成弱酸(如通入CO 2)又是怎样的图像? 现象: 现象: 离子方程式: 离子方程式: Al 3+ Al(OH)3 AlO 2—
2、基本图象的拓展 ①若AlCl 3溶液中混有MgCl 2,向此溶液中逐滴滴加NaOH 溶液直至过量,发生了什么反应?图象是怎样的? 现象:开始产生沉淀,之后沉淀部分溶解 写出涉及的离子方程式: Mg 2+ + 2OH - = Mg (OH)2↓ Al 3+ + 3OH - = Al(OH)3↓ Al(OH)3 + OH - = AlO 2- +2H 2O ②若AlCl 3溶液中除混有外MgCl 2,还混有盐酸,向此溶液中逐滴滴加NaOH 溶液直至过量,发生的反应有何不 同,图象有什么样的变化? 现象:开始无沉淀,之后产生沉淀,之后沉淀部 分溶解 H + + OH - = H 2O Mg 2+ + 2OH - = Mg (OH)2↓ Al 3+ + 3OH - = Al(OH)3↓ Al(OH)3 + OH - = AlO 2- +2H 2O ③若AlCl 3溶液中除混有MgCl 2和盐酸外,还混有NH 4Cl ,向此溶液中逐滴滴加NaOH 溶液直至过量,发生的反应又有何不同,图象又有什么样的变化? 现象: 离子方程式: H + + OH - = H 2O Mg 2+ + 2OH - = Mg (OH)2↓ Al 3+ + 3OH - = Al(OH)3↓ NH 4+ + OH - NH 3·H 2O Al(OH)3 + OH - = AlO 2- +2H 2O 【变式训练1】Al 2(SO 4)3和MgSO 4混和, 加适量水溶解,再加入KOH 溶液,析出 的沉淀量(W)与KOH 溶液体积(V)的关系如图, 则Al 2(SO 4)3和MgSO 4的物质的量之比是 A . 2:1 B . 1:2 C . 1:1 D . 1:3 【典型例题】 例1 向30 mL 1 mol·L -1 的AlCl 3溶液中逐渐加入浓度为4 mol·L -1 的NaOH 溶液,若产生0.78 g 白色沉淀,则加入的NaOH 溶液的体积可能为 ( ) A .3 mL B .7.5 mL C .15 mL D .17.5 mL
选修三物质结构与性质总结 一.原子结构与性质. 1、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度 越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子 层.原子由里向 外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用 s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f 轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述 .在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具 有较低的能量和较大的稳定性.如24Cr[Ar]3d54s1、29Cu[Ar]3d104s1. (3).掌握能级交错1-36号元素的核外电子排布式. ns<(n-2)f<(n-1)d 铝三角 1. Al(OH) 3+3HCl==AlCl 3 +3H 2 O Al 2 (SO 4 ) 3 +6NH 3 ·H 2 O==2Al(OH) 3 ↓+3(NH 4 ) 2 SO 4 Al(OH) 3+3H+==Al3++3H 2 O Al3++3NH 3 ·H 2 O==Al(OH) 3 ↓+3NH 4 + 2. AlCl 3+3NaOH==Al(OH) 3 ↓+3NaCl Al3++3OH-==Al(OH) 3 ↓ 3.AlCl 3+3NaOH==Al(OH) 3 ↓+3NaCl AlCl 3+4NaOH==NaAlO 2 +3NaCl+2H 2 O Al(OH) 3+NaOH==NaAlO 2 +2H 2 O Al3++4OH-==AlO 2 -+2H 2 O 4.NaAlO 2+HCl+H 2 O==Al(OH) 3 ↓+NaCl NaAlO 2+4HCl==AlCl 3 +NaCl+2H 2 O Al(OH) 3+3HCl==AlCl 3 +3H 2 O AlO 2 -+4H+==Al3++2H 2 O 5.Al(OH) 3+NaOH==NaAlO 2 +2H 2 O Al(OH) 3+OH-==AlO 2 -+2H 2 O 6.NaAlO 2+HCl+H 2 O==Al(OH) 3 ↓+NaCl Al 2 O 3 +6HCl==AlCl 3 +3H 2 AlO 2-+H++H 2 O==Al(OH) 3 ↓Al 2 O 3 +2NaOH==2NaAlO 2 +H 2 O NaAlO 2+CO 2 +2H 2 O==Al(OH) 3 ↓+NaHCO 3 AlO 2-+CO 2 +2H 2 O==Al(OH) 3 ↓+HCO 3 - 2NaAlO 2+CO 2 +3H 2 O==2Al(OH) 3 ↓+Na 2 CO 3 2AlO 2-+CO 2 +3H 2 O==2Al(OH) 3 ↓+CO 3 2- 高三化学总复习――金属及其化合物知识点总结 5.18 一.金属的通性1.位置:金属元素位于周期表的左下角,最外层电子数大部分少于4个。 2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。 3.化学性质:易失电子,被氧化,金属表现还原性。 4.钠、铝、铁、铜单质的重要性质 钠铝铁铜 与非 O2 4Na+O 2= 2Na2 O 4Al+3O 2 2Al 2O3 3Fe+2O2 Fe3 O4 2Cu+O 2 2CuO 金属O 2+2Na Na 2O2 单质 Cl 2 2Na+Cl 2 2NaCl 2Al+3Cl 2 2AlCl 3 2Fe+3Cl 2 2FeCl3 Cu+Cl 2 CuCl 2 S 2Na+S Na2 S 2Al+3S Al 2S3 Fe+S FeS 2Cu+S Cu2S H 2O 2Na+2H 2O=2NaOH+H 2↑2Al+6H2O 3Fe+4H 2O 不反应 2Al(OH) 3 +3H 2↑Fe3O4+4H 2 HCl 溶液2Na+2HCl = 2NaCl+H 2↑2Al+6HCl = 2AlCl 3+3H 2↑Fe+2HCl = FeCl 2+H 2↑不反应 NaOH 溶液与水反应2Al+2NaOH+2H 2O=不反应不反应 CuSO 4溶液 2Na+2H 2O+CuSO 4=2NaAlO 2+3H 2↑ 较复杂较复杂不反应 Na2 SO4+Cu(OH) 2↓ +H2↑ 制备 2NaCl 2Na+Cl 2↑2Al 2O3 4Al+3O 2↑Fe2O3+3CO CuO+CO 2Fe+3CO 2 Cu+CO 2 二.钠及其化合物 1.钠 ⑴钠的物理性质 状态颜色硬度密度熔点导电、导热性 固体银白色较小 ( 比水大)较小 ( 比水小)较低(用酒精灯加热,很快 是电和热的良导体熔化) ⑵钠的化学性质 ①钠与非金属单质的反应 A:与氧气: 4Na+O 2= 2Na2O( 变暗 ) ; O2+2Na Na2O2( 燃烧生成淡黄色固体 ) B:与氯气: 2Na+Cl 2 2NaCl ; C:与 S: 2Na+S Na2S ②钠与水的反应(水中先滴入酚酞) 2Na+2HO=2NaOH+H↑ 现象概述现象描述原因浮浮在水面钠的密度比水小 游四处游动钠与水反应产生气体 熔融化成银白色小球钠的熔点较低,且该反应放出大量热响发出咝咝的响声钠与水反应剧烈 红溶液由无色变为红色生成了碱性物质 ③钠与酸的反应:2Na+2H += 2Na++H 2↑铝三角铁三角化学方程式总结(修改版)
高三一轮复习金属及其化合物知识点的总结.doc