阿片类镇痛药=最实用
- 格式:wps
- 大小:281.23 KB
- 文档页数:16

第二节吗啡吗啡为纯天然阿片类生物碱。
1806年德国化学家F.W.A.Serturner从鸦片中提出纯品吗啡;1847年Knorr确定其分子式;上世纪20年代初J.M.Gulland和R.Robinson提出吗啡的化学结构;1952年M.Gates和G.Tschudi人工合成了吗啡,才正式确定了其化学结构。
虽历经一百余年,吗啡仍然是目前使用最为广泛的阿片类药物之一,因其止痛效果确切、价格低廉而被世界卫生组织(WHO)推荐为阿片类镇痛药物的标准用药,通常也作为其他阿片类药物临床评估的参考。
化学结构:分子式:C17H19NO3分子量:285.37一、药动学吗啡口服易吸收,由于肝脏和消化道的首过效应(first-pass effect),其生物利用度为30%~40%,控缓释制剂与即释制剂生物利用度相近,直肠给药生物利用度变异比较大。
皮下、肌肉和静脉注射吗啡无首过效应,生物利用度接近100%。
吗啡的pKa为7.9,进入血管内的吗啡约有1/3与血浆蛋白结合,其余在生理pH下呈游离状态,并迅速分布于人体大多数组织中,包括实质性脏器、空腔脏器甚至体液、皮肤、毛发等,其表观分布容积(apparent volume of distribution,Vd)约为1.0~4.7 L/kg。
只有游离状态的吗啡可通过血-脑脊液屏障和胎盘组织。
吗啡的辛醇/水(octanol/water)分配系数在pH7.4时为1.42,呈低脂溶性,亲水性强,虽然吗啡在机体内分布广泛,但其组织穿透力弱,因而只有极少部分吗啡(静脉注射后不到1%)能够透过血-脑脊液屏障发挥镇痛作用。
吗啡血浆清除率(plasma clearance)为0.9~1.2 L/(kg·h),主要在肝脏代谢。
5%左右去甲基化生成去甲吗啡(normorphine),60%~80%葡萄糖醛酸化,其分子结构上3位和6位的羟基分别被葡糖醛酸替代,生成吗啡-3-葡萄糖醛酸(morphine-3-glucuronide,M3G)和吗啡-6-葡萄糖醛酸(morphine-6-glucuronide,M6G)。

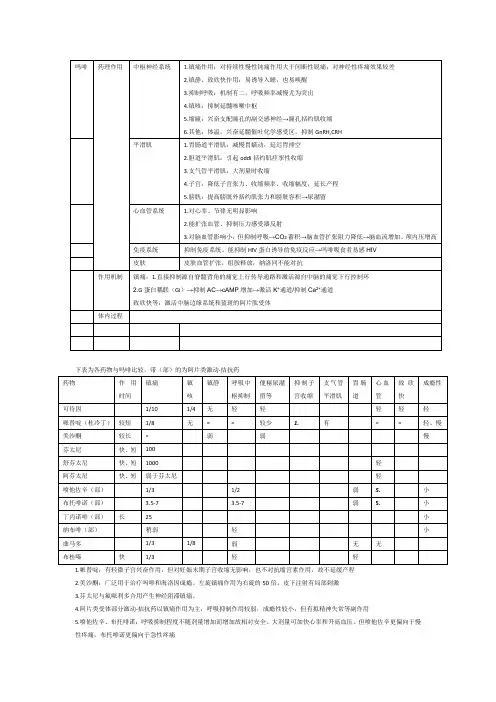
下表为各药物与吗啡比较,带(部)的为阿片类激动-拮抗药
1.哌替啶:有轻微子宫兴奋作用,但对妊娠末期子宫收缩无影响,也不对抗缩宫素作用,故不延缓产程
2.美沙酮:广泛用于治疗吗啡和海洛因成瘾。
左旋镇痛作用为右旋的50倍。
皮下注射有局部刺激
3.芬太尼与氟哌利多合用产生神经阻滞镇痛。
4.阿片类受体部分激动-拮抗药以镇痛作用为主,呼吸抑制作用较弱,成瘾性较小,但有拟精神失常等副作用
5.喷他佐辛、布托啡诺:呼吸抑制程度不随剂量增加而增加故相对安全。
大剂量可加快心率和升高血压。
但喷他佐辛更偏向于慢性疼痛,布托啡诺更偏向于急性疼痛
6.丁丙诺啡也可用于控制毒瘾
7.罗通定:镇痛作用较哌替啶弱,但较解热镇痛药强,无明显成瘾性,镇痛作用于脑内阿片肽受体及前列腺素系统无关,能阻断脑内多巴胺受体,过量可导致帕金森病。
对慢性持续性钝痛效果好。
对产程及胎儿均无不良影响
8.。

疼痛门诊的常用药物卫生部中日友好医院刘波涛一、总论疼痛门诊的常用药物。
主要包括:中枢性镇痛药、非甾体类消炎药、糖皮质激素类药物、局部麻醉药、神经破坏药以及疼痛的辅助用药。
二、中枢性镇痛药中枢性镇痛药物,一般来说主要分作两大类:一类是阿片类镇痛药物,另一类是非阿片类的镇痛药物。
接下来我们先讲阿片类镇痛药物。
阿片类镇痛药物习惯上又称为麻醉性镇痛药物,它可以提高痛阈,减轻以至消除疼痛,减少患者因疼痛而引起的身体的痛苦和精神、心理上的压力,还有这种焦虑、烦燥,改善患者的情绪和生活质量。
麻醉性镇痛药物在缓解疼痛时一般不产生意识消失,但大剂量时能够抑制中枢神经系统,并能产生睡眠或者麻醉。
在疼痛门诊中常用的阿片类镇痛药物,列举了六种,分别是吗啡、芬太尼、羟考酮、可待因、哌替啶和丁丙诺啡。
吗啡这是从阿片中提取的一种生物碱,它可以直接作用于中枢神经系统和肠壁的阿片受体而产生镇痛作用。
这是治疗中、重度癌性疼痛的一种重要的镇痛药。
口服是最佳的给药途径,可以减少患者的药物依赖性,方便而且没有创伤。
吗啡在临床上具有多种剂型,如硫酸或者盐酸吗啡的口服剂型就有即食片、缓释片,或者水剂,同时还有这种注射针剂。
盐酸吗啡的即释片和控释片,区别主要是在体内维持的时间不同,所以服药的间隔时间也不同,一般吗啡即释片的间隔时间是4-6小时,而缓释片的间隔时间是8-12个小时。
吗啡可以对身体多个系统产生作用,对中枢神经系统是具有这种强烈的麻醉镇痛作用,镇痛范围非常广泛,几乎适用于各种严重疼痛,包括晚期癌性病变的这种剧痛。
它在镇痛的时候能保持意识,以及其他感觉不受影响。
同时还有比较明显的一种镇静作用。
需要注意的是,阿片类药物可以产生欣快的精神效应,这就是导致药物滥用的神经生理基础。
同时吗啡也可以对呼吸系统产生这个呼吸抑制的作用,对心血管系统,治疗剂量的吗啡对血管和心率没有明显的作用,但大剂量的吗啡可以引起体位性低血压和心动过缓。
吗啡可以使消化道的这个平滑肌、括约肌兴奋,然后主动减慢,所以可以有止泻和治疗便秘的这个作用。



阿片类镇痛药第一节:概述:疼痛是一种因组织损伤或潜在的组织损伤而产生的痛苦感觉,常伴有不愉快的情绪甚或心血管和呼吸方面的变化。
——它既是机体的一种保护性机制,提醒机体避开或处理伤害,也是临床许多疾」病的常见症状.剧烈疼痛不仅给患者带来痛苦和紧张不安等情绪反应,还可引起机体生理功能紊乱, 甚至诱发休克。
控制疼痛是临床药物治疗的主要目的之躯体痛(Somaticpai n):快痛、慢痛,对机械性、化学性、炎症性、温度性刺激均敏感。
内脏痛(Visceral pai n):对牵张、炎症刺激敏感。
神经痛(Neuropat hi c pai n):多由神经损伤或兴奋性增高引起,呈发作性或持续性,一般镇痛药无效。
躯体疼痛分两类:快痛(剧痛):(Fast pain, acute pain, sharp pai n)尖锐而定位清楚的刺痛,刺激时立即发生,撤除刺激立即消失。
由A S -类纤维传导。
慢痛(钝痛)(chro ni c pa in, sl ow pa in, blunt pain)定位不明确的烧灼痛,发生较慢,持续时间较长。
疼痛除了使患者感受痛苦外,常伴有情绪、心血管和呼吸等方面的变化。
剧痛常引起失眠或其它生理机能的紊乱,甚至引起休克。
由无髓鞘的G类纤维传导。
阿片那与疼痛产生有关的物质:绝大多数情况下,伤害性神经末稍的有效刺激即为化学物质, 包括: 神经递质类(5-HT 、组胺、ACh )、激肽类(缓激肽、赖氨酰缓激肽)、 代谢产物(ATP 、ADP 、H+、K+)、 前列腺素类(PGE2)、 辣椒素(Capsai ci n )。
与疼痛传导有关的神经递质和调质:许多物质参与了痛觉信号的传递和调控过程,包括: 神经肽类:P 物质(SP )、神经激肽(NKA 、NKB ) 经典递质类:Gu )、GA3A 、5 — HT 、NA 腺嘌呤.阿片肽类(opi oi d pept i des )亮氨酸脑啡肽、甲硫氨酸脑啡肽、内啡肽、强啡肽、 内吗啡肽等。

阿片类药物可以抑制痛觉在中枢神经系统内的传导,达到镇痛作用。
阿片类药物可分为弱阿片类药物和强阿片类药物。
1、吗啡:吗啡是最常用的强阿片类药物,也是晚期癌痛最常选用的镇痛药物,其代谢产物吗啡-6-葡糖甘酸(M6G)也是产生镇痛效应的活性代谢产物。
口服易吸收,肝脏首过效应较强,因此,口服生物利用度约25%。
吗啡血浆半衰期3小时,健康人M6G的血浆半衰期超过3小时,但在肾功能不全的病人将明显延长。
速释硫酸吗啡、盐酸吗啡镇痛时间为4-6小时。
口服吗啡控释片的作用时间可达12小时。
2、芬太尼:芬太尼是术中常用的镇痛药物,经皮芬太尼贴剂(TTS-Fentanyl)是晚期癌痛治疗的重要药物。
与吗啡相同,芬太尼也属强阿片类药物、α受体激动剂,其镇痛强度是吗啡的70-100倍。
因其分子量小,脂溶性高,对皮肤刺激小,适用于制成缓释透皮贴剂,因此适用于不能口服的患者。
经皮芬太尼贴剂皮肤吸收利用率为92-94%,初次用药,6-12小时达到血浆峰浓度,12-24小时达到血浆稳态浓度。
每隔72小时更换一次贴剂,可维持稳定的血药浓度。
芬太尼的释放量与贴剂的药物含量和贴剂的表面积成正比。
不良反应与吗啡相类似,如恶心呕吐、便秘等,但比吗啡发生率低。
3、哌替啶:因其在体内代谢、去甲基后可产生去甲哌替啶,此代谢物的半衰期是哌替啶本身的2-3倍,长期使用可导致在体内的蓄积,引起中枢神经系统的一系列不良反应,如震颤、肌震挛甚至癫痫发作,而且纳洛酮不能拮抗去甲哌替啶引起的不良反应、甚至有加重的趋势,因此哌替啶不适用于慢性疼痛和癌痛的治疗。


止痛药缓解疼痛的有效药物疼痛是人们日常生活中常见的一种不适感,它可以由多种原因引起,例如损伤、炎症或慢性疾病等。
为了缓解疼痛,止痛药成为了一种常见的解决方案。
在市面上,有许多种类的止痛药可供选择,每一种药物都有其独特的特点和适应症。
本文将介绍几种常用的止痛药,它们被广泛认可为缓解各种类型疼痛的有效药物。
一、非处方药1. 对乙酰氨基酚(通常称为“扑热息痛”):对乙酰氨基酚是一种常见的非处方药,常用于缓解轻至中度疼痛,如头痛、关节痛和痛经等。
其作用机制主要是通过减少中枢神经系统对疼痛的感受敏感度。
然而,对乙酰氨基酚对于治疗慢性疼痛并不适用,并且过量使用可能对肝脏造成损伤。
2. 非甾体类抗炎药(NSAIDs):NSAIDs是常见的非处方止痛药,如布洛芬和阿司匹林等。
它们通过抑制炎症反应和丙酸类物质的产生来缓解疼痛。
NSAIDs也可以减轻炎症引起的发热。
然而,NSAIDs在长期使用时可能会对消化系统产生负面影响,引发溃疡和胃出血等问题。
二、处方药1. 阿片类镇痛药:阿片类镇痛药如吗啡和氢化可待因等,被广泛用于缓解中度至重度疼痛,如手术后的疼痛或癌症引起的疼痛。
这类药物通过作用于中枢神经系统的阿片受体来减轻疼痛。
然而,阿片类药物具有潜在的成瘾性和滥用风险,因此需要在医生的指导下使用。
2. 抗抑郁药和抗惊厥药:一些抗抑郁药和抗惊厥药也可以用于缓解疼痛,特别是神经性疼痛。
例如,氯米帕明和盐酸丙咪嗪可以通过平衡神经递质来减轻疼痛。
这些药物需要经过医生的处方,并且可能会产生不同的副作用。
需要注意的是,不同的人对止痛药的反应有所不同。
因此,在使用任何止痛药之前,最好咨询医生的建议。
此外,应注意药物的剂量和使用频率,以避免不良反应和药物滥用。
对于长期、慢性疼痛的治疗,综合治疗方法,如物理疗法、心理治疗和中医药等,可能更为有效。
综上所述,止痛药是缓解疼痛的有效药物,但不同类型的止痛药适用于不同类型的疼痛。
患者应在医生的指导下选择合适的止痛药,并遵循药物使用的指导,以获得最佳的止痛效果。
阿片类镇痛药物作者:赵成龙来源:《黄河黄土黄种人》2016年第06期阿片类药物是目前疼痛治疗的主力军。
“阿片”一词广义是指从罂粟的汁液中提取出的药物,包括天然产物吗啡、可待因,二甲基吗啡以及从中提取的许多半合成物质。
生物碱可止痛,鸦片中含有20多种生物碱,其中吗啡的含量最多(9%~17%),因此,吗啡是目前应用最广泛的阿片类镇痛药物。
鸦片战争给我国人民带来了灾难和痛苦,并留下了深深的烙印,这是很多国人恐惧阿片类药物的历史原因,也导致了人们对阿片类药物镇痛治疗的错误认识。
错误认识一:用阿片类药物会成瘾用阿片类药物镇痛,成瘾性的发生率与药物的给药方式有关。
静脉注射大量止痛药物,会使血液中药物浓度突然增高,脑内药物浓度也明显增高,超过所需要的止痛药浓度,易成瘾。
在慢性疼痛中,采用阿片类药物的控缓释制剂,药物在胃肠道内缓慢释放,使血液中药物浓度在一定程度上保持恒定,成瘾现象极其罕见。
在临床上常用的阿片类药物包括吗啡控释片、羟考酮控释片、芬太尼透皮贴剂、盐酸吗啡注射液、盐酸吗啡片等。
长期的临床实践证明,以止痛治疗为目的,阿片类药物在常规剂量、规范化使用情况下,疼痛患者出现成瘾的现象极为罕见。
国外大型临床实验证实成瘾的患者只占0.029%,也就是说成瘾性发生率不足万分之三。
错误认识二:用阿片类药物意味着“临终期”将至目前,由于众所周知的原因,癌症的发病率越来越高,而且至少有50%的中、晚期癌症患者伴有不同程度的疼痛。
随着肿瘤治疗技术的进步,有一部分患者可取得较好的治疗效果,而经过有效的抗肿瘤治疗后,阿片类药物是可以减量甚至停用的。
而有些患者认为自己得了癌症,肯定活不成了,“临终期”将至,于是任由疼痛持续存在,坚持不服阿片类药物。
久而久之,导致患者生存欲望降低、治疗依从性差、机体免疫力下降等恶性循环,这样就缩短了生存期。
错误认识三:疼时再服阿片类药物部分患者担心服用阿片类药物会成瘾或出现其他身体不适,内心深处抵触服药。
治疗疼痛的药物——阿片类镇痛药(1)阿片类镇痛药第一节概述阿片类镇痛药又称麻醉性镇痛药(narcotic analgetics),是一类能消除或减轻疼痛并改变对疼痛情绪反应的药物。
除少数作用弱的药物外,此类药物若使用不当多具有成瘾性,但规范化用于临床时,其止痛导致成瘾极为少见。
研究显示,慢性疼痛和癌痛患者长期使用以控缓释阿片类药物为主的治疗时,成瘾的发生率极为罕见。
阿片类药物的镇痛作用机制是多平面的:与外周神经阿片受体结合;阿片类药物又可与位于脊髓背角胶状质(第二层)感觉神经元上的阿片受体结合,抑制P物质的释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑和脑干的疼痛中枢,发挥下行性疼痛抑制作用。
至于阿片类药物与受体结合后又如何抑制痛觉的冲动传递仍不清楚。
实验证明,用阿片药后可使神经末梢释放的乙酰胆碱、去甲肾上腺素、多巴胺及P物质等减少,此外阿片类药可抑制腺苷酸环化酶,使神经细胞内cAMP浓度下降,并进一步作用在G蛋白。
阿片类药物抑制疼痛还涉及钠离子、钙离子、钾离子和氯离子传导。
一、阿片类药物的分类阿片类药物有多种分类方法:1.按化学结构分类分为吗啡类和异喹啉类,前者即天然的阿片生物碱(如吗啡、可待因),后者主要是提取的罂粟碱,不作用于阿片受体,有平滑肌松弛作用。
2.按来源分类该类药物又可分为天然阿片类、半合成衍生物(如双氢可待因、二乙酰吗啡)和合成的阿片类镇痛药。
合成药物又分为4类:①苯哌啶类(phenylpiperidine derivatives),如哌替啶、芬太尼等;②吗啡烷类(morphinenans),如左吗喃、左啡诺(levorphanol);③苯并吗啡烷类(bengmorphans),如喷他佐辛;④二苯甲烷类(diphenylmethanes),如美沙酮(methadone),右丙氧芬(dextroproxyphene)、镇痛新(pentazocine)。
3.按受体类型分类可分为μ、κ、δ受体激动剂,该3种受体的分子结构已被确定,并被成功克隆。