
物理化学讲稿
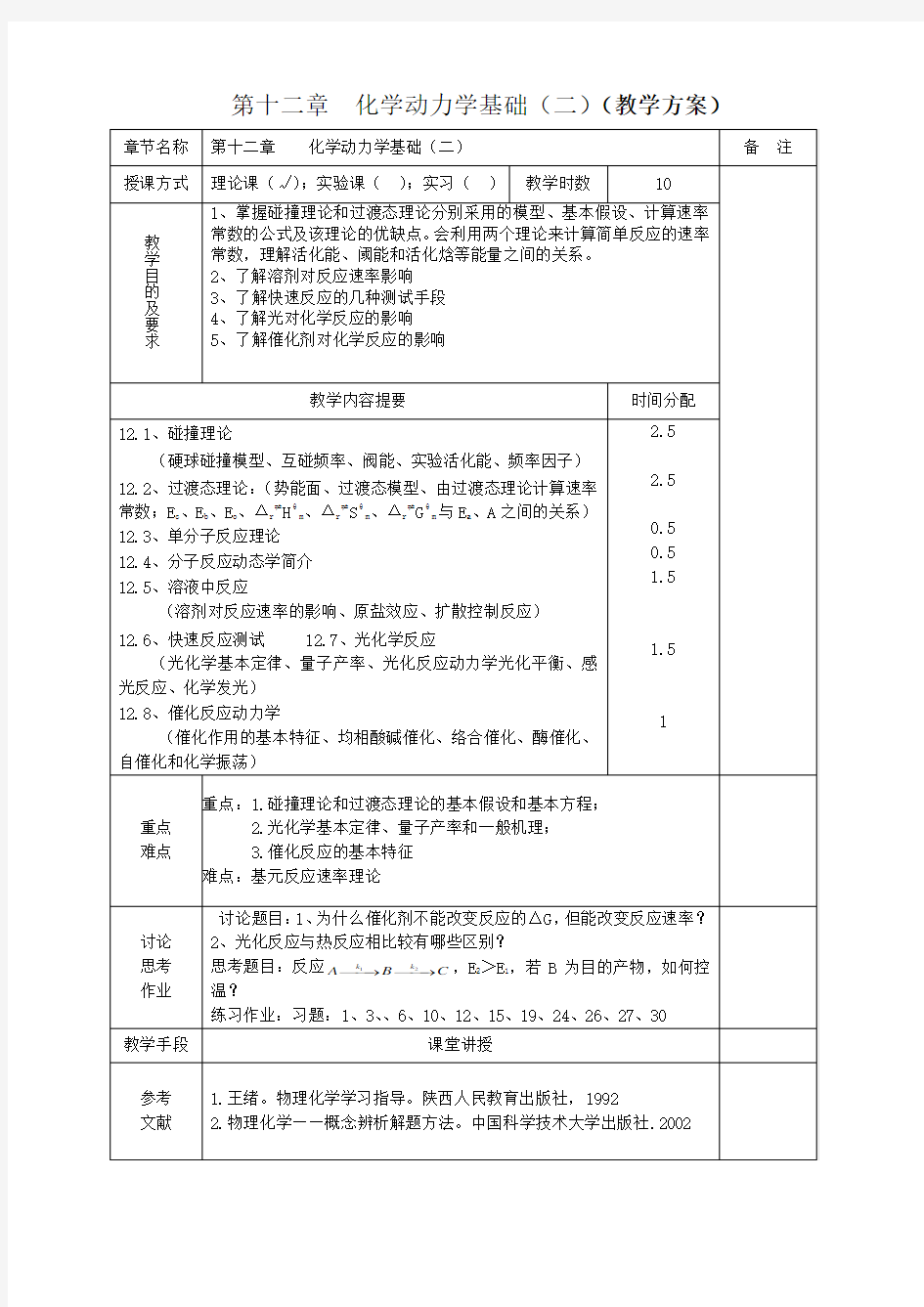
第十二章化学动力学基础(二)
(10学时)
物理化学教研室
第十二章化学动力学基础(二)(教学方案)
第十二章 化学动力学基础(二)
人们在测量了大量反应的速率常数,并对反应速率常数于温度的依赖关系有了相当了解以后,对于为什么会有这些宏观规律存在必须从理论给予回答。在反应速率理论的发展过程中,先后形成了碰撞理论、过渡态理论和单分子反应理论等。动力学理论与,发展较迟。先后形成的碰撞理论、过渡态理论都是20世纪后建立起来的。而且与热力学的经典理论相比尚有明显不足之处。
速度理论是研究化学反应的速率系数与温度的关系,描述反应过程的动力学性质。 速率理论的共同点:首先选定一个微观模型,用气体分子运动论(碰撞理论)或量子力学(过渡态理论)的方法,并经过统计平均,导出宏观动力学中速率系数的计算公式。
由于所采用模型的局限性,使计算值与实验值不能完全吻合,还必须引入一些校正因子,使理论的应用受到一定的限制。
§12.1 碰撞理论(Simple Collision theory )(SCT )
碰撞理论是接受了阿伦尼乌斯关于“活化状态”和“活化能”概念的基础上,利用已经建立起来的气体分子运动论的基础上,在20世纪初由路易斯建立起来的。路易斯把气相中的双分子反应看作是两个分子激烈碰撞的结果。在这里只学习简单的硬球碰撞理论(SCT )。气相双分子简单反应如A + B → 产物,2A → 产物。
一、碰撞理论
1、微观模型
(1) 反应物分子可看作简单的刚球,无内部结构; (2) 分子间除碰撞间外无其它相互作用;
(3) 在反应过程中,反应分子的速率分布遵守麦克斯韦-玻耳兹曼分布。 2、碰撞理论的基本要点
(1) 分子必须通过碰撞才能发生反应,反应物分子间的接触碰撞是发生反应的前提。即要反应,先碰撞;
(2) 不是任何两个反应物分子碰撞都能发生反应,只有当两个反应物碰撞分子的能量超过一定的数值ε0时,并满足一定的空间配布几何条件的碰撞反应才能发生反应;
(3)活化分子的能量较普通能量高,它们碰撞时,松动并部分破坏了反应物分子中的旧键,并可能形成新键,从而发生反应,这样的碰撞称为有效碰撞或非弹性碰撞,活化分子愈多,发生化学反应的可能性就愈大。
根据上述的基本观点,自然得出一个结论:活化分子在单位时间内的碰撞就是反应速率。
[]A q AB
d Z r dt
L
=-
=
? Z AB —(collision frequency)单位体积、单位时间内碰撞的分子数 q — (fraction of effective collision)有效碰撞在总碰撞中所占分数 设法求的Z 和q 就可求出r ,碰撞理论就是求碰撞数Z 和q 。
简单碰撞理论是以硬球碰撞为模型,导出宏观反应速率常数的计算公式,故又称为硬球碰撞理论。
二、双分子的互碰频率Z 的求算
1、两个分子的一次碰撞过程
两个分子在相互的作用力下,先是互相接近,接近到一定距离,分子间的斥力随着距离的减小而很快增大,分子就改变原来的方向而相互远离,完成了一次碰撞过程。粒子在质心体系中的碰撞轨线可用示意图表示为:
2、有效碰撞直径和碰撞截面
运动着的A 分子和B 分子,两者质心的投影落在直径为d AB 的圆截面之内,都有可能发生碰撞。两个分子的质心在碰撞过程所能到达的最短距离称为有效直径(或碰撞直径)。其数值往往要稍大于分子本身的直径。在分子碰撞理论中,采用了刚球模型,设A 、B 两种分子都是完全弹性的、无压缩性的刚球,二者半径各为
A B 11
, 22
d d ,如图所示,A 、B 分子的有效碰撞直径d AB ,数值上等于A 分子和B 分子的半径之和。AB A B 11
22
d d d =+
碰撞截面(σAB 表示)为虚线圆的面积称,σAB = π? d AB 2 。 3、A 与B 分子互碰频率
设A 分子数为N A ,单位体积中的分子数为 N A /V ,有效直径为d A ,平均速率为A u ; B 分子数为N B ,单位体积中的分子数为 N B /V ,有效直径为d B ,假定静止不动。 (1) 先求出一个A 分子以A u 速率与N B /V 个静止B 分子碰撞次数
将A 分子看作是半径为d AB 的分子,而将B 看作是质点,若A 以速率A u 运动,则在t 时间内扫过的体积为V t =σAB ?A u ?t=π? d AB 2? A u ?t
σA B= π? d AB 2 d AB =(d A +d B )/2
在单位时间内扫过的体积为 V = V t /t =σA B?A u =π? d AB 2? A u
假设B 分子静止不动,则一个A 分子以A u 速率与N B /V 个静止B 分子在单位体积、单位时间内碰撞次数为
Z AB /=σAB ?A u ?N B /V =π? d AB 2? A u ?N B /V 2
A A
B B AB
AB AB N N Z u d u V V
σπ==¢
(2) N 个A 分子以A u 速率与静止B 分子碰撞次数
N A /N 个A 分子以A u 速率与N B /V 个静止B 分子在单位体积、单位时间内碰撞次数为
2
A
A B
AB AB N N Z d u V V
π=ⅱ (3) N A /V 个A 分子以A u 速率与N B /V 个B 分子速率为B u 的碰撞次数
如果所有分子都在运动,则要用用A ,B 分子的平均相对运动速度r u 代替A 分子的平
均运动速度A u 。当A 与B 分子各自以平均运动速度A u ,B u 作相对运动而发生碰撞时,可以从0°到180°之间的任何角度彼此趋近。
A ,
B 两分子的平均相对运动速度分别为
(a):两个分子运动方向一致 r u = B u + A u (b):两个分子运动方向相反 r u = B u -A u (c):平均情况为两个分子以90o角互相碰撞
221/2
A B 1/21/21/21/2A B A A B B
[]
8888()() ()()
r u u u kT RT kT RT u u m M m M ππππ=+==== 式中 k —Boltzmann 常数,R 为气体常数。
将A 和B 分子看作硬球,根据气体分子运动论,它们以一定角度相碰,A ,B 分子的平均相对运动速度
1/2
r A
8(
)RT u M π= 式中μ—A ,B 分子的折合质量 A B
A B
M M M M μ=
+,单位为:kg ·mol -1
N A /N 个A 分子以A u 速率与N B /V 个速率为B u 的B 分子在单位体积、单位时间内碰撞
次数为 2
221/2
A B []A B AB AB
N N Z d u u V V
π=+
互碰频率为:2
AB AB
Z d π
=2
AB AB ]Z d L π=或
因为
A B [A] [B]N N
L L V V
== 4、两个A 分子的互碰频率
如果是同一种分子(两个A 分子)的互碰时,系统中只有一种A 分子,两个A 分子互碰的相对速度为:1/2
r A
8(2)RT u M π=?
每次碰撞需要两个A 分子,为防止重复计算,在碰撞频率中除以2,所以两个A 分子互碰频率为:
2A AA AA ()N Z d V
=
2A AA 2()N d V π
=2
2AA 2d L π= 在常温常压下,碰撞频率约为353110m s --? 速率常数的推导
设有反应 A B P +→
若每次碰撞都能起反应,则反应速率为 A
AB d d n Z t
-= 改用物质的浓度表示 A A d d n c L =?
A A A
B d d 1d d c n Z t t L L -
=-?=2
AB A B 8RT d L c c ππμ
= A A B d d c kc c t -
= 2
AB 8RT k d L
ππμ
= 这就是根据简单碰撞理论导出的速率常数计算式,由于不是每次碰撞都能发生反应,
所以要乘以有效碰撞分数q
三、有效碰撞分数q 的计算
1、硬球碰撞模型——碰撞截面与反应阈能
设A 和B 为没有结构的硬球分子,质量分别为A m 和B m ,折合质量为μ ,运动速度分别为A u 和B u ,总的动能为:22
A A
B B
1122
E m u m u =
+ 将总的动能表示为质心整体运动的动能g ε和分子相对运动的动能r ε
2
2g r A B g r 11()22
E m m u u εεμ=+=++
两个分子在空间整体运动的动能g ε对化学反应没有贡献,而相对动能r ε可以衡量两个分子相互趋近时能量的大小,有可能发生化学反应。 2、碰撞参数
描述粒子碰撞激烈的程度的物理量,用字母b 表示 设具有相对速度为r u 的B 分子与A 分子碰撞 在硬球碰撞示意图上,A 和B 两个球的碰撞直径AB d 与相对速度r u 之间的夹角为θ
通过A 球质心,画平行于r u 的平行线,两平行线间的距离就是碰撞参数 b 数值上:
AB sin b d θ=?
因为θ使从0到180度,当θ=0时,b=0,为迎头碰撞;当o o 90180θ<<时 max AB b d >不发
生碰撞;当o o
090θ<<,有碰撞,但是AB b d <,所以max AB b d =
b 值愈小,碰撞愈激烈,b=0迎头碰撞最激烈max AB b d =
3、碰撞截面c σ为: max
c 2
d b b b σπ=?22
max AB b d ππ==
分子碰撞的相对平动能为2
r 12
r u εμ=
相对平动能在连心线上的分量'r ε
()2'r
r 1cos 2u εμθ=()22
r 11sin 2u μθ=-2r 2AB 1b d ε??=- ???
只有当'r ε的值超过某一规定值c ε时,这样的碰撞才是有效的,才是能导致反应的碰撞。
c ε称为能发生化学反应的临界能或阈能。 发生反应的必要条件是2r c 2AB 1b
d εε??
-≥ ???
设碰撞参数为某一数值时 2r r c 2AB 1b d εε??-= ??? 22c r AB r 1b d εε??=- ??? 凡是r b b ≤ 的所有碰撞都是有效的
碰撞截面的定义 2r r def b σπ2c AB r 1d επε??=- ???
c ε为反应阈能,当 r c εε≤ r 0σ= 当 r c εε> r ε的值随着r σ的增加而增加
碰撞截面是相对平动能的函数,相对平动能至少大于阈能
r c εε3,才有反应的可能性,相对平动能越大,反应截面也越大。
由于2r r 12u εμ=
, ()2c r r AB 2r 21u d u εσπμ??=- ???
,故σr 也是u r 的函数。 4、反应阈能(threshold energy of reaction)
反应阈能又称为反应临界能。两个分子相撞,相对动能在连心线上的分量必须大于一个临界值 E c ,这种碰撞才有可能引发化学反应,这临界值E c 称为反应阈能。
E c 值与温度无关,实验尚无法测定,而是从实验活化能E a 计算。c a 1
2
E E RT =-
5、有效碰撞分数q 的计算
究竟怎样的碰撞才算有效碰撞呢?从气体分子运动论知道,虽然在温度一定的某种气体的分子有一定的平均移动能,但每个分子的移动能却是千差万别,而且瞬息万变的。根据Boltzmann 能量分布规律,大多数分子的移动能在平均值附近,有少量分子的移动能比平均值要低的多,也有少量分子的移动能比平均值要高的多,对于大多数移动能在平均值附
近或比平均值低的气体分子来说,由于碰撞不剧烈,不足以引起分子中键的松动和断裂,因此不能引起反应,碰撞后就分开,这种碰撞称为“弹性碰撞”。只有那些动能足够高的气体分子,碰撞较为剧烈,有可能松动和破坏旧化学键而变为产物分子。这种碰撞引起反应称为“有效碰撞”。应指出,A 、B 分子碰撞的剧烈程度并不取决于A 、B 两分子的总移动能E ,而是取决于A 、B 两分子在质心连续方向上的相对移动能r ε,只有r ε超过某一数值c ε方能发生反应。c ε叫反应的阈能或临界能,c ε ? L = Ec 反应活化能。即分子互碰并不是
每次都发生反应,只有相对平动能在连心线上的分量大于阈能的碰撞才是有效的,r c εε>反应能发生。所以绝大部分的碰撞是无效的。要在碰撞频率项上乘以有效碰撞分数q 。
根据气体分子运动论中的Boltzmann 二维能量分布规律可得:
c
c
exp()exp()B E q k T
RT
ε=-
=-
q 就是Boltzmann 因子,在一定温度下,q 随Ec 的增加呈指数性衰减。
如 Ec=160 KJ ? mol -1 (这是通常反应的数量级),在T=300K 时
c exp()E q RT =-=28160000
exp() 1.38108.314300
--=?? exp (-160000/80314?300)=1.38?10-28
也就是说约在1027次分子碰撞中才有一次有效碰撞。
四、碰撞理论计算反应的速率常数k
速率常数的求算
设有反应 A B P +→ 则反应速率为 [][][]d A A B d r k t
=-
=
根据碰撞理论 []
AB d A d Z r q t L =-=?
[][]2AB A B c B k T d ε
π-= 比较上面两式得
2
c sct AB B ()k T
d k T επ??
=- ???
若用物质的量浓度表示,则2
c sct AB ()E k T
d RT π??
=- ???
*五、反应阈能与实验活化能的关系 根据实验活化能的定义: 2
a d ln ()
d k T E RT T
= 已知
2
a
sct AB ()) E k T d RT
π=-
将与T 无关的物理量总称为B ,取对数:
c sct 1
ln ()ln ln 2E k T T B RT =-
++有 对T 微分,得: sct c 2d ln ()1
d 2k T E T RT T
=+
代入活化能定义式,得:a c 1
2
E E RT =+
反应阈能E c 与温度无关,但无法测定,要从实验活化能E a 计算。
在温度不太高时 a 1
2
E RT ? 时 E a ≈ E c ,但是两者意义不同。
用碰撞理论求算Arrhenius 公式中的指前因子A
将E a 代入速率常数的计算式2AB
e
c E Ec RT
RT
k d A π-
-
==,
得:2
a sct AB ()E k T d RT π??
=- ???
与Arrhenius 经验式对照 a
E RT
k Ae -=
得指前因子的表示式为: 2
AB A d π=
可见:A 不必从动力学实验中求得,只要通过计算就可以求出,但是要求k ,必须先知道Ec ,而Ec 是碰撞理论本身不能预言的临界能,常需要用实验活化能Ea 来代替,计算出的k 与A 值,与实验结果基本相符,但是有时相差很大。
六、概率因子(方位因子、空间因子)P
对于一些常见反应,用碰撞理论计算所得k(T)和A 值与实验结果基本相符,但也有不少反应理论计算得k(T)比实验值大,有时很大,如溶液计算结果比实验值大105—106倍,原因是由于简单碰撞理论所采用的模型过于简单,没有考虑分子的结构与性质,所以用概率因子来校正理论计算值与实验值的偏差。 P=k (实验)/k (理论) ()e
a E RT
k T P A -=??
P —概率因子又称为空间因子或方位因子,数值1-109。 理论计算值与实验值发生偏差的原因主要有:
(1) 从理论计算认为分子已被活化,但由于有的分子只有在某一方向相撞才有效; (2) 有的分子从相撞到反应中间有一个能量传递过程,若这时又与另外的分子相撞而失去能量,则反应仍不会发生;
(3) 有的分子在能引发反应的化学键附近有较大的原子团,由于位阻效应,减少了这个键与其它分子相撞的机会等等。 碰撞理论应用范围: ① 对基元反应都适用; ② 对简单级数的反应也适用; ③对于较复杂的反应,必须校正。 七、碰撞理论的成败之处
1、成功之处:
(1)碰撞理论揭示了反应究竟是如何进行的一个简单而明了的物理图像,从微观上说明了基元反应速率公式的由来和阿仑尼乌斯公式成立的原因,在反应速率理论的发展中起了很大作用。
2
a sct AB ()E k T d RT π??=- ???
2
AB A d π= a c 12E E RT =+ (2)碰撞理论对a
exp E
RT
??
- ???
,A ,E c 等都提出了较明确的物理意义。 (3) 碰撞理论肯定了E a 与温度有关,即a c 1
2
E E RT =+
碰撞理论对Arrhenius 公式中的指数项、指前因子和阈能都提出了较明确的物理意义,认为指数项相当于有效碰撞分数,指前因子A 相当于碰撞频率。
它解释了一部分实验事实,理论所计算的速率常数 k 值与较简单的反应的实验值相符。
2、不足之处:
(1) 要从碰撞理论来计算速度常数k ,必须知道临界能Ec ,但碰撞理论本身却不能预言Ec 的大小,还需通过阿仑尼乌斯公式来求得,而阿仑尼乌斯公式中Ea 的求得,首先需要从实验测得k ,这就使该理论失去了从理论上预示k 的意义。说明理论是半经验的。 (2) 碰撞理论中假设反应物是无内部结构的刚性球体,这种模型的假设过于简单,粗糙,因此只对简单的反应来说,理论值与实验值符合的较好,对更复杂的分子来说,计算值与实验值有很大偏差,为了解决这个问题,引入的概率因子P 进行校正,P 值在1—109之间,但概率因子的值很难具体计算,却碰撞理论本身不能求算P 值的大小,因而P 是一个经验常数。
总之, 碰撞理论描绘了一幅形象、直观的分子反应的图像, 由于模型过于简单,要引入概率因子P ,且概率因子的值很难具体计算。阈能还必须从实验活化能求得,因此没有给出如何从理论上计算或确定Ec 和P 的方法,所以k 的计算仍是一个半理论半经验的公式。碰撞理论也是半经验的。
由于碰撞理论有以上缺点,所以该理论要进一步发展,必须解决P 和Ea 的问题,这个问题由过渡态理论来解决。
§12.2 过渡态理论
过渡状态理论又称活化络合物理论, 是1935年由艾林(E.Eyring),埃文斯(Evans )和波兰尼(Polany)等人在统计热力学和量子力学的基础上提出来的。
该理论的重要性在于: 可根据反应物分子的某些性质, 如分子的大小、质量、振动频率等求出反应速率常数, 对定性认识化学反应提供了一个理论框架. 因此, 该理论也称为绝对反应速率理论。
理论的基本思想:
(1) 反应物分子发生有效碰撞是反应的前提条件,但不只是简单碰撞就变成产物,而是反应物分子要经过以一定的构型存在的一个中间过渡态,又称活化络合物。形成这个活化过渡态必须吸收一定的活化能,具有相对较高的能量而很不稳定,一方面很快与反应物建立热力学平衡,另一方面又极易分解为产物,即两个具有足够能量的反应物分子相互接近时,分子的价键要经过重排,能量经过重新分配,方能变成产物分子。这个过渡态就称为活化络合物,所以又称为活化络合物理论。
c
r K K A B C X [A B C]A B C ≠
≠≠
+-????????
→-+垐垎噲垐 (2) 活化络合物具有内部结构和各种运动形式,即平动,转动和振动等。但其中有一个振动运动与其他振动不同,该振动无回复力,振动发生后活化体将分解为产物。活化物与反应物分子间建立快化学平衡,总反应速度由活化络合物转化成产物的速度决定。
(3) 反应物分子和活化络合物的能量分布均服从麦克斯韦尔-玻兹曼分布。即反应物分子间相互作用的势能是分子间相对位置的函数,由反应物变成产物过程中,体系的势能不断变化。 E p = E p (r )
利用该理论,只要知道分子的振动频率、质量、核间距等基本物性,就能计算反应的速率系数,所以又称为绝对反应速率理论(absolute rate theory)。
一、过渡态理论的物理模型—势能面
化学反应是分子或原子之间的价电子的重排作用,表现为分子之间化学键的短裂和性键的生成.要了解化学作用的动力学实质(如活化能),就必须获得分子间化学相互作用。
该理论认为反应物分子间相互作用的势能是分子间相对位置的函数,E p = E p (r ),对于双原子体系,只有一个核间距,故可以表现在一个平面图上。
莫尔斯(Morse)公式是对双原子分子最常用的计算势能E p 的经验公式:
p e 00()[exp{2()}2exp{()}]E r D a r r a r r =-----
式中r 0是分子中双原子分子间的平衡核间距
D e 是势能曲线的井深 a 为与分子结构有关的常数。 AB 双原子分子根据该公式画出的势能曲线如图所示。
这个势能曲线是一个键解离的曲线,由AB 分子的平衡核间距r 0(曲线最低点)向r 增大方向的一段曲线表示AB 分子的解离,一般把原子
A 和
B 处于无限远时(孤立原子)的势能取为零。体系的势能在平衡核间距r 0有最低点。
当r>r 0时,有引力,即化学键力;当r 图12.4 双原子分子的Morse 势能面曲线 线,实际上分子AB 不会处于取消的最低点。如分子处于振动基态(振动量子数ν=0时也有一定的振动能),振动基态的能级为振动基态能级,E 0为零点能。 D 0为把基态分子离解为孤立原子所需的能量(平衡解离能),它的值可从光谱数据得到。D 0 = D e - E 0 对于n 个原子得分子,其势能E 是3n-6(对于线形分子为3n-5)个内坐标的函数,例如三原子分子,n=3,则势能E 是3n-6=3维内坐标函数。 A B C [A B C]A B C ≠+-??????→-+? 当A 原子与双原子分子BC 反应时,首先形成三原子分子的活化络合物,该络合物的势能是3个内坐标的函数 P P AB BC CA (,,) E E r r r = P P AB BC ABC (,,)E E r r =∠或 这要用四维图表示。四维图形当然无法画出,所以为了简化,通常是把一个内坐标(如键角φ)固定,如上三原子反应令∠ABC=180°,即A 与BC 发生共线碰撞,活化络合物为线型分子,则E P =E P (r AB ,r BC ),就可用三维图表示。 1、势能面 仍以双分子反应为例: A B C [A B C]A B C ≠+-??????→-+? 令∠ABC=180o , 即A 与BC 发生共线碰撞,活化络合物为线型分子,即E P =E P (r AB ,r BC ),就可用三维图表示。 A B C AB r BC r 180φ=o 随着核间距r AB 和r BC 的变化,势能也随之改变。 这些不同点在空间构成高低不平的曲面,称为势能面,如图所示。 图中R 点是反应物BC 分子的基态,随着A 原子的靠近,势能沿着R T 线升高,到达T 点形成活化络合物。随着C 原子的离去,势能沿着T P 线下降,到P 点是生成物AB 分子的稳态。 D 点是完全离解为A ,B ,C 原子时的势能;O E P 一侧,是原子间的相斥能,也很高。 势能面的类型:目前常见的势能面有两种: 一种是Eyring 和Polanyi 利用London 对三原子体系的量子力学势能近似式画出的势能面称为London-Eyring-Polanyi 势能面,简称LEP 势能面。 图12.5 三原子分子的核间距 A B C 另一种是Sato 又在这个基础上进行了修正,使势垒顶端不合理的势阱消失,这样得到的势能面称为 London-Eyring-Polanyi-Sato 势能面,简称LEPS 势能面。 如何获得势能面(意义和用途) 对于一个基元反应,如果能准确地获得势能面,就能知道它过渡态的势能大小,从势能面上推测最可能的反应途径,从过渡态势能面的位置可确定活化能,这将给出重要的反应动力学信息。因此如何获得势能面就成为化学动力学的重要任务,不过,目前只能对简单的基元反应得到准确的势能面。研究最多的是H+H2和F+H2反应。 获得势能面的方法有三种: (1) 纯理论方法 通过量子力学计算。每个原子和分子有薛定谔方程,然后用量子力学求解得到势能面。 (2) 半经验方法 也源于量子力学,但它应用了经验的双原子分子的势能公式—Morse 式:p e 00()[exp{2()}2exp{()}]E r D a r r a r r =----- (3) 纯经验方法:如Morse 势能公式或其它经验公式。 2、马鞍点(saddle point) 在势能面上,活化络合物所处的位置T 点称为马鞍点。 该点势能与反应物和生成物所处的稳定态能量R 点和P 点相比是最高点,但与坐标原点一侧和D 点的势能相比又是最低点 如把势能面比作马鞍的话,则马鞍点处在马鞍的中心。从反应物到生成物必须越过一个能垒。 3、反应坐标(reaction coordinate) 势能面 反应坐标是一个连续变化的参数,其每一个值 都对应于沿反应体系中各原子的相对位置。如在势 能面上,反应沿着RT →TP 的虚线进行,反应进程不同,各原子间相对位置也不同,体系的能量也不同。 如以势能为纵坐标,反应坐标为横坐标,画出的图可以表示反应过程中体系势能的变化,这是一条能量最低的途径。 沿势能面上R-T -P 虚线切剖面图,把R-T -P 曲 线作横坐标,这就是反应坐标。以势能作纵坐标,标出反应进程中每一点的势能,就得到势能面的剖面图。 从反应物A+BC 到生成物走的是能量 最低通道,但必须越过势能垒E b ,E b 是活化络合物与反应物最低势能之差,E 0是两者零点能之间的差值。这个势能垒的存在说明了实验活化能的实质。 4、势能面投影图 将三维势能面投影到平面上,就得到 势能面的投影图。 图中曲线是相同势能的投影,称为等 势能线,线上数字表示等势能线的相对值, 等势能线的密集度表示势能变化的陡度。 靠坐标原点(O 点)一方,随着原子核间距0 E b E A+BC AB+C []A B C L L ≠反应坐标势能势能剖面图 图12.7 势能面投影图 O D AB r BC r P R T ≠ 70 6050506065 变小,势能急剧升高,是一个陡峭的势能峰。在D 点方向,随着r AB 和r BC 的增大,势能逐渐升高,这平缓上升的能量高原的顶端是三个孤立原子的势能,即D 点。反应物R 经过马鞍点T 到生成物P ,走的是一条能量最低通道。 二、由过渡态理论(统计热力学方法)计算速率系数 过渡态理论的数学表达式 1、三原子体系振动方式 线性三原子体系有三个平动和两个转动自由度,所以有四个振动自由度: (a)为对称伸缩振动,r AB 与r BC 相等; (b)为不对称伸缩振动,r AB 与r BC 不等; (c)和(d)为弯曲振动,分别发生在相互垂直的两个平面内,但能量相同。 对于稳定分子,这四种振动方式都不会使分子破坏。但对于过渡态分子,(c),(d)是弯曲振动,(a)是对称伸缩振动,都不会导致络合物分解,但(b)是不对称伸缩振动,无回收力,它将导致络合物分解。 所以这种不对称伸缩振动每振一次,导致一个络合物分子分解,所以其不对称伸缩振动的频率就相当于络合物分解的速率常数。 2、过渡态理论假设: (1) 从反应物到生成物必须获得一定的能量,首先形成活化络合物; (2) 活化络合物的浓度可从它与反应物达成热力学平衡的假设来计算; (3) 一旦形成活化络合物,就向产物转化,这步是反应的速决步。 设某基元反应为 A B C A B C +-?? →-+ []c A B C A B C A B C K ≠ ≠+-?? →-+垐垎L L 噲垐 [A B C] [A] [B C] c K ≠ ≠ =-L L [] []d A B C A B C d r t ν≠ ≠ =- =L L L L [][]A B C c K ν≠=- 因为[][]A B C r k =-,所以速率常数为 c k K ν≠= 根据统计热力学在化学平衡中的应用,平衡常数的计算式为 A BC [A B C][A][B C]c q K q q ≠ ≠ ≠== -L L (q 不包括体积项) 0A BC exp E f f f RT ≠??=- ??? (f 不包括体积和零点能) 从 f ≠ 中再分出不对称伸缩振动的配分函数 ' B 11exp f f h k T ν≠≠=??-- ??? 设 B h k T ν=, B B 1 1exp k T h h k T νν≈??-- ? ?? ' B 1 1exp f f h k T ν≠≠≠=?? -- ? ?? 'B k T f h ν≠≈ '0B A BC exp c E k T f k K h f f RT ννν≠≠ ??==- ???'0B A BC exp E k T f h f f RT ≠?? =- ??? B k T h 在常温下约等于131 10s -,原则上只要知道分子的质量,转动惯量,振动频率等微观物理量(有些可从光谱数据得到),就可用统计热力学方法求出配分函数,从而计算k 值。但由于不可能获得过渡态的光谱数据,所以只有在准确描绘势能面的基础上才能计算配分函数。 对于一般基元反应,速率常数的计算式为'0B B exp B E k T f k h RT f ≠?? =- ??? ∏ 对于反应 ()()[]()A B A B ≠ +垐?L 噲?单原子单原子双原子 速率常数的计算式为() () () 32t r 0B 33 t t A B exp f f E k T k h RT f f ≠ ??= - ??? 1个振动自由度用于活化络合物的分解 对于反应 ()()A B A B N N +,非线型多原子分子,非线型多原子分子 [ ]()A B A B ,N N ≠ +垐?L 噲?非线型多原子分子 速率常数的计算式为 ()( ) () () A B A B 373 3t r v 0B 36363333t r v t r v A B exp N N N N f f f E k T k h RT f f f f f f ≠ +-????--??= - ??? ()0b 001122E E h h L νν≠?? =+-???? 反应物 用热力学方法计算速率常数 []A B C A B C A B C ≠ +-?? →-+垐?L L 噲? 令 '0A BC exp c E f K f f RT ≠≠ ?? =- ??? B c k T k K h ≠= 设有双原子气相反应 ()()[]()A g B C g A B C g ≠ +-垐?L L 噲? [][][] A B C A B C c K ≠ ≠ = -L L [][][] () 21 A B C A BC c c c K K c c c ≠ -≠= =L L g () 1 n c c K K c -≠= B c k T k K h ≠ = ()()1 r m ln[]n c G c RT K c -≠≠?=- ()()1r m exp n c G c K c RT ≠ -≠ ?? ? ?=- ??? () ()1r m B exp n G c k T k c h RT ≠ -??? ?=- ?? ? r m r m r m G H T S ≠≠≠???=- ()()()1r m r m B exp exp n S c H c k T k c h R RT ≠≠-?????? ? ?=- ? ????? 说明反应速率还与活化熵有关 若用压力表示,标准态是100 kPa ,速率常数为 ()1r m B exp n G p k T p k h RT RT -≠????? ?=- ? ????? ()()1r m r m B exp exp n S p H p k T p h RT R RT -≠ ≠?? ?????? ? ?=- ? ? ??? ? ? ? ? r m r m ()()G c G p ≠≠?≠? r m r m ()()S c S p ≠≠ ?≠? 在热力学数据表上查到的都是压力是100 kPa 时的数值。 活化络合物的活化能E a 和指前因子A 与诸热力学函数之间的关系 c a 12 E E RT =- 根据活化能定义式 2 a d ln d k E RT T = 代入式 '0B A BC exp E k T f k h f f RT ≠?? =- ??? 得:a 0E E mRT =+ 代入式 B c k T k K h ≠ = 2 a d ln d k E RT T =2ln 1c V K RT T T ≠???????=+?? ???????? 根据化学平衡中的van’t Hoff 公式 r m 2 ln c V K U T RT ≠≠????= ??? ? ()a r m r m m E RT U RT H pV ≠≠ =+?=+?-? 对于凝聚相反应 r m r m U H ≠≠?≈? a r m E H RT ≠=?+ 对于气相反应 ()B m B pV RT ν≠?=∑ a r m B B 1E H RT ν≠≠??=?+- ???∑ 将这个关系代入速率常数计算式 ()()()1r m r m B exp exp n S c H c k T k c h R RT ≠≠-???? ?? ? ?=- ? ???? ? 整理后得 () ()1r m a B exp exp n n S c E k T k e c h R RT ≠ -????? ?=- ? ??? ? ? 与Arrehnius 经验式比较,得 () ()1r m B exp n n S c k T A e c h R ≠ -??? ?= ?? ? 过渡态理论的优缺点 优点: 1.形象地描绘了基元反应进展的过程; 2.原则上可以从原子结构的光谱数据和势能面计算宏观反应的速率常数; 3.对阿仑尼乌斯的指前因子作了理论说明,认为它与反应的活化熵有关; 4.形象地说明了反应为什么需要活化能以及反应遵循的能量最低原理。 缺点: 引进的平衡假设和速决步假设并不能符合所有的实验事实;对复杂的多原子反应,绘制势能面有困难,使理论的应用受到一定的限制。 §11.3 单分子反应理论(theory of unimolecular reaction ) 单分子反应是只有单一反应物参加而实现的反应,现在得知真正的单分子反应只包括在气相中单一反应物分子的解离与异构化或在复杂反应中,关键一步的反应是单分子反应。如果一个分子孤立地处于基态的反应分子不能自发进行反应,实际上,为了使这类反应发生,反应分子必须有足够的能量或以其他方式(如辐射能)或获得能量。碰撞理论认为每次碰撞至少要两个分子,因此严格讲它就不是一级反应,而应称为准一级反应。 一、单分子反应理论 关于单分子反应的早期研究工作中,探讨的焦点集中在下面的两个问题上: ①按照定义单分子反应应该是由一个分子所实现的基元反应, 似乎排除了分子发生碰撞获得活化能的可能, 那么单分子反应是如何获得活化能的呢? ②为什么多原子分子的单分子反应在高压下表现为一级反应, 压力足够低时表现为二级反应? 总之单分子反应究竟是以怎么样的机理进行的? 1922年, 林德曼(lindeman)正确地提出了单分子反应机理, 该机理认为:反应的活化能来自分子间相互热碰撞而获取的. 1、林德曼(Lindemann )单分子气体反应机理或理论要点 (1)反应物A 可以通过碰撞而获得高于反应临界能εc 的能量ε,变成活化分子A ﹡; (2)活化分子A ﹡有可能再经碰撞而失活,回到能量较低的稳定状态,也有可能分解为产物P 。 单分子气体反应的历程为: 总反应 A P ?? → 具体步骤为:*11 1A M A M k k -++()垐垎噲垐 *22 A P k ?? →() M 可以是另一个A ,也可是不参与化学反应的惰性分子。 根据林德曼观点,分子必须通过碰撞才能获得能量,所以不是真正的单分子反应。 2、时滞(time lag )(停滞时间):活化后的分子还要经过一定时间才能离解,这段从活化到反应的时间称为时滞。在时滞中,活化分子可能通过碰撞而失活,也可能把所得能量进行内部传递,把能量集中到要破裂的键上面,然后解离为产物。 对多分子的复杂反应,需要的时间要长一点。 林德曼提出的单分子反应理论就是碰撞理论加上时滞假设,很好的解释了时滞现象和为什么单分子反应在不同压力下会体现不同的反应级数等实验事实。 3、单分子反应的级数 因A ﹡很活泼,可用稳态法处理,根据林德曼机理推导速率方程: *11 1A M A M k k -++()垐垎噲垐 *22 A P k ??→() * 2d[P][A ]d r k t == *2**112d[A ][A][A][A ][A ]0d k k k t -=--= 2*112[A][A ][A]k k k -= + 2 12 12 [A]d[P] d [A]k k t k k -=+ 12 [A]k k -<<低压时,21d[P] [A] d k t =二级反应 12 [A]k k ->>高时压,12 1 d[P][A] d k k t k -=一级反应 2、RRKM 理论 林德曼的单分子反应理论在定性上基本符合实 际,但在定量上往往和实验结果有偏差,后来经过许多学者修正,目前最好的是RRKM 理论。RRKM 理论是20世纪50年代,Marcus 把30年代由RRK (Rice-Ramsperger-Kassel )提出的单分子反应理论与过渡态理论结合,对林德曼的单分子理论加以修正,提出了 k '3603K 时偶氮甲烷的热分解 RRKM 理论,该理论提出的反应机理为: 1*-1 (1)A A A A k k ++垐垎噲垐 * 2()*(2)A A P k E k ≠ ≠???→??→ 富能分子A *要转变成产物P 必须先变成过渡态A *,消耗一部分能量来克服势能垒E b , 这过程就是林德曼理论中的时滞。 RRKM 理论的核心是计算k 2的值。他们认为 k 2 是 E 的函数,当E*<E b , k 2=0;E*>E b ,E*愈大,k 2愈大。 当*b E E <, 20k = 当*b E E >,*22()k k E = 当反应(2)达稳定时, ()2d A A A 0d k E k t ≠ **≠≠ ???? ????=-=???? ()2A A k k E ** ≠≠ ???? =???? §11.4 分子反应动态学简介(molecular reaction dynamics) 概述: 分子反应动态学是在分子水平上或者说从微观的角度研究反应分子在一次碰撞行为 中的动态性质。所以也称微观化学反应动态学。 这种研究起始于二十世纪三十年代,由Eyling ,Polanyi 等人开始,但真正发展是在六十年代,随着新的实验技术(激光防分子束等)和计算机的发展,才取得了一系列可靠的实验资料。 D.R.Herschbach 和美籍华裔科学家李远哲在该领域做出了杰出的贡献,因而分享了1986年诺贝尔化学奖。 1、分子动态学主要研究内容: (1)分子的一次碰撞行为及能量交换过程。即分子如何碰撞,如何进行能量交换。碰撞过程中,旧键如何被破坏,新键又如何形成。形成的产物分子如何进行分离等一系列过程的动态性质。 (2)反应几率与碰撞角度和相对平动能的关系 (3)产物分子所处的各种平动、转动和振动状态 (4)如何用量子力学和统计力学计算速率系数。 也就是说分子反应动态学是研究基元反应的微观历程。 2、微观可逆性原理(principle of micro reversibility) 这是力学中的一个基本原理。在力学方程中,时间t 用-t 代替,速度u 用-u 代替,力学方程不变,意味着力学方程是可逆的,这是力学中的微观可逆原理。 基元反应是分子的一次碰撞行为,应该服从力学的基本定律。将该原理用于基元反应,可表述为: 一个基元反应的逆反应也必然是基元反应,而且逆反应需按原来的途径返回,有相同的过渡态。 一、态-态反应(state to state reaction ) 在宏观动力学的研究中所得的结果是大量分子的平均行为,只遵循总包反应的规律。 态-态反应是从微观的角度,观察具有确定量子态的反应物分子经过一次碰撞变成确定量子态的生成物分子时,研究这种过程的反应特征,需从分子水平上考虑问题。 如双分子基元反应 A + BC → AB + C 宏观研究反应的速率 r=K [A][BC] 式中速率常数k 可用阿仑尼乌斯公式表达 宏观动力学主要任务就是在一定的温度范围内,测定k 值并求出反应活化能Ea 和指前因子A 。所得结果都是在热力学平衡条件下的平均值。是大量分子的平均行为和总包反应的规律。如从微观角度去研究反应,就要知道确定能态的反应物到确定的生成物的反应规律。对上述反应 A (i )+ BC (j ) → A B (m ) + C (n ) 从量子态i 的A 和 量子态j 的BC 发生反应生成量子态分别为m 和 n 的AB 和 C 。这种反应称为态—态反应,这样的反应只能靠个别分子的单次碰撞来完成,需要从分子水平上考虑问题。 二、研究分子反应的实验方法: 为了选择反应分子的某一特定量子态,需要一些特殊设备和装置,主要有分子交叉束、红外化学发光、激光诱荧光等,对于产物的能态也需要用特殊的高灵敏度监测器进行检测。 1、交叉分子束装置示意图 交叉分子束装置主要由5部分组成: (1)束源,用来产生分子束。图中有喷嘴源和溢流源两个束源。 (2)速度选择器,在溢流源上方的一组平行线条,表示带有齿孔的选速盘。 (3)散射器,两束分子交叉的中部为反应散射室。 (4)检测器,在360o 立体角范围内检测碰撞后的结果。 (5)速度分析器,检测产物的速度分布、角分布和平动能分布。 喷嘴源内气体压力很高,突然以超声速向真空作绝热膨胀,分子由随机的热运动转变为有序的束流,具有较大的平动能。这种分子束的速率分布较窄,不需再加选速器,调节源内压力可改变分子速度。由于绝热膨胀后分子束温度较低,分子的转动和振动可处于基态。 溢流源俗称炉子,将反应物放入炉中加热变为蒸气,让蒸气从小孔中溢出形成分子束。它的优点是适用与各种物质,炉子结构简单易控制,缺点是束流强度低,分子的速度分布宽。 速度选择器:溢流源产生的分子束中分子运动的速度具有布兹曼分布,为了使进入散射室的分子具有很窄的速度范围,必须选速。选速器是由一系列带有齿孔的圆盘组成,每个盘上刻有数目不等的齿孔。控制轴的转速,使符合速度要求的分子穿过齿孔进入散射室,不符合速度要求的分子被圆盘挡住,达到选择分子速度的要求。但这样也会降低分子束的强度。 散射室就是交叉分子束的反应室。两束分子在那里正交并发生反应散射 为了防止其它分子的干扰,散射室必须保持超高真空。在散射室周围设置了多个窗口,由检测仪接收来自散射粒子辐射出的光学信号,以便分析它的量子态,或射入特定的激光束,使反应束分子通过共振吸收激发到某一指定的量子态,达到选态的目的。 检测器:检测器用来捕捉在散射室内碰撞后产物的散射方向、产物的分布以及有效碰撞的比例等一系列重要信息。由于稀薄的两束分子在散射室里交叉,只有一小部分发生碰撞,而且有效碰撞的比例更低,产物可能散射到各个不同的方向,所以检测器要灵敏的检 ) ex p(RT E A k a -= 化学动力学基础(一、二)习题 化学动力学基础(一、二)习题 一、选择题: 1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为: (A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分(D) 1/(4.62×102×0.1)分 答案:(B) 2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则: (A ) t1﹥t2(B) t1=t2 (C) t1﹤t2(D) 不能确定二者关系 答案:(B) 3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是: (A) 零级(B) 一级反应(C) 三级反应(D) 二级反应 答案:(B ) 4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例: (A)提高反应温度(B) 降低反应温度 (C) 延长反应时间(D) 加入适当的催化剂 答案:C 5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则 (A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C (B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C (C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C (D)dC D/dt=-K A3C A C C 答案:(B) 6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1, 反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2, 1--化学动力学基础 [教学要求] 1.掌握化学反应速率的基本概念及表示方法。 2.掌握反应机理概念,掌握有效碰撞理论,了解过渡状态理论,掌握活化能、活化分子的概念及其意义。 3.掌握浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系:质量作用定律,化学反应的温度因子,熟悉阿仑尼乌斯方程及其应用。 [教学重点] 1.反应机理的概念,有效碰撞理论,过渡状态理论,活化能、活化分子的概念及其意义。 2.浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系:质量作用定律,化学反应的温度因子,阿仑尼乌斯方程及其应用 [教学难点] 1.有效碰撞理论,过渡状态理论,活化能、活化分子的概念。 2.阿仑尼乌斯方程。 [主要内容] 1.化学反应速率的基本概念及表示方法:平均速率和瞬时速率,同一反应用不同物系表示速率时这些速率间的关系。 2.反应机理(反应历程)概念:基元反应和非基元反应、反应分子数(单分子反应、双分子反应、三分子反应)。 3.反应速率理论简介:有效碰撞理论的基本要点,有效碰撞的条件,有效碰撞、活化能、活化分子的概念,碰撞频率因子与化学反应临界能或阀能的关系公式,活化能、方位因子、碰撞频率因子与反应速率的关系,活化过渡状态理论的基本要点,活化络合物;实验活化能。 4.浓度对化学反应速率的影响:质量作用定律、反应级数、化学反应速率方程式;温度对化学反应速率的影响:阿仑尼乌斯方程式及其应用。 5.催化剂基本概念及其基本特征,催化作用,催化剂对化学反应速率的影响机制 。 [教学内容] §3.1 化学反应速率的概念 3.1.1 平均速率和瞬时速率 1. 平均速率 某一有限时间间隔内浓度的变化量。 2. 瞬时速率 时间间隔Δt 趋于无限小时的平均速率的极限。 1 2NO 2 (CCl 4) + O 2(g) 例:N 2O 5(CCl 4) 2 1 252152252) O N ()O N ()O N (t t c c r --- =t c ??- =)O N (52 lim t r r ?→= 物理化学动力学试卷2 一、选择题( 共16题26分) 1. 298 K时两个级数相同的反应Ⅰ、Ⅱ,活化能EⅠ= EⅡ,若速率常数kⅠ= 10kⅡ,则两 反应之活化熵相差:( ) (A) 0.6 J·K-1·mol-1 (B) 10 J·K-1·mol-1 (C) 19 J·K-1·mol-1 (D) 190 J·K-1·mol-1 2. 实验活化能E a,临界能E c,势垒E b,零度活化能E0概念不同,数值也不完全相等, 但在一定条件下,四者近似相等,其条件是:( ) (A) E0很小(B) E b很小 (C) 温度很低(D) 基态振动频率大 3. 根据微观可逆性原理,反应物分子能量消耗的选择性和产物能量分配的特殊性有对应关系,因此对正向反应产物主要是平动激发,则对逆向反应更有利于促进反应进行的能量形式 应为:() (A)振动能(B)转动能 (C)平动能(D)能量形式不限,只要足够高 4. 双分子反应的速率常数k以cm3·s-1为量纲换算为以mol-1·dm3·s-1为量纲时,应乘以 因子() (A) L(B) 103L (C) 106L2(D) 10-3L 5. 2 分(6037)6037 分子的数密度若以cm-3计,浓度以mol·dm-3计,则k N与k c之关系应为:( ) (A) k c=103Lk N(B) k c=10-3Lk N (C) k c=106L2k N(D) k c=10-6L2k N 6. 2 分(6531)6531 酶催化作用有很多特征,但其主要的缺点是:() (A) 对温度反应迟钝(B) 选择性不高 (C) 催化活性低(D) 极易受酶杂质影响 7. 2 分(6479)6479 光化学反应A2+hν→2A的反应历程为: A2+hν→A2*A2*k1 2AA 2 *+A 2 k2 2A2 可得:r=k1I a/(k1+k2[A2])则该反应之量子产率Φ为( ) (A) 1 (B) 2 (C) k1/(k1+k2[A2]) (D) k2/(k1+k2[A2])·2 8. 2 分(6409)6409 下面四种说法中不正确的是:( ) (A)在具有速控步的反应历程中,达到稳态后,速控步后的各个步骤的反应速 率都等于速控步的反应速率,速控步前的各步骤均处于平衡状态 (B) 根据微观可逆性原理,在反应历程中不可能出现2A →C + 3D 这样的基 元反应 (C) 在光化学反应中,体系的Gibbs自由能总是在不断地降低 (D) 在采用温度跃变的驰豫法来研究溶液中的快速反应时,该反应必须是放热 物理化学动力学试卷3 一、选择题( 共16题26分) 1. 2 分(6453)6453 除多光子吸收外,一般引起化学反应的光谱,其波长范围应是: (A) 可见光(400 - 800 nm) 及紫外光(150 - 400 nm) (B) X射线(5 - 10-4 nm) (C) 远红外射线 (D) 微波及无线电波 2. 2 分(6181)6181 单原子分子A与双原子分子B生成非线性过渡态时,据A(TST)=(k B T/h)[q≠/(q A q B)] 计算A时,q≠为 (A) f t3f r2f v3(B) f t3f r2f v4 (C) f t3f r3f v3(D) f t3f r3f v2 3. 2 分(6104)6104 在过渡态理论的速率方程中,因数RT /Lh或k B T/h对所有反应都是一样的。其值约为∶ (A) 103 s-1 (B) 1013 s (C) 1013 s-1 (D) 103 s 4. 2 分(6109)6109 设气体A和B都是单原子分子,它们发生化合A + B = C,已知一维平动配分函数 f t = 108,一维转动配分函数f r= 10。按过渡态理论,在温度T时,反应的频率因子为: (A) 10-22k B T/h (B) 10-21k B T/h (C) 10-23k B T/h (D) 1023k B T/h 5. 下列双分子反应中: (1) Br + Br →Br2 (2) CH3CH2OH + CH3COOH →CH3CH2COOCH3+ H2O (3) CH4+ Br2→CH3Br + HBr 碰撞理论中方位因子P的相对大小是∶ (A) P(1) > P(2) > P(3) (B) P(1) > P(3) > P(2) (C) P(1) < P(2) < P(3) (D) P(1) < P(3) < P(2) 6. D+B→产物,从各物理量均以基本单位计算所得之k N ,换算为以mol·dm-3为量纲的k c,它们的关系为: (A) k c =Lk N(B) k c=106L2 (C) k c=103Lk N(D) k c=10-3Lk N 7. 理想气体反应A + BC[ABC]≠→产物,若设E a为阿累尼乌斯活化能,?≠H m$表示活化络合物与反应物在标准状态下的焓差,则 $+ RT (A) E a= ?≠H m 化学动力学基础(一) 一、简答题 1.反应Pb(C 2H 5)4=Pb+4C 2H 5是否可能为基元反应?为什么? 2.某反应物消耗掉50%和75%时所需要的时间分别为t 1/2和 t 1/4,若反应对该反应物分别是一级、二级和三级,则t 1/2: t 1/4的比值分别是多少? 3.请总结零级反应、一级反应和二级反应各有哪些特征?平行反应、对峙反应和连续反应又有哪些特征? 4.从反应机理推导速率方程时通常有哪几种近似方法?各有什么适用条件? 5.某一反应进行完全所需时间时有限的,且等于 k c 0(C 0为反应物起始浓度),则该反应是几级反应? 6. 质量作用定律对于总反应式为什么不一定正确? 7. 根据质量作用定律写出下列基元反应速率表达式: (1)A+B→2P (2)2A+B→2P (3)A+2B→P+2s (4)2Cl 2+M→Cl 2+M 8.典型复杂反应的动力学特征如何? 9.什么是链反应?有哪几种? 10.如何解释支链反应引起爆炸的高界限和低界限? 11.催化剂加速化学反应的原因是什么? 二、证明题 1、某环氧烷受热分解,反应机理如下: 稳定产物?→??+?+??→??++??→??? +??→?432134 33k k k k CH R CH R CH RH CO CH R H R RH 证明反应速率方程为()()RH kc dt CH dc =4 2、证明对理想气体系统的n 级简单反应,其速率常数()n c p RT k k -=1。 三、计算题 1、反应2222SO Cl SO +Cl →为一级气相反应,320℃时512.210s k --=?。问在320℃ 加热90min ,22SO Cl 的分解百分数为若干?[答案:11.20%] 2、某二级反应A+B C →初速度为133105---???s dm mol ,两反应物的初浓度皆为 32.0-?dm mol ,求k 。[答案:11325.1---??=s mol dm k ] 3、781K 时22H +I 2HI →,反应的速率常数3-1-1HI 80.2dm mol s k =??,求2H k 。[答 案:113min 1.41---??=mol dm k ] 4、双光气分解反应32ClCOOCCl (g)2COCl (g)→可以进行完全,将反应物置于密 闭恒容容器中,保持280℃,于不同时间测得总压p 如下: [答案: 1.1581a =≈;-14-12.112h 5.8710s k -==?] 5、有正逆反应均为一级反应的对峙反应: D-R 1R 2R 32L-R 1R 2R 3CBr 已知半衰期均为10min ,今从D-R 1R 2R 3CBr 的物质的量为1.0mol 开始,试计算10min 之后,可得L-R 1R 2R 3CBr 若干?[答案:0.375mol] 第十一章 化学动力学 §11.1化学反应的反应速率及速率方程 1.反应速率的定义 非依时计量学反应: 若某反应不存在中间物,或虽有中间物,但其浓度甚微可忽略不计,则此类反应将在整个反应过程中符合一定的计量式。那么,这类反应就称为非依时计量学反应 某反应的化学计量式:B B 0B ν=∑ 对非依时计量学反应,反应进度ξ定义为:B B d d /n ξν= 转化速率为:B B d /d (1/)(d /d )t n t ξξν==& 反应速率为:B B /(1/)(d /d )r V V n t ξ ν==& 即用单位时间单位体积内化学反应的反应进度来定义反应速率。对非依时计量学反应,此定义与用来表示速率的物质B 的选择无关,与化学计量式的写法有关。 对于恒容反应,反应速率可表示为:B B (1/)(d /d )r c t ν= 对任何反应: E F G H e f g h +=+ G E F H d d d d 1111d d d d c c c c r e t f t g t h t =- =-== 2.基元反应 定义:如果一个化学反应,反应物分子在碰撞中相互作用直接转化为生成物分子, 这种反应称为基元反应。基元反应为组成一切化学反应的基本单元。例如: 2222C +M =2C +M C +H =HC +H H +C =HC +C 2C +M =C +M g g 化学反应方程,除非特别注明,一般都属于化学计量方程,而不代表基元反应。 反应机理:反应机理又称为反应历程。在总反应中,连续或同时发生的所有基元反应称为反应机理,在有些情况下,反应机理还要给出所经历的每一步的立体化学结构图。3. 基元反应的速率方程--质量作用定律、反应分子数 (1)反应分子数:基元反应方程式中各反应物分子个数之和,称为反应分子数。 (2)质量作用定律:对于基元反应,反应速率与反应物浓度的幂 乘积成正比。幂指数就是基元反应方程中各反应物的系数。这就是质量作用定律,它只适用于基元反应。 例如:单分子反应:A ??→产物,A A d /d c t kc -= 双分子 反应:A B +?? →产物,A A B d /d c t kc c -= A A +??→产物,2A d /d A c t kc -= (3)说明: 速率方程中的比例常数k ,叫做反应速率常数。温度一定,反应速率常数为一定值,与浓度无关;它是反应本身的属性。同一温度下,比较几个反应的k , k 越大,则反应越快。 基元反应按反应分子数可划分为:单分子反应、双分子反应和三分子反应。 对于非基元反应,只有分解为若干个基元反应时,才能对每个基元反应逐个运用质量作用定律。 4. 化学反应速率方程的一般形式、反应级数 对于化学计量反应 A B Y Z a b y z ++?????→???++由实验数据得出的经验速率 方程,一般形式为: A A A B d d c r kc c t αβ =- =??? 反应级数:速率方程中各反应物浓度项上的指数称为该反应物的级数。 说明:(1)式中各浓度的方次α和β等,分别称为反应A 和B 等的反应分级数,量纲为一。所有浓度项指数的代数和称为该反应的总级数,通常用n (n αβ=++???)表示。n 的大小表明浓度对反应速率影响的大小。 (2)反应级数可以是正数、负数、整数、分数或零,有的反应无法用简单 化学动力学基础(一) 教学目的与要求: 使学生了解和掌握化学动力学的一些基本概念,测定化学反应速率的一般方法,几种简单级数反应的动力学特征,几种典型的复杂分应的动力学特征,温度对反应速率的影响,有自由基参加的反应的动力学特征,拟定反应动力学方程的一般方法。 重点与难点: 化学动力学的一些基本概念:反应的级数与反应的分子数,基元反应与非基元反应以及反应的速率的描述方法等;简单级数反应的动力学特征,几种典型复杂反应的动力学特征,温度对反应速率的影响(反应的活化能的概念),链反应的动力学特征以及动动学方程的推导方法。 §11.1 化学动力学的任务和目的 化学反应用于生产实践所遇到的两个方面的问题和热力学的局限性以及化学动力学的必要性,它的实际意义。 化学动力学的基本任务:1.研究化学反应的速率,以及各种因素(浓度,压力,温度,催化剂)对速率的影响。2.研究反应的机理(历程)。 化学动力学与物质结构的关系:化学动力学和化学热力学的研究方法是不同的。它要研究反应速率及其影响的因素,必须了解体系的物质结构方面的知识,同时,通过对反应速率以及反应机理的研究,也可以加深人们对物质结构的认识。 化学动力学的发展过程:第一阶段,宏观动力学阶段,主要从宏观上测定化学反应的速率,确定反应的级数,在此阶段,确立了质量作用定律和阿累尼乌斯定律,并提出了活化能的概念。 第二阶段,包括从宏观动力学到微观动力学的过程,以及从微观研究化学反应的速度。在这一阶段,建立了各种反应的速度理论,如碰撞理论,过渡状态理论,链反应,单分子反应速度等理论,从二十世纪五十年代开始,分子束和激光技术应用于化学动力学的研究,使人们进入到了态--态反应的层次,研究不同量子态的反应物和产物的速率,以及反应的细节。 化学动力学理论还不能象热力 学理论那样系统和完善。 §11.2化学反应速 率表示法 反应系统中反应物的消耗和 第十二章化学动力学基础(二) 1. 将1.0 g氧气和0.1 g氢气于300 K时在1 dm3的容器内混合,试计算每秒钟内单位体积内分子的碰撞数为若干? 设O2和H2为硬球分子,其直径分别为0.339和0.247 nm. 2. 某双原子分子分解反应的阈能为8 3.68 kJ/mol,试分别计算300 K及500 K时,具有足够能量可能分解的分子占分子总数的分数为多少? 3. 某气相双分子反应, 2A(g) ---> B(g)+C(g),能发生反应的临界能为100 kJ/mol.已知A的相对分子量为60,分子直径为0.35 nm,试计算在300 K时,该分解作用的速率常数k 值. 4. 松节油萜(液体)的消旋作用上一级反应,在457.6 K和510.1 K时的速率 常数分别为2.2×和3.07× min-1,试求反应的实验活化能E a,在平均温度时的活化焓和活化熵. 5. 在298 K时某化学反应,如加了催化剂后使其活化熵和活化焓比不加催化剂是时分别下降了10 J/(mol·K)和10 kJ/mol,试求不加催化剂与加了催化剂的两个速率常数的比值. 6. 在298 K时有两个级数相同的基元反应A和B,其活化焓相同,但速率常数k A=10k B,求两个反应的活化熵相差多少? 7. 某顺式偶氮烷烃在乙醇溶液中不稳定,通过计量其分解放出的N2气来计算其分解的速率常数k值,一系列不同温度下测定的k值如下所示: T/ k 248 252 256 260 264 k×/s-1 1.22 2.31 4.39 8.50 14.3 试计算该反应在298K时的实验活化能,活化焓,活化熵和活化吉布斯自由能. 8. 对下述几个反应,若增加溶液中的离子强度,则其反应速率常数是增大,减小还是不变? (1) NH4+ +CNO- --->CO(NH2)2 (2) 酯的皂化作用. (3) S2O82- + I- --->P 9. 在298 K时,反应N2O4(g) 2NO2(g)的速率常数k1=4.80× s-1,已知NO2和N2O4的生成吉布斯自由能分别为51.3和97.8 kJ/mol,试求 (1)298 K时, N2O4的起始压力为101.325 kPa时, NO2(g)的平衡分压? (2)该反应的弛豫时间? 10. 用温度跳跃技术测量水的离解反应: H2O H+ + OH-,在298 K时 的弛豫时间τ=37× s,试求该反应正向和逆向反应的速率常数k1和k-2. 11. 在光的影响下,蒽聚合为二蒽.由于二蒽的热分解作用而达到光化平衡.光化反应的温度系数(即温度每增加10K反应速率所增加的倍数)是1.1,热分解的温度系数是2.8,当达到光化平衡时,温度每升高10K.二蒽产量是原来的多少倍? 12. 用波长为313nm的单色光照射气态丙酮,发生下列分解反应: (CH3)2CO +hv---> C2H6 + CO ,若反应池的容量是0.059 dm3,丙酮吸收入射光的分数为0.915,在反应过程中,得到下列数据: 反应温度:840 K照射时间t=7 h 第11章化学动力学基础 重点: 基元反应的质量作用定律及其应用,速率方程的积分形式,速率方程的确定,温度对反应速率的影响,阿累尼乌斯方程的各种形式及其应用,指前因子k0、活化能Ea 的定义,典型复合反应及复合反应速率的近似处理法,链反应,气体反应的碰撞理论,势能面与过渡状态理论。 难点: 由反应机理推导速率方程的近似方法(选取控制步骤法、稳态近似法和平衡态近似法)的原理及其应用。 重要公式 2. a ln ()k E k R T T =-211211E k A RT =-+a ln 3.非基元反应的表观活化能: a a,1a,2a,3E E E E =++ 4. 1-1级对行反应:A,0A,11A A,ln ()e e c c k k t c c --=+-B 1A 1,e c ,e c k K c k -== 5. 1-1级平行反应:A,012A c ln ()k k t c =+1B 2C k c k c = 6.平衡态近似法:C 1A B 1c c k K c c k -== 7.稳态近似法:B d 0d c t = 化学动力学是物理化学的一个重要组成部分,其主要任务是 (1) 研究反应速率及其影响因素 (2) 揭示反应的历程,并研究物质结构和反应能力的关系。 动力学和热力学不同:平衡态热力学只讨论系统的平衡态,其性质不随时间而变化,因而不考虑时间这个因素;另外,热力学是用状态函数研究化学反应从始态到终态的可能性,即变化过程的方向和限度,并不涉及化学变化所经历的中间途径和中间步骤。所以,热力学对化学反应的速率和具体反应历程不能给予回答,只能说明反应进行的可能性。 例:298K ,101325Pa 时,氢氧发生反应: H 2(g )+ 1/2O 2(g ) H 2O (l ) Δr G m θ = -287.19 kJ/mol <0,表明反应可自发进行,但在上述条件下,并没有观察到氢氧的变化。 这主要是因为在上述条件下,反应速率太慢,难以达到热力学平衡。 所以,这个反应在上述条件下,从热力学角度看,是可以进行的;但从动力学角度看,则没有实际意义。 但若改变反应条件,升温到1073K 或加入合适的催化剂,反应可瞬间完成。 由此可看出,若一个反应仅从热力学角度判断是自发的,并不说明反应可以实际操作;若从动力学角度看,反应速率太慢,则没有实际意义。 因此,必须从动力学角度进行研究,改变不利状况,使反应能实现。而且,从控制反应过程而言,动力学研究非常重要。且动力学研究远比热力学复杂。它不仅涉及反应速率和反应机理本身,反应条件如:催化剂、温度、压力等对反应速率和反应机理的影响也是很复杂的。 一般可以认为: 热力学——反应的可能性;动力学——反应的可行性。 本章只讨论动力学基础,它包括以下三方面的内容: 动力学基础:反应速率——与反应物浓度、温度的关系 反应机理 反应速率理论 §11.1化学反应的反应速率及速率方程 此文档收集于网络,如有侵权,请 联系网站删除 A. 32 精品文档 B. 36 C. 40 D. 60 第^一、十二章动力学概念理解 1.反应302 2O 3,速率方程 k[O 3】2[O 2]或 d[O ^] k[O 3『[O 2],k 与k 的关系应为: dt dt dD ,已知a be ,则速率常数k A 、k B 、k D 的关系为: k A Ik B A. B. k A k B k D a b d 3. 关于反应速率r ,表达不准确的是: A. 与体系的大小无关而与浓度的大小有关 k A k p C. k A k B k D D. a b d B. 与各物质的浓度标度选择有关 C. 可为正值也可为负值 D. 与反应方程式写法无关 4. 基元反应A 2D 3G ,在298 K 以及2dm 3的容器中进行,若某时刻反应进度随时间的变化率为 0.3mol s -1,则此时的G 的生速率(单位: mol dm -3 s -1)为: 5. 基元反应aA bB gG 的速率表达式中,不准确的是: A. 零级 B. 一级 C.二级 D.三级 7. 某一基元反应,2A(g) B(g) E(g),将2mol 的A 与1mol B 放入1L 的容器中混合并反应,那 么反应物消耗一半时的反应速率与反应起始速率间的比值是: A. 1:2 B. 1:4 C. 1:6 D. 1:8 8. 关于反应级数,说法准确的是: A. 只有基元反应的级数是正整数 B.反应级数不会小于零 C.催化剂不会改变反应级数 D.反应级数都可以通过实验确定 9. 某反应,其半衰期与起始浓度成反比,则反应完成 87.5%的时间1与反应完成50%的时间t 2之间的 关系为: A. t 1 匚 B. t 1 4t 2 C. t 1 7t 2 D. C 5t 2 10. 某反应只有一种反应物,其转化率达到 75%的时间是转化率达到 50%的时间的两倍,反应转化率 达到64%的时间是转化率达到 x%的时间的两倍,贝U x 为: A. 2 k = k B. k = k C. 3k =2k D. 2k =3k 2.简单反应aA bB A. 0.15 B. 0.9 C. 0.45 D.0.2 A. B. d[B] dt k B 【A] a [B] C. d[G] dt k G [G]g D. d[G] dt k G 【A]a [B]b 6.某一反应在有限的时间内可反应完全,所需时间为 C 0 /k ,该反应级数为: 5202 反应 2O 3→ 3O 2的速率方程为 - d[O 3]/d t = k [O 3]2[O 2]-1 , 或者 d[O 2]/d t = k '[O 3]2[O 2]-1,则速率常数 k 和 k ' 的关系是: ( ) (A) 2k = 3k ' (B) k = k ' (C) 3k = 2k ' (D) -k /2 = k '/3 5203 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时 并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( ) (A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 5204 对于反应 2NO 2= 2NO + O 2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( ) (A) -2d[NO 2]/d t = 2d[NO]/d t = d[O 2]/d t (B) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = d ξ /d t (C) - d[NO 2]/d t = d[NO]/d t = d[O 2]/d t (D) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = 1/V d ξ /d t 5207 气相基元反应 2A k 1 B 在一恒容的容器中进行,p 0为 A 的初始压力, p t 为时间 t 时反应 体系总压,此反应速率方程 d p t / d t = 。 - k (2p t - p 0)2 5208 有一反应 mA → nB 是一简单反应,其动力学方程为 -d c A / d t = kc A m , c A 的单位为 mol ·dm -3, 时间单位为 s ,则: (1) k 的单位为 ___________ mol 1- m ·dm 3( m -1)·s -1 (2) 以d c B /d t 表达的反应速率方程和题中给的速率方程关系为 B A A A 1d 1d 'd d m m c c k c k c n t m t m =-== 5209 反应 2N 2O 5─→ 4NO 2+ O 2 在328 K 时,O 2(g)的生成速率为0.75×10-4 mol ·dm -3·s -1。 如其间任一中间物浓度极低, 难以测出, 则该反应的总包反应速率为 _______________mol ·dm -3·s -1, N 2O 5之消耗速率为__________ mol ·dm -3·s -1,NO 2之生成速率为_______________mol ·dm -3·s -1 。0.75×10-4, 1.50×10-4, 3.00×10-4 5210 O 3分解反应为 2O 3─→3O 2 ,在一定温度下, 2.0 dm 3容器中反应。实验测出O 3每秒消耗1.50×10-2 mol, 则反应速率为_______________mol ·dm -3·s -1氧的生成速率为_______________mol ·dm -3·s -1, d ξ /d t 为_______________ 0.75×10-2, 2.25×10-2, 1.50×10-2.。 5211 2A +B =2C 已知反应某一瞬间, r A =12.72 mol ·dm -3·h -1, 则 r B = , r C =_____________r B =6.36 mol ·dm -3·h -1, r C =12.72mol ·dm -3·h -1 5212分别用反应物和生成物表示反应A +3B =2C 的反应速率, 并写出它们间关系为: 。r A = 13r B =1 2 r C 5222 有关基元反应的描述在下列诸说法中哪一个是不正确的: ( ) (A) 基元反应的级数一定是整数 (B) 基元反应是“态-态”反应的统计平均结果 (C) 基元反应进行时无中间产物,一步完成 (D) 基元反应不一定符合质量作用定律 5223 400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,如速率常数用 k C 表示,则 k C 应为: (A) 3.326 (mol ·dm -3)-1·s -1 k C = k p (RT ) (B) 3.0×10-4 (mol ·dm -3)-1·s -1 (C) 3326 (mol ·dm -3)-1·s -1 (D) 3.0×10-7 (mol ·dm -3)-1·s -1 5224 如果反应 2A + B = 2D 的速率可表示为: 第11章 化学动力学基础 重点: 基元反应的质量作用定律及其应用,速率方程的积分形式,速率方程的确定,温度对反应速率的影响,阿累尼乌斯方程的各种形式及其应用,指前因子k0、活化能Ea 的定义,典型复合反应及复合反应速率的近似处理法,链反应,气体反应的碰撞理论,势能面与过渡状态理论。 难点: 由反应机理推导速率方程的近似方法(选取控制步骤法、稳态近似法和平衡态近似法)的原理及其应用。 重要公式 2. a ln ()k E k R T T =-211211 E k A RT =-+a ln 3.非基元反应的表观活化能: a a,1a,2a,3E E E E =++ 4. 1-1级对行反应:A,0A,11A A,ln ()e e c c k k t c c --=+- B 1A 1,e c ,e c k K c k -== 5. 1-1级平行反应:A,012A c ln ()k k t c =+ 1B 2C k c k c = 6.平衡态近似法:C 1A B 1c c k K c c k -== 7.稳态近似法:B d 0d c t = 化学动力学是物理化学的一个重要组成部分,其主要任务是 (1)研究反应速率及其影响因素 (2)揭示反应的历程,并研究物质结构和反应能力的关系。 动力学和热力学不同:平衡态热力学只讨论系统的平衡态,其性质不随时间而变化,因而不考虑时间这个因素;另外,热力学是用状态函数研究化学反应从始态到终态的可能性,即变化过程的方向和限度,并不涉及化学变化所经历的中间途径和中间步骤。所以,热力学对化学反应的速率和具体反应历程不能给予回答,只能说明反应进行的可能性。 例:298K,101325Pa时,氢氧发生反应: H2(g)+ 1/2O2(g)H2O(l) Δr G mθ = -287.19 kJ/mol < 0,表明反应可自发进行,但在上述条件下,并没有观察到氢氧的变化。 这主要是因为在上述条件下,反应速率太慢,难以达到热力学平衡。 所以,这个反应在上述条件下,从热力学角度看,是可以进行的;但从动力学角度看,则没有实际意义。 但若改变反应条件,升温到1073K或加入合适的催化剂,反应可瞬间完成。 由此可看出,若一个反应仅从热力学角度判断是自发的,并不说明反应可以实际操作;若从动力学角度看,反应速率太慢,则没有实际意义。 因此,必须从动力学角度进行研究,改变不利状况,使反应能实现。而且,从控制反应过程而言,动力学研究非常重要。且动力学研究远比热力学复杂。它不仅涉及反应速率和反应机理本身,反应条件如:催化剂、温度、压力等对反应速率和反应机理的影响也是很复杂的。 一般可以认为: 热力学——反应的可能性;动力学——反应的可行性。 本章只讨论动力学基础,它包括以下三方面的内容: 动力学基础:反应速率——与反应物浓度、温度的关系 反应机理 反应速率理论 第十一、十二章 动力学概念理解 1. 反应233O 2O →,速率方程2232d[O ] [O ][O ]d k t - =或2332d[O ][O ][O ]d k t '-=,k 与k '的关系应为: A. 2k =k ' B. k = k ' C. 3k =2k ' D. 2k =3k ' 2. 简单反应A B D a b d +=,已知a b c <<,则速率常数A k 、B k 、D k 的关系为: A. A B D k k k a b d << B. A B D k k k << C. A B D k k k >> D. A B D k k k a b d >> 3. 关于反应速率r ,表达不准确的是: A. 与体系的大小无关而与浓度的大小有关 B. 与各物质的浓度标度选择有关 C. 可为正值也可为负值 D. 与反应方程式写法无关 4. 基元反应A 2D 3G +→,在298K 以及23dm 的容器中进行,若某时刻反应进度随时间的变化率为0.3-1mol s ?,则此时的G 的生速率(单位:-3-1mol dm s ??)为: A. 0.15 B. 0.9 C. 0.45 D.0.2 5. 基元反应A B G a b g +=的速率表达式中,不准确的是: A. A d[A][A][B]d a b k t - = B. B d[B] [A][B]d a b k t -= C. G d[G][G]d g k t = D. G d[G][A][B]d a b k t = 6. 某一反应在有限的时间内可反应完全,所需时间为0/c k ,该反应级数为: A. 零级 B. 一级 C. 二级 D.三级 7. 某一基元反应,2A(g)B(g)E(g)+→,将2mol 的A 与1mol B 放入1L 的容器中混合并反应,那么反应物消耗一半时的反应速率与反应起始速率间的比值是: A. 1:2 B. 1:4 C. 1:6 D. 1:8 8. 关于反应级数,说法准确的是: A. 只有基元反应的级数是正整数 B. 反应级数不会小于零 C. 催化剂不会改变反应级数 D. 反应级数都可以通过实验确定 9. 某反应,其半衰期与起始浓度成反比,则反应完成87.5%的时间1t 与反应完成50%的时间2t 之间的关系为: A. 12t t = B. 124t t = C. 127t t = D. 125t t = 10. 某反应只有一种反应物,其转化率达到75%的时间是转化率达到50%的时间的两倍,反应转化率达到64%的时间是转化率达到x %的时间的两倍,则x 为: A. 32 B. 36 C. 40 D. 60 化学动力学基础(一、二)习题 一、选择题: 1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为: (A) 1/(6.93×10-2×0.12) (B) 15分 (C) 30分(D) 1/(4.62×102×0.1)分 答案:(B) 2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则: (A ) t1﹥t2(B) t1=t2 (C) t1﹤t2(D) 不能确定二者关系 答案:(B) 3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是: (A) 零级(B) 一级反应(C) 三级反应(D) 二级反应 答案:(B ) 4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例: (A)提高反应温度(B) 降低反应温度 (C) 延长反应时间(D) 加入适当的催化剂 答案:C 5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则 (A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C (B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C (C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C (D)dC D/dt=-K A3C A C C 答案:(B) 6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1, 反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2, K2/ K1=(3 t1/2’ C0’/2 t1/2” C0”2)则 (A) Ⅰ为零级, Ⅱ为二级(B) Ⅰ为一级,Ⅱ为三级 (C) Ⅰ为二级, Ⅱ为零级(D) Ⅰ为二级, Ⅱ为三级 答案:(D) 7、某反应, 以㏒(-dC/dt) 对㏒C作图得直线, 如果该反应为二级, 则直线的 (A)截距=2 (B) 截距=0.3010 (C) 斜率=2 (D) 截距/斜率=2 答案:(C) 8、微观可逆性原则不适用的反应是 (A)H2+I2=2HI (B)Cl+Cl=Cl2 第十二章 化学动力学基础(二) 1.在K 300时,将)(0.12g gO 和)(1.02g gH 在30.1gdm 的容器内混合,试计算每秒钟、每单位体积内分子碰撞的总数?设)(2g O 和)(2g H 为硬球分子,其直径分别为 nm 339.0和nm 247.0。 解:)(1093.2102 247 .0339.02 1092 2m d d d H O AB --?=?+= += )(10896.110016 .200.32016 .200.321332 222---??=?+?= +?= mol kg M M M M H O H O μ )(10881.11011 1002.600.320.13253 232--?=????==m n n O A )(10968.210 111002.6016.21.03253 232 --?=????==m n n H B 25 253 2102 10 986.210881.110896.114.3300314.88)1093.2(14.38????????? ??==--B A AB AB n n RT d Z πμ π )(1077.21335--??=s m Z AB 2.请计算恒容下,温度每增加K 10时, (1)碰撞频率增加的百分数; (2)碰撞时在分子连心线上的对平动能超过180-?=mol kJ E c 的活化分子对的增加百分数; (3)由上述计算结果可得出什么结论? 解:(1)B A AB AB n n RT d Z πμ π82 = T n n R d Z B A AB AB ln 2 1 )8ln(ln 2 +=∴πμπ T dT Z d AB 21 ln = 或T dT Z dZ AB AB 2= 当温度变化范围不太大时,有 T T Z Z AB AB 2?= ? 如K T 298=,K T 10=?时,有 %68.1298 210=?= ?AB AB Z Z 第八章 化学反应动力学(Chemical kinetics) 1.(基础题★)气体反应SO 2Cl 2 = SO 2 + Cl 2为一级反应。在593K 时的k = 2.20×10-5 s -1。求半衰期和反应2h 后分解的百分比。 解:1/25 ln 20.693315002.2010t s k -===? 5100ln 2.21023600 1.58410c kt c x --==???=?- 0000 1 1.171611.1716100%14.65%1.17161c x x c x c c -===?=--, 4.某二级反应,经过500s 原始物作用了20%,问原始物作用60%时须经过多少时间? 解:根据二级反应速率方程 s t c c s t c c kt c c 3000,4.0'500,8.011000 =====-则 5.证明一级反应完成99.9%所需时间是其半衰期的10倍。 证: 0000111ln ln ln10000.001c c t k c x k c k ===-,1/2ln 2t k =, ∴1/2/ln1000/ln 29.96610t t ==≈, ∴一级反应完成99.9%所需时间为其t 1/2的10倍 7.在760℃加热分解N 2O 。当N 2O 起始压力p 0 = 38.66 kPa 时,半衰期为255s ,p 0 = 46.66 kPa 时,半衰期为212s 。求反应级数和时p 0 = 101.3 kPa 的半衰期。 解:利用公式1200lg()lg(255212)1110.9822lg()lg(46.6638.66) t t n p p '''=+=+=+≈''', ∴反应为2级反应 ∵1/201t kc =,∴1/2001/200t c p t c p '''''=='''',∴ 01/21/2038.6625597.62101.325 p t t p ''?'''==≈' s 10.根据速率方程 《动力学部分》题库及题解 一、填空题: 1.何为具有简单级数的反应:反应速率只与浓度有关,且组分级数和反应总级数为零或正整数,某反应A+B=P为基元反应,则该反应的反应级数为:二级,该反应的反应速率与反应物浓度的关系可表示为r=k[A][B],得此关系的理由是基元反应遵守质量作用定律,该反应的分子数为:二,得此结论的理由是基元反应的反应级数等于反应分子数。 2.对峙反应A B,其正反应的速率可表示为:r正=k1[A];逆 反应的速率为:r 逆=k -1 [B],该对峙反应的净速率可表示为:r=r 正 -r 逆 =k1[A]-k -1 [B];当反应达到平衡时,正、逆反应速率常数之间的关系可表示为k1[A]-k-1[B]或k1/k-1=[B]/[A]=K。 3.阿累尼乌斯经验式为:k=Aexp(-E a/RT)或lnk=-E a/RT+lnA;从式中可以得出活化能越大,反应速率越慢。阿累尼乌斯的活化能意义是对基元反应有明确的意义,活化分子的平均能量与所有分子平均能量之差,此意义适用于基元反应(基元反应、非基元反应、都适用?)。实验测定活化能的方法是:测不同温度下的速率常数k,作lnk~1/T关系图,通过斜率求得活化能。 4.某气体反应A+B—→3C的速率方程为r==kCαA CβB,为确定α、β值在常温 下进行实验,当初始压力为P A ,0=102Pa,P B ,0 =105Pa时,作反应的lnP A~t(时间) 图为一直线,当初始压力为P A ,0=P B ,0 =5×102Pa时,仍作反应的lnP A~t图仍为一 直线,则α=1,β=0。(lnc~t成直线关系的是一级反应) 5.何为基元反应由反应物直接变为产物的反应(一步完成的反应),基元反应的速率与反应物浓度的关系符合质量作用定律定律。如果反应2A+B=P为基元反应,则反应速率与浓度的关系可表示为:r=k[A]2[B],该反应的反应级数为:三级,反应的分子数为:三分子反应。 6.温度对反应速率的影响可用阿累尼乌斯经验式来衡量,其经验式 的数学表达式为:k=Aexp(-E a /RT)或lnk=-E a /RT+lnA;从此经验式中可得 出反应速率与二个重要的动力学参量有关,它们分别是活化能E a 和指前因子A,实验测定这二个参量的方法是:测不同温度下的速率常数k,作化学动力学基础(一、二)习题
1--化学动力学基础
物理化学动力学 试题2
物理化学动力学 试题3
第十一章 化学动力学基础(一)习题
物理化学 第七章动力学
化学动力学基础(一)
化学动力学基础二
化学动力学基础
最新整理物理化学动力学学习资料
化学反应动力学基础(一)-学生
化学动力学基础.
物理化学动力学分解
化学动力学基础(一、二)习题
第十二章化学动力学基础(二)
王淑兰 物理化学(第三版)【第八章】 化学反应动力学 习题解答
物理化学动力学测试卷