FMT 小动物活体荧光断层成像技术的特点及优势
小动物活体光学成像技术已出现近10年时间,并已被应用于生物及医学研究的诸多领域。然而,随着各项研究的深入,传统的小动物活体成像系统已在诸多方面无法满足研究的需求,主要表现于:1、无法实现深层信号的观测;2、无法进行绝对精确定量;3、无法获取真实的3D 重建信息;4、无法与其它分子成像系统(如CT 、PET 、MRI 等)进行联合使用;5、无法应用于临床研究。Perkinelmer 公司全新推出的FMT (Fluorescence Molecular Tomography )小动物活体荧光断层成像技术是小动物活体成像领域的新一代技术,该技术由哈佛大学医学院分子影像中心历经10年时间而研发成熟,是对现有活体光学成像技术的革新与完善,与现有技术相比,FMT 成像技术的主要特点及优势如下:
1. 真正的绝对精确定量
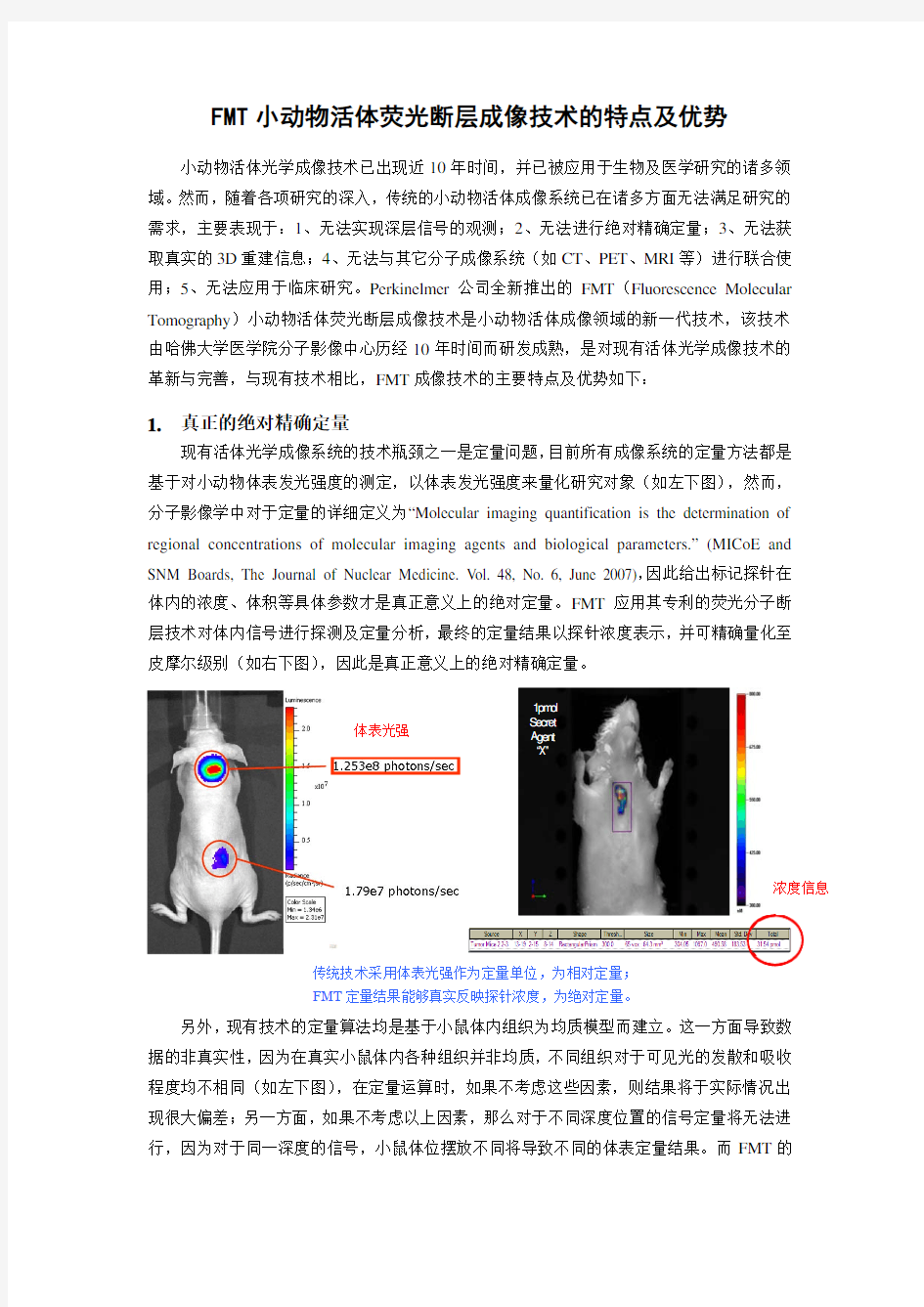
现有活体光学成像系统的技术瓶颈之一是定量问题,目前所有成像系统的定量方法都是基于对小动物体表发光强度的测定,以体表发光强度来量化研究对象(如左下图),然而,分子影像学中对于定量的详细定义为“Molecular imaging quantification is the determination of regional concentrations of molecular imaging agents and biological parameters.” (MICoE and SNM Boards, The Journal of Nuclear Medicine. V ol. 48, No. 6, June 2007),因此给出标记探针在体内的浓度、体积等具体参数才是真正意义上的绝对定量。FMT 应用其专利的荧光分子断层技术对体内信号进行探测及定量分析,最终的定量结果以探针浓度表示,并可精确量化至皮摩尔级别(如右下图),因此是真正意义上的绝对精确定量。
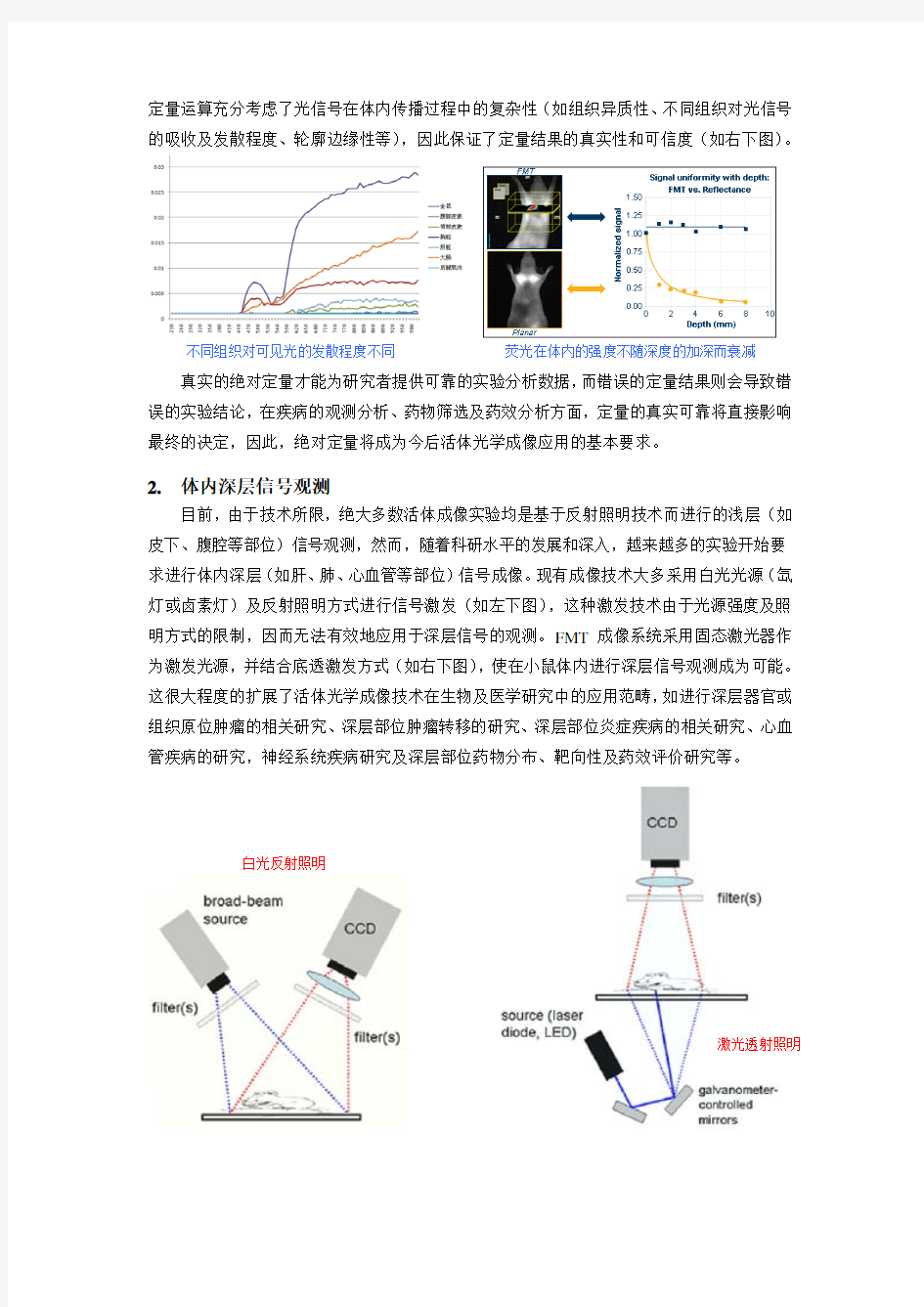
另外,现有技术的定量算法均是基于小鼠体内组织为均质模型而建立。这一方面导致数据的非真实性,因为在真实小鼠体内各种组织并非均质,不同组织对于可见光的发散和吸收程度均不相同(如左下图),在定量运算时,如果不考虑这些因素,则结果将于实际情况出现很大偏差;另一方面,如果不考虑以上因素,那么对于不同深度位置的信号定量将无法进行,因为对于同一深度的信号,小鼠体位摆放不同将导致不同的体表定量结果。而FMT
的
体表光强 浓度信息 传统技术采用体表光强作为定量单位,为相对定量;
荧光在体内的强度不随深度的加深而衰减 不同组织对可见光的发散程度不同 白光反射照明
定量运算充分考虑了光信号在体内传播过程中的复杂性(如组织异质性、不同组织对光信号的吸收及发散程度、轮廓边缘性等),因此保证了定量结果的真实性和可信度(如右下图)。
真实的绝对定量才能为研究者提供可靠的实验分析数据,而错误的定量结果则会导致错误的实验结论,在疾病的观测分析、药物筛选及药效分析方面,定量的真实可靠将直接影响最终的决定,因此,绝对定量将成为今后活体光学成像应用的基本要求。
2. 体内深层信号观测
目前,由于技术所限,绝大多数活体成像实验均是基于反射照明技术而进行的浅层(如皮下、腹腔等部位)信号观测,然而,随着科研水平的发展和深入,越来越多的实验开始要求进行体内深层(如肝、肺、心血管等部位)信号成像。现有成像技术大多采用白光光源(氙灯或卤素灯)及反射照明方式进行信号激发(如左下图),这种激发技术由于光源强度及照明方式的限制,因而无法有效地应用于深层信号的观测。FMT 成像系统采用固态激光器作为激发光源,并结合底透激发方式(如右下图),使在小鼠体内进行深层信号观测成为可能。这很大程度的扩展了活体光学成像技术在生物及医学研究中的应用范畴,如进行深层器官或组织原位肿瘤的相关研究、深层部位肿瘤转移的研究、深层部位炎症疾病的相关研究、心血管疾病的研究,神经系统疾病研究及深层部位药物分布、靶向性及药效评价研究等。
激光透射照明
激光透射照明
LED 反射照明通过反射激发成像无法呈现深度信号(左),而通过FMT 透射激发成像,能够清晰呈现肺部哮喘信号(右)
FMT 硬件结构示意图 FMT 三维成像结果
3. 3D 断层扫描及重建
随着研究水平的提高,传统基于二维体表成像的方式已不能满足科研的需要,因为所有生命现象均不是发生在二维水平,要获取完整丰富的生物学数据,必须在三维水平进行成像、观测及分析。
FMT 荧光3D 断层技术利用激光底透扫描以及超声探头深度定位的方式(左下图),获取10万级数量的不同断层深度荧光信息
(右下图),并结合独特的算法及强大的3D 重建和分析软件实现真实的三维断层信号扫描及重建,从而得到目的荧光的形态,浓度,体积等三维定量信息,实现了从二维水平研究向三维水平的突破。
而目前其他3D成像技术完全是对FMT技术的不成功模仿:从硬件角度来说,虽然也采用底部透射照明方式,但其光源仍为白光光源(左上图上),如上所述无法实现深层信号的有效激发,另外,其底部激发点的限定是通过一个多孔铁板(左上图下),由于小孔数量有限,因此无法得到数以万计的丰富数据,再者,其没有用于探测小鼠体位深度的探测器(如超声探头),因而无法给出不同深度的分层信息,导致其3D重建仍是基于体表光学信号的简单回归(右上图);从软件及3D重建算法而言,FMT充分考虑了小鼠组织异质性、散射性、厚度不一致性等因素对于3D重建准确度的影响,因此保证了3D数据定量的准确度及真实性,而其它模仿技术均未考虑上述复杂因素,因此在真实性及准确度方面相去甚远,可以说这些模仿技术均是伪三维技术。
4.多通道探针同时成像
之前,应用可见光成像技术的研究大多局限于在一个实验中使用一种探针观测一种生物学现象。然而,生物体是由复杂的网络构成,任何一个生物学过程都不可能单独发生,因此,分子成像的目的是在整体水平研究疾病相关分子事件及其相互作用网络的动态变化。这就需要成像系统具备同时成像多种探针的能力。
FMT成像系统配备有多个通道的激光器(2个或4个),因此,研究人员可以同时利用不同波段的多个探针标记多种对象,从而在一个实验中观测相关的生物学过程,如利用肿瘤靶向探针反映肿瘤本身变化,同时利用新生血管标记探针揭示在肿瘤发展过程中其周边新生血管的生成。
5.多模式成像
分子影像学发展至今,陆续出现了基于小动物活体成像的micro CT、micro MRI、micro PET、micro SPECT及micro Ultrasound,研究人员已将各种影像方法广泛应用于小动物活体水平研究。而随着研究的深入以及技术的发展,分子影像学的发展趋势已从单独使用一种成像模式转为同时结合多种成像模式获取更为丰富的生物学数据,如将PET或SPECT与CT 联用,在获取功能性影像数据的同时,得到结构性解剖学信息。因此,将多种影像学方法结合使用,已成为今后分子影像学发展的方向。
FMT小动物活体成像系统除具备可见光活体成像功能外,还配备有与其他成像模式结合使用的配套模块,通过这些适配器(如下图上),可实现FMT与MRI(Bruker)、CT (GE/Gamma Medica)、SPECT/PET/CT(Siemens)等多种影像系统的复合使用(如下图下),获取更为丰富的影像学信息,使科研水平得到极大提升。
6.生物医学转化潜力
目前,活体光学成像技术的应用领域主要局限于利用小动物进行临床前研究。然而,由
于可见光成像相对于核素成像或磁共振成像具有诸多优势,如操作简便、结果直观、测量快速、对人体无辐射、对环境要求不高及费用低廉等,因此,研究人员希望在未来能够将可见
光成像技术应用于临床医学诊断。
限制可见光成像技术应用于临床的主要原因之一是目前尚未出现合适的应用于人体的
荧光探针。在小动物研究中目前使用的标记手段有两大类:一是利用荧光素酶或荧光蛋白作
为探针,通过基因改造的方法而对研究对象进行光学标记(如将荧光素酶基因稳定转染整合
至目标细胞);二是利用一些荧光有机染料或量子点等荧光探针,通过化学结合等方式直接
标记研究对象(如使用ICG染料标记抗体,观测抗体在体内的分布靶向等特性)。由上述标
记原理可知,第一类标记方法不可能被应用于人体标记,因为不可能将人的基因进行此类改造,另外,由于第一类方法的标记操作需要在体外完成,因此无法进行原发疾病的侦测。而
第二类标记方式不需要对研究对象有任何改造,因此具备应用于临床研究的潜力。
PerkinElmer公司一直致力于医学诊断解决方案的发展,因此,在推出FMT成像系统的
同时,还配套推出了多种具有诊断潜能的荧光探针(如下图),这些探针包括能够检测与疾
病发展相关的酶活性的探针(MMPSense、ProSense等)、能够反应血管相关病理的探针(AngioSense等)、能够识别靶向肿瘤表面标识物的探针(IntegriSense)以及用于蛋白、抗体、多肽等分子物质标记的荧光染料和量子点。这些探针的研发目的均是为了从转录后水平
监测疾病的发展过程,因此随着技术的完善,相信将可见活体成像及监测技术应用于临床将
成为可能。
FMT——小动物活体荧光成像的金标准和最佳选择!!
活体动物光学成像系统在活体荧光成像中的应用 第一部分技术原理 一、技术简介 随着活体动物光学成像技术在国内外的普及和应用,越来越多的科研人员希望能通过该技术来观察活体动物体内肿瘤细胞的生长以及对药物治疗的反应,希望能观察到荧光标记的多肽、抗体、小分子药物在体内的分布和代谢情况。NightOWL ⅡLB 983 NC320活体动物光学成像系统正是为满足这样的应用需求而设计的。该系统通过荧光光路的特殊设计,实现了对激发光的能量控制和调节,提高了活体荧光成像的稳定性和灵敏度,并且该系统操作简单、费用低廉、不涉及放射性,是不错的进行活体荧光成像的仪器。与传统技术相比,活体荧光成像技术不需要杀死动物,可以对同一个动物进行长时间反复跟踪成像,既可以提高数据的可比性,避免个体差异对试验结果的影响。更重要的是,该技术可以得到直观的成像图片,了解标记物在动物体内的分布和代谢情况,避免了传统的体外实验方法的诸多缺点,特别是在药物制剂学、药物临床前研究中有不可估量的应用前景。 NightOWL ⅡLB 983 NC320活体荧光体内成像技术的基本原理是激发光源通过特殊的光路设计使其能量稳定、强度合适的激发光使荧光基团达到较高的能量水平,然后发射出较长波长的散射光,该散射光可以穿透实验动物的组织并且可由仪器cooling slow scaning CCD以光子数量化检测到光强度,同时反应出标记物的数量。 二、标记原理 活体荧光成像技术有三种标记方法:荧光蛋白标记、荧光染料标记和量子点标记。荧光蛋白适用于标记肿瘤细胞、病毒、基因等。通常使用的是GFP、EGFP、RFP(DsRed)等。荧光染料标记和体外标记方法相同,常用的有Cy3、Cy5、Cy5.5及Cy7,可以标记抗体、多肽、小分子药物等。量子点标记作为一种新的标记方法,是有机荧光染料的发射光强的20倍,稳定性强100倍以上,具有荧光发光光谱较窄、量子产率高、不易漂白、激发光谱宽、颜色可
FMT 小动物活体荧光断层成像技术的特点及优势 小动物活体光学成像技术已出现近10年时间,并已被应用于生物及医学研究的诸多领域。然而,随着各项研究的深入,传统的小动物活体成像系统已在诸多方面无法满足研究的需求,主要表现于:1、无法实现深层信号的观测;2、无法进行绝对精确定量;3、无法获取真实的3D 重建信息;4、无法与其它分子成像系统(如CT 、PET 、MRI 等)进行联合使用;5、无法应用于临床研究。Perkinelmer 公司全新推出的FMT (Fluorescence Molecular Tomography )小动物活体荧光断层成像技术是小动物活体成像领域的新一代技术,该技术由哈佛大学医学院分子影像中心历经10年时间而研发成熟,是对现有活体光学成像技术的革新与完善,与现有技术相比,FMT 成像技术的主要特点及优势如下: 1. 真正的绝对精确定量 现有活体光学成像系统的技术瓶颈之一是定量问题,目前所有成像系统的定量方法都是基于对小动物体表发光强度的测定,以体表发光强度来量化研究对象(如左下图),然而,分子影像学中对于定量的详细定义为“Molecular imaging quantification is the determination of regional concentrations of molecular imaging agents and biological parameters.” (MICoE and SNM Boards, The Journal of Nuclear Medicine. V ol. 48, No. 6, June 2007),因此给出标记探针在体内的浓度、体积等具体参数才是真正意义上的绝对定量。FMT 应用其专利的荧光分子断层技术对体内信号进行探测及定量分析,最终的定量结果以探针浓度表示,并可精确量化至皮摩尔级别(如右下图),因此是真正意义上的绝对精确定量。 另外,现有技术的定量算法均是基于小鼠体内组织为均质模型而建立。这一方面导致数据的非真实性,因为在真实小鼠体内各种组织并非均质,不同组织对于可见光的发散和吸收程度均不相同(如左下图),在定量运算时,如果不考虑这些因素,则结果将于实际情况出现很大偏差;另一方面,如果不考虑以上因素,那么对于不同深度位置的信号定量将无法进行,因为对于同一深度的信号,小鼠体位摆放不同将导致不同的体表定量结果。而FMT 的 体表光强 浓度信息 传统技术采用体表光强作为定量单位,为相对定量;
上海光源X射线成像讲习班2013年10月23-25日上海 X 射线荧光成像 邓彪 上海光源国家科学中心先进成像实验室
目录 X射线荧光光谱基本原理 X射线荧光成像 X射线荧光mapping X射线荧光CT 上海光源成像线站 X射线荧光成像系统上海光源成像线站X 实验装置 重建算法 实验操作
X射线荧光的产生 当试样受到x射线、高 能粒子束、紫外光等照射时,由于高能粒子或光子与试样原子碰撞,将原子内层电子逐出形成空穴,使原子处于激发态,这种 激发态离子寿命很短,当外层电子向内层空穴跃迁时,多余的能量即以x射线的形式放出,并在外层产生新的空穴和产生新的x射线发射,这样便产生一系列的特征x射线。
莫斯莱定律 1913年,英国物理学家莫斯莱(Moseley)就详细研究了不同元素的特征X 射线谱,依据实验结果确立了原子序数Z 与X 射线波长之间的关系射线波长之间的关系。。这就是莫斯莱定律: 不同的元素具有不同的特征X 射线,根据特征谱线的波长波长,,可以判断元素的存在可以判断元素的存在,,即定性分析分析。。 根据谱线的强度,可以进行定量分析分析。。
特征X 射线线系 并不是对应于所有能级组合 的谱线都能出现的谱线都能出现,,而是必须遵 守电子跃迁的选择定则进行跃 迁,才能辐射出特征X 射线射线。。 ?n=1的跃迁产生的线系命名 为α线系线系,,?n=2的跃迁产生的 线系命名为β线系线系,,依次类推依次类推。。 各系谱线产额依K ,L ,M 系顺序递减系顺序递减,,因此原子序数<55的元素通常选K 系谱线做为分析线系谱线做为分析线,,原子序数>55的元素元素,,选L 系谱线做为分析线系谱线做为分析线。。
荧光成像的原理与方法 荧光成像在基因组学和蛋白质组学等生物学领域应用中的独特优势: 高灱敏度:灱敏度进超比色法,在大部分应用中其灱敏度近乎放射性同素。 多组样品一次成像:将不同样品(如:对照、处理)通过不同发射波长的荧光素标记(如 Cy3或 Cy5等)可以同时检测多样品荧光信号。 稳定性高:较放射性同位素相比,荧光素标记的抗体、杂交探针、PCR引物等的信号稳定性优势明显,可稳定存在数月以上,这使需要大规模标记并多阵列之间的标准化比较成为了可能。 低毒性成本低:多数情况下,荧光标记和检测的全过程试验用手套即可对实验者提供足够的保护。易于运输和实验后处理,多数情况下实验成本低于放射性同位素。 商业可获得性:许多重要的荧光标记型生物大分子如各种单抗、多抗、CAT等及荧光标记用试剂盒都可以方便获得,同时一些公司提供荧光标记的外包服务。 荧光信号的产生及信号捕获原理: 荧光物质被特定外界能量激发(如激光等高能射线),引起其电子轨道向高能轨道跃迁, 并最终释放能量回归基态的过程中会产生可被检测的荧光信号。当然不是所有的物质都能被激发产生荧光,只有当该物质与激发光具有相同的频率并在吸收该能量后具有高的荧光效率而非将能量消耗于分子间碰撞过程中,其荧光信号才可被光学设备所检测(Fig.1)。 Fig.1 ①激发能②无辐射弛豫能③荧光发射能。三种荧光素(绿色:fluorescein;黄色:DNA-bound TOTO TM;红色:DNA-bound EB)的激发光波长(a)和发射光波长(b)。 荧光成像系统的组件和工作原理: 荧光物质被激发后所发射的荧光信号的强度在一定范围内是与荧光素存在的量成线性关系的,这是荧光成像系统应用于生物学研究的理论基础,激光扫描系统的性能指标主要有:系统分辨率、线性范围、均一性、灱敏度。 为了实现荧光信号的激发、捕获和放大的检测过程,按照顺序荧光成像系统主要包括以下组件:激发源(Excitation resource)、激光传输组件(Light delivery optics)、荧光收集组件(Light collection optics)、发射滤镜(Emission filter)和信号检测放大组件(Detection and amplification)(Fig.2)。在荧光成像系统工作的过程中,每个组件的性能都关系着最终荧光信号的收集和检测结果。
小动物活体成像技术 关键词:动物成像分子影像学光学成像2010-04-20 00:00来源:互联网点击次数:5089 1、背景和原理 1999年,美国哈佛大学Weissleder等人提出了分子影像学(molecular imaging)的概念——应用影像学方法,对活体状态下的生物过程进行细胞和分子水平的定性和定量研究。 传统成像大多依赖于肉眼可见的身体、生理和代谢过程在疾病状态下的变化,而不是了解疾病的特异性分子事件。分子成像则是利用特异性分子探针追踪靶目标并成像。这种从非特异性成像到特异性成像的变化,为疾病生物学、疾病早期检测、定性、评估和治疗带来了重大的影响。 分子成像技术使活体动物体内成像成为可能,它的出现,归功于分子生物学和细胞生物学的发展、转基因动物模型的使用、新的成像药物的运用、高特异性的探针、小动物成像设备的发展等诸多因素。目前,分子成像技术可用于研究观测特异性细胞、基因和分子的表达或互作过程,同时检测多种分子事件,追踪靶细胞,药物和基因治疗最优化,从分子和细胞水平对药物疗效进行成像,从分子病理水平评估疾病发展过程,对同一个动物或病人进行时间、环境、发展和治疗影响跟踪。 2、分子成像的优点 分子成像和传统的体外成像或细胞培养相比有着显著优点。首先,分子成像能够反映细胞或基因表达的空间和时间分布,从而了解活体动物体内的相关生物学过程、特异性基因功能和相互作用。第二,由于可以对同一个研究个体进行长时间反复跟踪成像,既可以提高数据的可比性,避免个体差异对试验结果的可影响,又不需要杀死模式动物,节省了大笔科研费用。第三,尤其在药物开发方面,分子成像更是具有划时代的意义。根据目前的统计结果,由于进入临床研究的药物中大部分因为安全问题而终止,导致了在临床研究中大量的资金浪费,而分子成像技术的问世,为解决这一难题提供了广阔的空间,将使药物在临床前研究中通过利用分子成像的方法,获得更详细的分子或基因述水平的数据,这是用传统的方法无法了解的领域,所以分子成像将对新药研究的模式带来革命性变革。其次,在转基因动物、动物基因打靶或制药研究过程中,分子成像能对动物的性状进行跟踪检测,对表型进行直接观测和(定量)分析; 3、分类 分子成像技术主要分为光学成像、核素成像、磁共振成像和超声成像、CT成像五大类。 (1) 光学成像 活体动物体内光学成像(Optical in vivo Imaging)主要采用生物发光(bioluminescence)与荧光(fluorescence)两种技术。生物发光是用荧光素酶(Luciferase)基因标记细胞或DNA,而荧光技术则采用荧光报告基团(GFP、RFP, Cyt及dyes等)进行标记。利用一套非常灵敏的光学检测仪器,让研究人员能够直接监控活体生物体内的细胞活动和基因行为。通过这个系统,可以观测活体动物体内肿瘤的生长及转移、感染性疾病发展过程、特定基因的表达等生物学过程。传统的动物实验方法需要在不同的时间点宰杀实验动物以获得数据, 得到多个时间点的实验结果。相比之下,可见光体内成像通过对同一组实验对象在不同时间点进行记录,跟踪同一观察目标(标记细胞及基因)的移动及变化,所得的数据更加真实可信。
生命科学 Chinese Bulletin of Life Sciences 第18卷 第1期2006年2月 Vol. 18, No. 1Feb., 2006 活体动物体内光学成像技术的研究进展 张 怡1,彧韩 2,赵春林2* (1中国医学科学院 中国协和医科大学 基础医学研究所,北京100005; 2北京龙脉得生物技术有限公司,北京100084) 摘 要:生物发光和荧光成像作为近年来新兴的活体动物体内光学成像技术,以其操作简便及直观性成为研究小动物活体成像的一种理想方法,在生命科学研究中得以不断发展。利用这种成像技术,可 以直接实时观察标记的基因及细胞在活体动物体内的活动及反应。利用光学标记的转基因动物模型可以研究疾病的发生发展过程,进行药物研究及筛选等。本文综述了现有活体动物体内光学成像技术的原理、应用领域及发展前景,比较了生物发光与几种荧光技术的不同特点和应用。 关键词:活体动物体内光学成像;体内成像技术;生物发光;荧光素酶;荧光成像;多谱段成像;时域光学分子成像 中图分类号:Q-331; R319 文献标识码:A Current developments in animal in vivo optical imaging technologies with bioluminescence and fluorescence ZHANG Yi 1, HAN Y u 2, ZHAO Chun-Lin 2* (1 Institute of Basic Medical Sciences, CAMS and PUMC, Beijing 100005, China; 2 Longmed, Inc., Beijing 100084, China) Abstract: Bioluminescence and fluorescence have been proved to be a versatile tool for in vivo imaging. Reporters that confer optical signals on a given biological process have been used widely in cell biology and more recently to interrogate biological process in animal models of human biology and disease. The theories,technologies, and the applications of these technologies will be compared and reviewed, especially the advan-tages and disadvantages between bioluminescence and fluorescence in vivo imaging. We also discussed the different technologies and applications about multi-spectral imaging and time-domain optical imaging, and reviewed the trend for future developments of these technologies. Key words: optical in vivo imaging; animal imaging; bioluminescence; luciferase; fluorescence; multi-spectral imaging; time domain optical imaging 收稿日期:2005-10-18 基金项目:龙脉得生物技术有限公司基金 作者简介:张 怡(1978—),女,博士研究生;韩 彧(1977—),女,博士;赵春林(1968—),男,博士,*通讯作者。 文章编号 :1004-0374(2006)01-0025-06 活体动物体内光学成像(optical in vivo imaging)主要采用生物发光(bioluminescence)与荧光(fluorescence)两种技术。生物发光是用荧光素酶(luciferase)基因标记细胞或DNA ,而荧光技术则采用荧光报告基团 (GFP 、RFP 、Cyt 及dyes 等)进行标记[1]。利用灵 敏的光学检测仪器,可以直接检测活体生物体内的细胞活动和基因行为。通过这些技术,可以观测活体动物体内肿瘤的生长及转移、疾病的发生发展、
Xenics液氮制冷相机在第二近红外小动物活体荧光成像方面的应用 1、应用背景介绍 癌症作为四大不治症之一,一直以来都是全球各国希望攻克的难题。World Cancer2014报告指出:全球范围内每年癌症新增病例高达1400万,死亡病例高达820万,而2010年全球在癌症上投入的资金为1.16万亿美金,为全球生产总值的2%。 影像方法一直以来都是癌症研究、药物开发,以及一般医疗行业重要的辅助研究手段;传统的获取影像的方法主要包括X-Ray成像、可见光成像以及核磁成像。X-Ray 成像主要是通过X光探测器来探测穿透人体组织后的X光影像,主要包括DR、CT、PET 等设备,但是X光成像由于有辐射,对人体有伤害,且这些成像技术的空间分辨率有限,很难实现微小病灶的早期检测,进而影响早期治疗。同样,由于这些设备的时间分辨率有限,不适合外科医生长期手术使用;可见光成像主要通过探测400nm—700nm范围内的可见光来获取影像信息,但是可见光无法获得被探测人和物内部的信息;MRI也是医疗行业一个有力的手段,但是MRI设备拍摄时间长、费用昂贵,无法在术中使用。 图1:CT、PET探测设备 基于上述背景,越来越多的生命科学工作者开始了其他影像方法对癌症检测价值的研究。近红外成像由于能够获得更高的空间分辨率和更高的时间分辨率,获得了越来越多研究者的喜爱。同时,由于更深的探测深度,以斯坦福大学为首的众多科研院所和高
校开始了第二近红外成像的研究。 图2:红外成像探测深度VS 可见光成像探测深度 2、第二近红外荧光成像研究原理 近红外成像,由于时空分辨率都比Micro-CT和PET高,又没有辐射,同时可以在手术中使用等,被广泛研究。近红外成像主要分为第1近红外(0.75um—0.9um)成像和第2近红外(1.1um--1.4um)成像,而第2近红外成像由于可以获得更深的探测深度(1 - 3毫米),更高的空间分辨率(~ 30毫米),更高的时间分辨率(< 200 ms 每帧),更受期待。 图3:可见光成像、红外成像,以及可见光和红外成像融合图 小动物体内的荧光基团,在激光的照射下,会辐射出比激发光波长更长的光子信号,辐射出来的光子穿透组织到达体表,被能够探测到900nm-1700nm近红外谱段的InGaAs材料的液氮制冷相机获取并成像,通过对荧光信息成像的分析,进而获取小动物体内血管、肿瘤等信息;
小动物活体成像技术 李冬梅万春丽李继承 摘要:随着小动物成像技术的发展,活体小动物非侵袭性成像在临床前研究中发挥着越来越重要的作用。本文围绕五种小动物成像专用设备,综述其特点及主要应用,比较各种设备的优势和劣势,总结小动物活体成像设备的发展趋势。 关键词:小动物;活体;成像技术 Small living animal imaging technology LI Dong-Mei1 WAN Chun-li 2 LI Ji-Cheng 1 (1Medical college of Zhejiang university,2Shanghai sciencelight biology sci&tech Co.,Ltd.)Abstract: With the development of small animal imaging technology, non-invasive imaging in small living animal models has gained increasing importance in pre-clinical research. Based on five kinds of small animal imaging special equipments, this article reviews their characteristics and illustrates their main applications. Meanwhile, this article also compares the advantages and limitations of these equipments and summarizes the trends of small living animal imaging equipments. Key words: small animal;living; imaging technology 动物模型是现代生物医学研究中重要的实验方法与手段,有助于更方便、更有效地认识人类疾病的发生、发展规律和研究防治措施,同时大鼠、天竺鼠、小鼠等小动物由于诸多优势在生命科学、医学研究及药物开发等多个领域应用日益增多。近年来各种影像技术在动物研究中发挥着越来越重要的作用,涌现出各种小动物成像的专业设备,为科学研究提供了强有力的工具。 动物活体成像技术是指应用影像学方法,对活体状态下的生物过程进行组织、细胞和分子水平的定性和定量研究的技术。动物活体成像技术主要分为光学成像(optical imaging)、核素成像(PET/SPECT)、核磁共振成像(magnetic resonance imaging ,MRI)、计算机断层摄影(computed tomography,CT)成像和超声(ultrasound)成像五大类。 活体成像技术是在不损伤动物的前提下对其进行长期纵向研究的技术之一。成像技术可以提供的数据有绝对定量和相对定量两种。在样本中位置而改变,这类技术提供的为绝对定量信息,如CT、MRI和PET提供的为绝对定量信息;图像数据信号为样本位置依赖性的,如可见光成像中的生物发光、荧光、多光子显微镜技术属于相对定量范畴,但可以通过严格设计实验来定量[1]。其中可见光成像和核素成像特别适合研究分子、代谢和生理学事件,称为功能成像;超声成像和CT则适合于解剖学成像,称为结构成像,MRI介于两者之间。 1 可见光成像 体内可见光成像包括生物发光与荧光两种技术[2]。生物发光是用荧光素酶基因标记DNA,利用其产生的蛋白酶与相应底物发生生化反应产生生物体内的光信号;而荧光技术则采用荧光报告基因(GFP、RFP)或荧光染料(包括荧光量子点)等新型纳米标记材料进行标记,利用报告基因产生的生物发光、荧光蛋白质或染料产生的荧光就可以形成体内的生物光源。前者是动物体内的自发荧光,不需要激发光源,而后者则需要外界激发光源的激发[3]。 1.1 生物发光:哺乳动物生物发光,一般是将萤火虫荧光素酶(Firefly luciferase)基因整合到需观察细胞的染色体DNA上,以表达荧光素酶,培养出能稳定表达荧光素酶的细胞株,当细胞分裂、转移、分化时,荧光素酶也会得到持续稳定的表达[4]。标记后的荧光素酶
本实验技术来源于SciMall科学在线 在活体成像中荧光色素标记细胞的方法举例 活体光学成像(Optical in vivo Imaging)主要采用生物发光(bioluminescence)技术与荧光(fluores cence)技术。生物发光是用荧光素酶(Luciferase)基因标记细胞或DNA,今天,生物发光标记物可以标记到任何一种基因上,使对基因功能的全面细致研究成为现实。而荧光技术则采用荧光报告基团(GFP、RF P, Cyt及dyes等)进行标记,利用荧光蛋白在外源光源或是内源发光照射下被激发产生的荧光作为检测信号。研究人员能够利用一套非常灵敏的光学检测仪器直接监控活体生物体内的细胞活动和基因行为。 该技术可被广泛应用于标记细胞或基因的示踪及检测;基因治疗在活体动物体内直接的观察和检测;基因组、蛋白组学、药学及生物技术在活体动物内的研究;药物及化学合成药物的药物代谢及毒理学监测;食品菌落生长成像;皮肤医学中皮肤疾病的体内成像;法医鉴定;微孔板成像,例如:免疫分析、报告基因、基因探针和嗜菌作用分析等;荧光团的体内成像,例如:Alzheimer疾病研究中结合嗪的β-淀粉沉淀物分析;转基因植物中通过报告基因对生理周期节奏的研究;凝胶成像分析等等。 但在研究过程中,研究者们必须事先用基因技术进行荧光素酶基因标记,或者某种荧光报告基团标记。目前活体光学成像系统的知名制造商,如Berthold、GE、Xenogen、Photometrics、Carestream Health 等,不仅为客户提供先进的仪器,也提供具体实验所需的整套解决方案,包括试剂、实验手册、特殊用途的质粒、细胞株、转基因动物、细胞处理和动物处理设施等配套技术支持。出色的多任务处理能力,人性化的整体设计,便捷精确的操作系统,使实验室影像分析领域进入了一个全新的时代 下面以研究干细胞活体移植后的存活率为例,简介一两种内源性荧光色素标记的实验方法,以供参考。 一、用荧光色素DiD标记间充质干细胞 1. 先用胰蛋白酶消化待标记材料,使之成为一定密度的悬浮液; 2. 从细胞培养箱中取出间充质干细胞,吸取含原有培养基的细胞悬浮液进行标记; 3. 用10 ml Mg/Ca-free PBS (不含钙镁离子的磷酸缓冲液)清洗细胞,吸去PBS,钙镁离子会影响胰蛋白
多功能荧光成像仪 一、技术参数 1.设备用途: 采集化学发光(chemiluminescence)、比色(colorimetric)、荧光(fluorescence)及Stain-Free免染成像等核酸凝胶、蛋白凝胶、印迹膜等的数字图像,并对获得的图像进行数据分析。 2.技术规格: 2.1硬件功能 *2.1.1:功能涵盖:化学发光,光密度成像,荧光成像,Stain-Free免染成像等, 2.1.2:CCD检测器:增强型超冷CCD检测器,分辨率6.1M pixel(2,758x2,208) 2.1.3:12.1英寸触摸屏控制,支持多点触控功能(2点) 2.1.4:425nm处绝对Q/E(光电转化率)值:70%,绝对Q/E峰值:75%@525nm 2.1.5:CCD暗电流:0.002 e/p/s;CCD读出噪音:6 e-rms,提供弱光成像所 需 2.1.6:使用f/0.95快速对焦镜头,提高进光量的同时完成自动聚焦 2.1.7:自动优化曝光功能,所有成像过程均保持自动对焦 2.1.8:16bit数据采集(65,536灰度级,4.8OD),所有样品动力学范围>4个 数量级 2.1.9智能样品托盘技术,自动识别插入的样品盘类型,选择成像功能 2.1.10三种样品托盘设计:Chemi/UV/Stain-Free样品盘(化学发光、紫外和 免染样品成像);白光样品盘(将透射紫外转换为透射白光,考染、银染及其他蛋白成像);蓝光样品盘(SYBR?等荧光染料) 2.1.11:光源:反射白光,透射紫外,透射白光(可选),透射蓝光(可选) 2.1.12:滤光片转轮位置:8位(5色荧光、标准滤光片、平场校正、化学发 光) 2.1.13:紫外光源:302nm *2.1.14:最大成像面积16.8 x 21 cm
活体动物体内光学成像主要采用生物发光与荧光两种技术。生物发光是用荧光素酶基因(Luciferase)标记细胞或DNA,而荧光技术则采用绿色荧光蛋白、红色荧光蛋白等荧光报告基因和FITC、Cy5、C
2. 生物发光成像 活体生物荧光成像技术是指在小的哺乳动物体内利用报告基因-荧光素酶基因表达所产生的荧光素酶蛋白与其小分子底物荧光素在氧、Mg2+离子存在的条件下消耗ATP发生氧化反应,将部分化学能转变为可见光能释放。然后在体外利用敏感的CCD设备形成图像。荧光素酶基因可以被插入多种基因的启动子,成为某种基因的报告基因,通过监测报告基因从而实现对目标基因的监测。 生物荧光实质是一种化学荧光,萤火虫荧光素酶在氧化其特有底物荧光素的过程中可以释放波长广泛的可见光光子,其平均波长为560 nm(460—630 nm),这其中包括重要的波长超过600 nm的红光成分。在哺乳动物体内血红蛋白是吸收可见光的主要成分,能吸收中蓝绿光波段的大部分可见光;水和脂质主要吸收红外线,但其均对波长为590—800 nm的红光至近红外线吸收能力较差,因此波长超过600 nm的红光虽然有部分散射消耗但大部分可以穿透哺乳动物组织被高灵敏的CCD检测到。 生物发光成像的优点可以非侵入性,实时连续动态监测体内的各种生物学过程,从而可以减少实验动物数量,及降低个体间差异的影响;由于背景噪声低,所以具有较高的敏感性;不需要外源性激发光,避免对体内正常细胞造成损伤,有利于长期观察;此外还有无放射性等其他优点。 然而生物发光也有自身的不足之处:例如波长依赖性的组织穿透能力,光在哺乳动物组织内传播时会被散射和吸收,光子遇到细胞膜和细胞质时会发生折射,而且不同类型的细胞和组织吸收光子的特性也不尽相同,其中血红蛋白是吸收光子的主要物质;由于是在体外检测体内发出的信号,因而受到体内发光源位置及深度影响;另外还需要外源性提供各种荧光素酶的底物,且底物在体内的分布与药动力学也会影响信号的产生;由于荧光素酶催化的生化反应需要氧气、镁离子及ATP等物质的参与,受到体内环境状态的影响。 二、小动物活体成像 1. 制作动物模型 可根据实验需要通过尾静脉注射、皮下移植、原位移植等方法接种已标记的细胞或组织。在建模时应认真考虑实验目的和选择荧光标记,如标记荧光波长短,则穿透效率不高,建模时不宜接种深部脏器和观察体内转移,但可以观察皮下瘤和解剖后脏器直接成像。深部脏器和体内转移的观察大多选用荧光素酶标记。 2. 活体成像 小鼠经过常规麻醉(气麻、针麻皆可)后放入成像暗箱平台,软件控制平台的升降到一个合适的视野,自动开启照明灯(明场)拍摄第一次背景图。下一步,自动关闭照明灯,在没有外界光源的条件下(暗场)拍摄由小鼠体内发出的特异光子。明场与暗场的背景图叠加后可以直观的显示动物体内特异光子的部位和强度,完成成像操作。值得注意的是荧光成像应选择合适的激发和发射滤片,生物发光则需要成像前体内注射底物激发发光。
专家解答体内荧光成像技术难点 1.如何解决组织吸收问题 来自斯坦福大学放射学系助理教授Jianghong Rao领导的研究小组在进行“Examining protease involvement in tumor metastasis and cell migration”(肿瘤转移与细胞迁移过程中涉及的蛋白酶)这一项研究中遇到了一个难题:利用标准的荧光分子标记观测深部组织,激发荧光的光源必须能穿透具有强吸收力和光散射的组织,并且当标记分子发出光时,也要能通过同样的组织块,从而被检测到。 为了解决这个难题,研究人员采用了一种称为生物发光共振能量转移(Bioluminescence Resonance Energy Transfer,BRET)的方法进行组织成像。不同于利用生物体外激发光源的能量转移方法,BRET主要依赖于生物发光的荧光素酶来提供荧光标记需要的能量转移。一般而言,进行BRET实验的研究人员是将与荧光素酶与荧光蛋白相交联,后者会吸收生物荧光,并重新发出光,但是由于这些BRET交联物的光仍然有大部分会被吸收和散射掉,因此剩下的信号依然很弱。 Rao改进了这一方法,他将荧光素酶交联在quantum dots (QDs),而不是荧光蛋白上,这就将发出的光线变成了依然是长波长,但吸收和散射不强的光。为了能对深部组织进行成像,Rao等人又将luciferase-QD这个结构连接上了一个配体——这个配体与目的分子相连。这样当将底物,复合体(包括荧光素酶的荧光基团)注入小鼠的尾静脉的时候,BRET标记就能发出两种特殊的光:蓝色的生物荧光和红色的quantum-dot光,这样就能更清楚的观测组织。 这里Rao用于解决组织吸收问题的是一类新型的荧光探针,即量子点Qdot或称为半导体纳米晶体,所谓Qdot,指的是准零维(quasi-zero-dimensional)的纳米材料,由少量的原子所构成。粗略地说,量子点三个维度的尺寸都在100纳米(nm)以下,外观恰似一极小的点状物,其内部电子在各方向上的运动都受到局限,所以量子局限效应(quantum confinement effect)特别显著。 这种纳米材料对于体内光学成像来说有着得天独厚的光学特点,这就是吸收性高、量子产量高、发射谱带窄、斯托克司频移大以及光褪色抗性强等,能够发射不同波长光谱,可以为单一波长所激发,适用于在一个实验中检测多靶点,因此非常适合活细胞成像和动态研究,甚至有人认为这种纳米荧光是纳米技术的真正代表,给荧光技术带来革命性的突破。 其具体特点如下: ·QDs的发射谱单一而且很“窄”。其半峰宽(FWHM)大都在40nm以下,更好的可以达到30nm甚至十几个nm,因此,QDs作为探针,可以很方便的区别于背景信号或者其它探针的信号。 ·QDs的激发谱很宽,可以在低于发射谱的广泛区间内任意选择激发波长。这个属性使得对设备(光源)的选择变得更加方便,而不必受限于特殊激光器。QDs的这个特点还可以让我们在同一固定激发波长下,同时激发不同颜色的QDs,从而使需要实时观测多种目标分子运
活体生物体内光学成像技术及其新进展 摘要:活体生物体内光学成像技术是近年发展起来的新兴技术,以其操作简便、灵敏度高、创伤性小成为研究生物活体成像的一种理想方法,在生命科学研究中有着较大优势并得以不断发展。按发光模式可分为生物自发光和荧光激发光两类。其原理为采用荧光素酶基因或荧光报告基团标记的目的细胞,通过灵敏的光学检测仪器,检测活体生物体内的细胞活动和基因行为。利用光学标记的转基因动物模型可以研究疾病的发生发展过程,进行药物研究及筛选等。本文综述了现有活体生物体内光学成像技术的基本原理、分类、比较以及发展应用。 关键词:活体生物体内光学成像;生物自发光成像;荧光激发光成像;文献综述 利用生物体内发出的能够穿透组织的光进行全身成像,是研究生物学过程的重要方法之一。活体生物体内光学成像技术主要采用生物自发光和荧光激发光两种技术。生物自发光是用荧光素酶基因标记或DNA,而荧光激发光则采用荧光报告基团进行标记[1]。成像试剂标记后,利用灵敏的光学检测仪器,可以直接检测活体生物体内的细胞活动和基因行为,是近年来发展起来的新兴技术。与其它的活体内成像技术,如超声、计算机断层显像、核磁共振成像、正电子衍射成像相比,活体生物体内光学成像技术有着灵敏度高、安全、易操作、结果直观、测量快速、数据真实可靠、费用低廉等特点。目前该技术已被广泛应用于生命科学、医学研究和药物研发等领域[2]。 1 活体生物体内光学成像技术的分类及其原理 活体生物体内光学成像系统由作为报告基因的荧光素酶或荧光蛋白、灵敏的光学检测仪器及其分析软件组成。报告基因被插入的多种基因启动之后,通过检测报告基因的表达情况,从而实现靶细胞或靶分子表达的实时检测[3,4]。目前活体生物光学成像仪的最高辨析度为0.1mm左右。活体生物体内光学成像技术按发光模式可分为两类,一种是采用生物发光技术, 另一种是采用荧光激发光技术。现分别加以介绍说明。 1.1 生物自发光技术 1995年,Contag首次在小动物体内检测到含有Lux操纵子的病原菌发出的可见光[5]。1997年,他又首次观察到表达Fluc基因的转基因小鼠在注入荧光素酶底物后后生物发光现象。从此,荧光素酶被广泛应用于小动物成像技术。细菌Lux 操纵子由荧光素酶基因和其底物合成酶基因组成,带有这种操纵子的细菌会持续发光。哺乳动物生物发光,是将Fluc基因整合到细胞染色体DNA上以表达荧光素
光学相干断层成像(OCT)对雷珠单抗玻璃体腔内注射治疗黄斑囊样水肿的观察 华厦眼科医院集团-合肥名人眼科医院 张阳曾令辉刘婷婷 【摘要】:目的: OCT对雷珠单抗玻璃体腔内注射治疗前后对比观察。方法:在我科眼底荧光造影检查2014年5月-2015年8月确诊为黄斑囊样水肿患者22 例39眼,其中单眼患者5 例,双眼患者17例。随访观察,光学相关断层扫描(OCT)检查黄斑中心凹说说厚度(CMT)的变化。OCT显示黄斑中心凹厚度平均降低268.4±115.0μm。结论:OCT的高分辨率可以在活体上显示视网膜的细微结构,可用于评价黄斑水肿患者治疗前后的黄斑厚度变化,在临床诊断和疗效观察上发挥了重要的作用。 黄斑水肿是由于黄斑区局部毛细血管内皮细胞屏障(血-视网膜内屏障)或/ 和视网膜色素上皮细胞屏障(血- 视网膜外屏障)功能损害, 致液体渗漏造成的一种细胞外水肿,其发病机制尚不清楚。[1]常见于老年黄斑变性(AMD),糖尿病性视网膜病变(DR),中央视网膜静脉阻塞(CRVO)等。近年来,雷珠单抗作为第二代人源化的抗血管内皮生长因子(anti-VEGF)抑制剂,重组鼠单克隆抗体片段,对人VEGF-A的所有亚型都具有特异性和亲和力,主要作用机制为结合VEGF后,阻止血管渗漏和新生血管的形成,抑制新生血管的形成。 OCT作为一种非接触性的生物组织成像技术的代表,已逐渐成为评价黄斑厚度的一种可靠方法。我科采用OCT对雷珠单抗玻璃体腔
内注射治疗各种病变所致的黄斑囊样水肿观察,现介绍如下。 1研究对象和方法 1.1 对象2014年5月-2015年8月期间,在我科确诊的黄斑囊样 水肿患者22例39眼, 其中单眼患者5例,双眼患者17例,年龄38~ 79岁,所有病例均经过视力及矫正视力检查、非接触眼压、间接眼底镜、荧光素眼底血管造影(fluo rescein fundusangiog raphy, FFA)及光学相关断层扫描(optical coherence tomography, OCT)等来确诊,并排除其他黄斑疾病,所有病例均采用雷珠单抗玻璃体腔内注射治疗1~3次雷珠单抗0.05ml/(0.5mg),每次间隔1个月,第1次注射7天后行OCT黄斑部检查,部分病人行眼底激光光凝治疗。 1.2方法采用ZEISS stratus OCT对39眼黄斑囊样水肿患者黄斑区 行放射状,水平及垂直线性扫描,扫描深度3mm,扫描长度3.45mm 及6mm,扫描角度0~360゜,扫描点数512,图象像分析采用ZEISS OCT3分析系统。扫描程序:以黄斑中心凹为中心的星状线性扫描,共6条扫描线,取平均值,获得黄斑地形图。利用ZEISS软件对所获得图象进行分析,主要分析指标黄斑中心凹,上方,下方,鼻侧及颞侧5个象限的视网膜厚度。 结果 1.一般信息:黄斑囊样水肿患者共39例,矫正视力范围 为0.04~0.6。 2.治疗前组:中央黄斑厚度387μm ~857μm,平均厚度
仪器名称:小动物近红外二区荧光活体影像系统 百购生物网为您提供 型号:Series II 900/1700 简介: 针对传统活体荧光成像技术面临的低组织穿透深度(<3毫米)和低空间分辨率(~毫米)、高自发荧光背景等瓶颈,苏州影睿光学科技有限公司的研究团队历经多年潜心研究,于2012年推出了第一款基于近红外二区荧光(NIR-II,900-1700nm)的小动物活体影像商业化系统(Series II 900/1700),实现了高组织穿透深度(>1.5cm)、高时间分辨率(50ms)和高空间分辨率(25μm)的活体荧光成像。 Series II 900/1700可针对不同的研究体系,在小动物活体水平进行实时、无创、动态、定性和定量的影像研究,包括肿瘤早期检测、肿瘤发展、转移和治疗过程、药物筛选、靶向药物和靶向治疗、干细胞活体示踪及其再生医学研究等。影睿光学拥有世界领先的量子点制备和应用专利技术、活体荧光影像设备,以及强大的数据处理和分析功能,为用户提供完整的科研产品及解决方案。 目前,影睿光学Series II 900/1700系统已成功销往美国埃默里大学,并与美国哈弗大学医学院、美国康奈尔大学、美国埃默里大学、北京大学、复旦大学附属华山医院、南京大学附属鼓楼医院、中国科学院北京动物研究所、中国科学院上海药物研究所等数十家国内外优秀研究机构建立了良好的商业伙伴及合作关系。
技术优势: 荧光活体成像解决方案:近红外二区荧光成像
活体组织对近红外二区荧光(1000-1700nm)具有更低的吸收和散射效应,以及可以忽略的自发荧光背景,因此,在活体荧光成像中,与传统荧光(400-900nm)相比,近红外二区荧光具有更高的穿透深度、更高的时间和空间分辨率,以及更高的信噪比。 近红外二区荧光探针解决方案:Ag2S 量子点
植物叶绿素荧光成像技术在国内的应用(第四期) 植物叶绿素荧光成像技术作为最早实用化的叶绿素荧光成像技术,是目前世界上最权威、使用范围最广、种类最全面、发表论文最多的叶绿素荧光成像技术。涵盖了从叶绿体、单个细胞、微藻到叶片、果实、花朵,乃至整株植物和植物灌层,几乎可以测量所有的植物样品,甚至包括含有叶绿素的微生物和动物。 叶绿素荧光成像技术最早在21世纪初引进到国内,但一直到2010年后国内的科学家才在国际交流中逐渐发现这项技术的巨大价值,在短短数年中也利用这一技术发表了几十篇高水平SCI 文献。本期主要介绍目前叶绿素荧光成像技术在国内的应用情况。 一、 植物光合生理研究 叶绿素荧光可以直接反应植物光系统的生理状况,因此从叶绿素荧光技术发明之初,就被用于各种植物光合生理研究。 山东农科院使用FluorCam 叶绿素荧光成像技术研究了小麦旗叶与外露花梗光合能力的差异[1]。研究中发现在小麦生长前中期,旗叶与外露花梗的最大光化学效率Fv/Fm 和量子产额ΦPSII 基本相同。但在生长后期,旗叶的光合能力显著下降,而花梗光合能力的下降幅度要小于旗叶(图1)。这证明了在生长后期的灌浆期,花梗对维持籽粒的生长更为重要。 之后,他们又研究了小麦叶片和颖片季节衰老过程中以及颖果发育过程中光合特性的变化[2;3,图2]。 图2. 不同生长期小麦叶片和颖片的最大光化学效率Fv/Fm (A )、量子产额ΦPSII (B )和非光化学淬灭NPQ (C )的变 化 图1. 不同生长阶段的旗叶(A ,C )和外露花梗(B ,D )的Fv/Fm (A ,B )和ΦPSII (C ,D )典型叶绿素荧光成像图
cy染料小动物活体成像操作流程 2017/4/13 吲哚花菁绿(ICG,indocyanine green)是经过FDA认证的菁染料,出于安全考虑,后期应用于活体(人、动物、细胞)的染料在结构上都和ICG有相似或相近之处。cy 系列染料是Amersham公司(目前为GE公司)最初开发的染料体系,它的桥环由苯并吲哚变为吲哚环,并在吲哚的苯环上对称地引入硫酸根基团,水溶性得到很大改善,分子量降低后对大分子的亲和力有所增加。cy系列菁染料多带有羟基琥珀酰亚胺活性酯(NHS ester)、异硫氰酸酯(NCS)等活性基团,可与蛋白质、多肽、DNA或其他生物分子中的羟基、氨基或巯基以化学键的方式键合,表征生物分子的特性,形成具有生物功能的标记衍生物,广泛被用于抗体、多肽、小分子等多种荧光探针的合成中,可以说是目前使用最为广泛的一类近红外染料。cy染料应选择GE、李记生物等公司产品,化工企业提供的cy染料产品,一般不作为活体成像使用。 一、Cy染料在活体成像的应用领域 1. 标记特异性抗体 在CY菁染料标记蛋白的研究中,除了牛血清白蛋白以外最先开始涉及的功能性物质是抗体。从起初与IgG结合,用荧光光纤免疫传感器(FFOI,fluorescent fiber-optic immunosensor)考察抗原抗体反应,到现在连接特异性的单克隆抗体片段,对动物全身进行免疫荧光显影,分析片段在体内的分布代谢情况。分析cy-抗体复合物在不同时间不同器官中的荧光强度变化,可对抗体的靶向性、清除率等有更直观的评价。不过,染料抗体衍生物在降低背景噪音和非特异性吸附方面还有待进一步完善。 2. 标记特异性多肽(Conjugating to peptides) 在肿瘤诊断和治疗中,与菁染料衍生物结合的多肽主要有两种:其一是针对肿瘤表面过量表达的受体;另一种则针对肿瘤相关酶类。前者的报道很多,如生长激素抑制素、表皮生长因子,甚至一些特殊设计过的短肽,都可以被用来靶向结合肿瘤,现在更趋向于一些只有十几个氨基酸的环肽,因为它分子量小易于接近肿瘤部位,且呈环状构形不易被分解。Cy系列染料均能利用自身携带的活性基团直接与环肽结合,部分此类探针检测发现,在近红外光学显影和放射显影在浅表的分辨率相似,但在深层组织中前者的信噪比更高。针对酶类研究一般是设计酶特异性荧光探针,这种与Cy系列染料结合的检测技术除了在体内定位时有显著优势外,亦可作为体外检测手段与一些常用技术结合,辅助确定组织中该酶的存在。 3. 与药物载体结合(Conjugating to drug carriers)