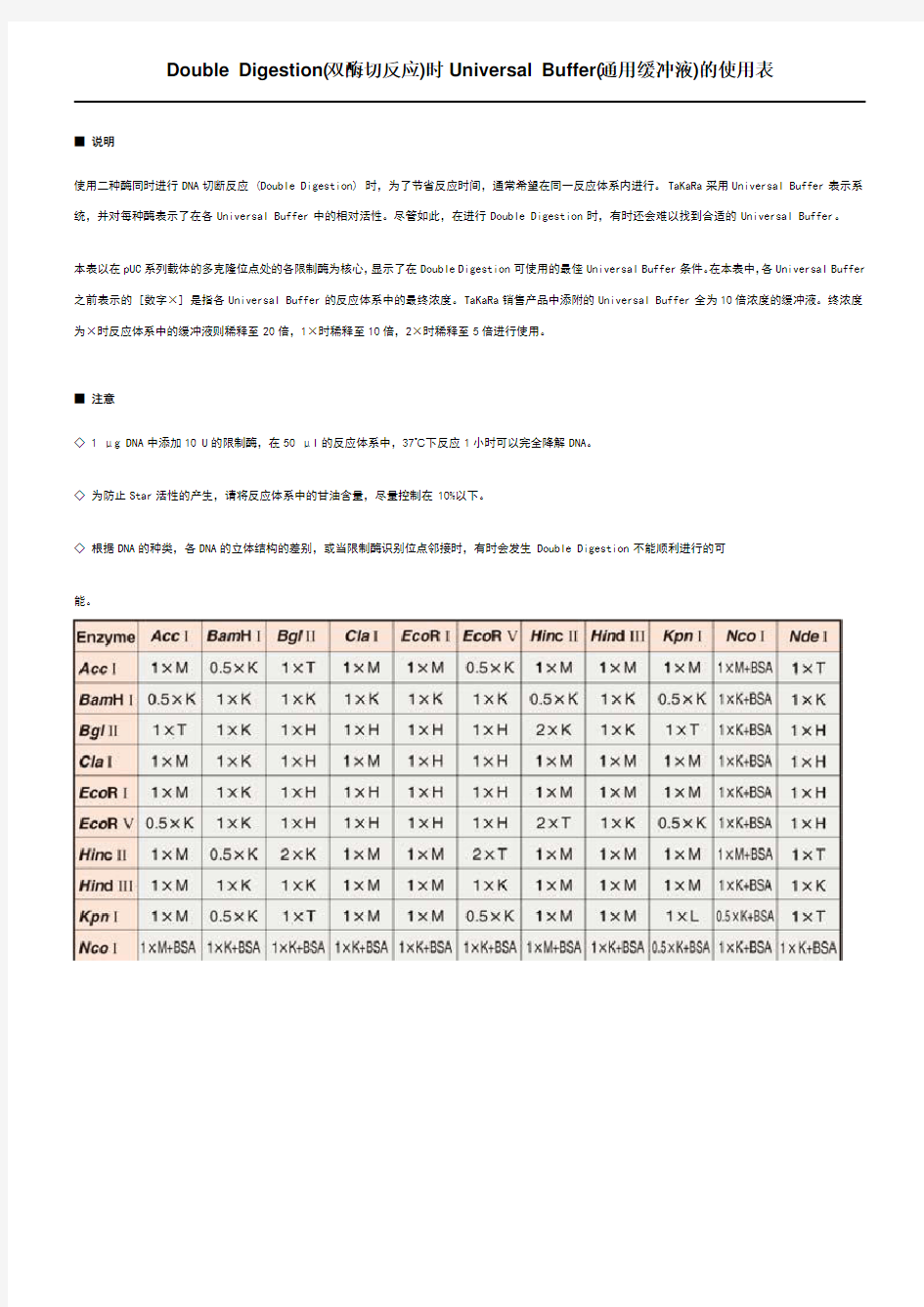
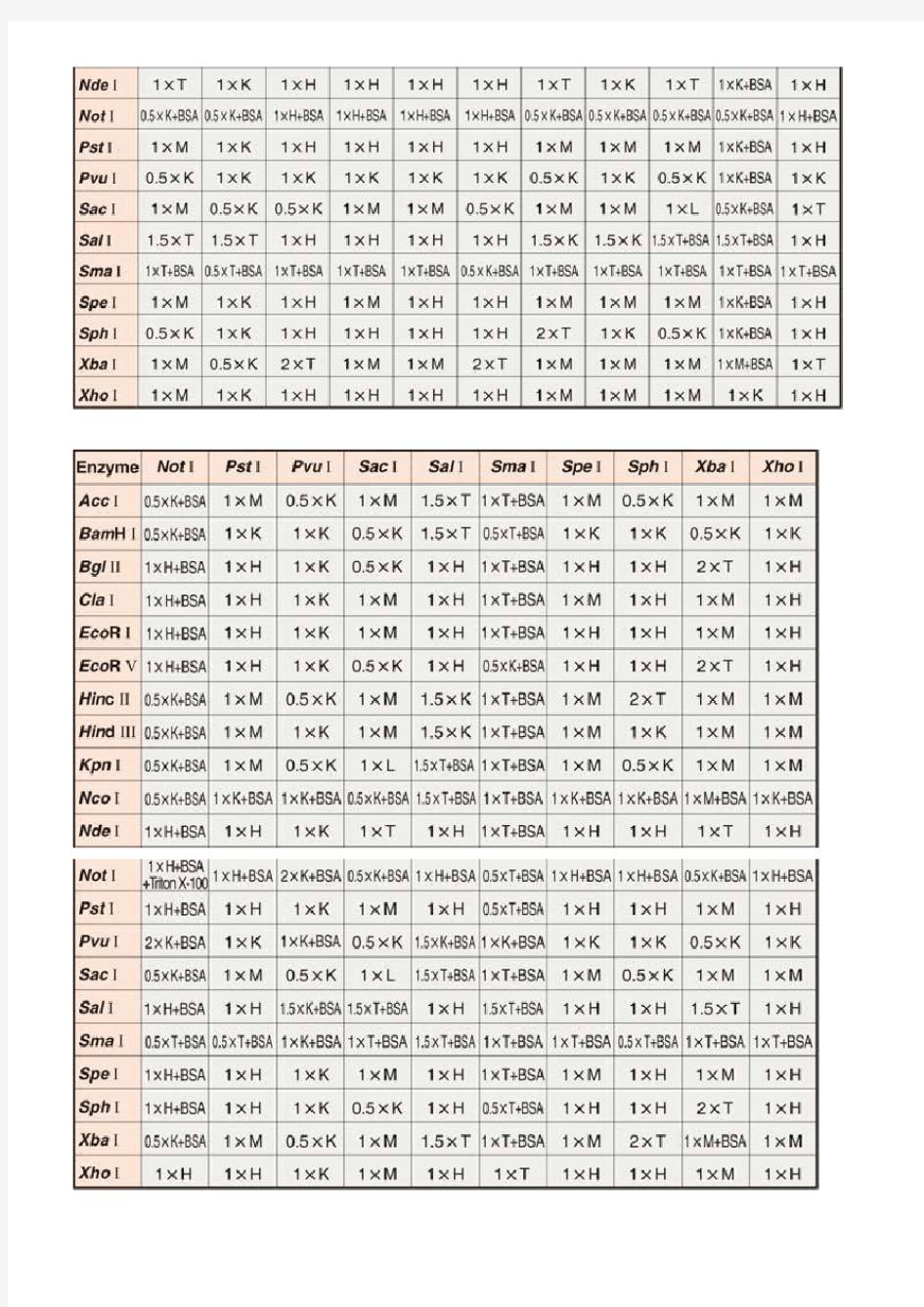
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
■ 说明
使用二种酶同时进行DNA切断反应 (Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。在本表中,各Universal Buffer 之前表示的 [数字×] 是指各Universal Buffer的反应体系中的最终浓度。TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。终浓度为×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■ 注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇ 为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇ 根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可
能。
双酶切概述 双酶切反应(Double Digests) 1、同步双酶切 同步双酶切是一种省时省力的常用方法。选择能让两种酶同时作用的最佳缓冲液是非常重要的一步。NEB每一种酶都随酶提供相应的最佳NEBuffer,以保证100%的酶活性。NEBuffer的组成及内切酶在不同缓冲液中的活性见《内切酶在不同缓冲液里的活性表》及每支酶的说明书。能在最大程度上保证两种酶活性的缓冲液即可用于双酶切。由于内切酶在非最佳缓冲液条件下的切割速率会减缓,因此使用时可根据每种酶在非最优缓冲液中的具体活性相应调整酶量和反应时间。 2、分步酶切 如果找不到一种可以同时适合两种酶的缓冲液,就只能采用分步酶切。分步酶切应从反应要求盐浓度低的酶开始,酶切完毕后再调整盐浓度直至满足第二种酶的要求,然后加入第二种酶完成双酶切反应。 3、使用配有特殊缓冲液的酶进行双酶切(图) 使用配有特殊缓冲液的酶进行双酶切也不复杂。在大多数情况下,采用标准缓冲液的酶也能在这些特殊缓冲液中进行酶切。这保证了对缓冲液有特殊要求的酶也能良好工作。由于内切酶在非最佳缓冲液中进行酶切反应时,反应速度会减缓,因此需要增加酶量或延长反应时间。通过《内切酶在不同缓冲液里的活性表》可查看第二种酶在特殊缓冲液相应盐浓度下的作用活性。 双酶切建议缓冲液 注: 只要其中一种酶需要添加BSA,则应在双酶切反应体系中加入BSA。BSA不会影响任何内切酶的活性。 注意将甘油的终浓度控制在10%以下,以避免出现星号活性,详见《星号活性》。可通过增加反应体系的总体积的方法实现这一要求。 某些内切酶的组合不能采用同步双酶切法,只能采用分步法进行双酶切。上表中这些组合以“se q”标注。 [编辑本段] 双酶切的注意事项 1、做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解.为保险起见,一般连接3小时,16度。 2、对含有AMP-RESISTENCE的质粒铺板时,注意加AMP时的温度,温度过高,会使克隆株无法筛选出来.我的方法是培基高温消毒后放在烤箱里,烤箱一般温度为55-60度,然后做的时候拿出来,这样好掌握温度。铺板前后注意用吹风机吹干。 3、对照的设立:为验证双酶切是否成功,可做如下对照: 酶切反应时加各单酶分别切,两管,用同一种BUFFER,跑胶,看单切的两管是否成线性.如两管均成线性可初步判断双酶切成功.做转化时,也要进行对照。 [编辑本段] 双酶切连接反应之全攻略 1、回收PCR产物:
实验二阳性重组质粒的抽提及双酶切鉴定 实验目的:练习质粒的抽提及双酶切的实验过程,熟悉相关操作。 实验材料及设备 pMD-T重组质粒;内切酶Xba I 及Pst I;10×M Buffe r;琼脂糖;电泳仪及电泳所需试剂。 实验步骤 A 大肠杆菌的扩繁及质粒DNA碱裂解法抽提 挑取筛选平板上的白色菌落, 接种到5ml LB液体培养基(含100μg/ml Amp)中, 37℃振荡培养约12小时至对数生长后期 ↓ 取培养液倒入2 ml eppendorf管中,4℃下12000 rpm离心2分钟,去上清 ↓ 沉淀中加入150 μl溶液I(50 mmol/L 葡萄糖,25 mmol/L Tris.Cl (pH8.0),10mmol/L EDTA (pH8.0)), 剧烈振荡使菌体悬浮,室温下放置5分钟 ↓ 加入250 μl新配制的溶液II (0.2 mol/L NaOH, 1%SDS, 临用前配制) 盖紧管口,快速温和颠倒eppendorf管数次, 以混匀内容物(千万不要振荡),室温下放置5分钟 ↓ 加入180 μl预冷的溶液III (5 mol/L KAc 60ml, 冰醋酸11.5ml, H2O 28.5ml, 定容至100ml , 并高压灭菌) 盖紧管口,并倒置离心管,温和振荡10秒,使沉淀混匀 ↓ 冰浴10分钟,4℃下12000rpm离心10分钟 ↓ 上清液移入干净eppendorf管中,计算体积 ↓ 加入各1/2体积的Tris-饱和酚以及氯仿/异戊醇(24:1),混匀 20℃下12000 rpm离心10分钟,取上清, 计算体积 ↓ 加等体积的氯仿/异戊醇(24:1),12000 rpm离心10分钟 ↓ 将上清移入干净eppendorf管中,计算体积 ↓ 加入2倍体积的无水乙醇 ↓ 混匀后置于-20℃冰箱中30分钟
前一阵子一直在做双酶切质粒重组,失败了很多次,不过很快改善了实验方法,用2周重组了14个质粒。现就自己的体会,谈一下质粒重组的一些个人经验。 1. 回收PCR产物: 在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶。选好酶切位点后,在各个酶的两边加上保护碱基。 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 2. 纯化问题: 纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。 3. 酶量的问题: 对1单位酶的定义如下:在50μl 反应液中,30℃温度下反应1小时,将1μg 的λDNA完全分解的酶量定义为1个活性单位(U)。而该酶浓度约为15单位/微升,在除外酶降解的因素外,该酶可分解15μg的DNA,而一般从1-4ml 菌液提出的DNA约为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的质量好,酶切完全切得动。 4. 酶切、回收后的PCR产物与载体的连接: 摩尔比的计算,很多人凭经验也可以。但对于初学者从头认真计算则非常有必要。回收的载体片段:回收的PC R产物片段=1:10,一般取前者0.03pmol,后者取0.3pmol。
pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000(注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套。1pmol 1000bp DNA=0.66μg,如载体是5380b p,则0.03pmol为0.03×5.38×0.66=0.106524μg。 5. 测DNA浓度: 测DNA浓度可以在专用机子上测,注意OD值,一般约1.8-2.0.另外,如果嫌麻烦,也可用MARKER进行估测,如MARKER2000,5微升的MARKER每个条带约50ng。 6. 连接反应: TAKARA的连接酶上的说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λD NA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNa段被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。 7.转化: ①全量(10 μl)加入至100μl JM109感受态细胞中,冰中放置30分钟。 ②42℃加热45秒钟后,再在冰中放置1分钟。 ③加入890 μl AMP阴性培养基,37℃振荡培养60分钟。 取100μl铺板。也可离心后余100μl 几个非常重要的问题: 1 做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解。为保险起见,一般连接3小时,16度。
双酶切连接反应之全攻略 1、回收PCR产物:在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,如BamHI,HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基,其原则可参照: 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 纯化问题:纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。我用的是TAKARA的纯化柱试剂盒 酶量的问题:以TAKARA的为例,其对1单位酶的定义如下:在50 μl 反应液中,30℃温度下反应1小时,将1 μg 的λDNA完全分解的酶量定义为1个活性单位(U)。 而该酶浓度约为15单位/ 微升,在除外酶降解的 因素外,该酶可分解15μg的DNA,而一般从1-4ml菌液提出的 DNA约 为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的 质量好,酶切完全切得动。 2、酶切、回收后的PCR产物与载体的连接 摩尔比的计算: 很多人凭经验也可以。但对于初学者从头认真计算则 非常有必要。回收的载体片段:回收的PCR产物片段=1:10 ,一般取前者0.03pmol,后者取0.3pmol。 pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套.1pmol 1000bp DNA=0.66μg,如载体是5380bp,则0.03pmol为 0.03×5.38×0.66=0.106524μg。 测DNA浓度: 可以在专用机子上测,注意OD值,一般约1.8-2.0.另外,如果嫌麻烦,也可用MARKER 进行估测,如MARKER2000,5微升的 MARKER每个条带约50ng。 连接反应:TAKARA的 连接酶上的 说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λDNA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNA片段 被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连 接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。 3、转化: a、全量(10 μl)加入至100 μl JM109感受态细胞中,冰中放置30分钟。 b、42℃加热45秒钟后,再在冰中放置1分钟。 c、加入890 μl AMP阴性培养基,37℃振荡培养60分钟。 取100μl铺板。也可离心后余100μl 几个非常重要的问题 1 做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解.为保险起见,一般 连接3小时,16度.
植物保护2003年12月塑垫鲞蔓!塑!丛蔓!堕堕旦坚!型堕竺.200t!堕.!!。奠!:! M:Marker(北京鼎国生物技术公司)1:EcoRI(02pL)/M删I(02pL)2:EcoRI(O.3PL)/MseI(03止)3:67一『YJRI.(04£t1.)/MmI(0.4vL)4:F“,RI(0.5vL)/M∞I(05/LL)5:EcoRI(06pl。)/M.∞I(0.6pL)6:EcoRI(f)7fm)/MseL(07“L)7:EcoRI(O8¨L)/M,el(08gL)8:EcoRI(O9vL)/MseI(09tzL) 圄1小麦基因组DNA不同酶切用量的酶切效果 从图1可看出,5泳道的EcoRI(0.6"L)和Msel(0、6“L)的酶切效果比较理想,基因组100~l800bp问的DNA片段都有出现。EvoRI和MseI两种酶用量各为0.2uL时酶切DNA片段为700~I800bp之间,各Hj0.3“L的酶切片段在500~一I800bp之间,各用0.4“L的酶切片段在400~1800bp之间,各用0.5"L的酶切片段在250~1800bp之间。由此可见,由于限制性内切酶』甘量太少,酶切不完全,基因组多态性不丰富。在6、7、8泳道则酶用量太多,既造成浪费,也容易出现酶切过头现象,产生许多低于100bp的DNA片段,导致接头连接不上,PCR反应失败的结果。6、7、8泳道的两种酶总用量分别是1.4、1.6、1.8HL,都接近或超过总反应体系15止的l/10(1,5止)。显而易见,一般两种酶的总量不能超过反应体积的l/10。2限制性内切酶的缓冲液选择 在双酶切过程中,如果两种酶反应温度一致而缓冲液不同时,可查阅内切酶供应商提供的各种酶在不同缓冲液中的话力表。如果一种缓冲液能同时使两种酶的活力都超过70%,便可用这种缓冲液作为反应缓冲液。如果两种酶厂家不同,可比较其缓冲液成份,倘若相似,可各取一半中和,也可使用通用缓冲液。例如,作者在进行小麦抗锈基因的AFLP标记研究中,选用E∞Rl(上海生工)和MseI(纽英伦生物有限公司)两种限制性内切酶,分别查阅并比较了卜述公司的酶在不同缓冲液中的活力表,确定用BufferY+/TANGO…(表1)。 从表1可见,EcoRI和M”I两种酶在2倍Buffery+/TANCr)TM中括力均为100%,而且没有过度消化现象。因而选用2倍液Buffery+门"ANGO"‘” 寰1限制性内切酶EcoR[和MseI在苇同缓冲液中韵酶活力情况 1)HufferB+(蓝)Ⅲ10IIml/LTrisHCI(pH75)。10mmol/LMgCl2,0.1mg/mLBSA;2)BufferG+(绿):10mmo]/I,TrisHCI(pH75).10mmol/LMgCl2,50mmo]/I。NaCI,0.1mg/mLBSA;3)BufferO+(橘):10mmo[/LTris—HCI(pH75)?10nmaol/LMgCIz,100mmo[/l—N《1.01mg/ml。BSA;4)BufferR’(红):iommol/LTrisHCI(pH85),10mmol/LMgClz,100mmolA—NaC[。01mg/mLBSA;5)BuHe“+,l'ANGOⅢ:33mmol/LTris8cetate(pH79),10mmol/I,Mgaeetste,66mmol/LKReState,01rag/mLFKqA。 作为2种内切酶的通用缓冲液。 3酶切时间 酶切时间是双酶切时较易忽略的问题,但却是酶切成败的关键。酶切时问过长,许多酶可能出现新的活性,就不能在原定的酶切位点切割,使接头连接不上,PCR反应无结暴。在作琼脂糖检测时,Marker100bp条带下方出现一片弥散,很可能就是酶切时间太长所致。因为AFLP经过PCR反应扩增出的产物主要在1000bp左右,范围可在100~1500bp之间,小于100bp的小分了量片段,接头可能连接不r。这是引起PCR扩增不出结果的原因之一。酶切时间太短,酶坷J不完全,酶切片段就不能覆盖整个基因组,影响PCR扩增的多态性。 一般来讲,酶切时间长短与酶的性质有关,具体
双酶切: 载体大小为3000bp左右,在SfiⅠ和BssHⅡ位点之间有370bp左右的片段存在。 我想通过SfiⅠ和BssHⅡ双酶切,将370bp的片段切掉,然后装入不同的片段。 我的酶切体系如下: 质粒(载体+老片段)1ul(约100ng) (NEBlack Eye SfiⅠ1ul (NEBlack Eye BssHⅡ1ul 10×buf 2.2ul 100×BSA 0.2ul 水14.8ul 总体积20ul 50度,2小时。切出了370bp左右的片段,回收载体。 然后取回收载体的1ul自连,铺平板,但是长出了300多个克隆。证明酶切不完全,怀疑有大量载体只是单酶切。50度3小时我试过,但是质粒有降解。酶量应该说是过量的。请问有什么办法可以酶切完全? 粘性连接 (一)外源DNA和质粒载体的连接反应 外源DNA片段和线状质粒载体的连接,也就是在双链DNA5’磷酸和相邻的3'羟基之间形成的新的共价链。如质粒载体的两条链都带5'磷酸,可生成4个新的磷酸二酯链。但如果质粒DNA已去磷酸化,则吸能形成2个新的磷酸二酯链。在这种情况下产生的两个杂交体分子带有2个单链切口,当杂本导入感受态细胞后可被修复。相邻的5'磷酸和3'羟基间磷酸二酯键的形成可在体外由两种不同的DNA连接酶催化,这两种酶就是大肠杆菌DNA连接酶和T4噬菌体DNA连接酶。实际上在有克隆用途中,T4噬菌体DNA连接酶都是首选的用酶。这是因为在下沉反应条件下,它就能有效地将平端DNA片段连接起来。 DNA一端与另一端的连接可认为是双分子反应,在标准条件下,其反应速度完全由互相匹配的DNA末端的浓度决定。不论末端位于同一DNA分子(分子内连接)还是位于不同分子(分子间连接),都是如此。现考虑一种简单的情况,即连接混合物中只含有一种DNA,也就是用可产生粘端的单个限制酶切割制备的磷酸化载体DNA。在瓜作用的底物。如果反应中DNA浓度低,则配对的两个末端同一DNA分子的机会较大(因为DNA分子的一个末端找到同一分子的另一末端的概率要高于找到不同DNA分子的末端的概率)。这
实验七重组质粒DNA的提取及酶切鉴定 【实验原理】 分离制备质粒DNA的方法很多,其中常用的方法有碱裂解法、煮沸法、SDS法、羟基磷灰石层析法等。在实际操作中可以根据宿主菌株类型、质粒分子大小、碱基组成和结构等特点以及质粒DNA的用途进行选择。 本实验采用SDS碱裂解法提取重组质粒DNA,十二烷基磺酸钠(SDS)是一种阴离子表面活性剂,它既能使细菌细胞裂解,又能使一些蛋白质变性。 限制性内切酶能特异地结合于一段被称为限制性酶识别序列的DNA序列之内或其附近的特异位点上,并切割双链DNA。限制性内切酶识别序列长度一般为4~8个呈回文序列的特异核苷酸对。由于限制性内切酶的切割特性不同,分子生物学中主要用到Ⅱ型限制性内切酶(切割位置在识别序列内部)。 对质粒进行酶切,通过跑胶观察片段大小,从而鉴定质粒。 【实验步骤】 本次实验所用的质粒提取试剂盒为天根的质粒小提试剂盒,操作步骤按说明书进行。 1. 吸附柱中加500ul 平衡液(BL),12000rpm离心1min ,弃收集管中的液体。 2.取1.5ml菌液至2ml离心管中,12,000rpm离心1min,弃上清。 3. 加250ul solution Ⅰ(P1),vortex。 4. 加250 solution Ⅱ(P2),上下颠倒混匀。操作时间不能超过5min 注:此步骤不宜超过5 min。 5. 加350 solution Ⅲ(P3),立即颠倒混匀几次。12000rpm离心10min。 6. 吸取上清加入吸附柱中,尽量不要吸出沉淀12000rpm离心1min ,弃收集管中的液体。注:此时4℃离心不利于沉淀沉降。 7. 加入600μL漂洗液(PW)于离心吸附柱中,12000rpm离心1min ,倒掉废液。 8. 重复上一步, 9. 空管离2min。将吸附柱放入1.5ml离心管中,在超净台中晾5min。10. 将700 μl的Rinse B加入Spin Column中,12,000 rpm离心30 sec,弃滤液。 10. 滴加50ul elution buffer(EB)至膜中央,室温放置2min后,12000rpm离心1min。离心管中即为纯化后的质粒。 11.构建重组质粒酶切体系,限制性内切酶反应一般在灭菌的15 ml PCR离心管中进行。 在冰浴上建立酶切反应体系(20 μl)
【原创】双酶切连接反应之全攻略(原创) 双酶切连接反应之全攻略 前一阵子一直在做双酶切质粒重组,失败了很多次,不过很快改善了实验方法,用2周重组了14个质粒。现就自己的体会,结合战友的宝贵经验,谈一下质粒重组的一些个人经验。 1、回收PCR产物:在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,如BamHI,HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基,其原则可参照: 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 纯化问题:纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。我用的是TAKARA的纯化柱试剂盒 酶量的问题:以TAKARA的为例,其对1单位酶的定义如下:在50 μl 反应液中,30℃温度下反应1小时,将1 μg 的λDNA完全分解的酶量定义为1个活性单位(U)。而该酶浓度约为15单位/微升,在除外酶降解的因素外,该酶可分解15μg的DNA,而一般从1-4ml菌液提出的DNA约为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的质量好,酶切完全切得动。 2、酶切、回收后的PCR产物与载体的连接 摩尔比的计算,很多人凭经验也可以。但对于初学者从头认真计算则非常有必要。回收的载体片段:回收的PCR产物片段=1:10,一般取前者,后者取。 pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套.1pmol 1000bp DNA=μg,如载体是5380bp,则为 ××=μg。 测DNA浓度可以在专用机子上测,注意OD值,一般约另外,如果嫌麻烦,也可用MARKER进行估测,如MARKER2000,5微升的MARKER每个条带约50ng。 连接反应:TAKARA的连接酶上的说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λDNA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNA片段被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。
实验二十一质粒DNA的提取、酶切与鉴定 一、质粒DNA的提取 [原理]分离质粒DNA的方法包括三个基本步骤:培养细菌使质粒扩增;收集和裂解细菌;分离和纯化质粒DNA。 本实验采用碱变性法抽提质粒DNA,是基于染色体DNA与质粒DNA的变性与复性的差异而达到分离目的。在pH高达12.6的碱性条件下,染色体DNA 的氢键断裂,双螺旋结构解开而变性。质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状的两条互补链不会完全分离。当以pH4.8的醋酸钾高盐缓冲液去调节其pH至中性时,变性的质粒DNA又恢复原来的构型,保存在溶液中,而染色体DNA不能复性而形成缠连的网状结构,通过离心,染色体DNA与不稳定的大分子RNA、蛋白质-SDS复合物等一起沉淀下来而被除去。 [试剂] 1.溶液I: 50mmol/L葡萄糖、10mmol/L EDTA、25mmol/L Tris-HCl pH8.0;用前加溶菌酶4mg/ml。 2.溶液II: 200mmol/L NaOH 、1% SDS。 3.溶液III: pH4.8醋酸钾缓冲液(60 ml 5mol/L 醋酸钾、11.5ml冰醋酸、28.5ml 蒸馏水) 4.TE缓冲液pH8.0 5.含RNaseA的TE缓冲液:TE缓冲液含20μg/ml RNaseA。 6.苯酚:氯仿(1:1,v/v):酚需在160℃重蒸,加入抗氧化剂8-羟基喹啉,使体积分数为0.1%,并用Tris-HCl缓冲液平衡两次。氯仿中加入异戊醇,氯仿/异戊醇为24:1(v/v)。 7.1×LB溶液 8.100μg/ml氨苄青霉素 [器材] 1.TGL-16型台式高速离心机
2.1.5ml塑料离心管 3.离心管架 4.微量移液器 5.常用玻璃器皿 [操作步骤] 1.培养细菌将带有质粒pUC19的大肠杆菌接种于5ml含100μg/ml氨苄青霉素的1×LB中,37℃培养过夜。 2.取液体培养菌液1.5ml置塑料离心管中,10 000r/min离心lmin,去掉上清液。加入150μl溶液I,充分混匀,在室温下放置10min。 3.加入200μl新配制的溶液II,加盖后温和颠倒5~10次,使之混匀,冰上放置2min。 4.加入150μl冰冷的溶液III,加盖后温和颠倒5~10次,使之混匀,冰上放置10min。 5.用台式高速离心机,10 000r/min离心5min,将上清液移入干净的离心管中。 6.向上清液中加入等体积酚/氯仿(1:1,v/v),振荡混匀,转速10 000r/min,离心2min,将上清液转移至新的离心管中。 7.向上清液加5mol/LNaCl至终浓度为0.3mol/L,混匀,再加入2倍体积无水乙醇,混匀,室温放置2min,离心5min,倒去上清乙醇溶液,把离心管倒扣在吸水纸上,吸干液体。 8.加0.5ml 70%乙醇,振荡并离心,倒去上清液,真空抽干或室温自然干燥。 9.加入50μl含RNase A 20μg/ml的TE缓冲液溶解提取物,室温放置30min以上,使DNA充分溶解待用或置-20℃备用。 二、质粒DNA 的限制性内切酶酶切及琼脂糖凝胶电泳分离、鉴定 [原理]限制性内切核酸酶(也可称限制性内切酶)是在细菌对噬菌体的限制和修饰现象中发现的。细菌内同时存在一对酶,分别为限制性内切酶(限制作用)和DNA甲基化酶(修饰作用)。它们对DNA底物有相同的识别顺序,但生物功能却相反。 Ⅱ型限制性内切酶,具有能够识别双链DNA分子上的特异核苷酸顺序的
双酶切编辑 做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解。为保险起见,一般连接3小时,16度;对含有AMP-RESISTENCE的质粒铺板时,注意加AMP 时的温度,温度过高,会使克隆株无法筛选出来。我的方法是培基高温消毒后放在烤箱里,烤箱一般温度为55-60度,然后做的时候拿出来,这样好掌握温度。铺板前后注意用吹风机吹干;对照的设立:为验证双酶切是否成功。 目录1简介 2连接反应 3注意事项 1简介编辑双酶切反应(Double Digests) 1、同步双酶切 同步双酶切是一种省时省力的常用方法。选择能让两种酶同时作用的最佳缓冲液是非常重要的一步。NEB每一种酶都随酶提供相应的最佳NEBuffer,以保证100%的酶活性。NEBuffer 的组成及内切酶在不同缓冲液中的活性见《内切酶在不同缓冲液里的活性表》及每支酶的说明书。能在最大程度上保证两种酶活性的缓冲液即可用于双酶切。由于内切酶在非最佳缓冲液条件下的切割速率会减缓,因此使用时可根据每种酶在非最优缓冲液中的具体活性相应调整酶量和反应时间。 2、分步酶切 如果找不到一种可以同时适合两种酶的缓冲液,就只能采用分步酶切。分步酶切应从反应要求盐浓度低的酶开始,酶切完毕后再调整盐浓度直至满足第二种酶的要求,然后加入第二种酶完成双酶切反应。 3、使用配有特殊缓冲液的酶进行双酶切(图) 使用配有特殊缓冲液的酶进行双酶切也不复杂。在大多数情况下,采用标准缓冲液的酶也能在这些特殊缓冲液中进行酶切。这保证了对缓冲液有特殊要求的酶也能良好工作。由于内切酶在非最佳缓冲液中进行酶切反应时,反应速度会减缓,因此需要增加酶量或延长反应时间。通过《内切酶在不同缓冲液里的活性表》可查看第二种酶在特殊缓冲液相应盐浓度下的作用活性。 双酶切建议缓冲液 注: 只要其中一种酶需要添加BSA,则应在双酶切反应体系中加入BSA。BSA不会影响任何内切酶的活性。 注意将甘油的终浓度控制在10%以下,以避免出现星号活性,详见《星号活性》。可通过增加反应体系的总体积的方法实现这一要求。 某些内切酶的组合不能采用同步双酶切法,只能采用分步法进行双酶切。上表中这些组合以“seq”标注。 2连接反应编辑1、回收PCR产物: 在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,如BamHI,HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基。 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 纯化问题:纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基
③双酶切处理目的片段和带有GFP的质粒并纯化 一、实验原理 1. 核酸限制性内切酶是在原核生物中发现的一类专一识别双链DNA中特定 碱基序列的核酸水解酶,他们的功能类似动物的免疫系统,用于抗击外来DNA的侵袭。现已发现几百种限制性内切酶,他们以内切方式水解核酸链中的磷酸二酯键,产生的DNA片段5’端为P,3’端为OH,由于限制性内切酶能识别DNA特异序列并进行切割,因而在基因重组、DNA序列分析、基因组甲基化分析、基因物理图谱绘制及分子克隆等技术上受到广泛应用。在酶切反应中,DNA的纯度、缓冲液中的离子强度、Mg2+等因素均可影响反应,一般可通过增加酶的用量,延长反应时间等措施以达到完全酶切。 2.DNA的酶切反应 II型限制性内切酶能识别双链DNA内部的特殊序列并在识别位点处将双链切断,形成粘性末端或齐平末端,通过电用酶切后的DNA混合物能够确认和分离酶切片段。 3.DNA的连接 在T4 DNA连接酶的作用下,平端或带有相同粘末端的DNA分子可以连接上。DNA连接酶的作分三步: ①T4 DNA连接酶与辅助因子ATP形成酶-AMP复合物。 ②酶-AMP复合物再结合到具有5’-磷酸基和3’-羟基切口的DNA分子上,使DNA腺苷 化 ③产生一个新的磷酸二酯键,把缺口封起来。 二、实验器材与处理方法(参照) 1、限制性内切酶酶BUFFER GFP质粒 2、T4 DNA连接酶连接酶缓冲液 3、电泳缓冲液(0.5×TBE或1×TAE)10×电泳加样缓冲液 4、溴酚蓝琼脂糖溴化乙锭(工作浓度0.5ug/ml)EcoR I 5、酚氯仿无水乙醇70%乙醇灭菌双蒸水 6、1.5ml离心管装入铝制饭盒(灭菌)、移液器吸头装入相应的吸头盒(灭 菌)电泳仪电泳槽紫外检测仪摄影设备 7、恒温水浴槽 三、实验步骤 先将步骤②扩增的目的片段进行纯化(柱层析或电泳割胶法) 1.酶切反应(按情况加大反应体系) 取GFP质粒(DNA)样品于合适的离心管中,按照表1加入试剂 ↓ 混匀;4000rpm离心30s,甩至管底 ↓ 37℃(限制性内切酶最适水温),保温1~3h酶切(酶切过夜则建议用稍大的酶切体积,以避免水分蒸发过多酶切体系各组分浓度改变过大,记得根据不同酶切位点加保护碱基)
原创】双酶切连接反应之全攻略(原创) 转自医学教育网的一篇贴子,很精彩,希望大家有做到的一定仔细看看,也添加了一些自己的体验。希望大家继续补充 双酶切连接反应之全攻略 前一阵子一直在做双酶切质粒重组,失败了很多次,不过很快改善了实验方法,用2周重组了 14个质粒。现就自己的体会,结合战友的宝贵经验,谈一下质粒重组的一些个人经验。 1、回收PCR产物:在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,如BamHI,HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基,其原则可参照: https://www.doczj.com/doc/694683559.html,/upload/2006/08/13/31219184.pdf。 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 纯化问题:纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。我用的是TAKARA 的纯化柱试剂盒 酶量的问题:以TAKARA的为例,其对1单位酶的定义如下:在50 μl 反应液中,30℃温度下反应1小时,将1 μg 的λDNA完全分解的酶量定义为1个活性单位(U)。而该酶浓度约为15单位/微升,在除外酶降解的因素外,该酶可分解15μg的DNA,而一般从1-4ml 菌液提出的 DNA约为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的质量好,酶切完全切得动。 2、酶切、回收后的PCR产物与载体的连接 摩尔比的计算,很多人凭经验也可以。但对于初学者从头认真计算则非常有必要。回收的载体片段:回收的PCR产物片段=1:10 ,一般取前者0.03pmol,后者取0.3pmol。 pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套.1pmol 1000bp DNA=0.66μg,如载体是5380bp,则0.03pmol为 0.03×5.38×0.66=0.106524μg。 测DNA浓度可以在专用机子上测,注意OD值,一般约1.8-2.0.另外,如果嫌麻烦,也可用MARKER进行估测,如MARKER2000,5微升的 MARKER每个条带约50ng。 连接反应:TAKARA的连接酶上的说明写的过夜,而其对连接酶单位的定义为:在20 μl 的连接反应体系中,6 μg的λDNA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNA片段被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。 3、转化: a、全量(10 μl)加入至100 μl JM109感受态细胞中,冰中放置30分钟。 b、42℃加热45秒钟后,再在冰中放置1分钟。 c、加入890 μl AMP阴性培养基,37℃振荡培养60分钟。 取100μl铺板。也可离心后余100μl 几个非常重要的问题
酶切 本实验室条件下酶切连接经验之谈 1、PCR产物可以切胶回收后酶切,用Elution buffer溶解即可,不影响后续实验。 2、50ulPCR产物切胶回收后用35ul Elution buffer溶解后只需取一半体积用于后续实验即可 满足要求。 3、PCR产物可以用乙醇沉淀法获得DNA用于后续反应,但需取少于一半的量用于后续实验, 否则会不能完全切开而导致实验失败。 4、双酶切时,若2种酶不是同一厂家时,可以根据Thermo厂家该2种酶的共同buffer, 选用Tango缓冲液,一般50ul体系各加1ul酶,而快切酶只需0.5ul,切3小时即可。 5、添加酶切试剂时,应先将buffer和样品振荡均匀后再加入相应的酶,轻弹混匀即可。 6、观察酶切后的载体片段会比质粒大很多,PCR产物双酶切后的片段也比未酶切时要大, 并且酶切后产物有时会呈现稍微弥散的宽带,由此可以判断是否切开。 7、部分限制性内切酶对甲基化的DNA不能切割,如FbaI和MboI等,一般生物公司提供的内切酶说明中均有说明。 大多数酶切位点的甲基化不影响切割,而有些会影响,如XbaI, BclI等。而且甲基化只发生在特定序列,以XbaI为例,只有在位点序列旁出现GA或TC,该XbaI位才会被甲基化。 而要解除这种限制修饰作用通常有两种方法: (1)选用上述酶的同功酶,如Sau3AI,DNA识别切割位点与MboI相同;但不受甲基化影响; (2)利用甲基化酶缺失的受体细胞进行DNA的制备,如E.coli JM110和链霉菌等,前者Dam和Dcm甲基化酶已敲出,而后者细胞内本就没有甲基化酶,从这些细胞中抽提的DNA就能被上述酶切割。 8:E.coli JM110 要排除dam,dcm甲基化的影响,需要用特定的dam-,dcm-的菌株,如JM110 如果由JM110或SCS110等甲基化缺失的菌株产生的质粒,则不会被甲基化. 若酶切不成功可以考虑以下因素的影响 a)有些内切酶对PCR产物酶切效率较低 b)双酶切无共同buffer时,可以采用分步酶切 c)PCR产物直接双酶切不成功,可以选择先做TA克隆后再双酶切 d)当载体的2个酶切位点很接近,或者其中一个酶切效率很差时,可以对载体进行去磷酸 化,该酶为牛小肠碱性磷酸酶,在大多数限制酶缓冲液中均有活性 e)导致“星星活性”可能是体系中甘油浓度过高、高PH、较低的离子强度所致。 连接 1、一定要选择未经过反复冻融的连接buffer,并准确加入,确保其终浓度准确。 2、目的片段和载体比例不是影响连接成功与否的关键原因,依据经验,取相等质量的的目 的片段和载体即可,载体可以尽量少加一点。3ug 载体(5kb)相当于2pmol 线性DNA 或者4pmol双酶切产物。 3、多个片段连接时,体系中,终浓度的各个片段与载体相同即可。
双酶切连接反应的注意要点 双酶切: 1、在双酶切载体时如果2个酶切位点靠得很近,必须注意酶切顺序。因为有的限制性内切酶要求其识别序列的两端至少保留有若干个碱基才能保证酶的有效切割。有的酶要求识别序列两端有多个碱基的,则必须先切,否则就可能造成酶切失败。 2、回收PCR产物:回收的PCR产物片段=1:10,一般取前者0.03pmol,后者取0.3pmol。pmol为单位的DNA转换为为?g单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为?g,也可以直接用这个公式套.1pmol 1000bp DNA=0.66μg,如载体是5380bp,则0.03pmol为0.03×5.38×0.66=0.106524?g。 3、双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,一般酶切3个小时,对于PCR产物,可以过夜酶切,效果会很好。酶切体系不宜过大,会影响质粒和酶的碰撞机会,效果降低;质粒量不应该超过酶切要求的最大量,否则酶切不完全,酶的用量控制在1U酶在15-20ul体系中酶解1ugDNA。 4、两种酶切的条件不同时,分别进行两次酶切,切完一个纯化后再切:温度要求不同,先酶切低温要求的,再酶切高温要求的;若盐浓度要求不同,先酶切低盐浓度要求的,再酶切高盐浓度要求的。 5、若质粒是在TE中保存的,TE 中的EDTA可能与酶的激活因子螯合,影响酶切效果,可放大酶切体积或重新浓缩质粒。 6、限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基。 7、纯化问题:纯化PCR产物割胶还是柱式,推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。 8、酶量的问题:以TAKARA的为例,其对1单位酶的定义如下:在50 μl 反应液中,30℃温度下反应1小时,将1 μg 的λDNA完全分解的酶量定义为1个活性单位(U)。而该酶浓度约为15单位/微升,在除外酶降解的因素外,该酶可分解15μg的DNA,而一般从1-4ml 菌液提出的DNA约为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的质量好,酶切完全切得动。 9、酶切、回收后的PCR产物与载体的连接:摩尔比的计算,很多人凭经验也可以。但对于初学者从头认真计算则非常有必要。回收的载体片段:回收的PCR产物片段=1:10,一般取前者0.03pmol,后者取0.3pmol。pmol为单位的DNA转换为为?g单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为?g,也可以直接用这个公式套.1pmol 1000bp DNA=0.66μg,如载体是5380bp,则0.03pmol 为0.03×5.38×0.66=0.106524?g。测DNA浓度可以在专用机子上测,注意OD值,一般约1.8-2.0.另外,如果嫌麻烦,也可用MARKER进行估测,如MARKER2000,5微升的MARKER 每个条带约50ng。 10、连接反应:TAKARA的连接酶上的说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λDNA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNA片段被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。
双酶切buffer的选择: 1、U :Supplied with its own unique reaction buffer that is different from the four standard NEBuffers. Its compatibility with the four standard NEBuffers is indicated by the chart. 2、BSA :Supplied with a separate vial of bovine serum albumin (10 mg/ml). To obtain 100% activity BSA should be added to the 1X reaction mix to a final concentration of 100 μg/ml. 3、SAM :Supplied with a separate vial of S-adenosyl-methionine (SAM). To obtain 100% activity, SAM should be added to the 1X reaction mix as specified on the product data card. 4、dd :When performing a double digest with this enzyme, this NEBuffer is recommended because it minimizes star activity. Purified by scientists at SibEnzyme and supplied with a SibEnzyme buffer (B, K, O, W or Y) which ensures 100% activity. Its compatibility with the NEBuffer System is indicated on the chart. 5、NR :This buffer is not recommended for use with with this enzyme。 6、Buffer Compositions :(1X): NEBuffer 1 (yellow): 10 mM Bis Tris Propane-HCl, 10 mM MgCl2, 1 mM DTT (pH 7.0 at 25℃). NEBuffer 2 (blue): 10 mM Tris-HCl, 10 mM MgCl2, 50 mM NaCl, 1 mM DTT (pH 7.9 at 25℃). NEBuffer 3 (red): 50 mM Tris-HCl, 10 mM MgCl2, 100 mM NaCl, 1 mM DTT (pH 7.9 at 25℃). NEBuffer 4 (green): 20 mM Tris-acetate, 10 mM magnesium acetate, 50 mM potassium acetate, 1 mM DTT (pH 7.9 at 25℃). 双酶切连接反应的经验谈: 双酶切: 1、在双酶切载体时如果2个酶切位点靠得很近,必须注意酶切顺序。因为有的限制性内切酶要求其识别序列的两端至少保留有若干个碱基才能保证酶的有效切割。有的酶要求识别序列两端有多个碱基的,则必须先切,否则就可能造成酶切失败。 2、回收PCR产物:回收的PCR产物片段=1:10,一般取前者0.03pmol,后者取0.3pmol。pmol为单位的DNA转换为为?g单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为?g,也可以直接用这个公式套.1pmol 1000bp DNA=0.66μg,如载体是5380bp,则0.03pmol为0.03×5.38×0.66=0.106524μg。 3、双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,一般酶切3个小时,对于PCR产物,可以过夜酶切,效果会很好。酶切体系不宜过大,会影响质粒和酶的碰撞机会,效果降低;质粒量不应该超过酶切要求的最大量,否则酶切不完全,酶的用量控制在1U酶在15-20ul体系中酶解1ugDNA。