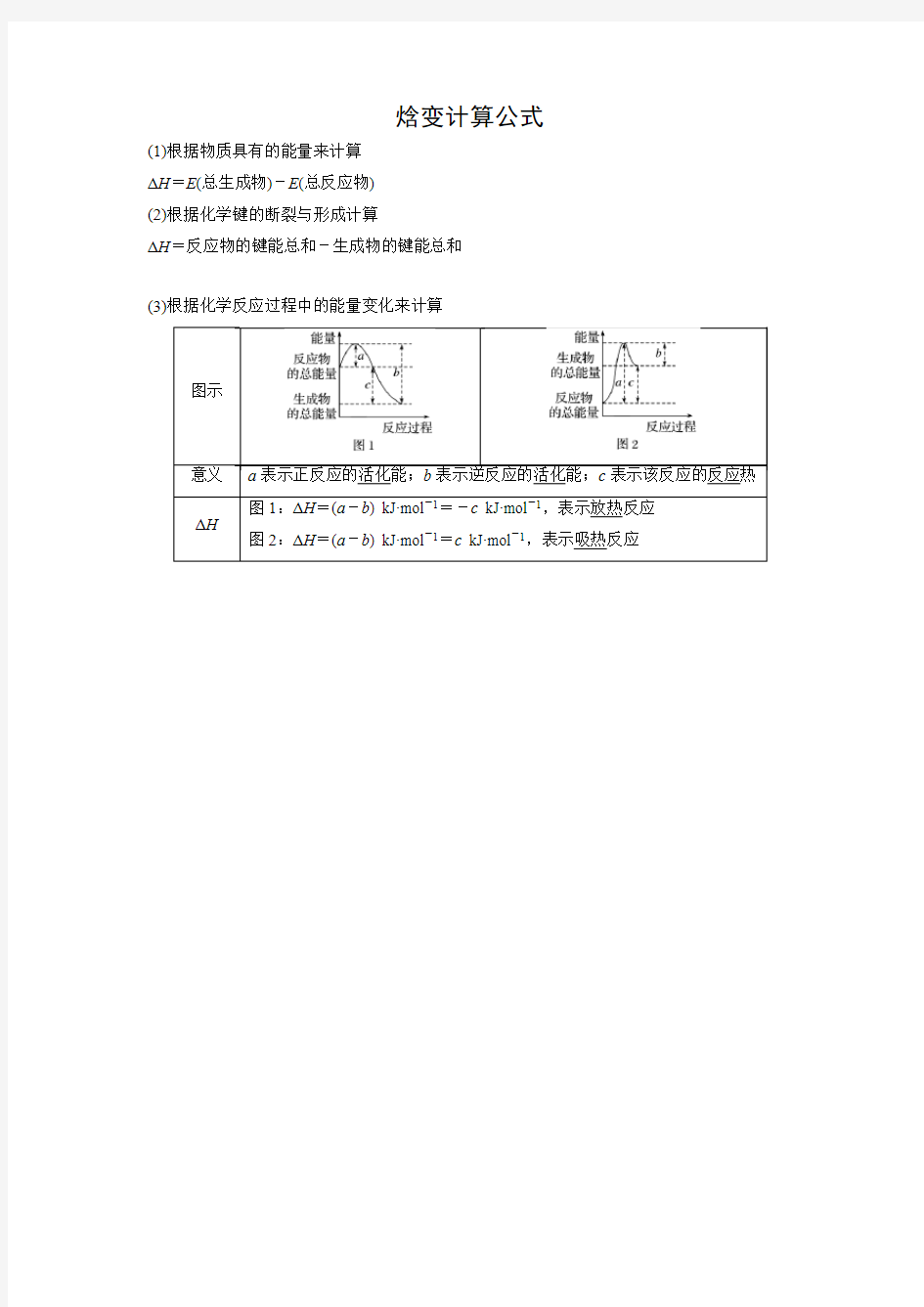
焓变计算公式
(1)根据物质具有的能量来计算
ΔH=E(总生成物)-E(总反应物)
(2)根据化学键的断裂与形成计算
ΔH=反应物的键能总和-生成物的键能总和
(3)根据化学反应过程中的能量变化来计算
a表示正反应的活化能;b表示逆反应的活化能;c表示该反应的反应热
供热蒸汽焓值计算方法:表1. 过热蒸汽特性参数
用温度和压力分别作为X 和Y ,焓值作为Z 变量,可求出表的规定范围内温度与压力任意组合下的焓值。 所计算的焓值 = 121min) ()(Y Y Y Z Yspan Y Yact Z Z +-?- 式中 1Y Z = m ax )m in,(m in)] m in,(m in)m ax ,([m in)(Y X Z Xspan Y X Z Y X Z X Xact +-?- 2Y Z = m ax )m in,(m ax )] m ax ,(m ax )m in,([m in)(Y X Z Xspan Y X Z Y X Z X Xact +-?- Xact = X 的实际值 Xmin = (紧靠X 实际值)前的X 值 Xmax = (紧靠X 实际值)后的X 值 XSpan = Xmax- Xmin ,紧靠X 实际值前后X 值的范围。 Yact = Y 的实际值。 Ymin = 紧靠Y 实际值之前的Y 值。 Ymax = 紧靠Y 实际值之后的Y 值。 YSpan = Ymax- Ymin ,紧靠Y 实际值前后Y 值的范围。 举个例子: 计算压力为,温度为295℃的焓值。 计算如下: 1Y Z = )5.1,290(290300)] 2.1,290()2.1,300([)290295(Z Z Z +--?- 2Y Z = )5.1,290(290 300)] 5.1,300()5.1,290([)290295(Z Z Z +--?-
所计算的焓值 H = 1212 .15.1) 2.1 3.1()(Y Y Y Z Z Z +--?- 总热量计算公式为: Q m =dt q H m t ***1000*36000 ? 其中,H 为计算值(kJ /kg ) q m 为所测质量流量(t/h ) Qm 为时间积分流量(时间为秒累计)
《反应焓变的计算》 班级:姓名: 考点一、焓变的计算 例1、化学反应可视为旧键的断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)出的能量。已知白磷和P4O6 的分子结构如右图所示,现提供以下化学键的键能 (KJ·mol–1)P–P:198 P–O:360 O–O:498 则 反应P4(白磷)+ 3O2→P4O6的反应热△H为() A.+1638KJ·mol–1 B.–1638KJ·mol–1 C.+126KJ·mol–1 D.–126KJ·mol–1 考点二、盖斯定律 例2、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol 写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:___________________ 考点三、综合应用 例4、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。 (1)反应的热化学方程式为。(2)又已知H2O(l) = H2O(g) ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。 (3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 一、当堂训练: 1.下列叙述正确的是( ) A.电能是二次能源 B.水力是二次能源C.天然气是二次能源 D. 水煤气是一次能源2.下列说法正确的是() A.物质发生化学变化都伴随着能量变化 B.任何反应中的能量变化都表现为热量变化C.伴有能量变化的物质变化都是化学变化 D.即使没有物质的变化,也可能有能量的变化 3.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是() ①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
烟气或空气温度RO2N2H2O hy0湿空气400771.88526.52626.163143.61028541.76 500994.35663.8794.853985.93835684.15 6001224.66804.12968.884850.57724829.74 7001461.88947.521148.845737.21036978.42 8001704.881093.61334.46643.047841129.12 9001952.281241.551526.047563.989431282.32 10002203.51391.71722.98500.24921437.3 11002458.391543.741925.119450.567391594.89 12002716.561697.162132.2810412.36041753.44 13002976.741852.762343.6411387.10041914.25 14003239.042008.722559.212367.81562076.2 15003503.121662779.0513357.96942238.9 16003768.82324.483001.7614356.08372402.88 17004036.312484.043229.3215363.1022567.34 18004304.72643.663458.3416372.07392731.86 19004574.062804.213690.3717387.44262898.83 20004844.229653925.618406.47223065.6 21005115.393127.534163.2519434.7493233.79 22005386.483289.224401.9820460.34983401.64
第1章第1节第3课时 1.假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化用下图表示,则下列说法不正确的是() A.|ΔH1|>|ΔH2| B.|ΔH1|<|ΔH3| C.ΔH1+ΔH2+ΔH3=0 D.甲―→丙的ΔH=ΔH1+ΔH2 解析:上述过程中甲为始态,乙为中间态,丙为终态,由盖斯定律可知:甲―→丙,ΔH=ΔH1+ΔH2<0 丙―→甲,ΔH3>0,故D项正确; 在过程中ΔH1与ΔH2的大小无法判断,故A项错误; 因|ΔH3|=|ΔH1|+|ΔH2|,故B项正确; 又因为甲―→丙和丙―→甲是两个相反的过程,所以ΔH1+ΔH2+ΔH3=0,故C项正确。 答案:A 2.在298 K、100 kPa时,已知: 2H2O(g)===O2(g)+2H2(g)ΔH1 Cl2(g)+H2(g)===2HCl(g)ΔH2 2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3 则ΔH3与ΔH1和ΔH2间的关系正确的是() A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2 C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2 解析:依次给三个热化学方程式编号为①、②、③,则③=①+2×②,故ΔH3=ΔH1+2×ΔH2。 答案:A 3.已知:2H2O(l)===2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1,2H2(g)+ O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1。当1 g液态水变为气态水时,对其热量变化的下列描述:①放出;②吸收;③2.44 kJ;④4.88 kJ;⑤88 kJ。其中正确的是() A.②和⑤ B.①和③ C.②和④ D.②和③ 解析:2H2O(l)===2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1①
水的焓值、比容、k 热系数计算方法 CJ128《热量表》以及国内有关热量表法规中没有任何有关热系数或焓值的算法规范性资料, 给研究或生产热量表带来不便,这是咱们法规制定过程中的缺憾。大家一般都是从热量表的规程或标准附录将附录表格中的数据进行差分计算。欧洲标准的第一册将IAPWS-IF97的相关公式列入附录A 作为标准的规范性资料,把摘抄下来,以便大家使用。 来自EN1434-1:2007 附录A (规范性资料) 热系数计算公式 用于热交换回路热交换的测量。热量表利用热系数k(p,θf ,θr )进行热量计算,热系数与物理量压 力p ,供水温度θf ,回水温度θr 有关。 水的热系数公式:r f r f r f h h p k θθνθθ--=1),,( 式中,ν—比容;hf —供水端比焓,hr —回水端比焓 比热焓h 可以按照《水和蒸汽热力学特性工业标准》(IAPWS-IF97),并按1990国际温标(ITS-90) 进行计算得到。(计算时温度使用绝对温度T =t +273.15,压力单位为MPa) 比容ν的计算公式:ππγτπν=RT p ),( π=p /p* ,p*=16.53MPa , i i J l i i i l n )222.1() 1.7(1 341---=-=∑τπγπ 比焓h 计算公式:ττγτπ=RT h ),( τ=T*/T ,T*=1386K ,1341)222.1()1.7(-=--=∑i i J i i l i J n τπγτ 在273.15K ≤T ≤623.15K ;ps(T) ≤p ≤100Mpa 范围内R=461.526J/kg/K 。Ps (T )为饱和压力。 公式中的数据l,j,n: L(1~34)={ 0, 0, 0, 0, 0, 0, 0, 0, 1, 1, 1, 1, 1, 1, 2, 2, 2, 2, 2, 3, 3, 3, 4, 4, 4, 5, 8, 8,21,23,29,30,31,32}; j (34)={ -2, -1, 0, 1, 2, 3, 4, 5, -9, -7,-1, 0, 1, 3, -3, 0, 1, 3, 17, -4, 0, 6, -5, -2, 10,-8,-11, -6,-29,-31,-38,-39,-40,-41}; n(34)= 0.14632971213167, -0.84548187169114, -3.756360367204,3.3855169168385, -0.95791963387872, 0.15772038513228,-0.016616417199501, 8.1214629983568E-04, 2.8319080123804E-04, -6.0706301565874E-04, -0.018990068218419, -0.032529748770505, -0.021841717175414, -5.283835796993E-05, -4.7184321073267E-04, -3.0001780793026E-04, 4.7661393906987E-05, -4.4141845330846E-06, -7.2694996297594E-16, 3.1679644845054E-05,-2.8270797985312E-06, -8.5205128120103E-10, -2.2425281908E-06, -6.5171222895601E-07, -1.4341729937924E-13, -4.0516996860117E-07, -1.2734301741641E-09, -1.7424871230634E-10, -6.8762131295531E-19, 1.4478307828521E-20, 2.6335781662795E-23,-1.1947622640071E-23,1.8228094581404E-24,-9.3537087292458E-26} 山东省计量院 朱江 QQ :69632265
实验十四 化学反应焓变的测定 一、教学要求: 1. 了解测定化学反应焓变的原理和方法; 2. 熟悉台秤、温度计和秒表的正确使用; 3. 学习数据测量,记录、整理,计算等方法; 二、预习内容 1. 复习《无机及分析化学》有关热力学部分的知识要点; 2. 锌与硫酸铜的置换反应; 3. 常用仪器 :台天平、电子天平、温度计以及容量瓶的使用方法; 三、基本操作 1. 台天平以及电子天平的使用; 2. 温度计及秒表的使用; 3. 容量瓶的使用; 四、实验原理 化学反应过程中,除了发生物质的变化外,还有能量的变化,这种能量变化表现为反应热效应,而化学反应通常是在恒压的条件下进行的,此反应热效应叫做等压热效应。化学反应的等压热效应Q p 等于化学反应的摩尔反应焓变△r H m (放热反应为负值,吸热反应为正值)。在标准状态下化学反应的焓变称为化学反应的标准焓变,用△r H m θ表示。反应热效应的测量方法很多,本实验采用普通的保温杯和精密温度计作为简易量热计来测量。假设反应物在量热计(图4-1)中进行的化学反应是在绝热条件下进行的,即反应体系(量热计)与环境不发生热量传递。这样,从反应体系前后的温度变化和量热器的热容及有关物质的质量和比热容等,就可以按(1)式计算出反应的热效应。本实验是 1.温度计 2.搅棒 3.胶塞 4.保温杯 5.CuSO 4溶液 图 4-1 保温杯式简易量热计装置 以锌粉和硫酸铜溶液发生置换反应: 在298.15K 和标准状态下,1mol 锌置换硫酸铜溶液中的铜离子,放出218.7kJ 的热量。 )()()()(22aq Zn s Cu aq Cu s Zn +++=+ 17.218-?-=?m o l kJ H m r θ 由溶液的比热和反应前后溶液的温度变化,可求得上述反应的焓变。计算公式如下: n V c T T H m r 1)(?????-=?ρ (1) 式中:m r H ? —— 反应的焓变(kJ·mol -1 ); T ? —— 反应前后溶液的温度变化(K); c —— 溶液的热容(J·g -1·K -1)(取4.18);
焓值的定义与计算公式 The Standardization Office was revised on the afternoon of December 13, 2020
焓值的定义与计算公式 空气中的焓值是指空气中含有的总热量,通常以干空气的单位质量为基准,称作比焓。工程中简称为焓,是指一千克干空气的焓和与它相对应的水蒸气的焓的总和。 在工程上,我们可以根据一定质量的空气在处理过程中比焓的变化,来判定空气是得到热量还是失去了热量。 空气的比焓增加表示空气中得到热量;空气的比焓减小表示空气中失去了热量。 在计算气流经过换热器的换热量的时候,气流一侧的换热量计算通过焓差计算相当简便:Q= M*(H_out-H_in) Q是换热量 M是气流质量流量 H为气流比焓值。 其实这不只针对气流,对于气液两相的制冷剂流动,也是同样的计算方法。 空气焓值的定义及空气焓值的计算公式 空气的焓值是指空气所含有的总热量,通常以干空气的单位质量为基准。 焓用符号i表示,单位是kj/kg干空气。 湿空气焓值等于1kg干空气的焓值与d kg水蒸气焓值之和。 湿空气焓值计算公式化: i=+(2500+d = (+)t+2500 d (kj/kg干空气)
式中: t—空气温度℃ d —空气的含湿量 g/kg干空气 —干空气的平均定压比热 kj/ —水蒸气的平均定压比热kj/ 2500—0℃时水的汽化潜热 kj/kg 由上式可以看出: (+)t是随温度变化的热量,即“显热”; 而2500d 则是0℃时d kg水的汽化潜热,它仅随含湿量而变化,与温度无关,即是“潜热”。 上式经常用来计算冷干机的热负荷。
能量单位。1Kcal=每kg 标准状况水开靠1C 能量 除常用的 KW , HP , KJ , Kcal , BTU 之外,表示热功的 单位还有 W , J , cal,和Mw , Mj , Mcal ,也就是瓦,焦耳, 卡和兆瓦,兆卡。他们是 KW 的千分之一和千倍。 三、需要分析的问题。 功率是单位时间作的功,它本身不是能量,只能说明单位时间 热功率、热负荷、热焓量 一、热功率定义及单位。 1、 热功率是加热设备根据事物加热的时间和能量消耗的多少 设计确定物理量,计算单位是 KW ,物理意义是单位时间 所释放的能量。常用的英制单位为马力(正 HP ) 2、 热负荷是加热设备在标准状况下所消耗能源全部转化的能 量,计算单位是千焦耳(KJ ),更常用的单位是千卡(Kcal ) 国外的设备常用英制 BTU 作单位。 3、 热焓量,是指热力传递的函数。通常用来计算气体(蒸汽) 可以释放热能数值,可以用千焦(KJ ),千卡(Kcal )做单 位。我们最常接触能的包含蒸汽的焓值。 二、各种热功率单位表示方法的意义。 1、 千瓦 单位时间所做的功。 1 千瓦=1000 焦耳/秒 1000J/S 2、 马力 单位时间所做的功。 马力=746焦耳/秒 1HP=746J/S 3、 千焦 能量单位。 1KJ=1KNM (千*牛顿*米) 5、 BTU 英制能量单位 1BTU=778.169*bf - ft (磅力?英尺) 4、 6、
内可以释放能量的大小。 而焦耳、千卡、BTU 是能量大小值,与时间无关。功率是表示 而能量是表示消耗能源的数值。10KW 的设备1 小时释放的能量与5KW 2 小时释放的能量相同的。功率不等于热功 能量。KW 与KJ,Kcal 之间没有可以换算的可能。 四、换算 1、热量之间的换算,1KJ=0.238846Kcal 1kcal=4.1868KJ 1KJ=0.948BTU 1BTU=1.05506KJ 1Kcal=3.967BTU 1BTU=0.252074Kcal 2、功率与热能的比例关系 常用千瓦时作单位(电度) 1 千瓦时=1KWH=3600KJ 1KJ=859.846Kcal 1KWH=859.846Kcal 1Kcal=0.001163KWh 1KWh=3412.14BTU 1BTU=0.252074Kcal 五、如何计算设备的功率,能耗,热负荷,设备的功率是用千 瓦表示的。热负荷可以用每小时的释放热量千卡来表示。 如28KW 的炉具热负荷为 28KWh=28*859.846 =24000Kcal 或者=95414BTU 利用第四节中的功率与热能的关系1kwh=859.84Kcal 可以方便
饱和蒸汽焓值计算公式-CAL-FENGHAI.-(YICAI)-Company One1
饱和蒸汽焓值计算公式(0-200度)一阶拟合: Linear model Poly1: f(x) = p1*x + p2 Coefficients (with 95% confidence bounds): p1 = , p2 = 2507 (2504, 2511) Goodness of fit: SSE: 3469 R-square: Adjusted R-square: RMSE: Linear model Poly1: f(x) = p1*x + p2 Coefficients (with 95% confidence bounds): p1 = , p2 = 2504 (2503, 2504) Goodness of fit: SSE: R-square: Adjusted R-square:
RMSE: Linear model Poly1: f(x) = p1*x + p2 Coefficients (with 95% confidence bounds): p1 = , p2 = 2502 (2501, 2503) Goodness of fit: SSE: R-square: Adjusted R-square: RMSE: 二阶拟合: Linear model Poly2: f(x) = p1*x^2 + p2*x + p3 Coefficients (with 95% confidence bounds): p1 = , p2 = , p3 = 2499 (2498, 2500) Goodness of fit: SSE: R-square:
关于P88例题5-1中,如何查水蒸气热力性质图和表,计算得到以下四组数据: (习题5中的求解类似) 12343214.5/,2144.2/,191.84/,195.3/h kJ kg h kJ kg h kJ kg h kJ kg ==== (1) 1h 在课本P86中,如图5-3, 点1为过热蒸汽,114,400p MPa t C ==?,故查附录14中 3,400p MPa t C ==?时,13133231.6/, 6.9231/()h kJ kg s kJ kg K == 5,400p MPa t C ==?时,15153196.9/, 6.6486/()h kJ kg s kJ kg K == 利用内插法,求得 114,400p MPa t C ==?时,11?/,?/()h kJ kg s kJ kg K == (2) 2h 由图5-3,知点1和点2的熵一样,故 21?/()s s kJ kg K == 点2为湿饱和蒸汽,由饱和水与饱和蒸汽组成,在条件为20.01p MPa =时,即可通过点2 的熵2s 反求出该点的干度: 2''(1)''(''')s xs x s s x s s =+-=+-,得?x = 再利用干度求出该点的焓2h : 2''(1)''(''')h xh x h h x h h =+-=+- (其中:'0.6493/(),''8.1505/(), '191.84/,''2584.4/s kJ kg K s kJ kg K h kJ kg h kJ kg ==== ) (3) 3h 在图5-3中,点3为饱和水,在条件为20.01p MPa =,查附录13,得3191.84/h kJ kg =。 (4) 4h 点3与点4重合,两者的熵一样,即430.6493/()s s kJ kg K == ,而点4为未饱
实验1 化学反应摩尔焓变的测定 一. 实验目的 1. 了解测定化学反应摩尔焓变的原理和方法; 2. 学习物质称量、溶液配制和溶液移取等基本操作; 3. 学习外推法处理实验数据的原理和方法。 二. 背景知识及实验原理 化学反应过程中,除物质发生变化外,还伴有能量变化。这种能量变化通常表现为化学反应的热效应(简称为化学反应热)。化学反应通常是在等温、等压、不做非体积功的条件下进行的,此时反应热效应亦称作等压热效应,用Q p表示。化学反应的等压热效应(Q p)在数值上等于化学反应的摩尔反应焓变(△r H m)(热力学规定放热反应为负值,吸热反应为正值)。在标准状态下,化学反应的摩尔反应焓变称为化学反应的标准摩尔焓变,用△r H mθ表示。 化学反应焓变或化学反应热效应的测定原理是:在绝热条件下(反应系统不与量热计外的环境发生热量交换),使反应物仅在量热计中发生反应,并使量热计及其内物质的温度发生改变。通过反应系统在反应前后的温度变化,以及有关物质的质量和比热,可以计算出反应的热效应值。 实验中溶液反应的焓变值测定采用如图1所示的简易量热计进行测定,通过测定CuSO4溶液与Zn粉的反应进行焓变值的获取。 图1保温杯式量热计 CuSO4溶液与Zn粉的反应式为: Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq) 由于该反应速率较快,且能进行得相当完全。实验中若使用过量Zn粉,则CuSO4溶液中Cu2+可认为完全转化为Cu。系统中反应放出的热量等于溶液所吸收的热量。 在简易量热计中,反应后溶液所吸收的热量为:
Q p =m ? c? ?T =V ? ρ? c ? ?T 式中: m —反应后溶液的质量(g ); c —反应后溶液的质量热容(J ? g -1?K -1) ?T —为反应前后溶液的温度之差(K ),经温度计测量后由作图外推法确定; V —反应后溶液的体积(mL ) ρ—反应后溶液的密度(g ?m L -1) 设反应前溶液中CuSO 4的物质的量为n mol ,则反应的焓变为: 1110001--? ?????-=????-=?mol kJ n T c V mol J n T c m H ρ (1) 设反应前后溶液的体积不变,则 mol V c n CuSO 10004? = 式中,C CuSO4——反应前溶液中CuSO 4的浓度(mol ?.L -1) 将上式代入式(1)中,可得 114 4100011000 --????-=???????-=?mol kJ c T c mol kJ V c T c V H CuSO CuSO ρρ (2) 由于此系统非严格绝热体系,因而在反应液温度升高的同时,量热计的温度也相应提高,而计算时忽略此项内容,故会造成温差的偏差。故在处理数据时可采用外推法,按图2中虚线外推至反应开始的时间,图解求得反应系统的最大温升值T ,这样则可较客观地反映出由反应热效应引起的真实温度变化值。在图2中,线段bc 表明量热计热量散失的程度。考虑到散热从反应一开始就发生,因此应将该线段延长,使与反应开始时的纵坐标相交于d 点。图中ddˊ所示的纵坐标值,即为外推法补偿的由热量散失造成的温度差。为获得准确的外推值,温度下降后的实验点应足够多。T 2与T 1的差值即为所求的?T 。 图2 温度校准曲线
第三课时、反应焓变的计算-----盖斯定律 【学习目标】 1.了解化学反应中能量变化的实质,理解反应热、放热反应、吸热反应、焓及焓变等概念。 2.明确测定反应热的要点,测定反应热的基本原理和方法。 3、能熟练书写热化学方程式,能利用盖斯定律进行有关反应焓变的简单计算 【学习重难点】 1. 理解放热反应和吸热反应的实质。 2.熟练书写热化学方程式。 3.掌握盖斯定律,并会计算反应的焓变。 【课堂学案】 【复习提问】写出下列反应的热化学方程式 (1)1molC 2H 5OH(l)与适量O 2(g)反应,生成CO 2(g)和H 2O(l),放出1366.8kJ 热量。 。 (2)18g 葡萄糖与适量O 2(g)反应,生成CO 2(g)和H 2O(l), 放出280.4kJ 热量。 。 【板书】三、反应焓变的计算 (一)盖斯定律: 1、内容: 2、理解要点: (1)反应焓变(反应热效应)只与 、 有关,与 无关。 (2)焓变(反应热)总值一定。 △H = △H 1 + △H 2 = △H 3 + △H 4 + △H 5 [合作探究]:如何进行反应热的计算? 由盖斯定律可知:反应热的大小与反应的 无关,无论是一步完成还是分几步完成,其反应热是 的。我们可以将两个或多个热化学方程式包括其△H 相 或相 ,得到一个新的热化学方程式。即热化学方程式具有 性,可以进行加、减、乘、除四则运算。 [要点强化指导]:⑴反应热的计算是以其定义为基础的,要掌握其定义的涵义,同时注意单位的转化。 反应物 a 生成物 △H △H 2 △H 1 c b △H 5 △H 4 △H 3
⑵依据热化学方程式的计算,要注意反应热是指反应按所该形式完全进行时的反应热。 ⑶热化学方程式中的化学计量数与反应热成正比关系。 (二)焓变的计算方法 1、利用已知焓变求未知焓变——热化学方程式相加减 【问题分析示例】 例题1:氢气和氧气生成液态水的反应, 可以通过两种途径来完成,如下图所示: 已知:H 2(g )+ 1/2O 2(g )= H 2O (l );△H = -285.8kJ ·mol - 1 H 2O (g )= H 2O (l );△H 2 = -44.0kJ ·mol - 1 求:H 2(g )+ 1/2O 2(g )= H 2O (g )的反应热△H 1 ? 解析:依据盖斯定律可得:△H =△H 1+△H 2 , 所以,△H 1=△H -△H 2 = -285.8kJ ·mol -1 -(-44.0kJ ·mol - 1) = -241.8kJ ·mol - 1 答案:△H 1= -241.8kJ ·mol - 1 【例2】试利用298K 时下述反应的实验数据,计算此温度下 C (s ,石墨)+1 2 O 2(g )=CO (g )的反应焓变。 C (s ,石墨)+ O 2(g )= CO 2(g ) △H 1 = —393.5kJ?mol —1 CO (g ) + 1 2 O 2(g )= CO 2(g ) △H 2 = —283.0kJ?mol —1 解:设此反应分两步进行: 第一步:C (s ,石墨)+ O 2(g )= CO 2(g ) △H 1 = —393.5kJ?mol —1 第二步:CO 2(g )= CO (g ) + 1 2 O 2(g )△H 2 ′= —△H 2 = 283.0kJ?mol —1 将上述两步反应相加得总反应为: C (s ,石墨)+1 2 O 2(g )=CO (g ) △H 3 = ? 根据盖斯定律,△H 3 =△H 1 + △H 2 ′ =—393.5kJ?mol —1 + 283.0kJ?mol —1 =—110.5kJ?mol —1 答:298KC (s ,石墨)+1 2 O 2(g )=CO (g )的△H 为—110.5kJ?mol —1。 【练习1】试利用298K 时下述反应的实验数据,计算此温度下P 4(s ,白磷)= 4P ( s ,红磷)的反应焓变。 P 4(s ,白磷)+ 5O 2(g )= P 4O 10(S ) △H 1 = —2983.2kJ?mol —1 P (s ,红磷)+ 54O 2(g )= 1 4 P 4O 10(S ) △H 2 = —738.5kJ?mol —1
饱和蒸汽焓值计算公式公司内部编号:(GOOD-TMMT-MMUT-UUPTY-UUYY-DTTI-
饱和蒸汽焓值计算公式(0-200度) 一阶拟合: Linear model Poly1: f(x) = p1*x + p2 Coefficients (with 95% confidence bounds): p1 = 1.569 (1.528, 1.61) p2 = 2507 (2504, 2511) Goodness of fit: SSE: 3469 R-square: 0.9916 Adjusted R-square: 0.9914 RMSE: 8.414 Linear model Poly1: f(x) = p1*x + p2 Coefficients (with 95% confidence bounds): p1 = 1.67 (1.659, 1.682) p2 = 2504 (2503, 2504) Goodness of fit: SSE: 252.6 R-square: 0.9994 Adjusted R-square: 0.9994 RMSE: 2.271
Linear model Poly1: f(x) = p1*x + p2 Coefficients (with 95% confidence bounds): p1 = 1.777 (1.765, 1.789) p2 = 2502 (2501, 2503) Goodness of fit: SSE: 295.6 R-square: 0.9993 Adjusted R-square: 0.9993 RMSE: 2.456 二阶拟合: Linear model Poly2: f(x) = p1*x^2 + p2*x + p3 Coefficients (with 95% confidence bounds): p1 = -0.002719 (-0.002911, -0.002526) p2 = 2.036 (2.002, 2.071) p3 = 2499 (2498, 2500) Goodness of fit: SSE: 195.7 R-square: 0.9995 Adjusted R-square: 0.9995 RMSE: 2.019
一、课题:反应焓变的计算二、课型:复习课 三、课程标准与考纲要求: 1、掌握盖斯定律,并会计算反应焓变。 2、培养学生学习化学的兴趣,培养创新精神和实践能力。 四、知识要点扫描: 中华第一考P234四、反应焓变的计算 五、考点解析与典例精讲: 考点一、焓变的计算 例1、化学反应可视为旧键的断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)出的能量。已知白磷和P4O6 的分子结构如右图所示,现提供以下化学键的键能 (KJ·mol–1)P–P:198 P–O:360 O–O:498 则 反应P4(白磷)+ 3O2→P4O6的反应热△H为() A.+1638KJ·mol–1 B.–1638KJ·mol–1 C.+126KJ·mol–1 D.–126KJ·mol–1 解析: 考点二、盖斯定律 例2、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol 写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:___________________ 解析: 考点三、综合应用 例4、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。 (1)反应的热化学方程式为。(2)又已知H2O(l) = H2O(g) ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。 (3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。 解析:
选修《化学反应原理》第1章第一章第一节化学反应的热效应第3课时 实施人:枣庄二中姜丽红 1.日期:2014年9月4日 2.课题:反应焓变的计算 3.课型:新授课 4.教学手段:多媒体辅助教学、常规 5.教学模式:先复习后上课,先预习后讲解,先探究后实验,先思考后合作,先检测后讲解,先复习后作业 一教材分析: 这节是在对上节课讲的热化学方程式及焓、焓变的基础上进一步深化,重点介绍盖斯定律求化学反应的反应热,在本节学完之后对化学反应中实验难测定的反应热的求算有了更充分的认识,打下了化学热力学的初步基础,为以后的进一步深入研究提供了知识支持。 二设计思路: 先介绍有些反应焓变很难直接由实验测得,进而引入盖斯定律,通过习题练习总结规律,最后应做一定量的巩固训练,加深对盖斯定律的理解。 三.教学目标: 知识与技能: 1、通过盖斯定律求算反应焓变,了解反应焓变与变化途径无关,仅仅与状态有关。 2、通过键能的变化求算反应焓变,了解物质的结构与其能量变化的关系。 过程与方法:通过盖斯定律求算反应焓变的过程,体会数学、物理在学习化学中的重要性,注意理科之间的相互渗透和影响。 情感态度与价值观:体会思考带给人的愉快情感体验。 教学重、难点: 利用盖斯定律求反应焓变 教学难点: 反应焓变的计算 四教学设计:
(2)1mol HgO(s)分解为液态汞和氧气,吸热90.4kJ热量。 。掌握学情. 新课导入联想与质疑: 已知C(s)+1/2O2(g)=CO(g) △H1=- 110.5kJ/mol CO(g)+1/2O2(g)=CO2(g) △H2=-283.0 kJ/mol 如何得到反应C(s)+O2(g)=CO2(g) 的△H3=? ①需要直接测定吗? ②若不能直接测,怎么办? 教师讲述:化学反应的反应热,有的能够测量,有的不能测 量。比如将一些生成不稳定物质的化学反应,例有C →CO, CO或多或少的要转化为CO2,还有一些反应进行的比较慢,要 几天,几个月,几年,甚至几十年,肯定不能测量。对于这样 的反应热,我们就要进行计算才能得到。这节课我们就来讲讲 反应焓变的计算 有学生回答 可以用实验 测定,有学生 会想到可以 计算。 自主学习请学生们先看书P7关于盖斯定律的内容。我们来讨论盖斯定律 的定义和应用 【板书】 一盖斯定律 不管化学反应是一步完成或分几步完成,其反应焓变是一样 的.换句话说,化学反应的焓变只与反应体系的始态和终态有关, 而与反应的途径无关。 学生看书,不 懂的可以提 问。 让同学口述 盖斯定律 指导 学生 看书, 有利 于学 生阅 读能 力的 提高, 养成 自学 的习 惯。 概 念 讨 论 化学反应的焓变,就如我们爬山,不论选择哪条路线,高度总是相同的(如图)。化学反应遵循质量守恒和能量守恒。在指定的状态下,各种物质的焓值都是确定且唯一的,因此反应提高学生理解能力。
热功率、热负荷、热焓量 一、热功率定义及单位。 1、热功率是加热设备根据事物加热的时间和能量消耗的多少 设计确定物理量,计算单位是KW,物理意义是单位时间所释放的能量。常用的英制单位为马力(正HP) 2、热负荷是加热设备在标准状况下所消耗能源全部转化的能 量,计算单位是千焦耳(KJ),更常用的单位是千卡(Kcal)国外的设备常用英制BTU作单位。 3、热焓量,是指热力传递的函数。通常用来计算气体(蒸汽) 可以释放热能数值,可以用千焦(KJ),千卡(Kcal)做单位。我们最常接触能的包含蒸汽的焓值。 二、各种热功率单位表示方法的意义。 1、千瓦单位时间所做的功。1千瓦=1000焦耳/秒 1000J/S 2、马力单位时间所做的功。马力=746焦耳/秒 1HP=746J/S 3、千焦能量单位。 1KJ=1KNM(千*牛顿*米) 4、千卡能量单位。 1Kcal=每kg标准状况水开靠1℃能量 5、BTU 英制能量单位 1BTU=*bf·ft(磅力·英尺) 6、除常用的KW,HP,KJ,Kcal,BTU之外,表示热功的单位 还有W,J,cal,和Mw,Mj,Mcal,也就是瓦,焦耳,卡 和兆瓦,兆卡。他们是KW的千分之一和千倍。 三、需要分析的问题。 功率是单位时间作的功,它本身不是能量,只能说明单位时间
内可以释放能量的大小。 而焦耳、千卡、BTU是能量大小值,与时间无关。功率是表示设备的强度,力量。而能量是表示消耗能源的数值。10KW的设备1小时释放的能量与5KW 2小时释放的能量相同的。功率不等于热功能量。KW与KJ,Kcal之间没有可以换算的可能。 四、换算 1、热量之间的换算, 1KJ= 1kcal= 1KJ= 1BTU= 1Kcal= 1BTU= 2、功率与热能的比例关系 常用千瓦时作单位(电度) 1千瓦时=1KWH=3600KJ 1KJ= 1KWH= 1Kcal= 1KWh= 1BTU= 五、如何计算设备的功率,能耗,热负荷,设备的功率是用千瓦表示的。热负荷可以用每小时的释放热量千卡来表示。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 知识点复习反应焓变的计算. 知识点复习反应焓变的计算. . 知识点 :反应焓变的计算【考纲定位】了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。 (高频【知识回顾】考点反应焓变的计算 1.利用反应物、生成物能量状态计算 H =H (反应产物 -H (反应物如图Ⅰ:H = ,该反应为 ; 图Ⅱ:H = ,该反应为。 图Ⅰ 图Ⅱ 【练一练】某反应的反应过程中能量变化如图所示 (图中 E 1 表示正反应的活化能, E 2 表示逆反应的活化能。 下列有关叙述正确的是 ( A .该反应为放热反应 B .催化剂能改变该反应的焓变 C .催化剂能降低该反应的活化能 D .逆反应的活化能大于正反应的活化能 2.根据化学键断裂和形成过程中的能量变化来计算 H =【练一练】 1.SF 6 是一种优良的绝缘气体,分子结构中只存在 S-F 键。 已知:1molS(s 转化为气态硫原子吸收能量280kJ, 断裂1molF-F 、 S-F 键需吸收的能量分别为 160kJ 、 330kJ 。 则 S(s+3F 2(g=SF6(g 的反应热△ H 为 A. -1780kJ/mol B. -1220 kJ/mol C.-450 kJ/mol D. +430 kJ/mol 2. 化学反应 N 2+3H 2===2NH3 的能量变化如图所示, 该反应的热化学方程式是 ( A . N 2(g+3H 2(g ===2NH3(l H =2(a -b -c kJmol -1 B . N 2(g+3H 2(g ===2NH3(g H =2(b -a kJmol -1 122(g+32H 2(g ===NH3(lH =(b +c -a 1 / 6
根据相对湿度计算含湿量的公式 op d ( 622B )) op /( 其中:o为相对湿度,百分比 P为水蒸气饱与分压力,可查水蒸气表,与温度一一对应,pa B为大气压,不同的海拔与地区不一样。一般为101325pa 温度与湿空气的水蒸气饱与分压力的拟合公式(我们一般用到的范围为(0~50°),拟合范围越小,则精度越高。 饱与水蒸气表 Linear model Poly3: f(x) = p1*x^3 + p2*x^2 + p3*x + p4 Coefficients (with 95% confidence bounds): p1 = 0、07394 (0、06667, 0、08122) p2 = -0、2556 (-0、8097, 0、2985) p3 = 62、49 (50、92, 74、06) p4 = 581、9 (518、4, 645、4) Goodness of fit: SSE: 6391 R-square: 1 Adjusted R-square: 0、9999 RMSE: 30、21
空气焓值的定义及空气焓值的计算公式: 空气的焓值就是指空气所含有的决热量,通常以干空气的单位质量为基准。焓用符号i 表示,单位就是kj/kg干空气。湿空气焓值等于1kg干空气的焓值与dkg水蒸气焓值之与。 湿空气焓值计算公式化: i=1、01t+(2500+1、84t)d 或i=(1、01+1、84d)t+2500d (kj/kg干空气) 式中: t—空气温度℃ d —空气的含湿量g/kg干空气 1、01 —干空气的平均定压比热kj/(kg、K) 1、84 —水蒸气的平均定压比热kj/(kg、K) 2500 —0℃时水的汽化潜热kj/kg 由上式可以瞧出:(1、01+1、84d)t就是随温度变化的热量,即“显热”;而2500d 则就是0℃时dkg水的汽化潜热,它仅随含湿量而变化,与温度无关,即就是“潜热”。 上式经常用来计算冷干机的热负荷。 MATLAB程序 T=30 O=0、6 B=101325 P=0、07394*T^3-0、02*T^2+62、49*T+581、9 d=622*(O*P/(B-O*P)) i=1、01*T+(1、84*T+2500)*d/1000 计算结果 T = 30 O =0、6000 B = 101325 P = 4、4350e+003 d =16、7755 i = 73、1647 空气焓值计算器的计算结果