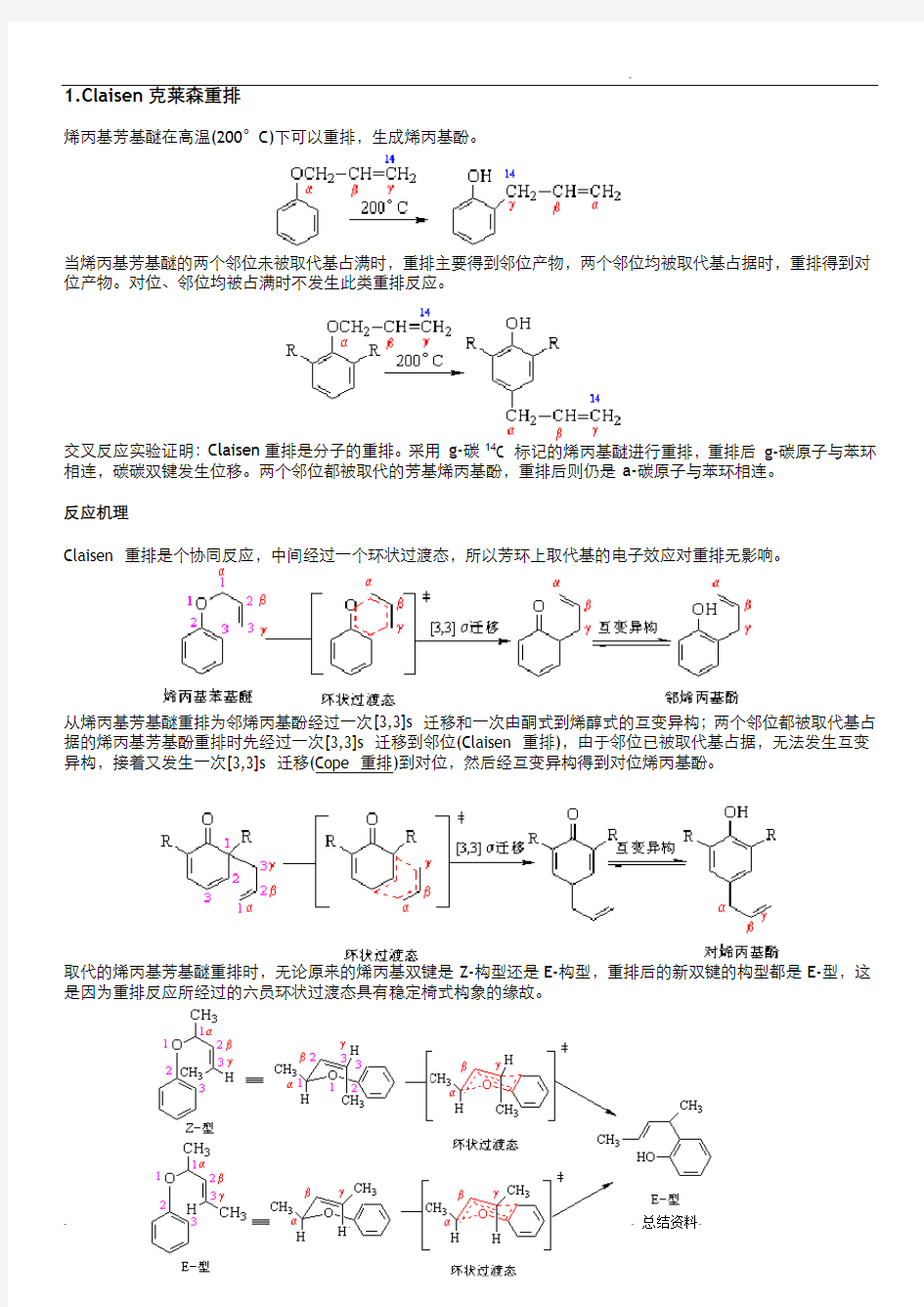

1.Claisen克莱森重排
烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子的重排。采用g-碳14C 标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理
Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己酰胺:
反应机理
在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
反应实例
3.Fries弗里斯重排
酚酯在Lewis酸存在下加热,可发生酰基重排反应,生成邻羟基和对羟基芳酮的混合物。重排可以在硝基苯、硝基甲烷等溶剂中进行,也可以不用溶剂直接加热进行。
邻、对位产物的比例取决于酚酯的结构、反应条件和催化剂等。例如,用多聚磷酸催化时主要生成对位重排产物,而用四氯化钛催化时则主要生成邻位重排产物。反应温度对邻、对位产物比例的影响比较大,一般来讲,较低温度(如室温)下重排有利于形成对位异构产物(动力学控制),较高温度下重排有利于形成邻位异构产物(热力学控制)。
反应机理
反应实例
4.Hofmann 霍夫曼重排(降解)
酰胺用溴(或氯)在碱性条件下处理转变为少一个碳原子的伯胺:
反应机理
反应实例
5.Pinacol频呐醇重排
连二醇类化合物在酸催化下,失去一分子水重排生成醛或酮的反应,称为Pinacol重排反应。
机理:
基团迁移能力:
(2)不对称的连二乙醇
重排的方向决定于羟基失去的难易
羟基离去后碳正离子的稳定性:叔碳>仲碳>伯碳
基础有机化学反应总结 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH -
【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】 2 C H 33H 32 3H 32 CH CH 2C H 3 2 CH CH=CH (CH 3CH 2CH 2)3 - H 3CH 2CH 2C 22CH 3 CH 2O CH 2CH 2CH 3 3CH 2CH 2C 2CH 2CH 3 + O H - O H B - OCH 2CH 2CH 3CH 2CH 2CH 3 H 3CH 2CH 2B OCH 2CH 2CH 3 CH 2CH 2CH 32CH 2CH 3 HOO -B(OCH 2CH 2CH 3)3 B(OCH 2CH 2CH 3)3 + 3NaOH3NaOH 3HOCH 2CH 2CH 33 + Na 3BO 3 2 【例】 CH 3 1)BH 32)H 2O 2/OH -CH 3 H H OH 3、X 2加成 C C Br /CCl C C Br Br 【机理】
1.Arbuzov 反应 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 一般认为是按 S N2 进行的分子内重排反应: 2.Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 3.Baeyer----Villiger 反应
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 4.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
1.A rndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例
2.Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。 3.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 反应实例
有机化学重排反应总结 1、Claisen克莱森重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚得两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 交叉反应实验证明:Claisen重排就是分子内得重排。采用 g—碳 14C 标记得烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代得芳基烯丙基酚,重排后则仍就是a—碳原子与苯环相连。反应机理 Claisen 重排就是个协同反应,中间经过一个环状过渡态,所以芳环上取代基得电子效应对重排无影响. 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移与一次由酮式到烯醇式得互变异构;两个邻位都被取代基占据得烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。 取代得烯丙基芳基醚重排时,无论原来得烯丙基双键就是Z—构型还就是E-构型,重排后得新双键得构型都就是E -型,这就是因为重排反应所经过得六员环状过渡态具有稳定椅式构象得缘故. 反应实例 Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连得结构,就有可能发生Claisen重排。 2、Beckmann贝克曼重排 肟在酸如硫酸、多聚磷酸以及能产生强酸得五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应得取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位得基团迁移到缺电子得氮原子上,所形成得碳正离子与水反应得到酰胺. 迁移基团如果就是手性碳原子,则在迁移前后其构型不变,例如:
Claisen 重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 交叉反应实验证明:Claisen重排是分子内的重排。采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。 反应机理 Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变 异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen
重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。 Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 反应实例
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
常见的有机反应机理 Arbuzov 反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如: 反应机理 一般认为是按 S N2 进行的分子内重排反应: 反应实例
Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例 Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:
不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在 10~40℃之间,产率高。 Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
有机化学反应机理 弯箭头代表一对电子的转移,弯钩意味着一个电子的转移,后者适用于自由基反应
1 有机反应机理入门 1.1 画路易斯结构式 先画出分子的骨架,环和pi键应准确无误,然后用氢原子完成其余的化学键。对于有机分子,骨架有时以简化形式给出。 画出孤对电子,使每个原子核外满足充满电子的结构:氢2个;硼、铝和镓6个;其它原子8个。最后结构式中的每个原子总的成键电子数可以通过数其核外的成键电子获得(包括共享电子)。 提示:画路易斯结构式可参考以下结构特征: (1) 氢原子永远在构的外围,因为它只能成一个共价键; (2) 碳、氮和氧有特定的键合模式。 在以下的示例中R代表氢、烷基、芳基或它们的组合,这种变化并不影响成键模 式。 ①中性的碳原子为4键。这4个键可以都是sigma键,也可以是sigma键与pi
键的组合(如双键和三键)。 ②带有单个正电荷或负电荷的碳有3个键。 ③中性的氮原子(氮烯除外)有3个键和一对未成对电子。 键,带有一个正电荷。4正电荷的氮成④. ⑤负电荷的氮成2键,带有一个负电荷和2对未成键电子。 ⑥中性的氧原子成2键,带有2对孤对电子。 ⑦带正电荷的氧成3键,带有1对孤对电子。 (3) 有时磷原子和硫原子可有10个成键电子,这是因为磷和硫具有d轨道,可以扩展而容纳10个电子。 Lewis结构式是价键理论的重要内容,也是学习反应机理的基础。 1.2 电负性 多数有机反应依赖于带有正电荷(或部分正电荷)的分子与带有负电荷(或部分负电荷)的分子的相互作用而发生。在中性有机分子中,部分电荷的产生依赖于电负性的差异。 电负性的数值最初由Linus Pauling在1960年确定。其数值越大,表明其吸电子能力越强,所以氟是吸电子能力最强的元素,见表: 成键后,电负性大的元素的原子拥有部分负电荷,而且,双键结构的部分电荷比单键结构的部分电荷密度更大,这是因为双键上的pi电子受原子核的束缚小,更易于流动。
有机化学重排反应总结 1.Claisen克莱森重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 交叉反应实验证明:Claisen重排是分子内的重排。采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。 反应机理 Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例 Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。 2.Beckmann贝克曼重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
1.Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 2.Baeyer----Villiger 反应 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应
具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 例 还原 芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
十、反应和反应机理 有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布,原有的键断裂,新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产生。这种变化过程称为有机反应(organic reaction)。 一级反应:在动力学上,将反应速率只取决于一种化合物浓度的反应称为一级反应。 二级反应:在动力学上,将反应速率取决于两种化合物浓度的反应称为二级反应。 按化学键的断裂和生成分类 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。亲电试剂是对电子有显著亲合力而起反应的试剂。 按反应物和产物的结构关系分类 加成反应:两个或多个分子相互作用,生成一个加成产物的反应称为加成反应。 取代反应:有机化合物分子中的某个原子或基团被其它原子或基团所置换的反应称为取代反应。 重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子的配置方式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反应。 消除反应:在一个有机分子中消去两个原子或基团的反应称为消除反应。可以根据两个消去基团的相对位置将其分类。若两个消去基团连在同一个碳原子上,称为1,1-消除或α-消除;两个消去基团连在两个相邻的碳原子上,则称为1,2-消除或β-消除;两个消去基团连在1,3位碳原子上,则称为1,3-消除或γ-消除。其余类推。 氧化还原反应:有机化学中的氧化和还原是指有机化合物分子中碳原子和其它原子的氧化和还原,可根据氧化数的变化来确定。氧化数升高为氧化,氧化数降低为还原。氧化和还原总是同时发生的,由于有机反应的属性是根据底物的变化来确定的,因此常常将有机分子中碳原子氧化数升高的反应为氧化反应,碳原子氧化数降低的反应为还原反应。有机反应中,多数氧化反应表现为分子中氧的增加或氢的减少,多数还原反应表现为分子中氧的减少或氢的增加。
一、Arbuzow反应(重排) 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzow反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:
反应机理 一般认为是按 S N2 进行的分子内重排反应: 反应实例 二、Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例 三、Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应
具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例
1.Claisen克莱森重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 交叉反应实验证明:Claisen重排是分子内的重排。采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。 反应机理 Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。 2.Beckmann贝克曼重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 1.Baeyer----Villiger 反应 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 例 还原 芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。 首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。(Ⅰ)不稳定而被质子化,随即从乙醇中夺取一个质子生成环己二烯自由基(Ⅱ)。(Ⅱ)在取得一个溶剂化电子转变成环己二烯负离子(Ⅲ),(Ⅲ)是一个强碱,迅速再从乙醇中夺取一个电子生成1,4-环己二烯。 环己二烯负离子(Ⅲ)在共轭链的中间碳原子上质子化比末端碳原子上质子快,原因尚不清楚。
3.Baeyer----Villiger 反应拜耳-维立格氧化重排反应 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 4.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。 7.Cannizzaro 反应 凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇: 脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。 醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。 9.Claisen 酯缩合反应
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。 乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的 pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。 10.Claisen 重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。
有机化学重排反应总结1.Claisen克莱森重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 C 标记的烯丙基醚进行重排,重排后 g-交叉反应实验证明:Claisen重排是分子 14碳原子与碳 内的重排。采用 g- 苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。反应机理 Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s ,由于邻位已被取代基占据,无法发生)占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排重排)到对位,然后经互变异构得到对位烯丙基酚。(Cope 互变异构,接着又发生一次[3,3]s 迁移
型,这E-E-Z-取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是构型还是构型,重排后的新双键的构型都是是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例 重排。重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen Claisen 贝克曼重排2.Beckmann肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排 生成己内酰胺:
有机化学中重排反应 有机化学中重排反应很早就被人们发现,研究并加以利用。第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。 按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。 一、亲核重排 重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。 (一)亲核1,2重排的一般规律 1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻 2.发生亲核1,2重排的条件 (1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子) (2)转变成稳定的中性化合物 (3)减小基团间的拥挤程度,减小环的张力等立体因素。 (4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面 (5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关 3.迁移基团的迁移能力 (1)多由试验方法来确定基团的固有迁移能力 (2)与迁移后正离子的稳定性有关 (3)邻位协助作用 (4)立体因素
4.亲核1,2重排的立体化学: (1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋 (2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机 5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程 (二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍: 1.基团向碳正离子迁移: (1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯 (2)片那醇重排:邻二醇在酸催化下会重排成醛和酮 (3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应 (4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物 (6)烯丙基重排:烯丙基系统中双键发生位移的反应 2.基团向羰基碳原子迁移: (1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐 (2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮 3.基团向碳烯碳原子迁移: (1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法 (2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯 4.基团向缺电子氮原子转移: (1)Beckmann重排:醛肟或酮肟重排成酰胺 (2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺 (3)Curtius重排:酰基叠氮热分解生成异氰酸酯 (4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应 (5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺 (6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮 5.基团向缺电氧原子的迁移: (1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上 (2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应 6.芳香族亲核重排: (1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚 (2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺 二、自由基重排反应 1.1,2迁移:比正离子重排反应少得多,主要发生在: (1)某些双自由基的1,2-烷基和氢
1.Arndt-Eister反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸. 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 2.Baeyer—---Villiger反应 过酸先与羰基进行亲核加成,然后酮羰基上得一个烃基带着一对电子迁移到-O—O—基团中与羰基碳原子直接相连得氧原子上,同时发生O-O键异裂。因此,这就是一个重排反应 具有光学活性得3---苯基丁酮与过酸反应,重排产物手性碳原子得枸型保持不变,说明 反应属于分子内重排:
不对称得酮氧化时,在重排步骤中,两个基团均可迁移,但就是还就是有一定得选择性,按迁移能力其顺序为: 醛氧化得机理与此相似,但迁移得就是氢负离子,得到羧酸。 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰 基旁边插入一个氧原子生成相应得酯,其中三氟过氧乙酸就是最好得氧化剂。这类氧化剂得特点 就是反应速率快,反应温度一般在10~40℃之间,产率高。
3、Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸得五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应得取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位得基团迁移到缺电子得氮原子上,所形成得碳正离子与水反应得到酰胺. 迁移基团如果就是手性碳原子,则在迁移前后其构型不变,例如:
例 4、Birch还原 芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)得混合液中还原,苯环可被还原成非共轭得1,4—环己二烯化合物. 首先就是钠与液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这就是苯环得л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道得反键轨道上,自由基负离子仍就是个环状共轭体系,(Ⅰ)表示得就是部分共振式.(Ⅰ)不稳定而被质子化,随即从乙醇中夺取一个质子生成环己二烯自由基(Ⅱ)。(Ⅱ)在取得一个溶剂化电子转变成环己二烯负离子(Ⅲ),(Ⅲ)就是一个强碱,迅速再从乙醇中夺取一个电子生成1,4—环己二烯。
有机化学重排反应总结 1、Claisen克莱森重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 交叉反应实验证明:Claisen重排就是分子内的重排。采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍就是a-碳原子与苯环相连。 反应机理 Claisen 重排就是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。 从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移与一次由酮式到烯醇式的互变异构;两个邻位都被取代基 占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键就是Z-构型还就是E-构型,重排后的新双键的构型都就是E-型,这就是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。 反应实例 Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。 2、Beckmann贝克曼重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成 的碳正离子与水反应得到酰胺。 迁移基团如果就是手性碳原子,则在迁移前后其构型不变,例如:
有机重排反应总结
Claisen 重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 交叉反应实验证明:Claisen重排是分子内的重排。采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。 反应机理 Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。 取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后 的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。 Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 反应实例
有机反应机理 一、游离基反应机理 1. 完成下列反应式: (1)H 3C H + CCl 2 (2)H 3C H +HBr ROOR (3)+NBS ROOR CCl 4 (4)+NBS ROOR CCl 4 H 3C (5)NaNO 2/HCl Cu 2Cl 2 Br Br NH 2Br 低温 2.含有六个碳原子的烷烃A ,发生游离基氯化反应时,只生成两种一元氯化产物,请推出A 的结构式,并说明理由。 3. 以苯为起始原料合成下列化合物: Cl Br 4. 烷烃的游离基卤化反应中,通常是卤素在光照或加热的情况下,首先引发卤素游离基。四乙基铅被加热到150O C 时引发氯产生氯游离基,试写出烷烃(RH )在此情况下的反应机理。 5.叔丁基过氧化物可以作为游离基反应的引发剂,当在叔丁基过氧化物存在下,将2-甲基丙烷和四氯化碳混合,加热至130~140O C ,得到2-甲基-2-氯丙烷和三氯甲烷,试为上述试验事实提出合理的反应机理。 6. 分别写出HBr 和HCl 与丙烯进行游离基加成反应的两个主要步骤(从Br ·和Cl ·开始)。根据有关键能数据,计算上述两个反应各步的△H 值。解释为什么HBr 有过氧化物效应,而HCl 却没有。 二、亲电反应机理 1.比较并解释烯烃与HCl ,HBr ,HI 加成时反应活性的相对大小。 2.解释下列反应:
H C H 3C C H CH 3 Br 2 H CH 3Br Br H CH 3+ Br H CH 3H CH 3 Br 3 写出异丁烯二聚反应的机理,为什么常用H 2SO 4或HF 作催化剂,而不用HCl ,HBr ,HI ? 4. 苯乙烯在甲醇溶液中溴化,得到1-苯基-1,2-二溴乙烷及1-苯基-1-甲氧基-2-溴乙烷,用反应机理解释。 5.解释: CH 2CH 2CHCH 2CCH 3 CH 3 24 H 3C CH 3 H CH 2CH 2 85% 6.解释下列反应机理: CH 2CHCH 2CH CHCH 3H 2SO 4 CH 2 CH 3 87% + CH 2CH 313% 7.写出HI 也下列化合物反应的主要产物: (1)(2)CH 3CH CHCH 2Cl (CH 3)3NCH CH 2 (3)(4)CH 3OCH CH 2 CF 3CH CHCl (5)(CH 3CH 2) 3CCH CH 2 8.完成下列反应式: (1) CH 2CH 3 B 2H 6 CH 3COOD (2) B 2H 6 H 2O 2,OH - (3) 4(浓)110 C °