
第五章 化学平衡
§5.1 化学反应的平衡条件
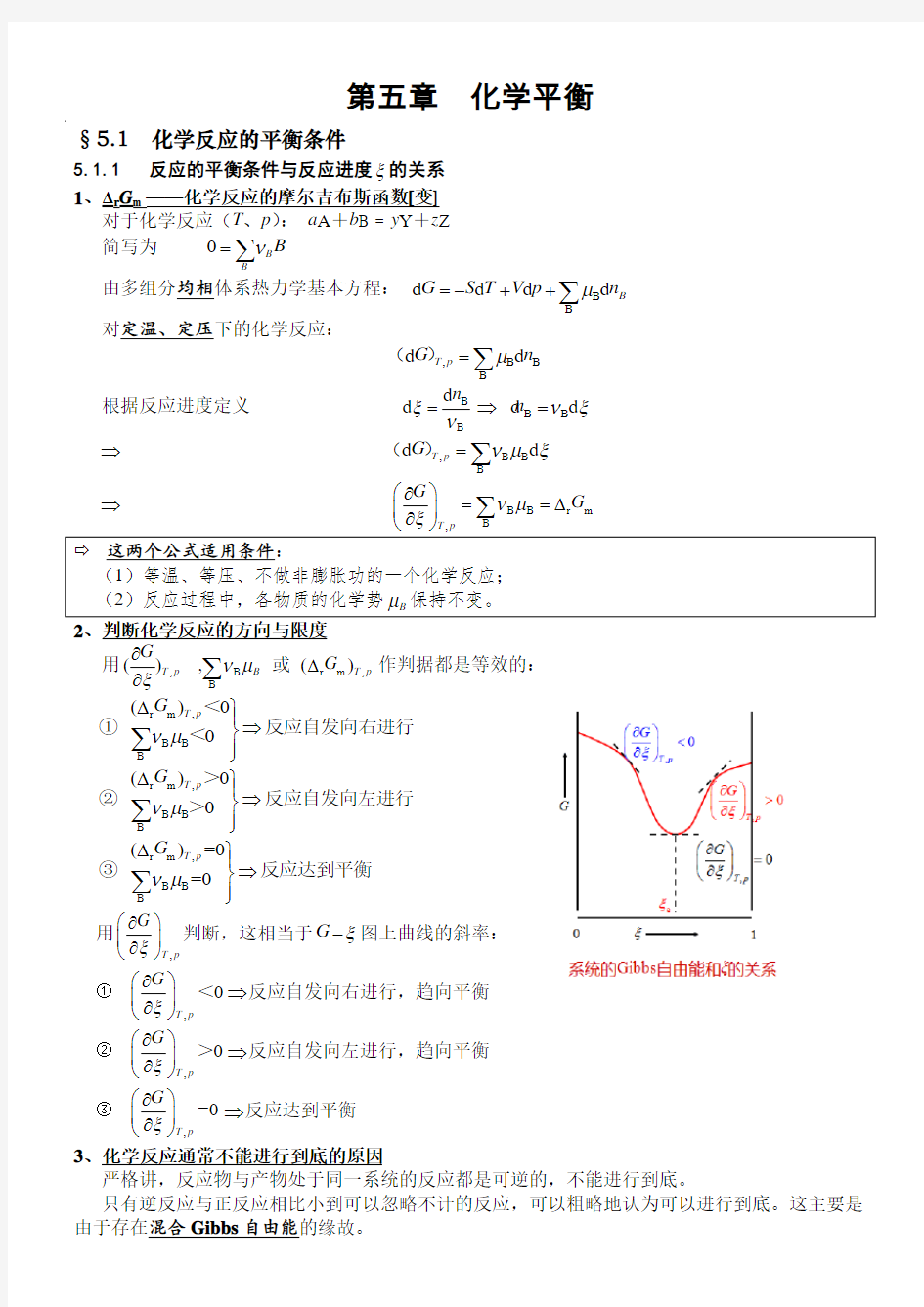
5.1.1 反应的平衡条件与反应进度ξ的关系 1Δr G m ——化学反应的摩尔吉布斯函数[变]
简写为 0B B
B ν=∑
由多组分均相体系热力学基本方程: B B
d d d d B G S T V p n μ=-++∑
对定温、定压下的化学反应:
,B B B
d d T p G n μ=∑()
根据反应进度定义 B
B
d d n ξν=
?B B d d n νξ=
? ,B B B
d d T p G νμξ=∑() ? B B r m B ,T p G G νμξ??
?==? ????∑
这两个公式适用条件:
(1)等温、等压、不做非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势B μ保持不变。 、判断化学反应的方向与限度
用,B r m ,B
() , ()T p B T p G
G νμξ???∑ 或 作判据都是等效的:
r m ,B B
B ()0 0T p G νμ??
?
????
∑<①反应自发向右进行<
r m ,B B
B ()0 0T p G νμ??
?
????
∑>②反应自发向左进行>
r m ,B B
B ()=0 =0T p G νμ??
?
????
∑③反应达到平衡
用,T p
G ξ??? ????判断,这相当于G ξ-图上曲线的斜率: ① ,0T p
G ξ??? ????<?反应自发向右进行,趋向平衡
② ,0T p G ξ??
?
????>?反应自发向左进行,趋向平衡 ③ ,=0T p
G ξ??
?
???
??反应达到平衡 3、化学反应通常不能进行到底的原因
严格讲,反应物与产物处于同一系统的反应都是可逆的,不能进行到底。
只有逆反应与正反应相比小到可以忽略不计的反应,可以粗略地认为可以进行到底。这主要是由于存在混合Gibbs 自由能的缘故。
以反应D E 2F +为例,在反应过程中Gibbs 自由能随反应过程的变化如图所示。
R 点,D 和E 未混合时Gibbs 自由能之和; P 点,D 和E 混合后Gibbs 自由能之和;
T 点,反应达平衡时,所有物质的Gibbs 自由能之
总和,包括混合Gibbs 自由能; S 点,纯产物F 的Gibbs 自由能。
若要使反应进行到底,需在van’t Hoff 平衡箱中进行,
防止反应物之间或反应物与产物之间的任何形式的混合, 才可以使反应从R 点直接到达S 点。
5.1.2 化学反应的亲和势 1、化学反应亲和势A
def
,r m
B B B
(
)==T p G
A G νμξ?--?=-?∑ 对于给定的化学反应系统,亲和势有定值,它决定于系统的始终态而与反应的过程无关,与系统的大小数量无关。客观上它仅与体系中各物质的强度性质μ
B 有关。 2、判断化学反应的方向与限度
对于一个给定反应:A ——化学反应进行的推动力 ①A >0,反应自左至右自发进行(正向进行); ②A <0,反应逆向进行; ③A=0,反应达到平衡。
§5.2 化学反应的平衡常数与等温方程式
5.2.1 化学反应等温方程式——理想气体的反应(均相系统) 1、化学反应等温方程式 讨论对反应物和生成物都为理想气体的化学反应: B r m ,B B B B B B
B
B
()()ln
T p p G T RT p
νμνμν?==+∑∑∑令 r m
B B
B
()()
G T T νμ
?=∑ 式中——r m G ?:化学反应标准摩尔吉布斯函数[变]
B
B B
r m r m B B
B r m B B
B r m B B r m ()ln ()ln ()ln ()ln ln p
G G T RT p p
G T RT p p G T RT p p G T RT p νννν?=?+=?+??
=?+ ?
?
???
??=?+∏??
???????
∑∑∑
B B B (,)()ln p T p T RT p
μμ=+
令压力商
ln p Q p
?=∏ ???
则
r m ()G G T ?2、理想气体反应的标准平衡常数
对于一般化学反应 0B B
B ν=∑
()B B B r m ()def
()exp exp T G T K T RT RT νμ??
-??-???=??????????
∑ 式中——K (T ):化学反应的标准平衡常数
它仅是温度的函数。在数值上等于平衡时的“压力商”,是量纲一的量,单位为1。它与标准化学势有关。 则
r m B B ()()G T T νμ?=∑
上式对任何化学反应系统都适用
3、用化学反应等温式判断反应方向
对理想气体化学反应等温式也可表示为:
ln ln G RT K RT Q ?=-+
p p Q >p p Q <=p p Q 5.2.2 液相中反应的平衡常数
1、若反应物与生成物能形成液体混合物,各组分可以同等对待,而不必有溶剂溶质之分:
在理想液态混合物中任一组分化学势为:*
B B B B (,,)(,)ln T p x T p RT x μμ=+
对于非理想液态混合物,利用活度概念:*B B B B (,,)(,)ln T p x T p RT a μμ=+ B B B B B B B B (,,)(,)ln d (,)ln d p p
T p
p
T p x T p RT a p
p T p RT a V p
μμμμ???=++ ????=++??
B
B B B B B B B B B B B
B
(,,)()ln d p p
T p x T RT a V p ννμνμν=++∑∑∑∏?
当系统达平衡时 0B B
B ν=∑
B
B
B B B
B
B
B
()ln d p p
T RT a V p νν
μ=--?∑∑∏?
忽略压力对液态系统的影响,得
B
r m B B B B
B
()()ln ln a G T T RT a RT K ννμ?==-=-∑∏
2、若形成溶液的组分中有一种(或多种)的量很少,可把它当成溶质,在稀溶液中溶质服从Herry 定律:
*
B B B B (,,)(,)ln T p x T p RT x μμ=+ 若对Henry 定律发生偏差,得
*
B B B ,B (,,)(,)ln x T p x T p RT a μμ=+ ***B B B B (,)(,)d (,)p
p T p T p V p T p μμμ=+≈?
B B ,B ,B (,,)()ln x x T p x T RT a μμ=+
如果溶质浓度用质量摩尔浓度表示,得:
B B B B (,,)(,)ln m T p m T p RT m
μμ=+□
B B B ,B ,B ,B (,,)(,)ln ()ln m m m T p m T p RT a T RT a μμμ=+≈+□
如果溶质浓度用物质的量浓度表示,得:
B B B B (,,)(,)ln c T p c T p RT c
μμ=+
△
B B B ,B ,B ,B (,,)(,)ln ()ln c c c T p c T p RT a T RT a μμμ=+≈+△
显然,B B B B B B (,,)(,,)(,,)T p x T p m T p c μμμ== 但是 ,B ,B ,B ()()()x m c T T T μμμ≠≠ 因为对数项中的数值也都不相等。
5.2.3 理想气体的化学平衡常数表达式 1、用压力表示的经验平衡常数K p
B
B
p K p ν=∏
、用摩尔分数表示的经验平衡常数K x
对于理想气体混合物 B B p px =
B
B
G H G H
e e D E
D E
g h
g h x p d e
d e p p p p x x K K p
x x
p
p p p ν-
???? ? ?∑????===???? ? ?
、用物质的量表示的经验平衡常数K c
H G D E
h g c d e c c
K c c
= 对于理想气体 p c R T =
()()()()B
B G H G H
e e D E
()g h
g h
p c d e
d e c RT c RT p p K
K RT p p c RT c RT ν∑===
、液相与固相反应的经验平衡常数
对于液相和固相反应的经验平衡常数,由于标准态不同,故有不同的表示形式
B
B a K a ν=∏
B
B B
c K c ν=∏ B B B
m K m ν=∏ B B B
x K x ν=∏
除x K 外,经验平衡常数的单位不一定是1。 5、平衡常数与化学方程式的关系
r m ()ln G T RT K ?=-
下标 m 表示反应进度为 1 mol 时的标准Gibbs 自由能的变化值。显然,化学反应方程中计量系数呈倍数关系,r m ()G T ?的值也呈倍数关系,而K 值则呈指数的关系。
§5.3 标准摩尔生成Gibbs 自由能
5.3.1 标准状态下反应的Gibbs 自由能变化值r m G ? 1、计算热力学平衡常数
r m ln a G RT K ?=-
r m
exp a G
K RT
???=- ???
2、计算实验不易测定的r m G ?和平衡常数
例如,求21C(s)O (g)CO(g)2
+→的平衡常数
22r m (1) C(s)O (g)CO (g)(1)G +→?
122r m 2(2) CO(g)O (g)CO (g) (2)G +→? (1) -(2) 得(3)
12r m 2(3) C(s)O (g)CO(g)
(3)G +→?
? r m r m
r
m
(3)(1)(2)
G G
G ?=?-? (1)(3)(2)
p p p K K K =
3、近似估计反应的可能性
r m r m ln p G G RT Q ?=?+
只能用f r m ,,0()T p W G =?判断反应的方向,r m G ?只能反映反应的限度
当G ?的绝对值很大时,基本上决定了G ?的值,所以可以用来近似地估计反应的可能性。
1r m (1) 41.84 kJ mol G -?>?,反应基本不能进行;
1r m (2) (41.840 )kJ mol G -?=?,改变反应外界条件,使反应能进行;
r m (3) 0G ?= 1p K =,存在反应进行的可能性;
r m (4) 0G ?< 1p K >,反应有可能进行,平衡位置对产物有利。 r m G ?的几种计算方法
(1)热化学的方法 r m r m r m
G H T S ?=?-? 利用热力学数据表或测定反应热效应,先计算反应的焓变和熵变;
(2)用易于测定的平衡常数,计算r m G ?,再利用Hess 定律计算所需的r m G ?
(3)测定可逆电池的标准电动势 r m G zE F ?=- (4)从标准摩尔生成Gibbs 自由能计算
(5)用统计热力学的热函函数和自由能函数计算
5.3.2 标准摩尔生成Gibbs 自由能 1、标准摩尔生成Gibbs 自由能
因为Gibbs 自由能的绝对值不知道,所以只能用相对标准,即将标准压力下稳定单质的生成
Gibbs 自由能看作零,则:
在标准压力下,由稳定单质生成单位物质的量化合物时Gibbs 自由能的变化值,称为该化合物的标准摩尔生成Gibbs 自由能,用下述符号表示:
f m G ?(化合物,物态,温度)
没有规定温度,通常在298.15 K 时的表值容易查阅。 2、离子的标准摩尔生成Gibbs 自由能
有离子参加的反应,主要是电解质溶液。溶质的浓度主要用质量摩尔浓度表示,这时规定的相对标准态是
1f m H
(H ,aq, 1.0 mol kg )0G m ++-?=?=
由此而得到其他离子的标准摩尔生成Gibbs 自由能的数值,列表备查。 3、f m G ?数值的用处
f m G ?的值在定义时没有规定温度,通常在298.15 K 时的数值有表可查,利用这些表值,我们可以:
(1)计算任意反应在298.15 K 时的
r m G ?
r m B f m B
(B)G G ν?=?∑
(2)判断反应的可能性
在有机合成中,可能有若干条路线,用计算r m G ?的方法,看那条路线的值最小,则可能性最大。
若r m G ?的值是一个很大的正数,则该反应基本上不能进行。 (3)用r m G ?值求出热力学平衡常数p K 值
根据p K 与温度的关系,可以决定用升温还是降温的办法使反应顺利进行。
5.3.3 Ellingham 图(?r G m - T 图)
冶金工业常用C 或CO 作金属矿物还原剂。 C 或CO 作还原剂的反应△r G θm 受T 影响; ?r G m ? =?r H m ?-T ?r S m ???r G m ? - T 成直线关系 斜率k =-?r S m ? , 截距?r H m ? 考虑C 或CO 作还原剂以下3个反应: (1)C (石墨)+O 2 (g) =CO 2 (g) △H ? = -393.5 kJ·mol -1 △S ? = 0.003 kJ·mol -1·K -1 斜率:-△S ?≈0(很小) (2)2C (石墨)+O 2(g) =2CO(g) △H θ = -221.0 kJ·mol -1 △S ? = 0.179 kJ·mol -1·K -1 斜率:-△S ?<0 (3)2CO(g) + O 2(g )=2CO 2(g) △H ? = -566 kJ·mol -1 △S ? = -0.173 kJ·mol -1,K -1 斜率:-△S ?>0
C 和CO 的Ellingham 图
定义:某物质与1 mol O 2(g)反应的?r G m 对温度T 作图,称为该物质氧化物的Ellingham 图。同
理,可得氯化物,硫化物…的Ellingham 图。 ? C 和CO 的Ellingham 图可了解的信息:
①由图可见:T ↑,C → CO ?r G m ↓
C → CO 2 ?r G m 基本不变 CO → CO 2 ?r G m ↑
∴高温下,C 作还原剂的主要产物是CO ,不是CO 2
②金属氧化物的Ellingham 图,其斜率- △S ?>0 (总是正的)
2M(s) + O 2(g)=2MO(s) ?S ?<0 “拐点”表示?S 改变,即发生了“相变”。
③位于下方的生成物,反应?G ?↓,热力学稳定性↑。
一些常见物质的Ellingham 图
Ellingham 图应用:
①判断氧化—还原反应方向:
例:①2C(石墨) + O 2(g)=2CO(g) △G θ1 ②Cr(s) + O 2(g)=Cr 2O 3(s) △G θ2
①-②, 得:③2C(石墨) +Cr 2O 3(s)=Cr(s) + 2CO(g) △G θ3 △G θ3 = △G θ1- △G θ2
当T >T 1 (~1500 K) 时,△G θ3<0,反应③→自发
结论 :
①在某温度范围内,位于Ellingham 图下方线的还原剂可以自发地把上方线的氧化物还原为单质。
②高温下,C → CO ,还原性更强。
②C 、H 2(g)、Si 、Al 、Mg 、Ca 等是常用的还原剂。
其中C 是“万能还原剂”因为:2C(石墨) + O 2(g)→ 2CO(g) 斜率为负! ③判断化合物热力学稳定性:
位于下方的生成物,反应?r G m ?0→, 热力学稳定性→∞。同理,可用氯化物,硫化物…的Ellingham 图。
§5.4 温度、压力及惰性气体对化学平衡的影响
5.4.1 温度对化学平衡的影响 1、范特霍夫方程
根据Gibbs-Helmholtz 等压方程 2
d d r m
r m G H T
T
T ??? ?
??
?=-,当反应物都处于标准状态时,有
将r m ()ln G T RT K ?=-代入上式,可得:
p
RT
?=——这是van’t Hoff 公式的微分式
由该式可知:
r m H ?> 0时:吸热反应,T ↑,K ↑,升温对正反应有利; r m H ?< 0时:放热反应,T ↑,K ↓,升温对正反应不利; 2、r m H ?不随温度变化时K 的计算
若温度区间不大,r m H ?可视为与温度无关的常数,得定积分式为:
2m 11()1(()
p p T T T - 这公式常用来从已知一个温度下的平衡常数求出另一温度下的平衡常数。
作不定积分,得 m
'I -?=
+将ln K 对1
T
作图,可得一直线,斜率?r m H ?
3、r m H ?随温度变化时K 的计算
若温度区间较大,则必须考虑r m H
?与温度的关系。
23r m 0011
()d 23
p H T H C T H aT bT cT ?=?+?=?+?+?+
?+?
代入van’t Hoff 微分式,得RT ?=移项积分,得:201ln ln 26a
K T T T I R T R R R ???=+++++
?
??
0H ?,I 为积分常数,可从已知条件或表值求得。
将平衡常数与Gibbs m G H =?这样可计算任何温度时的r m G K ?、。 对于低压下的气体 p K K =
又因为 B
B
p c c RT K K p ν∑??= ?
?? 所以
B
B
d l n d l n
c K K
T ν=+∑
可得
c
RT ?=
5.4.2 压力对化学平衡的影响
温度:改变标准平衡常数K 而影响平衡。 其它因素: 压力、惰性气体等: 不能改变K
但对于气体化学计量数代数和∑νB ≠ 0的反应,能改变 其平衡转化率。
根据Le chatelier
原理,增加压力,反应向体积减小的方向进行。这里可以用压力对平衡常数的影响从本质上对原理加以说明。
对于理想气体,B B , f p p c RT K K ==
r m B
B B
()ln p G T RT K νμ?==-∑
ln p T
K p ??
?= ? ???
? B
B ()p c c RT K K p
ν∑
=
对理想气体 B B m B B
/, x p p p V R T ν=?=
∑ B B B (
)p p K p ν=∏ B
B
B B
B B ()x p K x p
νν=∏=∏ B
B
()p x p K K p ν∑=
B
B
ln ln (
)()0p
x T T K K p
p p
ν
??=+=??∑
B
B
m
ln ()x
T K V p
p
RT
ν
??=-=-
?∑ ? 结论:加压对气体物质的量减小(∑νB (g)< 0)的反应有利,
减压对气体物质的量增加(∑νB (g)> 0)的反应有利。
5.4.3 惰性气体对化学平衡的影响
惰性气体不影响平衡常数值,当B B
ν∑不等于零时,加入惰性气体会影响平衡组成。
B
B
B
B G H
G H
D E
D E
B B B
B
()g h g h d e d e p x x x n n p p x x p n n p n p
K K p
ννν∑??∑?? ?== ? ???
???
∑=∑ 惰性气体的影响取决于B B
ν∑的值。
∑νB (g) >0时,加入惰性气体, ∑n B ↑, K n ↑ ,平衡向右移动;
∑νB (g) < 0时,加入惰性气体, ∑n B ↑, K n ↓,平衡向左移动。
? 结论:加入惰性气体,相当于系统总压降低,对气体物质的量增加(∑νB (g)> 0)的反应有利。
§5.5 同时化学平衡
在一个反应系统中,如果同时发生几个反应,当到达平衡态时,这种情况称为同时平衡。 在处理同时平衡的问题时,要考虑每个物质的数量在各个反应中的变化,并在各个平衡方程式中同一物质的数量应保持一致。
§5.6 近似计算
()r m B f m B B
G G ν?=?∑ r m r m r m 298.15 K G H S ?=?-??
r m 2d ln d H K
T RT ?=
利用以上公式虽然可以通过热力学数据表作一些计算,但是要获得完备的在各个温度下的热力学数据还是困难的,所以有时只能作一些估算。
()=p K f T
()=c K f T
5.6.1 ()r m G T ?的估算
根据Gibbs 自由能的定义式,在等温时有
r m r m r m ()()()G T H T T S T ?=?-?
已知
r m r m 298K
()(298K)d T
p H T H C T ?=?+??
r m r m 298K
()(298K)d T
p
C S T S T T ??=?+?
代入上面的计算式,得
r m r m r m 298K
298K
()(298K)(298K)d d T T
p
p C G T H T S C T T T T
??=?-?+?-?
?
r m r m (298K)(298K)H S ??、的数据有表可查,
若有完整的,m p C T 数据,就可以计算任意温
度下的()r m G T ?。
若数据不全可以用如下两种方法,作近似计算。
(1)设p C α?=常数
r m r m r m 298K ()(298K)(298K)ln 1298K T G T H T S T T α?
??=?-?--+ ???
若令:0298K
ln 1T M =-+ m r m r m ()(298K)(298K)G T H T S TM α=?-?-不同温度下的0M 数值事先制表备用。 (2)设0p C ?=
r m r m r m ()(298K)(298K)G T H T S a bT ?=?-?=-
这里实际上设焓和熵变化值与温度无关,从298.15 K 的表值可求出任意温度T 时的r m
G ?值。这是一个十分粗略的估算公式。
5.6.2 估计反应的有利温度
r m r m r m ()()()G T H T T S T ?=?-?
通常焓变与熵变在化学反应中的符号是相同的,对Gibbs 自由能的贡献刚好相反。要使反应顺利进行,则()r m G T ?的值越小越好。
m r m ()0, ()0T S T >?>,提高温度对反应有利;m r m ()0, ()0T S T
通常将r m ()0 (1)G T K ?==时的温度称为转折温度,意味着反应方向在这里发生变化
m r m r ()
()
T T 转折温度可以用298.15 K 时的H ?和S ?值进行近似估算。
m m (298.15K)
(298.15K)
第五章 化学平衡 考研辅导题答案 说明:如果答案有问题,请及时联系 1、化学反应体系的ΔrGmθ是指( B )。天津工业2006 A 、 反应体系处于平衡状态下,体系G 的改变量; B 、由标准状态下各自独立的反应物变为标准状态下各自独立的产物,Δξ=1mol 假想变化中体系G 的改变量; C 、与ΔrGm 有相同的物理含义及数值; D 、总压力为101.325kPa 下,Δξ=1mol 的化学反应体系G 的改变量。 2、根据某一反应的ΔrGmθ,下列( D )不能确定。浙江工业2005 A 、 标准状态下,反应自发变化的方向; B 、在ΔrGmθ下所对应的平衡位置; C 、在标准状态下,系统所能做的最大非膨胀功; D 、提高温度反应速率的变化趋势。 3、摩尔反应吉布斯函数变?rGm 不仅是___T__ 的函数,而且还是__P__ 的函数。在G-ξ曲 线上的最低点处?rGm__=0_,此点即为系统的平衡点。在平衡点的左边?rGm<0_;在平衡点的右边?rGm_>0__。 4、在恒T 、恒P 、非体积功为零的条件下,某反应的△G 负值很大,表明该反应进行的程度 大,反应速度也快 ( 错 ) 5、在 中, 是化学反应达到平衡时的摩尔吉布斯函数的变化值。 ( 错 ) 6、在T 、P 条件下化学反应2A(g)+B(g)?3C(g)自发地由反应物变为产物,则反应体系中化学势之间应满足( A ) A 、 2μA+μ B >3μ C B 、2μA+μB <3μC C 、2μA+μB=3μC D 、 μA+μB >μC 7、在恒T ,恒P ,非体积功为零的条件下,反应2O3 =3O2在任何温度下都能自发进行,这说明该反应的( C ) A 、 △H>0△S>0 B 、△H>0 △S<0 C 、△H<0 △S>0 D 、△H<0 △S<0 8. 若某一化学反应的ΣνBμB <0,那该反应能自发向正反应方向进行,此叙述能成立的条件是体系处于( C ) A 、等温 B 、等压.等温 C 、等温等压,除膨胀功外无其它功 D 、等温无非膨胀功 9、化学反应CaCO3=CaO+CO2,在某温度下若将CO2的压力保持在这样一个值,使得 μ(CaCO3 )> μ(CaO) + μ(CO2),则CaCO3将_分解_. 10、恒温恒压下,某反应的 =5kJ/mol ,无法判断该反应是否自发。 ( 对 ) θθK RT G m r ln -=?θ m r G ?θ m r G ?
1、Δr G m ——化学反应的摩尔吉布斯函数[变] 对于化学反应(T、p):a A+b B = y Y+z Z 简写为 由多组分均相体系热力学基本方程: 对定温、定压下的化学反应: 根据反应进度定义 (2)反应过程中,各物质的化学势保持不变。 2、判断化学反应的方向与限度 用作判据都是等效的:
用判断,这相当于图上曲线的斜率: ① 反应自发向右进行,趋向平衡 ② 反应自发向左进行,趋向平衡 ③ 反应达到平衡 3、化学反应通常不能进行到底的原因 严格讲,反应物与产物处于同一系统的反应都是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的反应,可以粗略地认为可以进行到底。这主要是由于存在混合Gibbs自由能的缘故。 以反应为例,在反应过程中Gibbs自由能随反应过程的变化如图所 示。
R点,D和E未混合时Gibbs自由能之和;
P点,D和E混合后Gibbs自由能之和; T点,反应达平衡时,所有物质的Gibbs自由能之 总和,包括混合Gibbs自由能; S点,纯产物F的Gibbs自由能。 若要使反应进行到底,需在van’t Hoff 平衡箱中进行, 防止反应物之间或反应物与产物之间的任何形式的混合,才可以使反应从R点直接到达S点。
5.1.2 化学反应的亲和势 1、化学反应亲和势A 对于给定的化学反应系统,亲和势有定值,它决定于系统的始终态而与反应的过程无关,与系统的大小数量无关。客观上它仅与体系中各物质的强度性质μB有关。 2、判断化学反应的方向与限度 对于一个给定反应:A——化学反应进行的推动力 ①A>0,反应自左至右自发进行(正向进行); ②A<0,反应逆向进行; ③A=0,反应达到平衡。 §5.2 化学反应的平衡常数与等温方程式 1、化学反应等温方程式 讨论对反应物和生成物都为理想气体的化学反应: 令 式中——:化学反应标准摩尔吉布斯函数[变] 令压力商 理想气体的化学反应等温方程式
第五章化学平衡 授课时数:8学时 主要内容: 1. 化学反应的等温方程式和化学反应的亲的势 2. 理想气体化学反应的标准平衡常数 3. 温度对标准平衡常数的影响 4. 其它因素对理想气体化学平衡的影响 5. 同时反应平衡 6. 真实气体反应及混合物和溶液中反应的化学平衡 重点: 1. 化学反应标准平衡常数的定义; 2. 平衡常数和平衡组成的计算; 3. 化学反应的等温方程式和等压方程式及其应用; 4. 温度、压力及惰性气体等因素对化学平衡的影响。 难点: 1. 利用等温方程式判断一定条件下化学反应可能进行的方向; 2. 范特霍夫方程式的推导及其应用。 教学方式: 1. 采用CAI 课件与黑板讲授相结合的教学方式; 2. 合理运用问题教学或项目教学的教学方法; 3. 作业:1,3,4,5,8,10,11,14,15,18,20,21,22,24,26,27,28; 4. 答疑:(a) 课后答疑;(b) 通过网络答疑。
5.1化学反应的等温方程 1.摩尔反应吉布斯函数和化学反应亲和势 在一定的温度、压力和非体积功为零的条件下,化学反应B 0B B ∑=ν的摩尔反应吉布 斯函数为 ? ?? ??=?<=自发 平衡0m r G 定义化学反应的亲和势A 为 m r G A ?-= A 代表在恒温、恒压和' 0W =的条件下反应的推动力。A >0反应能自动进行;A =0反应处 于平衡态;A < 0反应不能自动进行。 2.摩尔反应吉布斯函数与反应进度的关系,平衡条件 对于化学反应 B 0B B ∑=ν,随着反应的进行,各物质的量均发生变化,对多组分系统 B B B d d d d n p V T S G ∑++-=μ 如果在恒温恒压下 B B B d d n G ∑=μ 根据反应进度的定义 B B d d νξn = , 得 ξ νd n B B d =, 代入上式,则 ξ μνd d B B B ∑=G m r B B B ,)/(G G P T ?=∑=??μνξ 式中的 ()p ξ??T,G 表示在T ,p 及 组成一定的条件下,反应系统的 吉布斯函数随反应进度的变化率, 恒温恒压下均相反应的G -ξ曲线示意图
第五章 化学平衡 选择题 1. 对于化学平衡, 以下说法中不正确的是 (A) 化学平衡态就是化学反应的限度 (B) 化学平衡时系统的热力学性质不随时间变化 (C) 化学平衡时各物质的化学势相等 (D) 任何化学反应都有化学平衡态 答案:C 。正确的说法应为 0B B B ν μ=∑ 2. 下面的叙述中违背平衡移动原理的是 (A) 升高温度平衡向吸热方向移动 (B) 增加压力平衡向体积缩小的方向移动 (C) 加入惰性气体平衡向总压力减少的方向移动 (D) 降低压力平衡向增加分子数的方向移动 答案:C 。加入惰性气体平衡向总压力增大的方向移动 3.要使一个化学反应系统在发生反应后焓值不变, 必须满足的条件是 (A) 温度和内能都不变 (B) 内能和体积都不变 (C) 孤立系统 (D) 内能, 压力与体积的乘积都不变 答案:D 。因ΔH=ΔU+Δ(pV ) 4. 在等温等压下,当反应的Δr G m = 5kJ·mol -1 时,该反应能否进行 (A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行 答案:C 。应该用Δr G m 判断而不是Δr G m 。 5.已知反应 2NH 3 = N 2 + 3H 2,在等温条件下,标准平衡常数为,那么,在此条件下,氨的合成反应1/2 N 2 + 3/2 H 2 = NH 3 的标准平衡常数为: (A) 4 (B) (C) 2 (D) 1 答案:C 。 6.反应 2C(s) + O 2(g) 2CO(g),其 r G m /(J·mol -1) = -232600 - K ,若温度升高,则: (A) r G m 变负,反应更完全 (B) K p 变大,反应更完全 (C) K p 变小,反应更不完全 (D )无法判断 答案:C 7.对于气相反应,当体系总压力p 变化时 (A) 对K f 无影响 (B) 对K r 无影响 (C) 对K p 无影响 (D) 对K f 、K r 、K p 均无影响 答案:A 。理想气体的K p 不受压力的影响而真实气体的K p 将随压力而变。 8.理想气体反应CO(g)+2H 2(g) = CH 3OH(g)的Δr G m 与温度T 的关系为: Δr G m = -21660+,若要使反应的平衡常数K p >1,则应控制的反应温度: (A) 必须低于409.3℃ (B) 必须高于 (C) 必须低于 (D) 必须等于
第五章化学平衡与滴定分析法概论练习题参考答案 1.所谓化学计量点和滴定终点是一回事。(.×) 2.所谓终点误差是由于操作者终点判断失误或操作不熟练而引起的。(×)3.滴定分析的相对误差一般要求为小于0.1%,滴定时消耗的标准溶液体积应控制在10~15mL。(.×) 4. 在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。这一点称为(C) (A)化学计量点(B)滴定误差(C)滴定终点(D)滴定分析 5. 滴定分析中,对化学反应的主要要求是(A ) (A)反应必须定量完成 (B)反应必须有颜色变化 (C)滴定剂与被测物必须是1:1的计量关系 (D)滴定剂必须是基准物 6. 滴定分析常用于测定含量(≥1%)的组分。 7. 滴定分析法包括(酸碱滴定法)、(络合滴定法)、(氧化还原滴定法)和(沉淀滴定法)四大类。 8.1L溶液中含有98.08gH2SO4,则c( 2H2SO4)=2mol/L。(×) 9. 0.2000 mol/LNaOH溶液对H2SO4的滴定度为(D )g·mL-1 (A)0.0004900 (B)0.004900 (C)0.0009800 (D)0.009800 10. T NaOH/HCl=0.003000g/mL表示每(1.00 mL NaOH标准溶液)相当于0.003000(g HCl )。 11.凡是优级纯的物质都可用于直接法配制标准溶液。(×) 12.溶解基准物质时用移液管移取20~30mL水加入。(×) 13. 120℃干燥过的分析纯CaO(不可以)(可以或不可以)作滴定分析的基 准物, 其原因是(不稳定, 易吸水及二氧化碳)。 14. 以下物质必须采用间接法配制标准溶液的是( B ) (A) K2Cr2O7(B) Na2S2O3(C) Zn (D) H2C2O4·2H2O 15. 以下标准溶液可以用直接法配制的是( C) (A) KMnO4(B) NaOH (C) K2Cr2O7(D) FeSO4 16. 以下试剂能作为基准物的是( D) (A) 分析纯CaO (B) 分析纯SnCl2·2H2O (C) 光谱纯FeO (D) 99.99%金属铜 17. 配制以下标准溶液必须用间接法配制的是( C) (A) NaCl (B) Na2C2O4(C) NaOH (D) Na2CO3 18. 为标定HCl溶液可以选择的基准物是( B) (A) NaOH (B) Na2CO3(C) Na2SO3(D) Na2S2O3 19.测量的准确度要求较高时,容量瓶在使用前应进行体积校正。(√)20. 直接法配制标准溶液必须使用(A) (A)基准试剂(B)化学纯试剂(C)分析纯试剂(D)优级纯试剂 21. 既可用来标定NaOH溶液,也可用作标定KMnO4的物质为( A) (A)H2C2O4·2H2O (B) Na2C2O4(C)HCl (D)H2SO4 22. 将称好的基准物倒入湿烧杯,对分析结果产生的影响是(C) (A)正误差(B)负误差(C)无影响(D)结果混乱
第五章 化学平衡 1.已知某反应的> 0,则该反应的平衡常数 值…………………………… () (A)> 0(B)< 0 (C)> 1(D)< 1 2. 500 K时,反应SO2(g) + O2(g) ? SO3(g) 的K p= 50,在同温下,反应2SO3(g) ? 2SO2(g) + O2(g) 的K p必等于……………………………………………() (A)100(B) 2 10-2 (C)2500(D) 4 10-4 3.某温度时,化学反应A +B ? A2B的平衡常数K = 1 104,那么在相同温度下,反应 A2B ? 2A +B 的平衡常数为………………………………………………… () (A) 1 104(B) 1 100 (C) 1 10-4(D) 1 10-8 4.在一定条件下,一个反应达到平衡的标志是…………………………………………() (A)各反应物和生成物的浓度相等(B)各物质浓度不随时间改变而改变(C)= 0(D)正逆反应速率常数相等 5.反应 Ag2CO3(s) ? Ag2O(s) + CO2(g),在110℃时的K p= 5.1 10-4,今在110℃的烘箱内干燥Ag2CO3,为防止其分解,必须使烘箱内空气中CO2的摩尔分数大于………() (A) 5.1 10-4 %(B) 5.1 10-2 %
(C)1/5.1 10-4 %(D) 6.在523 K时,PCl 5(g) ? PCl3(g) + Cl2(g),= 1.85,则反应的(kJ·mol 为……………………………………………………………………………………………() (A) 2.67(B)-2.67 (C)26.38(D)-2670 7.已知在20℃,H 2O(l) ? H2O(g),= 9.2kJ·mol-1,H2O(l)的饱和蒸气压为 2.33 kPa,则………………………………………………………………………………………() (A)> 0,H 2O(g)将全部变为液 态 (B)20℃,H2O(l)和H2O(g)不能达到平衡 (C)20℃时,p H2O = 2.33 kPa,体系的Δr G m= 0(D)水蒸气压为100 kPa时,平衡向形成H2O(g)的方向移动 8.某一气相反应A=B,同一温度下,则该反应的平衡常数 是……………() (A)0(B)大于1 (C)小于1(D)1 9.硫酸铜有多种不同水合物,它们脱水反应的K p分别为:CuSO4·5H2O(s) CuSO4·3H2O(s) + 2H2O(g) K p1 ; CuSO4·3H2O(s) ? CuSO4·H2O(s) + 2H2O(g) K p2 ; CuSO4·H2O(s) ? CuSO4(s) + H2O(g) K p3 ; 为了使CuSO4·H2O晶体保持稳定(不风化也不潮解),容器中水蒸气压p H2O 应为……() (A)K p1 < p H2O < K p3(B)p H2O必须恰好等于K p2 (C)K p1 > p H2O > K p2(D)K p2 > p H2O > K p3
第五章物理化学习题 1、已知四氧化二氮的分解反应 在298.15 K 时, 175.4-Θ ?=?mol kJ G m r 。试判断在此温度及下列条件下,反应进行的方向。 (1) N 2O 4(100 kPa), NO 2(1000 kPa); (2) N 2O 4(1000 kPa), NO 2(100 kPa); (3) N 2O 4(300 kPa), NO 2(200 kPa); 2、Ag 可能受到H 2S (气)的腐蚀而发生如下反应: )()()(2)(222g H s S Ag s Ag g S H +?+ 今在298K 、100kPa 下,将Ag 放在等体积的H 2和H 2S 组成的混合气体中。 试问(1)Ag 是否可能发生腐蚀而生成Ag 2S ? (2)在混合气体中,H 2S 的百分数低于多少才不致发生腐蚀? 已知298K 时,Ag 2S 和H 2S 的标准生成吉布斯函数分别为–40.25和–32.93kJ /mol 。 3、 在288K 将适量CO 2(g )引入某容器测得其压力为0.0259p ?,若再在此容器中加入过量)(24s COONH NH ,平衡后测得系统总压为0.0639p ?,求 (1)288K 时反应)()(2)(2324g CO g NH s COONH NH +?的Θ K 。 (2)288K 时上述反应的Θ ?m r G 。 4、将一个容积为1.0547dm 3的石英容器抽空,在温度为297.0K 时导入一氧化氮直到压力为24136Pa 。然后再引入0. 7040g 溴,并升温到323.7K 。达到平衡时压力为30823Pa 。求323.7K 时反应 )()(2)(22g Br g NO g NOBr +?的K Θ。(容器的热膨胀可忽略不计)。 5、已知298.15K ,CO (g )和CH 3OH (g )的标准摩尔生成焓Θ ?m f H 分别为-110.52及-200.7 KJ·mol -1。CO (g )、H 2(g )、CH 3OH (g )的标准摩尔熵Θ m S 分别为197.67,130.68及239.4111--??mol K J ,试根据上述数据求298.15K 时反应 CO (g )+2 H 2(g )== CH 3OH (g )的Θ?m r G 及Θ K 。 6、用丁烯脱氢制丁二烯的反应如下: CH 3CH 2CH=CH 2(g) →CH 2=CHCH=CH 2(g) + H 2(g)
第五章 化学平衡 选择题 1. 对于化学平衡, 以下说法中不正确的是 (A) 化学平衡态就是化学反应的限度 (B) 化学平衡时系统的热力学性质不随时间变化 (C) 化学平衡时各物质的化学势相等 (D) 任何化学反应都有化学平衡态 答案:C 。正确的说法应为0B B B ν μ=∑ 2. 下面的叙述中违背平衡移动原理的是 (A) 升高温度平衡向吸热方向移动 (B) 增加压力平衡向体积缩小的方向移动 (C) 加入惰性气体平衡向总压力减少的方向移动 (D) 降低压力平衡向增加分子数的方向移动 答案:C 。加入惰性气体平衡向总压力增大的方向移动 3.要使一个化学反应系统在发生反应后焓值不变, 必须满足的条件是 (A) 温度和内能都不变 (B) 内能和体积都不变 (C) 孤立系统 (D) 内能, 压力与体积的乘积都不变 答案:D 。因ΔH =ΔU +Δ(pV ) 4. 在等温等压下,当反应的?r G m = 5kJ ·mol -1 时,该反应能否进行? (A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行 答案:C 。应该用?r G m 判断而不是?r G m 。 5.已知反应 2NH 3 = N 2 + 3H 2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N 2 + 3/2 H 2 = NH 3 的标准平衡常数为: (A) 4 (B) 0.5 (C) 2 (D) 1 答案:C 。 6.反应 2C(s) + O 2(g) ←→ 2CO(g),其?r G m /(J ·mol -1) = -232600 - 16 7.7T /K ,若温度升高,则: (A) ?r G m 变负,反应更完全 (B) K p 变大,反应更完全 (C) K p 变小,反应更不完全 (D )无法判断 答案:C 7.对于气相反应,当体系总压力p 变化时 (A) 对K f 无影响 (B) 对K r 无影响
第5章 化学平衡 5.1 化学反应方向及平衡条件 1.填空题 (1)右 (2)α-HgS (3)1706.7K 2.1000K 时,反应C(s)+2H 2(g)=CH 4(g)的△r G θm =19.397kJ.mol -1。现有与碳反应的气体混合物,其组成为体积分数ψ(CH 4)=0.10,ψ(H 2)=0.80,ψ(N 2)=0.10。试问: (1)T=1000K ,p=100kPa 时,△r G m 等于多少,甲烷能否生成? (2)在T=1000K ,不改变H2(g)和CH4(g)的比例下,压力需增加到若干,上述合成甲烷的反应才可能进行? 5.2 理想气体化学反应的等温方程式及标准平衡常数 1.填空题 (1)0.008 (2)66.3kPa 2.已知同一温度,两反应方程及其标准平衡常数K r θ和标准反应Gibbs 函数△r G θ m 如下: θ θ θ θ 2 ,r 22241,r 1224 K )(3)()()( K )(2)(2)()(CH m m G g H g CO g O H g CH G g H g CO g CO g ?+=+?+=+ 求反应:θ θ3,r 32224K )(4)()(2)(m G g H g CO g O H g CH ?+=+,的 解:依题 (3)=2×(2)-(1) 则:θ θθ 1 2 23) (K K K = θ θ θ1,2,3,2m r m r m r G G G ?-?=? 3.在真空容器中放入固态的NH 4HS ,与25℃下分解为NH 3(g)和H 2S(g),平衡时容器内总压力为66.66kPa 。 (1)计算25℃时此分解反应的标准平衡常数K θ。 (2)当放入NH 4HS 时容器内已有39.99kPa 的H 2S ,求平衡时容器内总压力;
第五章 化学平衡 选择题 1. 对于化学平衡, 以下说法中不正确的是 (A) 化学平衡态就是化学反应的限度 (B) 化学平衡时系统的热力学性质不随时间变化 (C) 化学平衡时各物质的化学势相等 (D) 任何化学反应都有化学平衡态 答案:C 。正确的说法应为 0B B B ν μ=∑ 2. 下面的叙述中违背平衡移动原理的是 (A) 升高温度平衡向吸热方向移动 (B) 增加压力平衡向体积缩小的方向移动 (C) 加入惰性气体平衡向总压力减少的方向移动 (D) 降低压力平衡向增加分子数的方向移动 答案:C 。加入惰性气体平衡向总压力增大的方向移动 3.要使一个化学反应系统在发生反应后焓值不变, 必须满足的条件是 (A) 温度和内能都不变 (B) 内能和体积都不变 (C) 孤立系统 (D) 内能, 压力与体积的乘积都不变 答案:D 。因ΔH =ΔU +Δ(pV ) 4. 在等温等压下,当反应的Δr G m = 5kJ·mol -1时,该反应能否进行? (A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行 答案:C 。应该用Δr G m 判断而不是Δr G m 。 5.已知反应 2NH 3 = N 2 + 3H 2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N 2 + 3/2 H 2 = NH 3 的标准平衡常数为: (A) 4 (B) 0.5 (C) 2 (D) 1 答案:C 。 6.反应 2C(s) + O 2(g) 2CO(g),其 r G m /(J· mol -1) = -232600 - 167.7T /K ,若温度升高,则: (A) r G m 变负,反应更完全 (B) K p 变大,反应更完全 (C) K p 变小,反应更不完全 (D )无法判断 答案:C 7.对于气相反应,当体系总压力p 变化时 (A) 对K f 无影响 (B) 对K r 无影响 (C) 对K p 无影响 (D) 对K f 、K r 、K p 均无影响 答案:A 。理想气体的K p 不受压力的影响而真实气体的K p 将随压力而变。 8.理想气体反应CO(g)+2H 2(g) = CH 3OH(g)的Δr G m 与温度T 的关系为: Δr G m = -21660+52.92T ,若要使反应的平衡常数K p >1,则应控制的反应温度: (A) 必须低于409.3℃(B) 必须高于409.3K (C) 必须低于409.3K (D) 必须等于409.3K 答案:C 9.某化学反应在298K 时的标准吉布斯自由能变化为负值,则该温度时反应的K p 将是: (A)K p = 0 (B) K p < 0 (C) K p > 1 (D) 0 < K p < 1 答案:C 。根据ln r m p G RT K ?=-。 10. 25℃时水的饱和蒸气压为3.168kPa, 此时液态水的标准生成吉布斯自由能 f G m 为-237.19kJ· mol -1 ,则水蒸气的标准生成 吉布斯自由能为: (A) -245.76kJ·mol -1 (B) -229.34kJ·mol -1 (C) -245.04kJ·mol -1 (D) -228.60kJ·mol - 1 答案:D 。可以设计使25℃的液态水变为3.168kPa 的水蒸气,此为恒温恒压可逆相变ΔG =0,再改变压力由3.168kPa 变为100kPa ,此步的100 ln 3.168 G RT ?=,再加上液态水的标准生成吉布斯自由能 f G m 即可。 11.在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是: (A) r G m (B)K p (C) r G m (D) r H m 答案:C 。 12.某温度时,NH 4Cl(s)分解压力是p ,则分解反应的平衡常数 K p 为: (A) 1 (B) 1/2 (C) 1/4 (D) 1/8 答案:C 。某温度不,固体分解为气体产物的平衡总压称为该固体的分解压力。此题中的分解压力为p ,可见分解产物NH 3与 HCl 的分压均为(1/2) p 。 13.在1100℃ 时,发生下列反应: (1) C(s)+2S(s)=CS 2(g) K 1 =0.258
第五章 化学平衡 §5.1 化学反应的平衡条件 5.1.1 反应的平衡条件与反应进度ξ的关系 1Δr G m ——化学反应的摩尔吉布斯函数[变] 简写为 0B B B ν=∑ 由多组分均相体系热力学基本方程: B B d d d d B G S T V p n μ=-++∑ 对定温、定压下的化学反应: ,B B B d d T p G n μ=∑() 根据反应进度定义 B B d d n ξν= ?B B d d n νξ= ? ,B B B d d T p G νμξ=∑() ? B B r m B ,T p G G νμξ?? ?==? ????∑ 这两个公式适用条件: (1)等温、等压、不做非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势B μ保持不变。 、判断化学反应的方向与限度 用,B r m ,B () , ()T p B T p G G νμξ???∑ 或 作判据都是等效的: r m ,B B B ()0 0T p G νμ?? ? ???? ∑<①反应自发向右进行< r m ,B B B ()0 0T p G νμ?? ? ???? ∑>②反应自发向左进行> r m ,B B B ()=0 =0T p G νμ?? ? ???? ∑③反应达到平衡 用,T p G ξ??? ????判断,这相当于G ξ-图上曲线的斜率: ① ,0T p G ξ??? ????<?反应自发向右进行,趋向平衡 ② ,0T p G ξ?? ? ????>?反应自发向左进行,趋向平衡 ③ ,=0T p G ξ?? ? ??? ??反应达到平衡 3、化学反应通常不能进行到底的原因 严格讲,反应物与产物处于同一系统的反应都是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的反应,可以粗略地认为可以进行到底。这主要是由于存在混合Gibbs 自由能的缘故。
第 5 章 化学平衡(4 学时) [教学要求] 1、了解化学反应的可逆性,掌握化学平衡和平衡常数的概念。 2、掌握标准平衡常数和吉布斯能变;熟悉多重平衡。 3、掌握浓度、压力、温度对化学平衡移动的影响;了解从热力学和动力学等方面来选 择合理的生产条件。 [教学重点] 1、标准平衡常数和吉布斯能变: Van't Hoff 等温式、反应商、标准平衡常数及其有关 计算、利用反应商和标准平衡常数判断反应进行的方向。 2、浓度、压力、温度对化学平衡移动的影响及其相关计算。 [教学难点] 标准平衡常数和吉布斯能变: Van't Hoff 等温式、反应商、标准平衡常数及其有关计算 [教学内容]
§第五章 Chapter 5
化学平衡
Chemical Equilibrium
1.化学平衡状态 经验平衡常数 平衡常数与平衡转化率 2.化学反应进行的方向 标准平衡常数 判断化学反应的方向 §本章要点 3. 标准平衡常数 K 与 ?r G? m 的关系 化学反应等温式 几种热力学数据间的关系 4.化学平衡的移动 浓度对化学平衡的影响 压强对化学平衡的影响 温度对化学平衡的影响 In the laboratory portion of your chemistry course, you have had the opportunity to observe a number of chemical reactions. After a certain amount of time many of these reactions appear to “stop”---colors stop changing, gases stop evolving, and so forth. For example, we can consider the inter conversion of the gaseous nitrogen oxides. When pure frozen N2O4 is warmed above its boiling point (21.2℃ ), the gas in the sealed tube turns progressively darker as colorless N2O4 gas dissociates into brown NO2 gas: N2O4(g) 2NO2(g) colorless brown Eventually the color change stops even though there is still N2O4 in tube. We are left with a mixture of N2O4 and NO2 in which the concentrations of the gases no longer change.
?
§5-1、化学平衡状态(State of Chemical Equilibrium)
通常,化学反应都具有可逆性。当然,有些化学反应几乎能进行到底,如氯酸钾的分解。又如,
第 1 页 共 12 页
第四章 化学平衡 核心内容: 恒T 、p 、W ˊ=0下,化学反应 自发 0,,>< =?∑='B B W p T G μν 平衡 反向自发 主要内容:化学反应△G 、K 的计算及过程方向的判断。
一、内容提要 1、化学反应自发进行和达到平衡的条件 自发 0,,>< =?∑='B B W p T G μν 平衡 反向自发 其中,B ν为B 的化学计量数,对于产物B ν取正值,对于反应物B ν取负值。 2、理想气体化学反应的等温方程(分压的影响) 和反应方向的具体判据 P m r m r Q RT G G ln +?=?θ θ p Q RT K RT ln ln +-=θ
θK Q RT p ln = <0 自发 (Qp <θ K ) =0 平衡 (Q p=θK ) >0 反向自发(Qp >θ K ) 式中:θ θμνB B m r G ∑=?为标准摩尔反应吉布斯函数变化,θ K 为标准平衡常数, )exp(RT G K m r θ θ ?-==B p p eq B B νθ)(∏=f(T) 3、理想气体化学反应平衡常数的其他表示法及其相互关系 除了标准平衡常数外,实际应用中常用经验平衡常数K P 、K C 、K n 、K y (1)K P :θK =∑∏=∏-B B B p p p p eq B B eq B B νθννθ)()()(
θK =∑- B p K P νθ)( θ K 仅是温度的函数,K P 也只与温度有关。 (2)K C :理想气体P B V=n B RT p B =RT c RT V n B B = θK =∑∏=∏=∏B B B B p RT c p RT c p p B B B B eq B B νθννθνθ)()()( ∑=B p RT K K C νθθ ) ( K C 也只与温度有关 (3)K y :p B =py B =θ K ∑∏=∏=∏B B B B p p y p y p p p B B B B eq B B νθννθνθ)()()( ∑=B p p K K y νθθ ) (总 K y 与温度和总压有关
第5章 化学平衡常数 5-1 写出下列反应的标准平衡常数的表达式和实验平衡常数表达式。 (1) 2SO 2(s) + O 2(g) = 2 SO 3(s) {}{}{} θ θθθ p O p p SO p p SO p K /)(/)(/)(2 2 22 3 = {}{}{} θ θθp O p p SO p p SO p K p /)(/)(/)(2 2 22 3 = (2) Ag 2O(s) = 2Ag(s) + 1/2O 2(g) {} 2 /12/)(θ θp O p K = {} 2 /12)(O p K = (3) CO 2(g) = CO 2 (aq) θθθ p CO p c CO c K /)(/)(22= θ θ p CO p c CO c K P /)(/)(22= (4) Cl 2(g) + H 2O (l ) = H +(aq) + Cl - (aq) + HClO(aq) {}{}{} θθθθ θ p Cl p c H c c Cl c c HlO c K /)(/)(/)(/)(2+- = ) () ()()(2Cl p H c Cl c HlO c K +-= (5) Ag 2CrO 4(s) = 2 Ag + (ap)+CrO 2-4 (aq) {}{} θθ θc CrO c c Ag c K /)(/)(24 2 - += )()(242- +=CrO c Ag c K C (6) 2NH 3(g) = N 2(g) + 3H 2(g) {}{} {} 2 3 3 22/)(/)(/)(θθθ θ p NH p p H p p N p K = {}{}{}2 33 22)()()(NH p H p N p K P = (7) Fe 2+(aq) + 1/2O 2(g) + 2H +(aq) = Fe 3+(aq) + H 2O(l) {} {}{} 2 /12 2 23/)(/)(/)(/)(θθθ θ θ p O p c H c c Fe c c Fe c K + + += 2 /1223)()()() (O p H c Fe c Fe c K C +++= 5-2 已知下列反应平衡常数: H 2(g) + S(s) H 2S(g) θ 1K S(s) + O 2(g) SO 2(g) θ 2K 问反应H 2(g) + SO 2(g) O 2(g) + H 2S(g)的平衡常数θ 3K 是下列中的哪一个。 (A) θ 1K -θ 2K (B) θ 1K · θ 2K (C) θ 2K /θ 1K (D) θ1K /θ 2K 解:将(1)式减去(2)式九等于(3)式 H 2(g) + S(s) H 2S(g) θ 1K
第五章 化学平衡基本概念题 一、填空题。在题中“____”处填上答案。 1、723 ℃时反应 Fe(s) + CO 2(g) == FeO(s) +CO(g) 的K =1.82,若气相y (CO 2)=0.65,y (CO)=0.35,则反应将????。(选填向左进行、向右进行、达到平衡) 2、反应 2C(石墨)+O 2(g) == 2CO(g) 在温度为T 时的标准平衡常数为 K ,则同温度下CO(g)的标准摩尔生成吉布斯函数?r G = 。 3、写出反应的摩尔吉布斯函数的定义式: ;写出化学反应等温方程式: 。 4、已知25 ℃时反应 CO(g) + H 2O(g) == CO 2(g) + H 2(g)的 ?r G =-28.49 kJ ·mol -1,则反应的K = 。 5、反应C (s) + H 2O (g) == CO (g) + H 2(g),在400 ℃时达到平衡,?r H = 133.5 kJ ·mol -1,为使平衡向右移动,可采取的措施有(1)?????????????????;(2) ???????????;(3)??????????????????;(4)?????????????????;(5)???????????。 6、在25 ℃时,气相反应A + B = 2C + D,当达到平衡时,p K θ C K θ(填<,= 或 > )。 二、是非题。在题后括号内,正确的打“√”,错误的打“×”。 1、当一个化学反应处于平衡状态时,反应的标准摩尔吉布斯函数?r G =0。是不是?( ) 2、由?r G =-RT ln K ,因为K 是平衡常数,所以?r G 是化学反应达到平衡时的摩尔吉布斯函数变化值。是不是?( ) 3、化学反应:nA = A n 和1/2nA = 1/2A n 的平衡常数分别为p K θ(1)和p K θ(2),它们之间的关系为p K θ(1)=1/2p K θ(2)是不是?( ) 4、压力商的表达式为'B B B B J p p ν νθθ∑=∏?,是不是?( ) 三、选择题。在题后括号内,填上正确答案代号。 1、将NH 4HS(s) 置于真空容器内在 298 K 时使其达分解平衡,测知K =0.11 ,则系统的平衡压力(总压力)为:( )。 (1) 66332 Pa (2) 33166 Pa (3) 2420 Pa (p = 100 kPa) 2、理想气体反应N 2O 5(g) == N 2O 4(g) + 1/2O 2(g )的?r H 为41.84 kJ ·mol -1 ,?C p ,m =0。要增加N 2O 4的产率可以:( ) 。 (1)降低温度; (2)提高温度; (3)提高压力; (4)等温等容加入惰性气体。 3、在温度T 时,反应2A(g) + B(g) == 2C(g) 的K 的值等于1 ,问在温度T ,标准状态及不作非体积功的条件下,上述反应:( )。 (1)能从左向右进行; (2)能从右向左进行; (3)恰好处于平衡状态; (4)条件不够,不能判断。
第五章 化学平衡练习 一、选择题: 1. 一个氧化还原反应在特定温度下的 m r G ?可由下列测量计算的是………… ( ) (A) 该温度下反应的平衡常数 (B) 速率常数随温度的变化 (C) 该温度下相应电池的电动势 (D) 该温度下反应的 m r H ? 2. 110℃ 密闭容器中,水气共存时,饱和水蒸气压为143 kPa ,则对于 H 2O(l)H 2O(g),下述正确的是…………………………… ( ) (A) 水蒸气压达到 p 时,平衡向生成H 2O(g) 的方向移动 (B) O H 2p = 143 kPa 时, m r G ?= 0 (C) O H 2p = 143 kPa 时,不能达到平衡 (D) O H 2p = 143 kPa 时,Δr G m > 0 3. 已知:2H 2(g) + S 2(g)2H 2S(g) K p 1 2Br 2(g) + 2H 2S(g)4HBr(g) + S 2(g) K p 2 H 2(g) + Br 2(g)2HBr(g) K p 3 则K p 3 等于…………………………………………………………………………………( ) (A) (K p 1 / K p 2 )1/2 (B) (K p 2·K p 1)1/2 (C) K p 2 /K p 1 (D) K p 2·K p 1 4. 下列说法中正确的是………………………………………………………………… ( ) (A) 标准平衡常数无单位,而实验平衡常数K p 一定有单位 (B) 对于溶液中的平衡, K 的值与K c 的值相同,所以 K 与K c 无区别 (C) 对于理想气体反应,当Δn = 0时, K = K p = K c (D) 当 m r G ?< 0时, K >1,反应一定向正反应方向进行 5. 在一定温度下,将1.0 mol SO 3放入1.00 dm 3的反应器内,当反应 2SO 3(g) = 2SO 2 (g) + O 2 (g) 达到平衡时, 容器内有0.6 0mol 的SO 2 ,其平衡常数是……( ) (A) 0.36 (B) 0.68 (C) 0.45 (D) 0.54 6. 下列关于平衡常数的陈述不正确的是……………………………………………… ( ) (A) 平衡常数是温度的函数 (B) 放热反应的平衡常数随温度的升高而减小 (C) 一定温度下,加入催化剂,平衡常数不变 (D) K p 是生成物分压之积与反应物分压之积的比值,在温度一定的情况下,改变某物 质的分压,K p 也会变化 7. 反应A + B C + D 的平衡常数 K 为4.0?10-2,若反应物和生成物都处于标准态, 下面论述正确的是………………………………………………………………………… ( ) (A) 反应能自发向右进行 (B) 反应不能自发向右进行 (C) m r G ?为0 (D) m r G ?与平衡常数 K 无关 8. 298 K 时, K 的数值大于K c 的反应是………………………………………………( ) (A) H 2(g) + S(g) = H 2S(g) (B) H 2(g) + S(s) = H 2S(g)
第五章物理化学习题及答案 1、已知四氧化二氮的分解反 应 在298.15 K 时, 175.4-Θ ?=?mol kJ G m r 。试判断在此温度及下列条件下,反应进行的方向。 (1) N 2O 4(100 kPa), NO 2(1000 kPa); (2) N 2O 4(1000 kPa), NO 2(100 kPa); (3) N 2O 4(300 kPa), NO 2(200 kPa); 解: 由J p 进行判断 1472.0)]15.298314.8/(1075.4exp[)/exp(3=??-=?-=ΘΘRT G K m r ()()Θ Θ=p O N p p NO p J p /]/[422 2 2、Ag 可能受到H 2S (气)的腐蚀而发生如下反应: )()()(2)(222g H s S Ag s Ag g S H +?+ 今在298K 、100kPa 下,将Ag 放在等体积的H 2和H 2S 组成的混合气体中。 试问(1)Ag 是否可能发生腐蚀而生成Ag 2S ? (2)在混合气体中,H 2S 的百分数低于多少才不致发生腐蚀? 已知298K 时,Ag 2S 和H 2S 的标准生成吉布斯函数分别为–40.25和–32.93kJ /mol 。 解:(1)判断Ag 能否被腐蚀而生成Ag 2S ,就是判断在给定的条件下,所给的反应能否自发进行。可以计算?r G m 值,由?r G m 的正、负来判断, 也可以计算反应的平衡常数K ?,再比较K ?与J p 的大小来判断。 Jp 为指定条件下的压力商,其值为 其中摩尔分数之比等于体积百分数之比。 ?r G ?m = ?f G ? (Ag 2S,s) – ?f G ? (H 2S,g) 222222H H H H S H S H S 1 p p x p x J p x p x = = = =