
甲基橙的制备 应用化工技术2班李代睿(20131825) 摘要:甲基橙,亦称“金莲-D”化学名是“对二甲氨基偶氮苯磺酸, 钠”0.1%的水溶液是常用的酸碱指示剂;分光光度测。定氯、溴和溴离子。可与靛蓝二磺酸钠或溴甲酚绿组成混合指示剂,以缩短变色域和提高变色的锐灵性。氧化还原指示剂,如用于溴酸钾滴定三价砷或锑。在偶联反应步骤,反应体系的酸性过强是导致实验失败的原因。为此在偶联反应步骤加入1mL冰醋酸和15 mL5%的氢氧化钠溶液对反应体系的酸碱度进行调节,取得了理想的实验结果。此外再次验证了温度对产率的影响。 关键词:对氨基苯磺酸二甲基苯胺甲基橙偶联反应重氮盐一、引言 甲基橙为小分子有机化合物,橙黄色粉末或结晶状鳞片,与水配比即可得到甲基橙溶液,主要作为酸碱指示剂使用,测量的PH范围是3.1--4.4(由红至黄色)。本实验以重氮盐制备过程中控制温度的变化及偶合过程中试剂间滴加方式的不同对产率的影响进行研究。 二、实验部分 2.1 实验仪器与试剂 主要仪器:烧杯量筒温度计布氏漏斗抽滤瓶 主要试剂:NaOH 对氨基苯磺酸亚硝酸钠N,N-二甲基苯胺乙醚冰醋酸淀粉-碘化钾试纸 2.2 实验步骤 (1)重氮盐的制备盐酸乙醇在50ml烧杯中、加入10ml 5%氢氧化钠溶液和2.1g 对氨基苯磺酸晶体,温热使结晶溶解,用冰盐浴冷却至0℃以下。另在一试管中配制0.8g亚硝酸钠和6ml水的溶液。将此配制液也加入烧杯中。维持温度0-5℃,在搅拌下,慢慢用滴管滴入3ml浓盐酸与10ml水配成的溶液,直至用淀粉-碘化钾试纸检测呈现蓝色为止,继续在冰盐浴中放置15分钟,使反应完全,这时往往有白色细小晶体析出。 (2)在试管中加入1.3ml N,N-二甲基苯胺和1ml冰醋酸,并混匀。在搅拌下将此混合液缓慢加到上述冷却的重氮盐溶液中,加完后继续搅拌10min。然后缓缓加。甲基入约25ml5%氢氧化钠溶液,直至反应物变为橙色(此时反应液为碱性)橙粗品呈细粒状沉淀析出。将反应物置沸水浴中加热 5 分钟,冷至室温后,再放入冰浴中冷却,使甲基橙晶体析出完全。抽滤,依次用少量水、乙醇和乙醚洗涤,压紧抽干。干燥后得粗品约 3.0g。粗产品用 1%氢氧化钠进行重结晶。待结晶析出完全,抽滤,依次用少量水、乙醇和乙醚洗涤,压紧抽干,得片状结晶。产量约 2.5g。将少许甲基橙溶于水中,加几滴稀盐酸,然后再用稀碱中和,观察颜色变化。本实验约需4-6小时。 2.3 实验关键及注意事项 1、对氨基苯磺酸钠为两性化合物,酸性强于碱性,它能与碱作用成盐而不能与酸作用成盐。
甲基橙的制备 姓名:汤小辉范玲霞 大连大学环境与化学工程学院化学111班 指导老师:杨光 摘要:对氨基苯磺酸在低温和不同的酸溶液中与亚硝酸钠经重氮化反应生成重氮盐,再与N,N-二甲基苯胺偶合制备甲基橙,探究不同类型的酸对甲基橙的产量的影响,并同时提出如何简单制备和在常温下制取甲基橙的建议。 关键词:对氨基苯磺酸;重氮化;N,N-二甲基苯胺;偶联反应; 1.前言:甲基橙,俗称金莲橙D;对二甲基氨基偶氮苯磺酸钠;4-{[4-(二甲氨基)苯]偶氮}苯磺酸钠盐。为橙红色鳞状晶体或粉末。微溶于水,较易溶于热水,不溶于乙醇。显碱性。现今被广泛应用作酸碱指示剂,pH值变色范围3.1之前为红色,3.1-4.4为橙色,4.4以后为黄色测定多数强酸、强碱和水的碱度。 2.实验 2.1实验原理 a.低温制取甲基橙 反应式: N H2 H O3S N a O H H 、 0~5℃ N a N O2 N H3C H3C H O A c N a O H N S O3N a N N H3C C H3 b.常温制取甲基橙 甲基橙还可以由对氨基苯磺酸与冰乙酸经重氮化反应生成重氮盐,再与N,N-二甲基苯胺在弱酸性介质中偶合而得。偶合首先得到嫩红色的酸式甲基橙(酸性黄),加碱后转变为橙黄色的钠盐,即甲基橙。
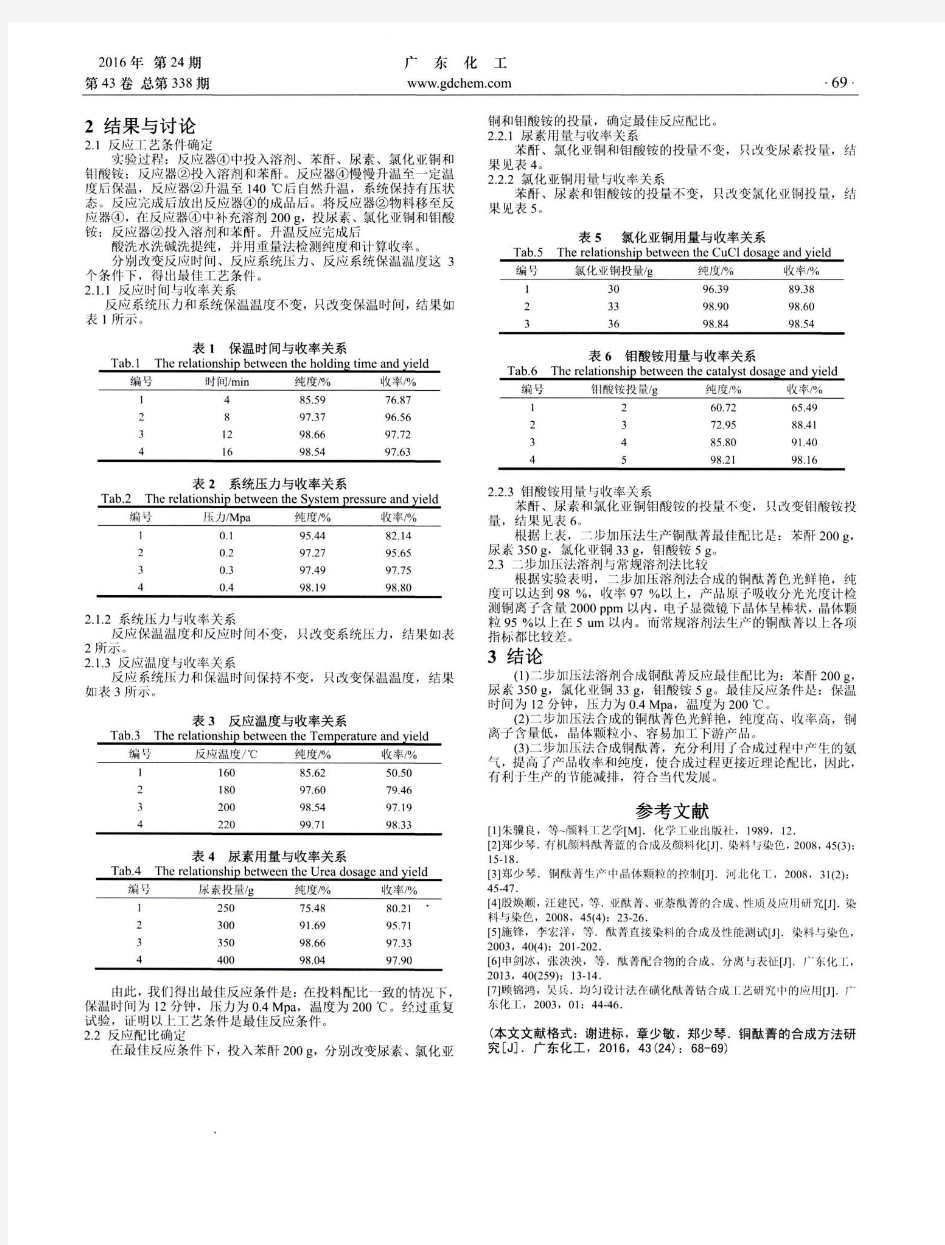
NH 2 HO 3S HOAc N CH 3 H 3C NaOH N N N CH 3 CH 3SO 3Na NaNO 2 2.2主要试剂及仪器 试剂:氢氧化钠溶液(5%,10%)、对氨基苯磺酸、亚硝酸钠、N ,N-二甲基苯胺、淀粉-碘化钾试纸、冰醋酸,浓盐酸、磷酸、硫酸、乙醇。 仪器:烧杯(100ml ,250ml )、玻璃棒、量筒(10ml ,100ml )、胶头滴管、布氏漏斗、电磁炉、抽气泵、锥形瓶。 2.3合成方法 2.3.1合成路线 a.低温下制取甲基橙 由对氨基苯磺酸在低温下、盐酸(磷酸、硫酸)中加亚硝酸钠经重氮化反应制成重氮盐,然后再与与N ,N 二甲基苯胺偶合制成酸式甲基橙,然后在碱化得到粗产品甲基橙。后冷却结晶,过滤,重结晶,等一系列操作,可得到纯度较高的产品甲基橙。 N H 2 H O 3S N a O H N H 2 N a O 3S N H 2 N a O 3S N H O 3S H + 、0~5℃ N a N O 2N H 3C H 3C N O 3S N N C H 3 C H 3 H H O A c N C l N H O 3S N N O 3S N N C H 3 C H 3 H N a O H N N a O 3S N N C H 3 H 3C
Synthesis of p -substituted tetraphenylporphyrins and corresponding ferric complexes with mixed-solvents method Zhicheng SUN 1,Yuanbin SHE (?)1,Rugang ZHONG 2 1Institute of Green Chemistry and Fine Chemicals,Beijing University of Technology,Beijing 100124,China 2College of Life Science &Bioengineering,Beijing University of Technology,Beijing 100124,China ?Higher Education Press and Springer-Verlag 2009 Abstract By using mixed-solvents method,?ve kinds of p -substituted tetraphenylporphyrin compounds [T(p -R)PPH 2,R =NO 2,Cl,CH 3,OCH 3,OH]were synthesized by the condensation of p -substituted benzaldehyde with pyrrole in mixed solvents (propionic acid,acetic acid and nitrobenzene),and corresponding ferric complexes [T(p -R)PPFe III Cl]were synthesized in dimethylformamide.The above free base porphyrins were obtained in 30%–50%yields,metalation yields were up to 90%and total yields of ferric complexes were 27%–50%.Effects of reactive conditions,solvents and oxidants on yields of free base porphyrins were investigated and the relevant mechanism was discussed.Structures of the above porphyrin complexes were characterized by ultraviolet-visible (UV-Vis),infrared (IR)and far infrared (FIR)spectroscopy. Keywords porphyrin,metalloporphyrin,mixed-solvents,synthesis,characterization 1Introduction Substituted tetraphenylporphyrin complexes with conju-gated macrocycles have been essential to the study of biomimetic chemistry in recent years [1–5].The porphyrin iron complexes are mostly used for the models of cytochrome P-450in which the dioxygen has been activated by metalloporphyrins under mild conditions [6,7].Based on that,the substituted metalloporphyrins present high catalytic activities and high selectivities in the catalytic oxidation of hydrocarbons without co-reducing reagents.So the catalytic effect of metalloporphyrins on the activity of inert C-H bonds has been given considerable attention [8]. However,the yields of substituted tetraphenylporphyrin complexes are lower and the cost of synthesis is still expensive,which have exceedingly restricted their current applications.Herein,the study on ef ?cient synthesis methods for improving the yields of metalloporphyrin complexes is obviously necessary. Chemists have developed a few synthetic methods to provide convenient access to synthesize substituent tetraphenylporphyrin complexes [9–11].The prevalent method of synthesis involves a mixed aldehyde condensa-tion with pyrrole via Adler method in re ?uxing propionic acid [12].Nevertheless,several limitations remain on the scope of synthetic porphyrin chemistry.One of these is the synthesis of porphyrins with only one solvent, e.g.,propionic acid or dimethylformamide,which brings the problems of a higher boiling point and inconsistent polarity [13].Therefore,the porphyrin complexes are often with low yields and the synthetic method is not universal for porphyrin complexes with various substituents. In this paper,a series of para -substituted tetraphenyl-porphyrin compounds and the ferric complexes [T(p -R)PPFe III Cl]were synthesized by using mixed-solvents method (Scheme 1).Different reaction conditions were investigated and the yields of porphyrin complexes were improved remarkably.This approach proved to be effective for the synthesis of a varity of metalloporphyrins. 2 Experimental 2.1 Reagent and instrument All chemicals were obtained commercially and used as received unless otherwise noted.Pyrrole was redistilled before use.Dichloromethane was dehydrated.Neutral Al 2O 3was baked at 100°C for 5h. Ultraviolet-visible (UV-Vis)spectra were obtained on HITACHI U-3010.Infrared (IR)spectra were obtained on Received September 18,2008;accepted November 10,2008E-mail:sheyb@https://www.doczj.com/doc/5e17415461.html, Front.Chem.Eng.China 2009,3(4):457–461DOI 10.1007/s11705-009-0169-6
2006年第26卷有机化学V ol. 26, 2006第11期, 1548~1552 Chinese Journal of Organic Chemistry No. 11, 1548~1552 ygzhou@https://www.doczj.com/doc/5e17415461.html, * E-mail: Received February 14, 2006; revised April 10, 2006; accepted May 23, 2006.
No. 11 陈国英等:1-取代异喹啉合成新方法的研究1549 Scheme 1 1.2 合成1-取代-2-苄氧羰基-1,2-二氢异喹啉 以合成1-正丁基-2-苄氧羰基-1,2-二氢异喹啉(1c)为例: 氮气保护下在一个50 mL反应瓶中, 加入镁(86 mg, 3.6 mmol), 几粒碘, 10 mL 干燥的乙醚. 滴加正丁基溴(493 mg, 0.38 mL, 3.6 mmol), 加毕, 室温搅拌30 min, 制备好格氏试剂备用. 氮气保护下的100 mL反应瓶中, 加入异喹啉(315 mg, 2.4 mmol), 再加入30 mL 干燥的乙醚. 冷却至-78 ℃后, 将制备好的格氏试剂滴加到异喹啉中, 继续搅拌10 min, 滴加氯甲酸苄酯(494 mg, 0.42 mL, 2.9 mmol). 加毕, 5 min后撤去冷浴. TLC跟踪反应, 原料消失后, 加入饱和氯化铵溶液40 mL, 乙醚(20 mL×2)萃取, 饱和食盐水洗涤, 无水硫酸钠干燥. 除去溶剂, 剩余物柱层析, 得到淡黄色油状物1c 724 mg (收率94%). 其它化合物的合成采用类似的操作进行. 化合物1a~1i的谱图数据如下: 1-甲基-2-苄氧羰基-1,2-二氢异喹啉(1a): 1H NMR (CDCl3, 400 MHz) δ: 1.30 (d, J=6.0 Hz, 3H), 5.23~5.28 (m, 2H), 5.32, 5.47 (q, J=6.4 Hz, 1H), 5.78, 5.88 (d, J=8.0 Hz, 1H), 6.80, 6.90 (d, J=8.0 Hz, 1H), 7.02~7.41 (m, 8H). 1-乙基-2-苄氧羰基-1,2-二氢异喹啉(1b): 1H NMR (CDCl3, 400 MHz) δ: 0.78~0.87 (m, 3H), 1.63~1.73 (m, 2H), 5.16~5.28 (m, 3H), 5.79, 5.91 (d, J=7.8 Hz, 1H), 6.83~7.40 (m, 10H); 13C NMR (CDCl3, 100 MHz) δ: 10.1, 28.2, 28.8, 57.1, 57.6, 68.0, 109.0, 109.3, 124.7, 124.8, 125.0, 125.5, 126.5, 126.7, 126.9, 127.7, 127.8, 128.3, 128.4, 128.5, 128.8, 130.3, 132.7, 136.3, 153.1, 153.9. HRMS calcd for C19H19NO2 (M++1) 294.1489, found 294.1465. 1-正丁基-2-苄氧羰基-1,2-二氢异喹啉(1c): 1H NMR (CDCl3, 400 MHz) δ: 0.77~0.85 (m, 3H), 1.18~1.25 (m, 4H), 1.61~1.66 (m, 2H), 5.20~5.35 (m, 3H), 5.81, 5.92 (d, J=7.6 Hz, 1H), 6.82~7.41 (m, 10H); 13C NMR (CDCl3, 100 MHz) δ: 14.2, 22.7, 22.8, 27.7, 34.9, 35.5, 55.9, 56.4, 68.0, 68.1, 69.9, 109.2, 109.4, 124.6, 124.8, 125.0, 125.5, 126.4, 126.6, 126.8, 127.0, 127.6, 127.7, 128.3, 128.4, 128.5, 128.8, 130.3, 133.1, 133.2, 136.3, 153.1, 153.8. HRMS calcd for C21H23NO2 (M++1) 322.1802, found 322.1774. 1-苄基-2-苄氧羰基-1,2-二氢异喹啉(1d): 1H NMR (CDCl3, 400 MHz) δ: 2.74~2.97 (m, 2H), 4.76~5.16 (m, 2H), 5.37~5.52 (m, 1H), 5.81, 5.97 (d, J=7.8 Hz, 1H), 6.59, 6.84 (d, J=7.8 Hz, 1H), 6.97~7.38 (m, 14H); 13C NMR (CDCl3, 100 MHz) δ: 41.0, 41.6, 57.4, 58.1, 68.0, 68.1, 108.9, 109.4, 124.4, 124.7, 125.0, 125.1, 126.6, 127.0, 127.8, 128.0, 128.2, 128.3, 128.5, 128.7, 129.9, 130.1, 131.7, 137.2, 152.8, 153.6. HRMS calcd for C24H21NO2 (M++1) 356.1645, found 356.1620. 1-苯基-2-苄氧羰基-1,2-二氢异喹啉(1e): 1H NMR (CDCl3, 400 MHz) δ: 5.16~5.29 (m, 2H), 5.86, 5.92 (d, J=7.4 Hz, 1H), 6.33, 6.52 (s, 1H), 6.89~7.34 (m, 15H). 1-(2-甲氧基苯基)-2-苄氧羰基-1,2-二氢异喹啉(1f): 1H NMR (CDCl 3 , 400 MHz) δ: 3.67 (s, 3H), 3.94 (s, 1H), 5.05~5.26 (m, 2H), 5.78, 5.86 (d, J=7.7 Hz, 1H), 6.78~7.51 (m, 14H); 13C NMR (CDCl3, 100 MHz) δ: 52.6, 55.4, 55.9, 68.0, 107.6, 107.8, 110.8, 111.3, 121.1, 121.3, 125.1, 125.2, 126.0, 126.6, 126.8, 127.3, 127.5, 127.6, 127.8, 128.1, 128.3, 128.5, 128.7, 129.2, 133.5, 136.1, 152.9, 154.0, 154.1, 154.9. HRMS calcd for C24H21NO3 (M++1) 372.1594, found 372.1573. 1-(3-甲氧基苯基)-2-苄氧羰基-1,2-二氢异喹啉(1g): 1H NMR (CDCl 3 , 400 MHz) δ: 3.68 (d, J=24.2 Hz, 3H), 5.17~5.29 (m, 2H), 5.85, 5.92 (d, J=7.7 Hz, 1H), 6.29, 6.49 (s, 1H), 6.73~ 7.35 (m, 14H); 13C NMR (CDCl3, 100 MHz) δ: 55.2, 5 8.2, 5 9.3, 68.3, 108.8, 109.1, 112.6, 112.9, 113.3, 119.0, 119.7, 125.0, 125.2, 125.4, 125.9, 127.3, 127.4, 127.5, 128.1, 128.3, 128.5, 128.7, 129.6, 130.3, 131.7, 136.0, 143.6, 144.3, 153.3, 159.7. HRMS calcd for C24H21NO3 (M++1) 372.1594, found 372.1572. 1-(4-甲氧基苯基)-2-苄氧羰基-1,2-二氢异喹啉(1h): 1H NMR (CDCl 3 , 400 MHz) δ: 3.74 (s, 3H), 5.16~5.29 (m, 2H), 5.85, 5.94 (d, J=7.6 Hz, 1H), 6.29, 6.49 (s, 1H), 6.72~6.87 (m, 2H), 7.05~7.35 (m, 12H); 13C NMR (CDCl3, 100 MHz) δ: 55.4, 57.7, 58.6, 68.3, 109.0, 113.9,
【摘要】本文主要介绍了利用一种用1,4-二甲氧基苯作为反应的起始原料,用氢气作为还原剂,在金属钯复合催化剂的作用下反应直接生成产物对苯二酚。此工艺简单方便易行,副产物少,反应条件相对比较温和。本文对反应的催化剂的种类进行了帅选并且对催化剂的用量、反应温度、反应压力和反应时间进行了优化,最终优化的结果可以使得对苯二酚的产率达到90%。 【关键词】 1,4-二甲氧基苯对苯二酚氢气 对苯二酚是一个重要的有机化工原料,用途非常广泛。酚主要用于制取黑白显影剂、蒽醌染料和偶氮染料、合成气脱硫工艺的催化剂、橡胶和塑料的防老剂单体阻聚剂、食品及涂料清漆、橡胶和汽油的稳定剂和抗氧化剂、石油抗凝剂、洗涤剂的缓蚀剂、稳定剂和抗氧剂等,还用于化妆品的染发剂。 目前世界上生产对苯二酚的方法主要分为以下四种(1)苯胺氧化法;(2)对二异丙苯氧化法;(3)苯酚丙酮法;(4)苯酚羟基化法。 路线1:苯胺氧化法。 目前我国大部分生产厂家仍沿用苯胺氧化法,这是对苯二酚最早的生产方法,至今已有70多年的历史。该法反应过程为:在硫酸中(将138g的1,4-二甲氧基苯和5%不同的催化剂加入烧瓶中,往体系中加入氢气,在压力10mpa和120℃的温度下反应,取样分析对苯二酚的产率。结果如表3所示。 从上表可以看出一共四种催化剂,pd/sio2-al2o3和pd/al2o3的催化效果基本上没有什么差别,分别为81%和80%,但是在产率上都低于催化剂pd/caco3和pd/deloxan apii。pd/caco3 和pd/deloxan apii的催化效果都非常好。下面对催化剂的用量进行了一些实验,结果如表4所示。 从实验结果看出,随着催化剂用量的增加,产率得到了提高,但当用量达到5%的时候,再增加用量,产率基本上没有变化,使用6%pd/caco3为催化剂的产品最终产率为96%,使用6%pd/deloxan apii为催化剂的最终产率为93%。 2.4 反应时间对反应的影响 将138g的1,4-二甲氧基苯和5% pd/caco3催化剂加入烧瓶中,往体系中加入氢气,在压力10mpa和120℃的温度下反应,取样分析对苯二酚的产率,研究反应时间对产率的影响。结果如表5所示。 从上表可以看出反应时间在2小时以下,随着时间的推移对苯二酚的产率渐渐的提高,当反应时间大于2小时的时候,对苯二酚的产率基本没有什么变化,所以反应时间规定在2小时。 3 结语 本文比较了不同种类的催化剂对此反应的影响,确定以pd/caco3或pd/deloxan apii 为反应的催化剂,并且经过对pd/caco3和pd/deloxan apii的用量进行对比实验,确定pd/caco3 和pd/deloxan apii的用量比为5%,并对温度、压力和反应时间进行了对比。最终确定最佳工艺条件为:1. pd/caco3的用量比为5%;2.反应的温度为120℃;3.反应的压力为10mpa;4.反应的时间2小时。
步骤缺点备注 Rothemunde 法以荃类和吡咯为原料,以吡啶 和甲醇为溶剂。在封口的玻璃 管中反应,水浴90—95度下 反应30个小时。将反应液降 温后过滤,以吡啶洗涤反应管 和虑饼,合成虑液,再以百分 之五十乙酸萃取两次。最后将 醚液用饱和NAHSO3萃取三 次后,水洗至中性 反应时间长,反应条件苛刻,且要 求反应器密闭,底物浓度较低,后 处理非常麻烦,反应收率低 Adler-longo 法苯甲醛和新蒸的吡咯在丙酸 中回流30min。冷却至室温后 过滤,然后分别用甲醇和热水 洗涤滤饼,得到蓝紫色晶体, 最后真空干燥。 由于反应条件的限制,一些带敏感 基团或对酸敏感的取代苯甲醛不 能用作原料,同时带有强吸电基的 苯甲醛进行合成时产率特别低,而 且由于底物浓度大以及反应的温 度高,在反应过程中容易长生大量 的焦油,产物不容易纯化。 Lindsey法在室温下采用苯甲醛和吡咯 为原料,在氮气保护下,以二 氮甲烷为溶剂,三氟化硼乙醚 络合物为催化剂,生成卟啉 原,然后以二氯二氰基苯醌将 四苯基卟啉原氧化得到最终 产物四苯基卟啉,收率可达 20—30 优点:反应条件温和,不会产生焦油状的副产物,且产率较高,适合合成带有敏感基团或是空间位阻较大的卟啉。 缺点:此反应只能在比较稀的溶液中进行,且反应步骤相对较多。不仅原料较为昂贵,且反应过程需要无水及无氧操作 [2+2]法利用两分子的二吡咯甲烷缩 合成卟啉优点:可以方便的合成出各种带有不同取代基的不对称的卟啉,且产率比较高,具有较强的灵活性和区域选择性 缺点:合成过程中消耗会比较大且这类反应要在酸性条件下催化进行,而在该条件下容易使得二吡咯甲烷裂解,从而不利于反应的进行。同时,吡咯也容易进行自身缩合反应,且缩合产物难于分离。 微波激励法将吡咯和苯甲醛附于无机载 体硅胶上,利用载体的酸性催 化作用,在微波激励下合成四 苯基卟啉,反应10min后, 直接加入层吸柱进行吸分离, 得到四苯基卟啉,收率百分之 9.5 以二甲苯为溶剂,对硝基苯甲酸为催化剂,使苯甲醛吡咯在微波炉中反应20min,收率可达到百分之42.
甲基橙的制备 一.实验目的 1. 通过甲基橙的制备学习重氮化反应和偶合反应的实验操作; 2. 巩固盐析和重结晶的原理和操作。 二.实验原理 甲基橙是一种指示剂,它是由对氨基苯磺酸重氮盐与N,N-二甲基苯胺的醋酸盐,在弱酸性介质中偶合得到的。偶合首先得到的是嫩红色的酸式甲基橙,称为酸性黄,在碱中酸性黄转变为橙色的钠盐,即甲基橙。 三.实验主要仪器及试剂 仪器:烧杯,布氏漏斗,吸滤瓶,干燥表面皿,滤纸 ,KI -淀粉试纸 。 试剂:对氨基苯磺酸 2.0g ,亚硝酸钠 0.8g ,5%氢氧化钠10 mL ,N,N -二甲基苯胺 1.3 mL , 氯化钠溶液20ml ,浓盐酸 2.5mL ,冰醋酸 1 mL ,10%氢氧化钠15ml ,乙醇4ml. 四.所用化学药品物理性质 外观 溶解性 熔点 毒性 相对分子质量 对氨基 苯磺酸 白色至灰白色 粉末 在冷水中微溶,溶于沸水,微溶于乙醇乙醚和苯 288℃ 摄入、吸入或经皮肤吸收后对身体有害。具有刺激作用 173.83g/mol N,N -二甲基苯胺 淡黄色至浅褐色油状 微溶于水,溶于水乙醇、氯仿、乙醚及芳香族 1.5~ 2.5℃ 高毒。吸入其气体或经皮肤吸收引起中毒 121.18g/mol NH 2 HO 3S NH 3 O 3S NaOH NH 2 NaO 3S H 2O
五.实验步骤及现象 实验时间 实验内容 实验现象 13:30~13:35 称取2.00g 对氨基苯磺酸于100ml 烧杯中,再加入10ml5%NaOH ,水浴加热至溶解。 对氨基苯磺酸为白色粉末状,溶解后溶液呈橙黄色。 13:35~13:42 让溶液冷却至室温。 13:42~13:54 向溶液中加入0.8gNaNO3和6ml 水,混合均匀后,冰水浴冷却。 加入NaNO3后,溶液的橙色变淡,溶液中有白色的小颗粒。 13:54~14:01 将2.5ml 浓HCl 慢慢加入到13ml 的水中,混合均匀后。边搅拌边逐滴加入到溶液中。然后用KI-淀粉试纸检验。 加入HCl 后溶液颜色加深,变成了红色溶液,但溶液中又有很多白色颗粒。KI-淀粉试纸呈紫色。 14:01~14:17 冰水浴15min.制得重氮盐。 溶液分层。下层为白色颗粒。 14:20~14:30 将1.3mlN,N-二甲基苯胺和1ml 冰醋酸加到试管中,震荡混合后,边搅拌边加到重氮盐中,搅拌10min 。 N,N-二甲基苯胺淡黄色 液体,有刺激臭味 有机溶剂。 甲基橙 橙红色 鳞状晶体或粉末 微溶于水,较易溶于热水,不溶于乙醇。 300℃ 低毒类,对眼睛有刺激性 327.33g/mol
甲基橙(实验室酸碱指示剂)的制备 一、训练要求 1、学习和掌握甲基橙(实验室酸碱指示剂)制备原理和方法,清楚反应的影响因素,进行制备方案的查询和选择。 2、根据所确定的方案查阅并记录原料、中间产物、副产物、产品的常规物性和毒理性质。做实验环境的评估、选择和安全预案。 3、理解反应过程中出现的副反应,且在合成操作后,有逻辑的明确提纯方案。 4、根据实施路线和数量要求,合理选择适合的玻璃仪器,辅助装置,并能够正确、熟练的搭建实验装置。 5、能够熟练的操作仪器,控制反应进程,对粗品进行纯化处理,进行基本的性质检测。 6、实验训练中,能够仔细观察现象,正确分析现象的原因,进行对应的正确操作与处理。 7、实验过程中,及时、准确、正确的记录实验数据和现象。实验结束后进行数据的归纳、整理、计算。 8、本实验要求熟练掌握:试剂的称量、低温合成、洗涤与抽滤操作、干燥、以及熔点仪的使用。 二、教学重点和难点 重点:偶氮化合物的制备原理和方法,反应设备的搭建,减压抽滤的原理和方法。 难点:通过减压抽滤去除固液混合组分中非产品成分的方法。甲基橙(实验室酸碱指示剂)粗品的重结晶提纯。 本制备过程的粗产物是固液非均相体系,并含有副产物,使用减压抽滤和重结晶的处理方式,获得纯度较高的产品是典型的固液混合相产物处理方法,在有机合成操作中具有代表意义。 三、试验原理 中文别名:金莲橙D 英文名称::Methyl Orange 结构式: 外观与性状:橙黄色鳞状晶体或粉末。 分子量:327.24 甲基橙的变色范围是pH<3.1 变红,pH>4.4变黄,3.1~4.4呈橙色。
相对密度:1.28 溶解性: 微溶于冷水,易溶于热水,几乎不溶于乙醇; 最大吸收波长:505nm 在酸碱滴定中主要用作酸碱指示剂,在氧化还原滴定法中可以用作氧化还原指示剂,在催化动力光度分析和氧化还原光度分析中主要用作还原剂,在配合物水相光度分析中主要用作配位剂。 主反应: 甲基橙是指示剂,它是由对氨基苯磺酸重氮盐与N ,N —二甲基苯胺的醋酸盐,在弱酸性介质中偶合,首先得到亮黄色的酸式甲基橙称为酸性黄,在碱中酸性黄转变为橙黄色的钠盐,即甲基橙。 大多数重氮盐很不稳定,温度高时易发生分解,所以重氮化反应和偶合反应都需在低温下进行。同时强酸性介质的存在,防止重氮盐与未反应的芳胺发生偶合。 对氨基苯磺酸是两性化合物,其酸性比碱性强,能形成酸性内盐,它能与碱作用生成盐,难与酸作用生成盐,所以不溶于酸。但重氮化反应要求在酸性溶液中完成,因此,首先将对氨基苯磺酸与碱作用,生成水溶性较大的对氨基苯磺酸钠,再进行重氮化反应。 四、实验步骤 第一部分,重氮盐的制备 第一步:在100 mL 烧杯中,加入2.1 g 对氨基苯磺酸,10 mL 5% NaOH 溶液,水浴中,加热溶解,冷却至室温。 第二步:加入0.8 g 亚硝酸钠,溶解。搅拌下将混合物分批倒入装有13 mL 冰水和2.5 mL 浓盐酸的烧杯中,保持温度在5 ℃以下(重氮盐为细粒状白色沉淀)。冰盐浴中放置15 min ,使重氮化反应完全。 第二部分,偶合反应 第一步:在另一烧杯中加入1.2 g N , N-二甲基苯胺,溶于1 mL 冰醋酸中,不断搅拌 NH 2 HO 3S NH 3 O 3S NaOH NH 2 NaO 3S H 2O
CoP-CMP的合成: 在50ml三口烧瓶中加入158.5mg对溴苯基钴卟啉、63.6mg1,4-苯二硼酸、 K 2CO 3 (221.1mg)溶液6ml、1,4-二氧六环30ml、Pd(PPh3) 4 18.5mg。冷冻到-70℃ 后通过三次15min-泵抽15min-通氮气-解冻除氧。然后在90℃下反应24小时。反应24小时后过滤,用去离子水、无水乙醇、THF、丙酮洗涤至滤液无色,再用甲醇、THF、丙酮索氏提取。最终得到0.1302g棕色粉末。 产物中的白色杂质比上次做的少很多,白色杂质可能是三口烧瓶的玻璃被碱腐蚀掉进产物里。由于对溴苯基钴卟啉在溶剂里溶解度低,产物很难洗干净。 对四硝基苯基卟啉(TNPP)的合成: 方法一:在装有冷凝管的250ml三口烧瓶中加入3.67g(24mmol)对硝基苯甲醛、3.9ml(41mmol)醋酸酐和100ml丙酸,加热至回流。10min内滴加1.6102g (48mmol)吡咯(溶于3ml丙酸),然后继续反应30min。反应混合物冷却至室温后过滤,得到的黑色固体用去离子水洗涤后40℃下真空干燥。得到的黑色固体里含有大量聚合物,这些聚合物易溶解于吡啶,而产物在冷的吡啶溶液里溶解度低。把黑色固体在50ml吡啶中回流1小时,冷却至室温后放在冰箱里过夜。混合物过滤后用丙酮洗涤固体至滤液无色,最后干燥得到0.8034g紫色产物。产率16.85%。 方法二:在装有冷凝管的100ml三口烧瓶中加入4g对硝基苯甲醛、7ml乳酸和25ml硝基苯,加热至130℃。20min内滴加12ml溶有1.71g吡咯的硝基苯溶液后继续反应2个小时。然后在60℃下加入20ml甲醇,搅拌30min。把反应物放在冰箱里过夜后抽滤得到紫黑色固体。然后把紫黑色固体在10ml吡啶中回流1个小时后放在冰箱里过夜。最后抽滤、用丙酮洗涤固体至滤液无色,最后干燥得到0.9735g紫色产物。产率18.5%。 UV-Vis(λ;nm;CHCl 3 溶剂):422,514,550,590,650。 对四氨基苯基卟啉(TAPP)的合成: 氮气保护下在装有冷凝管的250ml三口烧瓶中加入1.44g(108mmol)对四硝基苯基卟啉和HCl(12mol/l,70ml)。在75-80℃下加入14ml溶解有13.04 g SnCl 2·2H 2 O (58mmol)的浓盐酸至三口烧瓶中反应30min。然后在冰浴条件下加 入80ml浓氨水终止反应,在空气条件下继续搅拌1h。过滤收集固体,加入到140ml 氢氧化钠溶液(2%),剧烈搅拌30min。过滤收集固体产物,用水洗涤后干燥。再用氯仿索氏提取,收集滤液,旋转蒸发得到对四氨基苯基卟啉。 对四硝基苯基钴卟啉(TNPPCo)的合成: 氮气保护下在装有冷凝管的100ml三口烧瓶中加入200mg T(P-NO 2)PPH 2 和 100mlDMF,加热至回流后在1h内分4次加入300mg(1.5mmol)CoCl 2·6H 2 O。继 续反应1h。溶液由紫色逐渐变成红黑色,TNPP在DMF里溶解度差,上金属后溶解度变大。蒸馏回收50mlDMF。然后用冰水冷却,加入50ml去离子水,过滤收集产物。用去离子水反复洗涤后用少量乙醇洗涤。干燥后得到0.2050g产物。
有机化学实验报告 实验名称:甲基橙的制备 学院:化工学院 专业:化学工程与工艺 班级: 姓名:学号 指导教师:房江华、李颖 日期: 一、实验目的: 1、通过甲基橙的制备学习重氮化反应和偶合反应的实验操作;
2、巩固盐析和重结晶的原理和操作。 二、实验原理: 三、主要试剂及物理性质: 四、实验试剂及仪器: 药品:对氨基苯磺酸()、5%氢氧化钠()、亚硝酸钠()、浓盐酸()、N,N二甲基苯胺()、冰醋酸()、10%氢氧化钠()、饱和氯化钠()、乙醇(少量) 仪器:电炉、烧杯、量筒、玻璃棒、滴管、表面皿、循环水真空泵。 五、仪器装置: 六、实验步骤及现象:
七、数据处理与实验结果: m=×M甲基橙/M对氨基苯磺酸=2×= 产率=(m0/m)×100% 八、注意事项: ①对氨基苯磺酸为两性化合物,酸性强于碱性,它能与碱作用成盐,而不能与酸作用成盐。 ②重氮化过程中,应严格控制温度,反应温度若高于5℃,生成的重氮盐易水解为酚,降低产率。 ③若试纸不显色,需补充亚硝酸钠溶液。 ④重结晶操作要迅速,否则由于产物呈碱性,在温度高时易变质,颜色变深,用乙醇洗涤的目的是使其迅速干燥。 ⑤N,N二甲基苯胺是有毒物品,要在通风柜内进行,并且尽量少占用仪器。 ⑥在第二次准备抽滤,甲基橙结晶时,有鳞片状甲基橙析出可以搅拌使整个烧杯中液体都
冷却。 ⑦N,N二甲基苯胺有毒,实验时应小心使用,接触后马上洗手。 九、实验讨论及误差分析: ①结晶出晶体颗粒小时,抽滤会浪费较多时间; ②在第一次抽滤甲基橙产品之前,由于搅拌时糊到整个烧杯上,在抽滤时还留有部分不能进行抽滤操作,可能使产品减少; ③重氮化过程严格控制温度在5℃以下,产率较高。
产能转移吡喹酮唯我独大 吡喹酮上市使用至今已有30多年历史,多年来,吡喹酮一直作为抗血吸虫病的主力药物和抗其他寄生虫的有效药物在临床一线应用,为人类健康起到了重要的作用。一线抗寄生虫药物吡喹酮最先由Seubere等人于1975年首先合成,德国默克(即现在的默克雪兰诺)和拜耳两药厂成功开发出药物制剂。1980年德国默克公司以商品名“Cesol”率先上市的吡喹酮,目前已在全世界范围内广泛应用。吡喹酮上市后,因其高效、低毒、抗寄生虫谱广、口服方便等特点,深受患者欢迎,销售额不断增加,市场占有率迅速扩大,很快成为世界上治疗血吸虫病和多种寄生虫病的主要药物。除用于人体外,它也广泛用作动物、家禽等的抗寄生虫治疗。吡喹酮又名环吡异喹酮、8440,为广谱抗寄生虫病用药,其抗蠕虫谱很广,对日本血吸虫、埃及血吸虫、曼氏血吸虫等均有杀灭作用。此外,它对并殖吸虫(肺吸虫)、华支睾吸虫、包虫、囊虫、孟氏裂头蚴、姜片虫、绦虫等也有杀灭作用。其作用特点是疗效高、剂量小、疗程短、代谢快、毒性小和口服方便。毋庸置疑,吡喹酮的问世是寄生虫病化疗史上的一项重大突破,现在,它仍是治疗多种寄生虫病的首选药物。 《中国药典》自1985年版以来,修订的历版均将吡喹酮收载其中,同时亦被收载于美国、英国等许多国家的药典以及《欧洲药典》、《国际药典》等。目前,吡喹酮已被列入我国《基本医疗保险及工伤保险药品目录》中抗吸虫病药物的甲类品种。多年来,每当我国长江流域以及其他南方广大地区遭受洪水袭击后,吡喹酮作为预防和治疗血吸虫的一线药物,均发挥了很大的作用。产能占全球近半. 目前,全世界有多家公司生产吡喹酮,如德国默克、拜耳、Miles、韩国大宇等,产量最大的是拜耳公司,年产量达50多吨。但是,近年来因环保等各种原因,这些公司的产量均有不同程度的减少甚至停产。前几年,吡喹酮全世界年总产量为200吨左右。 我国于1977年研发成功吡喹酮并开始临床试验,1982年正式投放市场。30余年来,我国吡喹酮年生产能力和产量均稳步上升。20世纪80年代,我国吡喹酮年生产能力不到20吨,年产量仅为10余吨,到20世纪90年代,年生产能力达到30多吨,年产量20余吨。20世纪末,我国吡喹酮的年生产能力已达到近50吨,年产量为35吨左右。多年来,南京制药厂、上海制药六厂为吡喹酮的主要生产企业,年产量和出口量占据全国80%以上的份额。21世纪以来,江苏、浙江、安徽等地有多家企业先后投入吡喹酮的生产,前些时候,浙江海正药业又与国外合作,兴建了年产40吨规模的吡喹酮生产线,这使我国的年生产能力增至150余吨,年产量80余吨,从而成为世界吡喹酮的主要生产国。现在全国共有吡喹酮生产批准文号25个,其中吡喹酮片剂生产批准文号有18个,吡喹酮原料药生产批准文号7个,原料药主要生产企业有:南京制药厂、浙江海正药业、常州亚邦制药、上海新华联制药、绍兴民生医药、江苏红豆杉药业、安徽省润康药业等。 此外,全国还有多家化工企业也生产吡喹酮原料药作为兽用药并出口,如石家庄嘉一药业和上海嘉一药业最近共同打造了国内规模最大的吡喹酮原料药产销集团。上海嘉一公司的吡喹酮原料药已于2011年4月通过农业部GMP认证,产品质量符合USP、EP、CVP等最新版
比拉斯汀的合成工艺研究 发表时间:2017-10-30T17:35:09.573Z 来源:《医药前沿》2017年10月第29期作者:徐连德1 徐琪琪2 徐英明2 [导读] 比拉斯汀(Bilastine),中文化学名为2-[4-(2-(4-(1-(2-乙氧基乙基)苯并咪唑-2-基)哌啶-1-基)乙基)苯基]-2-甲基丙酸。(1沂水县第一中学山东临沂 276405) (2山东罗欣药业集团股份有限公司山东临沂 276017) 【摘要】α,α-二甲基-4-(2-溴乙酰基)苯乙酸甲酯[2]经过还原反应制得α,α-二甲基-4-(2-溴乙基)苯乙酸甲酯[3],3与1-(2-乙氧基-乙基)-2-哌啶-4-基-1H-苯并咪唑[4]发生烷基化反应,再经水解得到比拉斯汀[1],总收率约76%。 【关键词】比拉斯汀;组胺H1受体拮抗剂;合成 【中图分类号】R976 【文献标识码】A 【文章编号】2095-1752(2017)29-0353-01 比拉斯汀(Bilastine),中文化学名为2-[4-(2-(4-(1-(2-乙氧基乙基)苯并咪唑-2-基)哌啶-1-基)乙基)苯基]-2-甲基丙酸,是西班牙FAES制药公司开发的第2代组胺H1受体拮抗剂,2012年欧盟批准其用于治疗变应性鼻炎及慢性特发性荨麻疹[1]。本品安全性良好,无常用抗组胺药物存在的镇静作用及心脏毒性,口服给药吸收迅速,具有良好的耐受性、安全性和较高的生物利用度[2]。 已有文献报道了1的合成路线[3-5]。本文选择以下路线α,α-二甲基-4-(2-溴乙酰基)苯乙酸甲酯[2]经过还原反应制得α,α-二甲基-4-(2-溴乙基)苯乙酸甲酯[3],3与1-(2-乙氧基-乙基)-2-哌啶-4-基-1H-苯并咪唑[4]发生烷基化反应,再经水解得到比拉斯汀[1],并进行了工艺优化。 文献[5]报道了由2制备3的过程,用三乙基硅烷-三氟乙酸进行还原,反应时间长达72h,收率91%。本研究通过调整三乙基硅烷-三氟乙酸的用量,控制回流反应温度,缩短了反应时间,收率90%。文献[5]由3制备1的过程中,3依次与2-(4-哌啶基)-1H-苯并咪唑和2-氯乙基乙醚发生亲核取代反应后,水解得比拉斯汀,反应步骤长,且操作繁琐,且3在与2-(4-哌啶基)-1H-苯并咪唑发生亲核取代反应时,咪唑环上的氮-氢不可避免的会与哌啶基上的氮-氢进行竞争,生成副产物,影响收率和纯度。本研究在文献基础上进行了改进,将3直接与4进行烷基化反应,再进行水解,一锅法制备1,方法工艺简单,操作简便,收率及产品纯度均有较大幅度提高,总收率为76%,适合工业化生产。 图1 1的合成路线 Fig.1 Synthetic Route of 1 1.实验部分 1.1 α,α-二甲基-4-(2-溴乙基)苯乙酸甲酯[3]的制备 冰浴冷却下分别向反应瓶内加入20mL二氯甲烷、α,α-二甲基-4-(2-溴乙酰基)苯乙酸甲酯(30.0g,100.7mmol,采用文献方法[5]制得,纯度99.1%)、三氟乙酸(36mL,484.6mmol)、三乙基硅烷(18mL,112.7mmol)。冰浴下搅拌30min后,升温至60℃回流反应20h。反应结束,滴加饱和碳酸溶液(约150ml),加入乙酸乙酯(100ml*2)萃取,有机相浓缩干燥,得无色油状物(25.7g,90%)(文献:91%[5])。ESI-MS,m/z(%):307[M+Na]+,283[M-H]+。元素分析:C13H17BrO2,实测值(计算值)%:C54.96(55.00);H6.02(6.04);Br28.11(28.14);O11.27(11.27)。 1.2 比拉斯汀[1]的合成 在反应瓶中加入3(99.36g,0.35mol)和4(82.01g,0.3mol,购自:江苏弘和药物研发有限公司,纯度98%),搅拌下加入10ml聚乙二醇-400和45ml水,在冰水浴的冷却下慢慢加入混合碱(0.25molNaOH+0.1molNa2CO3),于40℃下快速搅拌3.5小时后放置,使反应液冷却至室温,加入3N丁二酸溶液2.1L,加热回流24小时,用10%氢氧化钠水溶液调至pH=7,用乙醚(450ml*2)萃取,旋出溶剂,得到固体1(116.83g,84%),mp291~293℃(文献:295-296[5])。纯度为99.8% [HPLC归一化法:同文献[5]。ESI-MS,m/z(%):487[M+Na]+,463[M-H]+。元素分析:C28H37N3O3,实测值(计算值)%:C72.50(72.54);H8.01(8.04);N9.07(9.06); O10.38(10.35)。 【参考文献】 [1] Corc6stegui R,Labeaga L,Inneririty A,et a1.Preclinical pharmacology of bilastine,a new selective histamine Hl receptor antagonist:receptor selectivity and in vitro anti-histaminic activity[J].Drugs R D,2005,6(6):371-384. [2] Carter NJ.Bilastine:in allergic rhinitis and urticaria [J].Drugs,2012,72(9):1257-1269. [3] Lee CH,Khoo JH,Kwon KC,eta1.Process for preparation of 2-methyl-2-phenylpropionic acid derivatives and novel intermediate compounds:WO,2009102155[P].2009-02-12. [4]王蕾,李科,王倩,等.2-(4-卤乙基)苯基-2-甲基丙酸酯的制备方法及合成比拉斯汀的方法:中国,102675101[P].2012-09-19. [5]孔昊,耿海明,梅玉丹,等.比拉斯汀的合成[J].中国医药工业杂志,2015,46(7):677-679.