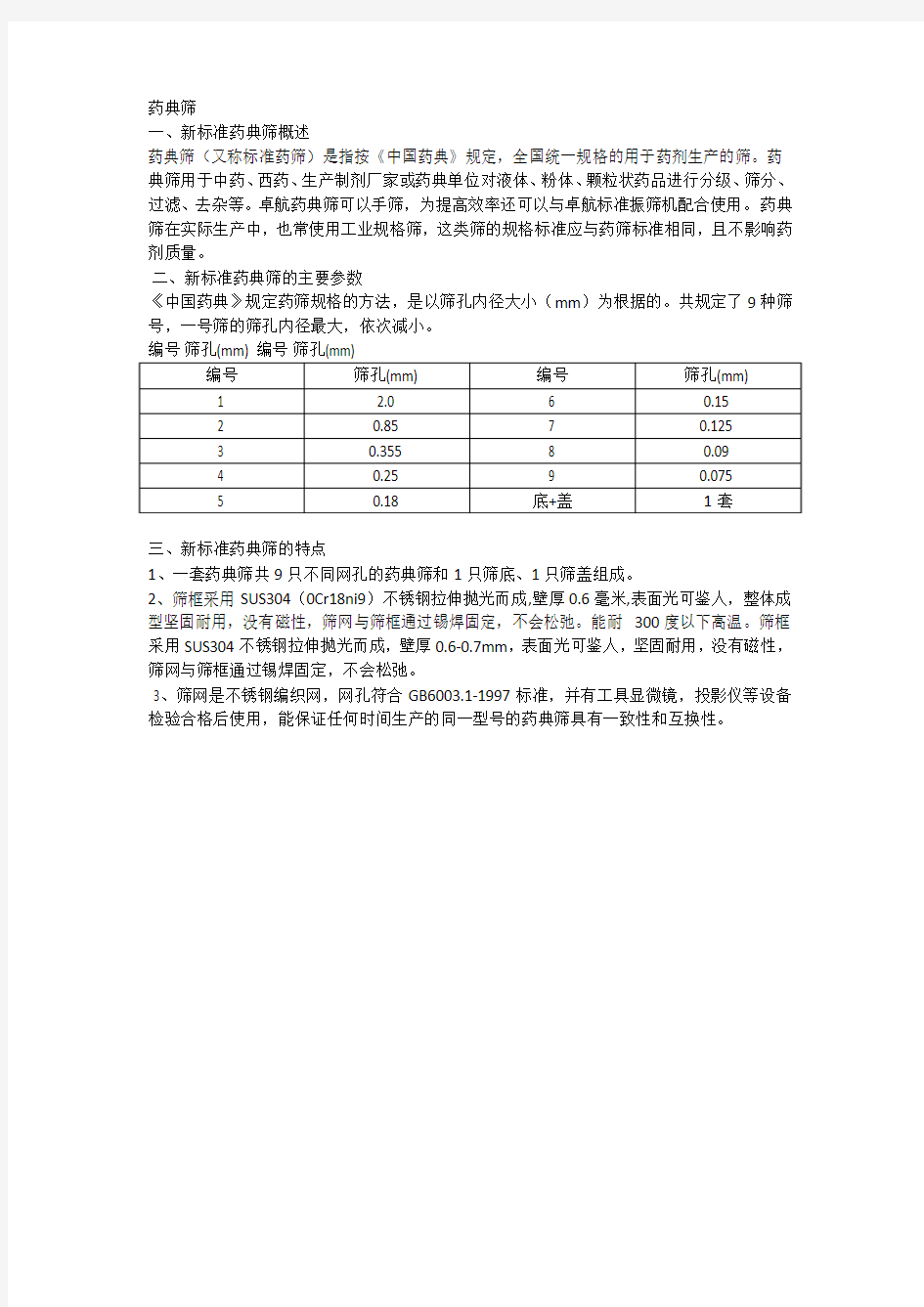
药典筛
一、新标准药典筛概述
药典筛(又称标准药筛)是指按《中国药典》规定,全国统一规格的用于药剂生产的筛。药典筛用于中药、西药、生产制剂厂家或药典单位对液体、粉体、颗粒状药品进行分级、筛分、过滤、去杂等。卓航药典筛可以手筛,为提高效率还可以与卓航标准振筛机配合使用。药典筛在实际生产中,也常使用工业规格筛,这类筛的规格标准应与药筛标准相同,且不影响药剂质量。
二、新标准药典筛的主要参数
《中国药典》规定药筛规格的方法,是以筛孔内径大小(mm)为根据的。共规定了9种筛号,一号筛的筛孔内径最大,依次减小。
编号筛孔(mm) 编号筛孔(mm)
三、新标准药典筛的特点
1、一套药典筛共9只不同网孔的药典筛和1只筛底、1只筛盖组成。
2、筛框采用SUS304(0Cr18ni9)不锈钢拉伸抛光而成,壁厚0.6毫米,表面光可鉴人,整体成型坚固耐用,没有磁性,筛网与筛框通过锡焊固定,不会松弛。能耐300度以下高温。筛框采用SUS304不锈钢拉伸抛光而成,壁厚0.6-0.7mm,表面光可鉴人,坚固耐用,没有磁性,筛网与筛框通过锡焊固定,不会松弛。
3、筛网是不锈钢编织网,网孔符合GB6003.1-1997标准,并有工具显微镜,投影仪等设备检验合格后使用,能保证任何时间生产的同一型号的药典筛具有一致性和互换性。
总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药,二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。 本部为《中国药典》四部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。药典收载的凡例与通则对未载入本版药典但经国务院药品监督管理部门颁布的其他中药标准具同等效力。 三、凡例是正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则及与质量检定有关的共性问题的统一规定。 四、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 五、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 六、《中国药典》的英文名称为Pharmacopoeia of The People's Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为ChP。 七、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 正文 八、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音与英文名);(2)有机物的结构式; (3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称及编排 十一、正文收载的药品中文名称通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名称均为法定名称;本版药典收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。 有机药物的化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。 十二、药品化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。 十三、正文按药品中文名称笔画顺序排列,同笔画数的字按起笔笔形一丨丿丶乛的顺序排列;通则包括制剂通则、通用检测方法和指导原则,按分类编码;索引分按汉语拼音顺序排序的中文索引以及英文名和中文名
2010版中国药典凡例(二部) 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。除特别注明版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》二部。 二、国家药品标准由凡例与正文及其引用的附录共同构成。本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。 三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。 四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 七、《中国药典》的英文名称为Pharmacopoeia(药典)of The People’s Republic(共和国)of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。 正文 八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。 附录 十、附录主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称与编排 十一、正文品种收载的中文药品名称系按照《中国药品通用名称》推荐的名称及其命名原则命名,《中国药典》收载的药品中文药品名称均为法定名称;药品英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names, INN)。 有机药物化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应
《中国药典》2015年版四部 凡例 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药 品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版 标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药, 二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。除特别注明 版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》四部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。本部药典收载的 凡例与通则对未载入本部药典的其他药品标准具同等效力。 三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则与药品质量检定有关的共性问题的统一规定。 四、凡例和通则中采用“除另有规定外”这一用语,表示存在与凡例或通则 有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 六、正文所设各项规定是针对符合《药品生产质量管理规范》Good Manufacturing Practices,GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加 物质或相关杂质,亦不能认为其符合规定。 七、《中国药典》的英文名称为Pharmacopoeia of the People’s Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为 ChP。 正文
八、《中国药典》各品种项下收载的内容为标准正文。正文系根据药物自身 的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规 定。 九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音 与英文名);(2)有机物的结构式;(3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药 物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种 进行相同检查项目的检测时所应釆用的统一的设备、程序、方法及限度等;指导 原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称与编排 十一、正文收载的药品中文名称通常按照《中国药品通用名称》收载的名称及其命名原则命名,《中国药典》收载的药品中文名称均为法定名称;本版药典 收载的原料药英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names,INN)。 有机药物的化学名称系根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。 十二、药品化学结构式按照世界卫生组织(World Health Organization,WHO)推荐的“药品化学结构式书写指南”书写。
制药企业产品检测理论试题 一、单选题 1下列哪项不属于2015版《中国药典》一部正文收载内容?(C) 2 A.药材和饮片B.成方制剂和单味制剂C.药用辅料D.提取物E.植物油脂 3下列收录在2015年版中国药典第四部中的是(B) 4 A.化学药品B.药用辅料C.生物制品D.中药 5下列哪些不是2015年版中国药典首次收载的指导原则(B) 6 A. 7 C. 8 9 A. 10 11 12 13 A. 14 15 A. 16 C. 17 18 A. 19 B. 20 C. 21 D. 222015版《中国药典》规定,细粉系指能全部通过五号筛,并含能通过六号筛不少于的粉末。(D)23 A.80%B.85%C.90%D.95% 24“能全部通过六号筛,并含能通过七号筛不少于95%的粉末”是(B) 25 A.细粉B.最细粉C.极细粉D.中粉 26铵盐检查所用的水必须是(C) 27 A.超纯水B.纯化水C.无氨水D.注射用水E.新沸冷水 28氯化物杂质检查的条件是(A)
29 A.硝酸酸性下B.醋酸酸性下C.硫酸酸性下D.盐酸酸性下 302015年版《中国药典》旋光度测定法中,一般应在样品溶液配置后内进行测定。(D) 31 A.10分钟B.15分钟C.20分钟D.30分钟E.1小时 32水的电导率与有关。(C) 33 A.水的纯度、pH和温度B.水的纯度、是否含有离子杂质、温度 34 C.水的纯度、是否含含有离子杂质、pH和温度D.水是否含有离子杂质、pH和温度 352015版《中国药典》可见异物检查法中,5瓶注射用无菌冻干粉制剂如检出微细可见异物,每瓶中检出微 36 A.1 37 38 39 40 41 42 43 A. 44 C. 45 46 47 C. 48 49 A. 502015年版中国药典中黏度测定法第二法(乌氏毛细管黏度计法)测定温度应为(A) 51 A.25℃±0.1℃B.20℃±0.05℃C.20℃±0.1℃D.25℃±0.05℃ 52下列不属于临用新配的试液是(A)。 53 A.浊度标准原液B.浊度标准液C.碘化钾试液D.淀粉指示液 54颗粒剂溶化性检查时,加热水,搅拌5分钟,立即观察,该热水温度为(C) 55 A.50~60℃B.60~70℃C.70~80℃D.80~90℃ 56药物干燥失重的测定方法不包括(C) 57 A.减压干燥器干燥法B.恒温减压干燥法C.费休式法
产品中心:煤炭行业→ WZDS系列双轴自同步等厚振动筛(法兰式) WZDS系列双轴自同步等厚振动筛工作原理: 两台电动机通过传动轴拖动激振器上的偏心块作反向旋转。两轴上的偏心质量合成的直线或椭圆运动带动筛箱在筛座上经过隔振系统作直线或椭圆运动,物料进入振动着的筛箱在连续不断的抛起前进中以通过筛板达到按颗粒外形大小而分级。 由于双轴自同步椭圆(直线)振动筛没有任何强制同步装置而实现自同步,省去了复杂的同步装置,结构非常简单,操作非常简便。零部件少,故障点少,维修量少,使用成本低。传动路径短,传动部件少,耗能少,节约能源,噪声低。 由于等厚筛分,使物料筛分充分,兼顾筛分效率和处理量。所以筛分效率高,处理量大。 WZDS系列双轴自同步等厚振动筛型号说明: W ZDS □ □ ┬ ┬ ┬ ┬ │ │ │ │ │ │ │ └────────- 筛子长度 │ │ │ │ │ └──────────筛子宽度 │ │ │ └───────────- 等厚振动筛代号 │ └─────────────威猛代号 WZDS系列双轴自同步等厚振动筛安装: 安装前,要检查零部件是否完好、齐全,并对筛机安装基础进行全面清理检查。 安装基础上的预埋钢板和地脚螺栓由用户自备。四个弹簧支承座下的预埋钢板须在同一水平面内。 传动平台的基础应在电动机的高度调整好后,再进行二次浇灌。待隔振架就位,隔振弹簧调整到与
上下支承面均成垂直状态后方可把弹簧座与下部预埋钢板焊牢。焊接时,只许焊弹簧的两侧,不许焊弹簧座的两端。 隔振弹簧在安装前,应对外形尺寸及钢度值进行检查,以保证各组弹簧的刚度和高度保持一致,弹簧安装好后,要求所有的弹簧与上下支撑面保持垂直。 激振器与筛箱在出厂时已装好,并一起发运,安装现场须对原装配情况进行检查,并重新紧固连接件,若安装时已超过设备出厂时间六个月,应将激振器拆开,将各零件清洗后重新安装,在轴承内注入适量的二硫化钼3号锂基脂,一个月加注一次润滑油。重新安装激振器时,要保证同轴各组偏心块的对称中心线在同一平面内。振动器装配完毕后,用转动偏心块,如阻力大或卡死现象。必须找出原因加以调整。 筛机运转时两台电机转向相反。 WZDS系列双轴自同步等厚振动筛使用与维护: 筛机应避免带料起动,起动和运行平稳后再行给料,停车前应先停止给料,待筛面上的物料全部走过后,才能停筛。 工作过程中应经常检查筛机运行是否平稳,若发现运行不正常或有撞击声应立即停车检查。如遇突然事故停机应设法将筛面上的物料排除,以免下次开机时带料起动,影响使用寿命。经常检查筛板与衬板的磨损情况,若发现磨损严重或关键部分出现裂缝,应及时更换或修补。 WZDS系列双轴自同步等厚振动筛技术参数表: WZDS系列双轴自同步等厚振动筛外型尺寸图表:
第三节药品标准 一、药品标准概述 1.药品标准是指对药品的质量指标、生产工艺和检验方法所作的技术要求和规定,内容包括药品的名称、成分或处方的组成;含量及其检查、检验方法;制剂的辅料;允许的杂质及其限量要求以及药品的作用、用途、用法、用量;注意事项;贮藏方法等。中药材、中成药、化学原料药及其制剂,生物制品等应根据各自的特点设置不同的项目。 2.国家药品标准《药品管理法》规定,国务院药品监督管理部门颁布的《中国药典》和药品标准为国家药品标准。 国家药品标准包括《中国药典》及增补本,经国家食品药品监督管理局批准的药品注册标准和颁布的其他药品标准,以及与药品质量指标、生产工艺和检验方法相关的技术指导原则和规范。 二、药品标准的分类 依据《药品管理法》规定,我国的药品标准分为国家药品标准和炮制规范。 1.国家药品标准分类《中国药典》、国家食品药品监督管理局颁布的药品标准和药品注册标准。 (1)《中国药典》由国家药典委员会编纂,国家食品药品监督管理局颁布。《中国药典》是国家药品标准的核心,是国家为保证药品质量、保护人民用药安全有效而制定的法典。 《中国药典》于1953年编纂出版第一版以后,相继于1963年、1977年分别编纂出版。从1985年起每5年修订颁布新版药典,现行版为2010年版《中国药典》。 2010年版《中国药典》是新中国成立以来第九版药典,本版药典收载品种总计4567个,与2005年版《中国药典》相比新增品种1386个;一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。药用辅料标准新增130多种。 (2)国家食品药品监督管理局颁布的药品标准这类药品标准是指未列入《中国药典》而由国家食品药品监督管理局颁布的药品标准,以及与药品质量指标、生产工艺和检验方法相关的技术指导原则和规范。 (3)药品注册标准是指国家食品药品监督管理局批准经申请人特定药品的标准,生产该药品的生产企业必须执行该注册标准。 根据《标准化法》规定和国际惯例,国家标准是市场准入的最低标准,原则上行业标准高于国家标准,企业标准应高于行业标准。所以,药品注册标准不得
药典与药品标准 1.药典 药典是一个国家记载药品规格,质量标准的法典。大多数由国家组织药典委员会编纂,并由政府颁发施行,具有法律的约束力。药典中收载医疗必需、疗效确切、毒副作用小、质量稳定的常用药物及其制剂,规定其质量标准,制备要求,鉴别,杂质检查,功能主治及用法用量等,作为药物生产,检验,供应与使用的依据。药典在一定程度上反映了该国家药物生产、医疗和科技的水平,也体现出医药卫生工作的特点和服务方向。药典在保证人民用药有效安全,促进药物研究和生产上起着重大作用。 新中国成立后,已颁布施行的《中华人民共和国药典》(简称《中国药典》)有1953 、1963 、1977、1985、1990、1995、2000及2005年共八版。除1953年版为一部,2005年版为三部外,其余均分为一部、二部两册。一部收载中药材和中药成方及单方制剂,二部收载化学药品、生化药品、抗生素、放射性药品、生物制品等各类制剂。将《中国生物制品规程》并入药典,设为药典三部。《中国药典》分别由凡例、正文、附录、和索引组成。 目前世界上有38个国家的药典及《国际药典》。我国经常参阅的主要有美国药典(U. S. P.)、英国药典(B.P.)和日本药局方(J. P)等。 2.药品标准 药品标准是国家对药品质量规格及检验方法所做的技术规定,是药品生产、供应、使用、检验和管理部门共同遵循的法定依据。 我国药品标准分为二级。《中国药典》和部(局)颁标准属国家药品标准;各省、自治区、直辖市药品监督管理部门及卫生部门批准的属地方药品标准。药品标准具有法规性质,属强制性标准。凡正式批准生产的药品及药用辅料要执行《中国药典》和部(局)颁标准。中药材、中药饮片分阶段,分品种实施,暂可参照执行省、自治区、直辖市药品监督局制订的《炮制规范》。 药品标准,英美法等国有国家处方集(NF),英国尚有准药典(BPC)等,日本有《日本药局方外药品成分规格》等。 “中华人民共和国卫生部药品标准”中药成方制剂自1989年第一册颁布以来,至1998年8月已发布至20册,总计收载中药成方制剂4061种。
2010版中国药典二部word版电子书 凡例 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。除特别注明版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》二部。 二、国家药品标准由凡例与正文及其引用的附录共同构成。本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。 三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。 四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic
of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。 正文 八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。 附录 十、附录主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称与编排 十一、正文品种收载的中文药品名称系按照《中国药品通用名称》推荐的名称及其命名原则命名,《中国药典》收载的药品中文药品名称均为法定名称;药品英文名除另有规定外,均采用国际非专利药名(International Nonproprietary Names, INN)。
中国药典凡例试卷 部门:姓名:试卷得分: 一.单选题(本大题共10小题,每题只有一个正确选项,选对的得2分,选错的不得分) 1.下列说法中不正确的是() A.凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》 正文、附录及与质量检定有关的共性问题的统一规定。 B.任何违反GMP或有未经批准添加物质所生产的药品,若符合《中国药典》或按照 《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 C.涉及牛源的应取自无牛口蹄疫病地区的健康牛群。 D.供直接分装成注射用无菌粉末的原料药,应按照注射剂项下相应的要求进行检查, 并应符合规定。 2.INN中文翻译为() A.国际纯粹与和化学联合会 B.世界卫生组织 C.国际非专利药名 D.世界动物卫生组织 3.现有10g的溶质,经充分搅拌后,能溶解于1000~10000ml的溶剂中,则按凡例规定,该物质的溶解度是() A.易溶 B.溶解 C.略溶 D.微溶 4.原料药的含量(%),除另有注明者外,均按()计。如规定上限为100%以上时,系指用本药典规定的分析方法测定时可能达到的数值,它为药典规定的限度或允许偏差,并非真实含有量;如未规定上限时,系指不超过() A.数量 100% B.重量 100% C.重量 % D.数量 % 5.表示溶液100g中含有溶质若干毫升可用下列哪个符号表示() A.%(ml/g) B.%(g/g) C.%(ml/ml) D.%(g/ml) 6.下列哪一组符号均可表示重量或体积的比例() ppt pph ppb ppt 7.现有一瓶溶液,发现溶液后标示“(1-10)”,代表了() A. 固体溶质加溶剂制成10ml的溶液 B. 液体溶质加溶剂制成10g的溶液
国际粉体颗粒筛目粒径对照表 2009-2-7 8:59:05 点击:803 来自:技术部石墨筛网目数与粒径的计算和对照: 目数,就是孔数,就是每平方英寸上的孔数目。50目就是指每平方英寸上的孔眼是50个,500目就是500个,目数越高,孔眼越多。除了表示筛网的孔眼外,它同时用于表示能够通过筛网的粒子的粒径,目数越高,粒径越小。一般来说,目数×孔径(微米数)=15000。比如,800目的筛网的孔径为19微米左右;200目的筛网的孔径是75微米左右。由于存在开孔率的问题,也就是因为编织网时用的丝的粗细的不同,不同的国家的标准也不一样,目前存在美国标准、英国标准和日本标准三种,其中英国和美国的相近,日本的差别较大。我国使用的是美国标准,也就是可用上面给出的公式计算。 粉体颗粒大小称颗粒粒度。由于颗粒形状很复杂,通常有筛分粒度、沉降粒度、等效体积粒度、等效表面积粒度等几种表示方法。筛分粒度就是颗粒可以通过筛网的筛孔尺寸,以1英寸(25.4mm)宽度的筛网内的筛孔数表示,因而称之为“目数”。目前在国内外尚未有统一的粉体粒度技术标准,各个企业都有自己的粒度指标定义和表示方法。在不同国家、不同行业的筛网规格有不同的标准,因此“目”的含义也难以统一。目前国际上比较通用等效体积颗粒的计算直径来表示粒径。以μm或mm表示。 用目数来恒量粉体的颗粒大小是不恰当的,正确的做法应该是用粒径(D50,D97)来表示颗粒大小,用目数折算最大粒径。如果大家看过日本关于磨料的标准JIS标准,就会觉得非常科学。他们的每个号的磨料均给出了D3,D50,D97的要求,而且用不同原理的粒度测定仪时的数据是不同的。其中的要求是非常严格的。 表示粒度特性的几个关键指标: ① D50:一个样品的累计粒度分布百分数达到50%时所对应的粒径。它的物理意义是粒径大于它的颗粒占50%,小于它的颗粒也占50%,D50也叫中位径或中值粒径。D50常用来表示粉体的平均粒度。 ② D97:一个样品的累计粒度分布数达到97%时所对应的粒径。它的物理意义是粒径小于它的的颗粒占97%。D97常用来表示粉体粗端的粒度指标。 其它如D16、D90等参数的定义与物理意义与D97相似。 ③ 比表面积:单位重量的颗粒的表面积之和。比表面积的单位为m2/kg或cm2/g。比表面积与粒度有一定的关系,粒度越细,比表面积越大,但这种关系并不一定是正比关系。 粒度分布: 用特定的仪器和方法反映出的不同粒径颗粒占粉体总量的百分数。有区间分布和累计分布两种形式。区间分布又称为微分分布或频率分布,它表示一系列粒径区间中颗粒的百分含量。累计分布也叫积分分布,它表示小于或大于某粒径颗粒的百分含量。粒度分布的表示方法: ① 表格法:用表格的方法将粒径区间分布、累计分布一一列出的方法。 ② 图形法:在直角坐标系中用直方图和曲线等形式表示粒度分布的方法。 ③ 函数法:用数学函数表示粒度分布的方法。这种方法一般在理论研究时用。如著名的Rosin-Rammler分布就是函数分布。目数(mesh)和粒径微米(μm)的换算
凡例(2005年版一部) 凡例 《中华人民共和国药典》简称《中国药典》是国家监督管理药品质量的法 定技术标准。《中国药典》一经国务院药品监督管理部门颁布实施,同品种 的上版标准或其原国家标准即同时停止使用。除特别注明版次外,《中国药 典》均指现行版《中华人民共和国药典》 “凡例”是解释和使用《中国药典》正确进行质量检定的基本指导原则,并把与正文、附录及质量检定有关的共性问题加以规定,避免在全书中重 复说明。“凡例”中的有关规定具有法定的约束力。 凡例和附录中采用“除另有规定外”这一修饰语,表示存在与凡例或附录有关规定未能概括的情况时,在正文各论中另作规定,并按此规定执行。 药典中引用的药品系指本版药典收载的并符合规定的品种。 附录中收载的指导原则,是为执行药典、考察药品质量、起草与复核药品标准所制定的指导性规定。 名称及编排 一、本部正文分三部分排列:药材及饮片;植物油脂和提取物;成方制剂 和单味制剂。 二、正文品种中文名称按笔画数顺序排列,同笔画数的字按起笔笔形─ 丨ノ丶フ顺序排列;单列的饮片排在相应药材的后面,制剂中同一品种凡因规 格不同而臻主标准内容不可须单列者,在其名称后加括号注明规格;附录包括 制剂通则、通用检测方法和指导原则,按分类编码;索引分别按中文索引、汉 语拼音索引、拉丁名索引和拉丁学名索引顺序排列。 三、每一品种项下根据品种和剂型不同,按顺序可分别列有: ⑴中文名称(必要时用括号加注副名),汉语拼音名与拉丁名;⑵来源; ⑶处方;⑷制法;⑸性状;⑹鉴别;⑺检查;⑻浸出物;⑼含量测定;⑽性 味与归经;⑾功能与主治;⑿用法与用量;⒀注意;⒁规格;⒂贮藏;⒃制 剂等。 项目与要求 四、药材的质量标准,一般按干品规定,特殊需用鲜品者,同时规定鲜 品的标准,并规定鲜品用法与用量。 五、药材原植(动)物的科名、植(动)物名、学名、药用部位(矿物 药注明类、族、矿石名或岩石名、主要成分)及采收季节和产地加工等,均 属各该药材的来源范畴。 药用部位一般系指已除去非药用部分的商品药材。采收(采挖等)和产 地加工即对药用部位而言。 六、药材产地加工及炮制规定的干燥方法如下:(1) 烘干、晒干、阴干均 可的,用“干燥”;(2) 不宜用较高温度烘干的,则用“晒干”或“低温干燥”(一般不超过60℃);(3) 烘干、晒干均不适宜的,用“阴干”或“晾干”;(4) 少数药材需
凡例 总则 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。 《中国药典》由一部、二部、三部、四部及其增补本组成。一部收载中药,二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。除特别注明版次外,《中国药典》均指现行版《中国药典》。 本部为《中国药典》一部。 二、国家药品标准由凡例与正文及其引用的通则共同构成。药典收载的凡例与通则对未载入本版药典但经国务院药品监督管理部门颁布的其他中药标准具同等效力。 三、凡例是正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则及与质量检定有关的共性问题的统一规定。 四、凡例和通则中采用“除另有规定外”这一用语,表示存在与凡例或通则有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。 六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP )的产品而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为ChP 。 正文 八、《中国药典》各品种项下收载的内容统称为标准正文,正文系根据药物自身的理化与生物学特性,按照批准的来源、处方、制法和贮藏、运输等条件所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 九、正文项下根据品种和剂型不同,按顺序可分别列有:( 1 )品名;(2 )来源;( 3 )处方;(4 )制法;( 5 )性状;(6 )鉴别;(7 )检查;(8 )浸出物;(9 )特征图谱或指纹图谱;(1 0 )含量测定;(11 )炮制;(12)性味与归经;(13)功能与主治;(14)用法与用量;(15 )注意;(16 )规格;(17 )贮藏;(18) 制剂;(1 9 )附注等。 通则 十、通则主要收载制剂通则、通用检测方法和指导原则。制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。 名称及编排 十一、药材和饮片名称包括中文名、汉语拼音及拉丁名,其中药材和饮片拉丁名排序为属名或属名+种加词在先,药用部位在后;植物油脂和提取物、成方制剂和单味制剂名称不设拉丁名。 十二、正文中未列饮片和炮制项的,其名称与药材名相同,该正文同为药材和饮片标准;正文中饮片炮制项为净制、切制的,其饮片名称或相关项目亦与药材相同。 十三、正文分为药材和饮片、植物油脂和提取物、成方制剂和单味制剂三部分。饮片系指药材经过炮制后可直接用于中医临床或制剂生产使用的处方药品。饮片除需要单列者外,一般并列于药材的正文中,先列药材的项目,后列饮片的项目,中间用“饮片”分开,与药材相同的内容只列出项目名称,其要求用“同药材”表述;不同于药材的内容逐项列出,并规定
药典中样筛孔径如下: 1号筛2000±70μm 10目 2号筛850±29μm 24目 3号筛355±13 50目 4号筛250±9.9 65目 5号筛180±7.6 80目 6号筛150±6.6 100目 7号筛125±5.8 120目 8号筛90±4.6 150目 9号筛75±4.1 200目 目数,是指物料的粒度或粗细度,一般定义是指在1英寸*1英寸的面积内有多少个网孔数,即筛网的网孔数,物料能通过该网孔即定义为多少目数:如200目,就是该物料能通过1英寸*1英寸内有200个网孔的筛网。以此类推,目数越大,说明物料粒度越细,目数越小,说明物料粒度越大。 筛孔尺寸与标准目数对应: 筛孔尺寸:4.75mm 标准目数:4目 筛孔尺寸:4.00mm 标准目数:5目 筛孔尺寸:3.35mm 标准目数:6目 筛孔尺寸:2.80mm 标准目数:7目 筛孔尺寸:2.36mm 标准目数:8目 筛孔尺寸:2.00mm 标准目数:10目 筛孔尺寸:1.70mm 标准目数:12目 筛孔尺寸:1.40mm 标准目数:14目 筛孔尺寸:1.18mm 标准目数:16目 筛孔尺寸:1.00mm 标准目数:18目 筛孔尺寸:0.850mm标准目数:20目 筛孔尺寸:0.710mm标准目数:25目 筛孔尺寸:0.600mm标准目数:30目 筛孔尺寸:0.500mm标准目数:35目 筛孔尺寸:0.425mm标准目数:40目 筛孔尺寸:0.355mm标准目数:45目 筛孔尺寸:0.300mm标准目数:50目 筛孔尺寸:0.250mm标准目数:60目 筛孔尺寸:0.212mm标准目数:70目 筛孔尺寸:0.180mm标准目数:80目 筛孔尺寸:0.150mm标准目数:100目 筛孔尺寸:0.125mm标准目数:120目 筛孔尺寸:0.106mm标准目数:140目 筛孔尺寸:0.090mm标准目数:170目 筛孔尺寸:0.0750mm标准目数:200目 筛孔尺寸:0.0630mm标准目数:230目
中国药典(二部)凡例附录试题 姓名:成绩: 一.填空 1.自建国以来共出版9版药典,现行版为2010年版,实行日期为 2010年7月1号。 2.《中国药典》现行版由一部、二部、三部及其增补本组成,内容分别包括凡例、正文、附录,《中国药典》英文缩写为 Ch.p 。 3.附录主要收载制剂通则、通用检测方法、指导原则。 4.对于生产过程中引入的杂质,应在后续的生产环节中有效去除。 5.任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。 6.除另有规定外,贮藏项下未规定贮藏温度的一般系指常温。 7.HPLC法测定有关物质,在保证灵敏度的前提下,一般以等度洗脱为主;必要时可采用梯度洗脱方式。 8.HPLC法流动相宜选用甲醇-水流动相,尽量不加 缓冲盐。 9.“精密称定”系指称取重量应准确至所取重量的千分之一;“称定”系指称取重量应准确至所取重量的百分之一;取用量为“约”若干时,系指取用量不得超过规定量的 10%;含量测定时,取供试品约0.2g,精密称定,应称取 0.2XXXg 。 10.溶出度指活性药物从片剂、胶囊剂或颗粒剂等制剂在规定条件下溶出的速率和程度。 11.溶出度测定法量取溶出介质实际量取的体积与规定体积的偏差不超过±1% ,实际取样时间与规定时间的差异不得过±2% ,溶出介质温度控制在
37°C±0.5°C 。 12.常用的波长范围, 200-400nm 为紫外光区,400-760nm 为可见光区,2.5-25μm为中红外光区,其皆符合朗伯比尔定律,其关系表达式为 A=lg1/T=Ecl 。 13.微生物限度检查中细菌及控制菌的培养温度为30-35°C ℃,细菌培养时间为 2 天,霉菌和酵母菌的培养时间为 3 天,必要时可延长至 5-7天。14.本版药典中附录电导率检查中,影响只要用水电导率的因素主要有:、、等。 15.试验中规定“按干燥品(或无水物,或无溶剂)计算”时,除另有规定外,应取未经干燥(或未去水、或未去溶剂)的供试品进行试验,并将计算中取用量按检查项下测得的干燥失重(或水分、或试剂)扣除。 16.试验中的“空白试验”,系指在不加供试品或以等量溶剂替代供试液的情况下,按同法操作所耗滴定液的量(ml)与空白试验中所耗滴定液量(ml)之差进行计算。 17.某品种重金属规定,取供试品4.0g,依法检查重金属不得过百万分十,应取标准铅溶液 4 ml。18.标准溶液必须规定有效期,除特殊情况另有规定外,一般规定为 3 个月。标准缓冲液一般可保存 2-3 个月,但发现有浑浊、发霉等现象,不得继续使用。 19.0.01805取三位有效数字是: 0.0180 ,PH=2.464取两位有效数字是 2.46 ,10.1583+1.1+0.208经数据处理后的值为 10.4 ,(2.1064×74.4)/2经数据处理后的值为 78.4 。 20.天平的称量操作方法可分为直接法和减量法,需称取准确重量的供试品常采用减量法。
中国药典与国家药品标准的主要内容 一.单选题 1 问题: 测定旋光度时的测定温度为 答案选项A 、15℃ B 、20℃ C 、25℃ D 、30℃ E 、35℃ 标准答案:B 2 问题: 药品贮藏条件的凉暗处是指 答案选项A 、不超过20℃B 、避光并不超过20℃ C 、指2℃~10℃ D 、10℃~30℃ E 、10℃~25℃ 标准答案:B 3 问题: 恒重系指供试品连续两次干燥或炽灼后的重量差小于 答案选项A 、0.5mg B 、0.6mg C 、0.4mg D 、0.3mg E 、0.2mg 标准答案:D 4 问题: “极易溶解”是指溶质1g(ml)能在溶剂()中溶解 答案选项A 、不到1ml B 、1ml C 、10ml D 、100ml E 、1000 ml 标准答案:A 5 问题: 对于原料药,用“含量测定”的药品,其含量限度均用有效物质的百分数(%)表示,此百分数均系指( )百分数 答案选项A 、体积B 、浓度C 、重量D 、容量E 、摩尔 标准答案:C 6 问题: 药物的英文名应尽量采用世界卫生组织制定的 答案选项A 、ChP B 、INN C 、CADN D 、BNF E 、BHP 标准答案:B 7 问题: 《中国药典》中的“精密称定”指称取重量应准确至所取重量的 答案选项A 、±10%B 、百分之一C 、千分之一D 、万分之一E 、百万分之一 标准答案:C 8 问题: 反相高效液相色谱法常用的流动相为 答案选项A 、氯仿B 、丙酮C 、正已烷D 、甲醇-水E 、乙醇-水 标准答案:D 9 问题: 直接酸碱滴定法测定阿司匹林原料含量时,若滴定过程中阿司匹林发生水解反应, 则会使测定结果 答案选项A 、偏高B 、偏低C 、偏高或偏低D 、准确E 、没有影响 标准答案:A 10 问题: 布洛芬中检查的特殊杂质是 答案选项A 、水杨醛B 、水杨酸C 、苯甲酸D 、苯甲醛E 、有关物质 标准答案:E 11 问题: 气相色谱法和高效液相色谱法中常用于鉴别的参数是 答案选项A 、峰高B 、峰宽C 、保留值D 、分离度E 、理论塔板数 标准答案:C 12 问题: 进行药品鉴别试验是为了 答案选项A 、判断已知药物的真伪B 、判断未知药物的真伪 C 、判断药物的纯度 D 、判断药物的优劣 E 、判断药物的有效性 标准答案:A 13 问题: 药品质量标准中性状项下不包括
何首乌 Heshouwu POLYGONI MULTIFLORI RADIX 本品为蓼科植物何首乌Polygortum muLti florum Thunb.的干燥块根。秋、冬二季叶枯萎时采挖,削去两端,洗净,个大的切成块,干燥。 【性状】本品呈团块状或不规则纺锤形,长6~15cm,直径4~12cm。表面红棕色或红褐色,皱缩不平,有浅沟,并有横长皮孔样突起和细根痕。体重,质坚实,不易折断,断面浅黄棕色或浅红棕色,显粉性,皮部有4~11个类圆形异型维管束环列,形成云锦状花纹,中央木部较大,有的呈木心。气微,味微苦而甘涩。 【鉴别】(1)本品横切面:木拴层为数列细胞,充满棕色物。韧皮部较宽,散有类圆形异型维管束4~11个,为外韧型,导管稀少。根的中央形成层成环;木质部导管较少,周围有管胞和少数木纤维。薄壁细胞含草酸钙簇晶和淀粉粒。 粉末黄棕色。淀粉粒单粒类圆形,直径4~50μm,脐点人字形、星状或三叉状,大粒者隐约可见层纹;复粒由2~9分粒组成。草酸钙簇晶直径10~80(160)μm,偶见簇晶与较大的方形结晶合生。棕色细胞类圆形或椭圆形,壁稍厚,胞腔内充满淡黄棕色、棕色或红棕色物质,并含淀粉粒。具缘纹孔导管直径17~178μm。棕色块散在,形状,大小及颜色深浅不一。 (2)取本品粉末0.25g,加乙醇50ml,加热回流1小时,滤过,滤液浓缩至3ml,作为供试品溶液。另取何首乌对照药材0.25g,同法制成对照药材溶液。照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各2μl,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上使成条状,以三氯甲烷一甲醇(7:3)为展开剂,展至约3.5cm,取出,晾干,再以三氯甲烷一甲醇(20:1)为展开剂,展至约7cm,取出,晾干,置紫外光灯(365nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。 【检查】水分不得过10. 0%(附录ⅨH 第一法)。 总灰分不得过5.0%(附录ⅨK)。 【含量测定】二苯乙烯苷避光操作。照高效液相色谱法(附录ⅥD)测定。 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈一水(25:75)为流动相;检测波长为320nm。理论板数按2,3,5,4’-四羟基二苯乙烯-2-0-β-D-葡萄糖苷峰计算应不低于2000。 对照品溶液的制备取2,3,5,4’-四羟基二苯乙烯-2-0-β-D-葡萄糖苷对照品适量,精密称定,加稀乙醇制成每1ml含0.2mg的溶液,即得。 供试品溶液的制备取本品粉末(过四号筛)约0.2g,精密称定,置具塞锥形瓶中,精密加入稀乙醇25ml,称定重量,加热回流30分钟,放冷,再称定重量,用稀乙醇补足减失的重量,摇匀,静置,上清液滤过,取续滤液,即得。 测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。 本品按干燥品计算,含2,3,5,4’-四羟基二苯乙烯-2-0-β-D-葡萄糖苷(C20H22O9)不得少于1.0%。 结合蒽醌照高效液相色谱法(附录ⅥD)测定。 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇O.l%磷酸溶液(80:20)为流动相;检测波长为254nm。理论板数按大黄素峰计算应不低于3000。 对照品溶液的制备取大黄素对照品、大黄素甲醚对照品适量,精密称定,加甲醇分别制成每1ml含大黄素80μg,大黄素甲醚40μg的溶液,即得。 供试品溶液的制备取本品粉末(过四号筛)约lg,精密称定,置具塞锥形瓶中,精密加入甲醇50ml,称定重量,加热回流1小时,取出,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液5ml作为供试品溶液A(测游离蒽醌用)。另精密量取续滤液25ml,置具塞锥形瓶中,水浴蒸干,精密加8%盐酸溶液20ml,超声处理(功率100W,频率40kHz)5分钟,加三氯甲烷20ml,水浴中加热回流1小时,取出,立即冷却,置分