
《机械制造技术基础》教案 教学内容:典型合金地结晶过程及组织
教学方式:结合实际,由浅如深讲解
教学目地:
1.了解铁碳合金地类型;
2.掌握共析钢.亚共析钢.过共析钢地结晶过程及其组织;
3.掌握共晶白口铸铁.亚共晶白口铸铁.过共晶白口铸铁地结晶过程及其组织.
重点.难点:六种典型合金地结晶过程及组织
教学过程:
4.3 典型铁碳合金地结晶过程及组织
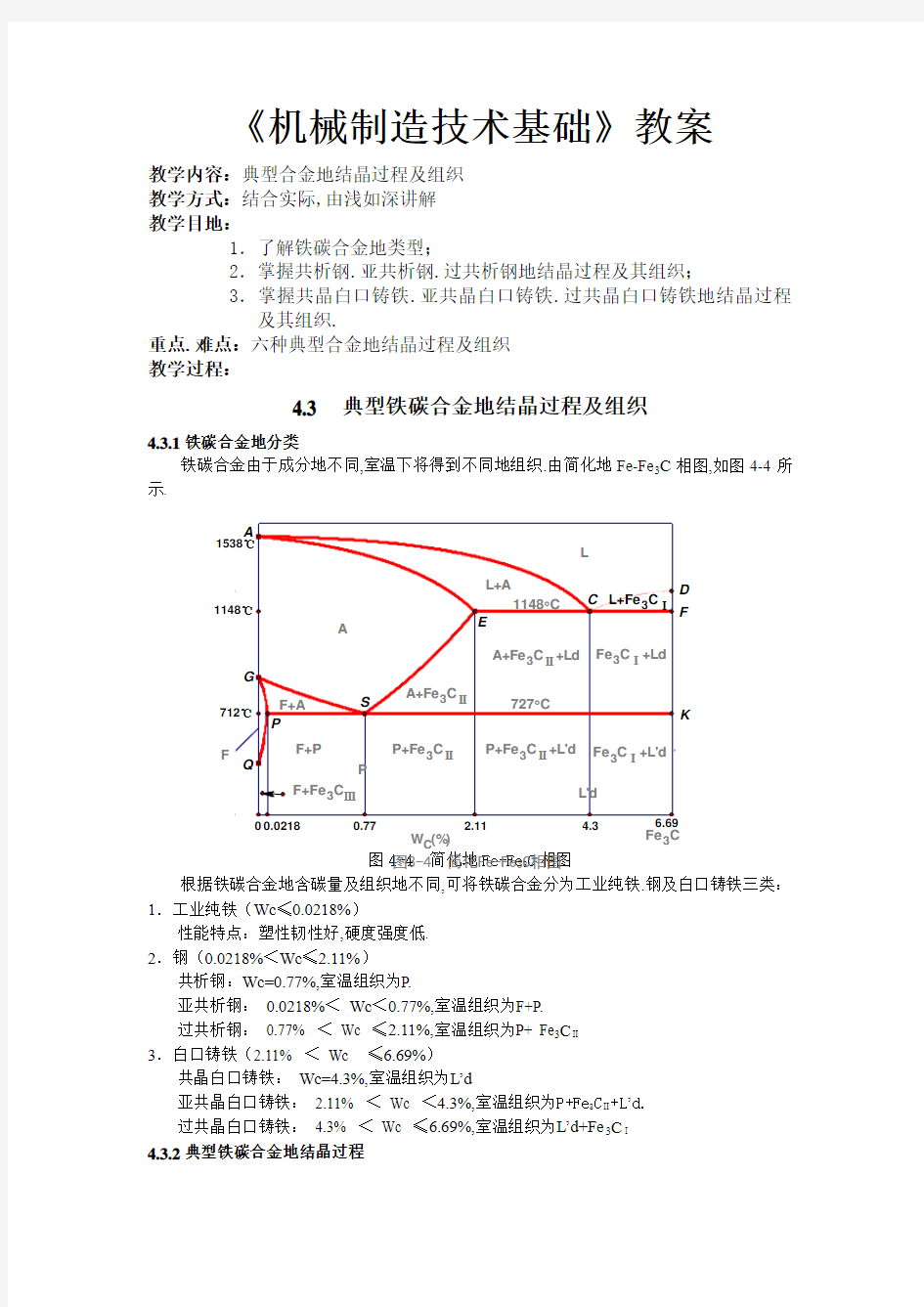
4.3.1铁碳合金地分类
铁碳合金由于成分地不同,室温下将得到不同地组织.由简化地Fe-Fe 3C 相图,如图4-4所示.
图4-4 简化地Fe-Fe 3C 相图 根据铁碳合金地含碳量及组织地不同,可将铁碳合金分为工业纯铁.钢及白口铸铁三类:
1.工业纯铁(Wc ≤0.0218%)
性能特点:塑性韧性好,硬度强度低.
2.钢(0.0218%<Wc ≤2.11%)
共析钢:Wc=0.77%,室温组织为P.
亚共析钢: 0.0218%< Wc <0.77%,室温组织为F+P.
过共析钢: 0.77% < Wc ≤2.11%,室温组织为P+ Fe 3C Ⅱ
3.白口铸铁(2.11% < Wc ≤6.69%)
共晶白口铸铁: Wc=4.3%,室温组织为L’d
亚共晶白口铸铁: 2.11% < Wc <4.3%,室温组织为P+Fe 3C Ⅱ+L ’d. 过共晶白口铸铁: 4.3% < Wc ≤6.69%,室温组织为L’d+Fe 3C Ⅰ
4.3.2典型铁碳合金地结晶过程
Fe 3C W C (%)图3-4 简化Fe-Fe 3C
相图F 0.0218K F
0 2.110.77 4.3D
依据成分垂线与相线相交情况,分析几种典型铁碳合金结晶过程中组织转变规律.
1.共析钢地结晶过程分析(如图4-5.4-6所示):
AC AE PSK S S 3L L+A A P(F+Fe C)??→??→???→共析
图4-5 共析钢结晶过程示意图 图4-6 共析钢金相组织
2.亚共析钢地结晶过程分析(如图4-7.4-8所示):
AC AE GS PSK PSK S L L A A A F A F P F ??→+??→??→+???→+???→+共析
图4-5 亚共析钢结晶过程示意图 图4-6 亚共析钢金相组织 亚共析钢地室温组织特征是:先析铁素体和共析珠光体呈均匀分布.
3.过共析钢地结晶过程分析(如图4-9.4-10所示):
333AC AE ES PSK S PSK L L A A A Fe C A Fe C P Fe C ??→+??→??→+???→+???→+ 共析
图4-9 过共析钢结晶过程示意图 图4-10 过共析钢金相组织 过共析钢地室温组织特征是:珠光体地基体上分布着网状地先析渗碳体(Fe 3C Ⅱ). 本质:钢是以固溶体为基体地组织,特别是在高温下具有单相地奥氏体组织,塑性.韧性好,适于塑性加工.
4.共晶白口铸铁结晶过程分析:
33()'()ECF PSK C L Ld A Fe C L d P Fe C ???→+???→+共晶共析
5.亚共晶白口铸铁结晶过程分析:
33'AC ECF ECF PSK C L L A L A Ld A Fe C L d P Fe C ??→+???→+???→++???→++ 共晶共析
亚共晶白口铸铁结晶过程
亚共晶白口铁地室温组织:莱氏体基体上分布着块状地珠光体
6.过共晶白口铸铁结晶过程分析:
3333'AC ECF ECF PSK C L L Fe C L Fe C Ld Fe C L d Fe C ??→+???→+???→+???→+共晶共析
过共晶白口铁地室温组织:莱氏体地基体上分布着粗大板条状地先晶渗碳体. 小结:略
作业:
1. 说明过共析钢地结晶过程及其组织变化.
2. 说明亚共晶白口铸铁地结晶过程及其组织变化
新课程有效教学案例之 教学案例 教龄:26年
《 晶体的生长》问题训练-评价单 姓名: __________ 班级: _______ 学号: _指导者: ____________ 审 核人 1、 把4C 时饱和的硫酸铜溶液冷却到室温时,观察到的现象是( ) A 、溶液变为无色溶液 B 、有白色沉淀析出 C 、有蓝色沉淀析出 D 、无变化 2、 实验室用氯酸钾和少量二氧化锰制取氧气,氯酸钾完全分解后,从剩余残渣 中回收二氧化锰,下列操作顺序正确的是( ) A 、溶解、蒸发、过滤 B 溶解、过滤、烘干 C 、结晶、溶解、过滤 D 、溶解、烘干、过滤 3、室温下,饱和食盐水露置在空气中一段时间后,有少量晶体析出,这是因为 A 、海水一经降温,就会有大量食盐晶体析出 B 、 加热蒸发硝酸钾溶液,开始就会有大量硝酸钾晶体析出 C 、 硝酸钾饱和溶液可以溶解硝酸钾 D 、将析出硝酸钾后晶体后的溶液在冷却,仍会有硝酸钾晶体析出 5、适宜使用结晶法分离的一组混合物是( ) A 、碳和硫 B 、氯化钠和硝酸钾 C 、硝酸钾和碳酸钾 D 、铁合铜 6关于晒盐原理的说法正确的是( ) A 、 利用阳光和风力,使水分蒸发析出盐 B 、 利用阳光和风力,使氯化钠蒸发出来 C 、 降低温度使氯化钠析出 D 日光照晒后,氯化钠的溶解度变小 7、 把食盐水放在敞口容器里,让水分蒸发,溶液首先达到 _________________ 继续蒸发就会有 ______________ 析出。对溶解度受温度影响不大的固体物 质,一般就采用 ______________________ 的 方法得到固体。 8、 多数物质热的饱和溶液降温后,就会有 _____________ 析出,对溶解度受温度影 ( ) A 、氯化钠溶解度变小 C 、溶剂质量减小 4、下列叙述正确的是( B. 溶液溶质质量分数变小 D 、溶液变成部饱和溶液 )
一、共析钢的结晶过程 图中Ⅰ表示共析钢(Wc=0.77%),合金在1点以上为液体(L),当缓冷至稍低于1点温度时,开始从液体中结晶出奥氏体(A),A的数量随温度的下降而增多。 温度降到2点时,液体全部结晶为奥氏体。2~S点之间,合金是单一奥氏体相。继续缓冷至S点时,奥氏体发生共析转变,转变成珠光体(P)。727℃以下,P基本上不发生变化。故室温下共析钢的组织为P。 共析钢的结晶过程如下图。 二、亚共析钢的结晶过程 图3-6中合金Ⅱ表示亚共析钢。合金在1点以上为液体。缓冷至稍低于1点,开始从液体中结晶出奥氏体,冷却到2点结晶终了。在2~3点区间,合金为单一的奥氏体组织,当冷却到与GS线相交的3点时,开始从奥氏体中析出时,就会将多余的碳原子转移到奥氏体中,引起未转变的奥氏体的含碳量增加。沿着GS线变化。当温度降至4点(727℃)时,剩余奥氏体含碳量增加到了Wc=0.77%,具备了共析转变的条件,转变为珠光体。原铁素体不变保留了在基体中。4点以下不再发生组织变化。故亚共析钢的室温组织为铁素体+珠光体。 亚共析钢的结晶过程如图3-8所示。 三、过共析钢的结晶过程 图3-6中合金Ⅲ表示过共析钢。合金在1点以上为液体,当缓冷至稍低于1点后,开始从液体中结晶出奥氏体,直至2点结晶终了。在2~3点之间是含碳时为合金Ⅲ奥氏组织。缓冷至3点时,奥氏体中开始沿晶界析出渗碳体(即二次渗碳体)。随着温度不断降低,由奥氏体中析出的二次渗碳愈来愈多,而奥氏体中的含碳量不断减少,并沿着ES线变化。3~4点之间的组织为奥氏体+二次渗碳体。降至4点(727℃)时,奥氏体的成分达到了共析成分,于是这部分奥氏体发生共析反应,转变为珠光体。在4点以下,合金的组织不再发生变化。故室温组织为珠光体+二次渗碳体。过共析钢结晶过程如图3-9。
7.4结晶现象教学设计 教学目标: 1.认识晶体及其形成过程;了解结晶现象。 2.初步学习分离混合物的方法。 教学重点:晶体与结晶、混合物的分离。 教学难点:结晶法分离混合物的原理和操作。 教学课时:一课时 教学过程 [复习提问]1.对于50℃的硝酸钾饱和溶液50mL,下列操作后的溶液是否饱和? ①取出10mL后 ②加热至80℃ ③冷却至10℃ ④恒温下加水 ⑤恒温下蒸发水 ⑥恒温下加入KNO3固体 2.已知KNO3的溶解度20℃为32g,40℃为64g。现有100g水与32g KNO3 组成的20℃的饱和溶液,当加热至40℃是,需加入多少克KNO3才能达到饱和? [引入新课]将上述第2题得到的40℃的饱和溶液,又冷却回20 ℃,大家猜想一下可能出现什么现象? [板书]7.4结晶现象 [展示目标] 1、认识晶体及形成过程。 2、了解结晶现象。 3、初步学习分离混合物的方法。 [自学指导1]阅读课本210-211页内容。思考晶体是怎样形成的? [板书]一.晶体:具有一定规则形状的固体。 [观察活动]【实验7-9】晶体可由饱和溶液形成 实验现象:硫酸铜的饱和溶液冷却后,析出蓝色的硫酸铜晶体; 硫酸钠的饱和溶液冷却后,析出无色的硫酸钠晶体。 [板书]二.晶体的形成:形成晶体的过程叫做结晶。 溶质从溶液中结晶出来,有两种方法: 1.保持溶剂的量不变,使溶液的温度降低。 2.蒸发溶剂,使溶剂的量减少; [设问]1.氯化钠与沙子混合在一起,有什么方法使它们分离而得到纯净的氯化钠?
2.氯化钠与硝酸钾两种可溶性固体混合,还能用上述方法吗? [自学指导2]阅读课本211页内容。思考怎样除去粗盐中难溶性杂质? [实验活动]认真观察【实验7-10】,完成课本212页填空。 [板书]三、怎样分离混合物? 1.过滤法:分离不溶性固体和液体的混合物或除去混合物中不溶 性杂质。 2.结晶法:从溶液中得到固体溶质或分离几种可溶性固体混合物。 [操作指引]过滤操作的要点可概括为:一贴:滤纸紧贴在漏斗内壁上。 二低:滤纸边缘低于漏斗边缘,液面低于滤纸边缘。 三靠:盛液烧杯口紧靠在倾斜的玻璃棒中部(让滤液沿玻璃棒缓缓地流入漏斗);玻璃棒末端斜靠三层滤纸一边(避免将滤纸戳穿);漏斗里的液体液面要低于滤纸的边缘(否则液体会从滤纸和漏斗壁之间流下,使固体混入滤液)。 [小结板书] 一.晶体:具有一定规则形状的固体。 二.晶体的形成:形成晶体的过程叫做结晶。 溶质从溶液中结晶出来,有两种方法: 1.保持溶剂的量不变,使溶液的温度降低。 2.蒸发溶剂,使溶剂的量减少; 三、怎样分离混合物? 1.过滤法:分离不溶性固体和液体的混合物或除去混合物中不溶性杂质。 2.结晶法:从溶液中得到溶质或分离几种可溶性固体混合物。
第三章材料的凝固与结晶 第一节凝固的概念第二节金属的结晶和铸锭第三节合金的结晶过程 第一节凝固的概念 目的要求:通过讲授晶体与非晶体的凝固,使学生掌握物质从液态转变为固态所遵循的基本规律. 授课内容: 一,晶体的结晶 二,非晶体的结晶 重点:晶体结晶时过冷现象及热力学条件 难点:晶体与非晶体凝固的不同点 教学方法:课堂讲授并结合多媒体演示 讲授重点内容提要 一,晶体的凝固 物质从液态到固态的转变过程统称为"凝固",如果通过凝固能形成晶体结构,则可称为"晶体".凡纯元素(金属或非金属)的结晶都具有一个严格的"平衡结晶温度"(即理论结晶温度T0),高于此温度(即实际结晶温度T1)才能进行结晶;两者之差ΔT=T0-T1称为过冷度,处于平衡结晶温度时,液体与晶体同时共存,达到可逆平衡. 为什么纯元素的结晶都具有一个严格不变的平衡结晶温度呢?这是因为它们的液体与晶体之间的能量在该温度下能够达到平衡的缘故.这一能量叫做"自由能(F).同一物质的液体与晶体,由于其结构不同,它们在不同温度下的自由能变化是不同的,如图3-1所示. 由此可见,要使液体进行结晶,就必须使其温度低于理论温度,造成液体与晶体间的自由能差:(ΔF=F液-F晶),即具有一定的结晶驱动力才行. 二:非晶体的凝固 若凝固后的物质不是晶体,而是非晶体,那就不能称之为结晶,只能称为凝固.非晶体的凝固与晶体的晶体,都是由液体转化为固体,但本质上又有区别.非晶体的凝固实质上是靠熔体粘滞系数连续加大完成,即非晶体固态可看作粘滞系数很大的"熔体",需在一个温度范围内逐渐完成凝固. 第二节金属的结晶和铸锭
目的要求:通过讲授金属的结晶过程 授课内容: 一:金属的结晶过程 二:金属结晶后的晶粒大小 1:晶粒大小与性能的关系 2:晶粒大小的控制 三:金属铸锭组织 1:表面细晶粒层 2;柱状晶粒层 3:中心等轴晶 重点:凝固的概念,金属结晶的铸锭. 难点:对结晶热力学条件的理解,金属的铸锭组织 讲授重点内容提要: 一:金属的结晶过程 纯金属的结晶过程是在冷却曲线上平台所经历的这段时间内发生的.它是不断形成晶核和晶核不断长大的过程,如图3-3所示.(P38页) 二:金属结晶后的晶粒大小. 1:晶粒大小与性能的关系. 金属结晶后是由许多晶粒组成的多晶体,而晶粒的大小是金属组织的重要标志之一.一般情况下,晶粒愈细小,金属的强度就愈高,塑性和韧性也愈好.表3-1(P39页)说明晶粒大小对纯铁机械性能的影响. 2:晶粒大小的控制 金属结晶后单位体积中晶粒数目Z,取决于结晶时的形核率N(晶核形核数目/S·m㎡)与晶核生长速率G(㎜/s),它们存在着以下的关系:Z∝√N/G,由上可知,当晶粒生长速率G一定时,晶核形核率N愈大,晶粒数目就愈多,反之则愈细. 1):增大过冷度: 金属结晶时的冷却速度愈大,其过冷度便愈大,不同过冷度ΔT对晶核形核率N和生长速率G的影响,如图3-6所示. 2):变质处理: 在液态金属结晶前,加入一些细小的变质剂,使金属结晶时的晶核形核率N
第三章 二元合金的相结构与结晶 (一)填空题 1 合金的定义是两种或两种以上的金属(或金属与非金属)熔合而成具有金属特性的物质。 2.合金中的组元是指 组成合金最基本的、独立的物质 。 3.固溶体的定义是 在固态条件下,一种组元“组分”溶解了其它组元而形成的单相晶态固体 4.Cr 、V 在γ-Fe 中将形成 置换 固溶体。C 、N 则形成 间隙 固溶体。 5.和间隙原子相比,置换原子的固溶强化效果要 差 些。 6.当固溶体合金结晶后出现枝晶偏析时,先结晶出的树枝主轴含有较多的高熔点组元。 7.共晶反应的特征是 由一定成分的恶液相同时结晶出成分一定的两个固相 ,其反应式为 L →a+β 8.匀晶反应的特征是 ,其反应式为 9.共析反应的特征是 ,其反应式为 10.合金固溶体按溶质原子溶入方式可以分为置换固溶体和间隙固溶体,按原子溶入量可以分为 有限固溶体 和 无限固溶体 11.合金的相结构有 固溶体 和 金属化合物 两种,前者具有较高的 塑性变形 性能,适合于做 基体 相;后者有较高的 高硬度 性能,适合于做 增强 相 12.看图4—1,请写出反应式和相区: ABC 包晶反应 B A C L γα?+ ;DEF 共晶反应 F D C L βγ+? ;GHI 共析反应 I G H βαγ+? ; ① L +α ;② γα+ ;③βα+ ;④ βγ+ ;⑤ L +γ ;⑥ β+L ; 13.相的定义是 ,组织的定义是 14.间隙固溶体的晶体结构与溶剂的晶格类型 相同,而间隙相的晶体结构与 溶剂组元晶体结构 不同。 15.根据图4—2填出: 水平线反应式 E C D βαγ+? ;有限固溶体 βα、 、 无限固溶体 γ 。 液相线 ,固相线 , 固溶线 CF 、 EG
三、典型铁碳合金的平衡结晶过程 铁碳相图上的合金,按成分可分为三类: ⑴ 工业纯铁(<0.0218% C ),其显微组织为铁素体晶粒,工业上很少应用。 ⑵ 碳钢(0.0218%~2.11%C ),其特点是高温组织为单相A ,易于变形,碳钢又分为亚共析钢(0.0218%~0.77%C )、共析钢(0.77%C )和过共析钢(0.77%~2.11%C )。 ⑶ 白口铸铁(2.11%~6.69%C ),其特点是铸造性能好,但硬而脆,白口铸铁又分为亚共晶白口铸铁(2.11%~4.3%C )、共晶白口铸铁(4.3%C )和过共晶白口铸铁(4.3—6.69%C ) 下面结合图3-26,分析典型铁碳合金的结晶过程及其组织变化。 图3-26 七种典型合金在铁碳合金相图中的位置 ㈠ 工业纯铁(图3-26中合金①)的结晶过程 合金液体在1~2点之间通过匀晶反应转变为δ铁素体。继续降温时,在2~3点之间,不发生组织转变。温度降低到3点以后,开始从δ铁素体中析出奥氏体,在3~4点之间,随温度下降,奥氏体的数量不断增多,到达4点以后,δ铁素体全部转变为奥氏体。在4~5点之间,不发生组织转变。冷却到5点时,开始从奥氏体中析出铁素体,温度降到6点,奥氏体全部转变为铁素体。在6-7点之间冷却,不发生组织转变。温度降到7点,开始沿铁素体晶界析出三次渗碳体Fe 3C III 。7点以下,随温度下降,Fe 3C III 量不断增加,室温下Fe 3C III 的最大量为: %31.0%1000008.069.60008.00218.03=?--=ⅢC Fe Q 。图3-27为工业纯铁的冷却曲线及组织转变示意图。工业纯铁的室温组织为α+Fe 3C III ,如图3-28所示,图中个别部位的双 晶界内是Fe 3C III 。
《水结冰了》教案 【教学目标】 科学概念: 1、当环境温度低于0℃,水的温度下降到0℃时,水开始结冰,从液体状态变成了固体状态。 2、水在结冰过程中,要向周围放出热量。 过程与方法: 1、观察、记录冰的特征,并比较冰和水的相同与不同。 2、观察水结冰过程中的温度及其他变化。 情感、态度、价值观: 1、乐于在实验观察活动中保持认真、细致的态度。 2、初次感受、体现物质状态的变化。 【教学重点】观察冰的特点和水结冰过程中的温度变化 【教学难点】水为什么会结成冰 【教学准备】小组:观察用冰块及盛放冰块的浅盘,保温杯1只、冰块1杯、试管1支、8 毫升纯净水(或自来水)、水温计1支。 【教学过程】 一、冰的观察 1、师:同学们一定见过冰吧,能说一说冰是什么样子的吗? 2、师:每个小组桌上放着冰,这是老师昨天把水在冰箱的冷冻槽中,今天取出来的一些冰,今天我们就来观察一下冰是怎么样的和水为什么结成冰了。 板书:水结冰了 3、师:接下来我们就来认真的观察冰,及时把冰的特点记录在维恩图中,同时要注意手小心被冰冻坏。 4、学生观察后汇报交流。(预设:冰是没有颜色的、没有气味的、透明的、比较硬、很光滑、温度低、易融化、冰块会浮在水上面、水结冰后占据了更大的空间等。) 5、水是我们上学期所探究过的,它的特点肯定还记得,我们把水和冰做一个比较,及时把结果记录在维恩图中。 6、学生比较后汇报。(预设:水是没有颜色的、没有气味的、透明的、会流动的、没有固定形状的液体等;水和冰的共同点:都是没有颜色的、没有气味的、透明的) 7、师:大家一起来看一下这个维恩图,水和冰的相同点和不同点都展现在这里,水是液体,那么冰呢? (学生发表意见,并请他们阐述原因。) 通过争论得出结论:(1)冰是固体,因为冰具有固体的特点。 (2)水结成冰以后,形态发生了改变,从液体变成固体。 (设计意图:此环节通过观察让学生初步了解冰的特征。水可以变成冰,通过比较渗透由液态水可以变成固态冰的物理变化。) 二、水在什么温度时结冰 1、师:我们知道了把冰放在冰箱冷冻槽内里水会结冰,但水到底是在什么温度的时候会结冰呢?我们一起来探究一下吧。 2、指导学生阅读书P49,然后请学生讲讲这个实验应该怎么做? (预设:(1)在细而短的试管里加入大约8毫升左右的纯净水,用温度计测量并记录试管里水的温度。(2)拿一只塑料杯(为了保温在外面包裹一块干毛巾),在杯内装满碎冰,把试管插入碎冰中。用温度计观试管里的水温的变化。(3)在碎冰里加入很多食盐(加盐可制造更低的温度),保持几分钟持续观测试管里的水温。(4)如果观察到试管里的水开始结冰时,读出温度计的示数。) 3、师:清楚怎么做了吗?请组长来领器材,同时注意轻声交流,仔细观察。 学生实验,教师巡视。 4、汇报交流观察到的现象。师:现在你能回答水在什么温度时会结冰了吗?是什么使水的状态发生了变化? (设计意图:此环节可能需要比较长的时间,学生在动手操作的过程中可能由于种种原因不能很快结冰,教师要引导学生找出原因,比如水不纯、水量太多、试管尽量细短、加入的盐不够等。边“思”变“行”,变“行”边“思”,从而得出温度的变化导致了水结冰。) 5、师:能解释冰箱里的水为什么会结冰了吗? (预设:冰箱中的低温使水向周围放热,温度降低,降到0℃时,使水的状态发生了变化,结成了固态的冰。) 三、拓展。 1、师:通过这节课的学习,你有什么收获吗? 2、师:现在知道为什么冬天有时候河里会结冰了吗?回家也自己去做一块冰。
广东省技工学校文化理论课教案 共 3 页第1页 科目金属 材料 二章一节课题金属的晶体结构 授课 日期 9.14 课 时 1 班级12机电班 授 课方式讲授、分析、演示 作业 题数 2 拟 用 时 间 0.2 小 时 教学目的1、了解金属晶体结构的概念 2、掌握金属晶格的类型 选 用 教 具 挂 图 重 点金属晶格的类型 难 点 金属晶格的类型 教 学 回 顾 第一章内容。 审阅签名:年月日
共 3 页第 2 页导入:由初中所学的物理中,玻璃,松香等引入课题,提问学生,哪些是晶体,哪些是非晶体,然后提问晶体与非晶体的区分引入新课 新课 一、晶体与非晶体 1、晶体:凡原子呈有序、有规则的排例的物体。 非晶体:物质内部凡原子呈无序堆积状况的如松香沥查。 2、晶体与非晶体的区别:晶体有固定熔点非晶体没有。 二、晶体结构的概念 1、晶格和晶胞 晶格是由许多形状、大小相同的最小几何单元重复堆积而成的,能够完整地反映晶格特征的最小几何单元称为晶胞。 2、晶面和晶向 晶体中由一系列原子组成的平面称为晶面 通过两个或两个以上原子中心的直线,可代表晶格空间排列的一定方向,称为晶向 三、金属晶格的类型(画图表达让学生观看) 金属晶格的类型很多(正方晶系、立方晶系正交晶系、六方晶系)等但绝大多数(85%)金属属于以下三种晶格
共 3 页第 3 页 3、体心立方晶格 晶胞是一个立方体,原子位于立方体的八个顶角上和立方体中心原子位于立方体八 个顶角上的原子只有原子的1/8食欲此类型金属有a-Fe(a-铁) 钨(w)钼(Mo)洛(Cr)等。 4、面心立方晶格 晶胞也是立方体,原子位于立方体八个顶角和立方体六个面中心食欲这种类型有铝(Al;)铜(Cu)γ-Fe(γ-铁)等 5、密排六方晶格:晶胞是正六棱柱体,原子排列在柱体每个顶角上和上、下 底面中心,另外三个原子排在柱体内,属于这中类型金属有镁(Mg)锌(Zn)铍(Be)等。 小结 1、晶体与非晶体的区别 2、金属晶格的三种类型 布置作业 1、晶体与非晶体的区别(课堂) 2、P25 1,2(课外)
课题2 溶解度 第1课时 教学目标 一、知识目标 1. 理解饱和溶液和不饱和溶液的涵义。 2. 知道饱和溶液和不饱和溶液的相互转化关系。 3. 能举例说明结晶现象。 二、能力目标 通过实验探究培养学生实验现象的观察、分析,结论的推理归纳能力。 三、情感目标 通过实验条件的改变,让学生感受饱和溶液与不饱和溶液的存在和转化是有条件的,逐步建立辩证的、发展的思想观。 教学重点 理解饱和溶液和不饱和溶液的涵义。 教学难点 确定饱和溶液与不饱和溶液是有前提条件的。 教学过程 一、情景导入 教师手持一杯水,问:“我这些水能溶解多少食盐呢?一勺、两勺?” 过渡:一定量的水中究竟能不能无限制地溶解溶质呢?我们还是让事实说话。 二、新课教学 1. 实验9-5 教师组织学生阅读教材第33页实验9-5,明确实验内容及步骤。 投影方案,以实验简图的形式,更显直观、生动,便于明确情景、理解内容。 精品
教师指导学生进行分组实验。学生观察实验现象,思考、交流。 结论:①5 g NaCl在20 mL水中能溶解完;②10 g NaCl在20 mL水中,杯底有少许固体NaCl,不能溶解完。即NaCl不能无限制溶解在一定量水中。 问题启发:怎么让这部分没溶解的NaCl再溶解掉? 学生:“再加水。” 学生实验验证、体验,然后将实验现象和结论填写在教材第33页的表格中。 教师: 同学们通过实验发现了什么?这个实验事实说明了什么? 学生:水多溶解的食盐就多,水少溶解的食盐就少。水的量一定时溶解的食盐是有限度的。 过渡:KNO3为实验室里化学药品,它在一定量的水中能不能无限制溶解呢? 2. 实验9-6 教师引导学生阅读教材第33页实验9-6,明确实验情景,按步骤进行分组实验。然后提出实验中需思考的问题: (1)溶剂量一定时,温度升高后硝酸钾到哪里去了? (2)溶剂量一定时,温度升高,溶解溶质硝酸钾的量的变化? (3)“在一定量的水中,食盐的溶解量是一定的。”我们从实验9-5得到的这个结论是否严密?如果也升高温度,溶解溶质食盐的量是否也会变? (4)溶剂(水)的量一定、温度一定时,与其所溶解溶质的量有什么关系?所能溶解溶质硝酸钾的量是否有限? 教师指导学生进行分组实验,学生观察实验现象,思考、交流、体验,然后将实验现象和结论填写教材中的表格。 (冷却至有晶体析出,需要一段时间,在此过程中组织学生思考交流) 教师: 同学们通过实验发现了什么?这个实验事实说明了什么? 学生:升高温度,KNO3溶解的量增加。结合生活常识,热水比凉水溶解固体物质的能力强。水的量一定、温度也一定时,溶解的硝酸钾是有限度的。 结论:①5 g KNO3在20 mL水中能溶解完;②10 g KNO3在20 mL水中,杯底有少许固体不能溶解完。即KNO3在一定量水中,一定温度下,不能无限制溶解。 3. 饱和溶液 学生阅读理解教材第34页第一自然段,形成饱和溶液、不饱和溶液概念。 饱和溶液 (1)定义:在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液叫饱和溶液,反之不饱和溶液。 引导学生分析:从以上两个实验中你还能得出什么结论?(从改变温度、溶剂的量 精品
新课程有效教学案例之7.4 教 学 案 例 学校名称:乌丹五中 课程名称: 化学 内容主题:结晶现象 教材版本:科学粤教版 教师姓名:456 教 龄: 26年
《7.4 晶体的生长》问题训练-评价单 姓名:班级:学号:指导者:审核人 1、把4℃时饱和的硫酸铜溶液冷却到室温时,观察到的现象是() A、溶液变为无色溶液 B、有白色沉淀析出 C、有蓝色沉淀析出 D、无变化 2、实验室用氯酸钾和少量二氧化锰制取氧气,氯酸钾完全分解后,从剩余残渣中回收二氧化锰,下列操作顺序正确的是() A、溶解、蒸发、过滤 B、溶解、过滤、烘干 C、结晶、溶解、过滤 D、溶解、烘干、过滤 3、室温下,饱和食盐水露置在空气中一段时间后,有少量晶体析出,这是因为() A、氯化钠溶解度变小 B.溶液溶质质量分数变小 C、溶剂质量减小 D、溶液变成部饱和溶液 4、下列叙述正确的是() A、海水一经降温,就会有大量食盐晶体析出 B、加热蒸发硝酸钾溶液,开始就会有大量硝酸钾晶体析出 C、硝酸钾饱和溶液可以溶解硝酸钾 D、将析出硝酸钾后晶体后的溶液在冷却,仍会有硝酸钾晶体析出 5、适宜使用结晶法分离的一组混合物是() A、碳和硫 B、氯化钠和硝酸钾 C、硝酸钾和碳酸钾 D、铁合铜 6、关于晒盐原理的说法正确的是() A、利用阳光和风力,使水分蒸发析出盐 B、利用阳光和风力,使氯化钠蒸发出来 C、降低温度使氯化钠析出 D日光照晒后,氯化钠的溶解度变小 7、把食盐水放在敞口容器里,让水分蒸发,溶液首先达到 继续蒸发就会有析出。对溶解度受温度影响不大的固体物质,一般就采用的方法得到固体。 8、多数物质热的饱和溶液降温后,就会有析出,对溶解度受温度影
第六章 合金结晶及其组织形态 § 6-1 合金凝固时的溶质分布 一、溶质在液固两相中的分布 1.合金结晶的基本规律 一般合金结晶首先经过匀晶相区; 结晶过程=形核+核长大; 形核为液固界面形成过程,核长大为液固界面向液相区方向推进过程; 无论是否平衡结晶,液固界面上溶质的浓度应分别处于平衡相图的液、固相线上; 无论是否平衡结晶,随温度下降,液固界面上固相成分沿相图固相线变化,液相成分沿相图液相线变化; 造成液固界面成分变化及维持相平衡均由原子的迁移和扩散实现; 不平衡结晶时,晶粒内部与晶界处溶质浓度不同,导致枝晶偏析。 以上总结的结晶基本规律与现象是分析结晶时溶质分布规律的基础。 2.平衡分配系数 具有匀晶转变的合金C 0结晶,液 固界面推进时成分分别沿相图液固 相线变化。若在T 0温度时,液固界 面液相成分为C L ,固相成分为C S , 则定义其比值k 0为平衡分配系数: L s C C k =0 根据相图液、固相线斜率不同, 平衡分配系数有k 0<1及 k 0>1之分。 k 0数值大小反映了液固相线偏离程度或在一定温度下液、固两相中溶质浓度的差别程度。k 0<1时的值越小及 k 0>1时的值越大,液、固两相中溶质平衡浓度差别越大。 若将液、固相线近似看作直线,则在任何温度下k 0均为常数。
二、平衡结晶时的溶质分布 结晶条件:平衡结晶,溶质有充分时间迁移,在液固两相中完全混合。 合金成分为C0的合金结晶,k0<1(固相中溶质含量低于液相)。取铸模中结晶单元体,或单向散热的棒状合金模型,设液固界面推进方向与散热方向相反,结晶总长为L。根据平衡相图,分析由于溶质分布在界面和内部的变化引起界面推进而形成结晶的过程如下: 不断降温使上述过程持续,最终在凝固终了温度使固相整体达到C0成分,结晶结束。 在固相中,成分均匀化依靠原子扩散,速率较小; 在液相中,成分均匀化除依靠原子扩散外,更依靠液体中的对流,速率较快。 三、液相完全混合时的溶质分布 结晶条件:缓慢结晶。固相中溶质扩散较慢而近似认为原子在固相中无混合,液相中溶质有时间可以均匀混合。 由于液相混合充分,任一温度下液相界面和内部成分相同,可按液相线变化。固相中溶质不能混合,则界面成分按固相线变化,内部成分连续变化,平均成分偏离固相线。
第三章 二元合金的相结构与结晶 (一)填空题 1 合金的定义是两种或两种以上的金属(或金属与非金属)熔合而成具有金属特性的物质。 2.合金中的组元是指 组成合金最基本的、独立的物质 。 3.固溶体的定义是 在固态条件下,一种组元“组分”溶解了其它组元而形成的单相晶态固体 4.Cr 、V 在γ-Fe 中将形成 置换 固溶体。C 、N 则形成 间隙 固溶体。 5.和间隙原子相比,置换原子的固溶强化效果要 差 些。 6.当固溶体合金结晶后出现枝晶偏析时,先结晶出的树枝主轴含有较多的高熔点组元。 7.共晶反应的特征是 由一定成分的恶液相同时结晶出成分一定的两个固相 ,其反应式为 L →a+β 8.匀晶反应的特征是 ,其反应式为 9.共析反应的特征是 ,其反应式为 10.合金固溶体按溶质原子溶入方式可以分为置换固溶体和间隙固溶体,按原子溶入量可以分为 有限固溶体 和 无限固溶体 11.合金的相结构有 固溶体 和 金属化合物 两种,前者具有较高的 塑性变形 性能,适合于做 基体 相;后者有较高的 高硬度 性能,适合于做 增强 相 12.看图4—1,请写出反应式和相区: ABC 包晶反应 B A C L γα?+ ;DEF 共晶反应 F D C L βγ+? ;GHI 共析反应 I G H βαγ+? ; ① L +α ;② γα+ ;③βα+ ;④ βγ+ ;⑤ L +γ ;⑥ β+L ; 13.相的定义是 ,组织的定义是 14.间隙固溶体的晶体结构与溶剂的晶格类型 相同,而间隙相的晶体结构与 溶剂组元晶体结构 不同。 15.根据图4—2填出: 水平线反应式 E C D βαγ+? ;有限固溶体 βα、 、 无限固溶体 γ 。 液相线 ,固相线 , 固溶线 CF 、 EG
新课程有效教学案例之 教 学 案 例 学校名称:乌丹五中 课程名称: 化学 内容主题:结晶现象 教材版本:科学粤教版 教师姓名:456 教 龄: 26年
《晶体的生长》问题训练-评价单 姓名:班级:学号:指导者:审核人 1、把4℃时饱和的硫酸铜溶液冷却到室温时,观察到的现象是() A、溶液变为无色溶液 B、有白色沉淀析出 C、有蓝色沉淀析出 D、无变化 2、实验室用氯酸钾和少量二氧化锰制取氧气,氯酸钾完全分解后,从剩余残渣中回收二氧化锰,下列操作顺序正确的是() A、溶解、蒸发、过滤 B、溶解、过滤、烘干 C、结晶、溶解、过滤 D、溶解、烘干、过滤 3、室温下,饱和食盐水露置在空气中一段时间后,有少量晶体析出,这是因为() A、氯化钠溶解度变小 B.溶液溶质质量分数变小 C、溶剂质量减小 D、溶液变成部饱和溶液 4、下列叙述正确的是() A、海水一经降温,就会有大量食盐晶体析出 B、加热蒸发硝酸钾溶液,开始就会有大量硝酸钾晶体析出 C、硝酸钾饱和溶液可以溶解硝酸钾 D、将析出硝酸钾后晶体后的溶液在冷却,仍会有硝酸钾晶体析出 5、适宜使用结晶法分离的一组混合物是() A、碳和硫 B、氯化钠和硝酸钾 C、硝酸钾和碳酸钾 D、铁合铜 6、关于晒盐原理的说法正确的是() A、利用阳光和风力,使水分蒸发析出盐 B、利用阳光和风力,使氯化钠蒸发出来 C、降低温度使氯化钠析出 D日光照晒后,氯化钠的溶解度变小 7、把食盐水放在敞口容器里,让水分蒸发,溶液首先达到 继续蒸发就会有析出。对溶解度受温度影响不大的固体物质,一般就采用的方法得到固体。 8、多数物质热的饱和溶液降温后,就会有析出,对溶解度受温度影
《机械制造技术基础》教案 教学内容:典型合金的结晶过程及组织 教学方式:结合实际,由浅如深讲解 教学目的: 1.了解铁碳合金的类型; 2.掌握共析钢、亚共析钢、过共析钢的结晶过程及其组织; 3.掌握共晶白口铸铁、亚共晶白口铸铁、过共晶白口铸铁的结晶过程及其组织。 重点、难点:六种典型合金的结晶过程及组织 教学过程: 4.3 典型铁碳合金的结晶过程及组织 4.3.1铁碳合金的分类 铁碳合金由于成分的不同,室温下将得到不同的组织。由简化的Fe-Fe 3C 相图,如图4-4所示。 图4-4 简化的Fe-Fe 3C 相图 根据铁碳合金的含碳量及组织的不同,可将铁碳合金分为工业纯铁、钢及白口铸铁三类: 1.工业纯铁(Wc ≤0.0218%) 性能特点:塑性韧性好,硬度强度低。 2.钢(0.0218%<Wc ≤2.11%) 共析钢:Wc=0.77%,室温组织为P 。 亚共析钢: 0.0218%< Wc <0.77%,室温组织为F+P 。 过共析钢: 0.77% < Wc ≤2.11%,室温组织为P+ Fe 3C Ⅱ 3.白口铸铁(2.11% < Wc ≤6.69%) 共晶白口铸铁: Wc=4.3%,室温组织为L’d 亚共晶白口铸铁: 2.11% < Wc <4.3%,室温组织为P+Fe 3C Ⅱ+L ’d 。 过共晶白口铸铁: 4.3% < Wc ≤6.69%,室温组织为L’d+Fe 3C Ⅰ 4.3.2典型铁碳合金的结晶过程 Fe 3C W C (%)图3-4 简化Fe-Fe 3C 相图F 0.0218K F 0 2.110.77 4.3D
依据成分垂线与相线相交情况,分析几种典型铁碳合金结晶过程中组织转变规律。 1.共析钢的结晶过程分析(如图4-5、4-6所示): AC AE PSK S S 3L L+A A P(F+Fe C)??→??→???→共析 图4-5 共析钢结晶过程示意图 图4-6 共析钢金相组织 2.亚共析钢的结晶过程分析(如图4-7、4-8所示): AC AE GS PSK PSK S L L A A A F A F P F ??→+??→??→+???→+???→+共析 图4-5 亚共析钢结晶过程示意图 图4-6 亚共析钢金相组织 亚共析钢的室温组织特征是:先析铁素体和共析珠光体呈均匀分布。 3.过共析钢的结晶过程分析(如图4-9、4-10所示): 333AC AE ES PSK S PSK L L A A A Fe C A Fe C P Fe C ??→+??→??→+???→+???→+共析
过滤和结晶教学目的 知识:了解用过滤和结晶的方法分离混合物的原理。 能力:培养学生观察能力、实验操作能力、思维能力。 思想教育:培养学生严肃认真、严谨求实的学习方法和科学态度。 教学重点 用过滤和结晶的方法分离混合物的原理。 教学方法 实验讨论法。 教学用具 仪器:烧杯、漏斗、玻璃棒、试管、试管夹、铁架台、铁环、滤纸、酒精灯、药匙。 药品:硝酸钾、氯化钠、明矾、胆矾。 其它:投影仪、火柴、粗盐、溶解度曲线图。 教学过程
附1:课堂练习一 1.粗盐提纯的主要步骤有__、__、__,使用的主要仪器有__、__、__、__、__、__、__、__、__、__。 2.二氧化碳通入石灰水,石灰水变浑浊,将浑浊液过滤,留在滤纸上的是__。 3.欲从氯酸钾和二氧化锰混合加热制取氧气(充分反应)的剩余固体物质中提取氯化钾并得氯化钾晶体,实验步骤有①加热蒸发,②过滤,③溶解,上述操作正确顺序是__。 附2:课堂练习二 4.把食盐水放在敞口容器中,让水分慢慢蒸发,溶液先达到__,继续蒸发就会有__析出。对溶解度受温度影响不大的固体物质,一般就用__的方法得到固体。 5.多数物质热的饱和溶液降温后,就会有__析出,对溶解度受温度影响变化大的固体物质,要得到晶体一般就采用____的方法。 6.在温度不变的情况下,析出晶体后的溶液一定是____溶液。 附3:课堂练习答案 1.溶解过滤蒸发烧杯玻璃棒漏斗铁架台药匙量筒天平砝码蒸发皿酒精灯 2.碳酸钙 2 1 4.饱和晶体 蒸发溶剂 5.晶体冷却热饱和溶液 6.饱和 附4:随堂检测
1.某温度时,从饱和溶液中得到晶体一般有两种方法。溶解度受温度影响大的固体,一般采用____的方法。溶解度受温度影响小的固体,一般采用____的方法。 2.采用__方法可以把不溶于液体的固体和液体分开。 3.温度不变的情况下,将一瓶氯化钠饱和溶液蒸发部分溶剂,有氯化钠晶体从溶液中析出,则 [ ] A.溶液变为不饱和溶液 B.溶液仍是饱和溶液 C.溶质的溶解度减小 D.溶液中溶剂质量不变 4.能用结晶方法分离的一组混合物是 [ ] A.氯化钾和二氧化锰 B.食盐和硝酸钾 C.氯化钠和氯化钾 D.铜粉和铁粉
第八节合金的晶体结构与结晶过程 一、基本概念 ●组成合金最基本的、独立的物质称为组元。 ●由两种或两种以上的组元按不同比例配制而成的一系列不同化学成分的所有合金,称为合金系。 ●相是指在一个合金系统中具有相同的物理性能和化学性能,并与该系统的其余部分以界面分开的部分。 ●组织是指用金相观察方法,在金属及其合金内部看到的涉及晶体或晶粒的大小、方向、形状、排列状况等组成关系的构造情况。 二、合金的晶体结构 根据合金中各组元之间的相互作用,合金中的晶体结构可分为固溶体、金属化合物及机械混合物三种类型。 (一)固溶体 ●合金在固态下一种组元的晶格内溶解了另一种原子而形成的晶体相,称为固溶体。 根据溶质原子在溶剂晶格中所占位置的不同,可将固溶体分为置换固溶体和间隙固溶体。 1.置换固溶体 ●溶质原子代替一部分溶剂原子,占据溶剂晶格的部分结点位置时,所形成的晶体相,称为置换固溶体。 按溶质溶解度的不同,置换固溶体又可分为有限固溶体和无限固溶体。 a) 置换固溶体 b) 间隙固溶体 图1-32 固溶体的类型 2.间隙固溶体 ●溶质原子在溶剂晶格中不占据溶剂晶格的结点位置,而是嵌入溶剂晶格的各结点之间的间隙内时,所形成的晶体相,称为间隙固溶体。 无论是置换固溶体,还是间隙固溶体,异类原子的插入都将使固溶体晶格发生畸变,增加位错运动的阻力,使固溶体的强度、硬度提高。这种通过溶入溶质原子形成固溶体,使合
金强度、硬度升高的现象称为固溶强化。固溶强化是强化金属材料的重要途径之一。 a)间隙固溶体 b)置换固溶体(大溶质原子) c)固溶体(小溶质原子) 图1-33 形成固溶体时产生的晶格畸变 (二)金属化合物 ●金属化合物是指合金中各组元之间发生相互作用而形成的具有金属特性的一种新相。 金属化合物具有与其构成组元晶格截然不同的特殊晶格,熔点高,硬而脆。 (三)机械混合物 ●由两相或两相以上组成的多相组织,称为机械混合物。 在机械混合物中各组成相仍保持着它原有晶格的类型和性能,而整个机械混合物的性能则介于各组成相的性能之间,并与各组成相的性能以及相的数量、形状、大小和分布状况等密切相关。 三、合金结晶过程 合金的结晶过程与纯金属一样,也是晶核形成和晶核长大两个过程。同时结晶时也需要一定的过冷度,结晶后形成由多晶体。合金的结晶过程中具有如下特点: (1)纯金属的结晶是在恒温下进行,只有一个结晶温度。而绝大多数合金是在一个温度范围内进行结晶的,一般结晶的开始温度与终止温度是不相同,一般有两个结晶温度。 (2)合金在结晶过程中,在局部范围内相的化学成分(即浓度)有差异,当结晶终止后,整个晶体的平均化学成分与原合金的化学成分相同。 (3)合金结晶后一般有三种情况:第一种情况是形成单相固溶体;第二种情况是形成单相金属化合物或同时结晶出两相机械混合物(如共晶体);第三种情况是结晶开始时形成单相固溶体,剩余液体又同时结晶出两相机械混合物(如共晶体)。 四、合金结晶冷却曲线 合金结晶过程比纯金属复杂得多,但其结晶过程仍可用结晶冷却曲线来描述。一般合金的结晶冷却曲线有以下三种形式:
7.4 结晶现象 教学目标 1.认识晶体及其形成过程。 2.了解结晶现象。 3.初步学习分离混合物的方法。 教学重点 晶体与结晶、混合物的分离。 教学难点 结晶法分离混合物的原理和操作。 教学课时 一课时 教学过程 [复习提问]1.对于50℃的硝酸钾饱和溶液50mL,下列操作后的溶液是否饱和? ①取出10mL后②加热至80℃③冷却至10℃ ④恒温下加水⑤恒温下蒸发水⑥恒温下加入KNO3固体 2.已知KNO3的溶解度20℃为32g,40℃为64g。现有100g水与32g KNO3组成的20℃的饱和溶液,当加热至40℃是,需加入多少克KNO3 才能达到饱和? [引入新课]将上述第2题得到的40℃的饱和溶液,又冷却回20℃,大家猜想一下可能出现什么现象? [板书]一.晶体:具有一定规则形状的固体。 [阅读]P.210图7-14 美丽奇特的晶体 [设问]晶体是怎样形成的? [板书]二.晶体的形成 [观察活动]【实验7-9】晶体可由饱和溶液形成(完成课本空白) [板书]形成晶体的过程叫做结晶。 [讲解]在实际生产中,常常需要是物质从溶液中结晶析出,如从蔗汁中提取砂糖,从海水中提取精盐。
[讲解]晶体析出后剩下的溶液叫母液,母液是该温度下的饱和溶液。 [设问]1.氯化钠与沙子混合在一起,有什么方法使它们分离而得到纯净的氯化钠?(讨论、交流,归纳出“溶解→过滤→蒸发) 2.氯化钠与硝酸钾两种可溶性固体混合,还能用上述方法吗? [板书]三.怎样分离混合物 [探究活动]分离硝酸钾与氯化钠的混合物 [板书]1.过滤法:分离不溶性固体和液体的混合物或除去混合物中不溶性杂质。 2.结晶法:从溶液中得到固体溶质或分离几种可溶性固体混合物。[讲解]P.211图7-10 用结晶法提纯固体物质 操作指引——过滤操作 [补充]结晶法的应用——两种方法四种情况 两种方法:冷却热饱和溶液法和蒸发溶剂法 四种情况与两种方法的关系: 1.将溶解度受温度影响变化大得固体溶质从其水溶液中析出(如将 KNO3从其水溶液中析出),一般采用冷却热饱和溶液法。 2.将溶解度受温度影响变化不大的固体溶质从其水溶液中析出(如 将NaCl从其水溶液中析出),一般采用蒸发溶剂法。 3.溶解度受温度影响很大的固体中,混有少量溶解度受温度影响小 的固体(如KNO3中混有NaCl),采用冷却热饱和溶液法。 4.溶解度受温度影响不大的固体中混有少量溶解度受温度影响很大 的固体(如NaCl中混有KNO3),采用蒸发溶剂法。 [小结]1.有规则形状的固体称为晶体,形成晶体的过程称为结晶。 2.两种固体混合后的分离方法: 过滤法——分离不溶性固体和液体的混合物或除去混合物中不溶 性杂质 结晶法——从溶液中得到固体溶质或分离几种可溶性固体混合物。[布置作业]现有两种同一温度下的溶液,一瓶是氯化钾的饱和溶液,一瓶是氯化钾的不饱和溶液,请你至少用三种方法把它们区别开来。
《机械制造技术基础》教案 教学内容:典型合金地结晶过程及组织 教学方式:结合实际,由浅如深讲解 教学目地: 1.了解铁碳合金地类型; 2.掌握共析钢.亚共析钢.过共析钢地结晶过程及其组织; 3.掌握共晶白口铸铁.亚共晶白口铸铁.过共晶白口铸铁地结晶过程及其组织. 重点.难点:六种典型合金地结晶过程及组织 教学过程: 4.3 典型铁碳合金地结晶过程及组织 4.3.1铁碳合金地分类 铁碳合金由于成分地不同,室温下将得到不同地组织.由简化地Fe-Fe 3C 相图,如图4-4所示. 图4-4 简化地Fe-Fe 3C 相图 根据铁碳合金地含碳量及组织地不同,可将铁碳合金分为工业纯铁.钢及白口铸铁三类: 1.工业纯铁(Wc ≤0.0218%) 性能特点:塑性韧性好,硬度强度低. 2.钢(0.0218%<Wc ≤2.11%) 共析钢:Wc=0.77%,室温组织为P. 亚共析钢: 0.0218%< Wc <0.77%,室温组织为F+P. 过共析钢: 0.77% < Wc ≤2.11%,室温组织为P+ Fe 3C Ⅱ 3.白口铸铁(2.11% < Wc ≤6.69%) 共晶白口铸铁: Wc=4.3%,室温组织为L’d 亚共晶白口铸铁: 2.11% < Wc <4.3%,室温组织为P+Fe 3C Ⅱ+L ’d. 过共晶白口铸铁: 4.3% < Wc ≤6.69%,室温组织为L’d+Fe 3C Ⅰ 4.3.2典型铁碳合金地结晶过程 Fe 3C W C (%)图3-4 简化Fe-Fe 3C 相图F 0.0218K F 0 2.110.77 4.3D
依据成分垂线与相线相交情况,分析几种典型铁碳合金结晶过程中组织转变规律. 1.共析钢地结晶过程分析(如图4-5.4-6所示): AC AE PSK S S 3L L+A A P(F+Fe C)??→??→???→共析 图4-5 共析钢结晶过程示意图 图4-6 共析钢金相组织 2.亚共析钢地结晶过程分析(如图4-7.4-8所示): AC AE GS PSK PSK S L L A A A F A F P F ??→+??→??→+???→+???→+共析 图4-5 亚共析钢结晶过程示意图 图4-6 亚共析钢金相组织 亚共析钢地室温组织特征是:先析铁素体和共析珠光体呈均匀分布. 3.过共析钢地结晶过程分析(如图4-9.4-10所示): 333AC AE ES PSK S PSK L L A A A Fe C A Fe C P Fe C ??→+??→??→+???→+???→+ 共析