
物理化学公式复习资料
第一章热力学第一定律
1、热力学三大系统:
(1)敞开系统:有物质和能量交换;
(2)密闭系统:无物质交换,有能量交换;
(3)隔绝系统(孤立系统):无物质和能量交换。
2、状态性质(状态函数):
(1)容量性质(广度性质):如体积,质量,热容量。
数值与物质的量成正比;具有加和性。
(2)强度性质:如压力,温度,粘度,密度。
数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。
特征:往往两个容量性质之比成为系统的强度性质。
3、热力学四大平衡:
(1)热平衡:没有热隔壁,系统各部分没有温度差。
(2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力相同
(3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而变化。
(4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随时间而变化。
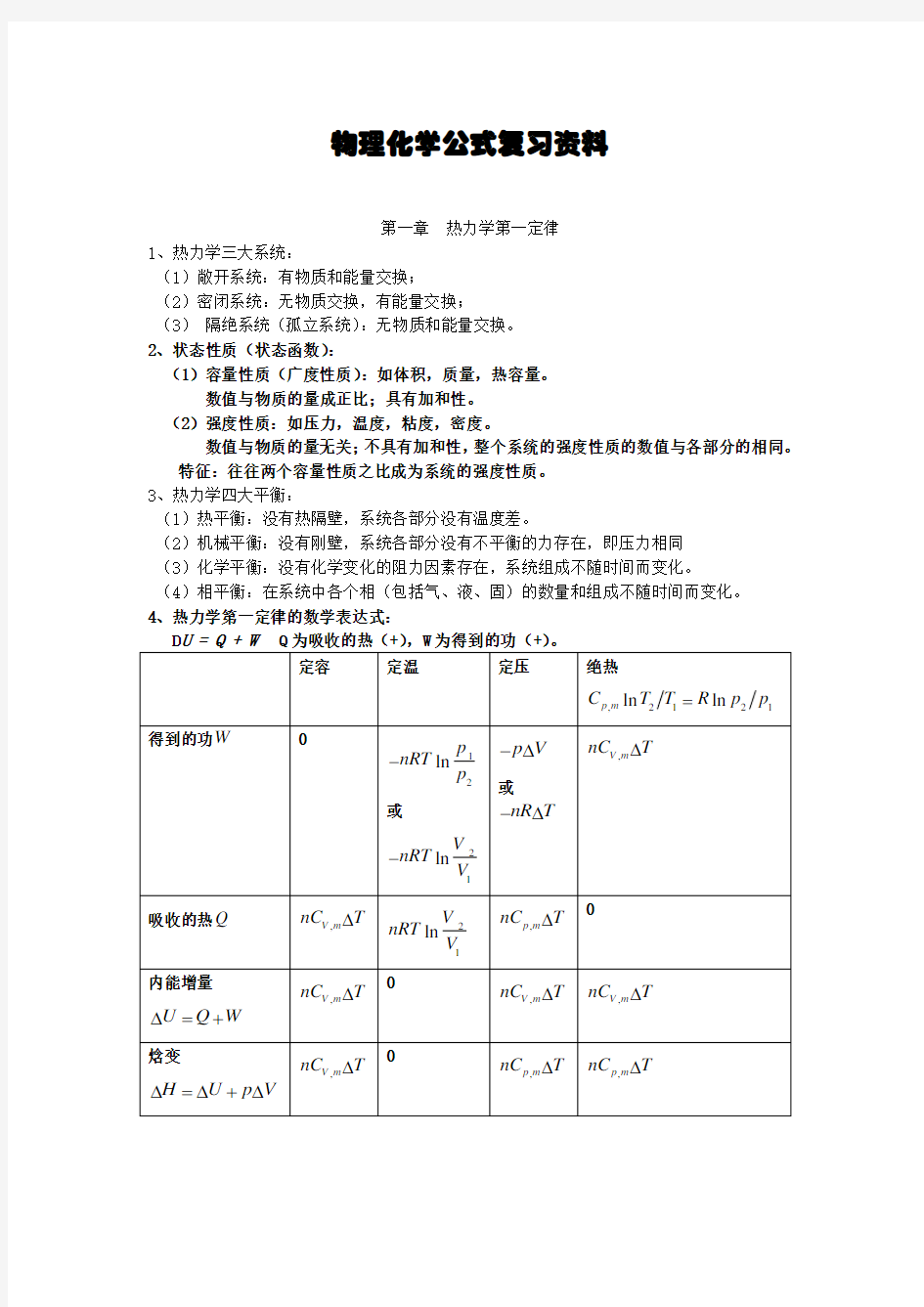
4、热力学第一定律的数学表达式:
12、在通常温度下,对理想气体来说,定容摩尔热容为:
单原子分子系统 ,V m C =
32
R 双原子分子(或线型分子)系统 ,V m C =52R 多原子分子(非线型)系统 ,V m C 6
32
R R == 定压摩尔热容:
单原子分子系统 ,52
p m C R =
双原子分子(或线型分子)系统 ,,p m V m C C R -=,72
p m C R = 多原子分子(非线型)系统 ,4p m C R = 可以看出:
,,p m V m C C R -=
13、,p m C 的两种经验公式:,2p m C a bT cT =++ (T 是热力学温度,a,b,c,c ’ 是经
,2'
p m c C a bT T
=++
验常数,与物质和温度范围有关) 14、在发生一绝热过程时,由于0Q δ=,于是dU W δ=
理想气体的绝热可逆过程,有:,V m nC dT pdV =-
? 22
,11
ln
ln V m T V C R T V =- 21,12ln ,ln V m p V C Cp m p V ?= ,,p m
V m
C pV C γγ=常数 =
>1.
15、-焦耳汤姆逊系数:J T T =(
)H p
μ??- J T μ->0 经节流膨胀后,气体温度降低; J T μ-<0 经节流膨胀后,气体温度升高; J T μ-=0 经节流膨胀后,气体温度不变。
16、气体的节流膨胀为一定焓过程,即0H ?=。
17、化学反应热效应:在定压或定容条件下,当产物的温度与反应物的温度相同而在反应过
程中只做体积功不做其他功时,化学反应所吸收或放出的热,称为此过程的热效应,或“反应热”。 18、化学反应进度:()()()
n B n B B ξν-=
末初
(对于产物v 取正值,反应物取负值)
1ξ=时,r r m U
U ξ??=
,r r m H
H ξ
??=
19、(1)标准摩尔生成焓(0
r m H ?):在标准压力和指定温度下,由最稳定的单质生成单位
物质的量某物质的定压反应热,为该物质的标准摩尔生成焓。 (2)标准摩尔燃烧焓(0
c m H ?):在标准压力和指定温度下,单位物质的量的某种物质
被氧完全氧化时的反应焓,为该物质的标准摩尔燃烧焓。
任意一反应的反应焓0
r m H ?等于反应物燃烧焓之和减去产物燃烧焓之和。 20、反应焓与温度的关系-------基尔霍夫方程
()()r B A p p p p p p H H H C B C A C T T T ??????????
=-=-=?
? ? ??????????
()()()()
210,021p p p C H T H H C T T ?=???>?-?=?-
0,Cp ?<即产物热容小于反应物热容,则 ()0p H T ???<,即温度升高时反应焓减小。 0,Cp ?>即产物热容大于反应物热容,则 ()0p H T ???>,即温度升高时反应焓增大。 0,p C ?=或很小时,反应焓将不随温度而改变。
21、基尔霍夫方程的应用: ()()()2121p H H C T T ?-?=?-
适用条件:温度变化范围不大时,将 p C ?近似看作常数,与温度无关。
第二章 热力学第二定律
1、热力学第二定律的经典表述:人们不可能设计成这样一种机器,这种机器能不断循环工
作,它仅仅从单一热源吸热变为功而没有任何其他变化。
2、卡诺循环:
过程1 保持T 2定温可逆膨胀。故2
2121
ln
V Q W RT V =-= 过程2 绝热可逆膨胀。由于系统不吸热,0Q =,故 212()V W U C T T =?=- 过程3 保持T 1定温可逆压缩。故 4
1313
ln V Q W RT V =-= 过程4 绝热可逆压缩。故 421()V W U C T T =?=- 卡诺热机的效率:2122W T T Q T η--=
= 制冷效率:1
21
T T T β=- 3、卡诺定理:
(1)在两个不同温度的热源之间工作的任意热机,以卡渃热机的效率为最大。否则将违
反热力学第二定律。
(2)卡诺热机的效率只与两个热源的温度有关,而与工作物质无关。否则也将违反热力学
第二定律。
4、热力学第二定律人数学表达式--------克劳修斯不等式 Q dS T
δ≥
dS 是系统的熵变,Q δ是实际过程中传递的热,T 是热源温度,
Q
T
δ是实际过程中的热温商。该式的等号适用于可逆过程;大于号适用于不可逆过程。它的含义是:
(1) 假如某一过程的发生将使系统的熵变大于热温商,则该过程是一个不违反热力学第
二定律的、有可能进行的不可逆过程。
(2) 假如某一过程发生时,系统的熵变为热温商相等地,则该过程是一个可逆过程。 (3) Q dS T
δ<
的过程不可能发生。
(4) 克劳修斯不等式用于孤立系统时,0dS ≥,即孤立系统中所发生的任意过程总是向
着熵增大的方向进行。
5、熵变的计算:
(1)定温过程中的熵变:2
21112
ln
ln ln r V nRT Q V p V S nR nR T T V p ?=
=
==? (2)定压过程的熵变:2
2
112
1
ln T T r
p T T Q C dT T S Cp T T T δ?=
==??
(3)定容过程的熵变:2211
2
1
ln T T r V V T T Q C dT T S C T T T δ?===??
(4)相变化的熵变:H n H
S T T
???==
(定温定压,两相平衡,可逆) 6、熵是系统混乱度的度量: ln S k =Ω Ω是热力学概率,k 是玻耳兹曼常数。
7、热力学第二定律的本质:一切自发过程,总的结果都是向混乱度增加的方向进行。 8、热力学第三定律:在0K 时,任何纯物质的完美晶体其熵值为零。 9、有反应: aA bB gG hH +→+
熵变计算:()()()()o o o o o
r m m m m m S gS G hS H aS A bS B ?????=+-+????
10、定温定容的系统--------亥姆霍兹函数A (1)定义A U TS =-
(2)(),'T V A W ?≤ 等式表示可逆,不等式表示不可逆。
在定温定容条件下,系统亥姆霍兹函数的减少等系统所能做的最大有效功(绝对值)。 (3)(),0T V A ?< ,表示能够发生的不可逆过程。
(),0T V A ?= ,表示可逆过程(或平衡) (),0T V A ?> ,表示不可能发生的过程
11、定温定压系统-----------吉布斯函数G
(1)定义: G H TS U pV TS A p V =-=+-=+ (2)(),'T p G W ?≤ 等式表示可逆,不等式表示不可逆。
在定温定压条件下,系统亥姆霍兹函数的减少等系统所能做的最大有效功(绝对值)。 (3)(),0T p G ?< ,表示能够发生的不可逆过程。 (),0T p G ?= ,表示可逆过程(或平衡)
(),0T p G ?> ,表示不可能发生的过程
12、热力学的基本公式:
当系统只做体积功不做其他功时
dU TdS pdV dH TdS Vdp
dA SdT pdV dG SdT Vdp
=-=+=--=-+
13、麦克斯韦关系式: V S T p V S ??????
=-
? ??????? S p T V p S ??????= ? ??????? V T S p V T ??????
= ? ??????? p T S V p T ??????-= ? ?????
?? 14、计算G ?: (1)定温:221
1
2
1
ln p p p p nRT p G Vdp dp nRT p p ?=
==?
?
(2)发生相变:始态和终态的两个相平衡,且温度和压力相同,则0G ?=
始态和终态不平衡,则设计可逆过程来计算。 (3)化学反应:G H T S ?=?-?
(4)G ?温度的变化--------吉布斯--亥姆霍兹公式
定温:()p G S T ????=-??
???? ()p G T G H T ?????=?-??????? ()2
p G T H
T T ?????=-?????
应用式: 22112
2111()T T T T G G H dT H T T T
T T ???????
??
-=-=?- ? ? ?
??????
?
第三章 化学势
1、 (1)偏摩尔量的定义:多组分系统的任一种容量性质X (X 可分别代表V ,U ,H ,S ,A ,
G 等),可以看成是温度T 、压力p 及各物质的量,B C n n ,…的函数: (),,
,,,B C D X f T p n n n =
C A ,(B)A ,(B),,(C A)
d d d d p n T n T p n X X X X T p n T p n ≠?????????=++ ? ? ?
?????????
C B B ,,(C B)
d T p n X n n ≠???++ ?
??
? 定义:()
B
B ,,
C B def C T p n X X n ≠??
? ?
??? 则A A B B d d d X X n X n =++B B B
d X n =∑
B X 称为B 的“偏摩尔量”。
(2)偏摩尔量的集合公式: A A C C X n X n X =++……
2、(1)化学势定义:B B B ,,(C B)
C
T P n
G G n μ≠??
?=
????
(2)物理意义:决定物质传递方向和限度的强度因素。 (3)定温定压下: 'B
B
r dG dn
W μδ=
=∑ ,也就是说B B dn μ∑是定温度定压条件下
一多组分均相系统在发生状态变化时所能做出的最大有效功。
(4)在不做其他功的条件下,(),0T p dG <是能够进行的过程;(),0T p dG =,过程即达
平衡。
3、理想气体化学势表达式:ln
p RT p
θ
θμμ=+ 4、对于理想气体混合物来说,其中某种气体的行为与该气体单独占有混合气体总体积时的
行为相同。即ln
B
B B p RT p
θ
θμμ=+ 5、实际气体的化学势:ln
p
RT p
θ
θ
γμμ=
+()ln RT f p θθμ=+
定义逸度f p γ= 校正因子γ称为逸度系数或逸度因子。
6、拉乌尔定律:一定温度时,溶液中溶剂的蒸气压A p 与溶剂在溶液中的物质的量分数A x 成正比,其比例是纯溶剂在该温度时的蒸气压*
A p (上标“*”表示纯物质)。即:
***A A A A A A B p p x p p p x =?-=
(溶液蒸气压的降低与溶质在溶液中的摩尔分数成正比) 7、(1)理想液态混合物:在一定的温度和压力下液态混合物中任意一种物质在任意浓度下
均遵守拉乌耳定律的液态混合物。
(2)理想液态混合物中物质的化学势:液态混合物与蒸气相达成平衡时,有: (ln)()()ln
B
B B B p s g g RT p
μμμ?
?==+*()ln B B l RT x μ=+, 其中*
*()()ln B B B
p l g RT p
μμ?
?=+
8、亨利定律:一定温度时,稀溶液中挥发性溶质的平衡分压与溶质在溶液中的摩尔分数成正比:B x B p k x = ,
B p 是与溶液平衡的溶质蒸气的分压,B x 是溶质在溶液中的摩尔分数,x k 是比例常数, 称为亨利系数。其数值在一定温度下不仅与溶质性质有关,还有溶剂性质有关,可以大于
或小于纯溶质的饱和蒸汽压*
B p 。
9、理想稀溶液的定义:一定的温度和压力下,在一定的浓度范围内,溶剂遵守拉乌尔定律、
溶质遵守亨利定律的溶液称为理想稀溶液。
10、不挥发性溶质理想稀溶液的依数性: (1)凝固点降低:*2()f f B fus m R T T x H ?
?=
? (fus m H ??与温度无关)
=f B K m ,其中B m 是溶液中溶质的质量摩尔浓度。
f K 是凝固点降低常数*2()f A f fus m
R T M K H ?
=
?(A M 是溶剂的摩尔质量,单位1
kg mol -)
(2)沸点升高:*11
ln ()vap m A b b
H x R T T ??=-
沸点升高常数*2()b A
b vap m
R T M K H ?=? 则b b B T K m ?=
(3)半透膜两边平衡时,纯溶剂的压力为*
p 、溶液的压力为p ,则 *
p p -=∏ ,压力差∏称为渗透压, 渗透压cRT ∏=B B W RT
M V
?=
∏ (4)求算活度:*
11ln (
)fus m A f f
H a R
T T ?
?=
- *11()vap m b b
H R T T ??=-
*,m A
V RT
∏=-
第四章 化学平衡
1、理想气体的化学反应:()()()()aA g bB g gG g hH g +===+
标准平衡常数()()()()g h
G H a b
A B p p p p K p p p p ???
??=
活度商(')(')(')(')
g h
G H a a b
A B p p p p Q p p p p ????= 标准吉布斯函数变化ln r m G RT K ???=- ln r m r m a G G RT Q ?
?=?+ 当a Q K ?
<时,0r m G ?<,反应能够正向进行。 当a Q K ?
>时,0r m G ?>,反应能够逆向进行。 当a Q K ?
=时,0r m G ?=,反应达到平衡。。
2、平衡常数的表示法:
(1)气相反应:()()()()()()
B g h G H B a b
A B p p p p K p p p p p p νν???
?-???==∏ (g h a b ν?=+--) ()()B
B B p B B B x K p px x p K p ννννν??=∏=∏=∏= B
x B p K x K p νν-?=∏=(与温度、压力有关)=
(()B
B
B x B
B B n K x n n n n K n ννννν-?-?=∏=∏=∏=总总总) n x K K n ν
?=总
电解质溶液 法拉第定律:Q =nzF m = M zF Q dE r U dl ++ = dE r U dl --= t +=-+I I =-++r r r +=-+U U U ++=∞∞ +Λm ,m λ=() F U U F U ∞∞+∞+-+ r +为离子移动速率,U +( U -)为正(负)离子的电迁移率(亦称淌度)。 近似:+∞+≈,m ,m λλ +∞ +≈,m ,m U U m m Λ≈Λ∞ (浓度不太大的强电解质溶液) 离子迁移数:t B = I I B =Q Q B ∑B t =∑+t +∑-t =1 电导:G =1/R =I/U =kA/l 电导率:k =1/ρ 单位:S ·m -1 莫尔电导率:Λm =kV m =k/c 单位S ·m 2·mol -1 cell l R K A ρ ρ== cell 1K R kR ρ== 科尔劳乌施经验式:Λm =() c 1 m β-∞Λ 离子独立移动定律:∞Λm =()m,m,+U U F λλ∞∞∞∞ +-- +=+ m U F λ∞∞+,+= 奥斯特瓦儿德稀释定律:Φc K =() m m m 2 m c c ΛΛΛΛ∞∞Φ - 平均质量摩尔浓度:±m =() v 1v v m m - - ++ 平均活度系数:±γ=() 1v v -- +γγ+ 平均活度:±a =() v 1v v a a - - ++=m m γ± ± Φ 电解质B 的活度:a B =v a ±=v m m ?? ? ??Φ±±γ +v v v B + a a a a ± -- == m +=v +m B m -=v -m B ( ) 1 v v v B m v v m +±+-- = 离子强度:I = ∑i 2i i z m 21 德拜-休克尔公式:lg ±γ=-A|z +z --|I
物理化学公式集 热力学第一定律 功:δW=δW e+δW f (1)膨胀功δW e=p外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f=xdy 非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。热Q:体系吸热为正,放热为负。 热力学第一定律:△U=Q—W 焓H=U+pV 理想气体的内能和焓只是温度的单值函数。 热容C=δQ/dT (1)等压热容:C p=δQ p/dT=(?H/?T)p (2)等容热容:C v=δQ v/dT=(?U/?T)v 常温下单原子分子:C v,m=C v,m t=3R/2 常温下双原子分子:C v,m=C v,m t+C v,m r=5R/2 等压热容与等容热容之差: (1)任意体系C p—C v=[p+(?U/?V)T](?V/?T)p (2)理想气体C p—C v=nR 理想气体绝热可逆过程方程: pVγ=常数TVγ-1=常数p1-γTγ=常数γ=C p/ C v 理想气体绝热功:W=C v(T1—T2)=(p1V1—p2V2) 理想气体多方可逆过程:W=(T1—T2) 热机效率:η=冷冻系数:β=-Q1/W 可逆制冷机冷冻系数:β=
焦汤系数:μJ-T==- 实际气体的ΔH和ΔU: ΔU=+ΔH=+ 化学反应的等压热效应与等容热效应的关系:Q p=Q V+ΔnRT 当反应进度ξ=1mol时,Δr H m=Δr U m+RT 化学反应热效应与温度的关系: 热力学第二定律 Clausius不等式: 熵函数的定义:dS=δQ R/T Boltzman熵定理:S=klnΩ Helmbolz自由能定义:F=U—TS Gibbs自由能定义:G=H-TS 热力学基本公式: (1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程: dU=TdS-pdV dH=TdS+Vdp dF=-SdT-pdV dG=-SdT+Vdp (2)Maxwell关系: ==- (3)热容与T、S、p、V的关系: C V=T C p=T Gibbs自由能与温度的关系:Gibbs-Helmholtz公式=- 单组分体系的两相平衡: (1)Clapeyron方程式:=式中x代表vap,fus,sub。 (2)Clausius-Clapeyron方程式(两相平衡中一相为气相):= (3)外压对蒸汽压的影响:p g是在惰性气体存在总压为p e时的饱和蒸汽压。
物理化学 试卷一 一、选择题 ( 共15题 30分 ) 1. 下列诸过程可应用公式 dU = (Cp- nR)dT进行计算的是: ( C ) (A) 实际气体等压可逆冷却 (B) 恒容搅拌某液体以升高温度 (C) 理想气体绝热可逆膨胀 (D) 量热弹中的燃烧过程 2. 理想气体经可逆与不可逆两种绝热过程: ( B ) (A) 可以从同一始态出发达到同一终态因为绝热可逆ΔS = 0 (B) 从同一始态出发,不可能达到同一终态绝热不可逆S > 0 (C) 不能断定 (A)、(B) 中哪一种正确所以状态函数 S 不同 (D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定故终态不能相同 3. 理想气体等温过程的ΔF。 ( C ) (A)>ΔG (B) <ΔG (C) =ΔG (D) 不能确定 4. 下列函数中为强度性质的是: ( C ) (A) S (B) (G/p)T (C) (U/V)T 容量性质除以容量性质为强度性质 (D) CV 5. 273 K,10p下,液态水和固态水(即冰)的化学势分别为μ(l) 和μ(s),两者的关系为:( C ) (A) μ(l) >μ(s) (B) μ(l) = μ(s) (C) μ(l) < μ(s) (D) 不能确定
6. 在恒温抽空的玻璃罩中封入两杯液面相同的糖水 (A) 和纯水 (B)。经历若干
时间后,两杯液面的高度将是(μ(纯水)>μ(糖水中水) ,水从(B) 杯向(A) 杯转移 ) ( A ) (A) A 杯高于 B 杯 (B) A 杯等于 B 杯 (C) A 杯低于 B 杯 (D) 视温度而定 7. 在通常情况下,对于二组分物系能平衡共存的最多相为: ( D ) (A) 1 (B) 2 (C) 3 (D) 4 * Φ=C+2-f=2+2-0=4 8. 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( C ) (A) 3 种 (B) 2 种 (C) 1 种 (D) 不可能有硫酸水合物与之平衡共存。 * S = 5 , R = 3 , R' = 0,C= 5 - 3 = 2 f*= 2 -Φ+ 1 = 0, 最大的Φ= 3 , 除去硫酸水溶液与冰还可有一种硫酸水含物与之共存。 9. 已知 A 和 B 可构成固溶体,在 A 中,若加入 B 可使 A 的熔点提高,则B 在此固溶体中的含量必 _______ B 在液相中的含量。 ( A ) (A) 大于 (B) 小于 (C) 等于 (D)不能确定 10. 已知反应 2NH3= N2+ 3H2在等温条件下,标准平衡常数为 0.25,那么,在此条件下,氨的合成反应 (1/2) N2+(3/2) H2= NH3 的标准平衡常数为: ( C ) (A) 4 (B) 0.5 (C) 2 K (D) 1 * $p(2) = [K $p(1)]= (0.25)= 2 11. 若 298 K 时,反应 N2O4(g) = 2NO2(g) 的 K $p= 0.1132,则: (1) 当 p (N2O4) = p (NO2) = 1 kPa 时,反应将 _____( B )_____; (2) 当 p (N2O4) = 10 kPa,p (NO2) = 1 kPa 时,反应将 ____( A )____ 。
1. 热力学第一定律的数学表示式 W Q U +=?或 'amb δδδd δdU Q W Q p V W =+=-+ 系统得功为正,对环境作功为负。上式适用于封闭体系的一切过程。 2. 焓的定义式 3. 焓变 (1) )(pV U H ?+?=? 式中)(pV ?为pV 乘积的增量,只有恒压下)()(12V V p pV -=?在数值上等于体积功。 (2) 2 ,m 1 d p H nC T ?=? 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。 4. 热力学能(又称内能)变 此式适用于理想气体单纯pVT 变化的一切过程。 5. 恒容热与恒压热 V Q U =? (d 0,'0)V W == p Q H =? (d 0,'0)p W == 6. 热容的定义式 (1)定压热容与定容热容 δ/d (/)p p p C Q T H T ==?? δ/d (/)V V V C Q T U T ==?? (2)摩尔定压热容与摩尔定容热容 ,m m /(/)p p p C C n H T ==?? ,m m /(/)V V V C C n U T ==?? 上式分别适用于无相变变化、无化学变化、非体积功为零的恒压与恒容过程。 (3)质量定压热容(比定压热容) 式中m 与M 分别为物质的质量与摩尔质量。 (4) ,m ,m p V C C R -= 此式只适用于理想气体。 7. 摩尔蒸发焓与温度的关系 2 1 vap m 2vap m 1vap ,m ()()d T p T H T H T C T ?=?+?? 式中 vap ,m p C ? = ,m p C (g) —,m p C (l),上式适用于恒压蒸发过程。 8. 体积功 ,m //p p p c C m C M ==pV U H +=2 ,m 1d V U nC T ?=?
热力学第一定律 功:δW =δW e +δW f (1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移。如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。 热 Q :体系吸热为正,放热为负。 热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。 热容 C =δQ/dT (1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差: (1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=1 1 -γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1 nR -δ(T 1—T 2) 热机效率:η= 2 1 2T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β= 1 21 T T T - 焦汤系数: μJ -T =H p T ???? ????=-()p T C p H ?? 实际气体的ΔH 和ΔU : ΔU =dT T U V ??? ????+dV V U T ??? ???? ΔH =dT T H P ??? ????+dp p H T ???? ???? 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B B γRT 化学反应热效应与温度的关系:()()()dT B C T H T H 2 1 T T m p B 1m r 2m r ? ∑??,+=γ 热力学第二定律
物理化学期末重点复习资料
热力学第一定律 功:δW =δW e +δW f (1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移。如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。 热 Q :体系吸热为正,放热为负。 热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。 热容 C =δQ/dT (1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差: (1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ=常数 TV γ-1=常数 p 1-γT γ =常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=1 1 -γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1 nR -δ(T 1—T 2) 热机效率:η= 2 1 2T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=1 21T T T - 焦汤系数: μ J -T =H p T ???? ????=-()p T C p H ?? 实际气体的ΔH 和ΔU : ΔU =dT T U V ??? ????+dV V U T ??? ???? ΔH =dT T H P ??? ????+dp p H T ???? ? ??? 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B B γRT 化学反应热效应与温度的关系:()()()dT B C T H T H 2 1 T T m p B 1m r 2m r ? ∑??,+=γ 热力学第二定律
第一章 气体的pVT 关系 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 / y B m,B B * =V ?∑* A V y A m,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩尔体积。∑*A A m,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。 上述各式适用于任意的气体混合物。 (3) V V p p n n y ///B B B B * === 式中pB 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p ,∑=B B p p 适用于任意气体。 V RT n p /B B = 适用于理想气体 4. 阿马加分体积定律 V RT n V /B B =* 此式只适用于理想气体。 5. 范德华方程 RT b V V a p =-+))(/(m 2m n R T nb V V an p =-+))(/(22
第四章多组分系统热力学 一.基本要求 1.了解混合物的特点,熟悉多组分系统各种组成的表示法。 2.掌握偏摩尔量的定义和偏摩尔量的加和公式及其应用。 3.掌握化学势的狭义定义,知道化学势在相变和化学变化中的应用。 4.掌握理想气体化学势的表示式,了解气体标准态的含义。 5.掌握Roult定律和Henry定律的含义及用处,了解它们的适用条件和不同之处。 6.了解理想液态混合物的通性及化学势的表示方法,了解理想稀溶液中各组分化学势的表示法。 7.了解相对活度的概念,知道如何描述溶剂的非理想程度,和如何描述溶质在用不同浓度表示时的非理想程度。 8.掌握稀溶液的依数性,会利用依数性来计算未知物的摩尔质量。 二.把握学习要点的建议 混合物是多组分系统的一种特殊形式,各组分平等共存,服从同一个经验规律(即Rault定律),所以处理起来比较简单。一般是先掌握对混合物的处理方法,然后再扩展到对溶剂和溶质的处理方法。先是对理想状态,然后扩展到对非理想的状态。 偏摩尔量的定义和化学势的定义有相似之处,都是热力学的容量性质在一定的条件下,对任一物质B的物质的量的偏微分。但两者有本质的区别,主要体现在“一定的条件下”,即偏微分的下标上,这一点初学者很容易混淆,所以在学习时一定要注意它们的区别。偏摩尔量的下标是等温、等压和保持除B以外的其他组成不变(C B )。化学势的下标是保持热力学函数的两个特征变量和保持除B以外的其他组成不变。唯独偏摩尔ibbs自G由能与狭义化学势是一回事,因为Gibbs自由能的特征变量是,T p,偏摩尔量的下标与化学势定义式的下标刚好相同。 多组分系统的热力学基本公式,比以前恒定组成封闭系统的基本公式,在 d n时所引起的相应热最后多了一项,这项表示某个组成B的物质的量发生改变 B
第一章 气体的pVT 关系 主要公式及使用条件 1、 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 此式适用于理想气体,近似地适用于低压的真实气 体。 式中p ,V ,T 及n 单位分别为Pa,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8、314510 J · mol -1 · K -1,称为摩尔气体常数。 2、 气体混合物 (1) (1) 组成 摩尔分数 y B (或x B ) = ∑A A B / n n 体积分数 /y B m,B B *=V ?∑*A V y A m ,A 式中∑A A n 为混合气体总的物质的量。A m,*V 表示在一定T ,p 下纯气体A 的摩尔体积。∑* A A m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总与。 (2) (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上述各式适用于任 意的气体混合物。 (3) V V p p n n y ///B B B B *=== 式中p B 为气体B,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3、 道尔顿定律 p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 5、 范德华方程 RT b V V a p =-+))(/(m 2m
第七章 电 化 学 主要公式及其适用条件 1.迁移数及电迁移率 电解质溶液导电是依靠电解质溶液中正、负离子的定向运动而导电,即正、负离子分别承担导电的任务。但是,溶液中正、负离子导电的能力是不同的。为此,采用正(负)离子所迁移的电量占通过电解质溶液的总电量的分数来表示正(负)离子之导电能力,并称之为迁移数,用t + ( t - ) 表示。即 正离子迁移数 -++ -++-++++= +=+= u u u Q Q Q t v v v 负离子迁移数 -+- -+--+--+= +=+= u u u Q Q Q t v v v 上述两式适用于温度及外电场一定而且只含有一种正离子和一种负离子的电解质溶液。式子表明,正(负)离子迁移电量与在同一电场下正、负离子运动速率+v 与 -v 有关。式中的u + 与u - 称为电迁移率,它表示在一定溶液中,当电势梯度为1V·m -1 时正、负离子的运动速率。 若电解质溶液中含有两种以上正(负)离子时,则其中某一种离子B 的迁移数t B 计算式为 ∑= +B B B B Q Q t z 2.电导、电导率与摩尔电导率 衡量溶液中某一电解质的导电能力大小,可用电导G ,电导率κ与摩尔电导率m Λ来表述。电导G 与导体的横截面A s 及长度l 之间的关系为 l A κR G s == 1 式中κ称为电导率,表示单位截面积,单位长度的导体之电导。对于电解质溶 液,电导率κ则表示相距单位长度,面积为单位面积的两个平行板电极间充满 电解质溶液时之电导,其单位为S · m -1。若溶液中含有B 种电解质时,则该溶液的电导率应为B 种电解质的电导率之和,即 ∑=B B κκ(溶液) 虽然定义电解质溶液电导率时规定了电极间距离、电极的面积和电解质溶液的体积,但因未规定相同体积电解质溶液中电解质的量,于是,因单位体积中电解质的物质的量不同,而导致电导率不同。为了反映在相同的物质的量条件下,电解质的导电能力,引进了摩尔电导率的概念。电解质溶液
第一章气体的pvT关系 一、理想气体状态方程 pV=(m/M)RT=nRT (1.1) 或pV m =p(V/n)=RT (1.2) 式中p、V、T及n的单位分别为 P a 、m3、K及mol。V m =V/n称为气 体的摩尔体积,其单位为m3·mol。R=8.314510J·mol-1·K-1称为摩尔气体常数。 此式适用于理想,近似于地适用于低压下的真实气体。 二、理想气体混合物 1.理想气体混合物的状态方程(1.3) pV=nRT=(∑ B B n)RT pV=mRT/M mix (1.4) 式中M mix 为混合物的摩尔质量,其可表示为 M mix def ∑ B B y M B (1.5) M mix =m/n=∑ B B m/∑ B B n (1.6) 式中M B 为混合物中某一种组分B 的摩尔质量。以上两式既适用于各种 混合气体,也适用于液态或固态等均 匀相混合系统平均摩尔质量的计算。 2.道尔顿定律 p B =n B RT/V=y B p (1.7) P=∑ B B p (1.8) 理想气体混合物中某一种组分B 的分压等于该组分单独存在于混合气 体的温度T及总体积V的条件下所具 有的压力。而混合气体的总压即等于 各组分单独存在于混合气体的温度、 体积条件下产生压力的总和。以上两 式适用于理想气体混合系统,也近似 适用于低压混合系统。
3.阿马加定律 V B *=n B RT/p=y B V (1.9) V=∑V B * (1.10) V B *表示理想气体混合物中物质B 的分体积,等于纯气体B在混合物的温度及总压条件下所占有的体积。理想气体混合物的体积具有加和性,在相同温度、压力下,混合后的总体积等于混合前各组分的体积之和。以上两式适用于理想气体混合系统,也近似适用于低压混合系统。 三、临界参数 每种液体都存在有一个特殊的温度,在该温度以上,无论加多大压力,都不可能使气体液化,我们把 这个温度称为临界温度,以T c 或t c 表 示。我们将临界温度T c 时的饱和蒸气 压称为临界压力,以p c 表示。在临界温度和临界压力下,物质的摩尔体积 称为临界摩尔体积,以V m,c 表示。临 界温度、临界压力下的状态称为临界 状态。 四、真实气体状态方程 1.范德华方程 (p+a/V m 2)(V m -b)=RT (1.11) 或(p+an2/V2)(V-nb)=nRT (1.12) 上述两式中的a和b可视为仅与 气体种类有关而与温度无关的常数, 称为范德华常数。a的单位为Pa·m 6·mol,b的单位是m3mol.-1。该方 程适用于几个兆帕气压范围内实际气 体p、V、T的计算。 2.维里方程 Z(p,T)=1+Bp+Cp+Dp+… (1.13) 或Z(V m, ,T)=1+B/V m +C / V m 2 +D/ V m 3 +… (1.14)
初中物理化学公式大全物理 1、匀速直线运动的速度公式: 求速度:v=s/t 求路程:s=vt 求时间:t=s/v 2、变速直线运动的速度公式:v=s/t 3、物体的物重与质量的关系:G=mg (g=9.8N/kg) 4、密度的定义式 求物质的密度:ρ=m/V 求物质的质量:m=ρV 求物质的体积:V=m/ρ 4、压强的计算。 定义式:p=F/S(物质处于任何状态下都能适用) 液体压强:p=ρgh(h为深度) 求压力:F=pS 求受力面积:S=F/p 5、浮力的计算 称量法:F浮=G—F 公式法:F浮=G排=ρ排V排g 漂浮法:F浮=G物(V排<V物) 悬浮法:F浮=G物(V排=V物) 6、杠杆平衡条件:F1L1=F2L2 7、功的定义式:W=Fs 8、功率定义式:P=W/t 对于匀速直线运动情况来说:P=Fv (F为动力) 9、机械效率:η=W有用/W总 对于提升物体来说: W有用=Gh(h为高度) W总=Fs 10、斜面公式:FL=Gh 11、物体温度变化时的吸热放热情况 Q吸=cmΔt (Δt=t-t0) Q放=cmΔt (Δt=t0-t) 12、燃料燃烧放出热量的计算:Q放=qm 13、热平衡方程:Q吸=Q放 14、热机效率:η=W有用/ Q放(Q放=qm) 15、电流定义式:I=Q/t (Q为电量,单位是库仑) 16、欧姆定律:I=U/R 变形求电压:U=IR 变形求电阻:R=U/I 17、串联电路的特点:(以两纯电阻式用电器串联为例) 电压的关系:U=U1 U2
电流的关系:I=I1=I2 电阻的关系:R=R1 R2 18、并联电路的特点:(以两纯电阻式用电器并联为例) 电压的关系:U=U1=U2 电流的关系:I=I1 I2 电阻的关系:1/R=1/R1 1/R2 19、电功的计算:W=UIt 20、电功率的定义式:P=W/t 常用公式:P=UI 21、焦耳定律:Q放=I2Rt 对于纯电阻电路而言:Q放=I2Rt =U2t/R=UIt=Pt=UQ=W 22、照明电路的总功率的计算:P=P1 P1 …… 化学 化合反应 1、镁在空气中燃烧:2Mg O2 点燃2MgO 2、铁在氧气中燃烧:3Fe 2O2 点燃Fe3O4 3、铝在空气中燃烧:4Al 3O2 点燃2Al2O3 4、氢气在空气中燃烧:2H2 O2 点燃2H2O 5、红磷在空气中燃烧:4P 5O2 点燃2P2O5 6、硫粉在空气中燃烧:S O2 点燃SO2 7、碳在氧气中充分燃烧:C O2 点燃CO2 8、碳在氧气中不充分燃烧:2C O2 点燃2CO 9、二氧化碳通过灼热碳层:C CO2 高温2CO 10、一氧化碳在氧气中燃烧:2CO O2 点燃2CO2 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 H2O === H2CO3 12、生石灰溶于水:CaO H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4 5H2O ==== CuSO4·5H2O 14、钠在氯气中燃烧:2Na Cl2点燃2NaCl 分解反应 15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O O2↑ 16、加热高锰酸钾:2KMnO4 加热K2MnO4 MnO2 O2↑ 17、水在直流电的作用下分解:2H2O 通电2H2↑ O2 ↑ 18、碳酸不稳定而分解:H2CO3 === H2O C O2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO CO2↑ 置换反应 20、铁和硫酸铜溶液反应:Fe CuSO4 == FeSO4 Cu 21、锌和稀硫酸反应(实验室制氢气):Zn H2SO4 == ZnSO4 H2↑ 22、镁和稀盐酸反应:Mg 2HCl === MgCl2 H2↑ 23、氢气还原氧化铜:H2 CuO 加热Cu H2O 24、木炭还原氧化铜:C 2CuO 高温2Cu CO2↑ 25、甲烷在空气中燃烧:CH4 2O2 点燃CO2 2H2O 26、水蒸气通过灼热碳层:H2O C 高温H2 CO
必修一金属及其化合物化学方程式 一、金属钠及其化合物 1、钠在空气中 (1)钠块在空气中变暗:2Na +O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体) 现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体 (3)2Na2O+O2=2Na2O2 2、钠与水反应(浮、熔、游、响、红) 2Na +2H2O =2NaOH +H2↑ 2Na +2H2O =2Na++2OH-+H2↑ 3、钠与盐溶液反应(先水后盐) (1)与氯化钠溶液:本质上就是与水反应 (2)与硫酸铜溶液: 2Na +2H2O =2NaOH +H2↑ 2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4 总:2Na +2H2O + CuSO4=Cu(OH)2↓+ Na2SO4+H2↑ 2Na +2H2O+ Cu2+ =Cu(OH)2↓+H2↑+ 2Na+ (3)与氯化铁溶液: 6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑ 6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑ 4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白) 2Na2O2+2H2O =4NaOH +O2 ↑ 2Na2O2+2H2O =4Na++4OH -+O2↑ 现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色) 碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O +H2O =2Na++2OH - 5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na2O2+2CO2=2Na2CO3+O2 碱性氧化物Na2O与二氧化碳的反应Na2O+CO2===Na2CO36、过氧化钠与盐酸的反应 2Na2O2+4HCl =4NaCl +2H2O+O2 ↑2Na2O2+4H+=4Na++2H2O+O2↑ 碱性氧化物Na2O与盐酸的反应 Na2O +2HCl =2NaCl +H2O Na2O +2H+=2Na++H2O 7、氢氧化钠 (1)与酸性氧化物反应 a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2O OH -+CO2 (少量)= CO32-+H2O b 继续向该溶液中通入CO2:Na2CO3+H2O +CO2=2NaHCO3 CO32-+H2O +CO2=2HCO3- c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3a+b OH -+CO2 (过量)= HCO3- d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2O Ca2++ 2OH -+CO2 (少量)= CaCO3↓+H2O e继续向该溶液中通入CO2:CaCO3+H2O +CO2=Ca(HCO3)2 CaCO3+H2O +CO2=Ca2++ 2HCO3- f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+e OH -+CO2 (过量)= HCO3- CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸 8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠) ①向盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑ CO32-+2H+=H2O +CO2↑ 现象:立即有气泡产生 ②纯碱溶液中滴加盐酸,至过量 Na2CO3+HCl =NaHCO3+NaCl CO32-+H+ =HCO3- NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑ 现象:先无明显现象,然后有气泡产生 9、碳酸氢钠和盐酸反应(无论是向碳酸氢钠中滴加稀盐酸还是向盐酸中滴加碳酸氢钠,现象均为:立 △△
第二章 热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式 或 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中 p amb 为环境的压力,W ’为非体积功。上式适用于封闭体系的一切过程。 2. 焓的定义式 3. 焓变 (1) 式中为乘积的增量,只有在恒压下在数值上等于体积功。 (2) 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。 4. 热力学能(又称内能)变 此式适用于理想气体单纯pVT 变化的一切过程。 5. 恒容热和恒压热 6. 热容的定义式 (1)定压热容和定容热容 (2)摩尔定压热容和摩尔定容热容 W Q U +=?' amb δδδd δdU Q W Q p V W =+=-+)(pV U H ?+?=?)(pV ?pV )()(12V V p pV -=?2 ,m 1d p H nC T ?=?V Q U =?(d 0,'0)V W ==p Q H =?(d 0,'0)p W ==δ/d (/)p p p C Q T H T ==??δ/d (/)V V V C Q T U T ==??,m m /(/)p p p C C n H T ==??pV U H +=2 ,m 1 d V U nC T ?=?
上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。 (3)质量定压热容(比定压热容) 式中m 和M 分别为物质的质量和摩尔质量。 (4) 此式只适用于理想气体。 (5)摩尔定压热容与温度的关系 式中, b , c 及d 对指定气体皆为常数。 (6)平均摩尔定压热容 7. 摩尔蒸发焓与温度的关系 或 式中 = (g) —(l),上式适用于恒压蒸发过程。 8. 体积功 (1)定义式 或 (2) 适用于理想气体恒压过程。 (3) 适用于恒外压过程。 (4) 适用于理想气体恒温 可逆过程。 (5) 适用于为常数的理想气体绝热过程。 9. 理想气体可逆绝热过程方程 ,m m /(/)V V V C C n U T ==??,m ,m p V C C R -=23 ,m p C a bT cT dT =+++a 21,m ,m 21d /()T p p T C T T T C =-?2 1 vap m 2vap m 1vap ,m ()()d T p T H T H T C T ?=?+??vap m vap ,m (/)p p H T C ???=?vap ,m p C ?,m p C ,m p C V p W d amb -=?V p W d amb ∑-=)()(1221T T nR V V p W --=--=)(21amb V V p W --=)/ln()/ln(d 12122 1p p nRT V V nRT V p W V V =-=-=?,m 21()V W U nC T T =?=-,m V C ,m 2121(/) (/)1V C R T T V V =,m //p p p c C m C M ==
物理化学主要公式及使用条件 第一章 气体的pVT 关系 主要公式及使用条件 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 /y B m,B B * =V ?∑*A V y A m ,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩 尔体积。∑*A A m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上 述各式适用于任意的气体混合物。 (3) V V p p n n y ///B B B B * ===
式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 4. 阿马加分体积定律 V RT n V /B B =* 此式只适用于理想气体。 第二章 热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式 W Q U +=? 或 'amb δδδd δdU Q W Q p V W =+=-+ 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中 p amb 为环境的压力,W ’为非体积功。上式适用于封闭体系的一切过程。 2. 焓的定义式 3. 焓变 pV U H +=
物理化学习题汇总 一、填空题 1.一定量的某理想气体,经过节流膨胀,此过程的ΔU =0 ,ΔH =0,ΔS >0,ΔG <0.(填>,<,=0或无法确定) 热力学第三定律可表示为:在绝对0K,任何物质完美晶体的熵值为零。 2.理想气体状态方程的适用条件:理想气体;高温低压下的真实气体。 3.可逆膨胀,体系对环境做最大功;可逆压缩。环境对体系做最小功。 4.可逆相变满足的条件:恒温,恒压,两相平衡。 5.可逆循环的热温商之和等于零,可逆过程的热温商 = dS. 6.自发过程都有做功的能力,反自发过程需环境对系统做功,自发过程的终点是平衡态。 10.理想气体在等温条件下反抗恒定外压膨胀,该变化过程中系统的熵变ΔSsys > 0 及环境的熵变ΔSsur < 0 。 (理想气体等温膨胀,体积增加,熵增加,但要从环境吸热,故环境的熵减少。)11.在50℃时,液体A的饱和蒸汽压是液体B的饱和蒸汽压的3倍,A和B两液体形成理想液态混合物,达气液平衡时,液相中A的摩尔分数为0.5,则气相中B的摩尔分数yB为______。 0.25yB=PB/P=PB*xB/(PA*xA+PB*xB) 13.道尔顿定理的内容:混合气体的总压力等于各组分单独存在于混合气体的温度体积条件下所产生压力的总和。 14.热力学第二定理表达式 ds ≧ &Q / T 。 15.熵增原理的适用条件绝热条件或隔离系统。 16.353.15K时苯和甲苯的蒸气压分别为100KPa和38.7KPa二者形成混合物,其平衡气相的组成Y苯为0.30,则液相的组成X苯为 0.142 。 17.在室温下,一定量的苯和甲苯混合,这一过程所对应的DH大约为 0 。 18.反应能否自发进行的判据。 答案:dS条件是绝热体系或隔离系统,(dA)T,V,Wf=o0,(dG)T,P,Wf。 20.节流膨胀的的定义。 答案:在绝热条件下气体的的始末态压力分别保持恒定不变情况下的膨胀过程。
1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 /y B m,B B * =V ?∑*A V y A m ,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩尔体积。∑*A A m ,A V y 为 在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上述各式适用于任意的 气体混合物。 (3) V V p p n n y ///B B B B * === 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 4. 阿马加分体积定律 V RT n V /B B =* 此式只适用于理想气体。 第二章 热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式
W Q U +=? 或 'amb δδδd δdU Q W Q p V W =+=-+ Q 吸正放负 W外对内正 内对外负 2. 焓的定义式 3. 焓变 (1) )(pV U H ?+?=? 式中)(pV ?为pV 乘积的增量,只有在恒压下)()(12V V p pV -=?在数值上等于体积功。 (2) 2 ,m 1d p H nC T ?=? 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。 4. 热力学能变 此式适用于理想气体单纯pVT 变化的一切过程。 5. 恒容热和恒压热 V Q U =? (d 0,'0)V W == p Q H =? (d 0,'0)p W == 6. 热容的定义式 (1)定压热容和定容热容 δ/d (/)p p p C Q T H T ==?? δ/d (/)V V V C Q T U T ==?? (2)摩尔定压热容和摩尔定容热容 ,m m /(/)p p p C C n H T ==?? ,m m /(/)V V V C C n U T ==?? 上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。 (3)质量定压热容(比定压热容) 式中m 和M 分别为物质的质量和摩尔质量。 (4) ,m ,m p V C C R -= (5)摩尔定压热容与温度的关系 23,m p C a bT cT dT =+++ ,m //p p p c C m C M ==pV U H +=2 ,m 1d V U nC T ?=?
物理化学公式集热力学第一定律 功:δW=δW e+δW f (1)膨胀功δW e=p 外 dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f=xdy 非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。热Q:体系吸热为正,放热为负。 热力学第一定律:△U=Q—W 焓H=U+pV 理想气体的内能和焓只是温度的单值函数。 热容C=δQ/dT (1)等压热容:C p=δQ p/dT=(?H/?T)p (2)等容热容:C v=δQ v/dT=(?U/?T)v 常温下单原子分子:C v ,m =C v ,m t=3R/2 常温下双原子分子:C v ,m =C v ,m t+C v,m r=5R/2 等压热容与等容热容之差: (1)任意体系C p—C v=[p+(?U/?V)T](?V/?T)p (2)理想气体C p—C v=nR 理想气体绝热可逆过程方程: pVγ=常数TVγ-1=常数p1-γTγ=常数γ=C p/ C v 理想气体绝热功:W=C v(T1—T2)=(p1V1—p2V2)理想气体多方可逆过程:W=(T1—T2) 热机效率:η=冷冻系数:β=-Q1/W
可逆制冷机冷冻系数:β= 焦汤系数:μJ ==- -T 实际气体的ΔH和ΔU: ΔU=+ΔH=+ 化学反应的等压热效应与等容热效应的关系:Q p=Q V+ΔnRT 当反应进度ξ=1mol时,Δr H m=Δr U m+RT 化学反应热效应与温度的关系: 热力学第二定律 Clausius不等式: 熵函数的定义:dS=δQ R/T Boltzman熵定理:S=klnΩHelmbolz自由能定义:F=U—TS Gibbs自由能定义:G=H-TS 热力学基本公式: (1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程: dU=TdS-pdV dH=TdS+Vdp dF=-SdT-pdV dG=-SdT+Vdp (2)Maxwell关系: ==- (3)热容与T、S、p、V的关系: C V=T C p=T Gibbs自由能与温度的关系:Gibbs-Helmholtz公式=- 单组分体系的两相平衡: (1)Clapeyron方程式:=式中x代表vap,fus,sub。(2)Clausius-Clapeyron方程式(两相平衡中一相为气相):=