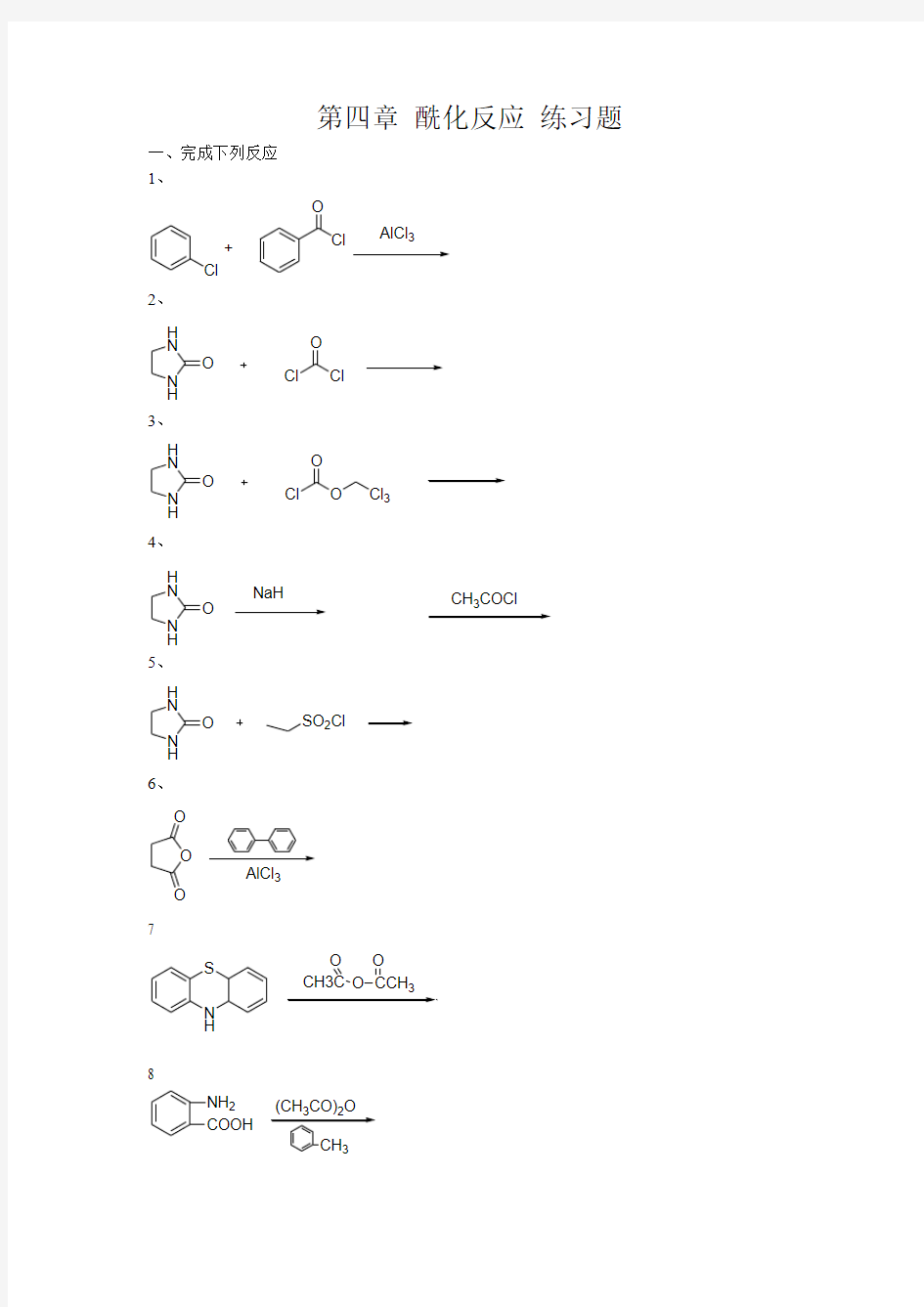

第四章 酰化反应 练习题
一、完成下列反应 1、
Cl
Cl
O
+AlCl 3
2、 N H
H N
O Cl
O Cl
3、 H
H N
O Cl
O O
Cl 3
4、 H
H N
O NaH
CH 3COCl
5、 H
H N
O SO 2Cl
6、
O
O
AlCl 3
7
N H
S O O O
8
NH 2COOH
N N S
H 2N
SH
O 3
O
10
NH 2
OH
O 3
O
11 NH 2
3
12
NH 2
F 3C Cl
2CH 3CN
13
NHNH 2
O O
O
14
O
COCl
+(CH 3)2CHCH 2CHCOOCH 2
OH
15 NH 2
CF 3
2
CH 3
16
COOH
NO 2
HOCH CH N(C H )xylene
17 CH 3
NH 2CH 3
ClCH 2COCl
H 3
H 2+H 3C
O
O
Et 3N,DMF
19
NHCH 3
C
Cl
ClCH 2COCl C 6H 12
20
F
+Cl
O
21
OH
AC 2O
22
OH
OH O +H 3C
O CH 3
O
O H SO
23
H 3CO
NHNHSO 3Na
Cl COCl
24
N H
Cl
Cl ClCH 2COCl
25
H 3C
CH 3
CH 3COCl 3
H 3CO
CH 3CH 2COCl
AlCl 3
27
HO HO
POCl 3,ClCH 2COOH
28
H 3C
S
Cl
O 3O H N
OH
O
29、 HC CH
Cl
Cl
O 3
30、
N
S NH 2
O O
O
O
C H OH H
31、 S
O O O
32、 O
O O O
H 3PO 4
33、 1)
N
H N
O TMSCl
N
O
N
N
O O
TMS Cl
Cl
O
2)
N
H N
O O
Cl
O
O 2
N
2
3)
N
H N O O
Cl 3
O
3
O CCl 3
O
.33、
COOH
2
3
34、
OH
2NaOH Tol
22
35、
N H
COCl 2
Tol
2
-HBr
3
C 2H 5OH
36、 COOH
H 2N
NH 2
I
I 32
N N H
O
Et 2N
Cl
O
38 Cl Cl
F
3CH 3COCl
39
OH
AlCl 3
40
O
O 2N
H
C CHCOOH
5
41
NH 2COOH
2
42、
CH 3OH/C 6H 6/△HCl(gas)
N
HO O
43、
HOCH 2CH 2N(C 2H 5)2/二甲苯
45℃,2h
OH
O O 2N
C 2H 5ONa △
N H
O
O HO
45、
CH Br
60-80℃,45min
O C
OH O N
HO
46、
Na 3OH
O
O
N
OH
47、
①(C 2H 5CO)2O/Py/△
OH N
48、
Cl
COCl +
N H
H 3CO
CH 2COOH
CH 3
49、
H 2N
C H 2N
O
R'R
C COOEt COOEt
+
50、
H 2NO 2S
3
C O
NO 2
NO 2
O N H 2
C
H 2N C 2H 5
+
51、
CH 3OH/C 6H 6/△
HCl(gas)
N
COOH
52、
HCl(gas)
Fe/HCl 45℃,2h
O 2N
COOH
22252
53、
HOCH 2CH 2N(C 2H 5)2
C 2H 5ONa △
t-BuHN
O O
54、
CH CH ONa 60-80℃,45min
HO
O
O
+
N
HO
MeBr
?
?
55、
N OH
CH 3
CH 3
①(C 2H 5CO)2O/Py/△
②HCl(gas)
56、 H 2N
NH 2
O R'R
COOEt COOEt
+
Cl
Cl
O +
NH 4Cl/NH 4OH/H 2O 脱乙酰基
H SO /H O
O
O
O
58、
+
2580-90℃,回流,10h ② HCl
△
-CO
C 6H 5
H
COOC 2H 5
O
O
O ?
?
59、
22H 2O,H
2(CH CO)O NO 2
Cl
?
?
?
60、 OH
(CH CO)O
61、
NH 2CH 3
CH 3
H
C Br CH 3
COBr
62、 CH N H 3H 3C
H NH
Cl
CH 2COCl HCl
63、
HO
CH 2CH 2NH 2
Cl
COCl
L-NH2CHCOOH
CH2
CH2COOH
65
65、
COOCH3
OH
NH2
(CH CO)O,C H OH 66、
OAc
Cl
Cl
O
AlCl3,CH2Cl2,0℃,2h
67、
CHO
NH2
O O +
68、
F
Cl
Cl +CH3COCl
AlCl
69、O2N
3+
O
O O
CrO3
70、
O +
O
O O
34+
71、
CN CH3COOC2H5
C2H5ONa , HCl 72、
OH
O OH OH
PCl 5
OH
O
ONa Cl
73、
HO
OH
O 24
74、 OCH 3
H 3CO
OCH 3
COCl
NH 2(CH 2)5COOH NaOH,HCl
75、
O O
3
76、
COCl
Cl 3
77、 COOH
Cl
SOCl
78、
HN
COOH
C H CH OCOCl
NaOH,HCl
79、
Cl
ClCH CH CH COCl
KOH,AlCl 3
80、
ClCH 2CH 2CH 2OH
CH COCl
81、 NH 2
CH 3
32
82、 H 3CO
23
83、
COOH Cl
25
84、
Cl
OCH 2COOH
Cl
C H OH
85、
Cl Cl
3
O
86、
Cl
Cl
3AlCl 3
87、
Cl
Cl
COCl 2
88、
NH(C 2H 5)2
COCl 2
苯
89、
NH C 2H 5
C 2H 5
C Cl
Cl O
苯
90、
O O
O
+
AlCl 3
91、
OH
OH
Zn(CN)2/HCl
2
92、
O
C 6H 5
+
HCON(CH 3)2
POCl
93、
H 3C
OH
CH 3
+
(CH 2)6N 2
3
94、
OH
+
CHCl 3
+
NaOH
95、
N H
CHO
+
CHCl 3
+
NaOH
96、
N 2Cl
Br
3
CH 2NOH
H 2O
CuSO 4/Na 2SO 3
97、
Br
CN
+CO
+H 2
[(C H )P]PdX 3
98、
RCOCl+R'CH CH2AlCl3/CHCl3
99、
CH3SOCH3RCOOR'NaH
+
100、
RCHO CH2N2
++ 101、
HO NH2
ClCOCH3
O
102、
ONa
32
103、
COCH3
OH
104、
CH3
NH2
CH3CHCOBr
Br
105、
NHCH(CH3)2ClCH2COCl
106、
Cl Cl
NH2
CH3CH2CCl
O 107、
NH 2OH
COOH
3
108、 S
(CH CO)O H 3PO 4
109、 CH 3
HO
H 3ClCCl O
110、 CHO
CH 3CCH 3
O
二、设计下列化合物的合成路线
1、由苯和其他有机或无机试剂合成邻、间、对氟代苯乙酮的有效方法
2、以对硝基苯乙酮为原料,合成氯霉素的中间体
O
H N O
O 2N
3、通过逆合成分析写出下列化合物最佳合成路线
O
4、通过逆合成分析写出下列化合物最佳合成路线
NO 2
NO 2
OMe
5、
H 3C H 3C
CCH 2CH 2COOH
O
Cl
三、用语言叙述下列人名反应或写出其反应的代表式或举例解释此人名反应。
1、Friedel-Crafts酰化反应:
2、Hoesch反应:
3、Gattermann反应:
4、Vilsmeier-Haauc反应:
5、Reimer-Tiemann反应:
6、Claisen反应:
7、Dickmann反应:
四、写出反应机理
1、
COOH
F
H2SO4
CH3CH2OH
COOCH2CH3
F
2、R OH
O H
R
O
3、R OH
O
R'OH
R OR'
O
4、R OR'
O
H
R OR''
O
5、+Z R
O
Lewis
R
O
Z=Hal, R'COO, OH, OR'
五、排序
1、F-C烷基化反应中常用Lewis酸催化剂的活性顺序:
AlCl3,SbCl5 ,FeCl3,BF3,SnCl4 ,TiCl4,ZnCl2
2、F-C烷基化反应常用质子酸的活性次序:
HF,P2O5,H2SO4,H3PO4
3、卤代烃的活性顺序:
叔卤代烷,仲卤代烷,伯卤代烷
RF,RI ,RBr,RCl
4、下列羧酸衍生物的酰化能力强弱次序为:
RCO ClO4 , RCO BF4 , RCO.Hal ,(RCO)2O ,RCOOR',RCOOH , RCONHR'
5、常用酰化剂(RCOX)的反应活性顺序:
RCO BF4 ,RCO.Hal ,(RCO)2O ,RCON3 ,RCOOR' ,RCOONR'2 , RCOOH , RCOR'六、解释下列名词或术语
1、DMAP:
2、PPY:
3、DEAD:
4、CDI:
5、BDP:
4-1 在定态操作反应器的进口物料中脉冲注入示踪物料。出口处示踪物浓度随时间变化的情况如下。假设在该过程中物料的密度不发生变化,试求物料的平均停留时间与时间t/s 0 120 240 360 480 600 720 840 960 1080 示踪物浓度 / )/(3cm g 0 0 0 t/min 2 4 6 8 10 12 14 16 18 3/cm g c i 0 0 0 min /1)(i t E 0 0 0 i i t E t )( 0 0 0 min )(2i i t E t 0 2 5 0 0 ])(2)(4[3109753864210c c c c c c c c c c t dt c i +++++++++?=?∞ ]0)5.20.1025.1(2)0.10.55.125.6(40[3 2++++++++= =100 min)/1(100) ()(0 ti i c dt c t c t E ==? ∞
} )(])()()()([2])()()()([4)({3 10109977553 38866442211_ t E t t E t t E t t E t t E t t E t t E t t E t t E t t E t t t +++++++++?= ]0)03.08.05.0(2)14.05.075.013.0(40[3 2 +++++++++=min 187.6= ?∞ =-=-=0 22 2 2971.8187.625.47)(t dt t E t t σmin 2 4-2 无量纲方差表达式的推导 (1)推导无量纲方差2 22 /t t σσθ=; (2)推导CSTR 的2 2t t =σ。 1. τ θt = 2. τ τ t e t E - =1 )( 证明: 20 22)(i i i i t t t t E t -?=∑∞σ ? ∞ --= 2 21 t dt e t t τ τ 2 2)()()()(ττθθττθ--=?∞ - d t E ()]1)1([0 22 --=?∞ θθθτd E 22θστ= 222/τσσθt =∴ 220 2 2 2)(1 )(- - ∞ -=-=??t dt e t t dt t E t t t ττ σ
烷基化反应的机理 石油炼制过程中的烷基化反应是指在酸性催化剂的作用下,烷烃分子与烯烃分子的化学加成反应,在反应过程中烷烃分子中的活泼氢原子的位置被烯烃所取代。由于异构烷烃中叔碳原子上的氢原子比正构烷烃中伯碳原子上的氢原子活泼得多,因此参加烷基化反应的烷烃为异构烷烃,一般特指异丁烷。 烷基化原料是以催化裂化液化气中异丁烷和异丁烯、丁烯-1为主。烷基化常用的酸性催化剂有硫酸、氢氟酸、三氯化铝等,本装置使用的催化剂为硫酸。 正碳离子的概念 在研究各种有机化学反应的时候,人们发现各种有机反应中间产物大体可以分为3种类型:自由基、阳离子、阴离子。烷基化反应属于其中的阳离子反应,即生成了正碳离子。随着人们对烷基化反应机理的不断探索与认识的日渐成熟,人们普遍接收的是正碳离子——链式反应机理。 所谓正碳离子是一个带正电荷的碳原子,它只有6个外层电子,是缺电荷的,其通式可以写为: 围绕正碳离子的取代物可以是氢原子,也可以是甲基基团,其四种形式分别为: 其稳定性从左到右依次增大,也就是说叔碳原子的正碳离子是最稳定的。这里所说的稳定性是相对而言的,总体来说,各种正碳离子都是极不稳定的,很容易进一步参与反应。只有当其与另一对电子成键以后,也就是说,当这个碳原子周围有了8个电子以后,它才能说是真正稳定了。 正碳离子与另一对电子成键的最常见的形式是加合一个负离子。这是正碳离子的最后一步反应,但却开始了另一个正离子的进程。 正碳离子的化学行为 以酸为催化剂的烷基化反应中,酸所提供的氢质子与烯烃的加成反应是产生正碳离子的主要反应。 C H H H CH 3 CH 3 CH 3CH 3 CH 3 CH 3 H H H C C C C
第四章维生素解释题 1 .维生素 2 .抗维生素 3 .维生素缺乏症 4. 维生素中毒症5 .脂溶性维生素 6 .水溶性维生素 7 .维生素原 8 .内源因子 填空题 1 .维生素A 是带β- 白芷酮环的不饱和一元醇,可被氧化成_____ ,它作为_____的组分在暗视觉中起作用。 2. 维生素D 是_____类化合物,它在人体内具有生物活性的分子形式为_____。 3 .维生素B 1 是由_____和_____借助甲烯基连接成的水溶性维生素。 4 .维生素B 1 的衍生物Tpp 是催化_____反应的一种辅酶,又称_____ 酶。 5 .维生素B 2 是由和6,7 一二甲基异咯嗪缩合成的橘黄色针状结晶,故维生素B 2 又称_____ 。 6. FMN 、FAD 在有关酶的催化反应中起作用,这是由于维生素B 2 分子中_____环上的1 位和10 位氮原子具有活泼双键能可逆地加氢脱氢的缘故。 7 .维生素PP 的化学本质是_____ ,缺乏它会引起_____病。 8 .生物素是_____的辅酶,在有关催化反应中起_____作用。 9 .叶酸是由_____、_____和L- 谷氨酸构成的。 10 .四氢叶酸(THFA )是由二氢叶酸在二氢叶酸还原酶和_____存在下还原成的,它在代谢中起_____作用。 11 .四氢叶酸分子中_____和_____原子参与一碳单位的转移。 12. 维生素B 12 在体内的辅酶形式有5- 脱氧腺苷钴胺素、氰钴胺素、羟钴胺素、甲钴胺素,其中_____是维生素B 12 在体内的主要存在形式,作为_____的辅酶在代谢中起作用。 13. 维生素C 是_____的辅酶,它参与胶原分子中的羟基化反应。 14. 维生素K 促进_____的合成。 一酮酸氧化脱羧反应需要的辅因子,除了硫辛酸、CoA-SH, FAD, NAD + 外,还有_____ 。 16 .缺乏维生素B1 可使神经组织中_____堆积,引起_____ 病。 17 .在嘌呤核苷酸从无到有的生物合成途径中,所需要的维生素为_____ 和_____ 。 18 .参与琥珀酸脱氢生成延胡羧酸反应的辅酶是_____ 。 19. 人类长期不摄人蔬菜、水果,将可能导致_____和_____这两种维生素的缺乏。 20. 由乙酰CoA 生成丙二酰CoA 需要_____作为酶的辅因子。 21 .脂溶性维生素包括_____ 、_____ 、_____ 、_____ 和_____ 。 22 .水溶性维生素包括维生素B 族和。维生素B 族有_____、_____ 、_____ 、_____ 、_____、_____和_____。 23 .维生素D 3 必须在_____、_____ 进行羟化反应生成_____,才有生物活性。 24 .谷氨酸脱羧生成_____,其脱氢酶的辅酶是_____。 25 .维生素C 参与体内_____、_____、_____ 等合成过程中的羟化作用。 26 .维生素B 1 构成的辅酶是_____ ,如果缺乏,糖代谢发生障碍,_____和_____在神经组织堆积,引起脚气病。 27. 维生素B 2 又名,它是由和缩合而成,其构成的辅基主要生化功能是_____ 。 28. 维生素PP 是_____衍生物,包括_____和_____,其构成的辅酶生化功能是_____。 29. 维生素B 6 包括_____ 、_____ 和_____ 。其中_____ 和_____ 经磷酸化成为辅酶,起_____ 作用。 30. 维生素C 是含6 个碳原子的_____ 化合物,其分子中C 2 及C 3 上的两个相邻的烯 醇式羟基,既可_____而呈酸性,又可_____生成氧化型维生素 C 。 31 .维生素A 主要以视黄醇的形式存在,它的结构是一种含有_____环的,在体内可以氧化生成_____及_____ 。 32. _____、_____、_____ 、_____ 在体内可以转化成为维生素A ,故称维生素A 原,但它们的转化效能并不相同,其中以_____ 转化率最高。
第八章聚合物化学反应 1. 聚合物化学反应有哪两种基本类型? 答:聚合物化学反应主要有以下两种基本类型。 ①相对分子质量基本不变的反应,通常称为相似转变。高相对分子质量的母体聚合物,在缓和的条件下,使基团转化为另一种基团,或把另一种基团引到分子链上,这种反应往往仅适用于分子链不含弱键的聚合物。 ②相对分子质量变大的反应,如交联、接枝、嵌段、扩链等。 2. 聚合物降解有几种类型?热降解有几种情况?评价聚合物的热稳定性的指标是什么?答:聚合物的降解有热降解、机械降解、超声波降解、水解、化学降解、生化降解、光氧化降解、氧化降解等。 热降解有解聚、无规断链和取代基的消除反应等。 评价聚合物热稳定性的指标为半寿命温度Th。聚合物在该温度下真空加热40~50(或30)min,其质量减少一半。 3. 从醋酸乙烯酯单体到维尼纶纤维,需经哪些反应?每一反应的要点和关键是什么?写出反应式。作纤维用与作悬浮聚合分散剂使用的聚乙烯醇有何差别? 答:(1) 须经自由基聚合发应、醇解反应及缩醛化反应。 (2) 各步反应要点和关键如下: ①自由基聚合反应 要点:用甲醇为溶剂进行溶液聚合以制取适当相对分子质量的聚醋酸乙烯酯溶液。 关键:选择适宜的反应温度,控制转化率,用甲醇调节分子量以制得适当相对分子质量,且基本不存在不能被醇解的醋酸乙烯酯侧基。 ②醇解反应: 要点:用醇、碱或甲醇钠作催化剂,在甲醇溶液中醇解。 关键:控制醇解度在98%以上。 ③缩醛化反应(包括分子内和分子间) 要点:用酸作催化剂在甲醛水溶液中反应。 关键:缩醛化程度必须接近90% 纤维用和悬浮聚合分散剂用的聚乙烯醇的差别在于醇解度不同。前者要求醇解度高(98%~99%)以便缩醛化。后者要求醇解度中等(87%~89%),以使水溶性好。 4. 将PM MA、PAN、PE、PVC 四种聚合物进行热降解反应,分别得到何种产物。 答:PM MA进行热解反应时发生解聚,主要产物为单体。 PE进行热解反应时发生无规降解,主要产物为不同聚合度的低聚物。 PVC进行热解反应时首先脱HCI,生成分子主链中带烯丙基氯的聚合物;长期热解则进一步发生环化交联甚至碳化反应。 PAN进行热解反应时首先发生主链环化,然后脱氢生成梯形聚合物。进一步热解脱氢后生成碳纤维。 5. 用化学反应式表示下列各反应: 1)聚乙烯的氯化;
烷基化操作规程 流出物制冷硫酸法 烷基化装置操作手册 目录 第一章、工艺简介 第二章、工艺原理 第三章、操作原理 第四章、开停工指南 第五章、硫酸安全使用手册 第六章、化验分析手册 第七章、故障及分析
第一章工艺简介 本章内容主要介绍烷基化过程中的基本化学原理,讨论对产品质量有较大影响的操作变量。 烷基化反应实在强酸存在的条件下轻烯烃(C3、C4、C5)和异丁烷的化学反应。虽然烷基化反应在没有催化剂存在时在高温下也可以发生,但是目前投入工业运行的主要的低温烷基化装置仅以硫酸或者氢氟酸做催化剂。一些公司正在继续致力于固体酸催化剂烷基化装置的工业化。烷基化过程发生的反应较为复杂,产品沸点范围较宽。选择合适的操作条件,大多数产品的馏程能够达到所期望的汽油馏程,马达法辛烷值范围88~95,研究法辛烷值范围93~98。 STRATCO流出物制冷硫酸法烷基化工艺极其专利反应设备(STRATCO接触式反应器)的设计可促进烷基化反应、抑制副反应如聚合反应的发生。副反应提高了酸消耗量,并造成产品干点升高、辛烷值降低。 本章的其余部分将对影响烷基化产品质量的烷基化反应化学原理及其工艺变量进行讨论。 A.化学原理 在STRATCO烷基化工艺中,烯烃与异丁烷在硫酸催化剂存在的情况下发生反应,形成烷基化物——一种汽油调和组分。进料中存在的正构烷烃不参加烷基化反应,但会在反应区域内起到稀释剂的作用。 下列化学式即可表示理想的C3、C4、C5烯烃的烷基化反应: CH3 CH3 H2SO4 H C CH3 +CH2 = C CH3CH3 C CH2CH CH3 CH3 CH3 CH3 CH3 实际的反应要复杂的多。这些反应在酸连续相乳化液进行,在乳化液中烯烃与异丁烷接触。酸/烃乳化液通过在STRATCO的专利设备——接触式反应器中对酸烯烃混合物剧烈搅拌得到。 STRATCO烷基化反应工艺使用硫酸作为催化剂。根据定义,催化剂可以加快化学反应,但自身不发生变化。然而,在硫酸烷基化工艺中,必须连续的向系统中加入硫酸。由于副反应及进料中的污染物造成酸浓度下降,所以需要向系统中补充酸。聚合反应是一种与烷基化反应竞争的副反应。在聚合反应中,烯烃分子相互反应形成几种聚合物,产生高终馏点、低辛烷值的产品,以及可导致高耗酸的酸溶性油。 B.反应条件的影响 反应区内对烷基化反应有利并抑制竞争副反应的条件是: ——高异丁烷浓度 ——低烯烃空速 ——低反应温度 ——剧烈搅拌 ——高酸强度 1.异丁烷浓度 为了加快期望的烷基化反应,必须在反应区内保持高浓度的异丁烷。因为异丁烷在酸中的溶解度比烯烃的溶解度低,所以异丁烷需要保持高浓度,以抑制在酸相中可能发生的烯烃聚合反应。混合进料中的异丁烷与烯烃体积比一般控制在7:1至10:1的范围内变化。由于异丁烷的消耗量大约与进料中的烯烃成化学计算比例,反应区域内物料中过量的异丁烷可以予以回收,并再循环到反应但愿。异丁烷的回收可以在制冷压缩单元及分馏单元中进行。 稀释剂可降低异丁烷的浓度,因而产生有害影响。正丁烷及丙烷,尽管是烷基化反应中的不活泼成分,如果不将其以外排物流方式清除,这些成分可能发生积聚。丙烷可以通过从制冷剂储罐到脱丙烷塔的制冷剂中分出一部分的方式将其从单元中清除。正丁烷可以在分馏单元中以产品物料形式清除。 2.烯烃空速
第四章 酰化反应 答案 一、完成下列反应 1、 Cl Cl Cl O O +AlCl 3 西替利嗪中间体 金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。实用医药杂志。2005.22(12).1108-1109 2、 N H H N O Cl O Cl N H N O Cl O HCl 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 3、 N H H N O Cl O O N H N O Cl O 2 HCl Cl 3 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 4、 N H H N O NaH N H Na N O CH COCl N H N O O 青霉素。 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 5、 H H N O SO 2Cl N H N O O 2 HCl 半合成β-内酰胺类抗生素 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000
6、 O O 3 C O CH 2CH 2COOH 芬不芬 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,1340 7 N H S O O O N S COCH 3 乙酰丙嗪 8 NH 2COOH NHCOCH 3COOH 安眠酮 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,13 9 N N S H 2N SH O 3 O N N S HN SH 3 乙酰唑胺 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,14 10 NH 2 OH O O O NHCOCH 3 OH 嘧啶苯芥 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,15 11 NH 2 3NHCOCH 3 磺胺类药物 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,17 12
过程三:原料药合成控制 酰化技术基本理论知识习题及答案 1.解释下列名词或术语 DCC,:二环己基碳二亚胺 DMSO:二甲基亚砜 DEPC,:焦碳酸乙二脂 Hoesch 反应:酚或酚醚在氯化氢和氯化锌等Lewis酸的存在下,与腈作用,随后进行水解,得到酰基酚或酰基酚醚: Vilsmeier反应:以氮取代的甲酰胺为甲酰化剂,再三氯氧磷的作用下,在放缓及防杂环上引入甲酰基的反应。 Claisen反应:一个无氢原子的醛与一个带有氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到不饱和醛或酮: Reisen-Tiemann反应:酚与氯仿及碱液反应生成芳醛的反应。 2.常见的酰化剂有哪些?他们的酰化能力、应用范围、以及使用条件上有何异同点? 作为酰化剂的羧酸衍生物酰化能力强弱顺序: RCO·H al >(RCO) O > RCOO Rˊ> RCOOH > RCONH Rˊ 2 3.羧酸和醇的酯化反应有何特点?加速反应和提高收率都有哪些方法?总结酯化反应的其他方法,并用实例加以说明。 反应物结构 对于羧酸(RCOOH),其羰基碳原子的 亲电性越强、位阻越小,反应越容易; 配料比及操作特点 酯化反应是一可逆平衡反应,要想提高产物的收率,较多采用将水蒸馏除去的方法。
除去水可用以下几种方法: (1)加脱水剂 加入如浓硫酸、无水氯化钙、无水硫酸酮、无水硫酸铝等。 (2)蒸馏除水 (3)共沸脱水 某些溶剂能与水形成具有较低共沸点的二元或三元共沸混合物,可以在较低温度水蒸馏除去。 4.羧酸法酯化反应常用的催化剂有哪些?要酰化酚类应用哪些方法? 常用的催化剂有以下几种。 (1)质子酸 质子酸催化剂主要有浓硫酸、高氯酸、四氟硼酸、氯化氢气体等无机酸及苯磺酸、对甲苯磺酸等有机酸。如: HOOCCH 2CH 2NH 2 424 25~60 ROOCCH 2CH 2NH 2 (34~94%) (2)Lewis 酸 常用的Lewis 酸催化剂有BF 3、AlCl 3、ZnCl 2及硅胶等。如: (94%) CH CHCOOCH 3 CH 3OH CH CHCOOH C 2H 5COOH n BuOH AlCl 3 2H 5COOBu n (97%) (3)强酸型离子交换树脂 如醋酸甲酯的制备,反应仅10分钟,收率即可达94%。 CH 3COOH CH 3OH R 34 10min CH 3COOCH 3 (94%) 5.胺类化合物的酰化活性一般有什么规律? N-酰化是制备酰胺类化合物的重要方法。被酰化的可以是脂肪胺,也可以是芳香胺;可以是伯胺,也可以是仲胺。 一般活性规律是;伯胺>仲胺,位阻小的胺>位阻大的胺,脂肪胺>芳香胺。
第四章化学平衡练习题 一、判断与问答题: 1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。 2.在恒定的温度和压力条件下,某化学反应的?r G m就是在一定量的系统中进行1mol 的化学反应时产物与反应物之间的吉布斯函数的差值。 3.因为= - RT ln K ,所以是平衡状态时的吉布斯函数变化。 4.是反应进度的函数。 5.在等温等压条件下,?r G m > 0 的反应一定不能进行。 6.?r G m的大小表示了反应系统处于该反应进度ζ 时反应的趋势。 7.任何一个化学反应都可以用来判断其反应进行的方向。 8.在等温、等压、W' = 0 的条件下,系统总是向着吉布斯函数减小的方向进行。若某 化 学反应在给定条件下?r G m < 0 ,则反应物将完全变成产物,反应将进行到底。 9.在等温、等压不作非体积功的条件下,反应的? r G m < 0 时,若值越小,自发进行反应的趋势也越强,反应进行得越快。 10.某化学反应的? r G m若大于零,则K 一定小于1。 11.理想气体反应 A + B = 2C ,当p A = p B = p C时,的大小就决定了反应进行方向。12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。 13.在给定温度和压力下发生的PCl5的分解反应,只须测定平衡时混合气体的密度就可以求知平衡常数了。 14.因K = f (T) ,所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。 15 .若已知某气相生成反应的平衡组成,则能求得产物的。 16.温度T时,若K = l ,说明这个反应在此温度,压力为100kPa的条件下已达到平衡。 17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。 18.因K = ∏(a Bν) ,所有化学反应的平衡状态随化学反应计量系数而改变。 19.有供电能力(W f ≠ 0) 的可逆电池反应体系的状态,在“G~ξ”曲线上可存在的位置? 20.“纯是相对的,绝对纯的物质是没有” ,试从反应的亲合能A 上分析这句话的道理? 21.化学反应亲合势愈大,则自发反应趋势越强,反应进行得愈快,对否? 22.标准平衡常数与标准反应自由能的关系:,那么,为什么反应的平衡态与标准态是不相同的?
第四章 酰化反应 练习题 一、完成下列反应 1、 Cl Cl O +AlCl 3 2、 N H H N O Cl O Cl 3、 H H N O Cl O O Cl 3 4、 H H N O NaH CH 3COCl 5、 H H N O SO 2Cl 6、 O O AlCl 3 7 N H S O O O 8 NH 2COOH
N N S H 2N SH O 3 O 10 NH 2 OH O 3 O 11 NH 2 3 12 NH 2 F 3C Cl 2CH 3CN 13 NHNH 2 O O O 14 O COCl +(CH 3)2CHCH 2CHCOOCH 2 OH 15 NH 2 CF 3 2 CH 3 16 COOH NO 2 HOCH CH N(C H )xylene 17 CH 3 NH 2CH 3 ClCH 2COCl
H 3 H 2+H 3C O O Et 3N,DMF 19 NHCH 3 C Cl ClCH 2COCl C 6H 12 20 F +Cl O 21 OH AC 2O 22 OH OH O +H 3C O CH 3 O O H SO 23 H 3CO NHNHSO 3Na Cl COCl 24 N H Cl Cl ClCH 2COCl 25 H 3C CH 3 CH 3COCl 3
H 3CO CH 3CH 2COCl AlCl 3 27 HO HO POCl 3,ClCH 2COOH 28 H 3C S Cl O 3O H N OH O 29、 HC CH Cl Cl O 3 30、 N S NH 2 O O O O C H OH H 31、 S O O O 32、 O O O O H 3PO 4 33、 1) N H N O TMSCl N O
第四章醌类化合物练习题 一、名词解释 1. 醌类化合物:分子内具有不饱和环二酮结构(醌式结构)或容易转变成这样结构的天然有机化合物。 2. 菲醌类:具有菲醌母核的化合物,于生物合成上可能来源于二萜类,故常称其为二萜醌类成分。 二、简答题 1. 简述醌类化合物的分子类型及其分类 答:苯醌、萘醌、菲醌、蒽醌。天然苯醌类化合物分为对苯醌和邻苯醌两大类;萘醌类化合物分为α(1,4)、β(1,2)、amphi(2,6)三类;天然菲醌衍生物主要包括邻醌及对醌两大类;蒽醌类成分包括蒽醌衍生物,包括1,2-蒽醌、1,4-蒽醌、9,10-蒽醌,根据羟基分布不同,蒽醌分为大黄素型和茜草素型;蒽酚和蒽酮衍生物;二蒽酮类,包括中位(meso-)连接二蒽酮类、α-位连接二蒽酮类。 2. 简述萘醌的特性 答:α-萘醌类是黄色结晶,可升华,微溶于水,能溶于乙醇和乙醚; 天然萘醌衍生物多为橙黄色或橙红色结晶,个别为紫色结晶; 许多萘醌类有很明显的生物活性,如抗感染、抗癌、抗凝血等。 3. 简述醌类化合物的溶解性特点 答:游离醌:溶于乙醇、乙醚、苯、氯仿等有机溶剂,难溶于水; 醌苷类:易溶于甲醇、乙醇,溶于热水,不溶于乙醚、苯、氯仿。 4. 如何判断醌类化合物的酸性强弱? 答:强弱取决于是否有羧基及酚羟基的数目、位置; 含–COOH > 含两个以上β-OH > 含一个β-OH > 含两个α-OH > 含一个α-OH 5. 简述醌类化合物颜色反应类型,如何判断结果 答:Feigl reaction:醌类衍生物在碱性条件下加热能迅速与醛类及邻二硝基苯反应生成紫色化合物。 无色亚甲兰显色试验:若出现兰色斑点,可能含苯醌或萘醌;不显色,可能含蒽醌。 与活性次甲基试剂的反应:醌环尚未完全取代的苯醌或萘醌,可在氨的碱性环境中与活性次甲基试剂的溶液反应,生成兰绿或兰紫色。 与金属离子的反应:醋酸镁反应:α-OH,邻-OH:显兰、兰紫色;间—OH:橙红、红色;对—OH:紫红、紫色。 Borntrager’s reaction:羟基蒽醌类在碱性溶液中发生颜色改变,会使颜色加深。多呈橙、红、紫红色及蓝色。 6. 简述一般醌类成分的提取分离方法 答:有机溶剂提取法;碱提酸沉法;水蒸气蒸馏法;其它方法,如超临界流体萃取法、超声波提取法。 7. 简述用于醌类化合物结构鉴定的衍生物制备方法 答:甲基化反应、乙酰化反应。 8. 简述羟基类型对制备甲基化醌类化合物的影响及常用的甲基化试剂。 答:–OH 类型不同,化学环境不同,其甲基化反应难易不同,R-OH < α-酚OH < β-酚OH <-COOH; 常用的甲基化试剂:重氮甲烷(CH2N2)、碘甲烷(CH3I)、硫酸二甲酯((CH3)2SO4)等。 9. 简述羟基类型对制备乙酰化醌类化合物的影响及常用的乙酰化试剂及反应能力。 答:–OH 类型不同,乙酰化反应难易不同,α-酚OH <β-酚OH 第七章芳烃习题 1、写出单环芳烃C9H12的同分异构体的构造式并命名之。 解: 正丙苯异丙苯邻甲基乙基苯间甲基乙基苯 对甲基乙基苯连三甲苯偏三甲苯均三甲苯 或1,2,3-三甲苯或1,2,4-三甲苯或1,3,5-三甲苯2、写出下列化合物的构造式。 (1)3,5-二溴-2-硝基甲苯(2)2,6-二硝基-3-甲氧基甲苯Br Br CH3 NO2CH3 NO2 O2N OCH3 (3)2- 硝基对甲苯磺酸(4)三苯甲烷 SO3H H3C NO2 CH (5)反二苯基乙烯(6)环己基苯 C=C H H (7)3-苯基戊烷(8)间溴苯乙烯 CH3CH2CHCH2CH3 CH=CH2 Br (9)对溴苯胺 (10)对氨基苯甲酸 Br NH 2 NH 2 COOH (11)8-氯-1-萘甲酸 (12)(E )-1-苯基-2-丁烯 Cl COOH C=C H CH 3H H 2C 3、 写出下列化合物的结构式。 (1)2-nitrobenzoic acid (2)p-bromotolutuene NO 2 COOH H 3C Br (3)o-dibromobenzene (4)m-dinitrobenzene Br Br NO 2 NO 2 (5)3,5-dinitrophenol (6)3-chloro-1-ethoxybenzene NO 2 NO 2HO OC 2H 5 Cl (7)2-methyl-3-phenyl-butanol (8)p- chlorobenzenesulfonic acid CH 3 CH 3CHCHCH 2OH SO 3H Cl (9)benzyl bromide (10)p-nitroaniline CH 2Br O 2N NH 2 (11)o-xylene (12)tert-butylbenzene 第四章循环系统药物 4-1、非选择性β-受体拮抗剂propranolol得化学名就是 A、 1-异丙氨基-3-[对-(2-甲氧基乙基)苯氧基]-2-丙醇 B、 1-(2,6-二甲基苯氧基)-2-丙胺 C、 1-异丙氨基-3-(1-萘氧基)-2-丙醇 D、 1,2,3-丙三醇三硝酸酯 E、 2,2-二甲基-5-(2,5-二甲苯基氧基)戊酸 4-2、属于钙通道阻滞剂得药物就是:B A、H N O N N B、H N O O O NO2 O C、 D、 O OH O E、O O I I O N 4-3、 Warfarin sodium在临床上主要用于:D A、抗高血压 B、降血脂 C、心力衰竭 D、抗凝血 E、胃溃疡 4-4、下列哪个属于Vaughan Williams抗心律失常药分类法中第Ⅲ类得药物:A A、盐酸胺碘酮 B、盐酸美西律 C、盐酸地尔硫卓 D、硫酸奎尼丁 E、洛伐她汀 4-5、属于AngⅡ受体拮抗剂就是: E A、 Clofibrate B、 Lovastatin C、 Digoxin D、 Nitroglycerin E、 Losartan 4-6、哪个药物得稀水溶液能产生蓝色荧光:A A、硫酸奎尼丁 B、盐酸美西律 C、卡托普利 D、华法林钠 E、利血平 4-7、口服吸收慢,起效慢,半衰期长,易发生蓄积中毒得药物就是:D A、甲基多巴 B、氯沙坦 C、利多卡因 D、盐酸胺碘酮 E、硝苯地平 4-8、盐酸美西律属于(B)类钠通道阻滞剂。 A、Ⅰa B、Ⅰb C、Ⅰc D、Ⅰd E、上述答案都不对 4-9、属于非联苯四唑类得AngⅡ受体拮抗剂就是:A A、依普沙坦 B、氯沙坦 C、坎地沙坦 D、厄贝沙坦 E、缬沙坦 4-10、下列她汀类调血脂药中,哪一个不属于2-甲基丁酸萘酯衍生物? E A、美伐她汀 B、辛伐她汀 C、洛伐她汀 D、普伐她汀 E、阿托伐她汀 二、配比选择题 [4-11~4-15] A、利血平 B、哌唑嗪 C、甲基多巴 D、利美尼定 E、酚妥拉明 4-11、专一性α1受体拮抗剂,用于充血性心衰B 4-12、兴奋中枢α2受体与咪唑啉受体,扩血管D 4-13、主要用于嗜铬细胞瘤得诊断治疗E 第四章 化学平衡 一、基本公式和内容提要 1. 化学反应的方向和限度 (1)反应系统的吉布斯自由能和反应进度 反应进行过程中,A 和B 均各以纯态存在而没有相互混合,则在反应进度为ξ时反应体系的总吉布斯自由能G *为: G * = n A μA * + n B μB * = (1-ξ)μA * +ξμB * = μA * +ξ(μB * -μA *) 对于封闭体系在定温定压下在反应实际进行过程中,A 和B 是不可能以纯态存在的。它们是混合在一起的,因此还存在混合吉布斯自由能△mix G 。 △mix G = RT (n A lnX A + n B lnX B ) = RT [(1-ξ)ln(1-ξ) + ξlnξ] (2)化学反应标准平衡常数 理想气体的化学反应 ()()()( a A g b B g g G g h H g ??→++←?? b B a A h H g G P P P P P P P P ) /()/()/()/(θ θ θθ= e ) --(1θ θ θ θ μμμμB A H G b a h g RT - += 常数 = K θ K θ称为标准平衡常数。 (3)化学反应的等温方程式 (a )对任意反应达平衡时:△r G m θ = -RTlnK θ △r G m θ是指产物和反应物均处于标准态时,产物的吉布斯自由能和反 应物的吉布斯自由能总和之差,称为反应的“标准吉布斯自由能变化”。 (b )反应在定温定压条件下 △r G m = △r G m θ+ RT ln Q p 上式称为范特霍夫(V ait Hoff) 等温方程。 (c )依据吉布斯自由能函数可判断反应进行的方向,在温度、压力一定的条件下: RT ln Q a < RTlnK θ Q a <K θ △r G m <0 反应正向自发进行 若 RT ln Q a >RTlnK θ Q a >K θ △r G m >0 反应逆向自发进行 第四章 化学平衡练习题 一、判断与问答题: 1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。 2.在恒定的温度和压力条件下,某化学反应的?r G m 就是在一定量的系统中进行1mol 的 化学反应时产物与反应物之间的吉布斯函数的差值。 3.因为m r G ?= -RT ln K ,所以m r G ?是平衡状态时的吉布斯函数变化。 4.m r G ?是反应进度的函数。 5.在等温等压条件下,?r G m > 0的反应一定不能进行。 6.?r G m 的大小表示了反应系统处于该反应进度ζ时反应的趋势。 7.任何一个化学反应都可以用m r G ?来判断其反应进行的方向。 8.在等温、等压、W’ = 0的条件下,系统总是向着吉布斯函数减小的方向进行。若某化 学反应在给定条件下?r G m < 0,则反应物将完全变成产物,反应将进行到底。 9.在等温、等压不作非体积功的条件下,反应的? r G m < 0时,若值越小,自发进行反应 的趋势也越强,反应进行得越快。 10.某化学反应的? r G m 若大于零,则K 一定小于1。 11.理想气体反应 A + B = 2C ,当p A = p B = p C 时,m r G ?的大小就决定了反应进行方向。 12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。 13.在给定温度和压力下发生的PCl 5的分解反应,只须测定平衡时混合气体的密度就可 以求知平衡常数了。 14.因 K = f (T ),所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。 15.若已知某气相生成反应的平衡组成,则能求得产物的m r G ?。 16.温度T 时,若K = l ,说明这个反应在此温度,压力为100kPa 的条件下已达到平衡。 17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。 18.因K = ∏(a B ν) ,所有化学反应的平衡状态随化学反应计量系数而改变。 19.有供电能力(W f ≠ 0)的可逆电池反应体系的状态,在“G ~ξ”曲线上可存在的位置? 20.“纯是相对的,绝对纯的物质是没有”,试从反应的亲合能A 上分析这句话的道理? 21.化学反应亲合势愈大,则自发反应趋势越强,反应进行得愈快,对否? 22.标准平衡常数与标准反应自由能的关系: K RT G ln m r -=?,那么,为什么反应的 平衡态与标准态是不相同的? 23.欲使反应产物的平衡浓度最大,反应物的投料比一般为多大? 24.对于计量系数?ν = 0的理想气体化学反应,哪些因素变化不改变平衡点? 25.平衡常数 K = 1的反应,在标准态下反应,反应朝什么方向进行? 26.在空气中金属不被氧化的条件是什么? 27.反应PCl 5(g) = PCl 3(g) + Cl 2(g) 在212℃、p 容器中达到平衡,PCl 5 离解度为0.5, 反应的m r H ?= 88 kJ·mol -1,以下情况下,PCl 5的离解度如何变化: (A) 通过减小容器体积来增加压力; (B) 容器体积不变,通入N 2气来增加总压力; (B) 升高温度; (D) 加入催化剂。 28.对于复分解反应,如有沉淀、气体或水生成,则容易进行到底,试以化学平衡理论 分析其道理? 29.2HgO(s) = 2Hg(g) + O 2(g),在反应温度下及p = 101.325kPa 时,K = 4×10-3,试问 HgO(s) 的分解压力多大?当达到分解温度时,与HgO(s) 平衡的p Hg 有多大?若在标 准状态下反应,体系的总压力是多少? 30.反应CO(g) + H 2O(g) = CO 2(g) + H 2(g),在600℃、100kPa 下达到平衡(各物质的逸度 系数均为1),当压力增大到500kPa 时,各物质的逸度系数分别为:γ (CO 2) = 1.09, γ (H 2) = 1.10,γ (CO) = 1.23,γ (H 2O) = 0.77,问这时平衡点向何方移动? 31.反应CaCO 3(s) = CaO(s) + CO 2(g) 在常温常压下的分解压力并不等于零,那么古代大 理石建筑物何以能够保留至今而不倒? 烷基化流程简述 装置由原料加氢精制、反应、制冷压缩、流出物精制和产品分馏及化学处理等几部分组成。 原料加氢精制 自MTBE来的未反应C4馏分经凝聚脱水器脱除游离水后进入原料缓冲罐,经泵抽出换热、加热到反应温度后与来自系统的氢气在静态混合器中混合,进入加氢反应器底部床层,反应物从反应器顶部出来,与加氢裂化液化气(来自双脱装置,进入缓冲罐,经泵抽出)混合进入脱轻烃塔(脱除C3以下轻组分和二甲醚)。塔顶轻组分经冷凝器冷凝,进入回流罐,不凝气排至燃料气管网,冷凝液部分顶回流,部分作为液化气送出装置。塔底C4馏分经换热、冷却至40℃进入烷基化部分。 反应部分 烯烃与异丁烷的烷基化反应,主要是在酸催化剂的作用下,二者通过中间反应生成汽油馏分的过程。 C4馏分与脱异丁烷塔来的循环异丁烷混合经换冷至11℃,经脱水器脱除游离水(10ppm)后与闪蒸罐来的循环冷剂直接混合,温降至3℃分两路进入烷基化反应器。反应完全的酸-烃乳化液经一上升管直接进入酸沉降器,分出的酸液循下降管返回反应器重新使用,90%浓度废酸排至废酸脱烃罐,从酸沉降器分出的烃相流经反应器内的取热管束部分汽化,汽-液混合物进入闪蒸罐。净反应流出物经泵抽出经换热、加热至约31℃去流出物精制和产品分馏部分继续处理。循环冷剂经泵抽出送至反应进料线与原料C4直接混合,从闪蒸罐气相空间出来的烃类气体至制冷压缩机。 制冷压缩部分 从闪蒸罐来的烃类气体进入压缩机一级入口,从节能罐顶部来的气体进入二级入口,上述气体被压缩到今天为止.2kg/cm2,,经空冷器冷凝,冷凝的烃类液体进入冷剂罐,后进入节能罐,在其内闪蒸,富含丙烯的气体返回压缩机二级入口液体去闪蒸罐,经降压闪蒸温度降低至-10℃左右,经泵抽出送至反应器入口循环。冷剂的一小部分经泵抽出至抽出丙烷碱洗罐碱洗,以中和可能残留的微量酸,从罐抽出的丙烷经丙烷脱水器脱水后送出装置。 流出物精制和产品分馏部分 目的是脱除酸脂(99.2%的硫酸+12%的NaOH)。 换热后的反应流出物进入酸洗系统,与酸在酸洗混合器内进行混合后,进入流出物酸洗罐,绝大部分酸脂被吸收。流出物烃类和酸在酸洗罐中分离,烃类流出物酸含量低于10ppm,酸则连续进入反应器作为催化剂使用。 酸洗后的流出物与循环碱液在流出物碱洗混合器中混合后,进入碱洗罐脱除微量酸,进入流出物水洗罐含硫酸钠和亚硫酸盐的碱水经泵从罐底抽出换热后送回混合器入口循环使用。 从流出物水洗罐顶部出来的流出物换热后进入脱异丁烷塔,塔顶馏出物经空 第七章芳烃 1.写出单环芳烃C9H12的同分异构体的构造式并命名之。 答案: 2.写出下列化合物的构造式。 (1)3,5-二溴-2-硝基甲苯(2)2,6-二硝基-3-甲氧基甲苯(3)2- 硝基对甲苯磺酸(4)三苯甲烷(5)反二苯基乙烯(6)环己基苯(7)3-苯基戊烷(8)间溴苯乙烯 (9)对溴苯胺(10)氨基苯甲酸(11)8-氯-奈甲酸(12)(E)-1-苯基-2-丁烯 答案: (11)Cl COOH (12) CH 2 CH 3 3、写出下列化合物的结构式。 (1)2-nitrobenzoie acid (2)p-bromotoluene (3)o-dibromobenzene (4)m-dinitrobenzene (5)3,5-dinitrophenol (6)3-chloro-1-ethoxybenzen (7)2-methyl-3-phenyl-1-butanol (8)p-chlorobenzenesulfonic acid (9)benzyl bromide (10)p-nitroaniline (11)o-xylene (12)tert-butylbenzene (13)p-cresol (14)3-phenylcyclohexanol (15)2-phenyl-2-butene (16)naphthalene 答案: 4.在下列各组结构中应使用“”或“ ”才能把它们正确地联系起来,为什么? (1) (2) (3) (4) 答案: 两组结构都为烯丙型C+共振杂化体 注:其中第(2)小题稍有问题。从电子状态来看应用“共振”,而从E 所连的碳的构型来看,已经改变了原子核的位置,不属“共振”,本题应将题目改为如下形式: 5. 写出下列反应物的构造式. (1) (2) (3) (4) 答案: 第四章 非理想流动1.停留时间分布的密度函数在t <0时,E (t )=_______。(0) 2.停留时间分布的密度函数在t ≥0时,E (t )_______。(>0) 3.当t=0时,停留时间分布函数F (t )=_______。(0) 4.当t=∞时,停留时间分布函数F (t )=_______。(1) 5.停留时间分布的密度函数E (θ)=_______E (t )。(t ) 6.表示停留时间分布的分散程度的量=2 θσ_______2 t σ。(2 1 t ) 7.反应器物料的停留时间的分布曲线是通过物理示踪法来测定的,根据示踪剂的输入方式不同分为_______、_______、_______、_______。(脉冲法、阶跃法、周期示踪法、随机输入示踪法) 8.平推流管式反应器t t =时,E (t )=_______。(∞) 9.平推流管式反应器t t ≠时,E (t )=_______。(0) 10.平推流管式反应器t t ≥时,F (t )=_______。(1) 11.平推流管式反应器t <t 时,F (t )=_______。(0) 12.平推流管式反应器其E (θ)曲线的方差= 2 θσ_______。(0) 13.平推流管式反应器其E (t )曲线的方差 = 2 t σ_______。(0) 14.全混流反应器t=0时E (t )=_______。(t t e t - 1 ) 15.全混流反应器其E (θ)曲线的方差= 2 θσ_______。(1) 16.全混流反应器其E (t )曲线的方差 = 2 t σ_______。(2 t ) 17.偏离全混流、平推流这两种理想流动的非理想流动,E (θ)曲线的方差 2 θ σ为_______。(0~1) 18.当流体在半径为R 的管内作层流流动时,在径向存在流速分布,轴心处的流速以0 u 记,则距轴 心处距离为r 的流速=r u _______。( ] )( 1[2 0R r u -) 19.当流体在半径为R 的管内作层流流动时,管壁处的流速=R u _______。(0) 20.流体在半径为R 的管内作层流流动的停留时间分布密度函数E (t )=_______。(3 22t t ) 21.流体在半径为R 的管内作层流流动的停留时间分布函数F (t )=_______。( 2 ) 2( 1t t -) 22.脉冲示踪法测定停留时间分布0C C A 对应曲线为_______。(E (t )曲线) 23.阶跃示踪法测定停留时间分布0C C A 对应曲线为_______。(F(t)曲线) 24.非理想流动不一定是由_______造成的。(返混) 25.非理想流动不一定是由返混造成的,但返混造成了_______。(停留时间分布) 26.为了模拟返混所导致流体偏离平推流效果,可借助这种轴向返混与扩散过程的相似性,在_______的基础上叠加上轴向返混扩散相来加以修正,并认为的假定该轴向返混过程可以用费克定律加以定量描述,所以,该模型称为_______。(平推流、轴向分散模型) 27.在轴向分散模型中,模型的唯一参数彼克莱准数= e P _______。(z E uL ) 28.在轴向分散模型中,模型的唯一参数彼克莱准数愈大轴向返混程度就_______。(愈小) 29.轴向分散模型的偏微分方程的初始条件和边界条件取决于采用示踪剂的_______、_______、(完整版)第七章芳烃习题
药物化学第四章习题及答案
物理化学答案——第四章_化学平衡习题解答[1]
物理化学第四章化学平衡练习题及答案
烷基化装置流程简述
第七章 芳烃练习及答案
化学反应工程第四章习题答案