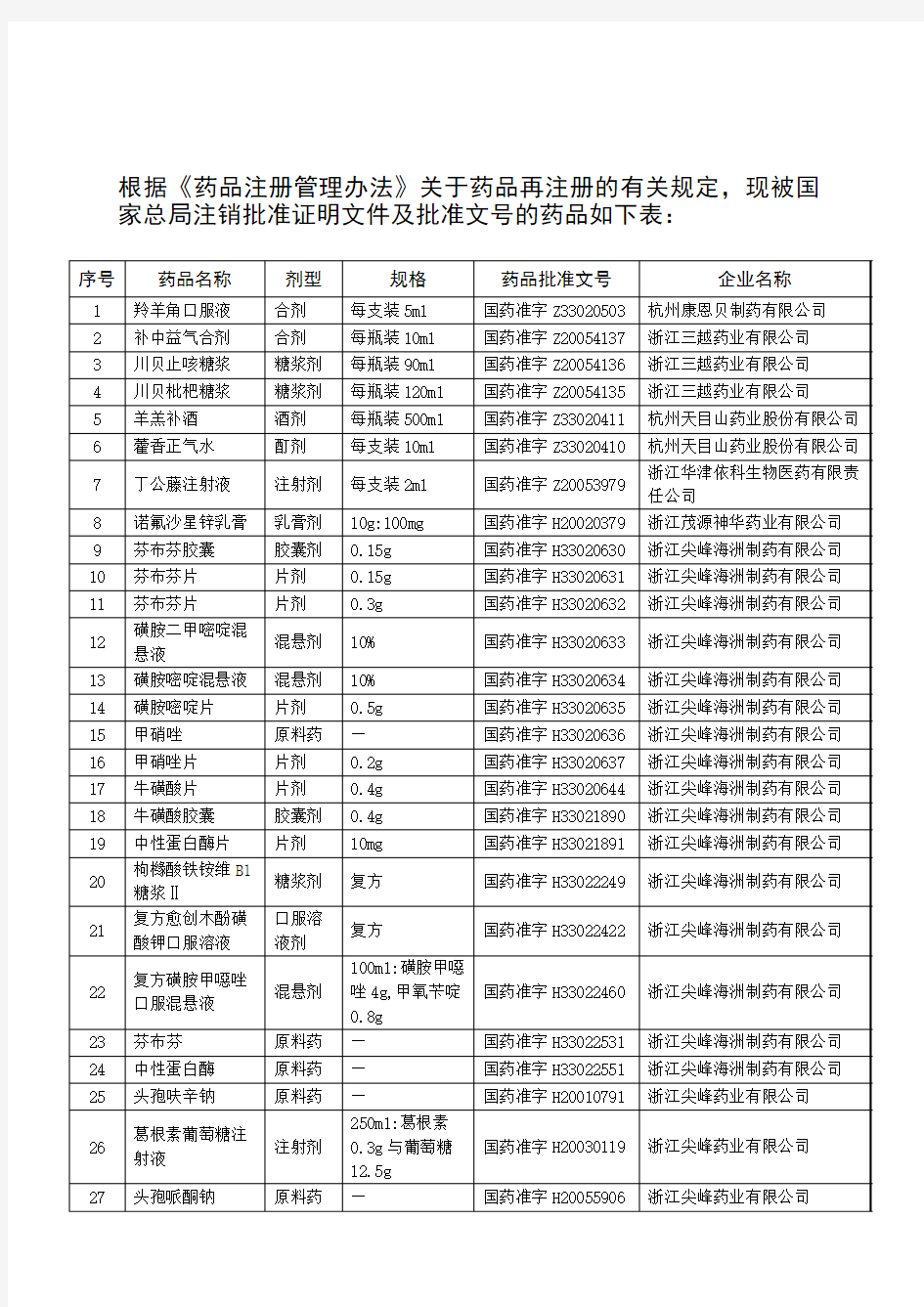
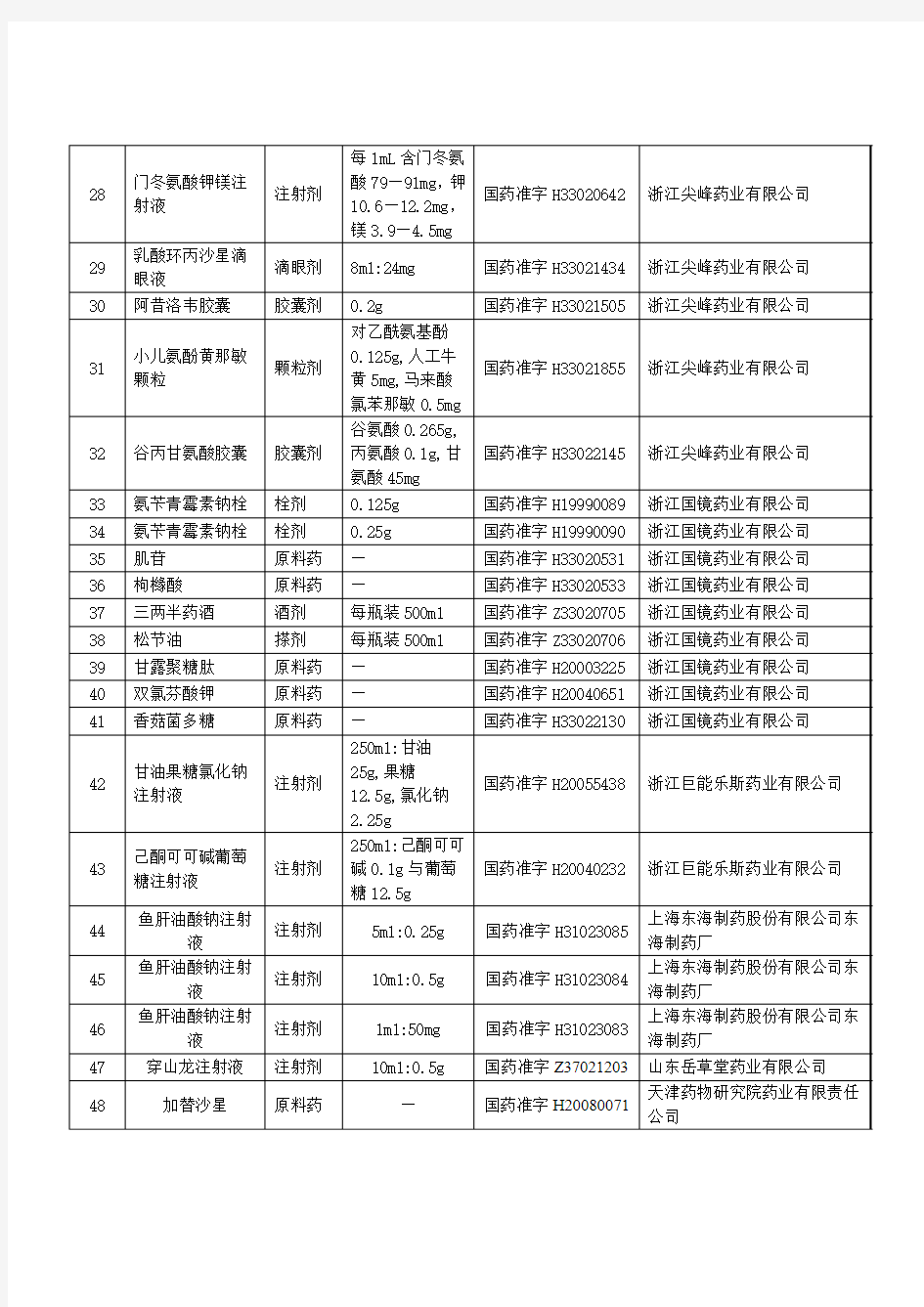
根据《药品注册管理办法》关于药品再注册的有关规定,现被国家总局注销批准证明文件及批准文号的药品如下表:
药品批准文号格式 2002年1月1日以后批准生产的新药、仿制药品和通过地方标准整顿或再评价升为国家标准的药品,采用新的药品批准文号格式 1、药品批准文号格式:国药准字+1位字母+8位数字,试生产药品批准文号格式:国药试字+1位字母+8位数字。进口药品注册证格式:由字母H(Z或S)后接八位阿拉伯数字组成,前四位为公元年号,后四位为顺序编号。化学药品使用字母“H”,中药使用字母“Z”,通过国家药品监督管理局整顿的保健药品使用字母“B”,生物制品使用字母“S”,体外化学诊断试剂使用字母“T”,药用辅料使用字母“F”,进口分包装药品使用字母“J”。数字第1、2位为原批准文号的来源代码,其中“10”代表原卫生部批准的药品,“19”、“20”代表2002年1月1日以前国家药品监督管理局批准的药品,其它使用各省行政区划代码(见附件一)前两位的,为原各省级卫生行政部门批准的药品。第3、4位为换发批准文号之年公元年号的后两位数字,但来源于卫生部和国家药品监督管理局的批准文号仍使用原文号年号的后两位数字。数字第5至8位为顺序号。 2、每种药品的每一规格发给一个批准文号。除经国家药品监督管理局批准的药品委托生产和异地加工外,同一药品不同生产企业发给不同的药品批准文号。 3、自2002年1月1日以后批准生产的新药、仿制药品和通过地方标准整顿或再评价升为国家标准的药品,一律采用新的药品批准文号格式。 4、自2002年1月1日以后批准发给的化学药品《进口药品注册证》,其注册证号格式亦作部分改变,其中字母“X”改为“H”,其它部分不变。原已发给的旧格式注册证号在换发《进口药品注册证》时用新格式取代。 5、药品批准文号及化学药品的进口药品注册证号换发后,印有原格式批准文号及注册证号的包装标签在2003年12月31日后禁止流通使用。
药品再注册申报资料项目 药品再注册申报资料项目 一、境内生产药品 1、证明性文件: (1)药品批准证明文件及药品监督管理部门批准变更的文件; (2)《药品生产许可证》复印件; (3)营业执照复印件; (4)《药品生产质量管理规范》认证证书复印件。 2、五年内生产、销售、抽验情况总结,对产品不合格情况应当作出说明。 3、五年内药品临床使用情况及不良反应情况总结。 4、有下列情形之一的,应当提供相应资料或者说明: (1)药品批准证明文件或者再注册批准文件中要求继续完成工作的,应当提供工作完成后的总结报告,并附相应资料; (2)首次申请再注册药品需要进行IV期临床试验的,应当提供IV期临床试验总结报告; (3)首次申请再注册药品有新药监测期的,应当提供监测情况报告。
5、提供药品处方、生产工艺、药品标准。凡药品处方、生产工艺、药品标准与上次注册内容有改变的,应当注明具体改变内容,并提供批准证明文件。 6、生产药品制剂所用原料药的来源。改变原料药来源的,应当提供批准证明文件。 7、药品最小销售单元的现行包装、标签和说明书实样。 二、进口药品 1、证明性文件: (1)《进口药品注册证》或者《医药产品注册证》复印件及国家食品药品监督管理局批准有关补充申请批件的复印件; (2)药品生产国家或者地区药品管理机构出具的允许该药品上市销售及该药品生产企业符合药品生产质量管理规范的证明文件、公证文书及其中文译本; (3)药品生产国家或者地区药品管理机构允许药品进行变更的证明文件、公证文书及其中文译本; (4)由境外制药厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件; (5)境外制药厂商委托中国代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国代理机构的《营业执照》复印件。 2、五年内在中国进口、销售情况的总结报告,对于不合格情况应当作出说明。
一般纳税人注销公司流程相关手续 注销公司是需要走一定的流程的,一般纳税人注销公司应该怎么走流程呢?公司注销的程序又是什么? ___为你带来了注销公司的流程,一起来看看吧! 第一步:成立清算组 公司除因分立、合并需要解散的,均应当在解散事由出现之日起十五日内成立清算组,开始清算。有限责任公司的清算组由股东组成,逾期不成立清算组进行清算的,债权人可以申请人院指定有关人员组成清算组进行清算。人民 ___应当受理该申请,并及时 ___清算组进行清算。 第二步:注销公司国、地税登记证 先到国税拿表格:按国税的要求填写、签字?、盖章、缴销 ___、补税后,它会收回国税登记证,给你一张国税注销税务登记书。 拿着国税的注销税务登记,到地税拿表格,补税后,它会收回地税税务登记证,给你一张地税注销税务登记通知书。如果公司有税务问题(税务师事务所出具查帐(企业注销要),提供所有报表,凭证,帐本及银行对帐单)。
第三步:公司主管局 ___公司注销备案 所需资料: 1、公司清算 ___负责人签署的《公司注销登记》(登记机关 ___或网上下载,公司加盖公章)。 2、《企业(公司)申请登记委托书》(登记机关 ___或网上下载,公司加盖公章),应标明具体委托事项和被委托人的权限。 3、股东提交股东会公司注销的,股东会决议由股东盖章或签字(人股东)。 ___宣告公司破产或行政机关依法责令公司关闭的提交 ___的裁定文件或行政机关的决定。 4、公司清算 ___成立文件: 有限责任公司提交股东会关于 ___公司清算 ___的决议;有限责任公司股东会决议由股东盖章或签字(自然人股东)。
___宣告公司破产或行政机关依法责令公司关闭的,提交 ___或者行政机关关于 ___公司清算 ___的文件。 5、经确认的清算报告: 有限责任公司、股份有限公司提交股东会关于确认公司清算报告的决议;有限责任公司股东会决议由股东盖章或签字(自然人股东)。 ___宣告公司破产或行政机关依法责令公司关闭的提交 ___或者行政机关确认公司清算报告的文件。 6、、规规定应当提交的其他文件。 7、《企业法人营业执照》正、副本。 8、出示公司在报纸上刊登的三次清算。 需要注意的是:依照公司登记管理登记的公司申请注销登记适用本规范。以上各项未注明提交复印件的一般均应提交原件;提交的复印件均需持原件到登记部门核对,不能提交原件的,由原件持有方核对复印件并加盖公章或签名并署明与原件一致。
浅谈进口药品注册申请中证明性文件的准备 “证明性文件”是药品申报资料项目中最重要的一份文件,是申请人所提供的证明这个药品及该申请符合有关法规的文件。同时,它也是SFDA受理中心形式审查的重要内容。一旦证明性文件有任何差错或是有不一致的地方,SFDA都会拒绝接受该申请。而由于证明性文件的修改或是重新出具,都需要境外制药厂商甚至是当地药监部门办理,有时更是需要进行公证和中国使领馆的认证,因此重新办理往往需要很长时间。由此可知,注册人员必须慎重对待此项文件,在申请递交之前就要确保这份文件的正确性,否则接到补正通知后再次办理就会耽误申请递交的时间。在本文中,笔者对于进口药品注册申请中的证明性文件进行简单的介绍,希望能够对刚从事该领域的人员有所帮助。 根据《药品注册管理办法》(28号令),对于进口药品,证明性文件包括: 1.生产国家或者地区药品管理机构出具的允许药品上市销售及该药品生产企业符合药品生产质量管理规范的证明文件、公证文书及其中文译本。 2.由境外制药厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件。境外制药厂商委托中国代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国代理机构的《营业执照》复印件。 3.申请的药物或者使用的处方、工艺等专利情况及其权属状态说明,以及对他人的专利不构成侵权的声明。 下面针对各种不同申请对证明性文件做更为详细的解释说明: 1.进口药品注册申请 进口药品申请,是指境外生产的药品在中国境内上市销售的注册申请。对于上面提到的文件1,申请人通常会提供CPP(Certificate of Pharmaceutical Product)证书,这份证书可以同时证明该药品在国外已经批准上市销售以及生产企业符合药品生产质量管理规范,而且一般国家出具的CPP证书都符合世界卫生组织推荐的统一格式,这样也就不需要经所在国公证机构公证及驻所在国中国使领馆的认证。因此,是目前进口注册申请中最为申请人经常使用的一份文件。但申请人也可以提供其他同等的文件,只要是当地的药品管理机构出具的能够证明申请药品已经批准上市销售,并且该药品生产企业符合药品生产质量管理规范就是符合受理条件的,比如“自由销售证书”+“GMP证书”就能够作出如此的证明,只是根据规定,这两份文件需要进行公证和认证。此外,还有其它形式的能做出同等证明的文件,但实际中比较少见。注册人员在使用这些文件时最好事先咨询SFDA受理中心,以证明这些文件的适用性。 以上讲的是进口制剂的该项文件的要求,对于进口原料药,因为有其特殊性,所以还需特别说明。法规中规定原料药可提供:①生产国家或者地区药品管理机构出具的允许该原料药上市销售及该药品生产企业符合药品生产质量管理规范的证明文件,也明确可提供②欧洲药典适用性证明文件(CEP,Certificate of Suitability to the Monographs of the European Pharmacopeia)与附件,或者③该原料药主控系统文件(DMF,Drug Master
中国药品生产企业排名前一百的名单 1 哈药集团有限公司 2 石家庄制药集团有限公司 3 上海医药集团有限公司 4 广州医药集团有限公司 5 天津医药集团有限公司 6 扬子江药业集团有限公司 7 华北制药集团有限责任公司 8 吉林修正药业集团股份有限公司 9 中国同仁堂(集团)有限责任公司10 北京医药集团有限责任公司11 西安杨森制药有限公司12 东北制药集团有限责任公司13 太极集团有限公司14 杭州华东医药集团有限公司15 拜耳先灵医药有限公司16 浙江海正药业股份有限公司17 步长制药集团18 珠海联邦制药股份有限公司19 齐鲁制药有限公司20 汇仁(集团)有限公司21 中国生物技术集团22 四川科伦实业集团有限公司(医药制造业部份)23 上海罗氏制药有限公司24 江西济民可信集团有限公司25 浙江医药股份有限公司26 诺和诺得(中国)制药有限公司27 山东新华医药集团有限责任公司28 阿斯利康制药有限公司29 北京诺华制药有限公司30 三九医药股份有限公司31 江苏恒瑞医药股份有限公司32 天津天士力集团有限公司(医药制造业部份)33 山东鲁抗医药集团有限公司34 辉瑞制药有限公司(中国·大连)35 丽珠医药集团股份有限公司36 上海复星医药(集团)股份有限公司(医药制造业部份)37 鲁南制药集团股份有限公司38 浙江新和成股份有限公司39 上海实业医药投资股份有限公司(医药制造业部份)40 先声药业有限公司41 利君制药42 中美上海施贵宝制药有限公司43 金陵药业股份有限公司44 康恩贝集团有限公司45 云南白药集团股份有限公司46 杭州赛诺菲安万特民生制药有限公司47 江苏康缘集团有限责任公司(医药制造业部份)48 辅仁药业集团有限公司49 河南省宛西制药股份有限公司50 菏泽睿鹰制药集团有限公司51 寿光富康制药有限公司52 广东康美药业股份有限公司53 黑龙江省珍宝岛制药有限公司54 中美天津史克制药有限公司55 成都地奥制药集团有限公司56 中国(杭州)青春宝集团有限公司57 福建省福抗
公司清算注销的详细流程 一、注销原因 公司因下列原因之一的,应当自清算结束之日起30日内向公司登记机关申请注销登记: 1.公司被依法宣告破产; 2.公司章程规定的营业期限届满或者公司章程规定的其他解散事由出时; 3.股东会决议解散; 4.公司因合并分立解散; 5.公司被依法责令关闭。 公司申请注销登记,应由公司指定或者委托公司员工或者具有资格的代理机构的代理人作为申请人办理注销登记。企业所得税在国税交纳的企业应先办理地税注销手续,注销流程按先后程序共分为五个步骤分别为注销地税、国税、银行账户、工商登记、组织机构代码证及统计证。 二、清算流程 (一)清算适用法规 公司清算因清算的性质不同而分别适用不同的法律: 1、公司因破产而清算,适用《企业破产法》和《民事诉讼
法》。 2、公司因非破产清算(是指公司自愿解散和被责令依法解散的情形,适用《公司法》和《民事诉讼法》。 (二)公司清算组备案提交的材料 1.公司清算组负责人签署的《公司备案申请表》(公司加盖公章); 2.公司签署的《制定代表或者共同委托代理人的证明》(公司加盖公章)及制定代表或委托代理人的身份证复印件(本人签字); 3.有限责任公司提交股东会关于成立清算组的决议(由代表三分之二以上表决权的股东签署;股东为自然人的由本人签字,自然人以外的股东加盖公章); 4.公司《企业法人营业执照》副本复印件(公司加盖公章)。(三)清算报告的主要内容 1.清算组的构成及何时开始清算; 2.企业的主要资产情况; 3.企业的主要债权债务情况; 4.企业的对外投资情况; 5.债权债务的清理情况、对外投资的处置情况; 6.剩余资产的分配情况。 (四)清算的具体流程 1.股东会决定公司解散,形成决议,停止一切经营活动; 2.决议形成后,15日内成立清算组,清算组由股东组成;清算组自成立之日起10日内将清算组成员、负责人名单向公司登记机
附件4: 药品补充申请注册事项及申报资料要求 一、注册事项 (一)国家食品药品监督管理局审批的补充申请事项: 1.持有新药证书的药品生产企业申请该药品的批准文号。 2.使用药品商品名称。 3.增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。 4.变更用法用量或者变更适用人群范围但不改变给药途径。 5.变更药品规格。 6.变更药品处方中已有药用要求的辅料。 7.改变影响药品质量的生产工艺。 8.修改药品注册标准。 9.替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。 10.进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。 11.申请药品组合包装。 12.新药的技术转让。 13.修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。 14.改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。 15.改变进口药品的产地。 16.改变进口药品的国外包装厂。 17.进口药品在中国国内分包装。 18.其他。 (二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项: 19.改变国内药品生产企业名称。
20.国内药品生产企业内部改变药品生产场地。 21.变更直接接触药品的包装材料或者容器(除上述第10事项外)。 22.改变国内生产药品的有效期。 23.改变进口药品制剂所用原料药的产地。 24.变更进口药品外观,但不改变药品标准的。 25.根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。 26.补充完善进口药品说明书安全性内容。 27.按规定变更进口药品包装标签。 28.改变进口药品注册代理机构。 29.其他。 (三)省级食品药品监督管理部门备案的补充申请事项: 30.根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。 31.补充完善国内生产药品说明书安全性内容。 32.按规定变更国内生产药品包装标签。 33.变更国内生产药品的包装规格。 34.改变国内生产药品制剂的原料药产地。 35.变更国内生产药品外观,但不改变药品标准的。 36.其他。 二、申报资料项目及其说明 1.药品批准证明文件及其附件的复印件: 包括与申请事项有关的本品各种批准文件,如药品注册批件、补充申请批件、商品名批准文件、药品标准颁布件、药品标准修订批件和统一换发药品批准文号的文件、《新药证书》、《进口药品注册证》、《医药产品注册证》等。附件包括上述批件的附件,如药品标准、说明书、标签样稿及其他附件。 2.证明性文件: (1)申请人是药品生产企业的,应当提供《药品生产许可证》及其变更记录页、营业执照、《药品生产质量管理规范》认证证书复印件。申请人不是药品生产企业的,应当提供其机构合法登记证明文件的复印件。
教你如何识别药品的批准文号 很多人往往存在药品和保健品的购买误区,错把保健品当成药品。其实我们在购买的时候可以注意产品的批准文号,这样就更能方便我们做出判断。 一、药品药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法用量的物质,包括中药材、中药饮片、中成药、化学药制剂、抗生素制剂、生化药品、放射性药品、血清、疫苗、血液制品和诊断药品等。 药品批准文号格式:国药准字+1位字母+8位数字,试生产药品批准文号格式:国药试字+1位字母+8位数字。 国药准字:代表国产药品,化学药品以H开头,中成药以Z开头,生物制品以S开头,保健药品以B开头,药用辅料以F开头,以J开头的为进口原料国内分装的产品。如国药准字H20030029,前四位为批准年份后面为顺序号。 进口注册证号:代表进口完整包装的药品,也分为化学药品H、中成药Z、生物制品S,药用辅料F,B为变更过的文号。 二、保健食品保健食品是指声称具有特定保健功能或者以补充维生素、矿物质为目的的食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。 国食健字Gxxxxxxxx:代表国产保健食品 国食健字Jxxxxxxxx:代表进口保健食品 三、化妆品 卫妆进字:代表进口化妆品,如卫妆进字(2003)第0271号,括号内为批准年份,第0271号为当年批准顺序号。 卫妆特字:代表特殊用途化妆品(生发、育发、染发、美体、祛斑、防晒、除臭、丰胸等) 四、医疗器械 国食药监械(准)字:代表国产二、三类医疗器械,如国食药监械(准)字2007第3400847号,2007为年份,第xx号的第一位为类型,后面为顺序号。
公司清算注销的详细流程 一、注销原因公司因下列原因之一的,应当自清算结束之日起30 日内向公司登记机关申请注销登记:1.公司被依法宣告破产; 2.公司章程规定的营业期限届满或者公司章程规定的其他解散事由出现时; 3.股东会决议解散; 4.公司因合并分立解散; 5.公司被依法责令关闭。公司申请注销登记,应由公司指定或者委托公司员工或者具有资格的代理机构的代理人作为申请人办理注销登记。企业所得税在国税交纳的企业应先办理地税注销手续,注销流程按先后程序共分为五个步骤分别为注销地税、国税、银行账户、工商登记、组织机构代码证及统计证。二、清算流程(一)清算适用法规公司清算因清算的性质不同而分别适用不同的法律:1、公司因破产而清算,适用《企业破产法》和《民事诉讼法》。2、公司因非破产清算(是指公司自愿解散和被责令依法解散的情形),适用《公司法》和《民事诉讼法》。(二)公司清算组备案提交的材料1.公司清算组负责人签署的《公司备案申请表》(公司加盖公章);2.公司签署的《制定代表或者共同委托代理人的证明》(公司加盖公章)及制定代表或委托代理人的身份证复印件(本人签字);3.有限责任公司提交股东会关于成立清算组的决议(由代表三分之二以上表决权的股东签署;股东为自然人的由本人签字,自然人以外的股东加盖公章);4.公司《企业法人营业执照》副本复印件(公司加盖公章)。(三)清算报告的主要内容1.清算组的构成及何时开始清算;2.企业的主要资产情况;3.企业的主要债权债务情况; 4.企业的对外投资情况; 5.债权债务的清理情况、对外投资的处置情况; 6.剩余资产的分配情况。(四)清算的具体流程1.股东会决定公司解散,形成决议,停止一切经营活动;2.决议形成后,15 日内成立清算组,清算组由股东组成;清算组自成立之日起10 日内将清算组成员、负责人名单向公司登记机关备案; 3.清算组成立后,应当在10 日内通知债权人,并于60 日内在报纸上公告;债权人应当自接到通知书之日30 日内,未接到通知书的自公告之日起45 日内,向清算组申报债权; 4.清算组自公告之日起45 日后(申报债权债务法定时限截止),开始清算;清算方案按如下顺序拨款清偿:(1)清算费用;清算费用包括清算组成员和聘请工作人员的报酬,清算财产的管理、变卖及分配所需要的费用,清算过程中支付的诉讼费用、仲裁费用及公告费用,清算过程中为了维护债权人和股东的合法权益支付的其他费用。(2)应支付的职工工资;(3)劳动保险费;(4)应缴纳的税款;(5)清偿公司债务。 5.清算结束,制作清算报告;清算组在清理公司财产,编制资产负债表和财产清单后,发现公司财产不足清偿债务的,应当立即向人民法院申请宣告破产。公司经人民法院裁定宣告破产后,清算组应当将清算事务移交给人民法院。 6.股东会对清算报告予以确认; 7.自清算结束30 日内,向公司登记机关申请注销登记; 8.经登记机关注销登记,申请人领取注销通知书,公司终止。三、注销流程(一)注销所需材料公司申请注销登记,应向登记机关提交下列文件:1.公司清算组织负责人签署的注销登记申请书;2.公司法定代表人签署的《公司注销登记申请书》; 3.法院破产裁定、行政机关责令关闭的文件或公司依照《公司法》作出的决议或者决定; 4.股东会或者有关机关确认的清算报告; 5.税务部门出具的完税证明; 6.银行出具的帐户注销证明; 7.《企业法人营业执照》正、副本; 8.法律、行政法规规定应当提交的其他文件。(二)注销地税流程 1.向主管税务机关申请办理注销税务登记,领取并填写《纳税清算申请表》、《纳税清算登记表》各一式两份、《注销税务登记申请审批表》一式三份(其中《纳税清算申请表》要填最近三个整年度的纳税额); 2.委托中介机构出具清税报告;3.持清税报告、《纳税清算申请表》、《纳税清算登记表》、《注销税务登记申请审批表》、及注销企业提供的税务登记(正、副本)、代码章、发票卡、IC 卡、加密盒、空白发票(带齐退票及最后一张已开发票记账联)、上级主管部门或股东会撤销企业决定书、公章到地税注销部门办理注销手续; 4.等待地税通知领取注销地税登记通知单(在未领到注销通知前务必按期申报纳税)。(三)注销国税流程1.凭《地税注销证明》原件及复印件到国税办理注销登记窗口领取并填写《注销税务登记申请审批表》、《注销及走逃企业审批表》、《缴销专用发票申请表》; 2.持填写完的以上各表,带齐至注销日购买的所有新、旧版普通发票及最后一次购买的最后一本增值税专用发票到专管员处办理缴销发票手续;3.办完缴销发票后找专管员办理取消一般纳税人资格需报送资料如下:(1)填写业务报批单一式二份;(2)注销税务登记申请审批表一式二份;(3)税务文书领取通知单(受理文书名称:取消增值税一般纳税人资格审批表)一式二份;(4)注销及走逃企业审批表一式二份;(5)《一般纳税人资格证书》原件;4.请专管员进行纳税评估并出具《评估报告》;待专管员取消一般纳税人资格后,到专管员处领取以下资料:(1)《评估报告》;(2)《业
批准文号什么是药品的批准文号?一共有多少种? 《中华人民共和国药品管理法》规定,生产药品须经国家药品监督管理部门批准,并发给药品批准文号方可生产,未经批准生产的药品以假药论处。因此,药品批准文号是指药品生产企业在生产药品前报请国家药品监督管理部门批准后获得的身份证明,是依法生产药品的合法标志。 怎样识别药品批准文号呢?国家药品监督管理局于2001年对药品批准文号和试生产药品批准文号的表达格式作了规定,统一格式为“国药准(试)字+1位汉语拼音字母+8位阿拉伯数字”。其中(1)“准”字代表国家批准正式生产的药品,“试”字代表国家批准试生产的药品。(2)国药准(试)字后的1位汉语拼音字母代表药品类别,分别是H代表化学药品,S代表生物制品,J代表进口分装药品,T代表体外化学诊断试剂,F代表药用辅料,B代表保健药品,Z 代表中药。(3)汉语拼音字母后的8位阿拉伯数字中的第1、2位代表批准文号的来源,其中10代表原卫生部批准的药品,19、20 代表国家食品药品监督管理局批准的药品,各省、自治区、直辖市的数字代码分别是11-北京市,12-天津市,13-河北省,14-山西省,15-内蒙古自治区, 第 1 页共3 页
21-辽宁省,22-吉林省,23-黑龙江省,31-上海市,32-江苏省,33-浙江省,34-安徽省,35-福建省,36-江西省,37-山东省,41-河南省,42-湖北省,43-湖南省,44-广东省,45-广西壮族自治区,46-海南省,50-重庆市,51-四川省,52-贵州省,53-云南省,54-西藏自治区,61-陕西省,62-甘肃省,63-青海省,64-宁夏回族自治区,65-新疆维吾尔自治区。8位阿拉伯数字中的第3、4位表示批准某药生产之公元年号的后两位数字,第5、6、7、8位数字(即最后四位数字)为顺序号。 了解药品批准文号统一格式识别方法后,让我们一起来识别几种常用药品,如(1)广谱喹诺酮类抗菌药可乐必妥(左氧氟沙星)片的批准文号为国药准字H20000655,表明该药是化学药品,系国家药品监督管理局于2000年批准生产的,顺序号为0655。(2)治疗腹泻的培菲康胶囊的批准文号是国药准字S1*******,表明该药为生物制品,是原卫生部于1995年批准生产的,顺序号为0032。(3)抗血小板聚集药物波立维(硫酸氯吡格雷)片的批准文号为国药准字J20040006,表明该药系进口分装药品,国家食品药品监督管理局于2004年批准生产,顺序号为0006。(4)用于跌打损伤的云南白药胶囊的批准文号是国药准字Z53020799,表明该药是中药,云南省药品监督管理部门于2002年批准生产,顺序号0799。
药品管理法 一、开办药品生产企业,必须具备以下条件: (一)具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人。 (二)具有与其药品生产相适应的厂房、设施和卫生环境; (三)具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备; (四)具有保证药品质量的规章制度。 二、药品经营企业购销药品,必须有真实完整的购销记录。购销记录必须注明药品的通用名称、剂型、规格、批号、有效期、生产厂商、购(销)货单位、购(销)货数量、购销价格、购(销)货日期及国务院药品监督管理部门规定的其他内容。 有下列情形之一的,为假药: (一)药品所含成份与国家药品标准规定的成份不符的; (二)以非药品冒充药品或者以他种药品冒充此种药品的。 有下列情形之一的药品,按假药论处; (一)国务院药品监督管理部门规定禁止使用的; (二)依照本法必须批准而未经批准生产、进口,或者依照本法必须检验而未经检验即销售的。
(三)变质的; (四)被污染的; (五)使用依照本法必须取得批准文号而未取得批准文号的原料药生产的; (六)所标明的适应症或者功能主治超出规定范围的。 三、有下列情形之一的药品,按劣药论处: (一)未标明有效期或者更改有效期的; (二)不注明或者更改生产批号的; (三)超过有效期的; (四)直接接触药品的包装材料和容器未经批准的; (五)擅自添加着色剂、防腐剂、香料、矫味剂及辅料的; (六)其他不符合药品标准规定的。 四、新开办药品批发企业和药品零售企业,应当自取得《药品经营许可证》之日起30日内,向发给其《药品经营许可证》的药品监督管理部门或者药品监督管理机构申请《药品经营质量管理规范》认证。 五、药品抽样必须由两名以上药品监督检查人员实施,并按照国务院药品监督管理部门的规定进行抽样;被抽检方应当提供抽检样品,不得拒绝,药品被抽检单位没有正当理由,国务院药品监督管理部门和被抽检单位所在地省、自治区、直辖市人民政府药品监督管理部门可以宣布停止该单位拒绝抽检的药品上市销售和使用。
购房者有下列情况之一的可办理合同备案注销手续: 一、房屋交付公告自公布之日起90日内,购房者所购房屋因质量存在问题,经有关部门认定的; 二、开发企业与购房者之间,因开发企业违约而发生纠纷,经仲裁机构、法院裁定或判决的; 三、退房者在所购项目中另换购商品房的; 四、购房者办理贷款手续未获批准或无力支付后续资金造成合同无法继续履行并承担违约责任的; 五、购房者因出国留学或定居,工作调出本地或患重大疾病急需资金等原因的; 凡在房屋交付预告登记起超过90日要求注销合同备案的,一律按照存量房交易转移登记程序,交纳应缴的相关税费后,方可办理注销合同备案手续。对购买二套以上商品房的单位或个人,其购买的商品房原则上不得作注销、更名处理。 二、办理合同备案注销需要提交以下资料:一、由质量管理部门出具的质量鉴定报告; 二、具体纠纷缘由和司法、仲裁机关出具的有关证明; 三、另换购的新购房合同文本; 四、商业银行出具的不能受理贷款的证明; 五、开发建设单位收取购房人违约金的证明; 六、护照及有关部门确认证明、工作调动证明、医院重症诊断书等; 七、本人身份证(含户口簿)、注销合同申请书、开发企业予以确认的签章证明以及全部购房合同原件; 八、房屋交付公告或公布的相关证明; 九、有抵押行为的,需提供金融机构同意解除和转让抵押的有关证明; 十、超时退房的,需提供税务部门的缴税凭证。(以上1-6条根据实际情况提交,7-10条必须提交) 三、办理商品房合同备案注销的程序为:一、购房者拟写合同备案注销、更名申请书,详细说明合同备案注销或更名的理由; 二、购房者向开发企业提交合同备案注销、更名申请,由开发企业签写意见并盖章同意; 三、购房者本人持合同备案注销或更名申请书、身份证或户口簿、《武汉市商品房买卖合同》以及其他有关证明材料,向项目所辖区域的市、区房产管理部门申请。受理申请的房产管理部门审查确定情况属实,符合合同备案注销、更名条件的,出具初审意见,报市房地产登记发证中心审批后,办理商品房合同备案注销、更名手续; 四、商品房合同备案注销、更名的有关证明材料及合同原件由市房地产登记发证中心办理时予以加盖“作废”及“更名修改”专用章,并将有关证明材料存档备案。
药品批准文号格式 02年1月1日以后批准生产的新药、仿制药品和通过地方标准整顿或再评价升为国家标准的药品,采用药品批准文号格式 、药品批准文号格式:国药准字+1位字母+8位数字,试生产药品批准文号格式:国药试字+1位字母+字。进口药品注册证格式:由字母H(Z或S)后接八位阿拉伯数字组成,前四位为公元年号,后四位为编号。化学药品使用字母“H”,中药使用字母“Z”,通过国家药品监督管理局整顿的保健药品使用字母,生物制品使用字母“S”,体外化学诊断试剂使用字母“T”,药用辅料使用字母“F”,进口分包装药用字母“J”。数字第1、2位为原批准文号的来源代码,其中“10”代表原卫生部批准的药品,“19”、”代表2002年1月1日以前国家药品监督管理局批准的药品,其它使用各省行政区划代码(见附件一)位的,为原各省级卫生行政部门批准的药品。第3、4位为换发批准文号之年公元年号的后两位数字,但于卫生部和国家药品监督管理局的批准文号仍使用原文号年号的后两位数字。数字第5至8位为顺序号。、每种药品的每一规格发给一个批准文号。除经国家药品监督管理局批准的药品委托生产和异地加工外药品不同生产企业发给不同的药品批准文号。 、自2002年1月1日以后批准生产的新药、仿制药品和通过地方标准整顿或再评价升为国家标准的药品采用新的药品批准文号格式。 、自2002年1月1日以后批准发给的化学药品《进口药品注册证》,其注册证号格式亦作部分改变,其母“X”改为“H”,其它部分不变。原已发给的旧格式注册证号在换发《进口药品注册证》时用新格式取 、药品批准文号及化学药品的进口药品注册证号换发后,印有原格式批准文号及注册证号的包装标签在年12月31日后禁止流通使用。
国产药品注册审批 子项四:变更研制新药、生产药品已获证明文件及附件中载明事项补充申请审批服务指南(化学药品征求意见稿) 一、适用范围 本指南适用于国产药品注册的变更研制新药、生产药品已获证明文件及附件中载明事项补充申请审批的申请和办理。 二、项目信息 (一)项目名称:国产药品注册审批 (二)子项名称:变更研制新药、生产药品已获证明文件及附件中载明事项补充申请审批 (三)审批类别:行政许可 (四)项目编码:30023 三、办理依据 《药品管理法实施条例》、《药品注册管理办法》、《药品上市许可持有人制度试点方案》、《化学药品新注册分类申报资料要求(试行)》 四、受理机构 省级食品药品监督管理部门 五、决定机构 国家食品药品监督管理总局 六、审批数量 无数量限制 七、办事条件 药品注册申请人,是指提出药品注册申请并承担相应法律责任的机构。境内申请人应当是在中国境内合法登记并能独立承担民事责任的机构。
根据《药品上市许可持有人制度试点方案》,符合试点行政区域、试点品种范围和申请人条件,申请成为药品上市许可持有人的申请人。 八、申请材料 (一)申请材料分类及要求 药品补充申请注册事项及申报资料要求(详见附件) (二)申请材料提交要求 申请人需按分类提交如下纸质申报资料:《药品注册申请表》、《药品研制情况申报表》、申报资料目录、按项目编号排列的申报资料(详见各分类)。 *申请人在提交纸质资料之前,应先完成电子申请程序: 1.从国家食品药品监督管理总局网站(https://www.doczj.com/doc/4816711542.html,)下载《药品注册申请表》填表程序并安装在电脑上。 2.按照填表说明,填写《药品注册申请表》、修改、保存、打印,核对电子文档和纸质文档的数据核对码一致。 3.制作其它需要提交的电子文档(压缩成ZIP格式)。 九、申请接收 (一)接收方式 窗口接收:省级食品药品监督管理部门 (二)办公时间:法定工作日 十、办理基本流程
销售员岗前培训试卷 姓名分数 一、填空题(每题8分) 1.企业应当将药品销售给()的购货单位,并对购货单位的证明文件、()及提货人员的()进行核实,保证药品销售流向()、合法。 2.企业应当严格审核购货单位的()、经营范围或者诊疗范围,并()的范围销售药品。 3.企业销售药品,应当如实开具(),做到票、()、货、()一致。 4.企业应当做好药品()。销售记录应当包括药品的()、规格、剂型、()、有效期、生产厂商()、销售数量、单价、()、销售日期等内容。 5.销售特殊管理的药品以及国家有专门管理要求的药品,应当严格按照()执行。 6.购货单位是药品生产企业时,应查验该企业()和《营业执照》、()加盖有该企业()的复印件。 7.购货单位是药品经营企业时,应查验该企业()和
《营业执照》、()加盖有该企业()的复印件。 8.购货单位审验合格后,按其提供的购货计划开具合法的票据,销售票据按规定保存()年。 9.销售人员应以国家药品监督管理部门批准的()为依据介绍药品,不得()和误导用户。 10.销售进口药品必须向购货单位出具()和《进口药品注册证》复印件,并加盖企业质量管理机构()。对已售出的药品如发现质量问题,应及时向当地药品监督管理部门报告,并及时追回所售药品,做好()。 二、简答。 1、药品销售人员任职资格?(5分)
2、对药品批发企业、连锁企业、零售单体药店,销售人员应当收取对方哪些材料?(15分) 销售员培训试卷
1.合法、采购人员、身份证明、真实 2. 生产范围、按照相应 3. 发票、账、款 4、销售记录、通用名称、批号、购货单位、金额 5. 国家有关规定 6、《药品生产许可证》、《GMP》、原印章 7、《药品经营许可证》、《GSP》、原印章 8. 5 9. 药品说明书、虚假夸大 10、《进口药品检验报告书》、原印章、《销出药品追回记录表》
药品批准文号表达格式 生产新药或者已有国家标准的药品的,须经国务院药品监督管理部门批准,并在批准文件上规定该药品的专有编号,此编号称为药品批准文号。药品生产企业在取得药品批准文号后,方可生产该药品。 药品批准文号格式:国药准字+1位字母+8位数字, 试生产药品批准文号格式:国药试字+1位字母+8位数字。 化学药品使用字母“H”,中药使用字母“Z”,通过国家药品监督管理局整顿的保健药品使用字母“B”,生物制品使用字母“S”,体外化学诊断试剂使用字母“T”,药用辅料使用字母“F”,进口分包装药品使用字母“J”。数字第1、2位为原批准文号的来源代码,其中“10”代表原卫生部批准的药品,“20”、“19”代表2002年1月1日以前国家食品药品监督管理局批准的药品,其它使用各省行政区划代码前两位的,为原各省级卫生行政部门批准的药品。第3、4位为换发批准文号之年公元年号的后两位数字,但来源于卫生部和国家药品监督管理局的批准文号仍使用原文号年号的后两位数字。数字第5至8位为顺序号。 怎样识别药品批准文号呢?国家药品监督管理局于2001年对药品批准文号和试生产药品批准文号的表达格式作了规定,统一格式为“国药准(试)字+1位汉语拼音字母+8位阿拉伯数字”。其中(1)“准”字代表国家批准正式生产的药品,“试”字代表国家批准试生产的药品。(2)国药准(试)字后的1位汉语拼音字母代表药品类别,
分别是H代表化学药品,S代表生物制品,J代表进口分装药品,T 代表体外化学诊断试剂,F代表药用辅料,B代表保健药品,Z代表中药。(3)汉语拼音字母后的8位阿拉伯数字中的第1、2位代表批准文号的来源,其中10代表原卫生部批准的药品,19、20代表国家食品药品监督管理局批准的药品,各省、自治区、直辖市的数字代码分别是11-北京市,12-天津市,13-河北省,14-山西省,15-内蒙古自治区,21-辽宁省,22-吉林省,23-黑龙江省,31-上海市,32-江苏省,33-浙江省,34-安徽省,35-福建省,36-江西省,37-山东省,41-河南省,42-湖北省,43-湖南省,44-广东省,45-广西壮族自治区,46-海南省,50-重庆市,51-四川省,52-贵州省,53-云南省,54-西藏自治区,61-陕西省,62-甘肃省,63-青海省,64-宁夏回族自治区,65-新疆维吾尔自治区。8位阿拉伯数字中的第3、4位表示批准某药生产之公元年号的后两位数字,第5、6、7、8位数字(即最后四位数字)为顺序号。
药品补充申请注册申报资料项目及说明 1.药品批准证明文件及其附件的复印件: 包括与申请事项有关的本品各种批准文件,如药品注册批件、补充申请批件、商品名批准文件、药品标准颁布件、药品标准修订批件和统一换发药品批准文号的文件、《新药证书》、《进口药品注册证》、《医药产品注册证》等。附件包括上述批件的附件,如药品标准、说明书、标签样稿及其他附件。 2.证明性文件: (1)申请人是药品生产企业的,应当提供《药品生产许可证》及其变更记录页、营业执照、《药品生产质量管理规范》认证证书复印件。申请人不是药品生产企业的,应当提供其机构合法登记证明文件的复印件。由境外制药厂商常驻中国代表机构办理注册事务的,应当提供外国企业常驻中国代表机构登记证复印件。境外制药厂商委托中国药品注册代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国药品注册代理机构的营业执照复印件。 (2)对于不同申请事项,应当按照“申报资料项目表”要求分别提供有关证明文件。 (3)对于进口药品,应当提交其生产国家或者地区药品管理机构出具的允许药品变更的证明文件、公证文书及其中文译本。其格式应当符合中药、天然药物、化学药品、生物制品申报资料项目中对有关证明性文件的要求。 除变更药品规格、改变产地、改变制药厂商和注册地址名称外,生产国家或者地区药品管理机构不能出具有关证明文件的,可以依据当地法律法规的规定做出说明。 3.修订的药品说明书样稿,并附详细修订说明。 4.修订的药品标签样稿,并附详细修订说明。 5.药学研究资料: 根据对注册事项的不同要求,分别提供部分或全部药学研究试验资料和必要的原注册申请相关资料,申报资料项目按照附件1~3中相应的申报资料项目提供。 6.药理毒理研究资料: 根据对注册事项的不同要求,分别提供部分或全部药理毒理研究的试验资料和必要的国内外文献资料,申报资料项目按照附件1~3中相应的申报资料项目提供。 7.临床研究资料: 要求进行临床研究的,应当按照附件1~3中相应的申报资料项目要求,在临床研究前后分别提交所需项目资料。不要求进行临床研究的,可提供有关的临床研究文献。
转发关于切实加强部分含特殊药品复方制剂销售管理的通知 各市食品药品监督管理局(药品监督管理局): 现将国家食品药品监督管理局《关于切实加强部分含特殊药品复方制剂销售管理的通知》(国食药监安〔2009〕503号)(以下简称503号文)转发给你们,结合我省实际提出以下贯彻意见,请及时通知辖区内有关企业一并遵照执行: 一、根据国家食品药品监督管理局《关于进一步加强含麻黄碱类复方制剂管理的通知》(国食药监办〔2008〕613号)的要求,具有蛋白同化制剂、肽类激素经营资质的药品经营企业,方可从事含麻黄碱类复方制剂的批发业务。现根据503号文精神,具有《药品经营许可证》的企业均可经营含特殊药品复方制剂。仅经营含麻黄碱类复方制剂且取得“蛋白同化制剂、肽类激素”经营资质的药品经营企业如决定今后不经营蛋白同化制剂、肽类激素,在换发《药品经营许可证》申请的同时递交核减“蛋白同化制剂、肽类激素”经营范围的报告并交回《蛋白同化制剂、肽类激素经营资格批件》原件,对已完成第二轮GSP认证且取得GSP证书的药品经营企业,无需开展现场验收检查。在换发的《药品经营许可证》上将自动核减“蛋白同化制剂、肽类激素”经营范围。 已换发《药品经营许可证》的药品经营企业,可按《药品经营许可证(批发)、药品GSP(批发)证书变更审批》程序向省食品药品监督管理局提出核减“蛋白同化制剂、肽类激素”经营范围申请,同时交回《蛋白同化制剂、肽类激素经营资格批件》原件。 二、药品生产、批发企业销售含特殊药品复方制剂时,销售、采购、验收入库等工作必须指定专人负责,必须确保药品送达购买方《药品经营许可证》所载明的仓库地址、药品零售企业注册地址,或者医疗机构的药库。如托运含特殊药品复方制剂必须选择当地有资质、信誉好且较大型的物流公司作为相对固定的承运单位,在签托运合同前必须对承运单位的有关资质、承运能力、运输安全等情况进行详细的考察,将考察材料与合同存档备查。承运单位必须将承运的含特殊药品复方制剂直接送至收货单位《药品经营许可证》登记的仓库地址。药品送达后,购买方应查验货物,无误后由入库员在随货同行单上签字。随货同行单原件留存,复印件加盖购买方公章或验收专用章后及时返回销售方存档。 三、各市药品监管部门应加强对含特殊药品复方制剂销售行为的监督检查。一是加强对药品生产企业的日常检查,严格审查复方制剂生产所需特殊药品原料药的购入、贮存、使用情况,跟踪核实含特殊药品复方制剂的销售流向;二是加强对药品经营企业购销含特殊药品复方制剂的跟踪检查,重点核查含特殊药品复方制剂的购进、进货验收、销售流向、资金流向等情况。如发现药品生产企业违规生产、销售含特殊药品复方制剂,应及时通报当地公安机关和省局。