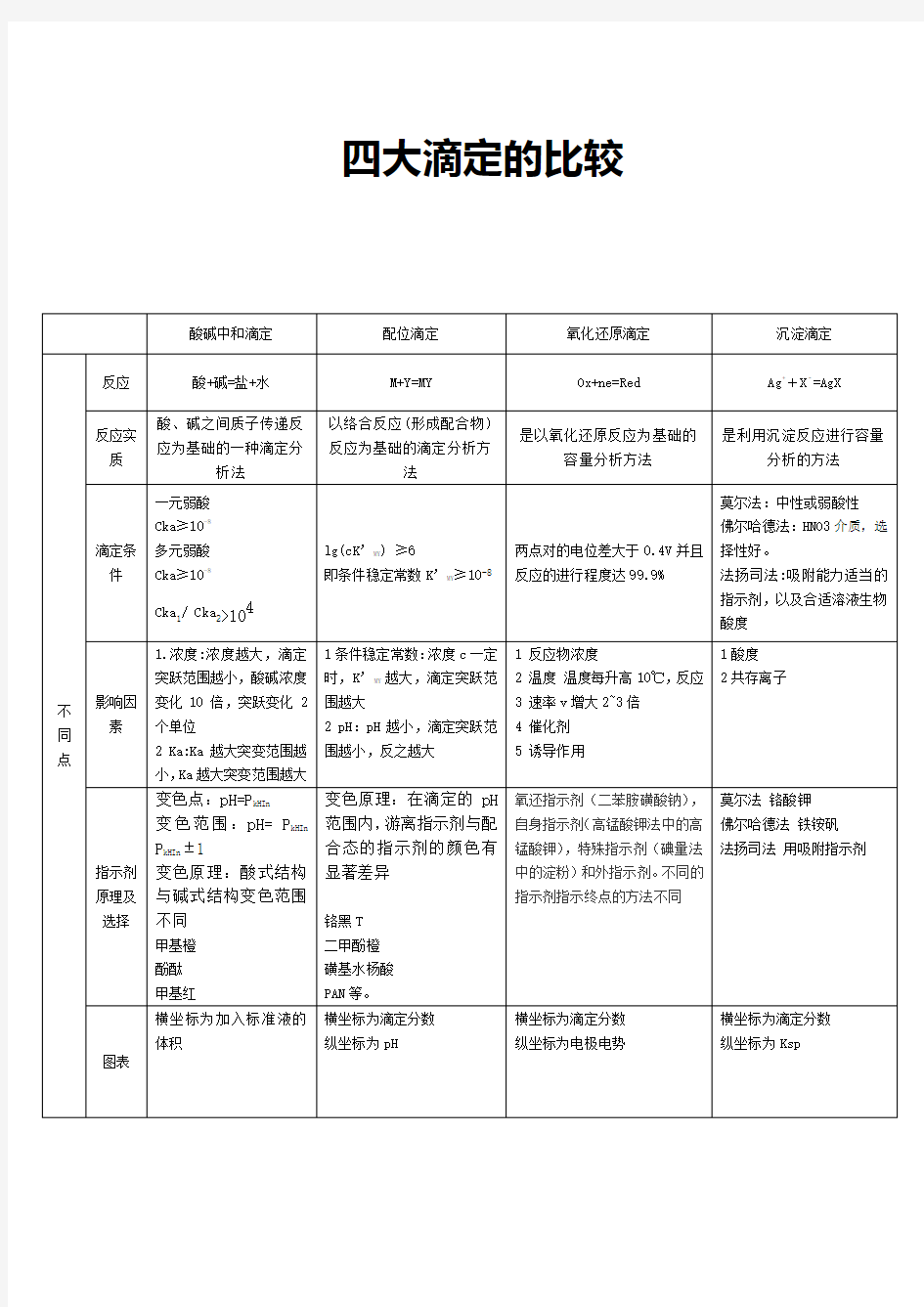
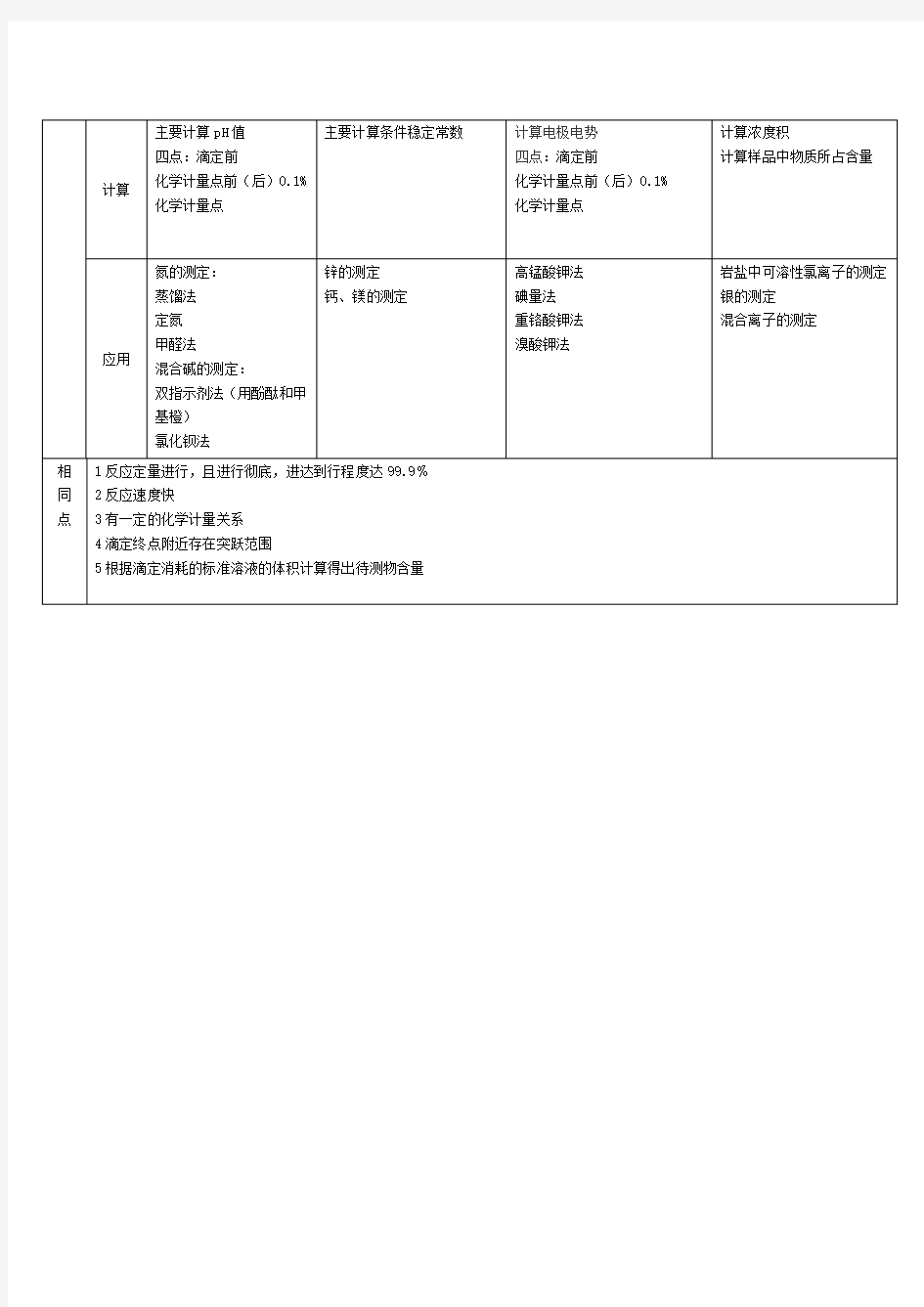
四大滴定的比较
四大滴定总结 -标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
四大滴定总结 分析化学中的四大滴定即:酸碱滴定,氧化还原滴定,配位滴定,沉淀滴定。 一酸碱滴定 1原理 酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。 基本反应为 H+ + OH- = H2O 也称中和法,是一种利用酸碱反应进行容量分析的方法 用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的 分析方法。[2] 2滴定曲线 强酸强碱的滴定 强酸和强碱相互滴定的滴定反应为: NaOH与HCL的滴定曲线 以NaOH液(0.1000mol/L)滴定20.00ml HCl液(0.1000mol/L)为例
滴定开始前 pH=1.00 滴入NaOH液19.98ml时 pH=4.30 化学计量点时 pH=7.00 滴入NaOH液20.02ml时 pH=9.70 指示剂的选择 (1)根据滴定突跃选择指示剂。滴定曲线显示,滴定突跃(在计量点附近突变的pH值范围)范围很大,为4.30~9.70,凡是变色范围全部或部分落在滴定突跃范围内的指示剂都可以用来指示终点,所以酸性指示剂(甲基橙、甲基红)和碱性指示剂(酚酞)都可以用来指示强碱滴定强酸的滴定终点。 (2)选择滴定液的浓度。浓度大,突跃范围宽,指示剂选择范围广;但是,浓度太大,称样量也要加大,所以一般使用0.1mol/L浓度的滴度液。 强碱滴定弱酸 滴定反应为: 以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L) 用NaOH滴定HOAc的滴定曲线
酸碱中和滴定 一、酸碱中和滴定原理 1.定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方法。 2. 酸碱中和滴定原理 (1)实质:H+ +OH-= H2O (2)原理:在中和反应中使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶液完全中和,测出二者所用的体积,根据化学方程式中酸碱物质的量比求出未知溶液的物质的量浓度。 (3)关键: ①准确测定两种反应物的溶液体积; ②确保标准液、待测液浓度的准确; ③滴定终点的准确判定(包括指示剂的合理选用) (4)酸、碱指示剂的选择 二、中和滴定所用仪器 酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、烧杯等 ①酸式滴定管用于盛装酸性、 中性或强氧化性溶液,不能盛装碱 性溶液或者氢氟酸(它们易腐蚀玻 璃)。 ②碱式滴定管用于盛装碱性 溶液,不能盛装酸性和强氧化性溶 液(它们易腐蚀橡胶)。 三、试剂: 标准液、待测液、指示剂;指示剂的作用: ①标准液:已知准确物质的量浓度的酸或碱溶液; ②待测液:未知物质的量浓度的酸或碱溶液 ③通过指示剂的颜色变化来确定滴定终点。 ④指示剂的选择:变色要灵敏、明显,一般强酸滴定强碱用甲基橙,强碱滴定强酸用酚酞。 四、中和滴定的操作(以标准盐酸滴定NaOH为例) Ⅰ、准备: (1)滴定管:————精确到小数点后两位如:24.00mL、23.38mL ①检验酸式滴定管是否漏水 ②洗涤滴定管后要用标准液洗涤2~3次,并排除管尖嘴处的气泡 ③注入标准液至“0”刻度上方2~3cm处
④将液面调节到“0”刻度(或“0”刻度以下某一刻度) (2)锥形瓶:只用蒸馏水洗涤,不能用待测液润洗 Ⅱ、滴定:(4)滴定 滴定管夹在夹子上,保持垂直 右手持锥形瓶颈部,向同一方向作圆周运动而不是前后振动 左手控制活塞(或玻璃球),注意不要把活塞顶出 Ⅲ、计算:每个样品滴定2~3次,取平均值求出结果。 Ⅳ、注意点: ①滴速:滴加速度先快后慢,后面可半滴,当接近终点时,应一滴一摇同时眼睛注视锥形瓶内溶液颜色变化. 直至溶液颜色变化,且30S 内颜色不复原,此时再读数。 ②终点判断:当最后一滴刚好使指示剂颜色发生明显的改变而且半分钟内不恢复原来的颜色,即为滴定终点。 五、中和滴定的误差分析 原理:滴定待测液的浓度时,消耗标准溶液多,则结果偏高;消耗标准溶液少,则结果偏低。从计算式分析,当酸与碱恰好中和时,有关系式:c (标)·V (标)·n (标)=c (待)·V (待)·n (待) (c 、V 、n 分别表示溶液物质的量浓度,溶液体积,酸或碱的元数)。故c (待)=) ()()()()(待待标标标n V n V c ???,由于 c (标)、n (标)、V (待)、n (待)均为定值,所以c (待)的大小取决于V (标)的大小,V (标)大,则c (待)大,V (标)小,则c (待)小。 六、中和滴定过程中的pH 变化和滴定终点的判断 ①酸碱滴定过程中,溶液的pH 发生了很大的变化。若用标准的强酸溶液滴定未知浓度的强碱溶液,则反应开始时溶液的pH 很大,随着强酸的滴入,溶液的pH 逐渐减小;当二者恰好中和时溶液的pH 为7;当酸过量一滴时,溶液立即变为酸性。若用强碱滴定强酸则恰恰相反。 ②根据滴定过程中的pH 变化及酸碱指示剂在酸性或碱性溶液中的颜色变化,只要选择合适的指示剂,即可准确判断中和反应是否恰好进行。 在实验室里选用的指示剂一般为酚酞,当用酸滴定碱时,恰好中和时颜色由红色刚好褪去;当用碱滴定酸时,恰好中和时颜色由无色变为浅红色。一般不选择石蕊试剂,因为石蕊变色范围太宽,且终点时颜色变化不明显,所以一般不用石蕊作中和滴定的指示剂。 常用指示剂:酚酞、甲基橙 强酸滴定强碱:甲基橙——黄色-橙色 强碱滴定强酸: 酚酞———无色-粉红
四大滴定总结 分析化学中的四大滴定即:酸碱滴定,氧化还原滴定,配位滴定,沉淀滴定。 一酸碱滴定 1原理 酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。 基本反应为 H+ + OH- = H2O 也称中和法,是一种利用酸碱反应进行容量分析的方法 用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。[2] 2滴定曲线
强碱滴定弱酸 滴定反应为: 以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L) 用NaOH滴定HOAc的滴定曲线 为例,滴定曲线如下图: 滴定开始前 pH=2.88 滴入NaOH 液19.98ml时 pH=7.75 化学计量点时 pH=8.73 滴入NaOH液20.02ml时 pH=9.70 指示剂的选择 (1)只能选择碱性指示剂(酚酞或百里酚酞等),不能选用酸性范围内变色的指示剂(如甲基橙、甲基红等)。因为突跃范围较小,pH值在7.75~9.70之间;计量点在碱性区。 (2)弱酸被准确滴定的判决是C·Ka>10-8。因为Ka愈大,突跃范围愈大。而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃范围也愈大。 3酸碱指示剂 用于酸碱滴定的指示剂,称为酸碱指示剂。是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。 常用类型 指示剂名称范围酸色中性色碱色 甲基橙 3.1-4.4 红橙黄 甲基红4.4-6.2 红橙黄 溴百里酚蓝 6.0-7.6 黄绿蓝 酚酞 8.2-10.0 无色浅红红 紫色石蕊 5.0-8.0 红紫蓝 4影响滴定结果的因素 ⑴读数:滴定前俯视或滴定后仰视(偏大)滴定前仰视或滴定后俯视(偏小) ⑵未用标准液润洗滴定管(偏大);未用待测溶液润洗滴定管(偏小) ⑶用待测液润洗锥形瓶(偏大)
四大滴定总结 酸碱滴定法 第一节 水溶液中的酸碱平衡 一、酸碱质子理论:酸是能给出质子的物质,碱是能接受质子的物质。 既可以是酸,又可以是碱,这类物质称为两性物质。 实质上是发生在两对共轭酸碱对之间的质子转移反应,由两个酸碱半反应组成。 二、酸碱溶液中各型体的分布 (一)分布系数:溶液中某型体的平衡浓度在溶质总浓度所占的比例,以δi 表示 []c i i = δ 式中:i 为某种型体 (二)弱酸(弱碱)各型体的分布系 一元弱酸 二元弱酸 (二)酸度对弱酸(碱)各型体分布的影响 弱酸(弱碱)各型体的分布系数与溶液的酸度和酸碱的离解常数有关,而与分析浓度无关。 (三)水溶液中酸碱平衡的处理方法 1、质量平衡(物料平衡):在一个化学平衡体系中,某一组分的分析浓度等于该组分各种 存在型体的平衡浓度之和,称为质量平衡 C mol/L Na 2CO 3溶液的质量平衡式 2、电荷平衡:在一个化学平衡体系中,正离子电荷的总和与负离子电荷的总和相等,称为 电荷平衡 C mol/L Na 2CO 3 水溶液的电荷平衡式: 3、质子平衡:酸碱反应达平衡时,酸失去的质子数等于碱得到的质子数,称为质子平衡 质子参考水准:能参与质子交换的组分的初始形态以及溶剂水。 例:写出Na(NH4)HPO4水溶液的质子条件式 得质子产物 参考水准 失质子产物 NH 4+ —→ NH 3 HPO 42- —→ PO 43- H 3 O + (H + ) ←— H 2 O —→ OH - -三、酸碱溶液中pH 的计算 (1)当Ca a K ≥20w K ,同时Ca/a K ≥500时,最简式: 24 H PO - [][]A HA C +=[][][]a HA K H H C HA +==++ δ[][]a a A K H K C A +==+δ1=+A HA δδ[][][]HA A H Ka -?= +[][][] A HA A H C ++=2[] [][][] 2 11222 2a a a A H K K K H H H C A H ++==+++ δ[] [][][] 2 1112a a a a HA K K K H H K H C HA ++= =+++--δ[] [][] 21121222a a a a a A K K K H H K K C A ++==++--δ[][][][] C CO HCO CO H C Na =++=- -+233322和[][][][][] - --++++=+23 32CO HCO OH H Na H 2PO 4- ←— H 3PO 4 ←— +H + +H + +2H + -H + -H + -H + [][ ] [][][][] -- -+ ++=++OH PO NH PO H PO H H 343434 22[]a a K c H = +
一、酸碱滴定 原 理 酸碱滴定法就是以酸、碱之间质子传递反应为基础的一种滴定分析法。 基本反应H++ OH- = H 2 O 滴定曲线与直接滴定的条件 强碱滴定强酸强碱滴定弱酸强酸滴定弱碱 cK a≥10-8 cK b≥10-8多元酸的滴定混合酸的滴定多元碱的滴定 c o K a1 ≥10-9 K a1 /K a2 >104 两种弱酸混合: C HA K HA ≥10-9 c HA K HA /c HB K HB >104 c o K b1 ≥10-9 K b1 /K b2 >104 指 示 剂 酚酞、甲基橙酚酞、百里酚蓝甲基红、溴甲酚绿 指 示 指示剂在不同pH下颜色不同
剂原理 影响滴定突跃范围因素1、Ka:Ka越小,滴定突跃范围越小,甚至不会出现滴定突跃,Ka影响的就是滴定曲线的前半部分 2、滴定剂浓度:浓度越小,滴定突跃范围范围越小 标准溶液酸标准溶液碱标准溶液HCl NaOH 基 准 物 质 无水碳酸钠、硼酸邻苯二甲酸氢钾、苯甲酸 应 用 硼酸的测定、铵盐的测定、克氏定发、酸酐与醇类的测定等 酸 碱 溶 液 p H 计 算 一元弱酸两性物质 二元弱酸缓冲物质
二、配位滴定 原理配位滴定就是以络合反应(形成配合物)反应为基础的滴定分析方法。 基本 反应 M+Y=MY 配合 物的 稳定 常数 酸效应αY(H) 干扰离子效应αY(N) 溶液酸度越大,αY(H)越大,表示酸效应引起的 副反应越严重。 αY(H)=1+β1[H+] +β2[H+] 2+β3[H+] 3+β 4[H+] ?+β? [H+] ? [Y]越小,αY(N)越大,表示干扰离子 效应引起的副反应越严重。 金属离子的配位效应αM(OH)、αM(L)及总副 反应αM Y的总副反应αY 条件稳定常数K’MY αM越小,αY越小,K’MY越小,配合物稳定性越 大 滴定 条件 准确直接滴定的条件 K’MY≥10-6 分别滴定的条件 K’MY≥10-6,△lgK≥5 配位1、无机配位剂2、有机配位剂:EDTA、CyDTA、EGTA、EDTP等
,、酸碱滴定 酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。 基本反应H++ OH = H 2O 强酸滴定弱碱 滴疋曲线与直接滴疋的条件 指示剂指示剂原理影响滴疋突跃 强碱滴定强酸强碱滴定弱酸 CK a> IO" mi? cK b》10-8多元酸的滴定混合酸的滴定多元碱的滴定 C o?》10-9 Kd/K a2>104 酚酞、甲基橙 指示剂在不同pH下颜色不同 两种弱酸混合: C H A K HA A 10 9 4 C HA K H A/C HB K HE>10 酚酞、百里酚蓝 1.Ka:Ka越小,滴定突跃范围越小,甚至不会出现滴定突跃, 前半 部分 2?滴定剂浓度:浓度越小,滴定突跃范围范围越小 ■9 C o K)i> 109 心/心 2>104 甲基红、溴甲酚绿 Ka影响的是滴定曲线的
1?金属离子浓度的影响:K' M一定时,CM越大,△ pM '越大 2? 条件稳定常数的影响:CM —定时,K' M越大,△ pM越大 3?酸度的影响:二pH越氧化还原越大定K' M越小,△ pM越小 4.其他辅助配位剂的影三、氧L越大还原滴転大,K' M越小,△ pM '越小 常用掩 蔽方法 配位掩蔽法沉淀掩蔽法氧化还原隐蔽法解蔽法 应用测定石灰 石中CaO MgO的含 量测定Ga2+、Mg2+Bi3+、Zr4+、Th4+的 滴定 测定Cu2+> Zn2+、Pb2+ 解蔽齐 U 三乙醇胺NaOH抗坏血酸掩敝剂:KCN 解敝剂:甲醛 影响滴定突跃范围因素 EDT J UNT人百好JR m ft-s 甲嵐口忖时的謹建畸线 EDTAj■人冃舒■:3-4 不ra i a?p KW^曲经
,、酸碱滴定 原 酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法 理 基 H + + OH - = H 2O 本 指 指示剂在不同pH 下颜色不同 1.Ka : Ka 越小,滴定突跃范围越小,甚至不会出现滴定突跃, 前半部分 2?滴定剂浓度:浓度越小,滴定突跃范围范围越小 滴 疋 曲 线 与 直 接 滴 疋 的 条 件 _9 C o K ai 》10 &/K a2>104 酚酞、甲基橙 混合酸的滴定 两种弱酸混合: _9 C H AK HA 》10 4 C HA K/C HB K HE >10 酚酞、百里酚蓝 强酸滴定弱碱 cK b >10_8 多元碱的滴定 _9 c °K )i 》10 心/心 2 >104 甲基红、溴甲酚绿 影 响 滴 疋 突 跃 Ka 影响的是滴定曲线的
金属离子的配位效应a M (OH )、a M ( L )及 总副反应a M ' [FT '[Fj 条件稳定常数K ' MY a M 越小,a Y 越小,K ' M 越小,配合物稳定 性越大 原理 基本 反应 配合 物的 稳定 常数 1、配位滴定 配位滴定是以络合反应(形成配合物)反应为基础的滴定分析方法。 M+Y=MY 酸效应a Y ( H ) 溶液酸度越大,a Y ( H )越大,表示酸效应引 起的副反应越严重。 a Y ( H ) =1+3 1[H+] + 3 2[H+] 2+ 3 3[H+] 3+3 4[H+]合 3 ? [H+] ? 干扰离子效应a Y (N ) [Y]越小,a Y ( N )越大,表示干扰 离 子效应引起的副反应越严重。 it : |V"| ------------- RUTA 片 鹭 *H 鼻与工住■韵*牛配事■庫出舶 |¥| 鼻轟聽傾底曲常“时导■卓庖 lAJ| + [ -W]+-屮笨」+ [订]+1 .iti 卜 TAM 」I [V] .1“ I.) + / 4 j 1 [M [Fl [f/r m [Afin 由 Er ” = LEJ 1巧 Iff _ _ 滴定 条件 配位 剂 指示 剂 指示 剂原 理 准确直接滴定的条件 K IMY > 10-6 分别滴定的条件 K'MY 》10- 也 IgK 》5 1.无机配位剂 2?有机配位剂:EDTA CyDTA EGTA EDTP 等 铬黑T 、二甲酚橙、钙指示剂、 PAN 等 指示剂游离态与配合态颜色不同 Y 的总副反应a Y
,、酸碱滴定 基本反应 滴疋曲线与直接滴疋的条件 指示剂指示剂原理影响滴疋突跃 酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。 H++ OH = H 20 强碱滴定强酸强碱滴定弱酸 CK a≥IO" Bi? JenMftUOOk I LI^n 巾^忖NfawI 帙 强酸滴定弱碱 CK b ≥1O- 8 多元酸的滴定混合酸的滴定多元碱的滴定 ∣W5-w nα?ι?≡m?L!,j?iι ? CdlLiII C o Kd ≥ 10-9 K√K a2>104 酚酞、甲基橙 指示剂在不同PH下颜色不同 两种弱酸混合: C HA KH A≥10 9 4 C HA K H A/C HB K HE>10 酚酞、百里酚蓝 1.Ka: Ka越小,滴定突跃范围越小,甚至不会出现滴定突跃, 前半部 分 2?滴定剂浓度:浓度越小,滴定突跃范围范围越小 C o K bi≥IO9 K√K b2>104 甲基红、溴甲酚绿 Ka影响的是滴定曲线的
1?金属离子浓度的影响:K' M一定时,CM越大,Δ PM '越大 2?条件稳定常数的影响:CM —定时,K' M越大,Δ PM越大 3?酸度的影响:二PH越氧化还原越大定K' M越小,ΔPM越小 4.其他辅助配位剂的影三、氧L越大还原滴c L?大,K' M越小,ΔPM '越小 常用掩 蔽方法 配位掩蔽法沉淀掩蔽法氧化还原隐蔽法解蔽法 应用测定石灰 石中Cao MgQ的含 量 测定Ga2+、Mg2+Bi3+、Zr4+、Th4+的 滴定 测定Cu2+? Zn2+、Pb2+ 解蔽齐 U 三乙醇胺NaQH抗坏血酸掩敝剂:KCN 解敝剂:甲醛影响 滴定 突跃 范围 因素 EDTJUNr人百好鼻: ≡ a-5 甲嵐时的謹建畸ft EDTAj■人冃舒Mt C?> ∣? 3-4 不ra I a K P l?W? 曲经
,、酸碱滴定 原酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。理 基H + OH = H 20 本 强碱滴定强酸强碱滴定弱酸强酸滴定弱碱 两种弱酸混合: C H A K HA A 10 9 4 C HA K H A/C HB K HE>10 1.Ka:Ka越小,滴定突跃范围越小,甚至不会出现滴定突跃, 前半部分 2?滴定剂浓度:浓度越小,滴定突跃范围范围越小 滴 疋 曲 线 与 直 接 滴 疋 的 条 件 多元酸的滴定 ■ ■ Si- CK a> IO"cK b >10'8 混合酸的滴定多元碱的滴定 指 示 剂 指 示 剂 原 理 酚酞、甲基橙酚酞、百里酚蓝甲基红、溴甲酚绿指示剂在不同pH下颜色不同 C o K s i> 10-9 K al/K a2>104 ■9 C o K,i> 109 心/心 影 响 滴 疋 突 跃 Ka影响的是滴定曲线的
1?金属离子浓度的影响:K' M一定时,CM越大,△ pM '越大 2?条件稳定常数的影响: CM —定时,K' M越大,△ pM越大 3?酸度的影响:二pH越氧化还原越大定K' M越小,△ pM越小 4.其他辅助配位剂的影三、氧L越大还原滴転大,K' M越小,△ pM '越小 常用掩 蔽方法 配位掩蔽法沉淀掩蔽法氧化还原隐蔽法解蔽法 应用测定石灰 石中CaO MgO的含 量测定Ga2+、Mg2+Bi3+、Zr4+、Th4+的 滴定 测定Cu2+> Zn2+、Pb2+ 解蔽齐U 三乙醇胺NaOH抗坏血酸掩敝剂:KCN 解敝剂:甲醛 影响滴定突跃范围因素
原理 基本反应氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析 方法。 Ox+ ne-=Red 条件电 极电位 4- 0.059 , -— 离子强度副反应 0.059 条件对电极电位的影响一般忽略离子强 度的影响,一般 用浓度代替活度 况谴反直来配{i民恵況垃皮应虹牝态生成混淀 述感禹生咸沆淀归T 配住反应氛化态生嚴的配住反应更穗定列还原态 生嚴的配位反应丸诜主 酸度 酸度变化直接影 响电对的电极电 位 条件平衡常数条件平衡常数K、 = 集一抵化还原反竝,U为定便*两电时的条幷电住之差愈 尢,R愈尢,反座逍行的越完全. 滴定反应条件影响反应速率的因素滴定曲线与终点的测疋 > 0.35 ?0.40V 1.反应物浓度2?温度3?催化剂4.诱导作用 化学计量点前化学计量点时化学计量点后 指示剂预处理 氧化还原指示剂、自身指示剂、专属指示剂 预氧化、预还原,除去有机物:干法灰化。湿法灰化 应用高锰酸钾法重铬酸钾碘量法 过氧化氢测定,钙、铁、有机物的测定,水样中化学需氧量的测疋铁的测定,水样中化学 需氧量的测定 硫化钠总还原 能力的测定, 硫酸铜中铜的 测定,漂白粉 中有效氯的测 定,费休法测 定微量水分 其他氧化还原滴定法硫 酸铈法,溴酸钾法、亚 砷酸钠-亚硝酸钠法 四、沉淀滴定 原理利用沉淀反应,可以定量测定试样中某些组分的一种滴定分析方法。
四大滴定总结 公司内部档案编码:[OPPTR-OPPT28-OPPTL98-OPPNN08]
四大滴定总结 分析化学中的四大滴定即:酸碱滴定,氧化还原滴定,配位滴定,沉淀滴定。一酸碱滴定 1原理 酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。 基本反应为 H+ + OH- = H2O 也称中和法,是一种利用酸碱反应进行容量分析的方法 用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。[2] 2滴定曲线 强酸强碱的滴定 强酸和强碱相互滴定的滴定反应为: NaOH与HCL的滴定曲线
以NaOH液(L)滴定 HCl液(L)为例 滴定开始前 pH= 滴入NaOH液时 pH= 化学计量点时 pH= 滴入NaOH液时 pH= 指示剂的选择 (1)根据滴定突跃选择指示剂。滴定曲线显示,滴定突跃(在计量点附近突变的pH值范围)范围很大,为~,凡是变色范围全部或部分落在滴定突跃范围内的指示剂都可以用来指示终点,所以酸性指示剂(甲基橙、甲基红)和碱性指示剂(酚酞)都可以用来指示强碱滴定强酸的滴定终点。 (2)选择滴定液的浓度。浓度大,突跃范围宽,指示剂选择范围广;但是,浓度太大,称样量也要加大,所以一般使用L浓度的滴度液。 强碱滴定弱酸 滴定反应为: 以NaOH液(L滴定醋酸(HAc,L)
用NaOH滴定HOAc的滴定曲线 为例,滴定曲线如下图: 滴定开始前 pH= 滴入NaOH 液时 pH= 化学计量点时 pH= 滴入NaOH液时 pH= 指示剂的选择 (1)只能选择碱性指示剂(酚酞或百里酚酞等),不能选用酸性范围内变色的指示剂(如甲基橙、甲基红等)。因为突跃范围较小,pH值在~之间;计量点在碱性区。 (2)弱酸被准确滴定的判决是C·Ka>10-8。因为Ka愈大,突跃范围愈大。而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃范围也愈大。 3酸碱指示剂 用于酸碱滴定的指示剂,称为酸碱指示剂。是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。 常用类型 指示剂名称范围酸色中性色碱色 甲基橙红橙黄 甲基红红橙黄
四大滴定法的异同点总结 滴定类型酸碱滴定法配位滴定法氧化还原滴定法沉淀滴定法理论酸碱质子理 M+Y=MY 基础论H++B-=HB 利用两个共 轭酸碱对发 反应生酸碱半反 实质应根据pH的 变化来滴定, 找到终点Ox+ne﹣=RedAg++X﹣=AgX利用氧化物质和还 利用不同金属与利用不用的难溶原物质这之间的氧 EDTA之间的配位物的溶度积不化还原反应,实质 能力不同和配体同,及沉淀和转是条件点击电位的 的取代化 变化 莫尔法:中性或弱酸性佛尔哈德法:HNO3介质,选择性好。 法扬司法:吸附能力适当的指示剂,以及合适溶液生物酸度 1.盐效应及同离子效应 2.酸效应 3.络合效应一元弱酸
Cka≥10-8 反应 多元弱酸 条件 Cka1≥10-9 Cka2≥10-9 不 同 点两点对的电位差大lg(cK’ MY)≥6 于0.4V并且反应 即条件稳定常数 的进行程度达 K’ MY≥8 99.9% 影响 滴定 突跃 范围
因素影响的主要1.条件稳定常因素是浓度:数:浓度c一 浓度越大,滴定时,K’ MY越 定突跃范围大,滴定突跃 越小,酸碱浓范围越大 度变化10倍,2.pH:pH越小,突跃变化2个滴定突跃范 单位围越小,反之 越大1.反应物浓度 2.温度温度每升 高10℃,反应 速率v增大2~3 倍 3.催化剂 4.诱导作用 甲基橙 指示 酚酞 剂选 甲基红
择 百里酚酞等。 指示指示剂酸式 剂原结构与碱式 理结构颜色不氧还指示剂(二苯胺磺酸钠),自身指 示剂(高锰酸钾法 铬黑T 中的高锰酸钾),特 二甲酚橙 殊指示剂(碘量法 磺基水杨酸 中的淀粉)和外指 PAN等。 示剂。不同的指示 剂指示终点的方法 不同 指示剂游离态与 配合态的的颜色 不同1.莫尔法铬酸钾 2.佛尔哈德法铁铵矾
四大滴定的比较与总结 一:反应原理及滴定曲线 酸碱滴定: 滴定曲线:溶液pH 随滴定分数(a)变化的曲线 指示剂选择: pHep 与pHsp 尽可能接近,以减小滴定误差 一、强碱强酸滴定 (一)强碱滴定强酸 NaOH (0.1000mol/L )→HCL (0.1000mol/L, 20.00mL ) 1.滴定过程中pH 值的变化 (1)Vb = 0: (2)Vb < V a : 加入NaOH 18.00mL ( 3)Vb = 19.80mL (4)Vb < V a : SP 前0.1% 时 ,加入NaOH 19.98mL (5)Vb = V a (SP ): (6)Vb > V a :SP 后0.1%, 加入NaOH 20.02mL L mol C H a /1000.0][==+ 0.1=pH 3 20.0018.000.1 5.26310/20.0018.00a b a a b V V H C m ol L V V +---??=?=?=???++2.28pH = 3.27 pH =[]L mol C V V V V H a b a b a /10 0.51.098 .1900.2098.1900.205 -+ ?=?+-= ?+-=3.4=pH [][]H OH K mol L w + - -== =10 7 /0 .7=pH 5 20.0220.000.1 5.010/20.0020.02b a b a b V V OH C mol L V V ----??=?=?=???++3 .4=pOH 7.9=?pH
(7)Vb = 40.00mL NaOH 加入量ml PH 范围 △ PH 0.00→19.80 1--3.3 2.3 19.80 →19.98 3.3 --4.3 1 19.98 →20.02 4.3--9.7 5.4 ↓ 0.04 ml △ PH=5.4 2.滴定曲线的形状 40.0020.000.140.0020.02 b a b a b V V O H C V V - --??=?=?? ?++1.48pOH =12.52 pH ?=
一、酸碱滴定 原酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析 法。理 基本反应 ++ OH- = H H 2O 强碱滴定强酸强碱滴定弱酸强酸滴定弱碱 滴定曲线与 直接 -8 cK b -8 ≥10 ≥10 cK a 多元酸的滴定混合酸的滴定多元碱的滴定滴定 的 条 件 两种弱酸混合: -9 c o K a1≥10 -9 C HA K HA≥10 -9 c o K b1≥10 4 K a1/K a2>10 4 c HA K HA/c HB K HB>10 4 K b1/K b2>10 指酚酞、甲基橙酚酞、百里酚蓝 甲基红、溴甲酚绿 示 剂 指指示剂在不同 p H 下颜色不同 示 剂 原 理 影 1.Ka:Ka 越小,滴定突跃范围越小,甚至不会出现滴定突跃,Ka 影响的是滴定曲线的响前半部分 滴 2.滴定剂浓度:浓度越小,滴定突跃范围范围越小 定 突 跃
范 围 因 素 标酸标准溶液碱标准溶液 准HCl NaOH 溶 液 基无水碳酸钠、硼酸邻苯二甲酸氢钾、苯甲酸准 物 质 应硼酸的测定、铵盐的测定、克氏定发、酸酐和醇类的测定等 用 酸 一元弱酸两性物质 碱 溶 液 p H 计 算 二元弱酸缓冲物质
二、配位滴定 原理配位滴定是以络合反应( 形成配合物) 反应为基础的滴定分析方 法 。 基本M+Y=MY 反应 酸效应αY(H)干扰离子效应αY(N)溶液酸度越大,αY(H)越大,表示酸效应引 [Y]越小,αY(N)越大,表示干扰起的副反应越严重。离子效应引起的副反应越严重 。 配合αY(H)=1+β1[H+]+β2[H+]2+β3[H+] 3+β 物的 4[H+] ?+β? [H+] ? 稳定 常数 金属离子的配位效应αM(OH)、αM(L)及Y 的总副反应αY 总副反应αM 条件稳定常数K’MY αM 越小,αY越小,K’MY越小,配合物稳定 性越大 滴定准确直接滴定的条件分别滴定的条件 条件-6 K’M Y≥10 K’M Y≥10-6,△lgK≥ 5 -6,△lgK≥ 5 配位 1.无机配位剂 2.有机配位剂:E DTA、CyDTA、EGTA、EDTP等剂 指示铬黑 T、二甲酚橙、钙指示剂、PAN等 剂 指示指示剂游离态与配合态颜色不 同 剂原 理
酸碱中和滴定 一、 酸碱中和滴定原理 1?定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方 法。 2. 酸碱中和滴定原理 (1) 实质:H + +0H 一 = H 2O (2) 原理:在中和反应中使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓 度的碱(或酸)溶液完全中和,测出二者所用的体积,根据化学方程式中酸碱物质的量比求 出未知溶液的物质的量浓度。 (3) 关键: ① 准确测定两种反应物的溶液体积; ② 确保标准液、待测液浓度的准确; ③ 滴定终点的准确判定(包括指示剂的合理选用) (4 )酸、碱指示剂的选择 二、 中和滴定所用仪器 酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、烧杯等 三、 试剂: 标准液、待测液、指示剂;指示剂的作用: ① 标准液:已知准确物质的量浓度的酸或碱溶液; ② 待测液:未知物质的量浓度的酸或碱溶液 ③ 通过指示剂的颜色变化来确定滴定终点。 ④ 指示剂的选择:变色要灵敏、明显,一般强酸滴定强碱用甲基橙, 强碱滴定强酸用酚酞。 四、 中和滴定的操作(以标准盐酸滴定 NaOH 为例) I 、准备: (1 )滴定管: ----- 精确到小数点后两位如: 24.00mL 、23.38mL ① 检验酸式滴定管是否漏水 ② 洗涤滴定管后要用标准液洗涤 2~3次,并排除管尖嘴处的气泡 ③ 注入标准液至 “0刻度上方2~3cm 处 ① 酸式滴定管用于盛装酸性、 中性或强氧化性溶液,不能盛装碱 性溶液或者氢氟酸(它们易腐蚀玻 璃)。 ② 碱式滴定管用于盛装碱性 溶液,不能盛装酸性和强氧化性溶 液(它们易腐蚀橡胶)