
17种稀土元素名称及用途 镧(La) "镧"这个元素是1839年被命名的,当时有个叫"莫桑德"的瑞典人发现铈土中含有其它元素,他借用希腊语中"隐藏"一词把这种元素取名为"镧"。镧的应用非常广泛,如应用于压电材料、电热材料、热电材料、磁阻材料、发光材料(兰粉)、贮氢材料、光学玻璃、激光材料、各种合金材料等。她也应用到制备许多有机化工产品的催化剂中,光转换农用薄膜也用到镧,在国外,科学家把镧对作物的作用赋与"超级钙"的美称。 铈(Ce)"铈"这个元素是由德国人克劳普罗斯,瑞典人乌斯伯齐力、希生格尔于1803年发现并命名的,以纪念1801年发现的小行星--谷神星。 铈的广泛应用: (1)铈作为玻璃添加剂,能吸收紫外线与红外线,现已被大量应用于汽车玻璃。不仅能防紫外线,还可降低车内温度,从而节约空调用电。从1997年起,日本汽车玻璃全加入氧化铈,1996年用于汽车玻璃的氧化铈至少有2000吨,美国约1000多吨. (2)目前正将铈应用到汽车尾气净化催化剂中,可有效防止大量汽车废气排到空气中。美国在这方面的消费量占稀土总消费量的三分之一强。 (3)硫化铈可以取代铅、镉等对环境和人类有害的金属应用到颜料中,可对塑料着色,也可用于涂料、油墨和纸张等行业。目前领先的是法国罗纳普朗克公司。 (4)Ce:LiSAF激光系统是美国研制出来的固体激光器,通过监测色氨酸浓度可用于探查生物武器,还可用于医学。铈应用领域非常广泛,几乎所有的稀土应用领域中都含有铈。如抛光粉、储氢材料、热电材料、铈钨电极、陶瓷电容器、压电陶瓷、铈碳化硅磨料、燃料电池原料、汽油催化剂、某些永磁材料、各种合金钢及有色金属等。 镨(Pr) 大约160年前,瑞典人莫桑德从镧中发现了一种新的元素,但它不是单一元素,莫桑德发现这种元素的性质与镧非常相似,便将其定名为"镨钕"。"镨钕"希腊语为"双生子"之意。大约又过了40多年,也就是发明汽灯纱罩的1885年,奥地利人韦尔斯巴赫成功地从"镨钕"中分离出了两个元素,一个取名为"钕",另一个则命名为"镨"。这种"双生子"被分隔开了,镨元素也有了自己施展才华的广阔天地。镨是用量较大的稀土元素,其用于玻璃、陶瓷和磁性材料中。 镨的广泛应用: (1)镨被广泛应用于建筑陶瓷和日用陶瓷中,其与陶瓷釉混合制成色釉,也可单独作釉下颜料,制成的颜料呈淡黄色,色调纯正、淡雅。
金属有机框架(MOF):为发光调制和发光传感的镧系元素(III)-掺杂方法?英文作者:Feng Luo*a and Stuart R. Batten b 一种不同的方法,镧系元素(Ⅲ)掺杂的途径是利用在第一次接入金属离子的基于MOF的发光传感取代镧系元素(Ⅲ)的MOF。研究结果显示,该策略是非常有效的,并显示出几个突出的特点。 金属有机框架(MOFs)的最有趣的性质之一是发光行为。1-4由于2002年金属有机框架材料的第一次发光的调查,我们已经见证了近200篇文章和一些关于MOF发光性质的回顾报告。5-7 特别感兴趣的是,最近开发的基于MOF的发光传感的离子或爆炸分子检测,8-13不仅因为发光MOFs材料的品种繁多和这些材料固有的合成的多功能性,这似乎使他们称为理想的分子识别,也因其在生物和环境系统中重要的潜在应用。14-16 2004年,由于稀土离子优异的发光优点及其敏感的天线效应,镧(Ⅲ)金属有机框架首次被提出来显示Ag +的发光传感。8此后,四个3d-4f 9-10和其他两个镧系金属有机框架材料11-12探讨了Zn2 +,Mg2 +,F-或Cu2+发光传感的证据。根据陈等人报道的研究结果,11-12这种特殊功能可能的机理是金属–配体的配位作用,或超分子导向的能力。显然,在这些现在已证明的概念中,有能够提供协调位点或超分子导向潜力的MOFs的设计和制备。然而,基于目前先进的晶体工程,所需的镧系元素金属有机框架材料合理的设计和制备仍然是不可能的。因此,尽管最近的事态发展令人兴奋的和令人信服,在我们看来基于MOF的发光传感领域还处于不成熟阶段,并认为,存在的大量的棘手的问题是一个有效的和可重复的战略目标目标的发现。 在文献中,镧系元素(Ⅲ)-掺杂的方法广泛用于改善金属或无机材料或金属有机框架材料的光学和磁学性质。17-20其次,在我们看来,镧(III)掺杂相预期与在镧系元素金属有机框架材料中可观察到的发光传感执行类似的功能。这里,我们以聚合物1([NH4]2 [ ZnL]·6H2O,L = 1,2,4,5-benzenetetracarboxylate),[NH4]+抗衡阴离子微孔骨架,为例,根据其结构中含有与[NH4]+抗衡离子占领的定期1D 通道。通过简单的镧系离子取代[NH4]+离子的阳离子交换,所需的镧系元素(Ⅲ)掺杂的相的生成可以预料。特别是,通过不同稀土(Ⅲ)的掺杂剂的选择,这种
稀土就是化学元素周期表中镧系元素——镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu),以及与镧系的15个元素密切相关的两个元素——钪(Sc)和钇(Y)共17种元素,称为稀土元素(Rare Earth)。简称稀土(RE或R)。 稀土的分类】 1)轻稀土(又称铈组):镧、铈、镨、钕、钷、钐、铕、钆。 2)重稀土(又称钇组):铽、镝、钬、铒、铥、镱、镥、钪、钇。 铈组与钇组之别,是因为矿物经分离得到的稀土混合物中,常以铈或钇比例多的而得名。 稀土金属(rare earth metals)又称稀土元素,是元素周期表ⅢB族中钪、钇、镧系17种元素的总称,常用R或RE表示。它们的名称和化学符号是钪(Sc)、钇(Y)、镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)。它们的原子序数是21(Sc)、39(Y)、57(La)到71(Lu)。 【名称由来】 17种稀土元素名称的由来及用途 镧(La) "镧"这个元素是1839年被命名的,当时有个叫"莫桑德"的瑞典人发现铈土中含有其它元素,他借用希腊语中"隐藏"一词把这种元素取名为"镧"。镧的应用非常广泛,如应用于压电材料、电热材料、热电材料、磁阻材料、发光材料(兰粉)、贮氢材料、光学玻璃、激光材料、各种合金材料等。她也应用到制备许多有机化工产品的催化剂中,光转换农用薄膜也用到镧,在国外,科学家把镧对作物的作用赋与"超级钙"的美称。 铈(Ce) "铈"这个元素是由德国人克劳普罗斯,瑞典人乌斯伯齐力、希生格尔于1803年发现并命名的,以纪念1801年发现的小行星--谷神星。 铈的广泛应用: (1)铈作为玻璃添加剂,能吸收紫外线与红外线,现已被大量应用于汽车玻璃。不仅 能防紫外线,还可降低车内温度,从而节约空调用电。从1997年起,日本汽车玻 璃全加入氧化铈,1996年用于汽车玻璃的氧化铈至少有2000吨,美国约1000多吨. (2)目前正将铈应用到汽车尾气净化催化剂中,可有效防止大量汽车废气排到空气中 美国在这方面的消费量占稀土总消费量的三分之一强。 (3)硫化铈可以取代铅、镉等对环境和人类有害的金属应用到颜料中,可对塑料着色 ,也可用于涂料、油墨和纸张等行业。目前领先的是法国罗纳普朗克公司。 (4)Ce:LiSAF激光系统是美国研制出来的固体激光器,通过监测色氨酸浓度可用 于探查生物武器,还可用于医学。铈应用领域非常广泛,几乎所有的稀土应用领 域中都含有铈。如抛光粉、储氢材料、热电材料、铈钨电极、陶瓷电容器、压电 陶瓷、铈碳化硅磨料、燃料电池原料、汽油催化剂、某些永磁材料、各种合金钢 及有色金属等。 镨(Pr) 大约160年前,瑞典人莫桑德从镧中发现了一种新的元素,但它不是单一元素,莫桑德发现这种元素的性质与镧非常相似,便将其定名为"镨钕"。"镨钕"希腊语为"双生子"之意。大约又过了40多年,也就是发明汽灯纱罩的1885年,奥地利人韦尔斯巴赫成功地从"镨钕"中分离出了两个元素,一个取名为"钕",另一个则命名为"镨"。这种"双生子"被分隔开了,镨元素也有了自己施展才华的广阔天地。镨是用量较大的稀土元素,其用于玻璃、陶瓷和磁性材料中。 镨的广泛应用: (1)镨被广泛应用于建筑陶瓷和日用陶瓷中,其与陶瓷釉混合制成色釉,也可单独作 釉下颜料,制成的颜料呈淡黄色,色调纯正、淡雅。 (2)用于制造永磁体。选用廉价的镨钕金属代替纯钕金属制造永磁材料,其抗氧性能 和机械性能明显提高,可加工成各种形状的磁体。广泛应用于各类电子器件和马 达上。 (3)用于石油催化裂化。以镨钕富集物的形式加入Y型沸石分子筛中制备石油裂化催 化剂,可提高催化剂的活性、选择性和稳定性。我国70年代开始投入工业使用, 用量不断增大。 (4)镨还可用于磨料抛光。另外,镨在光纤领域的用途也越来越广。
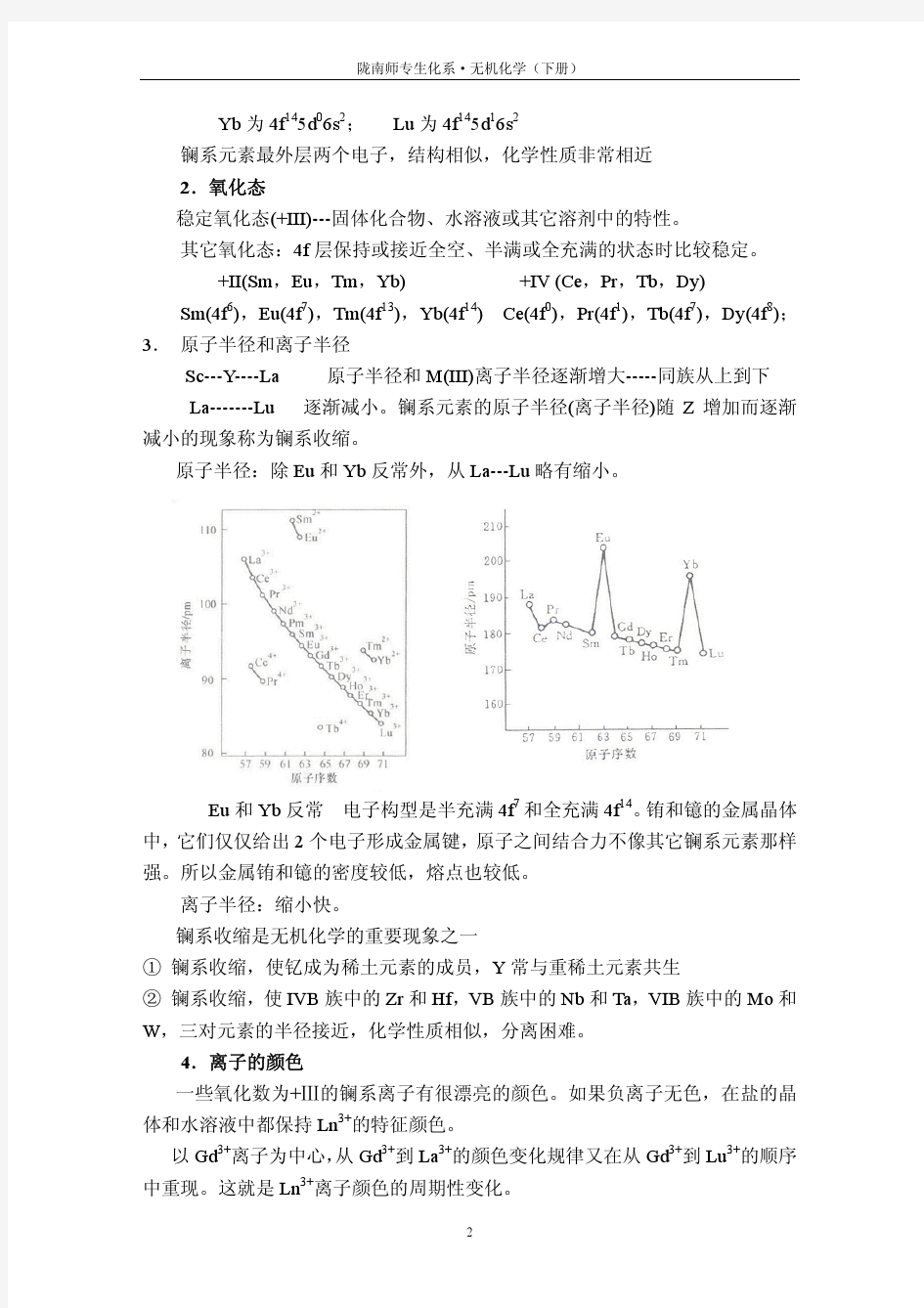
镧系元素和锕系元素 1.从Ln 3+的电子构型,离子电荷和离子半径来说明三价离子在性质上的类似性。 2.试说明镧系元素的特征氧化态是+3,而铈、镨、铽却常呈现+4,钐、铕、镱又可呈现+2。 3.何谓“镧系收缩”,讨论出现这种现象的原因和它对第五、六周期中副族元素性质所产生的影响。 4.稀土元素有哪些主要性质和用途? 5.试述镧系元素氢氧化物Ln(OH)3的溶解度和碱性变化的情况。 6.稀土元素的草酸盐沉淀有什么特性? 7.Ln 3+离子形成配合物的能力如何?举例说明它们形成鳌合物的情况与实际应用。 8.锕系元素的氧化态与镧系元素比较有何不同? 9.水合稀土氯化物为什么要在一定真空度下进行脱水?这一点和其他哪些常见的含水氯化物的脱水情况相似? 10.写出Ce 4+、Sm 2+、Eu 2+、Yb 2+ 基态的电子构型。 11.试求出下列离子成单电子数:La 3+、Ce 4+、Lu 3+、Yb 2+、Gd 3+、Eu 2+、Tb 4+。 12.完成并配平下列反应方程式: (1)EuCl 2+FeCl 3 → (2)CeO 2+HCl → (3)UO 2(NO 3)2 → (4)UO 3 → (5)UO 3+HF → (6)UO 3+NaOH → (7)UO 3+SF 4 → (8)Ce(OH)3+NaOH +Cl 2 → (9)Ln 2O 3+HNO 3 → 13.稀土金属常以+3氧化态存在,其中有些还有其他稳定氧化态。如Ce 4+和Eu 2+。Eu 2+的半径接近Ba 2+。怎样将铕与其他稀土分离? 14.f 组元素的性质为什么不同于d 组元素?举例说明。 △ △
15.讨论下列性质 (1)Ln(OH)3的碱强度随Ln原子序数的提高而降低? (2)镧系元素为什么形成配合物的能力很弱?镧元素配合物中配位键主要是离子性的?(3)Ln3+离子大部分是有色的,顺磁性的。 16.回答下列问题: (1)钇在矿物中与镧系元素共生的原因何在? (2)从混合稀土中提取单一稀土的主要方法有哪些? (3)根据镧系元素的标准电极电势,判断它们在通常条件下和水及酸的反应能力。镧系金属的还原能力同哪个金属的还原能力相近? (4)镧系收缩的结果造成哪三对元素在分离上困难? (5)镧系+3价离子的配合物只有La3+、Gd3+和Lu3+具有与纯自旋公式所得相一致的磁矩? 17.Ln3+(aq)+EDTA(aq) →Ln(EDTA)(aq) 上述生成配合物的反应中,随镧系元素原子序数的增加,配合物的稳定性将发生怎样的递变?为什么? 18.试述238U和235U的分离方法和原理。 19.在核动力工厂,核燃料铀生产中的关键反应如下: UO2(s)+4HF(g)→UF4(s)+2H2O(g) UF4(s)+F2(g)→UF6(g) 计算上述反应的△rH?m。 20.用配合剂2-羟基异丁酸作淋洗剂从离子交换柱上淋洗重镧系金属离子时(含Eu3+到Lu3+之间的多种三价稀土离子),问洗出的顺序如何?为什么?
·44卷(2015年)9期 镧系元素掺杂的上转换纳米颗粒 (中国原子能科学研究院周书华编译自Marco Bettinelli ,Luís Carlos ,Xiaogang Liu.Physics Today ,2015,(9):38) 光子上转换——光与物质相互作用将低能激光转换为高能光发射——是非线性光学中最令人着迷的效应。在已研究过的几种上转换方法中,镧基光子上转换是最有效的。 1961年,John Porter 在用非同时光子激发Pr 3+离子时,观察到镨掺杂的氯化镧(LaCl 3:Pr )晶体的发光现象。此后几年中,一些研究人员利用掺杂离子之间的能量转移进行了镧系敏化的上转换。 然而,直到21世纪初,研究集中于块状玻璃或晶体材料中光子的上转换,其发展前景并没有得到展现。随着上转换纳米材料的出现,情况发生了显著变化。在纳米水平上,许多新效应开始起作用,为上转换研究打开了新的局面。 早期研究中遇到的主要挑战在于,为了吸收等间隔增加的入射激光能量,有效的上转换材料的能级必须成阶梯状排列。由于这一原因,早期关于上转换的工作几乎完全集中在少数能满足这种严格要求的几种掺杂离子上(即Er 3+,Tm 3+和Ho 离子),因而可获得的发射波长受到很大限制。2011年,随着每层掺杂着不同离子的核—壳纳米结构的研发,上转换研究有了重要突破。在图1所示的结构中,核心掺杂离子(称作敏化剂)吸收入射的激光光子。所吸收的能量通过一系列 步骤转移给壳掺杂离子(称作激活剂),后者发射上转换辐射。大部分情况下,将Yb 3+和Nd 3+选作敏化剂的材料,因为Yb 3+在980nm 处及Nd 3+在800nm 处有很大的吸收截面。激活剂可以是一些镧系离子中的任一种,而不需要具有阶梯状的能级。因而核—壳上转换纳米颗粒可以发射任何颜色的光。 尽管对镧系掺杂的上转换纳米颗粒的研究还处在初级阶段,但是已经出现了令人印象深刻的成果,展现出广泛的应用潜力,包括单颗粒跟踪、生物成像和治疗学、热感应、光伏学、防伪以及全色三维立体显示。 利用发出的光实时跟踪生物体内的单个纳米颗粒(见图2 ),可以使生物学和医学科学领域产生革命性的进 展。例如,可以提供有关注入到病人体内的药用纳米颗粒的摄入途径和分布的重要信息。镧系掺杂的纳米颗粒为常规的量子点提供 了利好。它们不闪烁,即使以大功率激发数小时仍是稳定的。因此可以以高空间分辨、高时间分辨和高灵敏度进行跟踪。 此外,与用于激发量子点的紫外光和蓝光相比,激发上转换纳米颗粒的近红外光可穿透到更深的组织中(多于1cm ),对细胞造成的光损害少,不会引起自荧光。上转换纳米颗粒本身显示出高的光化学稳定性和低的细胞毒性。 为使上转换纳米颗粒不仅发光而且是生物相容的,其表面可以采用各种配体(如小分子、树状大分子、聚合物以及生物分子)进行官能化。表面的官能性使纳米颗粒具有生物传感所需要的生物选择性或特 图1 核—壳纳米颗粒结构示意图。核心掺杂离子(称作敏化剂) 吸收入射的激光光子。所吸收的能量通过一系列步骤转移给壳掺杂离子(称作激活剂) ,后者发射上转换辐射 · ·623
第21章镧系元素和锕系元素 1.稀土元素与镧系元素是一个概念吗?它们各自的含义是什么? 答:稀土元素与镧系元素不是同一个概念。周期表中ⅢB族的第57号元素镧(La)到第71号元素镥(Lu)共15种元素统称为镧系元素。常把镧系元素与钇统称为“稀土元素”。 2.由电子构型阐明镧系元素化学性质的相似性。 答:镧系元素原子的最外层和次外层电子的构型基本相同,从Ce开始,新增加的电子填充在4f层上,随着原子序数增加,4f轨道中电子的填充出现两种类型即[Xe]4f n-15d16s2和[Xe]4f n6s2。当4f层填满以后,再填入5d层。由于镧系元素原子最外面两层电子结构相似,只是4f内层的电子结构不同,而4f层的电子结构对化学性质的影响不大,因此它们的化学性质非常相近。 3.什么叫“镧系收缩”?试述其产生的原因和由此产生的后果。 答:镧系收缩是无机化学的重要规律之一,它指的是,镧系元素的原子半径(离子半径)随着原子序数的增大逐渐减小的现象。镧系元素中,原子核每增加一个质子,相应的有一个电子进入4f层,而4f电子对核的屏蔽不如内层电子,因而随着原子序数增加,有效核电荷增加,核对最外层电子的引力增强,使原子半径、离子半径逐渐减小。它们的原子半径减小很慢,性质相似,难于分离。 镧系收缩的结果使镧系元素后面的过渡元素的原子半径都相应的缩小,使第三过渡系列元素的原子半径与第二过渡系列元素的原子半径相近,使得Zr和Hf,Nb和Ta,Mo和W的性质极为相似,很难分离。 4.为什么镧系元素具有+Ⅲ的特征氧化态? 答:因为镧系元素的气相原子失去最外层的2个s电子和次外层的1个d电子或失去最外层的2个s电子和1个倒数第3层的f电子(一般是在d0的情况下)所需要的电离能较低,所以镧系元素在具有+Ⅲ的特征氧化态。 5.为什么铈.镨.铽.镝的氧化态常呈现+Ⅳ,而钐、铕、铥、镱却能呈现+Ⅱ氧化态? 答:铈.镨.铽.镝原子的外层电子构型分别为:4f1 5d1 6s2,4f3 5d0 6s2,4f95d06s2和4f105d06s2,铈失去4个电子后原子的外层电子构型为:4f0 5d0 6s0是全空的稳定结构。铽失去4个电子后原子的外层电子构型为:4f7 5d0 6s0是4f半充满的稳定结构。镨和镝原子失去4个电子后原子的外层电子构型是接近全空或接近半充满的稳定结构,所以铈.镨.铽.镝的氧化态常呈现+Ⅳ。 钐、铕、铥、镱原子的外层电子构型分别为:4f65d06s2,4f75d06s2,4f135d06s2和4f145d06s2。
第22章:镧系和锕系元素习题参考答案(P1110-1111) 1. 答:镧系和锕系元素的名称、元素符号和原子序数如下: 镧系元素:锕系元素: 2. 答:(1) 镧系元素的特征氧化态为+3: 镧系元素原子的(基态)价层结构为:4f 0~14 5d 0~1 6s2; 镧系元素原子的基态电子层结构中“最外三个电子层的结构”为: (4s24p64d10)4f 0~14, (5s25p6)5d 0~1, 6s2。 由于镧系元素最外两个电子层对4f轨道有较强的屏蔽作用,4f电子与核的作用较强(即4f电子受核的引力较大),当镧系元素与其它元素化合时,它们都是失去最外层的2个6s电子、次外层的1个5d电子或倒数第三层 的1个4f电子(4f轨道中的电子一般只有1~2个能够参与形成化学键),这三级电离势之和是比较低的、且都很相近(3450~4190 kJ·mol-1 ),而且它们的Ln3+离子半径很相近,Ln3+的水合能相近。因此,镧系元素的特征氧化 态为+3。 (2) Ce(铈)、Pr(镨)、Tb(铽)、Dy(镝)还常呈现+4氧化态: Ce4+(4f0)、Pr4+(4f1)、Tb4+(4f7)、Ce4+(4f8),是因为它们的4f能级具有全空或接近全空、半满或接近半满的结构,这符合Hund规则。
(3) Sm(钐)、Eu(铕)、Tm(铥)、Yb(镱)能呈现+2氧化态: 凡是具有相对稳定电子层结构的镧系元素Ln2+的离子,都是可以形成的。镧系元素中几乎有一半的元素都能形成+2氧化态的离子,特别是: Sm2+(4f6 )、Eu2+(4f7 )、Tm2+(4f13 )、Yb2+(4f14 )。 3. 解释镧系元素在化学性质上的相似性。 答:镧系元素在化学性质上都十分相似,尤其是下列两组的元素: 铈组稀土(轻稀土):La、Ce、Pr、Nd、Pm、Sm、Eu; 钇组稀土(重稀土):Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu(Sc)、Y。 镧系元素原子的基态电子层结构中“最外三个电子层的结构”为: (4s24p64d10)4f 0~14, (5s25p6)5d 0~1, 6s2,倒数一、二两个电子层结构几乎相同,仅是倒数第三电子层中的4f能级中电子数不同,即:镧系元素原子的价层 结构(4f 0~14 5d 0~1 6s2 )十分相似。由于镧系元素最外两个电子层对4f轨道有较强的屏蔽作用,4f电子与核的作用又较强(即4f电子受核的引力较大), 尽管4f能级中电子数不同,它们的化学性质受4f电子数的影响很小,所以 它们的化学性质都十分相似。 (*注:镧系元素4f能级中的电子,一般只有1~2个能够参与形成化学键) 例如: 镧系元素都有特征+3氧化态,镧系金属在水溶液中都容易形成+3价离子; 镧系金属都是较强的还原剂,其还原性强弱仅次于碱土金属,?θ(Ln3+/Ln) 在(-2.5V)~(-2.3V)之间、?θ[Ln(OH)3/Ln] 在(-2.9V)~(-2.7V)之间,都比较接近; 镧系元素的电负性(1.10~1.27)都相近,(I1+I2+I3)三级电离势之和是比较低的、且都很相近(3450~4190 kJ·mol-1 ),而I4(3600~4800 kJ·mol-1 )都较大; 镧系金属的Ln3+离子半径很相近,Ln3+的水合能相近;…等。 4. 什么叫做“镧系收缩”?讨论“镧系收缩”的原因,并回答“镧系收缩” 对周期表中其它元素的性质所造成的影响。 答:La系元素的原子半径和离子半径“随原子序数的增大而逐渐减小”,这种 现象叫“镧系收缩”(Lanthanide Contraction )。镧系收缩有两个特点: (1) 相邻元素原子半径之差仅1pm左右,即在镧系内“原子半径呈缓慢减 小的趋势”,但是经过从La→Lu 14种元素的原子半径递减的累积却减小了约14pm之多。 (2) 离子半径收缩的幅度比原子半径大得多。 镧系收缩的原因→与4f电子的屏蔽效应强弱有关: 镧系元素的4f电子在倒数第三层,4f电子比6s和5s 5p电子对核电荷的
稀土掺杂纳米发光材料的研究发展 姓名:王林旭学号:5400110349 班级:经济107 摘要:本文先介绍了关于稀土纳米发光材料的有关基本概念及基本用途,让读者有个基本认识。文章重点对稀土氟化物纳米颗粒的上转换光学性能以及稀土磷酸盐纳米发光材料的研究进展方面做个简单的介绍 关键词:稀土发光材料稀土磷酸盐纳米发光材料 1.引言:短短半个学期的选修课学习,自己对纳米材料有了一定的了解,这篇论文的选题是“稀土掺杂纳米发光材料的研究发展”,查阅跟搜索了相关资料后,主要从稀土氟化物纳米颗粒的上转换光学性能以及稀土磷酸盐纳米发光材料的研究进展方面给以论述。 首先,先来了解几个基本概念。 1.1什么是稀土元素? 稀土元素包括钪、钇和57到71的镧系元素共17种元素。它们在自然界中共同存在,性质非常相似。由于这些元素发现的比较晚又难以分离出高纯状态,最初得到的是元素的氧化物,它们的外观似土,所以称它们为稀土元素。 稀土元素的电子组态是[Xe]4fDI15s25 ̄sao~6s2。镧系元素离子的吸收光谱或激发光谱,来源于组态内的电子跃迁,即f—f跃迁;组态间的能级跃迁,即4f一5d,4f一6s,4f一6p等跃迁:还有电荷迁移跃迁,即配体离子的电子向离子的跃迁,从高能级向低能级的跃迁就产生相应的发射光谱。由于稀土的这些特性,所以它可以做发光材料。发光材料包括半导体发光材料和稀土化合物发光材料两大类…1。稀土荧光材料以应用铕、铽、钆、钇等高纯中稀土为主要特色2。纳米稀土发光材料是指基质粒子尺寸在1—1oo哪的发光材料l3。纳米粒子本身具有量子尺寸效应、小尺寸效应、表面效应和宏观量子隧道效应等。受这些结构特性的影响,纳米稀土发光材料表现出许多奇特的物理和化学特性,从而影响其中掺杂的激活离子的发光和动力学性质,如光吸收、激发态寿命,能量传递,发光量子效应和浓度猝灭等性质。在各种类型激发作用下能产生光发射的材料。 1.2什么是发光材料? 在各种类型激发作用下能产生光发射的材料。主要由基质和激活剂组成,此外还添加一些助溶剂、共激活剂和敏化剂 1.3什么是稀土发光材料? 稀土发光是由稀土4f电子在不同能级间跃出而产生的,因激发方式不同,发光可区分为光致发光(photoluminescence)、阴极射线发光(cathodluminescence)、电致发光(electroluminescence)、放射性发光(radiation luminescence)、X射线发光(X-ray luminescence)、摩擦发光(triboluminescence)、化学发光(chemiluminescence)和生物发光(bioluminescence)等。稀土发光具有吸收能力强,转换效率高,可发射从紫外线到红外光的光谱,特别在可见光区有很强的发射能力等优点。稀土发光材料已广泛应用在显示显像、新光源、X射线增光屏等各个方面。 1.4什么是纳米材料? 纳米材料是指晶粒尺寸小于100nm的单晶体或多晶体,由于晶粒细小,使其晶界上的原子数多于晶粒内部的,即产生高浓度晶界,因而使纳米材料有许多不同于一般粗晶材料的性能,如强度和硬度增大、低密度、低弹性模量、高电阻、低热导
第22章镧系和锕系元素习题目录 一判断题;二选择题;三填空题;四完成反应方程式;五计算一判断题返回目录 稀土元素都是f区元素。() 稀土元素又称为镧系元素。() 我国是世界上稀土元素资源最丰富的国家。() 所有镧系元素都不是放射性元素。() Pr是人造放射性元素。() 轻稀土元素是指从La Eu的镧系元素,它们又称为铈族稀土元素。() 铈在自然界中的丰度很小。() f区元素又称为内过渡元素。() 大多数镧系元素气态原子的电子排布不同于固态原子的电子排布。() La的价层电子排布不符合洪德规则。() 钕原子气态时价层电子排布与固态时相同。() 镧系元素的还原能力仅次于Li、Na、K、Mg、Ca、Sr、Ba。() Sc、Y、La均为银白色金属,都能溶于酸。() 在酸性溶液中,CeO 2能将Mn2+氧化成MnO 4 -。() Sm2+、Eu2+、Yb2+在水溶液中是强还原剂。() Ln2O3为离子型化合物,其熔点高。() 锕系元素都是放射性元素。() 锕系元素都是人造元素。() 与镧系收缩相似,在锕系元素中也存在锕系收缩。() 锕系元素不同氧化态离子所具有的颜色与f电子数无关。() 二选择题返回目录 下列各元素中是人造元素的为()。 (A)Yb;(B)Pm;(C)Th;(D)Bk。 下列元素为镧系元素的是()。 (A)Sc;(B)Y;(C)Lr;(D)Sm。 下列元素不为镧系元素的是()。 (A)Dy;(B)Er;(C)Pa;(D)Gd。 下列元素中为锕系元素的是()。 (A)At;(B)Tm;(C)Md;(D)Pm。 镧系元素的原子半径随原子序数的增加而减小的过程中出现两个极大值(双峰效应),处于极大值的元素是()。 (A)La和Eu;(B)Eu和Yb;(C)Yb和Lu;(D)La和Lu。 镧系元素的特征氧化值是()。
稀土是化学元素周期表中镧系元素:镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Th)、镝(Dy)、钬(Ho)、铒(Er)、铥( Tm)、镱(Yb)、镥(Lu),以及与镧系的l 5个元素密切相关的两个元素:钪(Sc) 和钇(Y)共l 7种元素。因为稀土元素最初是从瑞典产的比较稀少的矿物中发现的,“土”是按当时的习惯,称不溶于水的物质。故得名稀土。稀土,在自然界中广泛分布,其中中国的储量就占世界储量的80%左右。随着稀土分离技术的迅速发展以及对其生物活性的不断深入研究,稀土在生物医药领域方面的作用是一个被广泛涉猎的重要研究课题。自上世纪6 0年代以来陆续发现稀土化合物具有一系列特殊的药效作用,可广泛用于治疗烧伤、炎症、皮肤病、血栓病以及镇静止痛等。很多稀土化合物可直接用作药物,如铈盐可用于医治慢性呕吐症和晕船病;铒盐和铈盐可提高血液中血红蛋白和红血球的含量。此外,简单的无机铈盐可用作伤口消毒剂。因此稀土在医药学领域的应用研究也日益受到重视。稀土生物化学、毒理学、药理学、人体组织学、临床医学以及稀土环境科学方面的研究在全球广泛展开,并取得了不少很有价值的研究成果。近年来,人们在稀土及稀土配合物的抗肿瘤、抗突变、抗菌、抗病毒,以及其对消化系统和内分泌系统的作用等方面的研究均取得了很大的进展。随着配位化学的发展,稀土配合物不断被合成,其活性研究也成为人们的研究重点。大量实验结果明,稀土配合物可以在很大程度上改变、修饰和增强稀土的生物活性,但是确属于毒性较低的物质,比许多有机合成物或过渡金属配合物的毒性低。如何有效地利用稀土及其配合物对生物细胞和病毒的作用,并应用到生物医学领域中,是人们研究的主要目标之一。
第九章稀土元素 【习题答案】 9.1 什么叫内过渡元素?什么叫镧系元素?什么叫稀土元素? 解:内过渡元素:指镧系和锕系元素,位于f区,也称为内过渡元素。 镧系元素:从57号元素镧到第71号元素镥,共15种元素,用Ln表示。 稀土元素:是15个镧系元素加上钪(Sc)和钇(Y),共计17个元素。 9.2 从稀土元素的发现史,你能得到何种启示? 解:请阅读“9.1.1 稀土元素的发现”一节的内容,体会科学研究的精神。 9.3 稀土元素在地壳中的丰度如何?主要的稀土矿物有哪些?世界和我国的稀土矿藏分布 情况如何? 解:稀土元素在地壳中的丰度如下表所示: 元素名称Sc Y La Ce Pr Nd Pm Sm 丰度/g·t-1 5 28.1 18.3 64.1 5.53 23.9 4.5×10-20 6.47 元素名称Eu Gd Tb Dy Ho Er Tm Yb Lu 丰度/g·t-1 1.06 6.36 0.91 4.47 1.15 2.47 0.20 2.66 0.75 主要的稀土矿物有独居石、氟碳铈矿、磷酸钇矿等。 我国稀土资源极其丰富,其特点可概括为:储量大、品种全、有价值的元素含量高、分 布广。已在18个省市发现蕴藏各类稀土矿,储量占世界已探明稀土矿藏的55%左右。南方 以重稀土为主,内蒙古以轻稀土为主。在内蒙古包头市北边白云鄂博,称为“世界稀土之都”, 储量占全国储量70%以上。国外稀土资源集中在美国、印度、巴西、澳大利亚和俄罗斯等国。 9.4 如何从稀土矿物中提取稀土元素? 解:从稀土矿物中提取稀土元素主要包括三个阶段: (1)精矿的分解:利用化学试剂与精矿作用使稀土元素富集在溶液或沉淀中,与伴生元 素分离开来。方法可分为干法和湿法。 (2)化合物的分离与纯化:从混合稀土氧化物或混合稀土盐中分离出单一的稀土元素。 方法有分级结晶法、分级沉淀法、选择性氧化还原法、离子交换法、溶剂萃取法等。 (3)稀土金属的制备:通常采用熔融盐电解和热还原法。
稀土元素掺杂光纤激光器原理与应用 稀土元素掺杂光纤激光器 StockerYale INC. 创于1946年,主要从事各类视觉光源的应用,同时也生产各类特种光纤以及全息相位掩模板,在国际相关领域有非常高的知名度。在光纤激光器方面Stockeryale 有全套的特种光纤,并在光纤的涂敷,双包层光纤的熔接上都有完整的技术。如图所示为StockerYale 专为光纤激光器生产的双包层光敏光纤。 目前光纤激光器在国内的市场也逐渐打开,尤其1060nm波段的应用比较广泛,而国内能做成型的光纤激光器光栅对产品的还没有,所以如果在国内开发光栅对,再结合Stockeryale 的涂敷技术,会有比较好的市场前景。 光纤激光器原理 对掺杂光纤作为增益介质的光纤激光器的研究始于20世纪60年代,而直到80年代后期,随着光纤制造工艺与半导体激光器生产技术的日趋成熟,以及光通讯技术的迅猛发展,大功率光纤激光器领域的研究才取得实质性突破。由于光纤激光器以灵巧的半导体激光二极管作为泵源,以柔软的光纤作为波导和增益介质,同时可采用光纤光栅,耦合器等光纤元件,因此无需光路机械调整,结构紧凑,便于集成,其特有的全光纤结构使器件的抗电磁干扰性强,温度膨胀系数小,在频域上应用WDM及光纤传感技术可实现多波长可调谐输出,在时域上结合激光锁模技术可产生几乎没有啁啾的皮秒级超短变换极限光脉冲。与固体激光器和半导体激光器相比,光纤激光器具有无可比拟的优点。目前光纤激光器作为光源在光通信领域已得到广泛应用,而随着大功率双保层光纤激光器的出现,其应用正向着激光加工、图像显示和生物医疗等更广阔的领域迅速扩展。本文以下内容概述了光纤激光器的基本结构、特点、应用及其发展前景。 光纤激光器主要由泵源,耦合器,掺稀土元素光纤,谐振腔等部件构成。泵源由一个或多个大功率激光二极管构成,其发出的泵浦光经特殊的泵浦结构耦合入作为增益介质的掺稀土元素光纤,泵浦波长上的光子被掺杂光纤介质吸收,形成粒子数反转,受激发射的光波经谐振腔镜的反馈和振荡形成激光输出。 双包层光敏光纤 特点: 光纤纤芯具有光敏性; 具有双包层结构; 外包层为低折射率的聚合物; 有优异的耐高温特性; 低背景噪声; 主要与StockerYale 的YDC-1100-8/230掺镱光纤配合制作光纤激光器。 光纤激光器原理 中国电子科技集团公司第三十四研究所 光纤激光器利用掺杂稀土元素的光纤研制成的光纤放大器给光波技术领域带来了革命性的变化。由于任何光放大器都可通过恰当的反馈机制形成激光器,因此光纤激光器可在光纤放大器的基础上开发。目前开发研制的光纤激光器主要采用掺稀土元素的光纤作为增益介质。由于光纤激光器中光纤纤芯很细,在泵浦光的作用下光纤内极易形成高功率密度,造成激光
镧系元素 在周期系中,你知道什么是镧系元素?什么是稀土元素吗?它们的电子层结构和性质有什么特点?它们在科学技术和生产中扮演了什么样的角色? “镧系元素”在周期表中从原子序数为57号的镧到原子序数为71号的镥共15种元素,它们的化学性质十分相似,都位于周期表中第ⅢB族,第6周期镧的同一格内,但它们不是同位素。同位素的原子序数是相同的,只是质量数不同。而这15种元素,不仅质量数不同,原子序数也不同。称这15种元素为镧系元素,用Ln表示。它们组成了第一内过渡系元素。“稀土元素”镧系元素以及与镧系元素在化学性质上相近的、在镧系元素格子上方的钇和钪,共17种元素总称为稀土元素,用RE表示。按照稀土元素的电子层结构及物理和化学性质,把钆以前的7个元素:La、Ce、Pr、Nd、Pm、Sm和Eu称为轻稀土元素或铈组稀土元素;钆和钆以后的7个元素:Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu,再加上Sc和Y共10个元素,称为重稀土元素或钇组稀土元素。 “稀土”的名称是18世纪遗留下来的。由于当时这类矿物相当稀少,提取它们又困难,它们的氧化物又和组成土壤的金属氧化物Al2O3很相似,因此取名“稀土”。实际上稀土元素既不“稀少”,也不像“土”。它们在地壳中的含量为0.01534,其中丰度最大的是铈,在地壳中的含量占0.0046,其次是钇、钕、镧等。铈在地壳中的含量比锡还高,钇比铅高,就是比较少见的铥,其总含量也比人们熟悉的银或汞多,所以稀土元素并不稀少。这些元素全部是金属,人们有时也叫它们稀土金属。 我国稀土矿藏遍及18个省(区),是世界上储量最多的国家。内蒙包头的白云鄂博矿是世界上最大的稀土矿。在我国,具有重要工业意义的稀土矿物有氟碳铈矿Ce(CO3)F,独居石矿RE(PO4),它们是轻稀土的主要来源。磷钇矿YPO4和褐钇铌矿YNbO4是重稀土的主要来源。我们从以下几个方面来讨论镧系元素的通性: 1、价电子层结构 2、氧化态 3、原子半径和离子半径 4、离子的颜色 5、离子的磁性 6、标准电极 7、金属单质 电子层结构 这是目前根据原子光谱和电子束共振实验得到的镧系元素原子的电子层结构:
材料科学与工程学院 电子信息材料系 大学生科技实践(二)考核表 实践报告 专业材料科学与工程学院 学号11121773 姓名丁伯林 指导教师雷芳 实践单位海上海大学材料科学与工程学院日期2014 年 1 月18 日
“大学生科技实践(2)”科研实践报告 稀土元素Eu3+掺杂的La2W2O9粉体的制备与荧光性能表征 摘要:采用水热法成功制得了不同浓度的稀土Eu3+掺杂的La 2W 2 O 9 荧光粉体,利用 XRD表征产物的晶体结构,研究表明:由于Eu3+离子半径和La3+大小相当,Eu3+掺 杂的La 2W 2 O 9 晶体结构并未引起晶体结构的较大变化。荧光光谱仪测定样品粉体的 发光特性,结果表明合成的荧光粉均可被紫外光激发。由此学习相关的制备方法与表征方法。 关键词:钨酸钙,掺杂,Eu3+,发光材料,水热法,晶体结构,表征 前言:钨和稀土元素是我国丰产元素,为充分利用钨和稀土资源,丰富固体化学的内容,寻找新型固体发光材料和催化活性高的催化剂,钨酸盐的合成、性质、反应机理及应用,尤其以多钨酸盐的应用,受到广泛重视,研究十分活跃。 钨酸镧(La 2W 2 O 9 )是一种典型的自激活发光材料,具有稳定的物理化学性质。 由于其特有的光学性能,La 2W 2 O 9 可被用作磷光体、放射强度闪烁计数材料和激光 器基质材料(1)。而将稀土离子如Eu3+、Pr3+等,可以使La 2W 2 O 9 产生红色长余辉发光, 从而获得重要应用(2),成为可发出高纯度红光的发光材料或长余辉材料,可应用于发光二极管中。稀土离子掺杂浓度对材料性能有着重大的影响,不同的离子掺杂浓度会使得样品在紫外光的激发下发出不同颜色的光。 水热法是近几年发明的制备无机发光材料的一种新兴方法,也是一种常用的方法。水热法主要是将原料的溶液放入密封的容器中(如水热釜),在一定的温度和压力下,使溶液中的物质进行化学反应。水热法是一种高效的合成方法,制备的粉体纯度高,晶粒粒径小且分布均匀。具有所需条件不复杂,体系稳定等优点。 为了探究稀土元素铕掺杂之后对钨酸钙的荧光性质的影响,现采用水热法制 备不同浓度Eu3+掺杂的La 2W 2 O 9 粉体进行研究,采用XRD、PL对制成的粉体进行表 征,探究不同掺杂浓度对样品性能的影响,学习水热法制备粉体的过程。了解无机发光材料常用的制备方法与表征方法。
稀土元素资料汇总 第一篇 周期系ⅢB族中原子序数为21、39和57~71的17种化学元素的统称。其中原子序数为57~71的15种化学元素又统称为镧系元素。稀土元素包括钪、钇、镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥。通常把镧、铈、镨、钕、钷、钐、铕称为轻稀土元素;钆、铽、镝、钬、铒、铥、镱、镥、钇称为重稀土元素。稀土元素是历史遗留下来的名称,通常把不溶于水的固体氧化物叫做土,而在18世纪,这17种元素都是很稀少的尚未被大量发现,因而得名为稀土元素。现已查明,它们并不稀少,特别是中国的稀土资源十分丰富,有开采价值的储量占世界第一位。从1794年芬兰J加多林从瑞典斯德哥尔摩附近的于特比镇发现钇开始,一直到1947年美国JA马林斯基从铀的裂变产物中分离出钷,共经历150多年。 已经发现的稀土矿物有250种以上,最重要的有氟碳铈镧矿[(Ce,La)FCO3]、独居石[CePO4,Th3(PO4)4]、磷钇石(YPO4)、黑稀金矿[(Y,Ce,Ca) (Nb,Ta,Ti)2O6]、硅铍钇矿(Y2FeBe2Si2O10)、褐帘石[(Ca,Ce)2(Al,Fe)3Si3O12]、铈硅石[(Ce,Y,Pr)2Si2O7·H2O]。 第二篇 稀土元素是镧系元素系稀土类元素群的总称,包含钪Sc、钇Y及镧系中的镧La、铈Ce、镨Pr、钕Nd、钷Pm、钐Sm、铕Eu、钆Gd、铽Tb、镝Dy、钬Ho、铒Er、铥Tm、镱Yb、镥Lu,共17个元素。 “稀土”一词是十八世纪沿用下来的名称,因为当时用于提取这类元素的矿物比较稀少,而且获得的氧化物难以熔化,也难以溶于水,也很难分离,其外观酷似“土壤”,而称之为稀土。稀土元素分为“轻稀土元素”和“重稀土元素”: “轻稀土元素”指原子序数较小的钪Sc、钇Y和镧La、铈Ce、镨Pr、钕Nd、钷Pm、钐Sm、铕Eu。 “重稀土元素”原子序数比较大的钆Gd、铽Tb、镝Dy、钬Ho、铒Er、铥Tm、镱Yb、镥Lu。 二、稀土资源及储备状况 由于稀土元素性质活跃,使它成为亲石元素,地壳中还没有发现它的天然金属无水或硫化物,最常见的是以复杂氧化物、含水或无水硅酸盐、含水或无水磷酸盐、磷硅酸盐、氟碳酸盐以及氟化物等形式存在。由于稀土元素的离子半径、氧化态和所有其它元素都近似,因
稀土元素的发现、种类和用途稀土一词是历史遗留下来的名称。稀土元素是从18世纪末叶开始陆续发现,当时人们常把不溶于水的固体氧化物称为土。稀土一般是以氧化物状态分离出来的,又很稀少,因而得名为稀土。这些稀土元素的发现,从1794年芬兰人加多林(J.Gadolin)分离出钇到1947年美国人马林斯基(J.A.Marinsky)等制得钷,历时150多年。其中大部分稀土元素是欧洲的一些矿物学家、化学家、冶金学家等发现制取的。钷是美国人马林斯基、格兰德宁(L.E.Glendenin)和科列尔(C.D.Coryell)用离子交换分离,在铀裂变产物的稀土元素中获得的。过去认为自然界中不存在钷,直到1965年,芬兰一家磷酸盐工厂在处理磷灰石时发现了痕量的钷。 1.稀土种类 镧系元素:镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)共15种元素。 与镧系的15个元素密切相关的:钪(Sc)和钇(Y)共17种元素,称为稀土元素(Rare Earth)。简称稀土(RE或R)。 2.稀土分类 (1)轻稀土(又称铈组):镧、铈、镨、钕、钷、钐、铕、钆 (2)重稀土(又称钇组):铽、镝、钬、铒、铥、镱、镥、钪、钇 铈组与钇组之别,是因为矿物经分离得到的稀土混合物中,常以铈或钇比例多的而得名。 也有的根据稀土元素物理化学性质的相似性和差异性,除钪之外(有的将钪划归稀散元素),划分成三组: (1)除钪之外(有的将钪划归稀散元素) (2)轻稀土组:为镧、铈、镨、钕、钷; (3)中稀土组:钐、铕、钆、铽、镝; (4)重稀土组:钬、铒、铥、镱、镥、钇。
镧系元素掺杂纳米TiO2在光催化的应用 摘要总结了近年来镧系元素掺杂纳米TiO2光催化的研究现状,对其掺杂机理、制备方法(溶胶一凝胶法、沉淀法、浸渍法、水热法等)和影响TiO2光催化效率与光谱响应范围的因素,如掺杂金属离子的种类、浓度、焙烧温度等。 关键字纳米二氧化钛;金属离子掺杂;光催化 TiO2是一种性能良好的光催化半导体材料,在一定能量的光照条件下,可将环境中许多有毒有机污染物氧化分解为CO 、H2O或简单的无机物,由于纳米TiO2由于具有活性高、稳定性好、比表面积大、、光吸收性能力强、表面活性大、热导性以及分散性能好等优良特性对人体无毒、成本低且在太阳能储存与利用、光化学转换、废水处理(有机污染物以及无机离子的降解)、空气净化以及杀菌、贵金属回收和防雾和自沽表面等方面的广泛应用而成为最具潜力的光催化剂。 但TiO2的电子和空穴容易发生复合,光催化效率低;带隙较宽(约3.2eV)只能在紫外区显示光化学活性,对太阳能的利用率小于10%。因此,为了提高光催化剂的光谱响应范围和催化效率,人们采用了多种方法和手段以改善TiO2的这一性质缺陷。常用的有:表面光敏化、半导体复合、贵金属沉积和金属离子掺杂等。 金属离子掺杂就是将一定量的杂质金属引入到TiO2的晶格中,从而引入缺陷位置或改变结晶度,影响电子与空穴的复合,提高光催化活性。某些金属离子的掺入还可以扩展光吸收波长的范围,故可更有效地利用太阳能。本人就镧系中金属元素掺杂TiO2的制备及其在光催化领域的研究现状进行简单总结。 1.掺杂TiO2反应机理[1] TiO2光催化的基本原理是:当用能量等于或大于其带隙能的光照射催化剂时,价带上的电子被激发,越过禁带进入导带,同时在价带上产生相应的空穴,即生成电子一空穴对。电子和空穴分离后分别迁移至催化剂表面,能与吸附在表面上的物质发生氧化还原反应。光生空穴具有很强的氧化能力,可使绝大多数有机物氧化,电子受体可以通过接受表面的电子而被还原。 金属离子掺杂通过捕获电子或空穴以及抑制电子-空穴对的复合速率影响TiO2的光催化活性。掺杂离子与TiO2中光生电子和空穴的反应方程为: M n++e cb-—M(n-l)+ 电子捕获 M n+ +h vb +—M (n+l)+空穴捕获 当M n+ /M(n-l)+的能级低于TiO2的导带能级M n+ /M(n-l)+的能级高于TiO2的价带能级,反应才能发生。由于杂质能级位于TiO2的禁带之中,导带上的电子和价带上的空穴可被杂质能级捕获,使电子和空穴分离,从而降低了电子一空穴对的复合几率,延长了载流子的寿命。因此,既可捕获电子又可捕获空穴的掺杂离子将显示较高的光催化活性;同时,TiO2带隙中这种能级的引入,使能量较小的光子能激发掺杂能级上捕获的电子和空穴,使TiO2的吸收带边红移,拓展了光谱响应范围。 2.掺杂TiO2制备方法