
中级无机化学线上考试总结
2019-2020-2
冯锡兰,王淑涛
中级无机化学是面向化学专业二年级学生开设的限选课,本学期共46名同学选修本课程。总学时32,由王淑涛老师(前四周)和冯锡兰老师(后四周)共同讲授。以往考试形式为线下开卷考试,总成绩构成为:平时成绩30%+期末成绩70%。本学期针对疫情下的特殊情况,我们共同商讨了在线教学模式和考试模式,并与学生进行沟通确定。成绩构成调整为平时成绩50%+期末成绩50%,加大了过程考核的权重,以有效督促学生平时的在线学习。平时成绩构成两位老师根据自己的教学模式单独制定。王淑涛老师的平时成绩计算方式:雨课堂出勤及八次作业取平均值。冯锡兰老师的平时成绩计算方式:作业50%+雨课堂(出勤+测试)50%+弹幕额外加分(一条弹幕0.5分)。总的平时成绩由两位任课教师的平时成绩汇总后取平均值。在线考试最终确定使用雨课堂平台进行,依然为开卷形式。
本课程已于第八周结课,4月25日19:00~21:20完成在线考试,目前已完成试卷批改及成绩统计,现将本课程考评模式及线上考试情况总结如下。
1、过程考核实施方案:
(1)灵活选择教学平台,保证过程考核的即时性和有效性
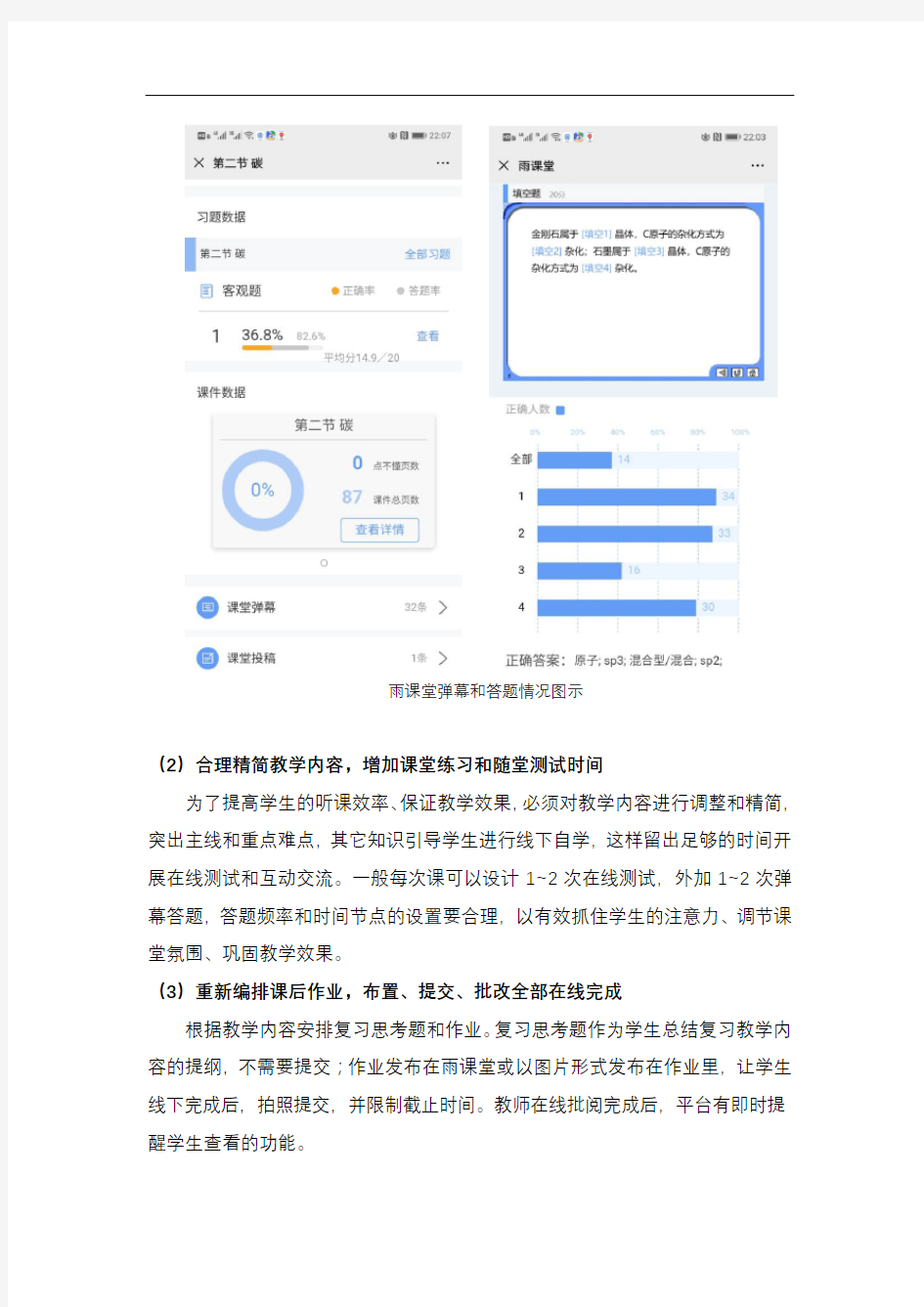
这次在线授课两位老师均选择了腾讯为主要平台。事实证明,平台始终运行稳定,直播、在线交流没有出现过卡顿或者崩溃的情况,并且作业的功能也非常强大。直播的同时使用了雨课堂的签到和在线测试、弹幕等功能,学生的出勤和答题情况可以即时查看、保留和传送,保证了过程考核的全面、客观、有效。
雨课堂弹幕和答题情况图示
(2)合理精简教学内容,增加课堂练习和随堂测试时间
为了提高学生的听课效率、保证教学效果,必须对教学内容进行调整和精简,突出主线和重点难点,其它知识引导学生进行线下自学,这样留出足够的时间开展在线测试和互动交流。一般每次课可以设计1~2次在线测试,外加1~2次弹幕答题,答题频率和时间节点的设置要合理,以有效抓住学生的注意力、调节课堂氛围、巩固教学效果。
(3)重新编排课后作业,布置、提交、批改全部在线完成
根据教学内容安排复习思考题和作业。复习思考题作为学生总结复习教学内容的提纲,不需要提交;作业发布在雨课堂或以图片形式发布在作业里,让学生线下完成后,拍照提交,并限制截止时间。教师在线批阅完成后,平台有即时提醒学生查看的功能。
作业完成情况图示
教师在线批改作业示例
作业批改完成自动提示功能图示
2、期末考试形式及出题方案:
期末考试采取线上开卷考试形式。我们从以下三个方面进行把控,以最大限度保证考试的公平公正:
(1)题目形式和难度:八道题目全部为主观问答题,无判断、选择、填空等客观题。授课的四章内容每章两道题,全面覆盖大纲,分值构成见下表:
或者归纳总结;题目的难度梯度比例要把握好,既要能够考查学生对基本知识的掌握情况,又要有一定的区分度。从最后的成绩统计来看,试卷的难度和区分度是合适的。
(2)考试时间的确定:
本次线上考试选择雨课堂平台进行。为确保线上考试顺利进行,考前在雨课堂提前单独建立了班级以便测试考试流程,两位任课教师提前对线上答题、线上试卷批改流程反复多次进行测试以确保不遗漏细节。根据测试过程确定了考试时间,比线下答题增加了20分钟,平均每道题多留出了约2~3分钟,以便学生完
成纸上答题后,再拍照上传。
教师考前测试过程图示
(3)考前模拟测试和考试纪律申明:鉴于学生也是首次参加线上考试,为保证学生对考试平台的熟练使用和考试流程的熟悉,提前让学生进行了一次模拟演练,并在群里发布了考试注意事项和纪律要求,在试卷首页将相关注意事项再次注明。
学生考前测试过程图示
发布考试纪律和注意事项图示
考虑到平台拥堵等不确定网络影响因素,本次考试同时以云课堂备份且同步发布。作为第三个备用的方案,为防止学生提交答案可能出现问题,另有群作业功能备用。
备用方案1:石大云课堂考试同步开启
备用方案2:群作业功能开启
以上措施全部落实到位后,线上考试于2020年4月25日19:00~21:20如期进行。46位同学基本都在雨课堂中完成测试,并未启用云课堂备用测试。个别同学有个别题目提交时雨课堂响应卡顿,或担心雨课堂拍照不够清晰,有8位同学通过作业提交答案,批改过程中确认这八人中仅2人是雨课堂有题目未提交答案在群补齐,另外6人均为两个平台重复提交。
雨课堂和提交情况
3、成绩统计和分析:
根据雨课堂的成绩统计,学生卷面成绩最高分92,最低分56,符合正态分布,且平均分与线下考试相比没有明显差异,说明学生的在线学习效果还是比较满意的,同时也说明试卷难度和考试方式能够客观反映学生的学习情况,其评价方式是合理有效的。
学生卷面成绩分布情况
4、存在问题及改进措施:
本次考试第一次使用雨课堂平台,虽然事先进行了多次模拟,并做了备用方
案,但还是出现了一个小问题,就是在离考试结束几分钟的时候,多位同学一起提交,结果网络拥堵,有的人就提交不上。考试时间截止后,系统自动交卷,只保存而没有提交的题目就看不到了。好在及时启用备用方案,通过发布作业,让两位在雨课堂没有提交成功的同学,顺利在作业里提交了。
回顾这次在线考试过程,我们认为应当注意以下情形:当参与考试的学生人数比较多的时候,应该施行错峰进行答题和提交,每组最多20人,以避免最后时刻网络拥堵,造成有人提交失败;要特别提醒学生,必须按照题目顺序,完成一题,提交一题,有的学生不按题号顺序提交,还有的把两道题的答案提交到一个题目下面,这样会给批阅和成绩统计造成麻烦,尤其是集体阅卷不方便。遇到这种情况,每个老师分别批阅不同题目的时候就要小心,需要仔细甄别,避免漏判和错判。
第一章 3排除下列各酸在醋酸中的酸强度次序,并指出其中那些是超酸? 4指出下列物质在液氨中的酸碱行为? 5指出在100%硫酸中的酸碱行为? 8方程式 10、什么是硬软酸原理?试从化学键角度解释这种现象。
12粗略估计下述各酸的pKa值: 第三章
28、说明无水CuSO4、Cu(H2O)62+和Cu(NH3)42+的颜色差异,并指出产生这些差异的原因 29、指出Mn(H2O)62+和Fe(H2O)63+的颜色有何特征?说明原因 30、MnO4-中Mn为d0组态,为什么他能有很深的颜色?说明颜色来源 34、CrO42-离子是d0配合物,但它能呈现颜色,1解释显色原因,2预言他的跃迁能量比 Mn4-高还是低? 第四章 6试解释二茂铁鎓离子是一种强氧化剂;二茂钴在合适的溶剂中是一中强还原剂;二茂镍易跟NO气体反应生成
O? 8举例说明什么叫做协同成键作用? 16如果钒的羰基化合物符合EAN规则,那么它的最简单化合物的分子式应该是什么?为什么它实际上又是不稳定的? 17已知Mn2(CO)10只观测到2044~1980cm-1范围内的伸缩振动带,而Co2(CO)8观察到2071~2022cm-1的振动带以及另外两个1860cm-1和1858cm-1的振动带,试画出Mn2(CO)10和Co2(CO)8的合理的结构式? 22试分析对比蔡斯盐中,乙烯与Pt2+的成键方式与金属羰基化合物中CO与金属原子的成键方式的相同与区别点。 23在乙烯中用金属锂处理Co2(CO)8时得到一个化学式为的同的红色晶体,并放出CO,该晶体的红外光谱出现3个不同的羰基伸缩振动吸收峰2080~2000,1850和1600cm-1请据此推出他的最合理的结构式。
软硬酸碱理论 将酸和碱根据性质的不同各分为软硬两类的理论。软硬酸碱理论简称HSAB理论,是一种尝试解释酸碱反应及其性质的现代理论。它目前在化学研究中得到了广泛的应用,其中最重要的莫过于对配合物稳定性的判别和其反应机理的解释。软硬酸碱理论的基础是酸碱电子论,即以电子对得失作为判定酸、碱的标准。 体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。将电负性高,极化性低难被氧化的配位原子称为硬碱,反之为软碱。硬酸和硬碱以库仑力作为主要的作用力;软酸和软碱以共价键力作为主要的相互作用力。 在软硬酸碱理论中,酸、碱被分别归为“硬”、“软”两种。“硬”是指那些具有较高电荷密度、较小半径的粒子(离子、原子、分子),即电荷密度与粒子半径的比值较大。“软”是指那些具有较低电荷密度和较大半径的粒子。“硬”粒子的极化性较低,但极性较大;“软”粒子的极化性较高,但极性较小。此理论的中心主旨是,在所有其他因素相同时,“软”的酸与“软”的碱反应较快速,形成较强键结;而“硬”的酸与“硬”的碱反应较快速,形成较强键结。大体上来说,“硬亲硬,软亲软”生成的化合物较稳定。 1963年由R.G. 皮尔孙提出。1958 年S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与Ag+、Hg2+、Pt2+ 配位;另一些则易与Al3+、Ti4+配位,将金属离子分为两类。a类金属离子包括碱金属、
碱土金属Ti4+、Fe3+、Cr3+、H+;b 类金属离子包括Cu+、Ag+、Hg2+、Pt2+。皮尔孙在前人工作的基础上提出以软硬酸碱来区分金属离子和配位原子:硬酸包括a类金属离子(碱金属、碱土金属Ti4+、Fe3+、Cr3+、H+)硬碱包括F-、OH-、H2O、NH3、O2-、CH3COO-、PO43-、SO42-、CO32-、ClO4-、NO3-、ROH等软酸包括b类金属离子Cu2+、Ag+、Hg2+、Pt2+ Au+;Cd 2+; Pd2+、Hg2+及M0等。软碱包括I-、SCN-、CN-、CO、H-、S2O32-、C2H4、RS-、S2-等 交界酸包括Fe2+、Co2+、Ni2+; Zn2+、Pb2+、Sn2+、Sb3+、Cr2+、Bi3+ 、Cu2+等,交界碱包括N3-、Br- 、NO2-、N2 、SO32-等 表:软硬酸碱分类反应规律“硬酸优先与硬碱结合,软酸优先与软碱结合①取代反应都倾向于形成硬- 硬、软- 软的化合物。②软-软、硬-硬化合物较为稳定,软- 硬化合物不够稳定。③硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质,许多有机化合物不易溶于水,就是因为水是硬碱。④解释催化作用。有机反应中的弗里德-克雷夫茨反应以无水氯化铝(AlCl3)做催化剂,AlCl3是硬酸,与RCl中的硬碱Cl -结合而活化。 金属离子和配位原子分成a 和b两类。a类金属离子包括碱金属、碱土金属、高氧化数的轻过渡元素Ti、Fe、Cr和H;b类金属离子包括较重的、低氧化数的过渡元素Cu、Ag、Hg、Pt。a类金属离子的特性随氧化数升高而加强,它优先与体积小、电负性大的原子结合;b类金属离子形成化合物的稳定性,因配位原子的电负性增大而减弱:C≈S>I>Br>Cl>N>O>F此顺序几乎(不是全部)和a类金属离子形成
简答題: 1. 第一过渡系元素氧化态分布有什么特点?为什么ⅦB族后的Fe元素不易达到族号氧化态? 答:氧化态分布的特征是两端少且氧化态低,中间氧化态多且高,元素呈现的氧化态与化合反应的能量及配位原子的性质有关:(1)Fe 原子虽然有8个价电子,但其要失去第七、第八个价电子时需要消耗很大的能量,虽然其形成化学键可获得一些能量,但其不能满足电离能的需要;(2)Fe的高氧化态,有很强的氧化能力,配体必须能与Fe共处。综上,Fe元素不易达到族号氧化态。 2. 钛被称作“第三金属”,请写出工业从TiO2矿抽取Ti的原理(用方程式表示)。 答:TiO2 + 2C + 2Cl2 →TiCl4 + 2CO TiCl4 + 2Mg → Ti + 2MgCl2 3. 为何氮气是反磁性物质而氧气却是顺磁性物质? 答:由分子轨道法,N2[KK(σ2s)2(σ2s*)2(π2p)4(σ2p)2], 而O2[KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)2],N2分子中无成单电子而O2分子中两个三电子π键中各有一个成单电子,因而N2是抗磁性的,而O2是顺磁性的。 4. PF3和BF3的分子组成相似,而它们的偶极矩却明显不同,PF3(1.03D)而BF3(0.00D),为什么? 答:这是因为P与B价电子数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 5. PF3和BF3的分子组成 相似,而它们的偶极矩却明 显不同,PF3(1.03D)而BF3 (0.00D),为什么? 答:这是因为P与B价电子 数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 6. 热量和功是否为体系的 性质?是否为状态函数? 答:热和功都不是体系的状 态函数,而是过程函数。也 不是体系的性质,体系的性 质是描述体系的状态的物理 量,如T,V等。不能谈体系 在某种状态下具有多少功或 多少热量,它们只有在能量 变换时才会有具体的数值, 与途径有关,不同的途径, 数值不同。 7. 为何氮气是反磁性物质 而氧气却是顺磁性物质? 答:由分子轨道法,N2[KK(σ 2s)2(σ2s*)2(π2p)4(σ 2p)2],而O2[KK(σ2s)2(σ 2s*)2(σ2p)2(π2p)4(π 2p*)2],N2分子中无成单电 子而O2分子中两个三电子 π键中各有一个成单电子, 因而N2是抗磁性的,而O2 是顺磁性的。 8. 什么叫杂化?原子轨道 为什么要杂化? 答:杂化是指形成分子时, 由于原子的相互影响,若干 不同类型、能量相近的原子 轨道混合起来重新组合成一 组新轨道的过程.原子轨道 之所以杂化,是因为:(1) 通 过价电子激发和原子轨道的 杂化有可能可以形成更多的 共价键; (2)杂化轨道比未 杂化的轨道具有更强的方向 性,更利于轨道的重叠;(3) 杂化轨道的空间布局使得化 学键间排斥力更小,从而分 子构型更稳定。 9. PF3和BF3的分子组成相 似,而它们的偶极矩却明显 不同,PF3(1.03D)而BF3 (0.00D),为什么? 答:这是因为P与B价电子 数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 选择题: 1.汞中毒的症状是 ( A )(A) 贫血 (B) 骨头畸形、压迫骨头会 引起剧痛 (C) 会诱发癌症 (D) 颤抖、呆滞、运动失调, 严重时死亡 2.在人体血液中负责输送氧 气的金属蛋白是( D ) (A) 肌红蛋白 (B) 铁贮存 蛋白 (C) 血蓝蛋白 (D) 血红蛋白 3.稀有气体中,最难被液化 的是 ( A )(A) He (B)Ne(C)Xe (D) Kr 4.下列物质中,强烈氧化性 与惰性电子对效应无关的是 ( C )(A) PbO2 (B) NaBiO3 (C) K2Cr2O7 (D) TlCl3 5. A → B + C是吸热的 可逆基元反应,正反应的活 化能为E正,逆反应的活化 能为E逆(B )(A) E正 < E逆(B) E正 > E逆 (C)E 正 = E逆 (D) 三种都可能 6.下列锕系元素是人工合成 的是 ( B )(A)Ac (B)Am (C)Th (D) U 7.维生素B12含有的金属元 素是 ( A )(A)Co (B) Fe (C) Ca (D) Mg 8.废弃的CN-溶液不能倒入 ( C )(A) 含Fe3+的 废液中 (B) 含Fe2+的废液 中 (C) 含Cu2+的酸性废液 中 (D) 含Cu2+的碱性废 液中 9. 速率常数k是一个 参数( D )(A) 无量纲 参(B) 量纲为 mol·L-1·s-1(C) 量纲为 mol2·L-1·s-1 的参数 (D) 量纲不定的参数 10.下列各元素中,电子亲 和能最高的是 ( C )(A) Cs (B) Li (C) Cl (D) F 11.最早被发现的稀有气体 元素是 ( A )(A) He (B)Ne (C)Ar (D) Kr 12.下列各元素中,第一电 离能最高的是 ( D )(A) Cs (B) Li (C) O (D) F 13. 已知某一反应 A + B →C 的E正=50kJ/mol,则该 反应的E逆为 ( D ) (A) -50KJ/mol (B) < 50KJ/mol (C) > 50KJ/mol (D) 无法确定 14.在酸性溶液中,不能稳 定存在的是 ( A ) (A) VO43- (B) CuSO4 (C) FeCl3 (D) Cr2O72- 16.Ln3+离子不易形成羰基 化合物是因为它们 ( B ) (A) 无d电子 (B) 是硬酸(C)无空d轨道 (D) 轨道对称性不匹配 17. H2O2的分解反应为: H2O2(aq) →H2O(l) + 1/2O2(g),下列表示的瞬时 速度中,正确的是 ( D ) (A) dc(H2O2)/dt (B)-dc(H2O)/dt(C)-dc(O2) /(2dt) (D) dc(O2)/(2dt) 18. 反应 X + Y → Z,其 速度方程式为:υ =k[X]2[Y]1/2,若X与Y的 浓度都增加4倍,则反应速 度将增加多少倍 ( D ) (A) 4 (B) 8 (C) 16 (D) 32 22下列元素中,电子亲和能 最高的是 ( B )(A) F (B) Cl (C) Li (D) Cs 23.在酸性溶液中,不能存 在的物种是 (A)(A)FeO42-(B)CuI
高一政治经济生活一至六课基本知识点 第一课神奇的货币 1、什么是商品(重点) 用于交换的劳动产品 2、什么是货币(重点) 从商品中分离出来固定地充当一般等价物的商品。 ·商品和货币不是一对孪生兄弟,货币晚于商品出现,是商品交换发展到一定阶段的产物。 ·货币的本质(重点):一般等价物 3、商品的基本属性(重点) 使用价值和价值 ·商品是使用价值和价值的统一体,二者缺一不可。 ·使用价值是价值的物质承担者。 价值尺度、流通手段(基本职能)(重点) ·价值尺度:货币表现和衡量其他一切商品价值大小的职能。观念上的货币。如:一件衣服标价100元。·流通手段:货币充当商品交换媒介的职能。现实的货币。如:用100元买了一件衣服。 ※价格:通过一定数量的货币表现出来的商品价值。 5、商品流通 以货币为媒介的商品交换。公式:商品——货币——商品。 6、流通中所需要的货币量公式 流通中所需要的货币量=商品价格总额=待售商品量×价格水平 货币流通速度 8、通货膨胀和通货紧缩 纸币发行量超过流通中实际需要的货币量,是导致通货膨胀的主要原因之一。 9、信用工具都有哪些
信用卡和支票 ·信用卡:具有消费、转账结算、存取现金、信用贷款等部分或全部功能的电子支付卡。集存款、取款、消费、结算、查询为一体。 ·支票:活期存款的凭证,是出票人委托银行等金融机构见票时无条件支付一定金额给受款人或者持票人的票据。 10、什么是外汇 用外币表示的用于国际间结算的支付手段 外汇≠外币 11、保持人民币币值稳定的表现和意义 表现:对内保持物价总水平稳定,对外保持人民币汇率稳定 意义:使人民生活安定,国民经济又好又快发展,对世界金融的稳定、经济的发展都具有重要意义。 第二课多变的价格 1、影响价格的因素(重点) 供求影响价格、价值决定价格 ·价值是价格的基础,价格是价值的货币表现。 ·价值决定价格,价格反映价值。 2、卖方市场与买方市场 对谁有利,即是谁的市场 3、价值量的决定因素(重重点) 社会必要劳动时间。 ·价值量与社会必要劳动时间成正比,与社会劳动生产率成反比。 ·一般情况下,价值量越大,价格越高;价值量越小,价格越低。 4、个别劳动时间低于社会必要劳动时间,处于有利地位;个别劳动时间高于社会必要劳动时间,处于不利地位;作为生产者,就要努力缩短自己的个别劳动时间,提高劳动生产率。 5、价值规律的基本内容(重重点) 商品的价值量由生产该商品的社会必要劳动时间决定,商品交换以价值量为基础实行等价交换。 ·等价交换:存在于商品交换的平均数之中 6、价值规律的表现形式(重重点) 商品价格受供求关系的影响,围绕价值上下波动。
高考化学中常见的电子式大全
————————————————————————————————作者:————————————————————————————————日期:
中学化学中常见的电子式大全原子 离子 单质分子 共价化合物
离子化合物 形成过程 电子式书写的常见错误及纠正措施 物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。因此电子式是近几年高考的考查热点之一。但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成(正确应为)。典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。例如HClO的电子式写 O O H Cl O Mg2+ Cl 2
成: ; MgCl 2的电子式写成: 。二、不能正确表达共价键的数目。例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。 一:“异性相吸、电荷交叉”让原(离)子快乐排队。 “异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正 电荷,O 带部分负电荷,因此HClO 的电子式应为 :。对于离子化合 物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉” 的规律其电子式为 。 这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。 二、“电子分配求差量”揭开共用电子对数目的面纱。 该方法的理论依据来源于配位化学中的“18电子规则”。(参见《中级无机化学》唐宗熏主编,2003,高等教育出版社)虽然该方法仅适用于计算共用键的数目,对配位键则爱莫能助。但在高中阶段要求掌握的配位化合物较少,典型代表为 Fe(SCN)3、[Ag(NH 3)2]OH 、 , 。该方法在高中阶段应用较广。具体算法以例说明: H C N H O Cl [Fe( —O - Mg 2+ N Mg 2+ N Mg 2+
西北大学化学系2003~2004学年度第二学期 《中级无机化学》试题及答案 一 按要求回答下列各题(6×5) 1 (1) 确定化合物B 10CPH 11的构型并予以命名; (2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。 解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子, n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1, 属闭式结构 命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11) (2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解 n -2=s +t m -2=2-2=0=s +x n -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2; 2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。 解: △Lat H m θ(LiH, s) △EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s) 3 应用Pauling 规则, (1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构; (2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。 解:(1) 根据pK a 值判断,应有相同非羟基氧原子。 H 3PO 4: H 3PO 3: H 3PO 2: (2) H 3PO 4:一个非羟基氧原子,pK a 值约为2;H 2PO 4-:pK a 值增加5,约为7;HPO 42 -pK a 约为12。 4 用VSEPR 理论预言下列分子或离子的结构,并写出它们所属的点群: f m θ P H HO HO P OH HO HO P H HO H
长江大学地球科学系试卷 一、填空题( 每空0.5 分,共10 分) 3 、一般说来,层状叠层石生成环境的水动力条件①__________ ,多属②__________ 的产物;柱状叠层石生成环境的水动条件③__________ ,多为④__________ 的产物。①较弱,②潮间带上部,③较强,④潮间带下部至潮下带上部。 6 、Young et al.(1972) 以潮汐作用带为形式的相带模式包括①__________ 、②__________ 、 ③__ ________ 和④__________ 四个相带。①潮上带,②潮间带,③局限潮下带,④开阔潮下带。 7 、第一部系统论述我国各地质时代的沉积岩层的古地理轮廓的专著是①__________ 编著的② __________ 。①刘鸿允,②《中国古地理图》。 1 、相标志是相分析及岩相古地理研究的基础,可归纳为①__________ 、②__________ 和③ __________ 三类。①岩性标志,②古生物标志,③地球化学标志。 6 、Laporate(1969) 以潮汐作用划分的相带模式包括①__________ 、②__________ 、③ __________ 和④__________ 四个相带。①潮上带,②潮间带,③潮下带上部,④潮下带下部。 7 、米德尔顿和汉普顿按支撑机理把沉积物重力流划分为四种类型,即①__________ 、②______ ____ 、③__________ 和④__________ 。①碎屑流,②颗粒流,③液化沉积物流,④浊流。 5、按照地貌特点、水动力状况和沉积物特征,可将砂质高能滨岸相划分为①_____________、②____________、③____________和④___________四个亚相。①海岸沙丘、②后滨、③前滨、④近滨。 6、欧文(Irwin,1965)根据潮汐和波浪作用的能量,将陆表海碳酸盐沉积作用环境划分出了三个能量带,即①____________、②____________和③____________。①远离海岸的X带(低能带)、②稍近海岸的Y带(高能带)、③靠近海岸的Z带(低能带)。 三、比较下列每对术语的异同点( 每小题 4 分,共32 分) 4 、泥岩与页岩——均为粘土岩,前者无页理,后者有页理。 5 、沉积相与岩相——岩相与沉积相是从属关系。沉积相是沉积环境及在该环境中形成的沉积岩(物)特征的综合,而岩相是一定沉积环境中形成的岩石或岩石组合,是沉积相的主要组成部分。 6 、河控三角洲与浪控三角洲——为不同作用所控制形成的三角洲。河控三角洲是以河流作用为主形成的三角洲,是高建设性的三角洲,形态上呈鸟足状或朵状。浪控三角洲是以波浪作用为主形成的三角洲,是破坏性的三角洲,形态上呈鸟嘴状。 7 、内波与内潮汐——内潮汐是内波的一种特殊类型。内波是指存在于两个不同密度的水层界面上或具有密度梯度的水体之内的水下波(LaFond,1966 ),内波的振幅、周期、传播速度、深度的变化范围都很大。其中周期与半日潮或日潮相同的内波叫做内潮汐。
沉积环境: 一个具有独特的物理、化学和生物特征的自然地理单元 沉积相——反映沉积记录成因(环境、条件和沉积作用)的岩石特征和生物特征的综合。即沉积记录成因的物质表现。生物相岩相 相变——地层的岩石特征和生物特征及其所反映的沉积环境和沉积作用在空间(横向)上的变化。 相分析——综合地层的岩石特征和生物特征,推断其成因(沉积环境和沉积作用)瓦尔特相(定)律亦称相对比原理 :只有那些目前可以观察到是相互毗邻的相和相区,才能原生地重叠在一起; 即在垂向上整合叠置的相是在侧向上相邻的沉积环境中形成的。 “The past history of our globe must be explained by what can be seen to be happening now” (James Hutton). It was named Uniformitarianism by Charles Lyell (1830; Hutton, 1795) Sed. Facies indicators——the physic, chemic and biologic characteristics which indicate sedimentary environments, processes and conditions. 。。。。。。 地层:各种层状岩石的统称.包括所有的沉积岩,部分火成岩和变质岩. 地层学:研究层状岩石形成的先后顺序、地质年代、时空分布规律(狭义)和形成环境条件及其物理、化学性质的地质学分支学科.她的核心目标就是建立地球科学的时间坐标。 地层叠覆律: 原始地层自下而上是从老到新的(上新下老) 原始水平律: 地层沉积时是近于水平的,而且所有的地层都是平行于这个水平面的(水平摆放). 原始侧向连续律: 地层在大区域甚至全球范围内是连续的,或者延伸到一定的距离逐渐尖灭(侧向连续)。 化石层序律:不同时代的地层含有不同的化石,含相同化石的地层其时代相同。
无机化学习题参考答案(II) 第一章 1.4.解: (1)H 2O 2 2C (2)S 2O 32 3v C (3)N 2O (N N O 方式) v C ∞ (4)Hg 2Cl 2 h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4 d T (8)SClF 5 4v C (9)反-Pt(NH 3)2Cl 2 2h D (10)PtCl 3(C 2H 4) 2v C 1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么? 一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃) 2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。 P F F H 3C CH 3 N P F F H 3C CH 3 N B B H 3F 3 (该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容) 3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性 4. 吸水后失效 的AlCl 3有什么方法可以脱水? 因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。 第二章
中级无机化学课程和教材建设 一、开设中级无机化学课是学科发展的需要 无机化学作为重要的化学分支学科,涉及周期表的100多个元素和数以万计的化合物,并渗透到化学学科内、外许多相关学科,产生了生物无机化学、无机固体化学、金属有机化学等新领域和新知识。即使是无机元素化学本身的研究和教学也正在从描述向推理、定性向定量、宏观向微观发展。而理科大学化学系本科各专业的教学计划按无机、分析、有机、物化开设基础课的传统延续了数十年,传统的在大学一年级开设的无机化学课程,基本上是建立在中学数、理、化基础之上。它分为两大块:前一块普通化学原理既是为基础元素化学的学习做好理论准备,又是为其他后续化学课程起先导作用;后一块基础元素化学是对元素及其化合物的性质进行介绍。这种课程设置对我国理科化学系学生的知识结构和无机化学的学术水平的提高产生了一定程度的不利影响。由于数、理及化学基础理论知识的局限性,要从结构化学、化学热力学及动力学等理论结合上对无机化学的问题进行深入阐述显然是不可能的,因之无机化学的教学显得不足。一些学校在大四开设无机化学专题来补充,但挂一漏万。所以化学系本科生的无机化学知识水平仍得不到根本提高。打破旧传统,代之以无机化学分段设置课程的结构改革,实施无机化学课程分段教学,开设中级无机化学课,这是新形势的需要。在教学内容上,中级无机化学应该系统介绍现代无机化学所涉及的新理论、新领域、新知识和无机新型化合物。在教学方法上突出结构化学、配位化学及热力学等基础理论在无机化学中的应用。 西北大学化学系自1988年开始在全国较早实施无机化学课程分段教学,在一年级开设初等无机化学,在三年级下学期开设“中级无机化学”课程。中级无机化学课程关注化学系课程体系的总体改革,除了要把握住中级无机化学在无机化学总教学计划中的准确位置,选择的内容应反映无机化学学科发展的现状之外,还要把握住中级无机化学在化学学科整体教学计划中的准确位置。在课堂教学中,体现“结构—反应—性能”一体化的讲授主线,根据课程要求对讲授的内容作精心的选择、创造性组织和深入浅出地介绍,以启迪学生,使其能在时代发展水平上超前和创造思维。这样的中级无机化学课程既能真正讲授无机化学本身的内容,又能用结构化学、热力学和反应理论来统一阐述无机元素化学,更便于新知识和新领域的介绍。克服了传统的在大学一年级开设的无机化学中讲授了一些不该由自己承担的化学基本原理的知识内容,而对应该由自己讲授的一些无机化学的基本内容却因学生的基础和学时的限制而舍弃的弊病。 二、恰当定位,构建中级无机化学课程
中级无机化学复习题 1.为什么第二周期与第三周期同族元素性质存在明显差异? 2.为什么在矿物中Mg、Ca、Sr、Ba等金属离子以氧化物、氟化物、碳酸盐和硫酸盐等形式存在?Cu、Ag、Pb、Zn、Hg则以硫化物形式存在? 3.通过计算说明钾原子最后一个电子填充在4s 轨道上。 4.比较Lewis碱强度:NH3NF3NCl3NBr3 比较Lewis酸强度:BBr3BCl3BF3 5.完成下列化学反应: CO(NH2)2+H2SO4→ HNO3 +HF → H-+NH3 → 6.由于形成水合物必须放热,试分析M c X a(s)在298K时形成四水合物至少放热多少?(假定正、负离子在无水盐和含水盐中对摩尔熵的加和贡献相等。 已知每mol晶格水对水合物的摩尔熵的独立加和贡献约为39 J·K-1·mol-1,S mθ(H2O,l)=69.91 J·K-1·mol-1) 7.试通过估算Xe[PtF6]的反应焓变来说明由Xe(g)和PtF6(g)可以制备Xe[PtF6]。 (已知:PtF6-的半径为310 pm,Xe+半径为180 pm;Xe(g) 的第一电离能I1=1170 kJ mol-1,PtF6(g)的电子亲合能-771 kJ mol-1) 8.利用HSAB理论判断下列反应进行的方向,并说明理由。 HgF2 + BeI2= BeF2 + HgI2 Ag+ + HI = AgI + H+ 9.下图为自由能-温度图,回答下面问题: (1)为什么CO2线几乎与温度坐标轴平行,而CO线是一条向下的斜线? (2)已知CO2线有△Gθ=-393.5-3.3×10-3T,CO线有△
G θ=-221-0.18T ,求二线交点温度。 (3) 分别写出当温度低于和高于交点温度时,用碳还原金属氧化物MO 时的反应方程式? (4)为什么可以采用加热的方法制备Ag? 10.通过设计热力学循环计算CrCl 的生成焓,并讨论其能否稳定存在?(已知Cr +的半径估计约为100 pm, r (Cl -)=181 pm ,Cr 的升华焓和电离能 分别为397和653 kJ mol -1,Cl 2的离解能为243.4 kJ mol -1, Cl 的电子亲合能为 368.5 kJ mol -1) 。11. 已知酸性介质中下面两个元素的元素电势图: 请回答下列问题: 1) 计算:φo (IO 3-/I -)=? φo (IO 3-/HIO)=? 2) 指出电势图中哪些物质能发生歧化反应; 3) 在酸性介质中H 2O 2与HIO 3能否反应; 4) 在酸性介质中I 2与H 2O 2能否反应;5) 综合3)、4)两个反应,HIO 3与H 2O 2反应最终结果是什么?用反应式说明. 12. 利用价层电子对互斥理论完成下列问题 1)判断ClF 3、IF 5分子结构,画出分子构型图,说出构型名称。 IO 3- HIO I 2 I - 1.1951.450.535O 2 H 2O 2 H 2O 1.770.68
火成岩 岩石:是天然产出的,由一种或多种矿物、或类似矿物的物质(如有机质、玻璃、非晶质)和生物遗骸等构成的固态集合体。 岩石的成因分类:按岩石的形成作用过程划分为:岩浆岩:是由地幔或地壳的岩石经熔融或部分熔融形成岩浆继而冷却固结的产物。沉积岩:是由地表风化产物、火山碎屑物等,在外力作用下搬运、沉积、固结而成的。变质岩:是由先已存在的岩石(岩浆岩及沉积岩)在温度、压力及应力条件发生变化的情况下,为适应新的环境而形成的岩石。 三大岩类之间的循环转换关系:已经存在的沉积岩、变质岩、火成岩抬升到地表以后,经风化剥蚀、机械破碎、搬运、沉积等作用可以形成沉积岩;已经存在的沉积岩、火成岩或变质岩,因温压条件的变化或流体的作用等可形成变质岩;温压条件的进一步变化,可使原来的沉积岩。变质岩或火成岩发生熔融形成岩浆,岩浆在固结形成新的火成岩。 岩石学:是专门研究地壳、地幔及其它星体产出的岩石的分布、产状、成分、结构、构造、分类、命名、成因、演化等方面的科学。 岩浆:是天然形成于上地幔或地壳深部,含有部分挥发分和固态物质、粘稠的、以硅酸盐为主要成分的高温熔融体。自然界中硅酸盐岩浆占绝大多数,极少量是金属硫化物岩浆和金属氧化物岩浆(矿浆)及碳酸岩浆。 岩浆的主要化学成分: (1) 常量元素: O、Si、Al、Fe、Mg、Ca、Na、K、Mn、Ti、P、H、C等,其中O最多。在岩浆结晶过程中这些元素相互结合,组成各种矿物。通常以氧化物形式来表示:如SiO2 、Al2O3 、Fe2O3 、 FeO 、MgO、CaO、Na2O、K2O、MnO、TiO2、P2O5、H2O、CO2 等。但实际上在岩浆中这些元素并非以氧化物形式存在,而多是呈离子、原子或离子团的形式存在,如: Mg2+、 Na +、[SiO4]4-。 另外还有挥发份:CO2、SO2、CO、N2、H2 NH3、NH4、HCl、HF、KCl、NaCl等等。硅酸盐岩浆化学成分以SiO2含量最多,根据SiO2含量将硅酸盐岩浆分成4种类型:1) 酸性岩浆SiO2 > 63%(wt%) 2) 中性岩浆SiO2 52~63%(wt%) 3) 基性岩浆SiO2 45~52%(wt%)
中级无机化学线上考试总结 2019-2020-2 冯锡兰,王淑涛 中级无机化学是面向化学专业二年级学生开设的限选课,本学期共46名同学选修本课程。总学时32,由王淑涛老师(前四周)和冯锡兰老师(后四周)共同讲授。以往考试形式为线下开卷考试,总成绩构成为:平时成绩30%+期末成绩70%。本学期针对疫情下的特殊情况,我们共同商讨了在线教学模式和考试模式,并与学生进行沟通确定。成绩构成调整为平时成绩50%+期末成绩50%,加大了过程考核的权重,以有效督促学生平时的在线学习。平时成绩构成两位老师根据自己的教学模式单独制定。王淑涛老师的平时成绩计算方式:雨课堂出勤及八次作业取平均值。冯锡兰老师的平时成绩计算方式:作业50%+雨课堂(出勤+测试)50%+弹幕额外加分(一条弹幕0.5分)。总的平时成绩由两位任课教师的平时成绩汇总后取平均值。在线考试最终确定使用雨课堂平台进行,依然为开卷形式。 本课程已于第八周结课,4月25日19:00~21:20完成在线考试,目前已完成试卷批改及成绩统计,现将本课程考评模式及线上考试情况总结如下。 1、过程考核实施方案: (1)灵活选择教学平台,保证过程考核的即时性和有效性 这次在线授课两位老师均选择了腾讯为主要平台。事实证明,平台始终运行稳定,直播、在线交流没有出现过卡顿或者崩溃的情况,并且作业的功能也非常强大。直播的同时使用了雨课堂的签到和在线测试、弹幕等功能,学生的出勤和答题情况可以即时查看、保留和传送,保证了过程考核的全面、客观、有效。
雨课堂弹幕和答题情况图示 (2)合理精简教学内容,增加课堂练习和随堂测试时间 为了提高学生的听课效率、保证教学效果,必须对教学内容进行调整和精简,突出主线和重点难点,其它知识引导学生进行线下自学,这样留出足够的时间开展在线测试和互动交流。一般每次课可以设计1~2次在线测试,外加1~2次弹幕答题,答题频率和时间节点的设置要合理,以有效抓住学生的注意力、调节课堂氛围、巩固教学效果。 (3)重新编排课后作业,布置、提交、批改全部在线完成 根据教学内容安排复习思考题和作业。复习思考题作为学生总结复习教学内容的提纲,不需要提交;作业发布在雨课堂或以图片形式发布在作业里,让学生线下完成后,拍照提交,并限制截止时间。教师在线批阅完成后,平台有即时提醒学生查看的功能。
沉积岩与沉积相 请注意: 1、本考试科目提供一套试题参考答案,进入本门课程点在线考试,随机抽题,如果考试题不是其中试题,千万别点最下面的“完成考试”按钮,立即关闭窗口,重新进入抽题,直到抽到所给这套题为止 2、在线考试只有一次机会,成绩为最终考试成绩,抄袭、雷同作业一律按零分处理。没给答案的可自行发挥,别空题,做完后一定点完成考试显示“答卷结果保存成功”表示提交成功,否则考试结果将无分值
1.成岩作用 广义的成岩作用是指从沉积物到沉积岩,以及在沉积岩形成以后再到它遭受风化作用或变质作用即到其被破坏或发生质的变化以前,发生的一系列的变化或作用,是沉积岩的形成和演化的重要阶段。 2.沉积相 沉积环境和该环境中所形成的沉积物(岩)特征的总和(综合)。 3.河流的“二元结构” 河流沉积的下段是由河床亚相的滞留沉积和边滩沉积组成,是由于河道迁移而引起的沉积物侧向加积的结果,构成了河流沉积的底层沉积。上段由堤岸亚相和河漫亚相组成,属泛滥平原沉积,主要是大量细粒悬浮物质在洪泛期垂向加积的结果,构成了河流沉积剖面的顶层沉积。底层沉积和顶层沉积的垂向叠置,构成了河流沉积的“二元结构”。 4.在海里或江里的岩石或珊瑚虫遗骸堆积成的岩状物 5.海洋或湖泊中,在重力的作用下,沿水下斜坡或峡谷流动的,含大量泥沙并呈悬浮状态搬运的高密度底流 6.如波状层理:纹层呈对称或不对称的波状,但其总的方向平行于层面。 7.又称毛细管浓缩作用或蒸发泵作用。 一般认为在潮上带,早先沉积的碳酸钙沉积物饱含孔隙水,在强烈蒸发时孔隙水沿毛细管上升,并使沉积物下部与海水沟通的孔隙不断获取海洋中正常海水的供给,就像泵汲一样。蒸发泵汲作用进行,使潮上带沉积物上部孔隙水的盐度大大提高,出现文石、高镁方解石及石膏沉淀,特别是石膏的沉淀增高了卤水中Mg/Ca比值,这些卤水就成为一种交代溶液,逐渐交代碳酸钙沉积物而形成白云岩。 8. 三角洲,即河口冲积平原,是一种常见的地表形貌。江河奔流中所裹挟的泥沙等杂质,在入海口处遇到含盐量较淡水高得多的海水,凝絮淤积,逐渐成为河口岸边新的湿地,继而
第三章配位化学 1.配合物 配合物:由提供孤对电子或多个不定域电子的一定数目的离子或分子(配体)和接受孤对电子或多个不定域电子的原子或离子(统称中心原子)按一定组成和空间构型所形成的化合物。其中,与中心原子直接相连的原子称为配位原子,与同一中心原子连接的配位原子数目称为配位数;由中心金属离子和配体构成的络合型体称为内界,通常用“[]”标出。 配合物的命名:配体名称在先,中心原子名称在后。阴离子名称在先,阳离子名称在后,两者间用“化”或“酸”相连。不同配体名称的顺序与化学式的书写顺序相同,相互间以圆点隔开,最后一种配体名称之后加“合”字。配体个数在配体名称前用中文数字表示。中心原子的氧化态在元素名称之后用括号内的罗马数字表示。 2.配合物的异构 立体异构:包括几何异构和旋光异构。配合物内界中两种或两种以上配体在空间的排布方式不同所产生的异构现象称为几何异构。若由配体在空间的排布方式不同所产生的异构体之间互为对映体,则这种异构现象称为旋光异构。 电离异构:配合物在溶液中电离时,由于内界和外界配体发生交换而生成不同配离子的异构现象称为电离异构。 键合异构:含有多种配位原子的单齿配体用不同的配位原子参与配位而产生的异构现象称为键合异构。 配位异构:在配阴离子与配阳离子形成的配合物盐中,配阴离子与配阳离子中配体与中心离子出现不同组合的现象称为配位异构。 3.配合物的常用制备方法 加成反应:路易斯酸碱之间直接反应,得到酸碱加合型配合物。加成后配位
数增大。 取代反应:用一种适当的配体(通常是位于光谱化学序列右边的配体)取代配合物中的某些配体(通常是位于光谱化学序列左边的配体)。取代后配位数通常不变。 氧化还原反应:伴随有中心金属氧化态变化的制备反应,在许多情况下同时伴随有配体的取代反应。 热解反应:在升高温度时,配合物中易挥发的配体失去,外界阴离子占据失去配体的配位位置,相当于固相取代反应。 4.配合物的化学键理论 (1)晶体场理论理论要点: (a)中心金属离子具有电子结构,配体视为无电子结构的阴离子或偶极子,二者之间存在的静电吸引作用产生配位键。 (b)中心金属离子的电子与配体电子之间存在排斥作用。由于配体在中心离子周围的分布具有方向性,配体的静电场作用使中心离子的d轨道发生能级分裂。分裂的方式与分裂的程度取决于配位场的类型及配体、中心离子的性质。 (c)中心离子的电子在配位场能级中的占据结果,使配合物获得一个晶体场稳定化能(CFSE)。 晶体场理论可以定性解释配合物的吸收光谱、稳定性、磁性、结构畸变等,但无法解释金属与配体间的轨道重叠作用,不能很好地解释光谱化学序列。 (2)配位场理论理论要点:配体的存在使中心金属离子与配体之间存在的化学键作用既包括静电作用也包括共价作用(既有σ成键作用也有π成键作用)。金属离子的d电子局限在金属原子核附近运动,不进入配体范围,但是配位场负电荷的影响使中心金属离子的d轨道能级分裂。在配位场中,分裂能既决定于静电作用,又决定于共价作用(其中首先包括σ成键作用,其次包括π成键作用)。
无机化学习题参考答案 第一章 1.4.解: (1)H 2O 2 2C (2)S 2O 32- 3v C (3)N 2O (N -N -O 方式) v C ∞ (4)Hg 2Cl 2 h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4- d T (8)SClF 5 4v C (9)反-Pt(NH 3)2Cl 2 2h D (10)PtCl 3(C 2H 4)- 2v C 1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么? 一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃) 2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。 P F F H 3CH 3 P F F H 3CH B B H 3F 3 (该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容) 3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性 4. 吸水后失效 的AlCl 3有什么方法可以脱水? 因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。