生物碱习题剖析
- 格式:doc
- 大小:416.50 KB
- 文档页数:11

生物碱类药物分析(总分40,考试时间90分钟)一、A型题题干在前,选项在后。
有A、B、C、D、E五个备选答案其中只有一个为最佳答案,其余选项为干扰答案。
考生须在5个选项中选出一个最符合题意的答案(最佳答案)。
1.口引噪类生物碱的特征反应A.发烟硝酸反应,显黄色B.药物酸性水溶液加稍过量漠水呈绿色的特征反应C.与香草醛等缩合反应显色D.钥硫酸试液显紫色-蓝色.棕紫色E.双缩服反应2.常用的生物碱薄层色谱显色剂是A.硅钙酸B.磷钙酸C.改良碘化秘钾D.氢氧化铉E.雷氏铉盐3.咖啡因,茶碱等黄噤吟生物碱的特征反应A.双缩腿反应B.紫缩酸反应C.与香草醛等缩合反应D.钥硫酸试液显紫色-蓝色.棕紫色E.硝化显色反应4.生物碱中具有两性的是A.奎宁B.小案碱C.阿托品D.麻黄碱E.吗啡5.吗啡生物碱的特征反应A.发烟硝酸反应,显黄色B.C+DC.甲醛硫酸试液显紫堇色D.钥硫酸试液显紫色■蓝色■棕紫色E.双缩服反应6.非水碱量法测定药物含量时,一般以消耗O.lmol/L高氯酸溶液为A.5mlB.8mlC.15mlD.30mlE.20ml7.阿托品,山莫若碱等托烷类生物碱,特征反应A.发烟硝酸反应,呈黄色B.药物酸性水溶液加稍过量漠呈绿色C.甲醛硫酸试液显紫堇色D.钥硫酸试液显紫色■蓝色■棕紫色E.双缩服反应8.用0.1mol/L高氯酸溶液直接滴定硫酸奎宁时,硫酸奎宁与高氯酸的摩尔比为A. 1:1B.1:2C.1:3D.1:4E.1:59.具有Vitali反应的药物是A.毒扁豆碱B.阿托品C.氯化琥珀碱D.哌仑西平E.漠丙安太林10.非水碱量法不适用的生物碱类药物为A.盐酸麻黄碱B.盐酸吗啡C.咖啡因D.硫酸奎宁E.硫酸阿托品11.生物碱中提取中和法最常采用的溶剂是A.乙醇B.甲醇C.丙酮D.乙酰E.氯仿和乙醍12.奎宁,奎尼丁等含氮哇琳类生物碱的特征反应A.发烟硝酸反应,显黄色B.药物酸性水溶液加稍过量漠水呈绿色的特征反应C.甲醛硫酸试液显紫堇色D.钥硫酸试液显紫色-蓝色.棕紫色E.双缩服反应13.酸性染料比色法中,水相的pH值过小,则A.能影响离子对B.有机溶剂提取能完全C.酸性染料以阴离子状态存在D.生物碱几乎全部以分子状态存在E.酸性染料以分子状态存在14.非水碱量法测定生物碱含量的限制条件是A. PkbV8〜10B.pKb< 10—12C.pKb<12D.pkb<13E.pKb<10~1415.生物碱类(PKb多为6〜9)提取分离测定时,须加碱化试剂,应考虑含酯结构,含酚结构等的影响,最适宜的碱化试剂是A.小苏打B.碳酸钠C.氢氧化钠D.氨溶液E.氧化钙16.有机含氮药物中碱性最强的胺类是A.伯胺B.脂肪仲胺C.季胺D.芳胺E.叔胺17.生物碱的含量测定,容量法可采用A.直接法,碱法B.提取中和法C.非水碱量法D.A+CE.A+B+C18.生物碱的鉴别反应中麻黄碱等芳香环侧链氨基醇的特征反应,是A.发烟硝酸反应,显黄色B.药物酸性水溶液加稍过量漠呈绿色C.甲醛.硫酸试液显紫堇色D.铜硫酸试液显紫色-蓝色.棕绿色E.双缩腿反应呈蓝色19.非水溶液滴定法测定盐酸吗啡含量时,为排除盐酸对滴定的影响需加入A.硝酸银B.三氯醋酸C.醋酸钠D.醋酸汞E.氤化钾20.生物碱提取中和法中最常采用的碱化试剂是A.氢氧化钠B.氢氧化钾C.氨溶液D.三乙胺E.碳酸钠二、B型题是一组试题(2至4个)公用一组A、B、C、D、E五个备选。


第十章生物碱类药物的分析一选择题(一)单选题相同知识点:生物碱的结构与性质1.既可溶于酸又可溶于碱的药物是()。
阿托品 B.奎尼丁 C.吗啡 D.可待因 E.山莨菪碱答案:C2.属于喹啉类生物碱的药物是()。
A.阿托品 B.奎尼丁 C.吗啡 D.可待因 E.山莨菪碱答案:B3.磷酸可待因与盐酸吗啡一样,同属()。
A.托烷类生物碱 B.异喹啉类生物碱 C.喹啉类生物碱D.黄嘌呤类生物碱 E.苯烃胺类答案:B4.磷酸可待因分子中不含酚羟基,仅有叔胺基团,具有()。
A.两性 B.强酸性 C.强碱性 D.弱酸性 E.弱碱性答案:C相同知识点:各类生物碱的鉴别试验5.绿奎宁反应主要用于鉴别()。
A.硫酸阿托品 B.硫酸奎尼丁 C.硫酸链霉素 D.盐酸麻黄碱 E.吗啡答案:B6.能用紫脲酸铵反应鉴别的药物是()。
A.咖啡因 B.奎尼丁 C.吗啡 D.可待因 E.山莨菪碱答案:A7.能用维他立反应鉴别的药物是()。
A.麻黄碱 B.奎尼丁 C.奎宁 D.阿托品 E.可待因答案:D8.在弱酸性溶液中,加过量溴水,再加过量氨水,呈翠绿色反应的是()。
A.紫脲酸铵反应 B.绿奎宁反应 C.双缩脲反应D.维他立反应 E.吲哚生物碱答案:B9.能区别盐酸吗啡和磷酸可待因的反应是()。
A.铁氰化钾反应 B.双缩脲反应 C.维他立反应D.紫脲酸铵反应 E.茜素氟蓝-硝酸亚铈反答案:A10. 生物碱的鉴别反应中麻黄碱等芳香环侧链氨基醇的特征反应是()。
A.发烟硝酸反应,呈黄色 B.药物酸性水溶液加稍过量溴呈绿色C.甲醛-硫酸试液呈紫堇色 D.钼硫酸试液呈紫色-蓝色-棕绿色E.硫酸铜、氢氧化钠蓝紫色答案: E11.阿托品.山莨菪碱等托烷类生物碱,特征反应()。
A.发烟硝酸反应,呈黄色B.药物酸性水溶液加稍过量溴呈绿色C.甲醛硫酸试液显紫堇色D.钼硫酸试液显紫色-蓝色-棕紫色E.铁氰化钾三氯化铁蓝色答案: A12. 绿奎宁反应所用试剂为()。

《中药化学》生物碱练习题及答案一、单项选择题1.下列有关生物碱的论述,正确的是(A)。
A.含有N原子B.显碱性C.自然界的所有含N成分D.无色2.生物碱不具有的特点是(D)。
A.分子中含N原子B.N原子多在环内C.具有碱性D.分子中多有苯环3.具有挥发性的生物碱是( D)。
A.吗啡碱B.小檗碱C.苦参碱D.麻黄碱4.生物碱在植物体内的存在状态多为( B)。
A.无机酸盐B.有机酸盐C.游离状态D.苷的形式5.有关生物碱性质叙述不正确的是(D)。
A.多为无色结晶B.多具苦味或辛辣味C.多具旋光性D.多具挥发性6.具有莨菪烷母核的生物碱是( C )。
A.甲基麻黄碱B.小檗碱C.阿托品D.氧化苦参碱7.属于异喹啉类生物碱的是( D )。
A.东莨菪碱B.苦参碱C.乌头碱D.小檗碱8.氧化苦参碱在水中溶解度大于苦参碱的原因是(B)。
A.属季胺碱B.具有半极性N→O配位键C.相对分子质量大D.碱性强9.水溶性生物碱通常是指(A)。
A.季铵碱B.叔胺碱C.仲胺碱D.伯胺碱10.某生物碱的碱性强,则它的(C)。
A.Ka大B.Kb小C.pKa大D.pKa小11.下列生物碱碱性最强的是( D)。
A.伯胺生物碱B.叔胺生物碱C.仲胺生物碱D.季铵生物碱12.决定生物碱碱性最主要的因素是( A)。
A.氮原子的杂化方式B.诱导效应C.共轭效应D.分子内氢键13.就生物碱分子中N原子未共用电子对杂化方式而论,其碱性顺序为(A)。
A.sp3>sp2>spB.sp>sp2>sp3C.sp2>sp>sp3D.sp2>sp3>sp14.影响生物碱碱性强弱的因素中,能使氮原子碱性增强的是(A)。
A.N上连接斥电子取代基B.N上连接吸电子取代基C.N的邻位碳上连接苯环D.N的邻位碳上连接乙酰基15.若将中药中所含的生物碱盐和游离生物碱都提取出来,应选用( B)。
A.水B.乙醇C.乙醚D.氯仿16.用酸水提取生物碱时,一般采用(C)。
A.渗漉法B.回流法C.煎煮法D.连续回流法17.提取生物碱盐不选用的溶剂是(A)。

生物碱类药物的分析(二)(总分73, 做题时间90分钟)一、X型题由一个题干和A、B、C、D、E五个备选答案组成,题干在前,选项在后。
要求考生从五个备选答案中选出二个或二个以上的正确答案,多选、少选、错选均不得分。
1.于酸性溶液中,能与生物碱类药物发生沉淀反应的试剂为SSS_MULTI_SELA 杂多酸类(大分子无机酸类)B 碘化铋钾C 碘化汞钾D 氯化汞E 重金属盐类分值: 1答案:B,C,D2.Vitali反应可用以鉴别的药物为SSS_MULTI_SELA 氢溴酸山莨菪碱B 磷酸可待因C 硫酸奎尼丁D 硫酸阿托品E 利血平分值: 1答案:A,D3.提取酸碱滴定法测定生物碱盐类药物时,不适于用强碱作碱化试剂的药物为SSS_MULTI_SELA 硫酸阿托品B 盐酸吗啡C 利血平D 与脂肪酸共存的生物碱盐药物E 硫酸奎宁片剂分值: 1答案:A,B,C,D4.生物碱类药物的特殊鉴别反应为SSS_MULTI_SELA Vitali反应B Marquis反应C Thalleioquin反应D Frohde反应E Zimmerman反应分值: 1答案:A,B,C,D5.下面最常用的有机溶剂为SSS_MULTI_SELA 乙醇B 氯仿C 二氯甲烷D 丙酮E 石油醚分值: 1答案:B,C6.酸性染料比色法测定生物碱或其他有机碱药物的原理包括SSS_MULTI_SELA 生物碱溶于有机溶剂B 生物碱在适宜pH值溶液中,形成盐(即阳离子)C 酸性染料在适宜PU值溶液中,解离出阴离子D 生物碱所生成的阳离子与酸性染料所给出的阴离子结合成有色离子对E 有色的离子对溶于有机溶剂而不溶于水分值: 1答案:B,C,D,E7.不能使生物碱类大多数药物显色的试剂有SSS_MULTI_SELA 浓硫酸、浓硝酸B 浓盐酸、冰醋酸C 钼硫酸、钒硫酸、硒硫酸、甲醛硫酸D 氢氧化钠试液E 氨试液分值: 1答案:B,D,E8.硫酸奎宁的特殊杂质有SSS_MULTI_SELA 阿扑吗啡B 可待因C 罂粟酸D 氯仿-乙醇不溶物E 其他金鸡纳碱分值: 1答案:D,E9.双缩脲反应鉴别盐酸麻黄碱时,所显紫堇色的产物应包括SSS_MULTI_SELA 无水铜配位化合物[(C10H15NO)2CuO]B 含2分子结晶水的铜配位化合物[(C10H15NO)2CuO•2H20)C 合4分子结晶水的铜配位化合物[(C10H15NO)2CuO•4H20)D 铜的氧化物E 含5分子结晶水的硫酸铜分值: 1答案:A,B,C10.双缩脲反应鉴别盐酸麻黄碱时,乙醚层中显紫红色的成分是SSS_MULTI_SELA C10H15NO•HClB [(C10H15NO)2CuO•4H2O)C [(C10H15NO)2CuO•2H2O]D [(C10H15NO)2CuO]E (C10H15NO)2Cu(OH)2分值: 1答案:C,D11.吲哚生物碱(利血平)和香草醛或对二甲氨基苯甲醛的呈色反应是基于SSS_MULTI_SELA 吲哚环上β位活泼氢原子B 芳香醛的醛基C 吲哚环不饱和结构D 芳香醛的苯环E 利血平分子结构中吲哚环上β位的活泼氢原子与芳醛的醛基发生的呈色缩合反应分值: 1答案:A,D,E12.提取酸碱滴定法测定生物碱药物时,常用的碱化试剂为SSS_MULTI_SELA 氢氧化钠或氢氧化钙B 氨水C 碳酸钠或碳酸氢钠D 氧化镁E 硅钨酸分值: 1答案:A,B,C,D13.硫酸阿托品的鉴别试验为SSS_MULTI_SELA Clˉ的反应B SOˉ的反应C Vitali反应D 红外光谱法E 紫外光谱法分值: 1答案:B,C,D14.生物碱药物的提取酸碱滴定法测定其含量的主要步骤包括SSS_MULTI_SELA 供试品的称取B 供试品溶液的碱化C 供试品的溶解D 游离生物碱的提取分离E 生物碱药物的测定分值: 1答案:B,D,E15.不适合用于酸性染料比色法的有机溶剂为SSS_MULTI_SELA 乙醇B 氯仿C 二氯甲烷D 丙酮E 石油醚分值: 1答案:A,D,E16.盐酸吗啡中的特殊杂质为SSS_MULTI_SELA 罂粟酸B 马钱子碱C 莨菪碱D 阿扑吗啡E 其他生物碱分值: 1答案:A,D,E17.不属于磷酸可待因中的特殊杂质为SSS_MULTI_SELA 吗啡B 阿扑吗啡C 游离磷酸D 马钱子碱E 莨菪碱分值: 1答案:B,C,D,E18.影响酸性染料比色法测定结果准确性的关键因素为SSS_MULTI_SELA 水分B 水溶液的pH值C 共存物D 有机溶剂E 被测生物碱药物的碱性分值: 1答案:B,D19.非水滴定法测定生物碱药物时,判断滴定终点的方法为SSS_MULTI_SELA 永停终点法B 电位指示终点法C 自身指示终点法D 指示剂法E pH值法分值: 1答案:B,D20.硫酸奎宁中的特殊杂质为SSS_MULTI_SELA 阿扑吗啡B 其他金鸡纳碱C 水不溶物D 二苯酮E 氯仿-乙醇中不溶物分值: 1答案:B,E21.硫酸奎宁中检查氯仿-乙醇不溶物是控制SSS_MULTI_SELA 其他金鸡纳碱B 无机盐C 罂粟碱D 莨菪碱E 其他生物碱分值: 1答案:B,E22.双缩脲反应鉴别盐酸麻黄碱的有色产物有SSS_MULTI_SELA [(C10Hl5NO)2CuO)B [(C10H15NO)2CuO•2H20)C [(C10H15NO)2CuO•4H20)D (C10Hl5NO)2Cu(OH)2E C10H15NO•HCl分值: 1答案:A,B,C23.提取酸碱滴定法测定对热稳定的生物碱盐类药物时,可采用SSS_MULTI_SELA 提取液蒸干后剩余滴定法B 提取溶液蒸干,溶解残渣后滴定法C 双相滴定法D 提取溶液直接滴定法E 提取溶液剩余滴定法分值: 1答案:A,B,E24.酸性染料比色法所用的酸性染料必须具备的条件为SSS_MULTI_SELA 在适宜pH溶液中能和生物碱阳离子定量地结合为离子对B 所成离子对能完全被有机溶剂提取C 离子对的有机溶剂溶液颜色应尽可能深D 离子对的有机相溶液在规定波长的吸收度应尽量大E 离子对的颜色与酸性染料的颜色应相同分值: 1答案:A,B,C,D25.盐酸吗啡中其他生物碱杂质包括的成分有SSS_MULTI_SELA 可待因B 蒂巴因C 罂粟碱D 那可汀E 罂粟酸分值: 1答案:A,B,C,D26.Vitali反应鉴别硫酸阿托品所用试剂有SSS_MULTI_SELA 发烟硝酸B 甲醛硫酸试液C 氢氧化钾结晶D 醇制氢氧化钾试液E 溴水或氯水分值: 1答案:A,C,D27.硫酸奎宁的鉴别试验有SSS_MULTI_SELA 与稀硫酸产生荧光反应B SO4 2-的反应C 红外光谱法D 紫外光谱法E 绿奎宁反应分值: 1答案:A,B,C,E28.硝酸士的宁的鉴别反应为SSS_MULTI_SELA 与重铬酸钾的呈色反应B NO3ˉ的反应C Clˉ的反应D 红外光谱法E SOˉ的反应分值: 1答案:A,B29.绿奎宁(Thalleioquin)反应可用以鉴别的药物为SSS_MULTI_SELA 茶碱B 硫酸奎宁C 硫酸奎尼丁D 硫酸阿托品E 盐酸吗啡分值: 1答案:B,C30.提取酸碱滴定法测定生物碱盐类药物时,常用有机溶剂(提取剂)为SSS_MULTI_SELA 乙醇B 乙醛C 乙醚D 丙酮E 氯仿分值: 1答案:C,E31.提取酸碱滴定法测定生物碱盐类药物时,最常选用氨水作碱化试剂,其原因是SSS_MULTI_SELA 一般生物碱的pKb为6~9B 水的pKw为14C 氨水的pKb为4.67D 氨具挥发性,易于消除E 可使大部分生物碱游离出来,同时不影响生物碱的稳定性,亦不会发生乳化作用分值: 1答案:A,C,D,E32.中国药典(2000年版)采用提取酸碱滴定法测定药物时,规定提取溶剂的用量原则包括SSS_MULTI_SELA 通用提取4次B 第1次用量至少应为药物溶液体积的1/2C 以后几次用量应为第1次用量的1/2D 第1次用量应和药物溶液体积相等E 以后几次用量依次适当递减分值: 1答案:A,B,C33.影响酸性染料比色法测定结果的因素SSS_MULTI_SELA 有机溶剂B 水分C 共存强酸性物质D 酸性染料E 水相pH值分值: 1答案:A,B,C,D,E34.SO4 2-的反应有SSS_MULTI_SELA 加AgNO3试液生成白色沉淀B 加氨试液发生沉淀反应C 加BaCl2试液生成白色沉淀,沉淀不溶于盐酸或硝酸D 加醋酸铅试液生成白色沉淀,沉淀可溶于醋酸铵试液或氢氧化钠试液中E 加H2SO4与铜丝加热,发生红棕色蒸气分值: 1答案:C,D35.《中国药典》(2000年版)采用紫外分光光度法测定的药物有SSS_MULTI_SELA 盐酸吗啡片B 硫酸奎宁片C 硫酸阿托品注射液D 硝酸士的宁注射液E 对乙酰氨基酚分值: 1答案:A,D,E36.检查盐酸吗啡中的“其他生物碱”时,所采用的方法为SSS_MULTI_SELA 主成分加对照品对照法B 重量法C 灵敏度法D 呈色法E 沉淀法分值: 1答案:A,B37.提取酸碱滴定法测定生物碱盐类药物的方式为SSS_MULTI_SELA 提取液蒸干后,酸碱剩余滴定法B 提取液蒸干后,加乙醇溶解,直接滴定法C 提取液用酸碱剩余滴定法D 提取液干燥后称重法E 提取液加热挥发去提取溶剂,称重法分值: 1答案:A,B,C38.生物碱类药物含量测定的方法应为SSS_MULTI_SELA 非水滴定法B 提取酸碱滴定法C 酸性染料比色法D 紫外分光光度法E 高效液相色谱法分值: 1答案:A,B,C,D,E39.硫酸阿托品的鉴别试验有SSS_MULTI_SELA 双缩脲反应B Vitali反应C SO4 2-的反应D Cl-的反应E 红外光谱法分值: 1答案:B,C40.不属于利血平中的杂质为SSS_MULTI_SELA 水杨酸B 氧化产物C 还原产物D 其他生物碱E 其他金鸡纳碱分值: 1答案:A,C,D,E41.生物碱药物中特殊杂质检查时,用其化学性质差异的为SSS_MULTI_SELA 旋光性质差异B 沉淀反应差异C 呈色反应差异D 分子极性差异E 酸碱性差异分值: 1答案:B,C42.盐酸吗啡分子结构中的具特性基团是SSS_MULTI_SELA 酚羧基B 叔胺基团C 烯醇式羟基D Cl-E 莨菪酸的羧基分值: 1答案:A,B,D43.提取酸碱滴定法测定其含量时,不宜用强碱进行碱化的生物碱的分子结构特点为SSS_MULTI_SELA 含有碱性氮原子B 含酯结构(如阿托品、利血平等)C 含酚羟基结构(如吗啡、阿扑吗啡)D 含莨菪酸E 芳香环侧链为氨基醇结构分值: 1答案:B,C44.影响酸性染料比色法测定准确度的关键因素是SSS_MULTI_SELA 酸性染料B 水分C 水溶液的pH值D 有机溶剂E 共存物分值: 1答案:C,D45.盐酸麻黄碱的鉴别试验有SSS_MULTI_SELA Vitali反应B Cl-反应C 红外光谱法D 双缩脲反应E 与铁氰化钾试液的反应分值: 1答案:B,C,D46.生物碱中特殊杂质检查利用其物理性质差异的为SSS_MULTI_SELA 溶解行为差异B 呈色反应差异C 旋光性质差异D 分子极性差异E 紫外吸收特征差异答案:A,C,D,E47.双缩脲反应鉴别盐酸麻黄碱时,乙醚层显紫红色,该颜色化合物应为SSS_MULTI_SEL分值: 1答案:A,C48.非水滴定法可测定的药物SSS_MULTI_SELA 盐酸麻黄碱B 硫酸阿托品C 盐酸吗啡D 硫酸奎宁片E 硝酸士的宁分值: 1答案:A,B,C,D,E49.酸性染料比色法所能用的酸性染料为SSS_MULTI_SELA 酚酞B 甲基红C 甲基橙D 溴甲酚绿E 溴百里酚蓝分值: 1答案:C,D,E50.不属于硝酸士的宁中的杂质为SSS_MULTI_SELA 酮体B 对氯酚C 对氨基酚D 马钱子碱E 其他生物碱答案:A,B,C,E51.生物碱类药物的一般鉴别试验包括SSS_MULTI_SELA 熔点测定B 呈色反应C 沉淀反应D 紫外光谱E 红外光谱分值: 1答案:A,B,C,D,E52.于酸性介质中能与生物碱类药物发生沉淀反应的杂多酸(大分子的无机酸)应为SSS_MULTI_SELA 钼硫酸B 磷钼酸C 钒硫酸D 硒硫酸E 硅钨酸分值: 1答案:B,E53.提取酸碱滴定法测定生物碱盐类药物含量时,所选用的有机溶剂(提取溶剂)应具备的主要条件为SSS_MULTI_SELA 与生物碱能相互结合B 与水不相混溶C 与生物碱或碱化试剂不能发生任何反应D 对生物碱溶解度大,对其他共存物质溶解度应尽可能小E 沸点低分值: 1答案:B,C,D,E54.盐酸吗啡的特殊杂质有SSS_MULTI_SELA 罂粟酸B 其他生物碱C 阿扑吗啡D 莨菪碱E 马钱子碱分值: 1答案:A,B,C55.硝酸士的宁的鉴别方法有SSS_MULTI_SELA Vitali的反应B Marquis的反应C Frohde反应D NO3-的反应E 与重铬酸钾的反应分值: 1答案:D,E56.双缩脲反应鉴别盐酸麻黄碱所用试剂是SSS_MULTI_SELA 乙醚B 氯仿C 硫酸铜试液D 发烟硝酸E 钼硫酸试液分值: 1答案:A,C57.绿奎宁(Thalleiaquin)反应需用的试剂有SSS_MULTI_SELA 稀硫酸B 溴水或氯水C 氨溶液D 三氯化铁试液E 硫酸铜试液分值: 1答案:B,C58.用紫脲酸铵反应可以鉴别的药物SSS_MULTI_SELA 咖啡因B 盐酸伪麻黄碱C 硫酸奎宁D 盐酸吗啡E 茶碱分值: 1答案:A,E59.离子对被有机溶剂提取的完全程度取决于SSS_MULTI_SELA 提取常数(EA、B)B 酸性染料阴离子的浓度C 酸性染料的种类D 有机溶剂的选用E 提取的方法分值: 1答案:A,B,C,D60.硫酸阿托品中特殊杂质为SSS_MULTI_SELA 莨菪碱B 莨菪酸C 吗啡D 其他金鸡纳碱E 其他生物碱分值: 1答案:A,E61.盐酸吗啡中检查的其他生物碱应包括SSS_MULTI_SELA 吗啡B 可待因C 罂粟碱D 那可汀E 蒂巴因分值: 1答案:B,C,D,E62.其盐酸盐能溶于氯仿的生物碱为SSS_MULTI_SELA 阿托品B 吗啡C 可待因D 麻黄碱E 奎宁分值: 1答案:C,E63.Vitali反应鉴别硫酸阿托品的步聚包括SSS_MULTI_SELA 加CuSO4和NaOH生成蓝紫色B 加稀铁氰化钾试液生成蓝色C 加发烟硝酸生成黄色硝基衍生物D 加醇制氢氧化钾试液显深紫色E 加氯化钡试液生成白色沉淀分值: 1答案:C,D64.盐酸吗啡的鉴别试验有SSS_MULTI_SELA Cl-的反应B 红外光谱法C SO4 2-的反应D 甲醛硫酸反应E 钼硫酸反应分值: 1答案:A,B,D,E65.《中国药典》(2000年版)附录中收载的NO3-的反应有SSS_MULTI_SELA 于硫酸存在下和硫酸亚铁的呈色反应B 在硫酸介质中与铜丝(或铜屑)的反应C 与氯化钡试液的沉淀反应D 与硝酸银试液的沉淀反应E 与醋酸铅试液的沉淀反应分值: 1答案:A,B66.盐酸麻黄碱的鉴别反应为SSS_MULTI_SELA 红外光谱法B 双缩脲反应C Vitali反应D Clˉ的反应E SOˉ的反应分值: 1答案:A,B,D67.双缩脲反应鉴别盐酸麻黄碱时,需用的试剂为SSS_MULTI_SELA 20%氢氧化钠试液B 乙醚C 氯仿D 硫酸铜试液E Marquis试液分值: 1答案:A,B,D68.硫酸奎宁中“氯仿-乙醇中不溶物”检查的杂质为SSS_MULTI_SELA 水溶物B 其他金鸡纳碱C 马钱子碱D 无机盐E 其他生物碱分值: 1答案:D,E69.硫酸阿托品的特殊杂质有SSS_MULTI_SELA 马钱子碱B 罂粟酸C 莨菪碱D 蒂巴因E 其他生物碱分值: 1答案:C,E70.酸性染料比色法可测定的药物有SSS_MULTI_SELA 硫酸阿托品B 硫酸阿托品片C 硫酸阿托品注射液D 硫酸阿托品片的含量均匀度E 异烟肼分值: 1答案:A,B,C,D71.吗啡生物碱的鉴别反应为SSS_MULTI_SELA 还原反应B 紫脲酸铵反应C 沉淀反应D Frohde反应E Marquis反应分值: 1答案:D,E72.硫酸奎宁的鉴别反应为SSS_MULTI_SELA 加稀H2S04液产生荧光的反应B 绿奎宁(Thalleioquin)反应C 红外光谱法D SOˉ的反应E NO3ˉ的反应分值: 1答案:A,B,C,D73.生物碱药物中特殊杂质检查方法的依据为SSS_MULTI_SELA 特殊杂质的物理性质B 特殊杂质的化学性质C 特殊杂质的溶解性D 药物与特殊杂质物理性质差异E 药物与特殊杂质化学性质差异分值: 1答案:D,E1。

生物碱试题及答案一、选择题1. 下列属于生物碱的是:A. 蛋白质B. 脂肪C. 糖类D. 核酸2. 生物碱主要存在于以下哪个植物器官中?A. 根B. 叶C. 茎D. 花3. 下列哪种物质在中药中具有较高的生物碱含量?A. 阔叶黄杨B. 烟草C. 枸杞D. 绿豆4. 生物碱对人体的影响是:A. 保护肝脏B. 促进消化C. 消炎抗菌D. 改善睡眠质量5. 生物碱的化学性质主要是:A. 酸性B. 碱性C. 中性D. 可变性二、填空题1. 生物碱是一类_________性质的含氮有机化合物。
2. 生物碱可以通过_____________提取和精细分离得到。
3. __________是生物碱的一种重要类别,具有广泛的药理活性。
4. 生物碱在医药领域中常用于_____________________。
5. 生物碱通过与______________发生相互作用来发挥作用。
三、解答题1. 请简要介绍生物碱的定义以及在医药领域中的应用。
生物碱是指一类具有碱性和含有氮原子的有机化合物。
它们广泛存在于植物中,并具有重要的药理活性。
在医药领域,生物碱被广泛用于药物研发和治疗。
它们可以用于抗菌、抗炎、抗肿瘤等方面的药物,对人体健康具有重要作用。
2. 生物碱的提取和分离方法有哪些?生物碱的提取方法主要包括超声波提取、浸提、微波提取等。
分离方法主要有色谱法、电泳法、毛细管电泳法等。
3. 生物碱与细胞的相互作用方式是怎样的?生物碱通过与细胞膜、细胞质中的受体或靶点发生相互作用来发挥作用。
它们可以与受体结合,影响细胞内的信号传导途径,从而调节细胞功能。
四、答案选择题:1. A2. C3. B4. C5. B填空题:1. 碱性2. 植物提取3. 生物碱4. 药物研发和治疗5.细胞受体解答题:略以上是关于生物碱试题及答案的部分内容,希望对你有所帮助。
如需获取更多相关信息,请参考相关科学文献或咨询专业人士。
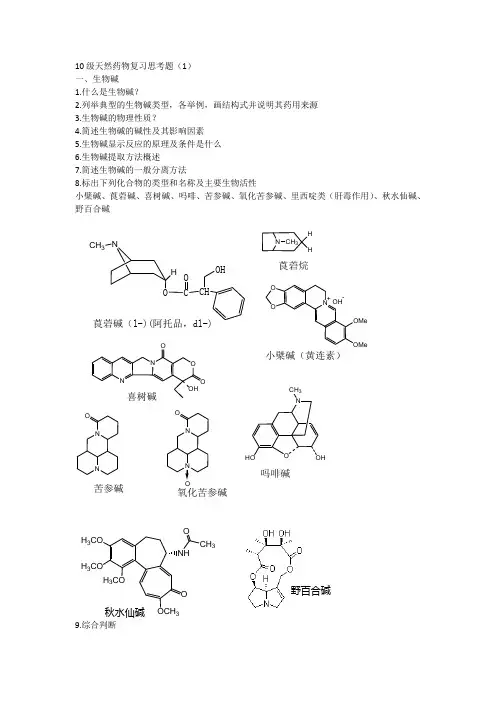
10级天然药物复习思考题(1) 一、生物碱
1.什么是生物碱?
2.列举典型的生物碱类型,各举例,画结构式并说明其药用来源
3.生物碱的物理性质?
4.简述生物碱的碱性及其影响因素
5.生物碱显示反应的原理及条件是什么
6.生物碱提取方法概述
7.简述生物碱的一般分离方法
8.标出下列化合物的类型和名称及主要生物活性
小檗碱、莨菪碱、喜树碱、吗啡、苦参碱、氧化苦参碱、里西啶类(肝毒作用)、秋水仙碱、 野百合碱
N
CH 3H
O
N CH 3
H
H
C
O CH
OH
莨菪碱(l-)(阿托品,dl-)
莨菪烷
N O O
OMe
+-OH
小檗碱(黄连素)
N
N
O O
O OH
喜树碱
N
N
O
苦参碱
氧化苦参碱
HO
O
N
CH 3OH
吗啡碱
O
NH
OCH 3
CH 3
O
H 3CO
H 3CO
H 3CO
秋水仙碱
野百合碱
9.综合判断
(1)比较碱性大小
CH
CH 2OH N CH 3
H
OCO
CH 2OH N CH 3
H
OCO HO
CH
CH 2OH N CH 3
OCO O
a
b
c
N HN 1
2
N N
H
CONHCH Me
CH 2OH
Me 123N
(2)如果将混合生物碱溶于酸水中,将pH 逐渐由低调到高,分别用氯仿萃取,氯仿中所得生物碱的碱度是由( )到( )。

天然药物化学-⽣物碱习题第⼗章⽣物碱习题】(⼀)选择题[1-220]A 型题[1-58]1. ⽣物碱不具有的特点是A分⼦中含N 原⼦ B.N 原⼦多在环内 C.具有碱性D分⼦中多有苯环 E.显著⽽特殊的⽣物活性2.具有莨菪烷母核的⽣物碱是A甲基⿇黄碱 B.⼩檗碱 C.阿托品D氧化苦参碱 E.乌头碱3. 属于异喹啉⽣物碱的是苦参碱A东莨菪碱 B. C.乌头碱D⼩檗碱 E.⿇黄碱4.在常温下呈液体的⽣物碱是A槟榔碱 B.⿇黄碱 C.苦参碱D乌头碱 E.莨菪碱5.具有挥发性的⽣物碱是A吗啡碱 B.⼩檗碱 C.苦参碱D⿇黄碱 E.乌头碱6.具有升华性的⽣物碱是A烟碱 B.咖啡因 C.⼩檗胺D益母草碱 E.氧化苦参碱7.⽣物碱的味多为A咸 B.辣 C.苦D甜 E.酸8.具有颜⾊的⽣物碱是A⼩檗碱 D.莨菪碱 C.乌头碱D苦参碱 E.⿇黄碱9.⽆旋光性的⽣物碱为A伪⿇黄碱 B.⼩檗碱 C.烟碱D乌头碱 E.长春新碱10. 表⽰⽣物碱碱性的⽅法常⽤A. pkbB. KbE. Ka C. pHD.pka11.⽣物碱碱性最强的是A.伯胺⽣物碱B. 叔胺⽣物碱C. 仲胺⽣物碱D.季铵⽣物碱E. 酰胺⽣物碱12. ⽔溶性⽣物碱主要指A.伯胺⽣物碱B. 仲胺⽣物碱C. 叔胺⽣物碱D.两性⽣物碱E. 季铵⽣物碱13.溶解脂溶性⽣物碱的最好溶剂是A.⼄醚B. 甲醇C. ⼄醇D.氯仿E. ⽔14. ⽣物碱沉淀反应呈桔红⾊的是A.碘化汞钾试剂B. 碘化铋钾试剂C. 饱和苦味酸试剂D.硅钨酸试剂C. 中性⽔溶液D.盐⽔溶液E. 醇⽔溶液16. ⽔溶性⽣物碱分离的常⽤⽅法是A.碘化汞钾沉淀法B. 硅钨酸沉淀法C. 雷⽒盐沉淀法D.苦味酸沉淀法E. 碘化铋钾沉淀法17.⽤离⼦交换树脂法分离纯化⽣物碱时,常选⽤的离⼦交换树脂是A.强酸型B. 弱酸型C. 强碱型D.弱碱型E. 中等程度酸型18.从CHCl 3 中分离酚性⽣物碱常⽤的碱液是A.Na2CO3B. NaOHC. NH4OHD.NaHCO 3E. Ca(OH) 219.碱性较强的⽣物碱在植物体内的存在形式多为A.有机酸盐B. 络合状态C. 游离状态D.⽆机酸盐E. 两性状态20. 在⽔溶液中两性⽣物碱形成沉淀的pH 为A. 1B. 10C.2 ?3D. 6 ?7E. 8 ?921. 游离⽣物碱的提取可选⽤pH 11 的⽔ E. pH 1 的⽔⽣物碱酸⽔提取液常⽤的处理⽅法是⼤孔树脂吸附 E. 氧化铝柱⾊谱吸附碱性不同⽣物碱混合物的分离可选⽤A. D.22.A.D. 23. A. D. 24. A. D. 25. A. D.26.A. D.27.A.D. 28. A. D. 29.A. D.30. A. D. 31.A.D.32.A.具有酰胺键E.具有N T O 配位键盐酸⼩檗碱可与下列哪项发⽣加成反应甲醇 B. ⼄醚C. 丙酮⼄醇 E. 氯仿含有酚羟基的⽣物碱是表⼩檗碱 B. 黄连碱C. 巴马丁药根碱 E. 甲基黄连碱⽣物碱的薄层⾊谱和纸⾊谱法常⽤的显⾊剂是碘化汞钾 B. 改良碘化铋钾C. 硅钨酸雷⽒铵盐 E. 碘—碘化钾⽤氧化铝薄层⾊谱法分离⽣物碱时,化合物的 R f 值⼤⼩取决于极性⼤⼩B. 碱性⼤⼩C. 酸性⼤⼩呈离⼦键 B. 碱性强 C. 呈喹诺⾥啶类 pH 8 的⽔ B. pH 9 的⽔ C. pH 10 的⽔阴离⼦交换树脂 B. 阳离⼦交换树脂 C. 硅胶柱⾊谱吸附简单萃取法 B. 酸提取碱沉淀法有机溶剂回流法E. 分馏法分配⾊谱法分离脂溶性⽣物碱选作固定相的是氨⽔ B. Ca(OH) 2⽔甲酰胺E. ⼆⼄胺吸附⾊谱法分离⽣物碱常⽤的吸附剂是聚酰胺 B. 氧化铝活性炭E. 硅藻⼟分离⿇黄碱和伪⿇黄碱的是利⽤硫酸盐溶解度 B. 草酸盐溶解度酒⽯酸盐溶解度 E. 磷酸盐溶解度氧化苦参碱⽔溶性⼤于苦参碱的原因是 C. p H 梯度萃取法C. CaO ⽔C. 硅胶C. 硝酸盐溶解度D. 分⼦⼤⼩E.挥发性⼤⼩33. 在⽔中溶解度最⼤的⼩檗碱盐是A.硫酸盐B.酸性硫酸盐C.磷酸盐D.盐酸盐E.枸橼酸盐34. 利⽤⾼效液相⾊谱法分离⽣物碱时,通常使⽤的流动相为A.弱酸性B.弱碱性A.吲哚类B.吡啶类C.喹啉类D.萜类E.莨菪烷类36. 此⽣物碱结构属于A.吲哚类B.异喹啉类D.甾体类E.⼤环类37.下列三个化合物碱性⼤⼩顺序为C.吡啶类(a)( b)(c)A. a >b>cB.c > b> aD. a >c>bE.b > c> a38.碱性最弱的⽣物碱⽦A.季胺碱B.叔胺碱D.伯胺碱E.酰胺碱39.雷⽒盐沉淀反应的介质是A.冷⽔B.醇⽔C. c > a> bC.仲胺碱C.酸⽔N _CHHc )- oD. 沸⽔E. 碱⽔40. 碘化汞钾反应⽣成沉淀的颜⾊为A. 棕⾊B. 蓝⾊D. 橘红⾊E. ⿊⾊41. 不属于⽣物碱沉淀试剂的是A. 苦味酸B. 碘化铋钾D. 碘化汞钾E. 变⾊酸42. 提取⽣物碱盐不选⽤的溶剂是A. 酸⽔B. 甲醇D. ⽔E. 氯仿43. 分离季铵碱的⽣物碱沉淀试剂为C. ⽩⾊C. 硅钨酸C. ⼄醇44. 能与盐酸⽣成难溶于⽔的⽣物碱盐的是C. 硅钨酸A. 伪⿇黄碱B. ⼩檗胺D. ⼩檗碱E. 粉防⼰碱45. 属于两性⽣物碱的为A. 巴马丁B. 黄连碱D. 可待因E. 延胡索⼄素46. 难溶于⽔的⽣物碱是C. ⿇黄碱C. 吗啡碱A. ⿇黄碱B. 氧化苦参碱D. 伪⿇黄碱E. 黄连碱47. 毒性较强的⽣物碱是C. ⼩檗碱A. 次乌头碱B. 黄连碱D. 乌头原碱E. 表⼩檗碱48. ⿇黄碱可与下列哪种试剂发⽣颜⾊反应C. 药根碱A. ⼆硫化碳碱性硫酸铜B. 碘化铋钾D. 碘化汞钾E. 苦味酸49. 不是季铵碱的化合物为C. 硅钨酸A. ⼩檗碱B. 巴马汀D. 药根碱E. 粉防⼰碱50. 检识⼩檗碱常⽤的显⾊反应是C. 黄连碱A. 氯化汞沉淀反应D. V itali 反应B. 铜络盐反应E. 漂⽩粉反应C. 苦味酸反应51. 区别莨菪碱与东莨菪碱的反应是 A. Vitali 反应 B. 氯化汞沉淀反应 C. 碘化铋钾反应D. 苦味酸沉淀反应E. 铜络盐反应52. 溶剂法分离I —⿇黄碱和d —伪⿇黄碱的依据是58. 从三棵针中提取和分离盐酸⼩檗碱和⼩檗胺,是利⽤⼆者下列哪项的⽔溶性差别A. 硫酸盐B. 酸性硫酸盐C. 磷酸盐D. 盐酸盐E. 枸橼酸盐B 型题 [59-133][59-63]A. 有机胺类59. ⼩檗碱属60. ⿇黄碱属61. 苦参碱属62. 阿托品属A. 硫酸盐溶解度的差异B. 草酸盐溶解度的差异 D. 磷酸盐溶解度的差异 E. 游离碱溶解度的差异53. 阿托品属于 A. 内消旋体 B. 右旋体 D. 外消旋体E. 都不是54. 存在于黄连中的⼩檗碱属于 A. 季铵碱 B. 酚性季铵碱 D. 叔胺碱E. 酚性叔胺碱55. 下列⽣物碱碱性最强的是 A. 季胺碱 B. 叔胺碱 D. 伯胺碱E. 酰胺碱56. 具有隐性酚羟基的⽣物碱是 A. ⼩檗胺 B. 粉防⼰碱 D. 烟碱E. 槟榔碱57. ⿇黄碱的碱性⼩于伪⿇黄碱是因为 A. 诱导效应 B. 共轭效应D. ⽴体效应E. 共轭酸的氢键效应C. 醋酸盐溶解度的差异 C. 左旋体C. 芳胺碱C. 仲胺碱C. 防⼰诺林碱C. 空间效应63. 乌头碱属69. 利⽤极性差异进⾏分离的是 70. 利⽤草酸盐溶解度差异⽽分离是 71. 利⽤碱性差异进⾏分离的是 72. 利⽤酚羟基进⾏分离的是 73. 利⽤盐酸盐差异进⾏分离的是 [74-78] A. 杂化⽅式 B. 诱导效应 D. 空间效应E. 分⼦内氢键74. 东莨菪碱碱性⽐莨菪碱弱是因为 75. 秋⽔仙碱碱性弱的原因是由于 76. ⿇黄碱碱性强于去甲⿇黄碱是由于 77. ⼩檗碱碱性强的原因是由于 78. 伪⿇黄碱碱性强于⿇黄碱是由于 [79-83] A. ⿇黄碱 B. ⼩檗碱 D. 莨菪碱E. 乌头碱79. 碱⽔解后可减低毒性的是 80. 不与⽣物碱沉淀试剂反应的是 81. 与碱液接触易发⽣消旋化的是82. 与氯化汞试剂加热反应⽣成红⾊复合物的是 83. 在碱液中可转变为醇式或醛式的是A. ⿇黄碱B. 吗啡碱 D. 氧化苦参碱E. 槟榔碱64. 有挥发性的是65. 呈酸碱两性的是66. 有N T O 配位键的是67. 呈液态的是68. 有升华性的是:[69-73]A. ⼩檗碱和⼩檗胺B. ⿇黄碱和伪⿇黄碱D. 莨菪碱和东莨菪碱E. 吗啡和可待因 [64-68] C. 咖啡因C. 苦参碱和氧化苦参碱C. 共轭效应C. 苦参碱。
第十章生物碱药物分析习题一填空题1 生物碱的结构碱性最强,酰胺结构的碱性很弱。
2 双缩脲反应可以鉴定生物碱药物。
3 非水碱量法测定盐酸吗啡,加入醋酸汞冰醋酸试液后,生成,从而消除测定干扰。
季铵氨基醇结构( 盐酸麻黄碱 )卤化汞二选择题1 生物碱沉淀剂有( )A 氢氧化钠B 碘化铋钾C 发烟硝酸D 铜2 以下生物碱中,碱性最弱的是:( )A 咖啡因B 盐酸吗啡C 硫酸阿托品D磷酸可待因3酸性染料法测定生物碱,加入( )控制水相PH值。
A 邻苯二甲酸氢钾B溴甲酚绿C 三氯甲烷 D 甲苯4 硫酸阿托品中,特殊杂质是( )A 吗啡B莨菪碱 C 甲烷 D 可待因5 利血平药物有( )结构,可以与香草醛反应。
A 酚羟基B 吲哚C氨基醇 D 托烷6 中国药典(2015)对( )的鉴别比较二个波长测出的吸光度比值为1.7-1.9.A 秋水仙碱B 茶碱C 吗啡D 阿托品7吗啡分子含有酚羟基,可以与( )试剂反应,最后与三氯化铁生成普鲁士蓝。
A 氯仿B硫酸铜 C 香草醛D稀铁氰化钾8 非水滴定法测生物碱,用到的滴定剂是( )A高氯酸 B 碘化铋钾C 发烟硝酸D 硫酸铜三简答题1 如何检查盐酸吗啡中的阿扑吗啡?答:吗啡在酸性溶液中加热,可以经脱水、分子重排生成具还原性的阿扑吗啡,其水溶液在碳酸氢钠碱性条件下经碘试液氧化生成水溶性绿色化合物,此产物能溶于乙醚,乙醚层显深宝石红色,水层仍显绿色。
2维他立(Vitaili)反应如何发生?可以鉴别什么药物?答:供试品与发烟硝酸共热,生成黄色三硝基(或二硝基)衍生物,冷却至室温后,遇醇制氢氧化钾即生成深紫色的醌型化合物。
如氢溴酸山莨菪碱的鉴别:取本品约10mg,加发烟硝酸5滴,置水浴上蒸干,得黄色残渣,放冷,加乙醇2~3滴湿润,加固体氢氧化钾一小粒,即显深紫色。
该反应为阿托品、东莨菪碱、山莨菪碱等含莨菪酸的托烷类生物碱的特征反应。
3 简述酸性染料比色法的原理和影响因素。
答:(1)原理:在适当PH的水溶液中,碱性药物(B)可与氢离子结合成阳离子(BH+),而一些酸性染料可解离成阴离子(In-)。

生物碱类药物的分析(总分100, 做题时间90分钟)一、最佳选择题1.非水溶液滴定法测定硫酸奎宁原料药的含量,1摩尔硫酸奎宁可消耗高氯酸的摩尔数为•**•**•**•****SSS_SIMPLE_SINA B C D E该题您未回答:х该问题分值: 2答案:C[解析] 本题考查重点是对生物碱盐用高氯酸滴定液滴定时两者反应分子关系的掌握。
2.硫酸阿托品中莨菪碱的检查是利用了两者• A.旋光性质的差异• B.溶解度差异• C.酸碱性的差异• D.紫外吸收光谱差异• E.吸附性差异SSS_SIMPLE_SINA B C D E该题您未回答:х该问题分值: 2答案:A[解析] 本题考查重点是药物为外消旋体时,即使有不对称碳原子,也无旋光性。
阿托品为莨菪碱的外消旋体,故无旋光性。
利用阿托品中引入的莨菪碱具有旋光性的特点,采用旋光度法检查。
3.具有苯烃胺结构的药物• A.麻黄碱• B.奎宁• C.阿托品• D.可待因• E.吗啡A B C D E该题您未回答:х该问题分值: 2答案:A[解析] 本题考查重点是对生物碱药物结构特点的掌握。
麻黄碱具有苯烃胺结构;阿托品属于托烷类生物碱;吗啡和可待因属于异喹啉类生物碱;奎宁为喹啉的衍生物。
4.硫酸奎宁中其他金鸡纳碱检查采用的方法是•**•**•**•****SSS_SIMPLE_SINA B C D E该题您未回答:х该问题分值: 2答案:D5.能发生绿奎宁反应的药物是• A.盐酸吗啡• B.硫酸李宁• C.盐酸麻黄碱• D.磷酸可待因• E.硫酸阿托品SSS_SIMPLE_SINA B C D E该题您未回答:х该问题分值: 2答案:B[解析] 本题考查重点是对硫酸奎宁的专属鉴别反应的掌握。
硫酸奎宁在微酸性水溶液中与溴试液作用生成醌式结构,再与氨试液作用生成翠绿色化合物。
该反应为硫酸奎宁的专属鉴别反应。
6.盐酸吗啡中检查的特殊杂质有• A.阿扑吗啡和罂粟酸• B.阿扑吗啡• C.阿扑吗啡、莨菪碱和其他生物碱• D.阿扑吗啡、罂粟酸和有关物质• E.阿扑吗啡和其他生物碱A B C D E该题您未回答:х该问题分值: 2答案:D[解析] 本题考查重点是对盐酸吗啡特殊杂质检查项目的掌握。
天然药物化学第八节生物碱一、A11、下列化合物具有解痉镇痛和散瞳作用的是A、巴豆苷B、柯桠素C、喜树碱D、肉桂鞣质AE、莨菪碱2、下列有关生物碱叙述正确的是A、都呈较强的碱性B、含有氮原子C、自然界的所有含氮成分D、无色E、在植物体内以盐的形式存在3、具有抗菌作用的生物碱是A、小檗碱B、吗啡碱C、阿托品D、可待因E、利血平4、具有镇痛作用的生物碱是A、奎宁B、莨菪碱C、吗啡碱D、东莨菪碱E、烟碱5、下列化合物中碱性最强的生物碱是A、季铵碱B、脂胺类生物碱C、芳胺类生物碱D、酰胺类生物碱E、五元芳氮杂环类生物碱6、关于生物碱的理化性质,叙述不正确的是A、大多数生物碱为结晶B、生物碱多有苦味或辛辣感C、生物碱分子中含有氮原子,氮原子上有一孤对电子,能接受质子,因而表现出碱性D、pK a值越大,表示生物碱的碱性越弱E、胍类生物碱为强碱7、碱性最强的生物碱是A、秋水仙碱B、麻黄碱C、番木鳖碱(的士宁)D、新番木鳖碱E、小檗碱8、生物碱沉淀反应要求的条件是A、在酸性水溶液中进行B、在强碱性水溶液中进行C、在亲水性有机溶剂中进行D、在亲脂性有机溶剂中进行E、在弱碱性水溶液中进行9、下列类别的化合物碱性最强的是A、季铵碱B、芳胺C、酰胺D、五元芳氮杂环E、六元芳氮杂环10、哪一个生物碱是弱酸性化合物A、茶碱B、山莨菪碱C、罂粟碱D、毛果芸香碱E、麻黄碱11、具有升华性的生物碱是A、咖啡因B、小檗碱C、美登木碱D、秋水仙碱E、乌头碱12、下列化合物中,按碱性强弱排列正确的是A、季铵碱>脂肪杂环碱>酰胺>芳香胺B、脂肪杂环碱>季铵碱>酰胺>芳香胺C、脂肪杂环碱>季铵碱>芳香胺>酰胺D、季铵碱>脂肪胺>芳香胺>酰胺E、芳香胺>季铵碱>脂肪胺>酰胺13、可溶于水的生物碱是A、紫草素B、小檗碱C、莪术油D、查耳酮E、莨菪碱14、水溶性最强的生物碱是A、氧化苦参碱B、苦参碱C、去氢苦参碱D、安那吉碱E、巴普叶碱15、氧化苦参碱溶于水是因为A、含有酚羟基B、具有N-O配位键C、含有亲水性官能团的小分子D、含有酰胺结构E、季铵结构16、下列生物碱类别中,按碱性强弱排列正确的是A、季铵碱>脂氮杂环碱>酰胺>芳香胺B、脂氮杂环碱>季铵碱>酰胺>芳香胺C、脂氮杂环碱>季铵碱>芳香胺>酰胺D、季铵碱>脂肪胺>芳香胺>酰胺E、芳香胺>季铵碱>脂肪胺>酰胺17、下列方法中能用来分离麻黄碱与伪麻黄碱的是A、NaHCO3B、Na2CO3C、醋酸D、草酸E、氯仿18、将混合生物碱溶于氯仿中,用pH由高到低的酸性缓冲溶液顺次萃取,生物碱则可按下列顺序依次萃取出来A、碱度由弱到强B、碱度由强到弱C、极性由小到大D、极性由大到小E、酸度由弱到强答案部分一、A11、【正确答案】 E【答案解析】莨菪碱具有解痉镇痛、散瞳、解磷中毒作用。
第四章生物碱类化合物一、填空题1.将生物碱总碱溶于酸中,加入碱水调理 pH 值,由 ( 低) 到( 高) ,则生物碱按碱性由 ( 弱) 到( 强) 挨次被有机溶剂萃拿出来;若将生物碱总碱溶于有机溶剂中,用pH值由 ( 高 ) 到( 低) 的缓冲液挨次萃取,生物碱按碱性由( 强) 到( 弱) 被萃拿出来2.小檗碱呈黄色,而四氢小檗碱则无色,其原由在于 ( 构造中有较长的共轭系统) 。
3.在生物碱的色谱检识中常用的显色剂是 ( 碘化铋钾 ) ,它与生物碱斑点作用常显(橘红色)。
4.Mayer 试剂的主要成分为 ( 碘化汞钾 ) ;Drugendroff试剂的主要成分为(碘化铋钾)。
5.黄连中的主要化学成分是(小檗碱)。
6、常用的生物碱积淀试剂有(碘化汞钾)试剂、(碘化铋钾)试剂等。
7、红豆杉中的主要生物碱为(紫杉醇)。
8、阿托品为(莨菪碱)的消旋体。
二、选择题1.以下生物碱中 pK a最大的是( D )A氨B甲胺C二甲胺D三甲胺2.雷氏铵盐可用于积淀分别( D )A. 伯胺碱B.仲胺碱C.叔胺碱D.季铵碱3.小檗碱的构造种类是( B )A.喹啉类 B .异喹啉类 C .哌啶类 D .有机胺类4.表示生物碱碱性的方法是( D )A .pK b,B.K C .pH D . pK a,5.pK a的含义是(D)A .生物碱的溶解度 BC .生物碱共轭酸的溶解度6.以下生物碱碱性最强的是(.生物碱的离解度D .生物碱共轭酸的离解度D)A.伯胺生物碱B.叔胺生物碱C.仲胺生物碱D.季铵生物碱7.碱性最弱的生物碱是( D )A .季铵生物碱B.叔胺生物碱C.仲胺生物碱 D .酰胺生物碱8.以下生物碱碱性大小排序正确的选项是(D )a .酰胺生物碱b .季铵生物碱c .伯、仲、叔胺类生物碱A . a>b>cB .c>b>aC .c>a>bD . b>c>a9.碱性不一样的生物碱混淆物的分别可采用 ( C )A .简单萃取法B .酸提取碱积淀法C .pH 梯度萃取法D .有机溶剂回流法10.在生物碱酸水提取液中,加碱调pH 由低到高,每调一次用氯仿萃取一次,第一获得(B)A .强碱性生物碱B .弱碱性生物碱C .季铵碱 D. 中等碱性生物碱11.将生物碱总碱溶于氯仿中,用不一样 pH(由高到低 ) 缓冲液挨次萃取,最后萃拿出的生物碱是 ( B )A .强碱性生物碱B .弱碱性生物碱C .季铵碱D .中等碱性生物碱12.用氧化铝薄层色谱法分别生物碱时,化合物的R f 值大小取决于 ( A )A .极性大小B .碱性大小C .酸性大小D .分子大小13、拥有莨菪烷母核的生物碱是(C )A. 甲基麻黄碱B. 小檗碱C.阿托品D. 氧化苦参碱14、生物碱积淀反响呈红棕色的是(A. 碘化汞钾试剂B. 碘化铋钾试剂B)C.饱和苦味酸试剂D.硅钨酸试剂15、碱性最弱的生物碱是( D )A. 季胺碱B. 叔胺碱C. 仲胺碱D. 酰胺碱16、拥有挥发性的生物碱是( D )A. 吗啡碱B. 小檗碱C. 苦参碱D. 麻黄碱17、今生物碱构造属于( B)O CH 2OHN CH 3OC CHA. 吲哚类B.莨菪烷类C.喹啉类D.萜类 18、生物碱分子中氮原子杂化方式与其碱性强弱的关系是( C )23B. SP323232A. SP >SP >SP>SP >SP C. SP>SP >SPD. SP >SP >SP19、罂粟碱、可待因和吗啡进行硅胶 G 薄层色谱,睁开剂为氯仿 - 乙醚 - 二甲胺(5 ﹕ ﹕ ),所得值 R f 分别为 0.67 , , ;可判断它们的极性大小次序为 ( A )4 1 0.38 0.10A. 吗啡>可待因>罂粟碱B. 罂粟碱>可待因>吗啡C. 可待因>罂粟碱>吗啡D.罂粟碱>吗>可待因20、三棵针中的主要化学成分是(B)A. 麻黄碱B.小檗碱C.苦参碱D.东莨菪碱21、配伍题: A. 有机胺类生物碱 B.异喹啉类生物碱 C.二萜类生物碱D. 喹喏里西啶类生物碱E.莨菪烷类生物碱小檗碱属( B )、麻黄碱属( A )、苦参碱属( D )、阿托品属(E)乌头碱属( C )22 、配伍题: A.莨菪碱 B.槟榔碱 C. 小檗碱 D. 长春碱 E.麻黄碱属于有机胺类生物碱的是( E )属于莨菪烷类生物碱的是(A)属于吡啶类生物碱的是(B)属于异喹啉类生物碱的是(C)属于吲哚类生物碱的是(D)23、生物碱的碱性强弱可与以下 ( C )状况相关。
第三章生物碱类一﹑选择题(一)A型题(每题有5个备选答案,备选答案中只有1个最佳答案)1.生物碱碱性的表示方法多用(D )A.Kb B.pKb C.Ka D.pKa E. pH2.下列生物碱中碱性最强的为(C )A.去甲麻黄碱B.麻黄碱C.伪麻黄碱D.胡椒碱E.东莨菪碱3.可溶于水的生物碱是(C )A.麻黄碱B.莨菪碱C.小檗碱D.胡椒碱E.延胡索乙素4.生物碱沉淀反应的条件是(A )A.酸性水溶液B.碱性水溶液C.中性水溶液D.盐水溶液E.醇溶液5. 不能与生物碱沉淀试剂产生沉淀的是(B )A.生物碱B.多糖C.多肽D.蛋白质E.鞣质6.分离碱性不同的混合生物碱可用(C. )A.简单萃取法B.酸提取碱沉淀法C. pH梯度萃取法D.有机溶剂回流法E.分馏法7.以硅胶为吸附剂进行薄层色谱分离生物碱时,常用的处理方法是(E )A.以碱水为展开剂B.以酸水为展开剂C.展开剂中加人少量氨水D.展开剂中加人少量酸水E.以CHCI3为展开剂8.从苦参总碱中分离苦参碱和氧化苦参碱是利用二者(A )A.在水中溶解度不同B.在乙醇中溶解度不同C.在氯仿中溶解度不同D.在苯中溶解度不同E.在乙醚中溶解度不同(二)B型题(备选答案在前,试题在后。
每组若干题均对应同一组5个备选答案,每题只有1个正确答案。
每个备选答案可重复选用,也可不选用)A.莨菪碱B.槟榔碱C.小壁碱D.吴茱萸碱E.麻黄碱1.属于有机胺类生物碱的是(E )2.属于莨菪烷类生物碱的是(A )3.属于吡啶类生物碱的是(B )4.属于异喹啉类生物碱的是(C )5.属于吲哚类生物碱的是(D )A.小檗碱B.麻黄碱C.伪麻黄碱D.东莨菪碱E.山莨菪碱6. 其共轭酸的分子内氢键稳定的是(C )7. 其草酸盐不溶于水的是(B )8. 其分子结构中具有氧环的是(D )9. 其盐酸盐在冷水中溶解度小的是(A )10.其盐酸盐加入氢氧化钠后,滴加丙酮,生成黄色结晶的是(A )A.吗啡B.小檗碱C.莨菪碱D.麻黄碱E.苦参碱11.可用雷氏铵盐沉淀法分离的是(B )12.在酸性或碱性溶液中加热易于消旋化的是(C )13.可用酚羟基性质进行分离的是(A )14.具有内酰胺结构,在加热条件下皂化开环生成溶于水的羧酸盐而进行分离的是(E )15.可用水蒸气蒸馏法提取的是( D )(三)C型题(备选答案在前,试题在后。
生物碱类药物分析练习试卷1(题后含答案及解析) 题型有:1. A1型题 2. B1型题 3. X型题1.非水碱量法不适用的生物碱类药物为A.盐酸麻黄碱B.盐酸吗啡C.咖啡因D.硫酸奎宁E.硫酸阿托品正确答案:C 涉及知识点:生物碱类药物分析2.具有Vitali反应的药物是A.毒扁豆碱B.阿托品C.氯化琥珀碱D.哌仑西平E.溴丙安太林正确答案:B 涉及知识点:生物碱类药物分析3.常用的生物碱薄层色谱显色剂是A.硅钨酸B.磷钨酸C.改良碘化铋钾D.氢氧化铵E.雷氏铵盐正确答案:C 涉及知识点:生物碱类药物分析4.生物碱类(PKb多为6~9)提取分离测定时,须加碱化试剂,应考虑含酯结构,含酚结构等的影响,最适宜的碱化试剂是A.小苏打B.碳酸钠C.氢氧化钠D.氨溶液E.氧化钙正确答案:D 涉及知识点:生物碱类药物分析5.有机含氮药物中碱性最强的胺类是A.伯胺B.脂肪仲胺C.季胺D.芳胺E.叔胺正确答案:C 涉及知识点:生物碱类药物分析6.非水碱量法测定生物碱含量的限制条件是A.Pkb<8~10B.pKb<10~12C.pKb<12D.pkb<13E.pKb<10~14正确答案:A 涉及知识点:生物碱类药物分析7.生物碱的鉴别反应中麻黄碱等芳香环侧链氨基醇的特征反应,是A.发烟硝酸反应,显黄色B.药物酸性水溶液加稍过量溴呈绿色C.甲醛-硫酸试液显紫堇色D.铜硫酸试液显紫色-蓝色-棕绿色E.双缩脲反应呈蓝色正确答案:E 涉及知识点:生物碱类药物分析8.阿托品,山莨菪碱等托烷类生物碱,特征反应A.发烟硝酸反应,呈黄色B.药物酸性水溶液加稍过量溴呈绿色C.甲醛硫酸试液显紫堇色D.钼硫酸试液显紫色-蓝色-棕紫色E.双缩脲反应正确答案:A 涉及知识点:生物碱类药物分析9.奎宁,奎尼丁等含氮喹啉类生物碱的特征反应A.发烟硝酸反应,显黄色B.药物酸性水溶液加稍过量溴水呈绿色的特征反应C.甲醛硫酸试液显紫堇色D.钼硫酸试液显紫色-蓝色-棕紫色E.双缩脲反应正确答案:B 涉及知识点:生物碱类药物分析10.吗啡生物碱的特征反应A.发烟硝酸反应,显黄色B.C+DC.甲醛硫酸试液显紫堇色D.钼硫酸试液显紫色-蓝色-棕紫色E.双缩脲反应正确答案:B 涉及知识点:生物碱类药物分析11.吲哚类生物碱的特征反应A.发烟硝酸反应,显黄色B.药物酸性水溶液加稍过量溴水呈绿色的特征反应C.与香草醛等缩合反应显色D.钼硫酸试液显紫色-蓝色-棕紫色E.双缩脲反应正确答案:C 涉及知识点:生物碱类药物分析12.咖啡因,茶碱等黄嘌呤生物碱的特征反应A.双缩脲反应B.紫缩酸反应C.与香草醛等缩合反应D.钼硫酸试液显紫色-蓝色-棕紫色E.硝化显色反应正确答案:B 涉及知识点:生物碱类药物分析13.生物碱中具有两性的是A.奎宁B.小檗碱C.阿托品D.麻黄碱E.吗啡正确答案:E 涉及知识点:生物碱类药物分析14.生物碱的含量测定,容量法可采用A.直接法,碱法B.提取中和法C.非水碱量法D.A+CE.A+B+C正确答案:E 涉及知识点:生物碱类药物分析15.生物碱提取中和法中最常采用的碱化试剂是A.氢氧化钠B.氢氧化钾C.氨溶液D.三乙胺E.碳酸钠正确答案:C 涉及知识点:生物碱类药物分析16.生物碱中提取中和法最常采用的溶剂是A.乙醇B.甲醇C.丙酮D.乙醚E.氯仿和乙醚正确答案:E 涉及知识点:生物碱类药物分析17.酸性染料比色法中,水相的pH值过小,则A.能影响离子对B.有机溶剂提取能完全C.酸性染料以阴离子状态存在D.生物碱几乎全部以分子状态存在E.酸性染料以分子状态存在正确答案:E 涉及知识点:生物碱类药物分析18.非水碱量法测定药物含量时,一般以消耗0.1mol/L高氯酸溶液为A.5mlB.8mlC.15mlD.30mlE.20ml正确答案:B 涉及知识点:生物碱类药物分析19.非水溶液滴定法测定盐酸吗啡含量时,为排除盐酸对滴定的影响需加入A.硝酸银B.三氯醋酸C.醋酸钠D.醋酸汞E.氰化钾正确答案:D 涉及知识点:生物碱类药物分析20.用0.1mol/L高氯酸溶液直接滴定硫酸奎宁时,硫酸奎宁与高氯酸的摩尔比为A.1:1B.1:2C.1:3D.1:4E.1:5正确答案:C 涉及知识点:生物碱类药物分析生物碱类药物的特征反应A.Vitali反应B.绿奎宁(Thalleiaquin)反应C.Marquis反应D.紫脲酸铵反应E.香草醛反应21.利血平正确答案:E 涉及知识点:生物碱类药物分析22.硫酸奎宁正确答案:B 涉及知识点:生物碱类药物分析23.硫酸阿托品正确答案:A 涉及知识点:生物碱类药物分析24.盐酸吗啡正确答案:C 涉及知识点:生物碱类药物分析25.咖啡因正确答案:D 涉及知识点:生物碱类药物分析非水碱量法测定生物碱盐时,酸根干扰的排除法A.加入醋酸汞试液B.直接滴定C.电位法指示终点D.加入甲醛或丙酮E.加入草酸或酒石酸盐酸盐的测定26.盐酸盐的测定正确答案:A 涉及知识点:生物碱类药物分析27.硫酸盐的测定正确答案:B 涉及知识点:生物碱类药物分析28.石肖酸盐的测定正确答案:C 涉及知识点:生物碱类药物分析29.磷酸盐的测定正确答案:B 涉及知识点:生物碱类药物分析30.氢溴酸盐的测定正确答案:A 涉及知识点:生物碱类药物分析31.维生素E的鉴别可以采用以下方法A.氯化铁-联吡啶反应B.硝酸反应C.紫外光谱法D.薄层色谱法E.与浓硫酸反应正确答案:A,B,C,D 涉及知识点:维生素类药物分析32.采用非水溶液滴定法测定维生素B1的含量,其溶剂、指示剂、试液、滴定液分别为A.冰醋酸B.高氯酸滴定液(0.1mol/L)C.醋酸汞试液D.新沸放冷的水E.喹哪定红-亚甲蓝混合指示剂正确答案:A,B,C,E 涉及知识点:维生素类药物分析33.计算滴定度需已知下列参数A.被测样品的分子量B.被测样品与滴定剂的摩尔比C.反应时间D.称样量E.滴定液的摩尔浓度正确答案:A,B,E 涉及知识点:维生素类药物分析34.硅钨酸重量法测定维生素B1的含量,需注意的试验条件有A.取样量约为50mg,不得少于25mgB.取样量约为50mg,不得多于100mgC.在酸性溶液中进行沉淀D.硅钨酸用量与维生素B1量的比为8:1E.硅钨酸用量与维生素B1量的比为1:8正确答案:A,C,D 涉及知识点:维生素类药物分析35.维生素C的含量测定采用碘量法,其溶剂、指示剂、试液、滴定液分别为A.稀醋酸B.碘滴定液(0.1mol/L)C.醋酸汞试液D.新沸放冷的水E.淀粉指示剂正确答案:A,B,D,E 涉及知识点:维生素类药物分析36.维生素C具有较强的还原性,除了可以使2,6-二氯靛酚褪色外,还可以使下列试液褪色A.亚甲蓝B.高锰酸钾C.醋酸汞D.碱性酒石酸酮E.淀粉正确答案:A,B,D 涉及知识点:维生素类药物分析37.生物碱类药物制剂的测定方法有2</sub>SO<sub>4</sub>标准液滴定”value1=“A”>A.直接用有机溶剂提取后,用H2SO4标准液滴定B.碱化后用有机溶剂提取,再用NaOH标准液滴定2</sub>SO<sub>4</sub>标准液滴定” value1=“C”>C.碱化后用有机溶剂提取,蒸去有机,溶剂后用中性乙醇溶解,再用H2SO4标准液滴定2</sub>S0<sub>4</sub>,再用NaOH标准液回滴”value1=“D”>D.碱化后用有机溶剂提取,蒸去有机溶剂,再加入定量的H2S04,再用NaOH标准液回滴E.酸化后,用有机溶剂提取,采用适宜方法滴定正确答案:C,D 涉及知识点:生物碱类药物分析38.用非水溶液滴定法测定盐酸吗啡含量时,应使用的试剂有A.高氯酸B.5%.醋酸汞冰醋酸液C.冰醋酸D.二甲基甲酰胺E.中性乙醇正确答案:A,B,C 涉及知识点:生物碱类药物分析39.非水溶液滴定法测定硫酸奎宁含量的反应条件为A.冰醋酸-醋酐为溶剂B.高氯酸滴定液(0.1mol/L)滴定C.1mol的硫酸奎宁与3mol的高氯酸反应D.电位法指示终点E.溴酚蓝为指示剂正确答案:A,B,C,D 涉及知识点:生物碱类药物分析40.不加HgAc2,以结晶紫作指示剂,用HClO4直接滴定的药物为A.硫酸奎尼丁B.硝酸士的宁C.盐酸吗啡D.磷酸可待因E.氢溴酸山莨菪碱正确答案:A,D 涉及知识点:生物碱类药物分析41.生物碱类药物制剂的测定方法A.直接用有机溶剂提取后,用硫酸标准液滴定B.碱化后用有机溶剂提取,再用氢氧化钠水溶液滴定C.碱化后用有机溶剂提取,蒸去有机溶剂后用中性醇溶液,再用硫酸标准液滴定D.碱化后用有机溶剂提取,蒸去有机溶剂,再加入定量的硫酸,再用氢氧化钠标准液回滴E.酸化后,用有机溶剂提取,采用适宜方法滴定正确答案:C,D 涉及知识点:生物碱类药物分析42.非水滴定法测定硫酸奎宁含量的反应条件为A.冰醋酸-醋酸为溶剂B.高氯酸滴定液(0.1mol/L)滴定C.1mol的高氯酸与1/3mol的硫酸奎宁反应D.仅用电位法指示终点E.溴酚蓝为指示剂正确答案:A,B,C 涉及知识点:生物碱类药物分析43.与生物碱类发生沉淀反应的试剂是A.碘-碘化钾试液B.碘化汞钾试液C.鞣酸试液D.碘化铋钾试液E.硫酸甲醛试液正确答案:A,B,C,D 涉及知识点:生物碱类药物分析44.生物碱常用的含量测定方法有A.碱量法B.非水碱量法C.离子对比色法D.紫外分光光度法E.色谱法正确答案:A,B,C,D 涉及知识点:生物碱类药物分析45.生物碱显色反应丰富。
生物碱类药物的分析(一)一、A型题题干在前,选项在后。
有A、B、C、D、E五个备选答案其中只有一个为最佳答案。
1. 取盐酸麻黄碱约10mg,加水1ml溶解后,加硫酸铜试液2滴与20%NaOH溶液lml,即显蓝紫色,加乙醚1ml振摇后,放置,乙醚层即显紫红色,水层变成蓝色,此盐酸麻黄碱的鉴别试验,其利用的反应是A.双缩脲反应B.紫脲酸铵反应C.Vitali反应D.Thalleiaquin反应E.Marquis反应答案:A2. 取某药物约10mg,加水1ml溶解后,加硫酸铜试液2滴与20%NaOH溶液1ml,即显蓝紫色,加乙醚1ml,振摇后,放置,乙醚层即显紫红色,水层变成蓝色。
该药物是A.盐酸麻黄碱B.硫酸奎宁C.硫酸阿托品D.盐酸吗啡E.硝酸士的宁答案:A3. 第12题项下的试验称为A.Marquis反应B.Vitali反应D.Frohde反应E.Thalleioquin反应答案:D4. 取某生物碱类药物约10mg,加发烟硝酸5滴置水浴上蒸干,得黄色残渣放冷,加乙醇2-3滴湿润,加固体氢氧化钾一小粒,即显深紫色。
此鉴别硫酸阿托品的反应称为A.Marquis反应B.Thalleiaquln反应C.Frohde反应D.Kober反应E.Vitali反应答案:E5. 取某生物碱药物10mg,加盐酸lml与氯酸钾0.1g,置水浴上蒸干,残渣遇氨气即显紫色;再加氢氧化钠试液数滴,紫色即消失。
该药物应为A.茶碱B.利血平C.地西泮D.异烟肼E.磷酸可待因答案:A6. 提取酸碱滴定法测定生物碱药物时,滴定反应的化学计量点和滴定突跃范围区应在A.碱性区B.酸性区C.中性D.酸碱性区答案:B7. 中国药典(2000年版)规定检查盐酸吗啡中“其他生物碱”的方法为A.TLCB.HPLCC.GCD.PCE.IR答案:A8. 提取酸碱滴定法测定生物碱盐类药物时,最常用的碱化试剂为A.氢氧化钙B.碳酸钠C.氧化镁D.氨水E.氢氧化钠答案:D9. 非水滴定法测定磷酸可待因含量时,1ml高氯酸滴定液(0.1mol/L)相当于该药物的量为(磷酸可待因的分子量为397.39)A.198.69mgB.19.87mgC.397.39mgD.39.739mgE.39.74mg答案:E10. 非水滴定法测定生物碱氢卤酸盐含量时,若加入醋酸汞的量不足,则会使测定结果A.不准B.不精密C.偏高D.偏低E.准确度下降答案:D11. 属于磷酸可待因中的特殊杂质为A.游离磷酸B.阿扑吗啡C.吗啡D.罂粟碱E.蒂巴因答案:C12. 提取酸碱滴定法测定磷酸可待因片剂含量时,应选用的指示剂为A.酚酞指示剂B.淀粉指示液C.铬酸钾指示液D.溴百里酚蓝E.甲基红答案:E13. 中国药典(2000年版)测定生物碱的氢卤酸盐时,应预先加入的试液为A.醋酸汞的水溶液B.醋酸汞固体E.醋酸汞的冰醋酸溶液答案:E14. 《中国药典》(2000年版)采用非水滴定法测定硫酸阿托品含量时,1mol的高氯酸相当于硫酸阿托品的摩尔数是A.4molB.3molC.2molD.1molE.1/2mol答案:D15. 《中国药典》(2000年版)规定盐酸麻黄碱含量测定方法是A.银量法B.非水滴定法C.酸性染料比色法D.提取中和法E.紫外分光光度法答案:B16. 检查硫酸阿托品中莨菪碱的方法是A.旋光度测定法B.比旋度法C.比色法D.比浊度法E.TLC17. 生物碱与酸性染料在合适的pH值条件下,分别形成阳离子与阴离子并结合为有色的离子对。
第九章生物碱类一、填空题1、吡咯的碱性(小)于吡啶,是因为吡咯型氮原子P轨道上的(未共用电子对)参与(共轭体系),导致碱性(减弱)。
2、酰胺型生物碱由于(酰胺)键的(P-Л共轭)效应,所以碱性(弱)。
3、生物碱的沉反应一般在(酸水)中进行,常用的沉淀试剂有(碘一碘化钾),(碘化汞钾),(硅钨酸)。
样品中某些杂质如(蛋白质)、(鞣质)、(多糖)等也和沉淀试剂发生沉淀反应。
4、多数生物碱有手性碳或不对称中心而呈(旋光性)性,且多为(左旋)。
一般(左旋)性生理活性显著。
5、分离生物碱单体时,可以利用生物碱的(碱)性或(极)性差异分离,或利用生物碱盐的(溶解度)不同分离,或利用生物碱(特殊功能基)的性质进行分离。
6.生物碱的碱性由来是N原子,其碱性强弱以PKa 表示,PKa 大,碱性越强。
7.从碱水中分离季铵碱除了用正丁醇萃取外,还可以将碱水调到弱酸性,采用(沉淀)法分离。
8.混合生物碱溶于氯仿,依次用不同pH的酸液由高到低依次萃取,所得生物碱的碱度由弱到强。
9.用亲脂性有机溶剂提取生物碱时,如果以氨水润湿药材,再用有机溶剂氯仿提取,可将亲脂性生物碱类提取出来。
如果以稀乙酸溶液润湿药材,再用有机溶剂氯仿提取,可将非生物碱留在原料中。
二、单选题1、生物碱在自然界分布最多的是( C )A、单子叶植物B、裸子植物C、双子叶植物D、菌类2、在植物体内大多数生物碱存形式是(D)A、游离状态B、无机酸盐C、络合物D、有机酸盐3、生物碱沉淀试剂碘化汞钾与生物碱产生沉淀为(C )A、黄色B、棕色沉淀C、类白色沉淀D、橙红色沉淀4.生物碱沉淀反应宜在(A)中进行A、酸性水溶液B、95%乙醇溶液C、氯仿D、碱性水溶液5.生物碱不具有的特点是( C )A. 分子中含N原子B. 具有碱性C. 分子中多有苯环D. 显著而特殊的生物活性E. N原子多在环内6. 生物碱碱性最强的是( D)A. 伯胺生物碱B. 叔胺生物碱C. 仲胺生物碱D. 季铵生物碱E. 酰胺生物碱7. 生物碱酸水提取液处理常用的方法是( B )A. 阴离子交换树脂B. 阳离子交换树脂C.硅胶柱色谱吸附D. 大孔树脂吸附E. 氧化铝柱色谱吸附8.碱性不同生物碱混合物的分离可选用(C )A. 简单萃取法B. 酸提取碱沉淀法C. pH梯度萃取法D. 有机溶剂回流法E. 分馏法9. 生物碱沉淀反应的条件是(A )A. 酸性水溶液B. 碱性水溶液C. 中性水溶液D. 盐水溶液E. 醇水溶液10.溶解游离亲脂性生物碱的最好溶剂为( D )A. 水B. 甲醇C. 正丁醇D. 氯仿E. 苯11. 常用生物碱薄层层析显色剂(C )A.硅钨酸B.碘化铋钾C.改良碘化铋钾D.碘-碘化钾E.雷氏铵盐12.在除去脂溶性生物碱的碱水中,提取水溶性生物碱宜用( D )A.酸化后乙醇提取B.乙醇直接从碱水提取C.丙酮直接从碱水提取D.正丁醇直接从碱水提取13.以pH梯度法分离生物碱,其分离条件确定通过( B )A.多层缓冲纸色谱B.甲酰胺为固定相纸色谱C.聚酰胺薄层色谱D.氧化铝薄层色谱E.硅胶薄层色谱三、分析比较题,并简要说明理由1.比较下列各组化合物碱性的强弱碱性的强→弱程度: A > B > CA B C理由:A 为SP3杂化最强,B 有供电效应,C 参与P-Л共轭碱性减弱 2.下列生物碱碱性强弱顺序: C > B > A >N O OOHCH 3NCH 3CH 3H 3CO HO HO H 3CONO OOA B C 理由:C 为季铵型碱性最强,B 有供电效应,A 参与P-Л共轭碱性减弱3.比较下列生物碱的碱性强弱顺序: B > A > CNH 3COH 3CO H 3COOCH 3N HOHHH 3CONHCOCH 3H 3COH 3COOOCH 3A B C理由:B 为SP3杂化最强, A 为SP2杂化,C 为酰胺 4.比较下列生物碱的碱性强弱顺序: b > aNO OOCH 3OCH 3OH NO OOHCH 3a b理由:b 有供电效应,a 有共轭效应5.比较下列生物碱的碱性强弱顺序: c > d > a > bNCOOCH 3N CH 3ON CH 3COOCH 3NO OOCH 3OCH 3OH H 3CO NHCOCH 3H 3COH 3COO OCH 3cN O OOHCH 3abNO OOd理由: c 有供电效应,d 为SP3杂化,a SP2杂化,b 为酰胺四、设计提取分离流程1.某药材的乙醇提取浓缩物中含有小檗碱、四氢巴马汀、小檗胺三种生物碱及水溶性杂质、脂溶性杂质,设计提取分离各类成分试验流程。
生物碱习题鉴别下列各组生物碱1。
A.莨菪碱B。
东莨菪碱C。
樟柳碱2. A。
麻黄碱 B.伪麻黄碱 C.N-甲基麻黄碱3. A.吗啡 B.可待因(化学法)4. A.吗啡 B.可待因(光谱法)5。
A。
阿托品 B.莨菪碱(物理法)6。
A。
小檗碱 B.山莨菪碱7。
A.苦参碱B。
麻黄碱8。
A。
士的宁B。
马钱子碱比较下列各组化合物Rf值大小,并简要说明理由。
(1)PC:甲酰胺为固定相,甲酰胺饱和乙酸乙脂为展开剂。
(2)TLC在石蜡溶液中浸过的硅胶板,展开剂为石蜡饱和丙酮.(3)缓冲PC:展开剂为氯仿-甲醇(1:1)。
(4)硅胶GTLC:展开剂为氯仿—甲醇—氨水(7:1:0.5),比较①苦参碱(A)与氧化苦参碱(B);②汉防己甲素(A)与汉防己乙素(B);③莨菪碱(A)与东莨菪碱(B)问答题1。
写出下列生物碱或母核的结构式:①东莨菪碱;②小檗碱;③麻黄碱;④苦参碱;⑤汉防己甲素;⑥吲哚里西啶类;⑦喹喏里西啶类;⑧吡咯里西啶类。
2. 大多数生物碱为何有碱性?其碱性强弱和哪些因素有关?3。
比较四氢异喹啉与异喹啉的碱性强弱,说明N的杂化方式对生物碱碱性的影响。
4。
比较麻黄碱、去甲麻黄碱及苯异丙胺三者的碱性强弱,说明诱导效应对生物碱碱性的影响。
5。
为什么空间效应和共轭效应可使生物碱碱性减弱,而分子内氢键作用却使生物碱碱性增强?6. 试从分子结构分析莨菪碱、山莨菪碱、东莨菪碱、去甲莨菪碱和樟柳碱的碱性强弱。
7。
生物碱沉淀反应在中药化学成分研究中有何作用?若用生物碱沉淀试剂检识提取液为阳性反应,能否说明一定含有生物碱?8. 简述提取生物碱用的酸水提取-碱化—亲脂性溶剂萃取的方法。
9. 简述生物碱醇提取—酸化-碱化-亲脂性溶剂萃取的方法.10. 用亲脂性溶剂提取生物碱时,为什么要先用碱水润湿药材?11. 在用氯仿等溶剂从碱水中萃取生物碱时,先加氯仿再碱化好,还是先碱化再加氯仿萃取好?为什么?12. 利用溶剂法从中药中提取水溶性生物碱选用哪些溶剂?为什么?13。
3 生物碱的碱性与哪些有关(1)氮原子的杂化类型:随杂化度升高而增强;②诱导效应:氮原子所连接的基团如为供电基团则碱性增强,如为吸电基团则碱性减弱;③诱导一场效应:使生物碱的碱性降低;④共轭效应:若生物碱分子中氮原子孤对电子成P-兀共轭体系时,通常情况下,其碱性较弱;⑤空间效应:若生物碱的空间环境不利于氮原子接受质子,其碱性减弱;反之,则碱性增强;⑥分子内氢键形成:若生物碱分子结构中氮原子附近存在羟基、羰基等取代基团,碱性增强。
4.生物碱类化合物的鉴别方法①沉淀反应:大多数生物碱能和某些酸类、重金属盐类以及一些较大分子量的复盐反应,生成单盐、复盐或络盐沉淀。
如与碘化铋钾试剂的反应;②显色反应:用于生物碱的冠色试剂很多,它们往往因生物碱的结构不同而显示不同的颜色,Mandelin试剂(1%钒酸铵的浓硫酸溶液);③成盐反应:绝大多数生物碱可与酸形成盐类,但不同类型的生物碱与酸成盐的形式不同,主要有:季铵生物碱的成盐反应、含氮杂缩醛生物碱的成盐反应、具有烯胺结构生物碱的成盐反应、涉及氮原子跨环效应生物碱的成盐反应。
5.生物碱类化合物的提取一般从天然药物巾提取总生物碱通常采用溶剂法、离子交换法、沉淀法等提取分离方法。
①对于脂溶性生物碱可采取酸水提取法、醇类溶剂提取法、亲脂性有机溶剂提取法;②对于水溶性生物碱可采取沉淀法、溶剂萃取法。
6.生物碱类化合物的分离对于生物碱的分离通常分为系统分离与特定分离。
一般的方法是先对总碱进行初步分离,将性质相近的生物碱分成几个类别或部位。
然后再按各成分的碱度、极性或功能团的差异分离生物碱单体。
①总生物碱的初步分离:根据总生物碱中各成分理化性质的差异,可将其初步分离为强碱性的季铵碱、中等强度碱性的叔胺碱及其酚性碱、弱碱性生物碱及其酚性碱等几个部分;②生物碱单体的分离:利用生物碱碱性的差异、利用生物碱极性的差异或生物碱盐的溶解度差异、利用生物碱特殊官能团、利用色谱法进行分离。
7.生物碱类化合物的结构鉴定①色谱法:色谱法在生物碱鉴别中的应用主要体现在天然药物及天然药物制剂中有无生物碱存在的检识、指导生物碱的分离、检查生物碱的纯度及对已知生物碱的鉴定等多个方面,主要有:薄层色谱法、纸色谱法、高效液相色谱法、气相色谱法;②谱学法:目前,在生物碱结构鉴定工作中,最常用的分析方法有紫外光谱(U V)、红外光谱(IR)、质谱(M S)和核磁共振 (N M R)。
【习题】一、名词解释1.生物碱2.两性生物碱3.生物碱沉淀反应4.诱导效应5.共轭效府6.空间效应7.诱导一场效应8.氢键效应二、填空题1.小檗碱呈黄色,而四氢小檗碱则无色,其原因在于。
2.弱碱性生物碱在植物体内是以状态存在。
3.在生物碱的色谱检识中常用的显色剂是,它与生物碱斑点作用常显色。
4.Mayer’s试剂的主要成分为;Dragendorff’s试剂的主要成分为。
5.总生物碱的提取方法大致有以下三类:、、。
6.麻黄碱和伪麻黄碱的分离可利用它们的——盐在水中的溶解度不同,在水中溶解度比较小,能先行结晶检出,则留在母液中。
7.生物碱沉淀反应可应用于:、、等。
8.用硅胶吸附剂进行生物碱的薄层色谱时,为克服硅胶的酸性,得到集中的斑点,有两种方法:、。
9.用pH梯度萃取法分离生物碱,是将总生物碱溶于有机溶剂中,用不同pH的缓冲液进行萃取,缓冲液pH值由到,所得生物碱的碱度则由到。
三、判断题1.所有生物碱都有不同程度的碱性。
2.含氮原子的杂环化合物都是生物碱。
3.一般生物碱的旋光性都是左旋的。
4.生物碱盐都易溶于水中。
5.在所有生物碱中,季铵碱的碱性最强。
6.生物碱与碘化铋钾多生成红棕色沉淀。
四、选择题(一)A型题(单项选择题)1.下列有关生物碱的论述,正确的是A.含有氮原子B.显碱性C.自然界的所有含氮成分D.无色E.在植物体内以盐的状态存在2.生物碱不具有的特点是A.分子中含氮原子 B.氮原子多在环内 C.具有碱性D.分子中多有苯 E.显著而特殊的生物活性3.小檗碱的结构类型是A.喹啉类 B.异喹啉类 C.哌啶类D.有机胺类 E.吲哚类4.水溶性生物碱从化学结构上多属于A.伯胺碱 B.仲胺碱 C.叔胺碱D.季铵碱 E.酰胺碱5.氧化苦参碱在水中溶解度大于苦参碱的原因是A.属季铵碱B.具有半极性N→0配位键C.相对分子质量大D.碱性强E.酸性强6.表示生物碱碱性的方法是A.Pk b, B.K b C.pHD.pK a, E.K a7.pK a的含义是A.生物碱的溶解度B.生物碱的解离度C.生物碱共轭酸的溶解度D.生物碱共轭酸的解离度E.生物碱共轭酸解离常数的负对数8.下列生物碱碱性最强的是A.伯胺生物碱 B.叔胺生物碱 C.仲胺生物碱D.季铵生物碱 E.酰胺生物碱9.碱性最弱的生物碱是A.季铵生物碱 B.叔胺生物碱 C.仲胺生物碱D.伯胺生物碱 E.酰胺生物碱10.下述生物碱碱性叙述项不正确的是A.酰胺生物碱几乎不显碱性B.脂肪胺为中等碱性C.季铵生物碱为强碱性D.吡啶为弱碱性E.苯胺类为中强碱性11.下列生物碱碱性大小排序正确的是a.酰胺生物碱 b.季铵生物碱 c.伯、仲、叔胺类生物碱A.a>b>c B.c>b>a C.c>a>bD.b>c>a E.b>a>c12.决定生物碱碱性最主要的因素是A.氮原子的杂化方式 B.诱导效应 C.共轭效应D.分子内氢键 E.空间效应13.L-麻黄碱和D麻黄碱的碱性差异是因为A.诱导效应 B.共轭效应 C.分子内氢键效应D.共轭酸分子内氢键效施.立体效应14.用酸水提取生物碱时,一般采用A.渗漉法 B.回流法 C.煎煮法D.连续回流法 E.沉淀法15.从药材中提取季铵型生物碱时,一般采用的方法是A.碱溶酸沉法B.醇-酸水-碱化-氯仿提取法C.pH梯度萃取法D.酸水一氯仿提取法。
E.醇-酸水-碱化-雷氏铵盐沉淀法16.在酸水溶液中可直接被氯仿提取出来的生物碱是A.强碱 B.中强碱 C.弱碱D.酚性碱 E.季铵碱l7.碱性不同的生物碱混合物的分离可选用A.简单萃取法 B.酸提取碱沉淀法 C.pH梯度萃取法D.有机溶剂回流法 E.分馏法18.吸附色谱法分离生物碱常用的吸附剂是A.聚酰胺 B.氧化铝 C.硅胶D.活性炭 E.硅藻土19.在生物碱酸水提取液中,加碱调pH由低到高,每调一次用氯仿萃取一次,首先得到 A.强碱性生物碱 B.弱碱性生物碱 C.季铵碱D.中等碱性生物碱 E.水溶性生物碱20.将生物碱总碱溶于氯仿中,用不同pH(由高到低)缓冲液依次萃取,最后萃取出的生物碱是A.强碱性生物碱 B.弱碱性生物碱 C.季铵碱D.中等碱性生物碱 E.水溶性生物碱21.生物碱进行薄层色谱时,一般使用的显色剂是A.碘化汞钾试剂 B.苦味酸试剂 C.硅钨酸试剂D.雷氏铵盐试剂 E.改良碘化铋钾试剂22.用氧化铝薄层色谱法分离生物碱时,化合物的尺,值大小取决于A.极性大小 B.碱性大小 C.酸性大小D.分子大小 E.挥发性大小(二)X型题(多项选择题)1.根据结构母核分类,生物碱主要分为A.异喹啉类 B.哌啶类 C.莨菪烷类D.吲哚类 E.有机胺类2.常温下为液态生物碱的是A.烟碱 B.咖啡因 C.麻黄碱D.槟榔碱 E.苦参碱3.下列有关生物碱旋光性的叙述,正确的是A.生物碱旋光性受溶剂影响B.生物碱旋光性影响其生理活性C.生物碱旋光性受pH影响D.麻黄碱在氯仿巾呈左旋光性E.麻黄碱在水中呈右旋光性4.酚性叔胺碱可溶于A.苯 B.氢氧化钠 C.水D.盐酸 E.乙醇5.亲水性生物碱常指A.两性生物碱B.游离生物碱.C.季钱生物碱D.仲胺生物碱E.具有N→O配位键的生物碱6.使生物碱碱性减弱的因素是A.吸电子诱导效应B.供电子诱导效应C.吸电子共轭效应D.供电子共轭效应E.立体效应7.使生物碱碱性增强的因素是A.吸电子诱导效应B.供电子诱导效应C.吸电子共轭效应D.供电子共轭效应E.其共轭酸易形成分子内氢键8.使生物碱碱性减弱的吸电子基团是A.烷基 B.羰基 C.醚基 D.酯基 E.苯基9.生物碱分子结构与其碱性强弱的关系正确的是A.氮原子的p电子成分比例越大,碱性越强B.氮原子附近有吸电子基团,碱性增强C.氮原子处于酰胺状态,碱性极弱D.生物碱的立体结构有利于氮原子接受质子,碱性增强E.氮原子附近取代基不利于其共轭酸质子形成氢键缔合,碱性增强1O.用酸水提取植物中的生物碱可采用的方法是A.煎煮法 B.渗漉法 C.回流法D.浸渍法 E.连续回流法五、指出化合物结构类型六、比较题1.比较下列生物碱中各N原子的碱度强弱,并简述理由。
2.比较下列各组化合物的碱性大小,并简述理由。
(1)(2)(3)(4)(5)3.比较下列各组化合物R f值大小,并简要说明理由。
(1)PC:甲酰胺为固定相,甲酰胺饱和乙酸乙酯为展开剂。
(2)TLC:在石蜡溶液中浸过的硅胶板,展开剂为石蜡饱和丙酮。
(3)缓冲PC:展开剂为氯仿-甲醇(1:1)。
(4)硅胶GTLC:展开剂为氯仿.甲醇一氨水(7:1:O.5),比较①苦参碱(A)与氧化苦参碱(B);②汉防己甲素(A)与汉防己乙素(B);③莨菪碱(A)与东莨菪碱(B)。
七、用化学方法区分下列各组化合物1.2.3.八、简答题1.某中草药含有下列三种生物碱,若按下面提取工艺,这些生物碱分别存在哪些部位?简要说明其理由。
2.某植物中,有下列几个生物碱,按下表分离时,应在哪个部位获得?将生物碱代号填人空格。
九、问答题1.比较四氢异喹啉与异喹啉的碱性强弱,说明N的杂化方式对生物碱碱性的影响。
2.比较麻黄碱和去甲麻黄碱及苯异丙胺三者的碱性强弱,说明诱导效应对生物碱碱性的影响。
3.多数生物碱为何有碱性?其碱性强弱与哪些因素有关?4.生物碱沉淀反应在天然药物化学成分研究中有何作用?若用生物碱沉淀试剂检识提取液为阳性反应,能否说明一定含有生物碱?5.雷氏铵盐沉淀法的主要操作步骤有哪些?用方程式表示。
6.试述生物碱pH梯度萃取法的原理,怎样运用梯度萃取法分离不同碱性的生物碱?【习题答案】一、名词解释(略)二、填空题1.结构中有较长的共轭体系2.游离3.碘化铋钾,橘红4.碘化汞钾,碘化铋钾5.溶剂法,离子交换树脂法,沉淀法6.草酸盐,草酸麻黄碱,草酸伪麻黄碱7.预试中药中是否存在生物碱,在提取分离过程中可作为追踪生物碱的指标,分离纯化生物碱8.用碱液或缓冲液替代水来制硅胶板,用碱性溶剂作为展开剂9.高,低,强,弱三、判断题‘1.√2.x 3.×4.x 5.x 6.V四、选择题(一)A型题(单项选择题)1.A 2.D 3.B 4.D 5.B 6.D 7.D 8.D 9.E 10.E 11 Dl2.A 13.D 14.A 1 5.E 16.C 17.C 1 8.B 19.B 20 B 21.E 22. A(二)X型题(多项选择题)1.ABCDE 2.AD 3.ABCDE 4.ABDE 5.CE 6.ACE 7.BDE 8.BCDE 9.ACD 10.BC五、指出化合物结构类型1.有机胺类2.吲哚里西啶类3.喹啉类4.原小檗碱型5.喹诺里西啶类6.吡啶类7.莨菪烷类8.双苄基异喹啉类9.吲哚类 1 O.甾类生物碱11.吗啡烷类六、比较题1.(1)N1<N2(2)N1<N2(3)N1<N2(4)N1<N22.(1)A<B (2)A>B (3)A>B (4)A<B (5)A<B3.(1)A<B (2)A>B (3)A>B (4)①A>B ②.A<B ③A>B七、用化学方法区分下列各组化合物1.Labat反应:A为阳性2.Vitali反应:B为阳性3.FeCl3反应:B为阳性八、简答题1.从左至右分别为:沉淀(B)、C HCI3(C)、不溶物(A)2.从左至右分别为:先(B)、后(D)、乙醚液(C)、水液(A)、氯仿萃(B)九、问答题(略)11。