
第一作者简介:王茜(1983-),女,硕士,主要从事食品科学方面的研究工作。E -mail:wq221348@https://www.doczj.com/doc/353015308.html, 。通讯作者:王颉。E -mail:wj591010@https://www.doczj.com/doc/353015308.html, 。
基金项目:保定市科技局农产品加工平台建设资助项目(05N005)。
收稿日期:2008-08-15
不同萃取条件对分光光度法测定烟草中尼古丁含量的影响
王 茜,王 颉,石 磊
(河北农业大学食品科技学院,河北保定071001)
摘 要:采用酸提取法将干燥的烟末中的尼古丁提出,研究了不同萃取条件对分光光度法测定烟草中尼古丁含量的影响,总结出了分光光度法测定烟草中尼古丁的条件。此方法建立了快速简便、灵敏度高的测定烟草及制品中烟碱含量的萃取分光光度法。
关键词:烟草;尼古丁;提取
中图分类号:S 572 文献标识码:A 文章编号:1001-0009(2009)01-0023-04
烟碱又名尼古丁(Nicotine),是烟草及其制品中特有的生物碱,其含量高低是烟草和香烟质量控制的一项重要指标,烟碱分析方法的研究对于烟草生产过程中的质量控制具有重要意义。烟碱分析过程中尼古丁的提取方法主要有水蒸汽蒸馏法、溶剂萃取法和离子交换法,
超临界萃取技术也被应用于尼古丁的提取[1-4]
。测定烟草中尼古丁的方法有重量法、紫外分光光度法、薄层色谱法、毛细管气相色谱法、离子选择性电极法和示波极
谱间接法[5-8]
。重量分析法的优点是不使用基准试剂和容量器皿,分析结果准确、重现性好、不受外界条件干扰;缺点是操作繁琐、耗时、不能区分尼古丁和其它植物碱,当溶液中有铵等无机盐存在时沉淀不易生成,不适用于低含量尼古丁的测定。分光光度法的优点是对于测定低含量的尼古丁准确度高、选择性好、检测速度快;其缺点是可测量的浓度范围小,对于高含量尼古丁的测定,因受方法本身灵敏度、谱带宽度、波长选择性及共存植物碱的影响,易造成测量结果的偏差;且往往需要蒸馏或萃取等复杂的前处理,较为费事,还易受外界条件影响。滴定分析法仪器投资小,操作简便,测试时间短,缺点是相对标准偏差较大,由于共存生物碱的干扰,往往结果比标准测量值高,不适合对准确度要求较高样品的测量。色谱法的优点是分离效率高,测定速度快,分离与测量同步进行,重现性好,回收率高,过程无污染。缺点是需用大型仪器和标准物,不易普及,测量范围较窄。电位法是目前最快的检测方法,它适合大批量样品的快速测定,且方法简便、选择性好、结果准确、测试过
程无污染。其缺点是:电极制作的好坏直接影响测量结果,对操作人员要求高,不同试验条件下结果差异大,需操作人员自身探索寻求最佳试验条件。极谱分析法测定灵敏度高,分辨能力强,具有良好的抗干扰能力,所用仪器简单;但需要对尼古丁进行蒸馏、络合、沉淀、分离等复杂的预处理,容易给测量引入误差。尼古丁测定除了上述常用方法之外,还有其它一些测定方法。如在H Cl 介质中,使尼古丁与雷氏盐生成难溶化合物,用原子发射光谱法间接测定了尼古丁;用毛细管电泳法测定了烟制品中痕量的尼古丁;以手性络合剂作为标记物,用核磁共振法测定了烟草生物碱和类烟碱化合物。这些方法多具有简便、快速、样品需要量小的优点,分别适用于对映体分析、药物性能检测及痕量组分分析,但它们都需要大型分析仪器,对测试人员要求素质高。
上述方法直接应用于烟碱测定分析均有一定难度,现在急需要找到一种更适合直接应用与生产,简单、方便、快捷、准确的方法。
1 材料与方法
1.1 试验材料
1.1.1 样品采集与加工 烟叶样品于2006年9月7日采于河北容城县,品种为异性烟串花。样品用毛刷除去灰尘后,分别用自来水、蒸馏水及高纯水冲洗干净,60 恒温烘干,研细混匀,备用。
1.1.2 仪器设备与试剂 仪器设备:721A 型分光光度计,HSD -2A 型酸度计。试剂:标准烟碱液(日本进口浓度为
2.5mg/mL),甲基橙(浓度为5.0mg/mL),HAc -NaAc 缓冲溶液,盐酸(浓度为1mol/L)其余试剂均为分析纯,水为去离子水。1.2 试验方法
甲基橙可与尼古丁形成黄色络合物,在紫外光区有最大吸收波长,用二氯甲烷将其从水相中萃取后直接进行分光光度测定。
1.2.1 样品液制备方法 准确称取1g 干燥的烟末于
23
100mL 锥形瓶中,加入30mL 1mol/L HCl 溶液,在小火上微沸10min,趁热抽滤,再用热高纯水洗涤残留物3次,滤液合并,定容至100mL,避
光保存待用。
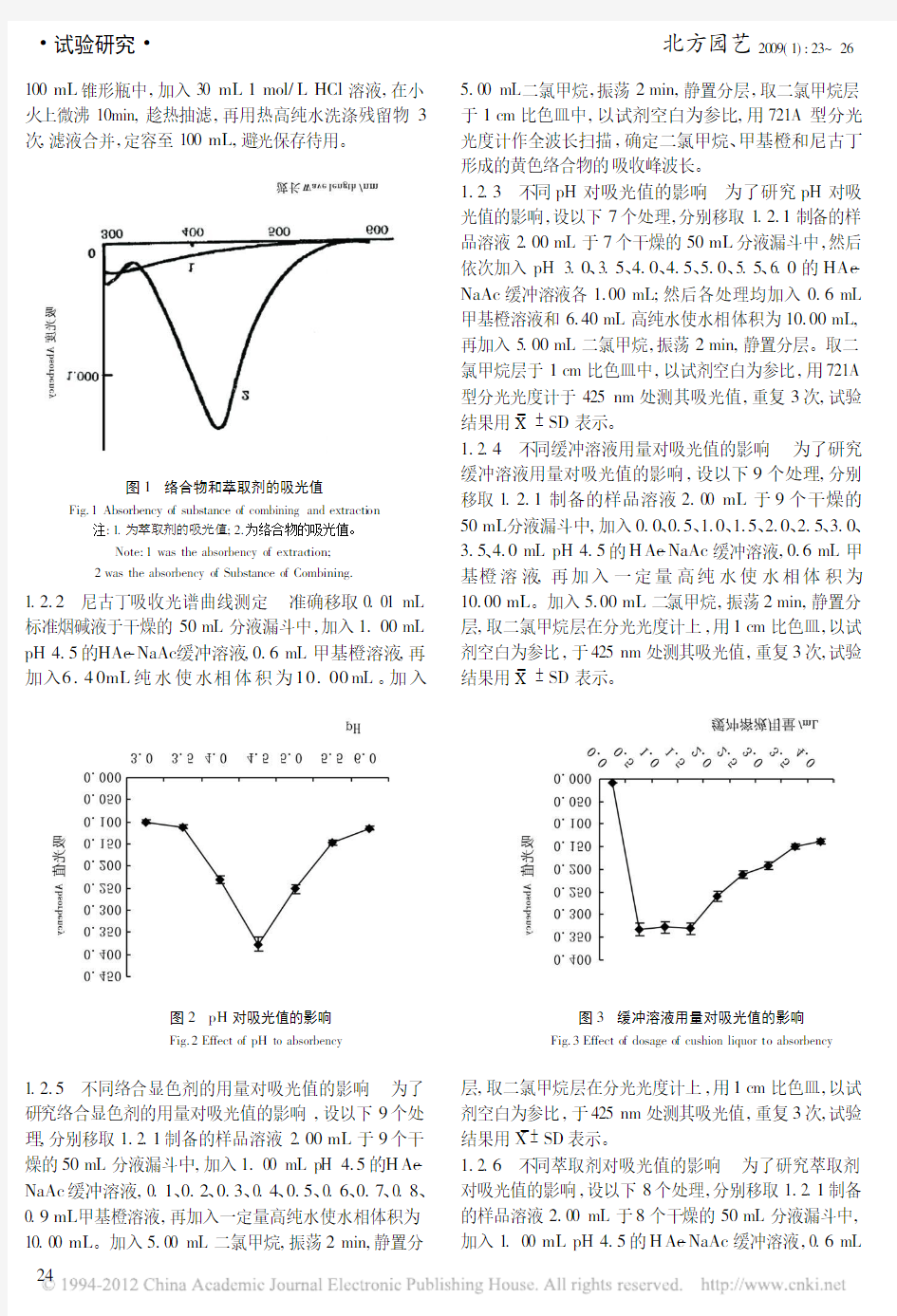
图1 络合物和萃取剂的吸光值
Fig.1Absorbency of substance of combining and extracti on
注:1.为萃取剂的吸光值;2.为络合物的吸光值。
Note:1was the absorbency of extrac tion;2was the absorbency of Substance of Combining.
1.2.2 尼古丁吸收光谱曲线测定 准确移取0.01mL
标准烟碱液于干燥的50mL 分液漏斗中,加入1.00mL pH 4.5的HAc -NaAc 缓冲溶液,0.6mL 甲基橙溶液,再加入6.40mL 纯水使水相体积为10.00mL 。加入
5.00mL 二氯甲烷,振荡2min,静置分层,取二氯甲烷层于1cm 比色皿中,以试剂空白为参比,用721A 型分光光度计作全波长扫描,确定二氯甲烷、甲基橙和尼古丁形成的黄色络合物的吸收峰波长。
1.2.3 不同pH 对吸光值的影响 为了研究pH 对吸光值的影响,设以下7个处理,分别移取1.2.1制备的样品溶液2.00mL 于7个干燥的50mL 分液漏斗中,然后依次加入pH 3.0、3.5、4.0、4.5、5.0、5.5、6.0的HAc -NaAc 缓冲溶液各1.00mL;然后各处理均加入0.6mL 甲基橙溶液和6.40mL 高纯水使水相体积为10.00mL,再加入5.00mL 二氯甲烷,振荡2min,静置分层。取二氯甲烷层于1cm 比色皿中,以试剂空白为参比,用721A 型分光光度计于425nm 处测其吸光值,重复3次,试验结果用 X SD 表示。
1.2.4 不同缓冲溶液用量对吸光值的影响 为了研究缓冲溶液用量对吸光值的影响,设以下9个处理,分别移取1.2.1制备的样品溶液2.00mL 于9个干燥的50mL 分液漏斗中,加入0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0mL pH 4.5的H Ac -NaAc 缓冲溶液,0.6mL 甲基橙溶液,再加入一定量高纯水使水相体积为10.00mL 。加入5.00mL 二氯甲烷,振荡2min,静置分层,取二氯甲烷层在分光光度计上,用1cm 比色皿,以试剂空白为参比,于425nm 处测其吸光值,重复3次,试验结果用 X SD 表示
。
图2 pH 对吸光值的影响 图3 缓冲溶液用量对吸光值的影响
Fig.2Effect of pH to absorbency Fig.3Effect of dosage of cushion liquor to absorbency
1.2.5 不同络合显色剂的用量对吸光值的影响 为了研究络合显色剂的用量对吸光值的影响,设以下9个处理,分别移取1.2.1制备的样品溶液2.00mL 于9个干燥的50mL 分液漏斗中,加入1.00mL pH 4.5的H Ac -NaAc 缓冲溶液,0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9mL 甲基橙溶液,再加入一定量高纯水使水相体积为10.00mL 。加入5.00mL 二氯甲烷,振荡2min,静置分层,取二氯甲烷层在分光光度计上,用1cm 比色皿,以试剂空白为参比,于425nm 处测其吸光值,重复3次,试验结果用 X SD 表示。
1.2.6 不同萃取剂对吸光值的影响 为了研究萃取剂对吸光值的影响,设以下8个处理,分别移取1.2.1制备的样品溶液2.00mL 于8个干燥的50mL 分液漏斗中,加入1.00mL pH 4.5的H Ac -NaAc 缓冲溶液,0.6mL
24
甲基橙溶液,再加入6.40mL 高纯水使水相体积为10.00mL 。分别加入5.00mL 乙醚、苯、甲苯、正已烷、二硫化碳、四氯化碳、三氯甲烷、二氯甲烷作萃取剂,振荡2min,静置分层,选择效果最好的为试验用萃取剂。1.2.7 不同振荡时间对吸光值的影响 为了研究振荡时间对吸光值的影响,设以下9个处理,分别移取1.2.1制备的样品溶液2.00mL 于9个干燥的50mL 分液漏斗中,加入1.00mL pH 4.5的HAc -NaAc 缓冲溶液,0.6mL 甲基橙溶液,再加入6.40mL 高纯水使水相体积为10.00mL 。加入5.00mL 二氯甲烷,分别振荡0.25、0.5、0.75、1、1.25、1.5、1.75、2、3.0min,静置分层,取二氯甲烷层在分光光度计上,用1cm 比色皿,以试剂空白为参比,于425nm 处测其吸光值,重复3次,试验结果用 X SD 表示。
2 结果与分析
2.1 吸收光谱曲线扫描结果
甲基橙可与尼古丁形成黄色络合物,用二氯甲烷将其从水相中萃取后可直接进行分光光度测定。
图1为样品液的全波长扫描曲线。由图1可知,烟
碱与甲基橙形成的黄色络合物,在425nm 处有最大吸收峰,并且萃取剂在此区间内对络合物的影响很小,可以忽略不计。最后选择在425nm 处测量甲基橙与尼古丁形成的黄色络合物的吸光值。2.2 缓冲液pH 对吸光值的影响
由图2可知,当缓冲液pH 从3.0逐渐升高到6.0时,烟碱与甲基橙形成的黄色络合物的吸光值先增大后减小。在pH 为4.5时,吸光值最高,即在pH 为4.5时黄色络合物的提取率最高,即吸光值最大。所以试验选用pH 4.5的HAc -NaAc 缓冲溶液最为适宜。2.3 缓冲溶液用量对吸光值的影响
由图3结果可知,烟碱与甲基橙形成的黄色络合物在当缓冲溶液用量从0.0mL 升至0.5~1.5mL 时,吸光度明显增大且能保持稳定。但随着缓冲溶液用量的逐渐增加,吸光值反而逐步下降。根据试验结果,吸光值在0.5~1.5mL 时最大,选用缓冲溶液用量1.0mL
最为适宜。
图4 络合显色剂的用量对吸光值的影响图5 振荡时间吸光值的影响
Fi g.4Effect of dosage of apparent colour stuff to absorbenc y Fig.5Effect of surging ti me to absorbency
2.4 络合显色剂用量对吸光值的影响
由图4可知,烟碱与甲基橙形成的黄色络合物在当络合显色剂用量从0.10mL 逐渐升至0.90mL 时,吸光度逐渐增大,当用量达为0.6mL 时吸光值达到最大,并且以后随着络合显色剂用量的增加吸光值保持不变。根据试验结果,烟碱与甲基橙形成的黄色络合物吸光值在络合显色剂用量为0.6mL 时就达到最大,故试验选用络合显色剂用量为0.6mL 。2.5 不同萃取剂对吸光值的影响
分别用乙醚、苯、甲苯、正已烷、二硫化碳、四氯化碳、三氯甲烷、二氯甲烷作萃取剂,对烟碱-甲基橙缔合物作萃取试验。结果发现只有三氯甲烷、二氯甲烷能将有色缔合物萃取到有机相,用二氯甲烷时乳化效果最小,效果更好,所以选用二氯甲烷作萃取剂。
2.6 不同振荡时间对吸光值的影响
由图5可知,烟碱与甲基橙形成的黄色络合物在振荡时间从0.25min 延至1.00min 的过程中,吸光值逐渐增大。但以后再增加振荡时间,吸光值也不会发生明显改变。即振荡1min 以上即能定量地将烟碱-甲基橙黄色缔合物萃入有机相,吸光度达到稳定,因此,为充分萃取烟碱与甲基橙形成的黄色络合物,试验选择振荡时间为2min 。
2.7 产物在有机相中的稳定时间
烟碱-甲基橙缔合物用二氯甲烷萃取后,由于水相在上层,二氯甲烷在下层,避免了与空气接触,这时产物可稳定至少2h 而保持吸光度不变。若将有机相置于空气中,吸光值缓慢下降。2.8 共存物质的影响
25
烟草试样中所含成分为Ca 、K 、Mg 、Na 、Fe 等,经该法处理后含量不变,经过萃取后不干扰测定。如样品中这些元素含量超过烟碱2倍时,其干扰可用加入一定量EDTA 的办法消除。
3 问题讨论
在测定尼古丁的过程中,经确定该方法对于测定低
含量的尼古丁准确度高、选择性好、检测速度快,并且克服了共存植物碱的影响,把测量结果的偏差减到最小,除去了复杂的前处理,消除外界条件的影响和增加了有利于提高分析准确度的措施。该方法可靠、方便、运用范围广泛。
该试验证明,利用酸性介质提取烟草中的尼古丁,再用甲基橙与尼古丁形成可萃入二氯甲烷的络合物,直接测定有机相的吸光度,即可准确定量测得烟草中的尼古丁。该测试体系操作简便、快速,结果准确,适用于各种烟样中尼古丁含量的分析。但该方法的缺点是可测量的浓度范围小,在高浓度的尼古丁条件下,吸光度与尼古丁浓度不呈线性关系,给测量带来一定难度,希望通过继续的试验解决这一问题。
该试验由于使用了普及型721分光光度计进行测
定,较为切合我国烟草行业的实际情况,为烟草工、农业提供了一个合适可供选择的分析方法,具有实际推广应用价值。
参考文献
[1] 朱仁发.超临界流体萃取技术及在烟草工业中的应用[[J].安徽化工,1999(2):18-19.
[2] 鲍成根.夹带剂在烟草超临界萃取中的应用[[J].安徽化工,1999(2):20.
[3] 董超宇.超临界CO 2从烟草中提取天然烟碱[J].化学工程师,1998(5):51.
[4] J Rincon.Preli minary Study on the Supercritical Carbon Di oxi de Ex -trac tion of Nicoti ne from Tobacc o Wastes[J].Separation Science and Techno-l ogy ,1998,33(3):411.
[5] 黎植昌.萃取分光光度法快速测定烟草中的烟碱[J].分析化学,1996,14(1):60-62.
[6] Gottscho A M.Nicoti ne Anal ysis of Commercial Tobacco Products [J].J Assoc.Off.A nal.Chem,1998,71(6):1110.
[7] 松冈俊惠.用离子缔合性试剂进行烟碱的吸光光度测定[J].分析化学(日),1992,31(7):377.
[8] First G D.Gas Chromatographic Petermi nation of Nicoti ne i n Gases and Liquids with Suppression of A dsorption Effects [J].A nal.Chem,1990,52:1755.
Different Extract C ond itio ns of Sp ectrop hotometric Metho d to
Influen ce th e C ontent of N icotine in T oba cco
WANG Q ian,WANG Jie,SHI Lei
(Colleg e of Food Science and Technology ,Ag ricultural Uni versi ty of Hebei ,Baoding ,Hebei 071001,Chi na)
A bstract:Nicotine is extracted from tobacco which was in 100mL taper bottle using the acid.The experiment studied the
different extract conditions of the spectrophotometric method to influence the content of nicotine in tobacco.At the end,summary extract conditions of the spectrophotometric method to determine the content of nicotine in tobacco.The meth -od showed good accuracy and reproducibility.Good results ace obtained for the determination of nicotine in tobacco and tobacco products.
Key words:Tobacco ;Nicotine;Ex
tract
26
邻二氮菲分光光度法测定微量铁 一、实验原理 邻二氮菲(1,10—二氮杂菲),也称邻菲罗啉是测定微量铁的一个很好的显色剂。在pH2—9范围内(一般控制在5—6间)Fe2+与试剂生成稳定的橙红色配合物Fe(Phen)32+lgK=,在510nm下,其摩尔吸光系数为, )Fe3+与邻二氮菲作用生成兰色配合物,稳定性较差,因此在实际应用中常加入还原剂盐酸羟胺使Fe2+还原为Fe3+: 2 Fe3++2NH2OHHCl=2 Fe2++N2+4H++2H2O+2Cl- 二、试剂与仪器 仪器: 1.721型分光光度计 2.50mL容量瓶8个,100mL1个,500mL1个 3.移液管:2 mL1支,10 mL1支 4.刻度吸管:10mL、5mL、1mL各1支 试剂: 1.铁标准储备溶液100ug/mL:1000 mL(准确称取铁盐NH4Fe(SO4)212H2O置于烧杯中,加入3moL/LHCI20mL和30ml水,然后加水稀释至刻度,摇匀。) 2.铁标准使用液10ug/mL:用移液管移取上述铁标准储备液 mL,置于100 mL容量瓶中,加入3moL/和少量水,然后加水稀释至刻度,摇匀。 3.HCI3moL/L:100mL 4.盐酸羟胺100g/L(新鲜配制):100mL 5.邻二氮菲溶液L(新鲜配制):200mL 6.HAc—NaAc缓冲溶液(pH=5)500 mL:称取136gNaAc,加水使之溶解,再加入120 mL 冰醋酸,加水稀释至500 mL 7.水样配制(mL):取2mL100ug/mL铁标准储备溶液加水稀释至500mL 三、实验步骤 1.配置mL的铁标准溶液。 1.绘制吸收曲线:用吸量管吸取铁标准溶液(10ug/mL)、、、、、分别放入50 mL容量瓶中,加入1 mL10%盐酸羟胺溶液、 L邻二氮菲溶液和5 mL HAc—NaAc缓冲溶液,加水稀释至刻度,充分摇匀,放置5分钟,用3cm比色皿,以试剂溶液为参比液,于721型分光光度计中,在440—560nm波长范围内分别测定其吸光度A值。当临近最大吸收波长附近时应间隔波长5—10nm测A值,其他各处可间隔波长20—40nm测定。然后以波长为横坐标,所测A值为纵坐标,绘制吸收曲线,并找出最大吸收峰的波长。 2.标准曲线的绘制:用吸量管分别移取铁标准溶液(10ug/mL)、、、、、、 mL依次放入7只50mL 容量瓶中,分别加入10%盐酸羟胺溶液1 mL,稍摇动,再加入%邻二氮菲溶液 mL及5 mL HAc —NaAc缓冲溶液,加水稀释至刻度,充分摇匀,放置5分钟,用3cm比色皿,以不加铁标准溶液的试液为参比液,选择最大测定波长为测定波长,依次测A值。以铁的质量浓度为横坐标,A值为纵坐标,绘制标准曲线。 3.水样分析:分别加入(或,铁含量以在标准曲线范围内为宜)未知试样溶液,按实验步骤2的方法显色后,在最大测定波长处,用3cm比色皿,以不加铁标准溶液的试液为参比液,平行测A值。求其平均值,在标准曲线上查出铁的质量,计算水样中铁的质量浓度。 四、数据记录与结果计算
实验一邻二氮菲分光光度法测定微量铁 实验目的和要求 1.掌握紫外可见分光光度计的基本操作; 2.掌握邻二氮菲分光光度法测定微量铁的原理和方法; 3.掌握吸收曲线绘制及最大吸收波长选择; 4.掌握标准曲线绘制及应用。 实验原理 邻二氮菲(1,10—邻二氮杂菲)是一种有机配位剂,可与Fe2+形成红色配位离子: Fe2++3 N N N N 3 Fe 2+ 在pH=3~9范围内,该反应能够迅速完成,生成的红色配位离子在510nm波长附近有一吸收峰,摩尔吸收系数为1.1×10-4,反应十分灵敏,Fe2+ 浓度与吸光度符合光吸收定律,适合于微量铁的测定。 实验中,老师我们又见面了采用pH=4.5~5的缓冲溶液保持标准系列溶液及样品溶液的酸度;采用盐酸羟胺还原标准储备液及样品溶液中的Fe3+并防止测定过程中Fe2+被空气氧化。 实验仪器与试剂 1.752S型分光光度计 2.标准铁储备溶液(1.00×10-3mol/L) 3.邻二氮菲溶液(0.15%,新鲜配制) 4.盐酸羟胺溶液(10%,新鲜配制) 5.NaAC缓冲溶液 6.50ml容量瓶7个 7.1cm玻璃比色皿2个 8.铁样品溶液 实验步骤 1.标准系列溶液及样品溶液配制,按照下表配制铁标准系列溶液及样品溶液。
2.吸收曲线绘制用1cm比色皿,以1号溶液作为参比溶液,测定4号溶液在各个波长处的吸光度,绘制吸收曲线,并找出最大吸收波长。 3.标准曲线制作
在选定最大吸收波长处,用1cm 比色皿,以1号溶液作为参比溶液,分别测定2至7号溶液的吸光度,平行测定3次,计算吸光度平均值,绘制标准曲线。 实验数据处理 1、 样品中铁的计算 2.50 50.00 C C X ? =读取值 Cx=4.65×10-5 ×50.00/2.50=9.30×10-4 mol/L 2、 摩尔吸光系数计算 在标准曲线的直线部分选择量两点,读取对应的坐标值,计算邻二氮菲配位物在最大吸收波长出的摩尔吸光系数: 1 21 2c -c A A ε-= ε=(0.460-0.233)/(0.00006-0.00004)=2.00×10-5 7 样品溶液 4.65×10-5 mol/ml
实验三、从烟草中提取烟碱 内容:P93-96和P42-44 一、实验目的(明确) 1、 学习从烟草中提取烟碱的基本原理和方法。 2、 初步了解烟碱的一般性质。 3、 掌握水蒸汽蒸馏的操作技术。 二、实验原理(介绍) 烟草中含有多种生物碱,除主要成分烟碱(约含2 ~ 8 %)外,还含有去甲烟碱、假木烟碱和多种微量的生物碱。烟碱又名尼古丁,是由吡啶和吡咯两种杂环组成的含氮碱,其结构式如右图: 烟碱能与HCl 结合生成烟碱盐酸盐(弱碱强酸盐)而溶于水中,在此提取液中加入强碱NaOH 后,可使烟碱游离出来。 + HCl → 游离烟碱在100℃左右具有一定的蒸气压。因此,可利用水蒸气蒸馏法分离提取。 由烟碱的结构可知,烟碱具有碱性,它不仅可以使红色石蕊变蓝,还可以使酚酞试剂变红,并可以被KMnO 4溶液氧化生成烟酸,与生物碱试剂作用 产生沉淀。 附:水蒸气蒸馏原理(见书P46) 三、实验仪器与试剂(要求学生认真检查) 1. 仪器 长颈圆底烧瓶(250 mL ) 圆底烧瓶(100 mL ) 直形冷凝管 电热套 玻璃棒 试管 止水夹 蒸汽导管(导入、导出) 烧杯(100 mL ) 球形冷凝管 接液管 T 形管 滴管 洒精灯 锥形瓶(100 mL ) 量筒(100 mL ) N N CH 3
2.试剂 烟叶(或烟丝) HCl溶液10 % NaOH 40 % KMnO4 % 酚酞 % Na2CO3 5 % 苦味酸(饱和) 3. 其它 红色石蕊试纸沸石 四、实验内容(简单介绍) 1、烟碱的提取 取一支烟,拨去外纸,将烟丝置于100 mL圆底烧瓶内,加入20 mL10%HCl溶液,安装好回流装置,回流20 min。(如图3. a) 将反应化合物冷却至室温,在不断搅拌下慢慢滴加40%NaOH溶液,使之呈明显碱性(用红色石蕊试纸检验)。 按图3. b安装好水蒸汽蒸馏装置。通入冷却水后,用电热套加热水蒸汽发生器,当有大量水蒸汽产生时,关闭T形管上的止水夹。 收集约10 mL提取液后,先打开止水夹,再停止加热[2]。待体系稍冷却,关闭冷却水。 2、烟碱的性质检验 (1)碱性试验:取10滴烟碱提取液,加入1滴%酚酞试剂,振摇并观察现象。另取1滴烟碱提取液在红色石蕊试纸上,观察试纸的颜色变化。解释上述现象。 (2)氧化反应:取20滴烟碱提取液加入1滴%KMnO4溶液和3滴5%Na2CO3溶液,摇动试管,于酒精灯上微热,观察颜色是否变化,有无沉淀生成。 (3)与生物碱的反应:取10滴烟碱提取液,逐滴加入饱和苦味酸,边加边摇动,观察有无黄色沉淀生成。 图3. a 回流图3. b水蒸气蒸馏 五、注意事项(强调) 1、电热套温度控制。
专业项目课程课例 项目十二分光光度法测定水中铁离子含量 一、项目名称:分光光度法测定水中铁离子含量 二、项目背景分析 课程目标:本课程是培养分析化学操作技能和操作方法的一门专业实践课,以定量分析的基本理论为基础,以实验强化理论,以期提高化工工作者的分析操作能力。 功能定位:在定量分析中我们常常用到分光光度分析法,它具有操作简便、快速、准确等优点,在工农业生产和科学研究中具有很大的实用价值。是仪器分析的基础实验,也是一种重要的定量分析方法。分光光度法测定水中铁离子含量的测定项目综合训练了学生分光光度计使用、系列标准溶液配制、标准曲线绘制等多个技能。 学生能力:学生通过相关基础学科的学习已经具备了相应的化学知识和定量分析知识,也具备一定的独立操作和思维能力。 项目实施条件:该项目是仪器分析的基础实验,一般中职学校具备相关的实训实习条件,学生有条件完成相应的实习任务。 三、教学目标 1、了解721可见分光光度计的构造 2、了解分光光度法测定原理 3、掌握721可见分光光度计的操作方法 4、掌握分光光度法测定分析原始记录的设计 5、掌握分光光度法测定分析报告的设计 6、掌握分光光度法测定水中铁离子含量的测定方法 7、掌握分光光度法测定水中铁离子含量的分析原始记录和分析报告的填写 四、工作任务 1
2 五、参考方案 参考方案一 1、邻二氮杂菲-Fe 2+ 吸收曲线的绘制 用吸量管吸取铁标准溶液(20μg/mL )0.00、2.00、4.00mL ,分别放入三个50mL 容量瓶中,加入1mL 10%盐酸羟胺溶液,2mL 0.1%邻二氮杂菲溶液和5mL HAc-NaAc 缓冲溶液,加水稀释至刻度,充分摇匀。放置10min ,用3cm 比色皿,以试剂空白(即在0.0mL 铁标准溶液中加入相同试剂)为参比溶液,在440~560nm 波长范围内,每隔20~40nm 测一次吸光度,在最大吸收波长附近,每隔5~10nm 测一次吸光度。在坐标纸上,以波长λ为横坐标,吸光度A 为纵坐标,绘制A 和λ关系的吸收曲线。从吸收曲线上选择测定Fe 的适宜波长,一般选用最大吸收波长λmax 。 2、标准曲线的制作 用吸量管分别移取铁标准溶液(20μg/mL )0.00、2.00、4.00、6.00、8.00、10.00mL ,分别放入6个50mL 容量瓶中,分别依次加入1.00mL 10%盐酸羟胺溶液,稍摇动;加入2.00mL 0.1%邻二氮杂菲溶液及5.00mL HAc-NaAc 缓冲溶液,加水稀释至刻度,充分摇匀。放置10min ,用1cm 比色皿,以试剂空白(即在0.00mL 铁标准溶液中加入相同试剂)为参比溶液,选择λmax 为测定波长,测量各溶液的吸光度。在坐标纸上,以含铁量为横坐标,吸光度A 为纵坐标,绘制标准曲线。 3、水样中铁含量的测定 取三个50mL 容量瓶,分别加入5.00mL (或10.00mL 铁含量以在标准曲线范围内为合适)未知试样溶液,按实验步骤2的方法显色后,在λmax 波长处,用1cm 比色皿,以试剂空白为参比溶液,平行
实验四邻菲罗啉分光光度法测定水样中的铁 一、实验目的: 1、掌握邻菲罗啉分光光度法测定微量铁的原理和方法; 2、学会标准曲线的绘制方法及其使用。 二、原理: 亚铁离子(Fe2+)在pH=3~9时与邻菲罗啉生成稳定的橙红色络合物,应用此反应可用比色法测定铁。橙红色络合物的吸光度与浓度的关系符合朗伯-比耳定律。若用还原剂(如盐酸羟胺)把高铁离子还原为亚铁离子,则此法还可测定水中的高价铁和总铁的含量。 三、仪器: 721型分光光度计、1cm比色皿、具赛比色管(50ml)、移液管、吸量管、容量瓶等。 四、试剂: 1、铁贮备液(100μg/mL):准确称取0.7020克分析纯硫酸亚铁铵 [(NH4)2Fe(SO4)2·6H2O]于100毫升烧怀中(或0.8640g分析纯的 NH4Fe(SO42·12H2O,其摩尔质量为482.18g/mol),加50毫升1+1 H2SO4,完全溶解后,移入1000ml的容量瓶中,并用水稀释到刻度,摇匀,此溶液中Fe的质量浓度为 100.0μg/mL。(实验室准备好) 2、铁标准使用液(20μg/mL):准确移取铁贮备液20.00ml于100ml 容量瓶中,用水稀释至刻度,摇匀。此溶液中Fe2+的质量浓度为20.0μg/mL。(学生配制)
3、0.5%邻菲罗啉水溶液:配制时加数滴盐酸能助溶液或先用少许酒精溶解,再用水稀释至所需体积。(临用时配制) 4、10%盐酸羟胺水溶液: 5、醋酸-醋酸钠缓冲溶液(pH=4.6):称取40克纯醋酸铵加到50毫升冰醋酸中,加水溶解后稀释至100毫升。 五、测定步骤: 1、标准曲线的绘制: (1)分别吸取铁的标准溶液0.00、1.00、2.00、4.00、6.00、8.00、10.00ml于7支50ml比色管中,加水至刻度; (2)依次分别加入10%盐酸羟胺溶液1ml,混匀,加入5ml醋酸-醋酸铵缓冲溶液,摇匀,加入0.5%邻菲罗啉溶液2ml,摇匀,(3)放置15分钟后,在510nm波长处,用1cm比色皿,以空白作为参比,测定各溶液的吸光度。 (4)以吸光度为纵坐标,铁含量(μg,50ml)为横坐标,绘制出标准曲线。 2、试样中铁含量的测定 吸取待测水样溶液10.00ml于50ml比色管中,按绘制标准曲线的操作,测得水样的吸光度A,由标准曲线查得相应的铁含量,计算出试样的铁的质量浓度。做平行样。 实验四邻菲罗啉分光光度法测定水样中的铁原始记录表
实验分光光度法测定铁 The following text is amended on 12 November 2020.
实验十四邻二氮菲分光光度法测定铁的含量 一、实验目的 1.学习吸光光度法测量波长的选择方法; 2.掌握邻二氮菲分光光度法测定铁的原理及方法; 3. 掌握分光光度计的使用方法。 二、实验原理 分光光度法是根据物质对光选择性吸收而进行分析的方法,分光光度法用于定量分析的理论基础是朗伯比尔定律,其数学表达式为:A=εb C 邻二氮菲(又称邻菲罗啉)是测定微量铁的较好试剂,在pH=2~9的条件下,二价铁离子与试剂生成极稳定的橙红色配合物。摩尔吸光系数ε=11000 L·mol-1·cm-1。在显色前,用盐酸羟胺把Fe3+还原为Fe2+。 2Fe3++2NH 2OHHCl→2Fe2++N 2 +4H++2H 2 O+2Cl- Fe2+ + Phen = Fe2+ - Phen (橘红色) 用邻二氮菲测定时,有很多元素干扰测定,须预先进行掩蔽或分离,如钴、镍、铜、铅与试剂形成有色配合物;钨、铂、镉、汞与试剂生成沉淀,还有些金属离子如锡、铅、铋则在邻二氮菲铁配合物形成的pH范围内发生水解;因此当这些离子共存时,应注意消除它们的干扰作用。 三、仪器与试剂 1.醋酸钠:l mol·L-1; 2.盐酸:6 mol·L-1; 3.盐酸羟胺:10%(用时配制); 4.邻二氮菲(%):邻二氮菲溶解在100mL1:1乙醇溶液中; 5.铁标准溶液。 (1)100μg·mL-1铁标准溶液:准确称取(NH 4) 2 Fe(SO 4 ) 2 ·12H 2 0于烧杯中, 加入20 mL 6 mol·L-1盐酸及少量水,移至1L容量瓶中,以水稀释至刻度,摇匀. 6.仪器:7200型分光光度计及l cm比色皿。 四、实验步骤 1.系列标准溶液配制 (1)用移液管吸取10mL100μg·mL-1铁标准溶液于100mL容量瓶中,加入2mL 6 mol·L-1盐酸溶液, 以水稀释至刻度,摇匀. 此溶液Fe3+浓度为10μg·mL-1. (2) 标准曲线的绘制: 取50 mL比色管6个,用吸量管分别加入0 mL,2 mL,4 mL, 6 mL, 8 mL和10 mL10μg·mL-l铁标准溶液,各加l mL盐酸羟胺,摇匀; 经再加2mL邻二氮菲溶液, 5 mL醋酸钠溶液,摇匀, 以水稀释至刻度,摇匀后放置 10min。 2.吸收曲线的绘制 取上述标准溶液中的一个, 在分光光度计上,用l cm比色皿,以水为参比溶液,用不同的波长,从440~560 nm,每隔10 nm测定一次吸光度,在最大吸收波长
1) tobacco sheet 烟草薄片 1. Preparation and application in tobacco sheet of brown reaction product derived from D-glucose and l-Leucine; D-葡萄糖与L-亮氨酸棕化反应物制备及在烟草薄片中的应用 2. A study on process of making tobacco sheet of fennel stalk with papermaking method; 小茴香秆造纸法烟草薄片的制造工艺研究 3. In order to test the prediction feasibility of total sugar,total nitrogen,nicotine,potassium and chlorine content in tobacco sheet,predictive models were established by partial least square(PLS) technique,based on the data of NIR diffuse reflective spectrum and determined chemical results of 250 tobacco sheet samples. 为了研究近红外光谱分析技术预测烟草薄片中的总糖、总氮、烟碱、钾和氯含量的可行性,本文以250个具有代表性的烟草薄片样品的近红外漫反射光谱数据和它们相对应化学测定数据为基础,通过偏最小二乘回归法(PLS)建立了以上5种成分的近红外分析模型,并对模型的预测效果进行了评价。 2) reconstituted tobacco 烟草薄片 1. The general situation of production and signification of reconstituted tobacco were introduced in this article . 介绍了烟草薄片生产技术应用现状及意义。 2. The relationships between DD of chitosan and the mechanical properties and smoking quality of reconstituted tobacco were studied when chitosan was used as adhesive in reconstituted tobacco. 甲壳素在不同Na OH溶液的浓度、不同反应时间和不同反应温度下,制备得到不同脱乙酰度的壳聚糖,并作为烟草薄片的粘合剂。 3. To increase the yield and ash content of reconstituted tobacco produced by papermaking technique and to cut down production cost, the effect of cationic guar gum addition levels and shearing force on furnish retention were investigated using a dynamic drainage analyzer to mimic actual production conditions. 为提高造纸法烟草薄片的得率和灰分,降低生产成本,该文利用动态滤水分析仪在实验室中 模拟生产条件,研究了阳离子瓜尔胶用量以及剪切力对其在造纸法烟草薄片中的助留效果的影响,为生产中阳离子瓜尔胶的添加量及添加地点的确定提供了参考依据。 3) tobacco slice 烟草薄片 1. Preparation of tobacco slice from tobacco leaf offal by papermaking; 烟草废弃物造纸法制烟草薄片 2.
从烟草中提取烟碱 主要仪器与试剂 仪器:烧杯,微型布氏漏斗,抽滤瓶,分液漏斗,圆底烧瓶,锥形瓶。试剂:干燥烟叶2g,5% NaOH溶液20mL,乙醚15mL,饱和苦味酸甲醇溶液,甲醇 1、碱处理。在25mL烧杯中加入2g干燥碎烟叶和2mL 5% NaOH溶液,搅拌10min,然后用带尼龙滤布的布氏滤斗抽滤(1),并用干净的玻塞挤压烟叶以挤出碱提取液。接着用4mL水洗涤烟叶,再次抽滤挤压,将洗涤水合并至碱提取液中。 2、醚萃取。将黑褐色滤液移入25mL分液漏斗中,用15mL乙醚分三次萃取。萃取时应轻旋液体,勿振荡漏斗以免形成乳浊液导致分层困难。上层醚相从漏斗上口倒入25mL圆底烧瓶中(2)。 3、蒸去乙醚。合并醚萃取液,在水浴上蒸去乙醚(3),并用水泵将溶剂抽干。 4、重新溶解。残留物中加入2滴水和1mL甲醇,使残渣溶解,然后将溶液通过放有玻璃毛的短颈漏斗滤入25mL烧杯中,并用1mL甲醇涮洗烧瓶和玻璃毛,合并至烧杯中(4)。 5、制备衍生物。在搅拌下往烧杯中加入2mL饱和苦味酸盐的甲醇溶液,立即有浅黄色的二苦味酸烟碱盐沉淀析出。用玻砂漏斗过滤,干燥称重,测定熔点,并计算所提取的烟碱的百分产量。此操作所得二苦味酸烟碱盐熔点:217~220℃。 6、重结晶。用刮刀将粗产物移入10mL锥形瓶中,加入4mL 50%乙
醇-水(V/V)溶液,加热溶解,室温下静置冷却,析出亮黄色长形棱状结晶。抽滤,烘干,称重,测熔点。纯二苦味酸烟碱盐的熔点为222~223℃。 注释(1)滤纸在碱液中会很快溶胀并失去作用。此处宜采用尼龙滤布挤压过滤。(2)在分液漏斗中进行乙醚萃取时,应注意不时放气,减低乙醚蒸气在漏斗内的压力。此时可一手握紧上口旋塞,让漏斗倾斜下支管口朝上,另一只手打开分液旋塞放气,或者在垂直放置时打开上口旋塞放气。在分离液层时,应小心使醚层与夹杂在中间的出现在漏斗尖底部的少量黑色乳状液相分离。上层液从上口倒出,下层液从下口放出。(3)乙醚易燃。在蒸馏乙醚时应用水浴加热,不能直火加热。同时开窗通风,避免外泄的乙醚蒸气富集遇火点引燃,酿成火灾!(4)烟碱毒性极强,其蒸气或其盐溶液吸入或渗入人体可使人中毒死亡。高浓度的烟碱液操作时务必小心。若不慎手上沾上烟碱提取液,应及时用水冲洗后用肥皂擦洗。
分析化学实验报告 实验名称: 邻二氮菲分光光度法测铁 一、实验目的(略) 二、实验原理(略) 三、仪器和药品(略) 四、实验步骤 1.光谱扫描并选择测量波长 相关思考:可见光波长范围,吸收曲线,最大吸收波长(λmax);为什么用λmax作为测量波长。 2.考查亚铁邻二氮菲配合物的稳定性 相关思考:为何考查,如何考查,设想吸光度随时间的变化趋势。 3.确定显色剂的用量 相关思考:如何确定显色剂的用量,设想吸光度随显色剂的用量变化趋势及如何根据曲线确定显色剂的用量。 4.绘制标准工作曲线 相关思考:定量测量的理论依据;选择参比液的原则;空白试剂;可信的标准曲线应满足什么要求。 5.测定未知样的含铁量 相关思考:如果未知样的吸光度值不在标准曲线内,如何解决? 五、数据处理 1.打印吸收曲线,确定λmax。
由吸收曲线,得到亚铁邻二氮菲配合物的最大吸收波长λmax=510.00nm,此时Abs=0.775. 2.打印吸光度-时间曲线,并根据曲线讨论亚铁邻二氮菲配合物的稳定性,确定溶液的显色时间并说明依据。(略) 3.打印吸光度-显色剂用量曲线,并根据曲线确定显色剂用量并说明依据。 在吸光度-显色剂用量曲线中,吸光度随显色剂用量的增加先变大、后保持稳定。由曲线可知,当显色剂用量在3mL附近时,吸光度较大且几乎恒定。因此,显色剂用量应为3mL。 4.打印标准工作曲线,计算未知样铁的含量(mol?L-1)。
六、问题与讨论(略) 七、思考题 1.如果用配制已久的盐酸羟胺溶液,对分析结果有何影响? 配制已久的盐酸羟胺溶液还原性降低,会使二价铁浓度降低,从而使测定的含铁量降低。 2.标准溶液是用分析纯的二价铁盐配制的溶液,为什么显色时还须加盐酸羟胺溶液? 二价铁溶液在空气中容易被氧化,加入盐酸羟胺溶液作为还原剂,可防止二价铁被氧化。 3.醋酸钠溶液的作用是什么? 调节溶液的pH,使pH在2~9范围内,满足生成亚铁邻二氮菲配合物的条件。 4.如何选取不同的量具进行所需溶液的量取? (1)铁标准溶液: ①5.00mL:用5mL移液管或5mL吸量管; ②1.00mL、2.00mL、3.00mL、4.00mL:用5mL吸量管; (2)盐酸羟胺2mL:用可调定量加液器; (3)邻二氮菲溶液0.60mL、1.00mL、2.00mL、3.00mL、4.00mL:用5mL吸量管;(4)NaAc溶液5mL:用可调定量加液器; (5)试样溶液10.00mL:用10mL移液管。
瑞升再造烟叶致力于成为中式卷烟配套再造烟叶产品技术的提供者和引领者。因此,他们积极研发创新性高品质再造烟叶生产技术及产品,目前已具备从再造烟叶生产线设计、技术装备集成、产品研发推广、配套材料开发到提供生产技术咨询的完整技术服务能力。 瑞升在传统的两步造纸法生产工艺的基础上,通过原料技术、成分分离重组技术、柔性化生产技术、质量控制技术、清洁生产技术等六大技术体系的系统构建,形成了多项自主研发技术及专利。 瑞升所开发形成的产品目前已成为国内高品质、特色化、功能型再造烟叶的代表,在国内中高档卷烟品牌中的占有率已达到国内领先。 六大优势技术体系 原料技术体系:生化预处理技术;原料分类加工技术;模块化配方技术 成分分离重组技术体系:多元复合萃取技术;大分子物质分离技术;烟草反应处理技术;内在关键组分调控技术 柔性化生产技术体系:柔性化制浆技术;自动配浆技术;专利涂布技术 质量控制技术体系:生产线关键工序多点控制技术;在线快速检测技术;整线自动控制技术 清洁生产技术体系:专利废水处理技术;固体废弃物综合利用技术 功能化配套材料开发及应用技术体系:特殊纤维材料开发技术;香味补偿技术及材料开发;功能性减害技术及材料开发 特色系列再造烟叶产品 1、特色原料产品系列 精选具有典型特征香气的烟叶原料,根据各特征原料的品质差异,运用不同工艺重组分离技术,形成具有特色烟叶原料风格特征的系列再造烟叶产品。特点:优雅的烟叶风格特征;凸显卷烟产品风格;满足卷烟差异化的原料需求。 2、特殊结构再造烟叶 筛选特殊纤维材料进行处理应用,使其具有疏松多孔的性能特点,开发出吸收性和疏松性能好的再造烟叶。特点:疏松多孔、吸收性能好;填充值高;能够提高卷烟烟支饱满度,减少烟丝耗用量。 3、非烟草特殊原料再造烟叶 以非烟草特殊原料通过低温萃取技术提取其致香成分和活性成分,通过物理结构重组,形成了特殊的香韵风格,新型外观和纹理及无烟碱的再造烟叶产品。特点:多种独特抽吸风
实验5 分光光度法测定微量铁的条件试验 一、目的要求 1. 通过本实验学习确定实验条件的方法; 2. 学习Vis-723G型分光光度计的使用方法。 二、基本原理在可见光分光光度测定中,通常是将被测物质与显色剂反应,使之生成有色物质,然后测量其吸光度,进而求得被测物质的含量。因此,显色反应的完全程度和吸光度的物理测量条件都影响到测定结果的准确性。显色反应的完全程度取决于介质的酸度,显色剂的用量、反应的温度和时间等因素。在建立分析方法时,需要通过实验确定最佳反应条件。为此,可改变其中一个因素(例如介质的pH值),暂时固定其它因素,显色后测量相应溶液的吸光度,通过吸光度-pH曲线确定显色反应的适宜酸度范围。其它几个影响因素的适宜值,也可按这一方式分别确定。本实验以邻二氮菲为显色剂,找出测定微量铁的适宜显色条件。 三、仪器及试剂 1. 仪器 Vis-723G型分光光度计(上海分析仪器厂);容量瓶50mL,250mL;吸量管5mL,10mL; 吸量管25mL,10 mL,5 mL,2 mL;pH计;玻璃复合电极。 2.试剂 ①铁盐标准溶液 准确称取若干克(自行计算)优级纯的铁铵矾NH4Fe(SO4)2·12H2O于小烧杯中,加水溶解,加入6mo1·L -1 HCl溶液5mL,酸化后的溶液转移到250mL容量瓶中,用蒸馏水稀释至刻度,摇匀,所得溶液每毫升含铁0.100mg。然后吸取上述溶液25.00mL置于250mL容量瓶中,加入6mo1·L-1 HCl 溶液5mL, 用蒸馏水稀释至刻度,描匀,所得溶液含铁0.0100mg·mL—1。 ②0.1%邻二氮菲(又称邻菲咯啉)水溶液③1%盐酸羟胺水溶液 ④HAc-NaAc缓冲溶液(pH=4.6) 称取136g优级纯醋酸钠,加120mL冰醋酸,加水溶解后,稀释至500mL。⑤0.1mo1.L-1NaOH溶液⑥0.1mo1.L-1HCl溶液⑦广泛pH试纸和不同范围的精密pH 试纸注上述试剂中,有特殊说明的除外,其余均为分析纯试剂或由分析纯试剂所配制。 四、实验步骤 1.吸收曲线的绘制 用吸量管吸取0.0,5.0 mL的0.0100mg·mL—1的铁标准溶液分别注入三个50mL的容量瓶中,各加入1mL盐酸羟胺溶液、2mL邻二氮菲、5mL NaAc,用水稀释至刻度,摇匀。放置10分钟后,用1cm比色皿、以试剂空白(即0.0mL铁标液)为参比溶液,在440~560nm之间,每隔5nm测定一次吸光度。 2.酸度影响 于9只50mL容量瓶中,用吸量管各加入5.0mL 0.0100mg/mL的铁标准溶液,2.5mL盐酸羟胺溶液和5.0mL邻二氮菲溶液,然后按下表1分别加入HCl或NaOH溶液。 表1 HCl、NaOH溶液加入量
实验1邻二氮菲 一、实验原理 邻二氮菲(phen)和Fe2+ 在pH3~9的溶液中,生成一种稳定的橙红色络合物Fe(phen) 32+ ,其lgK=21.3,κ 508=1.1×104 L·mol-1 ·cm-1 ,铁含量在0.1~6μg·mL-1 范围内遵守比尔定律。其吸收曲线如图1-1所示。显色前需用盐酸羟胺或抗坏血酸将Fe3+ 全部还原为Fe2+ ,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。有关反应如下: 2Fe3+ +2NH 2OH·HC1=2Fe2+ +N 2↑+2H 2O+4H+ +2C1-
图1-1邻二氮菲一铁(Ⅱ)的吸收曲线 用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的标准溶液,在实验条件下依次测量各标准溶液的吸光度(A),以溶液的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。在同样实验条件下,测定待测溶液的吸光度,根据测得吸光度值从标准曲线上查出相应的浓度值,即可计算试样中被测物质的质量浓度。 二、仪器和试剂 1.仪器721或722型分光光度计。 2.试剂 (1)0.1 mg·L-1 铁标准储备液准确称取0.702 0 g NH 4Fe(S0 4) 2·6H 20置于烧杯中,加少量水和20 mL 1:1H 2S0 4溶液,溶解后,定量转移到1L容量瓶中,用水稀释至刻度,摇匀。 (2)10-3 moL-1 铁标准溶液可用铁储备液稀释配制。 (3)100 g·L-1 盐酸羟胺水溶液用时现配。
(4)1.5 g·L-1 邻二氮菲水溶液避光保存,溶液颜色变暗时即不能使用。 (5)1.0 mol·L-1 叫乙酸钠溶液。 (6)0.1 mol·L-1 氢氧化钠溶液。 三、实验步骤 1.显色标准溶液的配制在序号为1~6的6只50 mL容量瓶中,用吸量管分别加入0,0.20,0.40,0.60,0.80,1.0 mL铁标准溶液(含铁0.1 g·L-1 ),分别加入1 mL 100 g·L-1 盐酸羟胺溶液,摇匀后放置2 min,再各加入2 mL 1.5 g·L-1邻二氮菲溶液、5 mL 1.0 mol·L-1 乙酸钠溶液,以水稀释至刻度,摇匀。 2.吸收曲线的绘制在分光光度计上,用1 cm吸收池,以试剂空白溶液(1号)为参比,在440~560 nm之间,每隔10 nm测定一次待测溶液(5号)的吸光度A,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,从而选择测定铁的最大吸收波长。 3.显色剂用量的确定在7只50 mL容量瓶中,各加2.0 mL 10-3 mol·L-1铁标准溶液和1.0 mL 100 g·L-1 盐酸羟胺溶液,摇匀后放置2 min。分别加入0.2, 0.4,0.6,0.8,1.0,2.0,4.0 mL 1.5 g·L-1 邻二氮菲溶液,再各加5.0 mL 1.0 mol·L-1
邻二氮菲分光光度法测定微量铁 一、实验目的 1、学会吸收曲线及标准曲线的绘制,了解分光光度法的基本原理。 2、掌握用邻二氮菲分光光度法测定微量铁的方法原理。 3、学会721型分光光度计的正确使用,了解其工作原理。 4、学会数据处理的基本方法。 5、掌握比色皿的正确使用。 二、实验原理 根据朗伯-比耳定律:A=εbc,当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比。只要绘出以吸光度A 为纵坐标,浓度c为横坐标的标准曲线,测出试液的吸光度,就可以由标准曲线查得对应的浓度值,即未知样的含量。同时,还可应用相关的回归分析软件,将数据输入计算机,得到相应的分析结果。 用分光光度法测定试样中的微量铁,可选用显色剂邻二氮菲(又称邻菲罗啉),邻二氮菲分光光度法是化工产品中测定微量铁的通用方法,在pH值为2-9的溶液中,邻二氮菲和二价铁离子结合生成红色配合物: =21.3,摩尔吸光系数ε510 = 1.1×104L·mol-1·cm-1,而Fe3+此配合物的lgK 稳 =14.1。所以在加入显色剂之前,能与邻二氮菲生成3∶1配合物,呈淡蓝色,lgK 稳 应用盐酸羟胺(NH2OH·HCl)将Fe3+还原为Fe2+,其反应式如下: 2Fe3+ + 2NH2OH·HCl → 2Fe2+ + N2 + H2O + 4H+ + 2Cl- 测定时酸度高,反应进行较慢;酸度太低,则离子易水解。本实验采用HAc-NaAc缓冲溶液控制溶液pH≈5.0,使显色反应进行完全。 为判断待测溶液中铁元素含量,需首先绘制标准曲线,根据标准曲线中不同浓度铁离子引起的吸光度的变化,对应实测样品引起的吸光度,计算样品中铁离
炉来汽 = 清水 1204.1萃取罐 加料 FRCQ5002/80 SS-5002-1 HS-5006-1/50 HS-5001/50 TV-5001/40 SS-5002-2 HS-5006-2/50 HS- 5007-3/50 SS-5003-3 SS-5002-3 1210水加热器 1211热水泵1.5KW SS-5004-1 SS-5004-2 SS-5004-3 1204.2萃取罐 1204.3萃取罐 1205.1 HS-5005-1/50 HS-5005-2/50 HS 5005-3/50 1224.1 中间加热器 1224.2 中间加热器 1224.2 中间加热器 DM5001-1 DM5001-2 DM5001-3 HK-5002-2
1204.4萃取罐 HS-5003-4/50 TV-5003-4/25 SS-5002-4 SS-5002-5 HS- 5007-6/50 SS-5003-4 SS-5003-6 SS-5002-6 SS-5004-4 SS-5004-5 SS-5004-6 1204.5萃取罐 1204.6萃取罐 1224.6 中间加热器 HS-5005-5/50 HS-5005-6/50 1224.5 中间加热器 1224.4 中间加热器 DM5001-6
加料 SS-6002-1 HS-6006-2/50 FRCQ-6002-1 SS-6004-1 1146水加热器1147热水泵 1.5KW 1108.1萃取罐 1108.2萃取罐 管道泵1.5KW HK-6002-1 HS-6005-2/50 1107.1 中间加热器 1107.2 中间加热器 DM6001-1 DM6001-2
邻二氮菲分光光度法测定铁 刘红阳 63 一、实验目的 1、学习测定微量铁的通用方法; 2、掌握分光光度法分析的基本操作及数据处理方法; 3、初步了解分光光度法分析实验条件研究的一般做法。 二、实验原理 一般选择络合物的最大吸收波长为工作波长。控制溶液酸度是显色反应的重要因素。因为多数显色剂是有机弱酸或弱碱,溶液的酸度会直接影响显色剂的理解程度,从而影响显色反应的完全程度及络合物的组成。另一方面,酸度大小也影响着金属离子的存在状态,因此也影响了显色反应的程度。应当确定显色剂加入量的合适范围。不同显色反应的络合物达到稳定所需要的时间不同,且达到稳定后能维持多久也大不相同。大多数显色反应在室温下就能很快完成,但有些反应必须加热才能较快进行。此外,加入试剂的顺序、离子的氧化态、干扰物质的影响等,均需一一加以研究,以便拟定合适的分析方案,使测定既准确,又迅速。本实验通过对铁(Ⅱ)-邻二氮菲显色反应的条件实验,初步了解如何拟定一个分光光度法分析实验的测定条件。 邻二氮菲是测定铁的高灵敏性、高选择性试剂之一,邻二氮菲分光光度法是化工产品中微量铁测定的通用方法。在pH2~9的溶液中,Fe2+和邻二氮菲生成1:3 橘红色络合物,lgβ 3=(20℃),ε 508 =×104L·mol-1·cm-1,其吸收曲线如图一所 示;Fe3+亦可以与邻二氮菲生成蓝色络合物,因此,在显色前需用盐酸羟胺溶液将全部的Fe3+还原为Fe2+。反应式如下(和图二): 2Fe3++2NH 2OH===2Fe2++N 2 ↑+2H 2 O+2H+
Fe2++3 N N Fe 2+ 图一图二 用分光光度法测定物质的含量,一般采用校准曲线法(又称工作曲线法),即配制一系列浓度有小到大的标准溶液,在选定条件下依次测量各标准溶液的吸光度A,在被测物质的一定浓度范围内,溶液的吸光度与其浓度呈线性关系(邻二氮菲测Fe2+,浓度在0~μg·mL-1范围内呈线性关系)。以溶液的浓度为横坐标,相应的吸光度为纵坐标,绘制出校准曲线。测绘校准曲线一般要配制3~5 个浓度递增的标准溶液,测出的吸光度至少要有三个点在一条直线上。作图时,坐标选择要合适,使测量数据的有效数字位数与坐标的读数精度相符合。 测定未知样时,操作条件应与测绘校准曲线时相同。根据测得的吸光度从校准曲线上查出相应的浓度,就可计算出试样中被测物质的含量。通常应以试剂空白溶液为参比溶液,调节仪器的吸光度零点。 三、实验试剂与仪器 试剂:·L-1乙酸钠溶液,·L-1柠檬酸(H 3C 6 H 5 O 7 ·H 2 O)溶液,%盐酸羟胺(NH 2 OH·HCl) 溶液,%邻二氮菲溶液,μg·mL-1标准铁溶液。
水质铁的测定邻菲啰啉分光光度法 (量程:0.12~5mg/L) 1 适用范围 本标准适用于地表水、地下水及废水中铁的测定。方法最低检出浓度为0.03mg/L,测定下限为0.12mg/L,测定上限为 5.00mg/L。对铁离子大于 5.00mg/L 的水样,可适当稀释后再按本方法进行测定。 2 原理 亚铁离子在pH3~9 之间的溶液中与邻菲啰啉生成稳定的橙红色络合物,其反应式为: 此络合物在避光时可稳定保存半年。测量波长为510nm,其摩尔吸光系数为 1.1×10 4 L·mol-1·cm-1。若用还原剂(如盐酸羟胺)将高铁离子还原,则本法可测高铁离子及总铁含量。 3 试剂 本标准所用试剂除另有注明外,均为符合国家标准的分析纯化学试剂;实验用水为新制备的去离子水。 3.1 盐酸(HCl):ρ20=1.18g/mL,优级纯。 3.2 (1+3)盐酸。 3.3 10%(m/V)盐酸羟胺溶液。 3.4 缓冲溶液:40g 乙酸铵加50mL 冰乙酸用水稀释至100mL。 3.5 0.5%(m/V)邻菲啰啉(1,10-phenanthroline)水溶液,加数滴盐酸帮助溶解。 3.6 铁标准贮备液: 准确称取0.7020g 硫酸亚铁铵((NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O),溶于(1+1)硫酸50mL 中,转移至1000mL容量瓶(A 级)中,加水至标线,摇匀。此溶液每毫升含100μg 铁。 3.7 铁标准使用液: 准确移取铁标准贮备液(3.6)25.00mL 置100mL 容量瓶(A 级)中,加水至标线,摇匀。此溶液每毫升含25.0μg 铁。
4 仪器 分光光度计,10mm 比色皿。2 5 干扰的消除 强氧化剂、氰化物、亚硝酸盐、焦磷酸盐、偏聚磷酸盐及某些重金属离子会干扰测定。经过加酸煮沸可将氰化物及亚硝酸盐除去,并使焦磷酸、偏聚磷酸盐转化为正磷酸盐以减轻干扰。加入盐酸羟胺则可消除强氧化剂的影响。 邻菲啰啉能与某些金属离子形成有色络合物而干扰测定。但在乙酸-乙酸铵的缓冲溶液中,不大于铁浓度10 倍的铜、锌、钴、铬及小于2mg/L 的镍,不干扰测定,当浓度再高时,可加入过量显色剂予以消除。汞、镉、银等能与邻菲啰啉形成沉淀,若浓度低时,可加过量邻菲啰啉来消除;浓度高时,可将沉淀过滤除去。水样有底色,可用不加邻菲啰啉的试液作参比,对水样的底色进行校正。 6 步骤 6.1 校准曲线的绘制 依次移取铁标准使用液(3.7)0、2.00、4.00、6.00、8.00、10.0mL 置150mL 锥形瓶中,加入蒸馏水至50.0mL,再加(1+3)盐酸(3.2)1mL,10%盐酸羟胺1mL,玻璃珠1~2 粒。加热煮沸至溶液剩15mL 左右,冷却至室温,定量转移至50mL 具塞比色管中。加一小片刚果红试纸,滴加饱和乙酸钠溶液至试纸刚刚变红,加入5mL 缓冲溶液(3.4)、0.5%邻菲啰啉溶液(3.5)2mL,加水至标线,摇匀。显色15min 后,用10mm 比色皿(若水样含铁量较高,可适当稀释;浓度低时可换用30mm 或50mm 的比色皿),以水为参比,在510nm 处测量吸光度,由经过空白校正的吸光度对铁的微克数作图。各批试剂的铁含量如不同,每新配一次试液,都需重新绘制校准曲线。 6.2 总铁的测定 采样后立即将样品用盐酸(3.1)酸化至pH<1(含CN -或S 2 -离子的水样酸化时,必须小心进行,因为会产生有毒气体),分析时取50.0mL 混匀水样于150mL 锥形瓶中,加(1+3)盐酸(3.2)1mL,盐酸羟胺溶液(3.3)1mL,加热煮沸至体积减少到15mL 左右,以保证全部铁的溶解和还原。若仍有沉淀应过滤除去。以下按绘制校准曲线同样操作,测量吸光度并作空白校正。 6.3 亚铁的测定 采样时将2mL 盐酸(3.1)放在一个100mL 具塞的水样瓶内,直接将水样注满样品瓶,塞好瓶塞以防氧化,一直保存到进行显色和测量(最好现场测定或现场显色)。分析时只需取适量水样,直接加入缓冲溶液(3.4)与邻菲啰啉溶液(3.5),显色5~10min,在510nm 处以水为参比测量吸光度,并作空白校正。 6.4 可过滤铁的测定 在采样现场,用0.45μm 滤膜过滤水样,并立即用盐酸酸化过滤水至pH<1,准确吸取样品50mL置于150mL 锥形瓶中,以下操作与步骤6.1 相同。 7 结果的计算 铁的含量按下式计算: