
第22卷 第4期大学化学2007年8
月
手性化合物的命名
王永梅 张文昊 翟玉平
(南开大学材料化学系 天津300071)
摘要 在总结各种手性化合物命名的基础上,加入了硅,氮,磷,硫,砷手性化合物的命名,着重阐述了新型手性分子的命名法则,并配以实例说明。
随着不对称合成的快速发展,手性化合物的结构和类型日渐丰富。手性碳化合物绝对构型的命名已为人们熟知,而新的手性化合物,如平面手性、螺手性的命名成为需要解决的问题。本文在总结前人工作的基础上,较全面地归纳了各种手性化合物的命名。
1 手性化合物的分类
分子存在手性的条件是分子实物和镜像不能重合。
分子结构是整个命名系统的基础,是命名法的根据。按分子结构可以把手性分子分为6类。
1.1 中心手性
图1显示了几种不同的手性中心,以手性中心为特征的分子称为中心手性化合物。特点是中心原子连有4个不同的基团(或孤对电子)。中心原子可以是主族的C,Si,N,P,A s,S,Ge 等,也可是副族的Mn,Cu,B i,Zn 等
。
图1 不同的手性中心
图2 轴手性化合物(丙二烯) 1.2 轴手性 轴手性在结构上可看作中心手性的衍生。分子中的4个
基团分为两对排列在手性轴的两端。当每对中的两个基团都不相同时,分子有手性。这类化合物包括:丙二烯型,
环己烷 图3 平面手性化合物
型,螺环型和联芳型(图2)。
1.3 平面手性
分子中某一平面两侧的结构不对称,这类化合物称为平
面手性化合物。图3分子中苯环所在平面为手性平面。
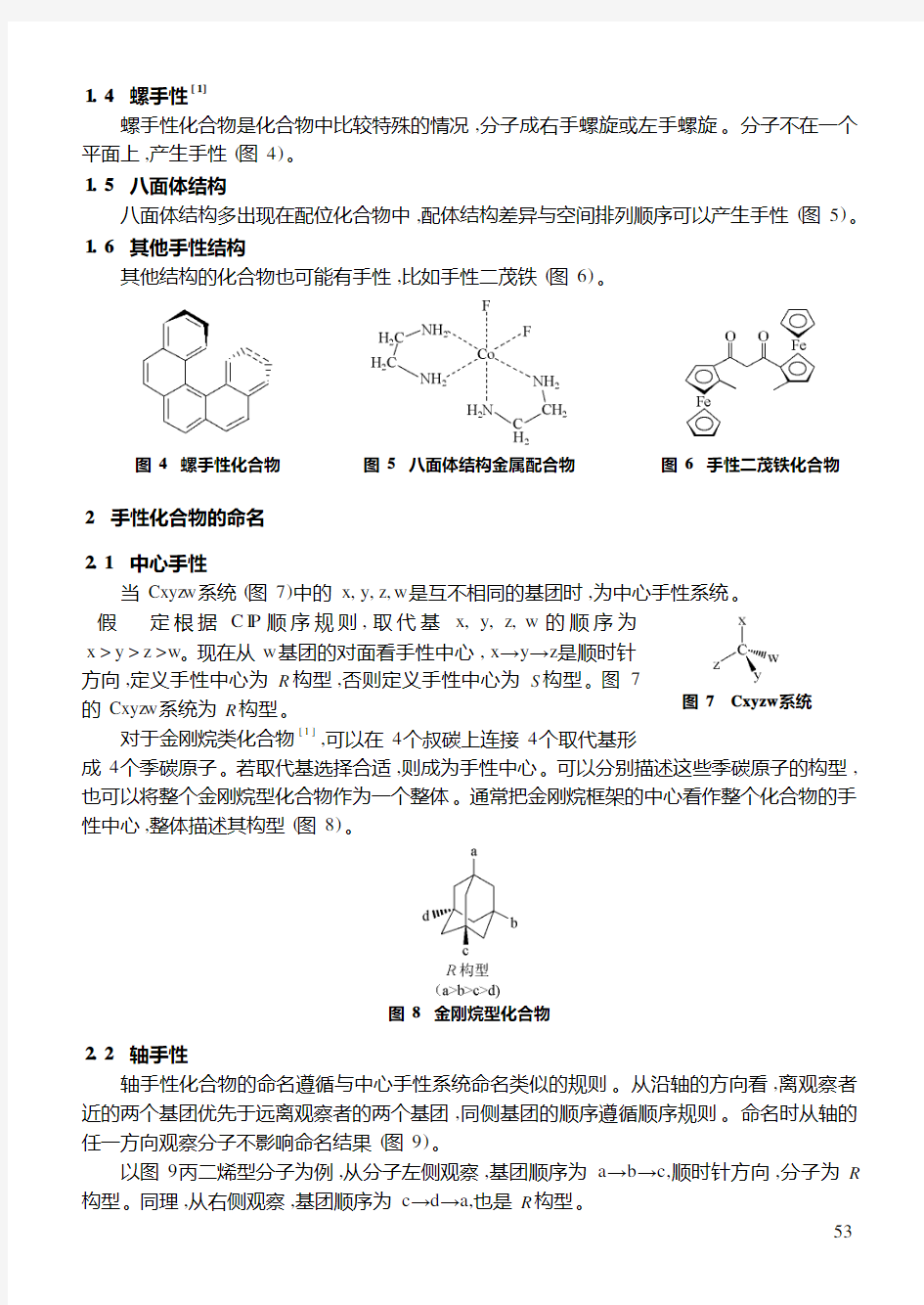
1.4 螺手性[1]
螺手性化合物是化合物中比较特殊的情况,分子成右手螺旋或左手螺旋。分子不在一个平面上,产生手性(图4)。
1.5 八面体结构
八面体结构多出现在配位化合物中,配体结构差异与空间排列顺序可以产生手性(图5)。
1.6 其他手性结构
其他结构的化合物也可能有手性,比如手性二茂铁(图6)
。
图5 八面体结构金属配合物
图4 螺手性化合物
图6 手性二茂铁化合物
2 手性化合物的命名
2.1 中心手性
当Cxyz w 系统(图7)中的x,y,z,w 是互不相同的基团时,为中心手性系统
。
图7 Cxyzw 系统 假定根据C I P 顺序规则,取代基x,y,z,w 的顺序为
x >y >z >w 。现在从w 基团的对面看手性中心,x →y →z 是顺时针
方向,定义手性中心为R 构型,否则定义手性中心为S 构型。图7
的Cxyz w 系统为R 构型。
对于金刚烷类化合物[1],可以在4个叔碳上连接4个取代基形
成4个季碳原子。若取代基选择合适,则成为手性中心。可以分别描述这些季碳原子的构型,也可以将整个金刚烷型化合物作为一个整体。通常把金刚烷框架的中心看作整个化合物的手性中心,整体描述其构型(图8)
。
图8 金刚烷型化合物
2.2 轴手性 轴手性化合物的命名遵循与中心手性系统命名类似的规则。从沿轴的方向看,离观察者近的两个基团优先于远离观察者的两个基团,同侧基团的顺序遵循顺序规则。命名时从轴的任一方向观察分子不影响命名结果(图9)。
以图9丙二烯型分子为例,从分子左侧观察,基团顺序为a →b →c,顺时针方向,分子为R 构型。同理,从右侧观察,基团顺序为c →d →a,也是R 构型。
图9 轴手性化合物的命名
(从分子左侧观察)
图10中上半部分的直箭头表示沿手性轴的观察方向,下半部分表示该观察方向分子特征基团的顺序。命名举例见图11。
图10 轴手性化合物
图11 轴手性化合物举例
2.3 平面手性[1]
命名此类化合物应首先选择包含原子数最多的平面作为手性平面。然后选择导引原子,选择离手性平面最近的、优先级最高的原子作为导引原子(图12)。从与导引原子相连的手性平面中的原子开始编号,在平面上依次沿邻接的优先级最高的原子编号。从导引原子的方向看手性平面,如果编号沿顺时针,此分子记为pR,如果编号沿逆时针,此分子记为pS。p表示平面手性。命名举例见图13。
图12 一些平面手性化合物
(a )导引原子C,原子顺序O →C 2→C 3→B r,逆时针方向,构型pS 。
(b )导引原子C,原子顺序C 1→C 2→C 3→B r,逆时针方向,构型pS 。
(c )(d )金属配合物,η62π键可看成被6个σ键取代(d ),整个分子的手性可由手性平面上最优先原子(箭
头所指)的手性决定:将该原子看成中心手性系统的中心原子,连结金属原子和环上与之相连的3个原子。
该中心原子的手性即为整个分子的手性。(c )(d )的手性都是pS
。
图13 R 2(–)2反2环辛烯[8]
由于环的张力,与烯碳相连的两个碳原子并不在双键平面上。
2.4 螺手性[1]
螺手性化合物是化合物中比较特殊的情况,分子成右手螺旋或左手螺旋,分别记为M 和P 。从螺旋轴的顶部看,顺时针方向的螺旋记为P ,逆时针方向的螺旋记为M (图14)
。
图14 螺手性化合物的命名
2.5 八面体结构[1]
将顺序规则扩展后可以把按八面体结构排列的原子或基
团按优先级排序。顺序规则应用于六取代的分子时比较特
殊。将取代基中优先级最高的基团编为1号(按普通顺序规
则),与1号基团相对的基团编为6号(不管其优先级),如果
1号空缺则将基团中优先级最小的基团编为6号。其余4个
基团成一个平面,通常将平面上优先级最高的编为2号。与2
号相邻的优先级最高的基团编为3号。观察者面对由1,2,3号组成的平面,如果1,2,3编号沿顺时针,记整个分子为R 构型,反之记为S 构型(图15)
。图15 八面体结构化合物的命名
3 其他元素形成的手性化合物
从原子结构和成键看,与碳元素相似的元素主要有硅,氮,磷,硫,砷。下面分别简要介绍。
3.1 硅
硅和碳是同族元素,成键形式相同,命名硅的手性化合物可按命名手性碳的法则直接命名,在此不赘述。
3.2 氮[9]
胺类化合物有3个基团和一对孤对电子,成假四面体排列,在连有3个不同的取代基时是有手性的。在正常情况下,构型快速翻转,对映异构体是无法拆分的。若孤对电子被固定,如成季铵盐、叔胺的氧化物等,或氮原子处于构型稳定的杂环上或环中,无法反转,对映异构体就可以拆分。命名举例见图16~图18。
图16 带有一个正电荷的不对称季铵盐
图17 不对称叔氨的氧化物
图18 氮的轴手性化合物
3.3 磷和砷[9]
膦,胂与胺不同,在常温下构型的翻转可以忽略。无论是三价的膦和胂或带正电荷的四级鏻盐和鉮盐,还是膦酸的五价衍生物,所连基团不同时都可以具有手性,能够拆分对映异构体。命名举例见图19。
3.4 硫[9]
以硫为中心元素的手性化合物包括各种不对称取代的多价硫化合物。无论是锍盐,亚磺酸酯,或是亚砜都可以成为能够拆分的手性化合物。
命名举例见图20。
图19 磷和砷的手性化合物命名举例
图20 硫的手性化合物命名举例
参 考 文 献
1 L in G Q,L i Y M,Chan A S C.Princi p les and App licati ons of A sy mmetric Synthesis.Electr onic Editi on.Ne w York:John W iley &Sons,2001
2 Agosta W C.J Am Che m Soc,1964,86:2638
3 W atersW L,L inn W S,Caseri o M C.J Am Che m Soc,1968,90:6741
4 B re wster J H,Privett J E.J Am Che m Soc,1966,88:1419
5 B r owne P A,HarrisM M,Singh S.J Che m Soc,1971,3990
6 Pignolet L H,Tayl or R P,Horr ocksW D J r.Che m Co mm un,1968,1443
7 Hulshof L A,McKervey M A,W ynberg H,J Am Che m Soc,1974,96:3906
8 Cope A C,Mehta A S.J Am Che m Soc,1964,86:1268
9 叶秀林.立体化学.北京:北京大学出版社,1999
分子的手性和旋光性 【摘要】长久以来,分子的手性和旋光性都受到了人们的密切关注。这些性质既带给了人们便利,也给人们造成了伤害。本文讲述了手性和旋光性的基本信息,详细阐述了它们的判断方法,着重说明了它们的应用领域和对人类生活的影响,文章的最后还提出了一些手性分子的合成方法。 【关键词】手性;旋光性;判断方法;应用;合成 1.分子的手性 1.1分子手性的概念 手性分子,是化学中结构上镜像对称而又不能完全重合的分子。碳原子在形成有机分子的时候,4个原子或基团可以通过4根共价键形成三维的空间结构。由于相连的原子或基团不同,它会形成两种分子结构。这两种分子拥有完全一样的物理和化学性质。但是从分子的组成形状来看,它们依然是两种分子。这种情形就像镜子里和镜子外的物体那样,看上去互为对应,可是由于是三维结构,它们不管怎样旋转都不会重合,就如同人们的左手和右手。这两种分子具有手性,所以叫手性分子。由于这两种分子互为同分异构体,所以这种异构的形式称为手性异构,有R型和S型两类。 1.2发展历史 在偏振光发现之后,人们很快认识到某些物质能使偏振光的偏振面发生偏转,产生旋光现象。1848年法国巴黎师范大学年轻的化学家Pastenr通过细心研究发现了酒石酸钠铵的晶体及水溶液的旋光现象,从而得出物质的旋光性与分子内部结构有关,提出了对应异构体的概念。人们在研究对应异构体时发现,在左旋和右旋两种对应异构体的分子中,原子在空间的排列是不重合的实物和镜像关系,这与左受和右手互为不能重合的实物和镜像关系类似,从而引入了手性及手性分子的概念。 1.3分子手性的判断方法 物质分子凡在结构上具有对称面和对称中心的,就不具有手性。反之,在结构上既不具有对称面,也不具有对称中心的,这种分子就有手性。具有手性的分子称为手性分子。 1.3.1对称轴 这种轴是通过物体或分子的一条直线,以这条直线为轴旋转一定的角度,得到的物体或分子的形象和原来的形象完全相同,这种轴称为对称轴。n指绕轴一周,有n个形象与原形象相同。
浅谈手性化合物与现代医学 一、手性化合物简介 手性化合物(chiral compounds)是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物。判断分子有无手性的可靠方法是看有没有对称面和对称中心。 手性问题与我们的日常生活密切相关。天然存在的手性化合物品种很多,并且通常只含有一种对映体,手性问题还牵涉到农业化学、食品添加剂、饮料、药物、材料、催化剂等诸多领域。它的研究已经成为科学研究和很多高科技新产品开发的热点。在过去20年里,手性研究具有戏剧性的发展,已从过去的少数几个专家的学术研究发展到大面积科学研究的需要,在一些领域并已带来了巨大的经济效益。物质的手性已经变成越来越需要考虑的问题,其对我们的日常生活正在起到越来越重要的作用。 手性化合物主要从天然来源、不对称合成和外消旋体拆分3个方面得到。由天然来源获得手性化合物,原料丰富,价廉易得,生产过程简单,产品的纯度一般都较高,因此很多量大的产品都是从天然物中获得。在药物工业中由于对手性药物的要求不断增加,其大大激发了不对称有机合成的发展,使一些生物技术、生物催化剂也迅速扩展到该领域产生纯的的手性中间体和手性产品。 二、手性药物 由于自然界的生命体存在有手性,因而也就产生了手性药物。手性药物指分子结构中存在手性因素的药物。通常是指由具有药理活性的手性化合物组成的药物,或者是只含有效对映体或是以有效对映体为主的药物。按药效方面的简单划分,手性药物可能存在以下几种不同的情况:①只有一种对映体具有所要求的药理活性,而另一种对映体没有药理作用或活性很小。②一对对映体中的两个化合物具有等同或近乎等同的同一药理活性。③一对对映体具有完全不同的药理活性。 ④一对对映体之间一个有药理活性,另一个不但没有活性,甚至表现出一定的毒副作用。⑤一对对映体之间药理活性相近,但存在个体差异。⑥一对对映体中,一个有活性,另一个却发生拮抗作用。 三、手性药物未来展望 手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予在分子不对称催化反应中做出杰出贡献的三位科学家。目前,世界单一对映体手性药物的销售额持续增长。1998年销售额已达到964亿美元。2000年的销售额为1330亿美元,并估计2008年达到2000亿美元。手性药物以其疗效高、毒副作用小、用药量少的优点满足了市场的需求,因而成为未来新药研发的方向。
Chirality Direct chiral discrimination in NMR The calculated isotropic component of the proton magnetic shielding polarizability for hydrogen peroxide (H2O2) is shown as a function of dihedral angle (_, as defined in the inset). The two enantiomers are R-HOOH for dihedral angles <180° and S-HOOH for dihedral angles >180°. σ(1)(N) is obtained from finite field calculations at the SCF level. The solid line is to guide the eye, and 1 ppm a.u. = 1.9446 _ 10-18 m/V. Nuclear magnetic resonance (NMR) spectroscopy is an important technique for determining the structure of molecules in solution. NMR can, however, not yet be used to determine the absolute configuration of chiral molecules in a pure liquid, as the chemical shifts and spin-spin coupling constants are identical for the two enantiomers of a chiral molecule. All NMR-based methods for chiral discrimination have therefore required that the chiral solute be in the presence of a chiral reagent or solvent. However, the electric-field perturbed chemical shift tensor, the nuclear magnetic shielding polarizability σ(1)(N), gives rise to three chiral NMR effects in a liquid that could make it possible to discriminate directly between the enantiomers of a chiral molecule: The coherent precession of nu clear spins following application of a π/2 pulse to an optically active liquid will lead to a rotating macroscopic electric polarization [1]; a laser polarized in the plane perpendicular to the field of the magnet may in principle give rise to chiral chemical shifts; and the application of an (oscillating) electric field at right angles to the magnetic field of the spectrometer may
手性化合物 手性化合物是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物 什么是手性? 当我们伸出双手,双手手心向上时,可以看出左右手是对称的,但是将双只手叠合,无论如何也不能全部重叠,总有一部分是不能重合在一起的;如果我们将左手置于一面平面镜前,手心对着镜子,可以看到镜子里的左手的像和右手手心对着自己一样,即左手的像和右手可以完全重叠。象这样左手和右手看来如同物与像,但又不能叠合在一起,互相成为“镜像”关系,就称之为“手性”。 有机化合物是含碳的化合物,一个碳原子的最外层上有四个电子,若以单键成键时,可以形成四个共价单键,共价键指向四面体的顶点,当碳原子连接的四个基团各不相同时,与这个碳原子相连接的四个基团有两种空间连接方式,这两种方式如同左右手,互为“镜像”,也是不能完全叠合在一起的,因此,这样的分子叫做“手性分子”。这种构成手性关系的分子之间,把一方叫做另一方的“对映异构体”。许多有机化合物分子都有“对映异构体”,即是具有“手性”。构成生物体的许多有机化合物都有“手性”。如α-氨基酸,在碳连接有一个羧基、一个氨基、一个烃基和一个氢原子(或一个不同于前边的烃基)*,这时你想将其中三个相同颜色的球重叠,但是余下的那个颜色的球总不能重叠。由这些手性氨基酸组成的蛋白质也就与“手性”有密切的关系,因此,生命生理活动中的许多现象与“手性”密不可分。 如何检验物质具有手性? 手性物质具有一特殊性质——旋光性,将纯净的手性物质的晶体,或是将纯净的手性物质配成一定浓度的溶液,用平面偏振光1照射,通过手性物质的偏振光平面会发生一定角度的旋转,这称为旋光性。这种偏振光的平面旋转可左可右,以顺时针方向旋转的对映体,称为右旋分子,用“+”或“d”表示;以逆时针方向旋转的对映体,称为左旋分子,用“-”或“l”;如果将互为对映体的手性物质等物质的量混合后,以偏振光照射,而偏振光不发生旋转,称为外消旋体或外消旋混合物,外消旋体是由于左旋分子和右旋分子发生的偏振光旋转
手性分子绝对构型的确定 手性分子可以分为下面几种类型:中心手性分子,轴手性分子,平面手性分子及螺旋手性分子。 下面用R/S 命名法依次对它们进行命名。 中心手性分子: 如果一个原子连接四个不同的基团,则称这个原子具有手性。常见的有C, N, P, S, Si, As 等原子。 判断方法:先将与手性原子相连的四个原子(团)按次序规则进行排列,然后将次序最小的原子(团)放在距观察者最远的位置,再观察其他3个原子(团)的排列次序,若由大到小的排列次序为顺时针方向,则R 为型,若为逆时针方向,则为S 型. e a 假定原子的优先次序为a >b > d >e b d 为顺时针方向,R 型 b d 为逆时针方向,S 型 轴手性分子:四个基团围绕一根轴排列在平面之外的体系,当每对基团不同时,有可能是不对称的。轴手性分子可分为以下几种类型: 丙二烯型分子:螺环型分子: 环外双键型分子: 联苯型分子: C 3 3 H 3 3 H 3 (远端) 逆时针方向,R 型 顺时针方向,R 型 (近端)逆时针方向,S 型 (近端)逆时针方向,S 型 从左向右看: 从左向右看: (远端) 判断方法:从左向右看,先看到的基团为近端,用实线表示,后看到的基团为远端,用虚线 表示,然后从近端的大基团看到近端的小基团再看到远端的大基团(不看远端的小基团),若为顺时针方向,则为则R 为型,若为逆时针方向,则为S 型. 平面手性分子:平面手性通过对称平面的失对称作用而产生,其手性取决与平面的一边与另
一边的差别,还取决与三个基团的种类。判断方法:第一步是选择手性平面,第二步是确定平面的优先边,这个优先边可以通过按标准的顺序规则在直接连接到平面原子的原子中找到哪一个是最优先的来确定。连接到平面的一套原子中的最优先原子,即先导原子或导向原子标记了平面的优先边(标记为1号),第二优先(标记为2号)给予手性平面直接与1号基团成轴连接的原子,等等,对于1-2-3为顺时针方向,则为R p 为型,若为逆时针方向,则为S p 型. 例如: S p 型R p 型 螺旋手性分子:螺旋性是手性的一个特例,其中分子的形状就像右的或左的螺杆或盘旋扶梯,从旋转轴的上面观察,看到的螺旋是顺时针方向的定为P 构型,而逆时针方向的定为M 构型. 例如: M 型 几个例子: 22 3 从上往下看: 顺时针方向,R 构型 近端 远端 从左向右看: R S 参考文献 《有机结构理论》,图书馆藏书
在有机合成中产生手性化合物的方法有4种: 1.使用手性的底物 2.使用手性助剂 3.采用手性试剂 4.使用不对称催化剂 常常需要使用天然产物,如:氨基酸、生物碱、羟基酸、萜、碳水化合物、蛋白质等。 1.使用手性的底物 这种方法局限于比较有限的天然底物 如图,该化合物的硼氢化反应中,由于羟基的作用产生另外新的立体中心(反应从分子的背后发生) 以下两个反应,第一个是由于羧基的控制得到相应的手性产物..另一个则是由于反应中间体烯醇阴离子的构象决定了构型 2.使用手性助剂 如图,在第一步使用LDA去质子化时,为了使得上边的醇锂和下边的烯醇锂相距最远,Z-异构体占优势,在下一步与EtI的反应中得以产生了立体中心。 类似地,用烯醇锆替代烯醇锂(使用LDA,ZrCp2Cl2)确保烯醇的构型,再和醛反应产生不对称中心。 这些反应多数通过手性助剂的金属原子和底物中已有手性的O、N等原子络合,之后再加入其他试剂实现不对称中心的形成。这其中手性唑啉环是一个非常不错的手性助剂,它水解后可以生成一个羧基(潜在官能团) 另外一个试剂是手性的3-烷基哌嗪-2,5-二酮(一个环状二肽,可由两个氨基酸环合生成),如图 在羰基的α位进行不对称烷基化使用的是以下两种试剂A和B(B称为SAMP),如图,对环己酮的反应中采用A得到S异构体而采用B得到R异构体.
在氨基的α位进行不对称烷基化使用的试剂如下二图,用胺和它们作用后再用LDA、MeI甲基化,最后用N2H4脱去助剂得到产物. 还有一些有趣的反应如脯氨酸的α烷基化,涉及到一个立体化学的"存储"问题,经历了一个消失和再产生的过程:: 手性亚砜的作用:分离得到手性亚砜试剂和卤代烷作用后在下一步反应中诱导手性基团的产生,Al/Hg可以方便地除去亚砜基团。 3.采用手性试剂 通过铝锂氢化物与手性二胺或氨基醇作用可以得到一个用于不对称还原的试剂。如图。 利用α-蒎烯和9-BBN作用得到的试剂是一个很好的不对称还原试剂.如图 不对称硼氢化反应也是一个很好的构造立体化学中心的反应。这里需要利用α-蒎烯(图中的反应是针对三取代烯烃的,对于双取代烯烃应采用条件温和的双取代硼烷)
不对称分子及生命分子的手性起源 王丁众钟绮文江来田松海张威关键词:不对称,光活性,起源 一、不对称分子 在引出这个概念之前,我们先看什么是对称分子。对称分子有以下几种对称因素: 1、平面对称因素即存在一个平面把分子分成两部分,这个平面好像一个镜子,镜外实体的镜象可与镜内实体重叠,如CH2=CH 2、C6H6、CO2等。 2、反射对称因素检查是否存在这种因素时,一般需经两个操作:先将分子通过一个轴旋转2π/n度,然后用一个垂直这个轴的镜面反射,如果镜内的镜象和镜外未旋转前的实 体完全重叠,如分子,这种具有n次反射对称轴的分子也为对称分子。 3、简单轴对称因素即以一条直线为旋转轴旋转2π/n度,得到的分子与原分子可以重叠,n表示轴的级,称n重轴,如氨分子有一个三重轴。但需注意的是,如果分子中不含其它对称因素,只有简单旋转轴因素,它们就必定和其镜象不重叠,这就是我们要说的不对称分子,又叫手性分子,如L-酒石酸、D-酒石酸。 由此我们可以引出不对称分子(即手性分子)的概念:在三维空间中实体与其镜象或经轴旋转后的镜象不重叠的分子,即为不对称分子。 旋光性是手性分子的重要特征。不对称分子的实体和镜象─—左手性分子(用L表示)和右手性(用D表示)─—互称对映体。它们的差别在于对偏振光作用不同:一个可以把偏振光向左旋,另一个则把偏振光向右旋。 二、不对称分子对生命的意义 1、不对称分子是生命的物质基础。 生命的基本物质是核酸和蛋白质。核酸和蛋白质以及糖元、淀粉、纤维素、磷脂等都有右手螺旋结构(可用右手螺旋方法判断),螺旋型分子均是不对称分子,而它们的单体如核苷酸、氨基酸等,也都是不对称分子。 2、光学活性是生命有序性和组织化的基础 生命是一个非常高度组织化了并高度有序的体系。为了生成这样的体系,就只能有一种对映体作为形成生物分子的空间结构,如组成生命蛋白质的氨基酸都是L型,组成核酸的核糖和脱氧核糖分子都是D型。 试想如果没有这种光学活性,会怎样呢?例如由100个谷氨酸组成的α一聚谷氨酸大分子,组成单元具有同一旋光性的,就只能生成一种α一聚谷氨酸。相反,若这100个氨基酸分子是L型和D型的混合物,则这100个氨基酸组成的聚合分子的异构体将有2100个之多,这样的分子根本构不成高度有序的生命分子。 3、生物大分子手性是识别生命与非生命的探针 在地球上的生命组织的蛋白质中,氨基酸都是L型;核酸中,核糖和脱氧核糖总是D
什么是手性分子 英文名:chiral molecules 我们知道,生命是由碳元素组成的,碳原子在形成有机分子的时候,4个原子或基团可以通过4根共价键形成三维的空间结构。由于相连的原子或基团不同,它会形成两种分子结构。这两种分子拥有完全一样的物理、化学性质。比如它们的沸点一样,溶解度和光谱也一样。但是从分子的组成形状来看,它们依然是两种分子。这种情形像是镜子里和镜子外的物体那样,看上去互为对应。由于是三维结构,它们不管怎样旋转都不会重合,就像我们的左手和右手那样,所以又叫手性分子。 对于非碳原子手性中心的分子,只要没有对称面和对称中心即为手性分子。 手性分子的基本标志 一个化合物的分子与其镜像不能互相叠合,则必然存在一个与镜像相应的化合物,这两个化合物之间的关系,相当于左手和右手的关系,即互相对映。这种互相对应的两个化合物成为对映异构体(enantiomers)。这类化合物分子成为手性分子(chiral molecule)。不具有对称面和对称中心的分子有一个重要的特点,就是实体和镜象不能重叠,镜面不对称性是识别手性分子与非手性分子的基本标志。 生物分子手性原则是什么 生物分子都有手性,即分子形式的右撇子和左撇子(或左旋、右旋)。在法国生物学家巴斯德发现酒石酸晶体的镜像后就更激起了科学家的兴趣。然而,手性分子是如何形成的却一直让人迷惑不解。过去,生物化学领域趋向于认为,单一手性形式的分子合成通常从一开始就要利用手性本体,也就是说生物分子自身在催化着手性形式的形成。而且在一些化学反应中手性产物的形成进一步扩大了。 2006年6月16日出版的英国《自然》刊发文章称,最近,美国研究人员发现,物质的固(体)-液(体)相平衡可能参与了生物分子手性的形成。比如,氨基酸固(体)-液(体)相的平衡,可以由刚开始时的小小的不平衡导致严重偏向一种手性形式,即左旋或右旋。而这种现象出现在水溶液中,因而也可以解释生命起源以前的左手性和右手性,即为何左右手性数量相当的分子为何会转变成生物分子偏爱一种手性。而物质世界中有活性作用的分子常常是左旋,如左旋糖苷。 手性分子的药用价值 手性是生命过程的基本特征,构成生命体的有机分子绝大多数都是手性分子。人们使用的药物绝大多数具有手性,被称为手性药物。手性药物的“镜像”称为它的对映体,两者之间在药力、毒性等方面往往存在差别,有的甚至作用相反。20世纪60年代一种称为反映停的手性药物(一种孕妇使用的镇定剂,已被禁用)上市后导致1.2万名婴儿的生理缺陷,因为反映停的对映体具有致畸性。因此,能够独立地获得手性分子的两种不同镜像形态极为重要。生命的手性之分 作为生命的基本结构单元,氨基酸也有手性之分。也就是说,生命最基本的东西也有左右之分。 惊人的发现---组成地球生命体的几乎都是左旋氨基酸,而没有右旋氨基酸 我们已经发现的氨基酸有20多个种类,除了最简单的甘氨酸以外,其它氨基酸都有另一种手性对映体!那么,是不是所有的氨基酸都是手性的呢?答案是肯定的,检验手性的最好方法就是,让一束偏振光通过它,使偏振光发生左旋的是左旋氨基酸,反之则是右旋氨基酸。通过这种方法的检验,人们发现了一个令人震惊的事实,那就是除了少数动物或昆虫的特定
有机化学之浅谈分子手性 有机化学是化学、化工、轻工、环工医药类各专业的一门重要的基础课,而立体化学是有机化学的一个重要组成部分,它的内容主要是研究有机化合物分子的三度空间结构、立体结构及其对化合物的物理性质和化学性质的影响,其中又以对映异构现象为重点。学习对应异构不仅可以锻炼我们学生的空间想象能力,也能锻炼学生的思维能力,这对于我们学生的成长有着积极影响。 学习认知 在学习立体化学时,难点就是分子的手性,接下来我们主要研究分子的手性 我们知道,生命是由碳元素组成的,碳原子在形成有机分子的时候,4个原子或基团可以通过4根共价键形成三维的空间结构。由于相连的原子或基团不同,它会形成两种分子结构。这两种分子拥有完全一样的物理、化学性质。比如它们的沸点一样,溶解度和光谱也一样。但是从分子的组成形状来看,它们依然是两种分子。这种情形像是镜子里和镜子外的物体那样,看上去互为对应。由于是三维结构,它们不管怎样旋转都不会重合,就像我们的左手和右手那样,所以又叫手性分子。 对于非碳原子手性中心的分子,只要没有对称面和对称中心即为手性分子。 一个化合物的分子与其镜像不能互相叠合,则必然存在一个与镜像相应的化合物,这两个化合物之间的关系,相当于左手和右手的关系,即互相对映。这种互相对应的两个化合物成为对映异构体。这类化合物分子成为手性分子。不具有对称面和对称中心的分子有一个重要的特点,就是实体和镜象不能重叠,镜面不对称性是识别手性分子与非手性分子的基本标志。 分子的手性和分子结构的对称性有密切联系。化合物分子存在的对称因素有:对称轴(旋转轴)、对称面、对称中心和交替对称轴旋转反映轴,在课堂学习时,重点应放在对一个分子有没有对称中心和对称面的考察上。一般地说,有机物分子只要既没有对称中心,又没在对称面存在,就可以断定它是个手性分子了。会有个别例外情况,但不是主要问题。所以只要对这个问题掌握了就会比较容易地判断有机化合物分子是否存在手性,同时对立体化学中内消旋体概念的理解也会有较大的帮助。 命名学习 R/S构型命名法 顺序规则:,是由Cahn和Ingold等人从1951年开始提出的,经过修改定型60年代中期,又被称为CIP系统,随后被IUPAC(国际纯粹和应用化学联合会)采用,得到国际上的普遍应用,用R或S符号指明分子构型的方法,取决于分子立体模型的特征,独立于两个化合物间的相互转化,即与化合物的类型和来源无关。因而是个独立的方法。一般包括以下三个步骤,首先按顺序规则确定与手性碳原子X相连的四个基团a,b,c,d的先后顺序,排列为a>b>c>d,然后将顺序最后的基团I放在离观测者最远的方向,三个基团就指向观测者。最后,这三个基团按顺序规则递减排列的顺序a-b-c,若为顺时针方向则构型为R型,若为反时针方向则构型为S型。 学以致用 在农药上的应用 杀虫剂农药的许多大类中存在着手性化合物分子。其中杀虫剂占了手性化合物分子的绝大多数。主要有合成拟除虫菊醇类和有机磷酸南类杀虫剂。蘸果磷是砷年代开发的一个优秀品种,其分子中台有一个不对称磷原子,它的R体与s体的生物活性茬化下的羟氰化作用 存在较大差异,如对家蝇乙酰胆醇蘸的活体抑制活性是s体较高,而杀虫的活性却是R体比s体高。同时人们还发现蔬果磷的氧化产物恰好与蘸果礴的立体化学与生物活性关系性质相
精心整理 手性分子的拆分技术 郝婷玉级材料工程 摘要:对外消旋体实施拆分是获得手性物质的重要途径。本文综述了外消旋体的拆分方法,主要有直接结晶拆分法、化学拆分法、动力学拆分法、色谱拆分法(含毛细管电泳法)和手性膜拆分法等五大类。其中,包括目前作为手性拆分主要方法的色谱技术在内的前4类方法,由于批处理能力小、工业放大成本高,不适合大规模生产;相反,膜分离技术具有能耗低、易于连续操作等优点,被普遍认为是手性的。,,有限,因而在应用上也受到一定的限制。(3)外消旋体拆分法:是在拆分剂的作用下,将外消旋体拆分成对映体。因为化学法合成外消旋体比较简单,这种方法成本相对较低,因而得到广泛应用。据统计,大约有65%的非天然手性药物是由外消旋体或中间产物拆分得到的。本文依据国内外相关文献报道,总结了外消旋体的拆分方法。 迄今,手性拆分技术主要有直接结晶拆分法、化学拆分法、动力学拆分法、色谱拆分法(含毛细管电泳法)和手性膜拆分法等五大类[3]。
1.直接结晶拆分法 对于一个外消旋混合物,其两种对映体常自发地以宏观晶体分别析出,如果这些晶体可以用肉眼区别,那么就可在放大镜的帮助下,用镊子之类的工具将他们拣出分开,从而达到拆分的目的。这就是所谓的机械拆分法。机械拆分法的缺点是过于繁琐,不能应用于外消旋化合物和外消旋固体溶液。Wynbery等[4]用(-)-α-蒎烯作溶剂,通过直接结晶法拆分了类似七环杂螺烯的外消旋体。但这种方法需要寻找特殊的手性溶剂,且适于拆分的外消旋混合物的范围相当狭窄,故实际工业生 本。 2. 2.1 体, 拆分剂和溶剂的选择较为盲目;(2)拆分的产率和产品的旋光纯度不高;(3)适用于手性拆分的化合物的类型不多。近年来,随着主-客体化学的深入研究而开发出来的包结拆分和组合拆分等新型手性拆分技术,在一定程度上解决了经典成盐拆分方法的不足。 2.2包结拆分 由日本化学家Toda教授发明的包结拆分[6]与经典成盐拆分相比,所拆分的化合物不再局限于有机酸或者有机碱。此法主要利用主-客体分子之间存在很强的分子识别作用,而使得手性化合物
手性化合物的合成和分离方法研究进展 摘要:手性问题与我们的生活密切相关,它涉及到生命、动植物、药物、食品、香料、农药等诸多领域,本文介绍了手性化合物的一些用途,合成和分离方法及发展方向。手性化合物的制备已成为当前国内外较热门的研究课题之一。本文从非生物法和生物法两个方面较全面地综述了手性化合物的制备方法, 希望为相关研究者提供参考。 关键词:手性化合物;手性药物;制备;生物合成 1.1用途 手性化合物(chiral compounds)是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物。判断分子有无手性的可靠方法是看有没有对称面和对称中心[1]。 手性问题与我们的日常生活密切相关。天然存在的手性化合物品种很多,并且通常只含有一种对映体,手性问题还牵涉到农业化学、食品添加剂、饮料、药物、材料、催化剂等诸多领域。它的研究已经成为科学研究和很多高科技新产品开发的热点。在过去20年里,手性研究具有戏剧性的发展,已从过去的少数几个专家的学术研究发展到大面积科学研究的需要,在一些领域并已带来了巨大的经济效益。物质的手性已经变成越来越需要考虑的问题,其对我们的日常生活正在起到越来越重要的作用。 手性化合物主要从天然来源、不对称合成和外消旋体拆分3个方面得到。由天然来源获得手性化合物,原料丰富,价廉易得,生产过程简单,产品的纯度一般都较高,因此很多量大的产品都是从天然物中获得。在药物工业中由于对手性药物的要求不断增加,其大大激发了不对称有机合成的发展,使一些生物技术、生物催化剂也迅速扩展到该领域产生纯的的手性中间体和手性产品[2]。 1.生物制药 在合成中引入生物转化在制药工业中已成为关键技术。如Merck公司开发的酰胺酶抑制剂西司他丁的生产就是一个实例。西司他丁是一种N-取代的(S)-2,2-二甲环丙烷羰酰胺衍生物,它可以从易得原料合成消旋2,2-二甲基环丙羰腈开始,通过不同途径合成。 2.生物农药 拟除虫菊酯类杀虫剂是70年代中期开始大量使用的新型农药,是天然除虫菊酯的模拟物,生物降解性好,对环境影响小。拟除虫菊酯具高效安全杀虫谱广等优点。在世界农药市场占有一定的地位。手性化合物在生物农药方面也有广扩的前景,此杀虫剂占全球杀虫剂市场的20%。 3.香料、添加剂和酶技术 香精香料和其他行业占手性市场总值的4.7%;如人工合成一些甜味剂癸内酯具有强烈的果香香气。 酶技术的一个新方向是美国Altus Biologics的交联酶结晶(cross - linked enzyme
对手性分子的认识与探究 科目:新能源教师:周小媛 姓名:司东辉学号:20142702016 专业:物理学类别:(学术、专业) 考生成绩: 阅卷评语: 阅卷教师(签名)
1.对手性分子认识 在生活中我们可以通过镜子看以看到另外一种镜像,这种镜像和镜子外的物体大体相似,但是他们的结构确实大不相同。手性分子,是化学中结构上镜像对称而又不能完全重合的分子。碳原子在形成有机分子的时候,4个原子或基团可以通过4根共价键形成三维的空间结构。由于相连的原子或基团不同,它会形成两种不同的分子结构。这两种分子物理性质不同,化学性质也有一定的差异。从分子的组成形状来看,它们依然是两种分子。这种情形像是镜子里和镜子外的物体那样,看上去互为对应。由于是三维结构,它们不管怎样旋转都不会重合,就像左手和右手那样,称这两种分子具有手性,又叫手性分子。因此这两种分子互为同分异构体,这种异构的形式称为手性异构,有R型和S型两类。在偏振光这一手性条件下,一对对映异构体的物理常数比旋光度大小相等而方向相反又例如,某一化学反应,如果在手性试剂,手性催化剂、手性溶剂等条件下进行,则可能生成或主要生成单一的对映异构体,更重要的是一对映异构体在生理活性上往往是不同的。手性分子的普遍性与重要性,手性在宇宙界普遍存在的体现了生命的演变过程,如自然界中的核酸、淀粉、纤维素中的糖单元都是D-构型,地球上 的一切大生物分子的基元材料是氨基酸,绝大多说是L-构型;蛋白质和DNA的 螺旋构象是右旋的;而且人们发现,海螺的螺纹和缠绕植物也都是右旋的,面对充满手性的自然界,人们不断发现,生物体内存在自然环境,作用于生物体内的药物及农药,其药效作用多与他们和体内靶子间的手性匹配和手性相关,因此手性药物和手性农药的研究就尤为重要。在用于治疗的药物中,有许多兽性药物,而手性药物的不同对映异构体,在生理过程中会显示出不同的药物,尤其是当手性药物的一种对映异构体对治疗有效,而另一种对映异构体表现为有害物质时,情况更为严重。 2.手性结构的研究 手性的发现可以追溯到19世纪早期,1811年法国物理学家Francois Jean 和Dominique Arago描述石英晶体旋转通过其中的线偏振光的偏振面,第一次观察到左旋右选偏振光与物质不同的相互作用。几乎于此同时,Jean Baptiste Biot 在有机松脂的液体和气体中也观察到同样的情况。线偏振光可以看成有等幅度的左旋和右旋偏振光组成。偏振光的转动时由左旋和右旋圆偏振光的折射指数不同
手性化合物的拆分技术研究进展 摘要 本文综述了分离外消旋体的几种主要拆分方法的优缺点及其应用情况。分别有:化学拆分法、膜拆分法、色谱拆分法以及毛细管电泳拆分法。 关键词:手性物;拆分;外消旋体 Technical Progress of Chiral Separation Abstract This article reviews separation methods of chiral which include chemical,membranous,chromatographic and electrophoretic methods. Key words:chiral compounds;chiral separation;raceme 目前获得手性物的主要方法还是通过拆分外消旋体。早期的拆分方法主要有机械拆分,结晶拆分以及手性溶剂结晶拆分。这三种方法都是利用外消旋混合物的两种对应体结晶性能不一样的特点进行分离。已经有较成熟工业应用,但一次性收率较差,在此不做赘述还是本文综述了今年来手性拆分方法中使用较多的化学拆分法、膜拆分、色谱拆分以及毛细管电泳拆分四种拆分技术。 1化学拆分[1] 1.1生成非对映体拆分 此方法是利用外消旋混合物与手性试剂反应后生成有不同性质的非対映体,从而利用生成物的不同物理性质(溶解度、蒸汽压、结晶速率等)将其分离,再将分离后的物质分别还原成之前的対映体。 还可以使用拆分剂家族代替单一拆分剂进行拆分,所谓拆分剂家族是指有类似结构的2~3个手性剂拆分剂。组合拆分提高了产品收率和纯度。 1998年Hulsho F L A等人[2]就使用一定量的(S,S)酒石酸衍生物的拆分剂家族拆分3-(1,4-亚乙基哌啶基)苯甲酸酯和3,4-二笨基四氢吡咯,经过一定处理后,两种対映体的纯度(ee值)分别达到了99%和98%。 如果拆分剂不能和対映体反应,就可以利用拆分剂的空穴与两种対映体之间
手性物质提取分离 手性药物的结晶拆分方法: 手性化合物的拆分是给外消旋混合物制造一个不对称的环境,使两个对映异构体能够分离开来。 从方法学上来讲,可以分为结晶拆分法(物理拆分方法、化学拆分方法)、动力学拆分方法、生物拆分方法(相当部分是生物催化的动力学拆分)及色谱拆分方法。 --手性药物的拆分方法— 1、结晶拆分法 --直接结晶法---在光学活性溶剂中的结晶拆分 --直接结晶法---外消旋体的不对称转化和结晶拆分 --直接结晶法---逆向结晶法逆向结晶法则是在外消旋体的饱和溶液中加入可溶性某一种构型的异构体[如(R)—异构体],添加的(R)—异构体就会吸附到外消旋体溶液中的同种构型异构体结晶体的表面,从而抑制了这种异构体结晶的继续生长,而外消旋体溶液中相反构型的(S)—异构体结晶速度就会加快,从而形成结晶析出。 --直接结晶法---优先结晶法优先结晶方法(preferential crystallization)是在饱和或过饱和的外消旋体溶液中加入一个对映异构体的晶种,使该对映异构体稍稍过量因而造成不对称环境,结晶就会按非稍的过程进行,这样旋光性与该晶种相同的异构体就会从溶液中结晶出来。 --直接结晶法---自发结晶拆分法自发结晶拆分(spontaneous resolution)是指当外消旋体在结晶的过程中,自发的形成聚集体。 --通过形成非对映异构体的结晶法--非对映异构体的形成和拆分原理 --通过形成非对映异构体的结晶法--用于碱拆分的拆分试剂(酸性拆分剂)
2、动力学拆分 --组合拆分拆分原理是采用一组同一结构类型的手性衍生物的拆分剂家族(resolving agent family)代替单一的手性拆分剂进行外消旋化合物的拆分。 --复合拆分方法---形成π电子复合物的拆分(通过形成π电子复合物或π电子转移复合物的拆分方法主要应用十含芳香环化合物的拆分,所用拆分剂是手性的含π电子的酸) --复合拆分方法---金属配合物的拆分方法:有机过渡金属化合物与被拆分物形成非对映异构体的配位物而被分离。 --包合拆分(inclusion resolution)方法--洞穴包合物拆分(拆分剂是手性的环状多元醚(冠醚)和环糊精) 3、色谱分离:气相色谱,液相色谱,薄层色谱、超临界色谱和电泳 -------气相色谱: 按照拆分机制 GC 手性固定相可分为三类:基于氢键的手性固定相;基于配位作用的手性金属配合物固定相;基于包含作用的环糊精衍生物固定相。 -----HPLC柱色谱法分离手性化合物: 直接法:手性固定相CSP拆分:手性流动相CMP拆分 间接法:手性试剂衍生化法CDF 直接法间接法 手性固定相拆分CSP 手性流动相拆分CMP 手性试剂衍生化法 CDF 定义将具有手性识别 作用的配基,通 过稳定的共价键 连接或以物理方 法涂敷于适当的 固相载体上,以 制备出手性固定 相。CMP手性流动相又称手 性添加剂法,这种拆分 法是在流动相中加入 手性试剂,利用手性试 剂与各对映体结合的 稳定常数不同,以及药 物与结合物在固定相 上分配系数的不同来 进行分离。有:配体交 换型手性添加剂、环糊 精添加剂、手性离子对 添加剂。 该法是药物对映体在 分离前与高光学纯度 衍生化试剂( C D A) 反应,形成非对映体, 再进行色谱分离测定。 优点分离时间短, 而手性选择性 和拆分能力此法不需昂贵的手性 柱,亦无须进行柱前衍 生,手性添加剂可视要 可使用已有的非 手性同定相,花费少, 通过选用具有强烈紫
手性分子和旋光性 一、手性分子与非手性分子 不具有对称面和对称中心的分子有一个重要的特点,就是实体和镜象不能重叠,其关系正和左、右手的关系相似,因此现在普遍地称这类分子为手 它可以写出结构式(i)和(ii),(i)和(ii)与左、右手一样具有实体和镜象的关系,因此乳酸是一个手性分子。实体和镜象互称为对映体。一对对映体从表观上看,它们是“非常对称”的,这种实体和镜象不能重叠的而表观上或结构上又“非常对称”的关系可看作是一种“特殊的对称”。 从对称因素考虑,乳酸只有一个C1简单对称轴,任何一个物体或分子旋转360°(n=1)时,都可复原。为了和许多其它只具有C n>1简单对称轴的手性分子区别开来,所以把这种手性分子称为不对称分子,而后者称为非对称分子。 乳酸分子还有一个特点,它的一个碳原子和四个不同的基团相连,这种碳原子称为不对称碳原子或手性碳原子,氮、磷、硫原子也可连接不同的基团,这种原子,均可称为手性中心。现在已知绝大多数手性分子(不对称分子)含有一个或多个不对称碳原子,但并不能因此就将含有手性碳原子作为产生手性分子的绝对条件,产生手性分子的必要与充分条件是实体和镜象不能重叠。
二、对映体和光活性 实体和镜象不能重叠的分子成为一对对映体。这二者的物理性质及化学性质,如溶解度、熔点、密度、焓等,都是相同的。它们的化学反应性能也是相同的,只有在特殊的环境下,如在手性溶剂或试剂存在下,才表现出差异,生物体内的大多数反应是在手性的环境下进行的。但一对对映体对偏振光的作用不同,一个可以把偏振光向左旋,另一个则把偏振光向右旋,而非手性分子对偏振光没有这种作用,因此手性分子又称为光活性分子。光活性并不是手性分子的唯一特征,个别手性分子显示不出旋光性来,因此用手性这个名词,就更恰当一些。偏振光是检查手性分子的一种最常用的方法,因此需要对它略加讨论。 普通的光线含有各种波长的射线,是在各个不同的平面上振动的,图3-1(i)代表一束光线朝着我们的眼睛直射过来,它包含有在各个平面上(如A,B,C,D…)振动的射线,假若使光线通过一个电气石制的棱镜,又叫尼可尔(Nicol)棱镜,一部分射线就被阻挡不能通过,这是因为这种棱镜具有一种特殊的性质,只有和棱镜的晶轴平行振动的射线才能全部通过。假若这个棱镜的晶轴是直立的,那么只有在这个垂直平面上振动的射线才可通过,这种通过棱镜的光叫做平面偏光。图3-1(ii)表示凡在虚线平面上振动的射线都将受到全部地或者部分地阻挡。图3-1(iii)表示通过棱镜的光线是仅含有在箭头所示平面上振动的偏光。 用两块电气石制的棱镜放在眼睛和一个光源之间,若两个棱镜的轴彼此平行,则通过第一个棱镜的射线也可通过第二个棱镜,我们看到的是透明的图3-2(i),若两个棱镜的轴互相垂直,通过第一个棱镜的射线就不能通过第二个棱镜,此时看到两镜相交处是不透明的[图3-2(ii)]。电气石棱镜对于光的作用可以用一本书和一