
蛋白质含量测定法——考马斯亮蓝法
[实验目的]
学习、掌握考马斯亮蓝法(Bradford 法)测定蛋白质含量的方法
[实验原理]
(蓝色)变为氨基酸芳香族
碱性
染料考马斯亮蓝磷酸nm G 595250max λ??→?+
-
[器材与试剂]
器材
722型可见光分光光度计、漩涡混合器、试管16支 试剂
1.标准蛋白质溶液,用牛血清清蛋白(BSA ),配制成1.00mg/ml 。
2.考马斯亮蓝G-250染料试剂:称100mg 考马斯亮蓝,溶于50ml 95%的乙醇后,再加入120ml 85% 的磷酸,用水稀释至1升。
[实验方法]
标准方法
1.取10支试管,分别编号后按 表1 剂量依次加入标准蛋白(或未知蛋白)、去离子水和考马斯亮蓝染料。每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用722分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
3.用标准蛋白浓度(mg/ml )为横坐标,用A 595为纵坐标,进行直线拟合,得到标准曲线。根据测得的未知样品的A 595,代入公式即可求得未知样品的蛋白质含量。根据所测样品的吸光度,在标准曲线上查得相应的蛋白质含量,按下式计算: 样品蛋白质含量(μg/g 鲜重) =
)
测定时提取液体积()样品重()
提取液总体积()查得的蛋白质(ml g ml g g ??/μ
SDS 干扰实验
1.取5支试管,分别编号后按表2剂量依次加入标准蛋白、SDS 、去离子水和考马斯亮蓝染料。每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用753分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
[实验数据与结果分析]
(一)标准方法的数据和图
表1 考马斯亮蓝标准法实验表格
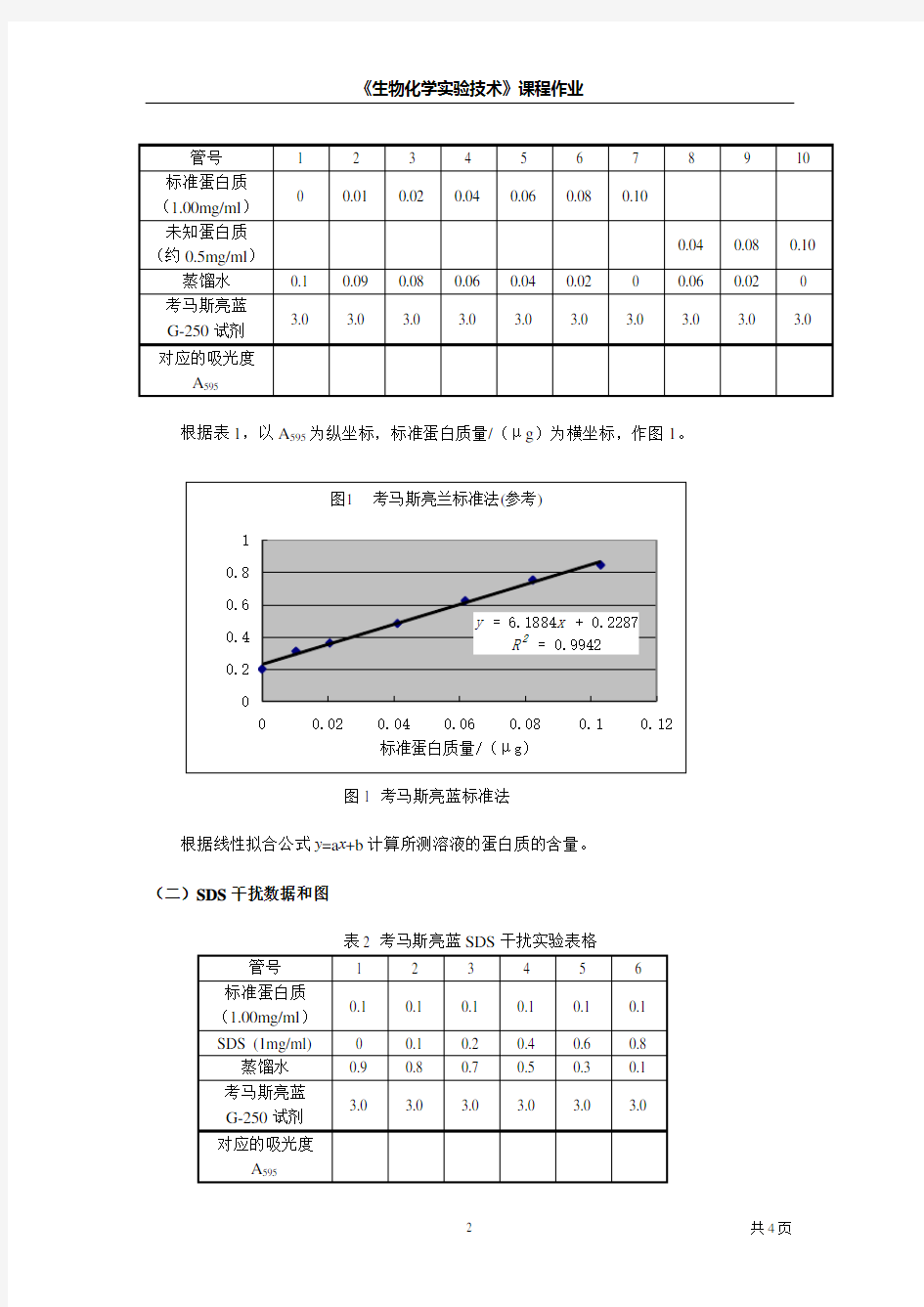
根据表1,以A595为纵坐标,标准蛋白质量/(μg)为横坐标,作图1。
图1 考马斯亮蓝标准法
根据线性拟合公式y=a x+b计算所测溶液的蛋白质的含量。
(二)SDS干扰数据和图
表2 考马斯亮蓝SDS干扰实验表格
根据表2,以A595为纵坐标,SDS浓度为横坐标,作图2。
图2 考马斯亮蓝SDS干扰实验
理论上,十二烷基硫酸钠(SDS)对考马斯亮蓝法测蛋白质含量有干扰,随着SDS浓度的增加,其混合液的595nm处的吸收峰逐渐降低,而后有一小段回升,最后趋于渐近线。
[结论]:
1.考马斯亮蓝标准法测得未知溶液中蛋白质含量为x mg/ml。
2.干扰考马斯亮蓝方法的物质中,SDS的干扰分析情况。
[干扰实验结果分析]:
当溶液中存在一定量的SDS后所测得的吸光度比正常值相对减小。但是随着SDS 浓度的增加,吸光度的减小量应没有呈现出很明显的规律。从SDS与蛋白质的作用机理来看,SDS可以断开分子内和分子间的氢键,破坏蛋白质的二级和三级结构。SDS 和蛋白质结合后使蛋白质-SDS复合物上带有大量的负电荷,平均每两个氨基酸结合一个SDS分子,这时各种蛋白质分子本身的电荷完全被SDS掩盖。由于SDS 的存在,阻碍了染料与碱性氨基酸和芳香族氨基酸的结合,使得吸光度减小。由于SDS与染料分子对蛋白质的竞争结合,使得显色减弱,吸光度值降低,因此在曲线前段呈下降趋势;
但由于SDS破坏氢键,使得蛋白质的空间结构更加伸展,一些原来包裹在结构中的碱性氨基酸和芳香族氨基酸暴露出来,所以会有少量的吸光度回升;但最终SDS与蛋白质的结合达到所处溶液条件下的“饱和”时,过量的SDS就不起作用了,曲线是最后为平缓段。
要去除SDS的干扰,可以利用它与K+结合生成沉淀的性质将其去除。K+对考马斯亮蓝方法不产生干扰。
[思考与讨论]
1.用考马斯亮蓝法G-250测定蛋白质含量有何特点,操作过程中应注意什么?
答:Bradford 法的优点是(1)灵敏度高,其最低蛋白质检测量可达1μg。这是因为蛋白质与染料结合后产生的颜色变化很大,蛋白质-染料复合物有更高的消光系数,因而光吸收值随蛋白质浓度的变化很大。(2)测定快速、简便、只需要加一种试剂。完成一个样品的测定,只需要5min左右,颜色在5min至20min之间稳定性也很好。(3)干扰物质相对其它方法少。缺点是(1)由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同,因此Bradford法用于不同蛋白质测定时有较大的偏差。(2)仍有些物质干扰此法测定:去污剂、Triton X-100、十二烷基硫酸钠(SDS)和0.1mol/L的NaOH。(3)标准曲线也有轻微的非线性。操作注意事项:不可使用石英比色皿,可用塑料或者玻璃比色皿,使用后立即用少量95%的乙醇荡洗,以洗去染色。塑料比色皿决不可以用乙醇或丙酮长时间浸泡。
2.考马斯亮蓝G-250和R-250各有何特点,在电泳染色方面有何异同?
答:考马斯亮蓝G-250和R-250的结构式不同,配方不同,染色方法也适合于不同性质的蛋白。考马斯亮蓝R-250即三苯基甲烷。每个分子含有两个-SO3H,偏酸性,与蛋白质的碱性集团结合。在一定pH时,染料—蛋白复合物可以被完全解聚。与不同蛋白结合呈现基本相同的颜色,并且在比较宽的范围内(15-20μg),扫描峰的面积与蛋白量有线性关系。通常用先固定,再进行染色和脱色的方法。考马斯亮蓝G-250即二甲花青亮蓝,其染色方法经常是对蛋白质同时进行固定和染色。这种方法的特点是快而简便,有时甚至不需脱色。但灵敏度略逊于R-250。同时考马斯亮蓝G-250对小肽染色效果很好。
3.试述几种主要干扰物质对考马斯亮蓝G-250蛋白测定法测定结果的影响及其作用机理。
答:SDS的存在会使相同条件下的吸光度值减小,其作用机理为:断开分子内和分子间的氢键,破坏蛋白质的二级和三级结构。SDS和蛋白质结合后使蛋白质-SDS复合物上带有大量的负电荷,平均每两个氨基酸结合一个SDS分子,这时各种蛋白质分子本身的电荷完全被SDS掩盖。由于SDS与染料分子与蛋白质的竞争结合,会使显色减弱,所以吸光度值减小。
Tris,乙酸,2-巯基乙醇,蔗糖,甘油,EDTA及微量的去污剂如TritonX-100,玻璃去污剂有少量颜色干扰,用适当的缓冲液对照很容易除掉。
4.说明各种蛋白质含量测定法中哪几种可以测出蛋白质的绝对含量,哪几种只能测定其相对含量,为什么?
答:严格地讲,只有凯氏定氮法可以测定蛋白质的绝对含量,因为每6.25蛋白质含1g氮,所以,通过氮含量的测定,可以得到蛋白质的绝对含量。其他的几种方法,由于都使用了标准蛋白制作标准曲线,所以,所测得的未知蛋白的含量,都是相对于标准蛋白含量而言的。
参考资料:
[1] 王德利等.食品中蛋白质的快速消化简便测定法.黑龙江八一农垦大学学报. 15(4):80~82
[2]余冰宾.生物化学实验指导.清华大学出版社.2004
[3] 南亚,李宏高.考马斯亮蓝G-250法快速测定牛乳中的蛋白质.检测与分析.2007.10(12):42~42
[4]黄婉玉等.考马斯亮蓝法测定果汁中蛋白质的含量.食品与发酵工业.2009.35(5) :160~163
[5] 郭敏亮,姜涌明.考马斯亮蓝显色液组分对蛋白质测定的影响. 生物化学与生物物理进展.1996.23(6) :558~561
[6]中国知网
https://www.doczj.com/doc/2814990392.html,/
6种方法测定蛋白质含量 一、微量凯氏(kjeldahl)定氮法 样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: NH2CH2COOH+3H2SO4――2CO2+3SO2+4H2O+NH3(1) 2NH3+H2SO4――(NH4)2 SO4(2) (NH4)2 SO4+2NaOH――2H2O+Na2SO4+2NH3(3) 反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。 为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。实验和计算方法这里从略。 计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白 氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。 二、双缩脲法(biuret法) (一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1-10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、tris缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。 (二)试剂与器材 1.试剂: (1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(bsa)或标准酪蛋白,配制成10mg/ml的标准蛋白溶液,可用bsa浓度1mg/ml的a280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05NaOH配制。 (2)双缩脲试剂:称以1.50克硫酸铜(CuSO4?5H2O)和6.0克酒石酸钾钠(KNaC4H4O6?4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需要重新配制。 2.器材: 可见光分光光度计、大试管15支、旋涡混合器等。 (三)操作方法 1.标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30分
实验五考马斯亮蓝法测定蛋白质含量 一、实验目的 1.掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法 2.熟练分光光度计的使用和操作方法。 二、实验原理 考马斯亮蓝G250测定蛋白质含量属于染料结合法的一种,它与蛋白质的疏水微区相结合,这种结合具有高敏感性。它在酸性溶液中呈棕红色,最大光吸收峰在465nm,当它与蛋白质结合形成复合物时,其最大吸收峰改变为595nm。考马斯亮蓝G-250—蛋白质复合物呈蓝色,在一定范围内,595nm下光密度与蛋白质含量呈线性关系,故可以用于蛋白质含量的测定。考马斯亮蓝结合法是近年来发展起来的蛋白质定量测定法,本方法具有操作方便、快速、干扰因素少的特点。 离心机的使用说明: 1.要离心的离心管和管套要称重,重量不等时将水加在管套里。2.离心管的放置是对角线放置,要求必须对称。 3. 先将离心机转速旋钮恢复到零刻度后,再定时间,定好时间后缓慢旋转转速旋钮,使离心机均匀的提速到预定转速。 分光光度计的使用说明: 1.接通电源开关,预热20min后,再选择须用的单色光波长。 2.放入已加入溶液的比色皿,盖上样品室盖,推动试样架拉手,使对照比色皿(溶液装入4/5高度,置第一格)置于光路上,调节100%透射比按钮,使吸光度值A=。 3.推动试样架拉手,使样品比色皿置于光路上,读出吸光度值。 4.测量完毕,取出比色皿,洗净后置于乙醇溶液中浸泡脱色。 5.电源开关置于“关”,拔下电源插头。 三、试剂与器材: 1. 试剂: (1)%NaCl:9g NaCl溶解在1L的容量瓶中。 (2)标准蛋白质:称取50mg结晶牛血清蛋白定溶于50ml容量瓶里。 (3)染液:考马斯亮蓝G-250 ,溶于250mL95%乙醇,再加入500mL85%(W
一原理 考马斯亮蓝 G — 250(GooMAssle BrIIIIAnT Blue G — 250)测定蛋白质含量属于染料结合法的一种。考马斯亮蓝 G— 250在游离状态下呈红色,在稀酸溶液中,当它与蛋白质的疏水区结合后变为青色,前者最大光吸收在465nM,后者在595nM。在一定蛋白质浓度范围内(1?100卩g),蛋白质与色素结合物在595nM波长下的光吸收与蛋白质含量成正比,故可用于蛋 白质的定量测定。蛋白质与考马斯亮蓝G — 250结合在2Min左右的时间内达到平衡,完成 反应十分迅速,其结合物在室温下1H内保持稳定。该反应快速灵敏(灵敏度比Foiln -酚法 还高4倍)、易于操作、干扰物质少(考马斯亮蓝G — 250和蛋白质通过范德华力结合,受蛋白质的特异性影响较小,除组蛋白外,其他不同种类蛋白质染色强度差异不大),可测定微克级蛋白质含量,是一种比较好的蛋白质定量法。但此方法也存在其缺点,考马斯亮蓝在蛋 白质含量很高时线性关系偏低,且不同来源蛋白质与色素结合状况有差异。 考马斯亮蓝G-250试剂呈色反应颜色稳定、灵敏度高,最低测试蛋白质量在1ug左右。 二试剂配置 考马斯亮蓝 G-250100mg溶于50mI95%乙醇,加入100ml质量浓度为0.85g/ml的磷酸,作为母液保存,使用时用水稀释到 1000ml。滤纸过滤。试剂的最终浓度为0.01%考马斯亮蓝 G-250、质量浓度为0.085g/ml磷酸。贮放在棕色瓶中,此溶液在常温下可放置1个月。 三步骤 1破碎细菌提取蛋白液 大肠杆菌表达外源蛋白,在超声破碎的时候,用含有1%triton-X-100的PBS悬浮,然后超 声的效果较好,1%triton-X-100的作用还是很明显的,对其他的一些细菌同样起作用,比如链霉菌。(30% Triton X-100 的配制 Triton X-100 28.2ml 0.1mol/L PBS(pH=7.3)或 0.05mol/l TBS(pH=7.4) 72.8ml 配制方法 取Triton X-100及PBS (或TBS)混合,置37C?40C水浴中2?3h,使其充分溶解混匀。用前取该储备液稀释至所需浓度。通常将30%稀释到1%。) 目的蛋白就在这些未破碎的细胞中。 1*会产生气泡是因为你的探头位置没放好。探头一定要接近底部,约1cm (我一般是距底部
蛋白质含量测定方法的比较及肽含量的测定 (一)蛋白质测定方法的比较(原理、优缺点)蛋白质含量测定法,目前包括定氮法、双缩脲法、福林酚法(Lowry 法)和紫 外吸收法、考马斯亮蓝法。其中考马斯亮蓝和福林酚法灵敏度最高,比紫外吸收法灵敏10~20 倍,比双缩脲法灵敏100倍以上。定氮法较复杂,但准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。在选择方法时应该考虑:(1)实验测定要求的灵敏度和精确度;(2)蛋白质的性质;(3)溶液中存在的干扰物质;(4)测定花费时间。蛋白质含量测定法,目前包括定氮法、双缩脲法、福林酚法(Lowry 法)和紫外吸收法、考马斯亮蓝法。其中考马斯亮蓝和福林酚法灵敏度最高,比紫外吸收法灵敏10~20 倍,比双缩脲法灵敏100倍以上。定氮法较复杂,但准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。在选择方法时应该考虑:(1)实验测定要求的灵敏度和精确度;(2)蛋白质的性质;(3)溶液中存在的干扰物质;(4)测定花费时间。 1 微量凯氏定氮法(GB 5009.5-2010) 1.1原理样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。 1.2操作方法样品经前处理、炭化、消化、蒸馏、滴定等主要步骤 1.3特点准确度较高,适用于0.2~ I.Omg氮,误差为土2%;操作复杂费时,整个过程需要耗时8~10h,试剂消耗量大。,测得结果为总氮含量,包括蛋白氮和非蛋白氮含 量;适用范围广,几乎所有样品均可用此方法。 2双缩脲比色法
实验报告 学院:第二临床医学院专业:临床医学年级:2013级班级:1班姓名:学号:日期:2014,3,8 得分:实验课程:生物化学实验 实验名称:蛋白质的定量测定(五)——考马斯亮蓝法测定蛋白质浓度 【实验目的】 掌握考马斯亮蓝G-250测定蛋白质含量的原理和方法。 【实验原理】 考马斯亮蓝G-250(Coomassie G-250)是一种甲基取代的三苯基甲烷,分子中磺酸基的蓝色染料,在465nm处有最大吸收值。考马斯亮蓝G-250能与蛋白质通过范得华相互作用形成蛋白质—考马斯亮蓝复合物蓝色溶液,引起该染料的最大吸收λmax的位置发生红移,在595nm处有最大吸收值。由于蛋白质—考马斯亮蓝复合物在595n处的光吸收远高于考马斯亮蓝在465nm处的光吸收,因此可大大地提高蛋白质的测定灵敏度。蛋白质—考马斯亮蓝复合物溶液颜色的深浅与蛋白质的浓度成正比。利用溶液颜色的差异进行比色测定,适合于蛋白质类的定量分析尤其适合于稀有蛋白质的微量分析。考马斯亮蓝G-250试剂呈色反应颜色稳定、灵敏度高,最低测试蛋白质量在1ug左右。 【试剂与器材】 试剂: 考马斯亮蓝试剂:考马斯亮蓝G-250溶于50ml95%乙醇,加入100ml质量浓度为0.85g/ml 的磷酸,用蒸馏水稀释到1000ml。 标准蛋白质溶液:结晶牛血清清蛋白,预先经微量凯氏定氮法标定该蛋白质的百分含量,然后根据该蛋白的纯度用0.15mol/LNacl配制成1.0mg/ml蛋白溶液。
器材: 试管和试管架 722型分光光度计 吸量管 移液枪 【实验步骤】 一、制作标准曲线 各管混匀后,静置3min,以0号管为空白管调零,在595nm波长下分别测定各管溶液的吸光度值(A595). 以A595值为纵坐标,蛋白质浓度为横坐标,绘制标准曲线。 二、待测蛋白质浓度测定 测定方法同上,1ml待测蛋白质家5ml考马斯亮蓝试剂,。用上述0号管调零,测出血清的A595值。 【实验结果】
蛋白质含量测定法(一) 蛋白质含量测定法,是生物化学研究中最常用、最基本的分析方法之一。目前常用的有四种古老的经典方法,即定氮法,双缩脲法(Biuret法)、Folin-酚试剂法(Lowry法)和紫外吸收法。另外还有一种近十年才普遍使用起来的新的测定法,即考马斯亮蓝法(Bradford法)。其中Bradford法和Lowry法灵敏度最高,比紫外吸收法灵敏10~20倍,比Biuret法灵敏100倍以上。定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。 五种蛋白质测定方法比较
值得注意的是,这后四种方法并不能在任何条件下适用于任何形式的蛋白质,因为一种蛋白质溶液用这四种方法测定,有可能得出四种不同的结果。每种测定法都不是完美无缺的,都有其优缺点。在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。 考马斯亮蓝法(Bradford法),由于其突出的优点,正得到越来越广泛的应用。 一、微量凯氏(Kjeldahl)定氮法 样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: NH2CH2COOH+3H2SO4——2CO2+3SO2+4H2O+NH3 (1) 2NH3+H2SO4——(NH4)2SO4 (2) (NH4)2SO4+2NaOH——2H2O+Na2SO4+2NH3 (3) 反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。 为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。实验和计算方法这里从略。 计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白 氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。 二、双缩脲法(Biuret法) (一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。 紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1-10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。 (二)试剂与器材
考马斯亮蓝法测蛋白质含量 一、原理 考马斯亮蓝G-25(Coomassie G-250是一种甲基取代的三苯基甲烷,分子中磺酸基的蓝色染料,在 465nm 处有最大吸收值。考马斯亮蓝 G-250能与蛋白质通过范得华相互作用形成蛋白质一考马斯亮蓝复合物蓝色溶液,引起该染料的最大吸收入max的位置发生红移,在 595nm 处有最大吸收值。由于蛋白质—考马斯亮蓝复合物在 595nm 处的光吸收远高于考马斯亮蓝在 465nm 处的光吸收,因此,可大大地提高蛋白质的测定灵敏度。蛋白质—考马斯亮蓝复合物溶液颜色的深浅与蛋白质的浓度成正比。利用溶液颜色的差异进行比色测定,适合于蛋白质类的定量分析,尤其适合于稀有蛋白质的微量分析。考马斯亮蓝G-250试剂呈色反应颜色稳定、灵敏度高,最低测试蛋白质量在 1ug 左右。 二、操作步骤 1. 标准曲线测定法 分别取六只试管,其中一只加入 1.0ml蒸馏水做空白,5只分别加入不同体积的浓度为 100ug/ml 牛血清清蛋白标准液,补充水到 1.0ml。然后每只试管加入5.0ml考马斯亮蓝G-250试剂,摇匀放置5min,在紫外 -可见分光光度计 595nm 处测定吸光值。以 A595 吸光值为纵坐标,牛血清清蛋白的 ug 数量为横坐标绘制标准曲线。具体操作见下表。
蛋白质标准曲线测定加样 在标准蛋白质测定时,为了减小误差,每一个浓度的蛋白质做3支平 行管。 3?试剂配置 a. 牛血清清蛋白标准液结晶牛血清清蛋白或酪蛋白,预先经微量凯氏定氮法标定该蛋白质的百分含量或者根据牛血清清蛋白的消光系数 是6.6来计算其百分含量。然后根据该蛋白的纯度配置成浓度为 100 ug/ml的蛋白溶液。 b. 考马斯亮兰G— 250染料试剂:称100mg考马斯亮兰G—250,溶于 50ml 95%的乙醇后,再加入100ml 85%的磷酸,用水稀释至1升
实验七蛋白质含量测定 测定蛋白质的定量方法有很多,目前常用的有染料法,双缩脲(Biuret)法,酚试剂法(Lowry)法及紫外吸收法。 [目的要求] 1.掌握测定蛋白质的含量基本方法。 2.了解染料法、双缩脲法、Lowry法和紫外吸收法测定原理。 一、染料法 [实验原理] 在酸性溶液中染料考马斯亮蓝G-250与蛋白质结合,此时考马斯亮蓝G-250颜色从红色变为蓝色,吸收高峰从460nm移至595nm。利用这个原理可以测定蛋白质含量。 该法近年在某些方面有取代经典的Lowry法趋势,因为它操作简单,反应时间短,染料-蛋白质颜色稳定,抗干扰性强。本法的缺点是:对于那些与标准蛋白氨基酸组成有较大差异的蛋白质,有一定误差,因为不同的蛋白质与染料的结合是不同的,故该法适合测定与标准蛋白质氨基酸组成相近的蛋白质。 [器材] 吸量管;试管;721型分光光度计 [试剂] 1.标准牛血清白蛋白溶液:配成0.1mg/ml的溶液。 2.待测蛋白质溶液。 3.染料溶液:称取考马斯亮蓝G-250 0.1g溶于95%的酒精50ml,再加入85%的浓磷酸100ml,用水稀释至1000ml,混匀备用。
[操作步骤] 1.标准曲线的绘制: 按上表分别向各支试管内加入各种试剂,充分混匀,5min后在595nm波长处以0号管调零,测定各管吸光度值(A)。以吸光度值为纵坐标,蛋白质浓度为横坐标绘制标准曲线。 2.样品测定: 取1ml样品溶液(约含25~250微克蛋白质),加入染料溶液5ml混匀,5min后测定其595nm吸光度值,对照标准曲线求得蛋白质浓度。 二、双缩脲(Biuret)法测定蛋白质含量 [实验原理] 在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。凡分子中含二个或二个以上酰胺基(—CO-NH2),或与此相似的基团[如—CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。蛋白质分子含有众多肽键(—CO-NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量
考马斯亮蓝法测定可溶性蛋白质含量 原理: 考马斯亮蓝G-250(Coomassie brilliant blue G-250)测定蛋白质含量属于染料结合法的一种。该染料在游离状态下呈红色,在稀酸溶液中当它与蛋白质的疏水区结合后变为青色,前者最大光吸收在465nm,后者在595nm在一定蛋白质浓度范围内(1-1000μg),蛋白质与色素结合物在595nm波长下的吸光度与蛋白质含量成正比,故可用于蛋白质的定量测定。 考马斯亮蓝G-250于蛋白质结合反应十分迅速,2min左右即达到平衡。其结合物在室温下1h内保持稳定。此法灵敏度高,易于操作,干扰物质少,是一种比较好的定量法。其缺点是在蛋白质含量很高时线性偏低,且不同来源蛋白质与色素结合状况有一定差异。 材料、仪器设备及试剂 1、材料 小麦叶片、马铃薯块茎、或其他植物材料 2、仪器设备 分光光度计、研钵、烧杯、移液管 3、试剂 (1)标准蛋白质溶液:100μg·Ml-1牛血清白蛋白:称取牛血清白蛋白25mg,加水溶解并定容至100ml,吸取上述溶液40ml,用蒸馏水稀释至100ml即可。(2)考马斯亮蓝G-250溶液:称取100mg考马斯亮蓝G-250,溶于50ml90%乙醇中,加入100ml85%(W/V)的磷酸,再用蒸馏水定容到1L,贮于棕色瓶中,常温下可保存一个月。 方法: 1、标准曲线的绘制 取6支具塞试管,按表加入试剂。混合均匀后,向各管中加入5ml考马斯亮蓝 G-250溶液,摇匀,并放置5min左右,在595nm下比色测定吸光度。以蛋白质浓度为横坐标,以吸光度为纵坐标绘制标准曲线。 管号 1 2 3 4 5 6 标准蛋白质(ml) 0 0.2 0.4 0.6 0.8 1.0 蒸馏水量(ml) 1.0 0.8 0.6 0.4 0.2 0 蛋白质含量(μg) 0 20 40 60 80 100 2、样品测定 (1)样品提取:取鲜样0.5g,加入2ml蒸馏水研磨,磨成匀浆后用6ml蒸馏水冲洗研钵,洗涤液收集在同一离心管中,在4000r/min下离心10min,弃去沉淀,上清液转入容量瓶,以蒸馏水定容至10ml,摇匀后待测。 (2)吸取样品提取液0.1ml,放入具塞试管中(每个样品重复2次),加入5ml 考马斯亮蓝G-250溶液,充分混合,放置2min后在595nm下比色,测定吸光度,并通过标准曲线查得蛋白质含量。 (3)结果计算(单位mg/g)样品中蛋白质含量=(C·VT)/(1000 VS·WF) 式中:C—查的标准曲线值(μg)
几种蛋白质含量测定方法的比较 【摘要】:蛋白质含量测定方法,是生物化学研究中最常用、最基本的分析之一。目前常 用的方法有凯氏定氮法、双缩脲法(Biuret)、紫外吸收法、考马斯亮蓝法(Bradford),Folin —酚试剂法(Lowry)杜马斯燃烧法。其中Bradford 法灵敏度颇高,比紫外吸收法灵敏10~20 倍,比Biuret法灵敏100 倍以上。凯氏定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。过去Folin—酚试剂法法是应用最广泛的一种方法,由于其试剂乙的配制较为困难(现在已可以在本公司订购),近年来逐渐被考马斯亮兰法所取代。测定农产品中全氮的凯氏定氮法在许多国家已被杜马斯然烧定氮法所代替,杜马斯燃烧法是基于在高温下(大约 900 ℃),通过控制进氧量、氧化消解样品的原理而进行氮测定的。这6种方法并不能在任何条件下适用于任何形式的蛋白质,每种方法都有其优缺点,在选择方法时应考虑:⑴实验对测定所要求的灵敏度和精确度;⑵蛋白质的性质;⑶溶液中存在的干扰物质;⑷测定所要花费的时间 【关键词】:凯氏定氮法双缩脲法紫外吸收法考马斯亮蓝法 Folin—酚试剂法杜马斯燃烧法 一、凯氏定氮法 1.1原理 凯氏定氮法测定蛋白质分为样品消化、蒸馏、吸收和滴定4 个过程。其原理是样品中含氮有机化合物与浓硫酸在催化剂作用下共热消化,含氮有机物分解产生氨,氨又与硫酸作用,变成硫酸铵。然后加碱蒸馏放出氨, 氨用过量的硼酸溶液吸收,再用盐酸标准溶液滴定求出总氮量换算为蛋白质含量。 1.2特点 凯氏定氮法是目前分析有机化合物含氮量常用的方法,是测定试样中总有机氮最准确和最简单的方法之一,被国际国内作为法定的标准检验方法。凯氏定氮法样品的最佳消化条件为硫酸铜2.50 g, 硫酸钾0.10 g,浓硫酸4.00 mL;硫酸铜的用量为影响消化时间的主要因素,硫酸钾和浓硫酸用量为第二和第三主要因素;用此最佳条件做实验, 消化时间仅为12 min;与其他硫酸铜、硫酸钾、浓硫酸用量方法对比,该法所需消化时间最短,试剂用量减少,可降低实验成本,也降低了对环境的污染。 凯氏定氮法适用范围广泛,测定结果准确,重现性好,但操作复杂费时,试剂消耗量大。若采用模块式消化炉代替传统的消化装置, 可同时测定几份样品,节省时间,提高了工作效率,适用于批量蛋白质的测定,具有准确、快速、简便、低耗、稳定的优点。 二、双缩脲法(Biuret ) 2.1原理 双缩脲(NH3CONHCONH3)是两个分子脲经180 ℃左右加热,放出1 个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4 形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能够以1 个中间碳原子相连的肽键,这类化合物都有双缩脲反应。紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
蛋白质含量测定法——考马斯亮蓝法 [实验目的] 学习、掌握考马斯亮蓝法(Bradford 法)测定蛋白质含量的方法 [实验原理] (蓝色)变为氨基酸芳香族 碱性 染料考马斯亮蓝磷酸nm G 595250max λ??→?+ - [器材与试剂] 器材 722型可见光分光光度计、漩涡混合器、试管16支 试剂 1.标准蛋白质溶液,用牛血清清蛋白(BSA ),配制成1.00mg/ml 。 2.考马斯亮蓝G-250染料试剂:称100mg 考马斯亮蓝,溶于50ml 95%的乙醇后,再加入120ml 85% 的磷酸,用水稀释至1升。 [实验方法] 标准方法 1.取10支试管,分别编号后按 表1 剂量依次加入标准蛋白(或未知蛋白)、去离子水和考马斯亮蓝染料。每支试管加完后,立即在漩涡混合器上混合。 2.加完染料20min 后,使用722分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。 3.用标准蛋白浓度(mg/ml )为横坐标,用A 595为纵坐标,进行直线拟合,得到标准曲线。根据测得的未知样品的A 595,代入公式即可求得未知样品的蛋白质含量。根据所测样品的吸光度,在标准曲线上查得相应的蛋白质含量,按下式计算: 样品蛋白质含量(μg/g 鲜重) = ) 测定时提取液体积()样品重() 提取液总体积()查得的蛋白质(ml g ml g g ??/μ SDS 干扰实验 1.取5支试管,分别编号后按表2剂量依次加入标准蛋白、SDS 、去离子水和考马斯亮蓝染料。每支试管加完后,立即在漩涡混合器上混合。 2.加完染料20min 后,使用753分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。 [实验数据与结果分析] (一)标准方法的数据和图 表1 考马斯亮蓝标准法实验表格
标准曲线制作—考马斯亮蓝法测蛋白质含量 一、标准曲线 一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。因此,制作标准曲线是生物检测分析的一项基本技术。 二、蛋白质含量测定方法 1、凯氏定氮法 2、双缩脲法 3、Folin-酚试剂法 4、紫外吸收法 5、考马斯亮蓝法 三、考马斯亮蓝法测定蛋白质含量—标准曲线制作 (一)、试剂: 1、考马斯亮蓝试剂: 考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml 85% H3PO4,雍蒸馏水稀释至1000ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G—250,4.7%(W/V)乙醇,8.5%(W/V)H3PO4。 2、标准蛋白质溶液: 纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0.15mol/LNaCl配制成100ug/ml蛋白溶液。 (二)、器材: 1、722S型分光光度计使用及原理()。 2、移液管使用()。 (三)、标准曲线制作: 1、 2、以A595nm为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、
40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。 1)、利用标准曲线查出回归方程。 2)、用公式计算回归方程。 3)、或用origin作图,测出回归线性方程。即A595nm=a×X( )+6 一般相关系数应过0.999以上,至少2个9以上。 4)、绘图时近两使点在一条直线上,在直线上的点应该在直线两侧。 (四)、蛋白质含量的测定: 样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品的A595nm,然后利用标准曲线或回归方程求出样品蛋白质含量。 一般被测样品的A595nm值在0.1—0.05之间,所以上述样品如果A595nm值太大,可以稀释后再测A595nm值,然后再计算。 (五)、注意事项: 1、玻璃仪器要洗涤干净。 2、取量要准确。 3、玻璃仪器要干燥,避免温度变化。 4、对照:用被测物质以外的物质作空白对照。
实验七考马斯亮蓝G250法测定的蛋白质含量 一、试验目的 1. 学习分光光度计的原理及操作 2.学习利用染色方法提高蛋白质消光系数,以提高分光光度法检测灵敏度 二、基本原理 1. 根据物质的吸收光谱进行定性或定量分析的方法称为吸收光谱法或分光 光度法。该法所用的仪器称为分光光度计或吸收光谱仪。该法所使用的光谱范围包括可见光和紫外光,即包括波长在200 - 800 nm之间的光。 2.分光光度计灵敏度高,测定速度快,应用范围广,其中的紫外/可见分光 光度技术更是生物化学研究工作中必不可少的基本手段之一。 3.紫外区可分为紫外(近紫外)和真空紫外(远紫外)。由于吸收池(又称样 品池、比色杯等)和光学元件以及氧气能吸收小于190nm波长的光,因此常规紫外测定集中在近紫外区,即200nm-400nm。可见光区为400nm -800nm。 4.考马斯亮蓝G250法 原理:考马斯亮蓝G250与蛋白质结合后,其最大吸收波长从465nm改变为595nm,该蛋白-染料复合物吸光系数很高,所以检测灵敏度很高,可以测定1μg /mL的蛋白质,染料和蛋白结合只需要2分钟,颜色在1小时内稳定。 操作简便,快速,是常用的蛋白含量测定方法之一。去污剂,粘多糖等严重干扰该方法的测定 三、试剂 1. 标准蛋白质溶液:0.5mg/ml牛血清白蛋白溶液 2. 考马斯亮蓝G250蛋白染色剂: 四、操作步骤 1.标准曲线的绘制: 取6只试管,分别加入浓度为0,0.1,0.2,0.3,0.4,0.5mg/ml的标准蛋白质溶液0.1ml,然后加入5ml考马斯亮蓝试剂,震荡混匀,2分钟后于595nm 测定吸光值,以蛋白质浓度为横坐标,光吸收值为纵坐标绘制标准曲线。 2.样品测定: 样品液0.1mL , 然后加入5ml考马斯亮蓝试剂,震荡混匀,2分钟后于595nm 测定吸光值。从标准曲线中查出相应的浓度。 五、试验结果
考马斯亮蓝法测定蛋白质浓度 蛋白质浓度测定的方法有很多,考马斯亮蓝测定蛋白质是实验室最常见的 一种方式,它利用比色法和色素法混合方法、操作简便,下文介绍了考马斯亮 蓝测定蛋白质浓度的原理、优缺点、操作以及注意事项。 实验原理 考马斯亮蓝(Coomassie Brilliant Blue)法测定蛋白质浓度,是利用蛋白质― 染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。这种蛋白质 测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。这一方 法是目前灵敏度最高的蛋白质测定法。 考马斯亮兰G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收 峰(lmax)的位置,由465nm变为 595nm,溶液的颜色也由棕黑色变为兰色。通 过测定595nm处光吸收的增加量可知与其结合蛋白质的量。研究发现,染料主 要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。 考马斯亮蓝染色法的突出优点是: (1)灵敏度高,据估计比Lowry法约高四倍,其最低蛋白质检测量可达1mg。这是因为蛋白质与染料结合后产生的颜色变化很大,蛋白质-染料复合物有更高 的消光系数,因而光吸收值随蛋白质浓度的变化比Lowry法要大的多。 (2)测定快速、简便,只需加一种试剂。完成一个样品的测定,只需要5分 钟左右。由于染料与蛋白质结合的过程,大约只要2分钟即可完成,其颜色可 以在1小时内保持稳定,且在5分钟至20分钟之间,颜色的稳定性最好。因而 完全不用像Lowry法那样费时和严格地控制时间。 (3)干扰物质少。如干扰Lowry法的K+、Na+、Mg2+离子、Tris缓冲液、 糖和蔗糖、甘油、巯基乙醇、EDTA等均不干扰此测定法。 此法的缺点是: (1)由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同,因此考马斯亮 蓝染色法用于不同蛋白质测定时有较大的偏差,在制作标准曲线时通常选用g—球蛋白为标准蛋白质,以减少这方面的偏差。 (2)仍有一些物质干扰此法的测定,主要的干扰物质有:去污剂、 Triton X-100、十二烷基硫酸钠(SDS)等。 试剂与器材 一、试剂
蛋白质含量测定法 蛋白质含量测定法,是生物化学研究中最常用、最基本的分析方法之一。目前常用的有四种古老的经典方法,即定氮法,双缩尿法(Biuret法)、Folin-酚试剂法(Lowry 法)和紫外吸收法。另外还有一种近十年才普遍使用起来的新的测定法,即考马斯亮蓝法(Bradford法)。其中Bradford法和Lowry法灵敏度最高,比紫外吸收法灵敏10~20倍,比Biuret法灵敏100倍以上。定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。 值得注意的是,这后四种方法并不能在任何条件下适用于任何形式的蛋白质,因为一种蛋白质溶液用这四种方法测定,有可能得出四种不同的结果。每种测定法都不是完美无缺的,都有其优缺点。在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。 考马斯亮蓝法(Bradford法),由于其突出的优点,正得到越来越广泛的应用。 一、微量凯氏(Kjeldahl)定氮法 样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: CH2COOH |+ 3H2SO4 →2CO2 + 3SO2 +4H2O +NH3 (1) NH2 170
2NH3 + H2SO4→(NH4)2SO4(2) (NH4)2SO4 + 2NaOH →2H2O +Na2SO4 + 2NH3(3) 反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。 为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。实验和计算方法这里从略。 计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。 五种蛋白质测定方法比较如下: 171
蛋白质含量的测定方法 蛋白质含量的测定是我们判断每一种食物是否含有高蛋白,所以我们建议大家应该要对于蛋白质的检测方法有一定的认识。一般我们在生活中检查蛋白质含量的方法是通过硫酸铜的方法,也可以通过酚试剂的方法,所以大家觉得哪种方法比较方便,我们建议大家可以尝试一下文章介绍的方法。 双缩脲法(Biuret法)灵敏度低1~20mg中速20~30分钟多肽键+碱性Cu2+紫色络合物硫酸铵;Tris缓冲液;某些氨基酸用于快速测定,但不太灵敏;不同蛋白质显色相似。 紫外吸收法较为灵敏50~100mg快速5~10分钟蛋白质中的酪氨酸和色氨酸残基在280nm处的光吸收各种嘌吟和嘧啶; Folin-酚试剂法(Lowry法)灵敏度高~5mg慢速40~60分钟双缩脲反应;磷钼酸-磷钨酸试剂被Tyr和phe还原硫酸铵;Tris 缓冲液;甘氨酸;各种硫醇耗费时间长;操作要严格计时;颜色深浅随不同蛋白质变化。 考马斯亮蓝法(Bradford法)灵敏度最高1~5mg快速5~15分钟考马斯亮蓝染料与蛋白质结合时,其lmax由465nm变为595nm 强碱性缓冲液; SDS最好的方法;干扰物质少;颜色稳定;颜色深浅随不同蛋白质变化。 硫酸铜法:称取0.2g硫酸铜,6g硫酸钾,把0.5g粉碎好的大豆(不用测量水分的)用滤纸包好放入定氮瓶中中,加20ml硫酸,
(瓶口上放一个小漏斗,防止蛋白跑掉)小火在电炉子上消化,等没有碳化颗粒,并处于澄清状态时,拿下来凉一会。再加过氧化氢直到把瓶颈上的蛋白冲洗干净为止,再消化30分钟。拿下来,等凉。 通过这篇文章对于蛋白质含量测定方法的介绍,我们应该都知道如何在生活检查蛋白质的含量,所以我们建议大家应该要对于蛋白质的测定方法进行分析。一般我们在生活中检测蛋白质的方法是比较多的,希望你们可以采纳文章介绍的方法。
考马斯亮蓝染色法测定蛋白质含量 一、实验目的 掌握考马斯亮蓝法测定蛋白质含量的原理和方法。学习分光光度计的原理及使用方法。 二、实验原理 三、实验步骤 试剂 试管编号 0 1 2 3 4 5 6 7 标准蛋 白质溶 液/ml 0.00 0.02 0.04 0.06 0.08 0.1 样品0.1 样品0.1 相当于 蛋白质 含量/微 克0.00 20 40 60 80 100 未知未知 蒸馏水 /ml 0.1 0.08 0.06 0.04 0.02 0 0 0 考马斯 亮蓝染 液/ml 3 3 3 3 3 3 3 3 1、打开分光光度计,预热30min。 2、取8支洁净的干燥试管,按上表进行编号,0~5号用于标准曲线的绘制,6号、7号用于 样品溶液的测定。 3、取微量注射器,用蒸馏水清洗3次,再用标准蛋白质溶液润洗2次。按上表在0~5号试 管中加入标准蛋白质溶液,然后用蒸馏水洗3次,再按上表在0~5号试管中加入相应含量的蒸馏水。 4、微量注射器用样品润洗2次,抽取100微克的样品加入到6号试管,再抽取100微克加 到7号试管。用蒸馏水清洗微量注射器。 5、取5ml的移液管,用蒸馏水清洗3次,用考马斯亮蓝染液润洗2次。在0~7号试管中各 加入3.0ml的考马斯亮蓝染液。振荡试管,混合均匀。 6、待其充分反应(约2分钟)后,用分光光度计分别测它的吸光值。 7、用0~5号的数据。以蛋白质浓度为横坐标,光吸收值为纵坐标,绘制标准曲线。 8、由样品液的吸光值查标准曲线求出蛋白质含量。 四、实验结果与分析 试管编号0 1 2 3 4 5 6 7 A595 0 0.383 0.603 0.871 1.093 1.189 0.876 0.83 6 样品溶液吸光值=(0.876+0.836)/2=0.856 查标准曲线得样品液的蛋白质含量为66.0微克
考马斯亮蓝法测定蛋白质浓度的具体方法及步骤 蛋白质浓度测定的方法有很多,考马斯亮蓝测定蛋白质是实验室最常见的一种方式,它利用比色法和色素法混合方法、操作简便,下文介绍了考马斯亮蓝测定蛋白质浓度的原理、优缺点、操作以及注意事项。 实验原理 考马斯亮蓝(Coomassie Brilliant Blue)法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。这一方法是目前灵敏度最高的蛋白质测定法。 考马斯亮兰G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰(lmax)的位置,由465 nm变为595 nm,溶液的颜色也由棕黑色变为兰色。通过测定595 nm处光吸收的增加量可知与其结合蛋白质的量。研究发现,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。考马斯亮蓝染色法的突出优点是: (1)灵敏度高,据估计比Lowry法约高四倍,其最低蛋白质检测量可达1 mg。这是因为蛋白质与染料结合后产生的颜色变化很大,蛋白质-染料复合物有更高的消光系数,因而光吸收值随蛋白质浓度的变化比Lowry法要大的多。 (2)测定快速、简便,只需加一种试剂。完成一个样品的测定,只需要5分钟左右。由于染料与蛋白质结合的过程,大约只要2分钟即可完成,其颜色可以在
1小时内保持稳定,且在5分钟至20分钟之间,颜色的稳定性最好。因而完全不用像Lowry法那样费时和严格地控制时间。 (3)干扰物质少。如干扰Lowry法的K+、Na+、Mg2+离子、Tris缓冲液、糖和蔗糖、甘油、巯基乙醇、EDTA等均不干扰此测定法。 此法的缺点是: (1)由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同,因此考马斯亮蓝染色法用于不同蛋白质测定时有较大的偏差,在制作标准曲线时通常选用g—球蛋白为标准蛋白质,以减少这方面的偏差。 (2)仍有一些物质干扰此法的测定,主要的干扰物质有:去污剂、Triton X-100、十二烷基硫酸钠(SDS)等。 试剂与器材 一、试剂 考马斯亮蓝试剂: 考马斯亮蓝G―250 100 mg溶于50 mL 95%乙醇中,加入100 mL 85%磷酸,用蒸馏水稀释至1000 mL。 二、标准和待测蛋白质溶液 1. 标准蛋白质溶液
. 蛋白质含量测定主要有五种方法,分别是凯式定氮法、双缩脲法、紫外吸收法、酚试剂法和考马斯亮蓝法。这五种方法各有特点,优缺点明确。 凯氏定氮法 蛋白质是含氮的化合物。食品与浓硫酸和催化剂共同加热消化,使蛋白质分解,产生的氨与硫酸结合生成硫酸铵,留在消化液中,然后加碱蒸馏使氨游离,用硼酸吸收后,再用盐酸标准溶液滴定,根据酸的消耗量来乘以蛋白质换算系数,即得蛋白质含量。因为食品中除蛋白质外,还含有其它含氮物质,所以此蛋白质称为粗蛋白。 优点:重现性好,是目前分析有机化合物含氮量常用的方法,是一种蛋白质测定的经典方法, ,测试结果准确。 缺点:操作比较繁复,费时,试剂消耗量大。且此法测定的蛋白质含量实际上包括了核酸,生物碱,含氮类脂,卟啉,含氮色素等非蛋白质含氮化合物。 双缩脲定氮法 双缩脲(NHCONHCONH)是两个分子脲经180℃左右加热,放出一个33分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO形成紫色络合物,称4为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1~10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。 优点:较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的
缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋1 / 5 . 白质测定。 缺点:不太灵敏;不同蛋白质显色相似。 紫外吸收定氮法 双缩脲法是传统的分光光度法测定蛋白质的方法,当含有两个或者两个以上肽键的物质和碱性的硫酸铜反应时,形成紫色的络合物,这个颜色产物是肽键中的氮原子和铜离子配价结合的结果。蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。形成颜色产物的量取决于蛋白质的浓度。实际测定时,必须预先用标准蛋白质溶液制作一个标准校正曲线,通常用牛血清白蛋白水溶液做蛋白质标准溶液。不同浓度的标准蛋白质溶液加入双缩脲试剂后,反应生成的颜色产物用紫外-可见分光光度计在540nm 波长下测定吸光度,以双缩脲试剂加缓冲或水作空白对照。然后将测得的值分别对蛋白浓度(mg/ ml) 作图,得标准曲线。未知蛋白样品用双缩脲试剂做同样处理,根据测得吸光度值在标准曲线上直接查得未知蛋白质样品中得蛋白质浓度。 优点:对各种蛋白质呈色基本相同;特异性和准确度好,精密度好;呈色稳定性好,试剂单一,方法简便。快速,不消耗样品,测定后仍能回收使用。 缺点:准确度较差,干扰物质多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质,有一定的误差。故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。核酸的干扰可以通过查校正表,再进行计算的方法,加以适当的校正。但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。此外,进行紫外吸收
第二法,Lowry法 ------摘自2010版药典 本法用于微量蛋白质的含量测定。蛋白质在碱性溶液中可形成铜-蛋白复合物,此复合物加入酚试剂后,产生蓝色化合物,该蓝色化合物在波长650nm处的吸光度与蛋白质的含量成正比,根据供试品的吸光度,计算供试品的蛋白质含量。 试剂 (1)酚试剂称取钨酸钠(Na2WO4·2H2O)100g、钼酸钠(Na2MnO4·2H2O)25g,置1500ml 蒸馏瓶中,加入700ml水、85%磷酸50ml、盐酸100ml,上连回流管(使用木塞或锡纸包裹的橡皮塞)微沸回流10 小时。取下回流管,加入硫酸锂150g、水50 ml、溴液几滴,煮沸约15分钟,驱除过量的溴。冷却,加水至1000ml,过滤,为酚试剂储备液。 酚试剂储备液用氢氧化钠滴定液(0.5mol/L)测定酸浓度,然后加水稀释至相当于1mol/L沿酸浓度。 (2)碱性铜溶液量取0.1mol/L酒石酸钾溶液与0.04mol/L硫酸铜溶液各0.5ml,4%碳酸钠溶液与0.8%氢氧化钠溶液各25ml,摇匀,即得。本液临用配制。 (3)氢氧化钠滴定液(0.5mol/L)的配制及标定去氢氧化钠适量,加水搅拌使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后,量取澄清的氢氧化钠饱和溶液28ml,加新煮沸后的冷却水,使成1000ml,摇匀。 取在105℃干燥至恒重的基准邻苯二甲酸氢钾约3g,精密称定,加新煮沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示剂2滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。每1ml氢氧化钠滴定液相当于102.1mg的邻苯二甲酸氢钾。根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。 标准蛋白溶液的制备用水将蛋白标准品定量稀释至每1ml含1mg,作为储 备液。精密量取储备液2.5ml置25ml量瓶中,用水稀释至刻度,摇匀,即为每1ml含100μg 的标准蛋白质溶液。 测定法精密量取一定体积供试品(含蛋白质50μg左右)置试管内,加水至1ml, 加碱性铜溶液5ml,摇匀,室温放置10分钟,快速加入酚试剂0.5ml摇匀,室温放置30分钟,显色后,照紫外-可见分光光度法(附录ⅡA),在波长650nm处测定吸光度(呈色后,如果发现浑浊,经每分钟3000转离心15分钟后,取上清液测定)。精密量取标准蛋白溶液0.2ml、0.4ml、0.6ml、0.8ml、1.0ml分别置于试管中,自“加水至1ml”起,同法操作。准确量取水1ml,自“加碱性铜溶液5ml”起,同法操作,作为空白对照。以标准品的蛋白质浓度对其相应吸光度做直线回归,求得直线回归方程,即得供试品的蛋白质含量。