
第十四章 气体分子热运动的统计规律
(statistical law of thermal motion of gas molecular ) §14-1 平衡态 概率 统计平均值
(equilibrium state ,probability ,statistical mean quantity ) 一、平衡态(equilibrium state ) 1、概念(concept )
宏观性质长时间不改变的状态 2、描述(describe )
(1)状态参量
① 体积V:气体分子所能到达的空间(3
m ) ② 压强P:单位面积上受到的压力 (
) 单位面积的动量变化率 (
)
③ 温度T:气体的冷热程度 (K)
VPT间关系——物态方程
RT M
pV μ
=
(但只有两个是独立变量)
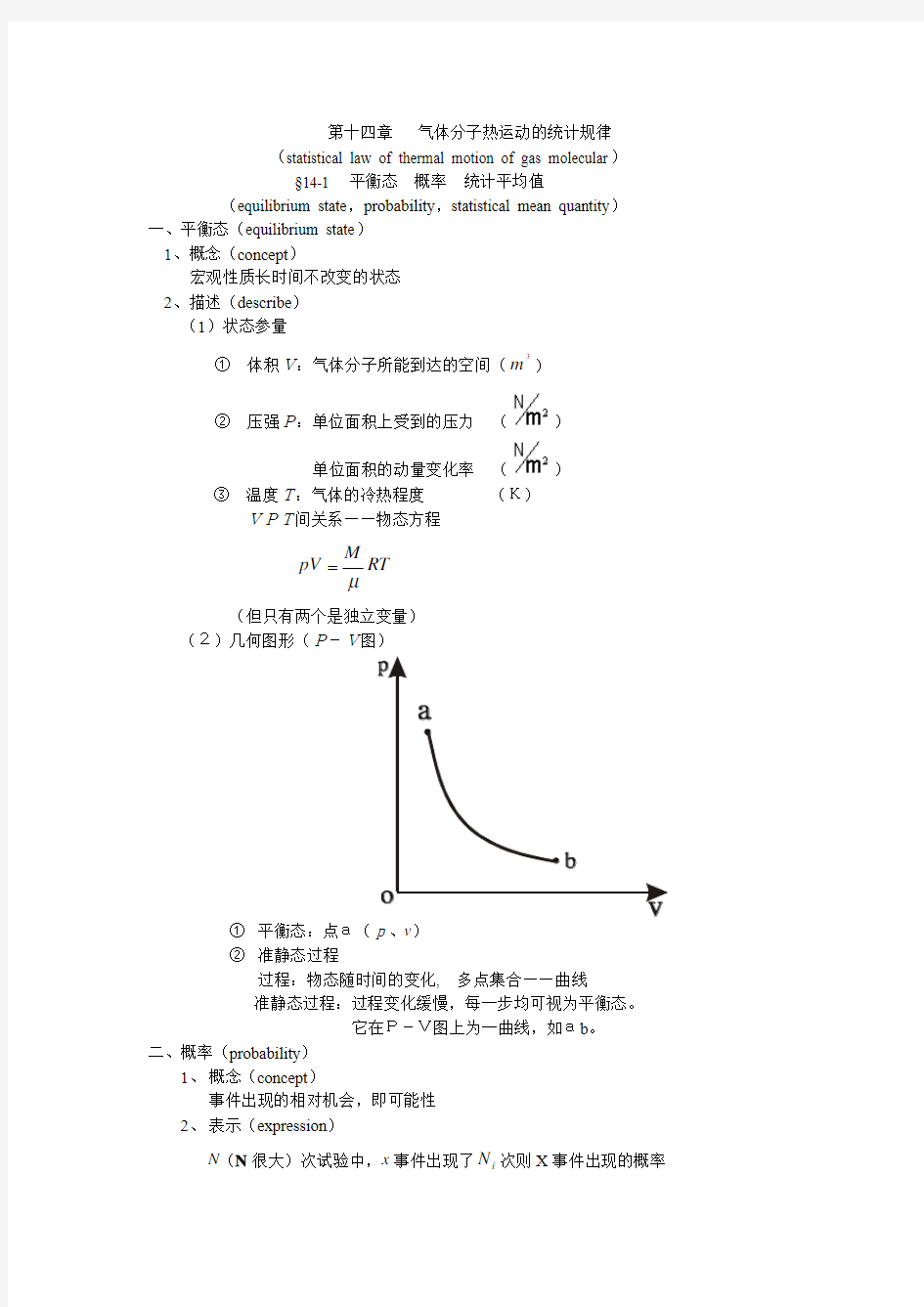
(2)几何图形(P-V图)
① 平衡态:点a(p、v ) ② 准静态过程
过程:物态随时间的变化, 多点集合——曲线
准静态过程:过程变化缓慢,每一步均可视为平衡态。 它在P-V图上为一曲线,如ab 。 二、概率(probability )
1、 概念(concept )
事件出现的相对机会,即可能性 2、 表示(expression )
N (N 很大)次试验中,x 事件出现了i N 次则X 事件出现的概率
P (X )=
N
N i
(离散事件) 如果事件连续分布,且f (x )表示单位间隔中出现的概率, (亦称概率密度或分布函数)则出现在d x 间隔中的概率 p (x )= f (x )d x 3、 特性(specific property ) (1) 小于1 , p (x )≤1 (2) 归1 , ∑p (x )=1 ,
1)(0
=?
∞
dx x f
4、 等概率假设(postulate of equal probability )处于平衡态时,分子向各个方向运动概
率相等
三、平均值(mean quantity )
1、 概念(concept )
物理量的平均大小,表示量上加“一”,如x 2、 计算(computer ) (1) 离散情况 n n i
i p x p x p x N
N x x +++=∑=
(2211)
(2) 连续情况
?
=dx x xf x )(
某变量的平均值=该量与分布函数的乘积对变量积分
§14—2 气体压强与温度的统计意义
(statistical meaning of gas pressure and temperature )
一、气体的微观模型(microscopic model of gas )
1、 微观模型 (microscopic model )
(1) 分子可视为质点,同类分子的质量相同
(2) 分子除碰撞外无其它相作用,而分子的碰撞为弹性碰撞 2、 验证(verification )
不能直接用实验
而是根据其推论与宏观实际(气体宏观实验)一致性来检验
二、压强(pressure )
1、 实质(substance )
大量分子对器壁的碰撞, 单位面积的动量变化率
s
t p s F p ???=?=
2、 公式(formula )
(1)如图,一个分子质量为m ,速率为i v 的分子
与器壁s ?碰后动量大小的变化(在x 方向上)
i
v
ix i i mv mv p 2cos 2-=-=?θ (力学) (2)一群处于斜高为i v t ?,底面为
s ? 的柱体中速率基本为i v 的分子与s ?碰后的动量变化
① 柱体中速率基本为i v 的分子数(设分子数密度为i n , θcos 'i tv s ni N ??= ② 它们与 s ?碰后动量的变化
t s nimv p N P ix i i ??-=?=?2
2''
但据等概率假设,有一半的分子可能反向
运动而不能与s ?同时相碰,故动量变化应修正减半,即 t s nimv P ix i ??-=?2
斜柱体中各种速率分子与s ?相碰后引起总动量变化
t
s v nm t s v n n nm n
n
t
s v n m Pi P x ix i ix i ??-=??∑-=??∑-=?∑=?2
2
2
(统计)
据等概率假设
2
22222
3x y x v v v v v =++=
即 3
2
2
v
v x
= (统计) 故气体动量的变化 t s v
nm
p ??-=?3
2
气体受到器壁的作用:
s v nm t
p F ?-=??=
3'2
(4)根据牛顿第三定律,气体对器壁的作用力'F F -=
压强公式 据定义
s
t p
p ???=
k n v m n v nm ε3
2
21323122===
式中 ,2
2
1v m k =ε 为单个分子的平均动能
统计力学处理问题方法小结
(1) 对单个粒子:用牛顿力学规律
(2) 对大量粒子:用统计规律(求平均值) 3、统计意义(statistical meaning )
∵公式的推导应用了统计的概念及方法 ∴压强是个统计量,是大量分子的集体表现,对少数几个分子说它们有多大压强无意义。
三、温度(temperature )
1、 公式(formula )
由物态方程
为玻耳兹曼常量为分子数密度式中得
加工整理A
k
A N R
k V
N
n n nkT T N R v n m VN NmRT V MRT p RT M
pv =
======
=,3
2
,,4εμμ
故得
2~2
3
v kT x ε=
2、 微观意义(microscopic meaning )
从温度公式可以看出,温度随分子运动速度增减面增减 温度是分子热运动剧烈程度的量度 3、 统计意义(statistical meaning )
从温度公式可以看出 K T ε~ (统计平均量)
∴温度是个统计量,是大量分子热运动的集体表现,离开了大量分子,仅说单个分子
或少数几个分子,有多高温度是没有意义的。 4、说明(explain )
(1)在很多物理公式中,k ,T 均以乘积形式同时出现,互不分离,故我们亦无必要
将其拆开,由于k T 的量纲与能量相同,
故也有人用能量单位来表示温度
(2)P=n kT 由物态方程PV =
RT M
μ
导出,因此也有人将其符为物态方程
① 随堂小议(discuss on the class )
关于温度的概念:下列说法中不正确的是(3)
(1) 温度的高低反映了物体内部分子运动剧烈程度的不同; (2) 气体的温度是分子平均平动动能的是度;
(3) 从微观上看,气体的温度表示气体每个分子的冷热程度; (4) 气体的温度是大量气体分子的集体形为,具有统计性
§14—3 玻耳兹曼分布律 (Boltzmann distribution )
一、气体分子在重力场中的分布(distribution of gas molecular in gravity field )
1、 等温气压公式(isothermal-pressure formula )
(1) 公式(formula )
dp
p +dz
z +
p 0
z s ?
利用空气柱模型可得压力差 pgdz s
mg
dp -=?-
= 利用p=nkt 可得密度
)2(ln ln )
1(ln 00
0000000
--------==
-------==-=
=→------===?=--??
p
p g RT p p mg kT z e
p e p p kT mgz p
p z p dz kT
mg
p dp kT
mp
nm sdz m p RT
gz
kt mgz
z
p μμ对应高度故积分得处压强故
式(1):等温气压公式 式(2):等温高度公式 (2) 物理意义
在温度不变情况下,大气压强随高温增加而接指数规律减少(Z ↑,P ↓)
2、 气体分子在重力场中的分布(distribution of gas molecular in gravity field )
利用P=nkT 可得
KT
mgz
e
n n -=0
分子数密度n 随高z 的增加而接指数规律减少 二、玻耳兹曼他分布(Boltzmann distribution )
1、 公式(formula )
可以得出(推导过程不要求)
KT
E e
I
A n -=
n ——分子数密度 A ——常量
i E ——粒(分)子的能量 kT
Ei
-——玻耳兹曼因子
2、 物理意义(meaning of physics )
具有i E 能量的分子数密度n 随i E 的增加而按指数规律减少——微观粒子优先占领
低能级。
3、 应用(application )
很广,如分离同位素,激光理论等
§14-4 麦克斯韦速率分布律
(Maxwell speed distribution )
一、麦克斯韦速率分布律(Maxwell speed distribution )
1、内容(content )
处于平衡态的气体,其分子处于某一速率附近(v ~dv v +) 的数目dN 与总分子数N 之比
dv v f dv v e nKT
m n N dN KT
mv )()2(4222
32
==-
(其推导不作要求) 2、实质(substance ) 是一概率分布
反映分子以速率v 出在dv 速率间隔内的分子占总分子数的比率,亦即出现概率。 3、特点(characteristic )
具有归一性,即
??==dv v f N dN
)(1
二、分布函数与分布曲线(distribution function and distribution curve )
4、 分布函数(distribution function )
(1) 概念
N d v
dN
v e nKT m n v f KT mv =
=-22232)2(4)( (2)实质
概率密度
5、 分布曲线(distribution curve )
(1) 概念
反映分布函数f (v )随v 而变化的曲线
(2) 得来
① 定量法
制表—计算一连点成图
v 1v 2v ……
f(v) 1f 2f ……..
② 定性法
(f
1) v = 0, f (v ) = 0,过O 点, 2) 初时 ↓?↑-↑↑
2
2,kv e
v
v 小陡
3) 而后 ↓↓↑?-2
kv v v 大 缓慢
4) 拐点 p v v =
(3) 几何意义
曲线下方面积→概率
曲线下方总面积=1 (归一化) (A ) 最概然速率
① 概念:对应拐点的速率
② 物理意义:分子以该速率出现概率最大
③ 大小:μ
RT
m kT v dv
df
p 41
.141.10===可得由
(4) 影响分布曲线形状的因素:
①m=c T ↑, p v ↑,右移,线矮平 ②T=c , m ↑,p v ↓,左移,线陡峭
(参见附图)
三、应用(application )
——两种速率的计算
1、平均速率(mean speed ) ?
===
==μRT
m kT m KT dr v vf v 60
.160.18......)( 利用积分公式?
∞
-=
32
12
dx e
x x 。 2、平均根速率(root-mean-square speed )
μ
RT
m kT m kT V m
kT dr
v f v v 73.173.133)(222===
∴=
=?
3、三种速率比较
(1)大小
41.1:60.1:73.1::2=p v v v
(它们有公共因子m
kT ) (2)用途
分子按速率分布
平均自由程分子运动能量动能分子——)(——)(——2p v v v 三、随堂练习(practice on the class )
1、 注意(take note )
(1) 理解f (v )的物理意义,会用它来分析简单情况下的分子分布。
(2) 理解分布线与p v 的关系,会用m 、T 的变化分析判断分布曲线的形状。 2、 例题(example )
例14—5 设N (很大)个气体分子的速率分布函数 =)(x f 0
)(0v v v c --
)
()0(00v v v v >≤≤
其中c 、0v 为常量,且已知,求
(1) 常量c ;
(2) 速率在 0~0.30v 间分子数。
解(1)分布函数中的常量常由归一化条件求解
13)23()()()(0
00
3
003
30
==--=--==
????∞v
v v c v v v v c vdv
v
v c dv v f dv x f 由
得 30
6
v c =
(2)据麦克斯韦速率分布律可得
216
.0]23[6)(6)(0
3.00
03303.00
03
3.00
=--=--
=
=??
?v v v vv v v vdv
v v v dr
v f N
N
故 N N 216.0=?
① 随堂小议(discuss on the class )
设某温度下氢与氧的分布函数曲线如图所示
(f 则代表氧的分布函数曲线为 (1) 曲线① (2) 曲线②
(②)
§14-5气体分子的平均动能 理想气体的内能
(mean kinetic energy of gas molecular internal energy of ideal gas)
一、自由度(free degree )
1、 概念(concept )
确空物体空向位置所需独立坐标数 2、 数目(number )
(刚性分子)
(1) 单原子分子→质点)(3三平动==?t i
(2) 双原子分子→两点一线)(23三平二转+=+=?r t i
(3) 三原子分子→两点一线一点)(123三平三转++=+=?r t i
(多原子分子同三原子分子)
二、能量均分定理(equipartition theorem )
1、 内容(content )
(1) 单原子分子
2
21)(2
32
122
22
2
2
2
2
2
2
2
kT v m v v v v v v v KT v m x y x y x k ====++==
=等概率而ε
∴一个自由度上的动能为2
kT
(2) 推广到一般情况——均分定理
∵各向运动机会相等。
∴当气体处于平衡态时,每个自由度上都平均分配有
2
kT
的平动动能 2、 证明(proof )不作要求
分子总动能
kT r t kT i )(2
12+==ε
三、理想气体的内能(internal energy of ideal gas )
1、 概念(concept )
理想气体无相互作用
∴理想气体的内能等于组成理想气体的各分子动能之和 2、 1个分子的平均动能(mean kinetic energy of a molecular )
kT i kT r t 2
)(21=+=ε
3、 1mol 分子的内能(molar internal energy ) RT i
kT N i N E A A mal 2
2=
=ε 4、 M 物质的内能(internal energy of M matter ) RT i
M NE E mol 2
μ=
= 可见,E 仅为T 的函数(对于一定量的理想气体),T 变则E 也变,即 T R i
M E ?=
?2
μ 四、随堂练习(practice on the class )
1、 注意(take note )
(1) 分清公式的物理意义
(2) 分清气体(均作理想气体看待)的性质 2、 例题(example )
例14-6计算500克氧气在c 0
0时的分子平均动能摩尔内能及内能。 解 氧气为双原子分子所以i =5
故氧分子的平均动能
)(1042.92731038.12
522123J kT i --?=???==ε
氧气的摩尔内能 )(1078.427331.82
5
22J RT i E m ?=??==
氧气的内能
)(1047.727331.82510
2.35.0232
J RT i M E ?=????==-μ
§14-6气体分子的平均自由程 (mean free path of gas molecular )
一、气体分子的热运动图象(thermal motion picture of gas molecular )
频繁碰撞 曲折复杂
二、平均碰撞频率(mean collision frequency ) 1、 概念(concept )
分子在单位时间里与其它分子的平均碰撞次数
2、 公式(formula )
在此时间内,分子与其它分子相碰的数目
(1) 其它分子不动
设分子有效直径(两分子碰撞所能接运的最少距离)为D ,分子数
密度为n ,以D 为半经,分子路径为轴, t V ? 为斜高作曲柱体如图
则柱体之积
t v D sh v ?==?2
π
体内平均分子数(它们均会与跟踪分子相碰) t v D n v n N ?=?=2'π (2) 其它分子也动
v 应用相对速度u 表示,其关系为
v u 2=
此时平均可碰分子数应修正为
t v D n N ?=)2(2
π
故平均碰撞频率
v n v D n t
N
z σπ222==?=
()2D πσ= 影响因数(正比于n )v 三、平均自由程(mean free path )
1、 概念(concept )
相邻两次碰撞间(自由)路程的平均值 2、 公式(formula )
据定义,平均自由程
p
kT
n z v t v σσλ221=
==
= 影响因数反比于分子数密度n 。
① 随堂小议(discuss on the class )
容积不变的容积储存有一定量的理想气体,温度为0T ,分子的平均速率为0v ,平均碰撞频率为0z ,平均自由程为0λ。当温度T 升至40T 时其分子的平均速率v ,
平均碰撞频率z ,平均自由程为
;
,2,2)2(;,2,4)1(000000λλλλ=======z z v v z z v v
[(2)]
作业(home work )
14-1,14-16,14-23,14-24,14-27
专题三:气体实验定律 理想气体的状态方程 [基础回顾]: 一.气体的状态参量 1.温度:温度在宏观上表示物体的________;在微观上是________的标志. 温度有________和___________两种表示方法,它们之间的关系可以表示为:T = ________.而且ΔT =____(即两种单位制下每一度的间隔是相同的). 绝对零度为____0 C,即___K ,是低温的极限,它表示所有分子都停止了热运动.可以无限接近,但永远不能达到. 2.体积:气体的体积宏观上等于___________________________________,微观上则表示_______________________.1摩尔任何气体在标准状况下所占的体积均为_________. 3.压强:气体的压强在宏观上是___________;微观上则是_______________________产生的.压强的大小跟两个因素有关:①气体分子的__________,②分子的_________. 二.气体实验定律 1.玻意耳定律(等温变化) 一定质量的气体,在温度不变的情况下,它的压强跟体积成______;或者说,它的压强跟体积的________不变.其数学表达式为_______________或_____________. 2.查理定律(等容变化) (1)一定质量的气体,在体积不变的情况下,温度每升高(或降低)10 C ,增加(或减少)的压强等于它在___________.其数学表达式为_______________或_____________. (2)采用热力学温标时,可表述为:一定质量的气体,在体积不变的情况下,它的压强与热力学温度成______.其数学表达式为____________. (3)推论:一定质量的气体,从初状态(P ,T )开始,发生一等容变化过程,其压强的变化量△P 与温度变化量△T 的关系为_____________. 3.盖·吕萨克定律(等压变化) (1)一定质量的气体,在压强不变的情况下,温度每升高(或降低)10 C ,增加(或减少)的体积等于它在___________.其数学表达式为_______________或_____________. (2)采用热力学温标时,可表述为:一定质量的气体,在压强不变的情况下,它的体积与热力学温度成______.其数学表达式为____________. (3)推论:一定质量的气体,从初状态(V ,T )开始,发生一等压变化过程,其体积的变化量△V 与温度变化量△T 的关系为_____________. 三.理想气体状态方程 1.理想气体 能够严格遵守___________的气体叫做理想气体.从微观上看,分子的大小可忽略,除碰撞外分子间无___________,理想气体的内能由气体_____和_____决定,与气体_____无关.在___________、__________时,实际气体可看作理想气体. 2.一定质量的理想气体状态方程: 2 2 2111T V P T V P = 3.密度方程: 2 22111ρρT P T P = [重难点阐释]: 一.气体压强的计算
一.单项选择题 1、用于测定两个变量之间密切程度的方法是( D )。 A、定性判断 B、相关表 C、相关图 D、相关系数 2、产品产量和单位成本的相关系数是—0.95,单位成本和利润率的相关系数是0.90,产量和利润的相关系数是0.08,因此( C)。 A、产量和利润的相关程度最高 B、单位成本和利润率的相关程度最高 C、产量和单位成本的相关程度最高 D、无法判断哪对变量的相关程度最高 3、相关系数的取值范围是( D )。 A、0≤r≤1 B、-1≤r≤0 C、r>0 D、-1≤r≤1 4、变量x和y之间的负相关是指(C )。 A、x值增大时y值也随之增大 B、x值减少时y值也随之减少 C、x值增大时y值随之减少,或x值减少时y值随之增大 D、y的取值几乎不受x取值的影响 5、两个变量之间的相关关系称为( B )。 A、复相关 B、单相关 C、曲线相关 D、直线相关 6、、正方形的边长和周长的相关系数为( A )。 A、1 B、-1 C、0 D、无法计算 7、在一元线性回归方程中,回归系数b的含义是( B )。
A 、当x=0时,y 的平均值 B 、当x 变动一个单位时,y 的平均变动数额 C 、当x 变动一个单位时,y 增加的总数额 D 、当y 变动一个单位时,x 的平均变动数额 8、常用的求解一元线性回归方程的方法是( B )。 A 、相关系数法 B 、最小平方法 C 、误差绝对值最小法 D 、误差和最小法 9、下列回归方程和相关系数的对应式中,错误的是( C ) A 、89.0,5.2170?-=-=r x y B 、94.0,8.35?-=--=r x y C 、78.0,5.036?-=+=r x y D 、98.0,9.25?=+-=r x y 10、已知变量x 和y 线性相关,x 和y 的协方差为-60,x 的方差为 64,y 的方差为去100,则二者的相关系数的值为( B )。 A 、0.75 B 、-0.75 C 、0.1 D 、-0.1 11、已知变量x 和y 高度线性相关,x 和y 的协方差为-60,x 的方 差为64,y 的方差为去100,则建立的y 依x 回归方程中的回归系 数b 的值为( B )。 A 、0.94 B 、-0.94 C 、0.6 D 、-0.6 12、若相关系数为正值,则回归系数的值( B )。 A 、为负 B 、为正 C 、视a 的符号而定 D 、不能确定 13、回归估计标准误差是说明( C )的指标。 A 、平均数代表性 B 、现象之间相关程度
气体定律练习题 A 基础达标 1.一定质量的理想气体处于平衡状态Ⅰ.现设法使其温度降低而压强升高,达到平衡状态Ⅱ,则() A.状态Ⅰ时气体的密度比状态Ⅱ时的大 B.状态Ⅰ时气体的平均动能比状态Ⅱ时的大 C.状态Ⅰ时分子间的平均距离比状态Ⅱ时的大 D.状态Ⅰ时每个分子的动能都比状态Ⅱ时的分子平均动能大 2. (09·全国卷Ⅰ·14)下列说法正确的是() A. 气体对器壁的压强就是大量气体分子作用在器壁单位面积上的平均作用力 B. 气体对器壁的压强就是大量气体分子单位时间作用在器壁上的平均冲量 C. 气体分子热运动的平均动能减少,气体的压强一定减小 D. 单位面积的气体分子数增加,气体的压强一定增大 3.(09·全国卷Ⅱ·16)如图12-3-9,水平放置的密封气缸内的气体被一竖直隔板分隔为左右两部分,隔板可在气缸内无摩擦滑动,右侧气体内有一电热丝。气缸壁和隔板均绝热。初始时隔板静止,左右两边气体温度相等。现给电热丝提供一微弱电流,通电一段时间后切断电源。当缸内气体再次达到平衡时,与初始状态相比() A.右边气体温度升高,左边气体温度不变 B.左右两边气体温度都升高 C.左边气体压强增大 D.右边气体内能的增加量等于电热丝放出的热量 4.(09·上海物理·9)如图为竖直放置的上细下粗的密闭细管,水银柱将气体分隔成A、B两部分,初始温度相同。使A、B升高相同温度达到稳定后,体积变化量为?V A、?V B,压强变化量为?p A、?p B,对液面压力的变化量为?F A、?F B,则() 12-3-9
A .水银柱向上移动了一段距离 B .?V A <?V B C .?p A >?p B D .?F A =?F B 5.(08全国卷2)对一定量的气体, 下列说法正确的是 ( ) A .气体的体积是所有气体分子的体积之和 B .气体分子的热运动越剧烈, 气体温度就越高 C .气体对器壁的压强是由大量气体分子对器壁不断碰撞而产生的 D .当气体膨胀时,气体分子之间的势能减小,因而气体的内能减少 6.(08重庆卷)地面附近有一正在上升的空气团,它与外界的热交热忽略不计.已知大气压 强随高度增加而降低,则该气团在此上升过程中(不计气团内分子间的势能)( ) A.体积减小,温度降低 B.体积减小,温度不变 C.体积增大,温度降低 D.体积增大,温度不变 7.(08年上海卷)已知理想气体的内能与温度成正比。如图12-3-10 所示的实线汽缸内一定质量的理想气体由状态1到状态2的变化 曲线,则在整个过程中汽缸内气体的内能 ( ) A.先增大后减小 B.先减小后增大 C.单调变化 D.保持不变 8.(08年上海卷)如图12-3-11所示,两端开口的弯管,左管插入 水银槽中,右管有一段高为h 的水银柱,中间封有一段空气,则 ( ) A.弯管左管内外水银面的高度差为h B.若把弯管向上移动少许,则管内气体体积增大 C.若把弯管向下移动少许,则右管内的水银柱沿管壁上升 D.若环境温度升高,则右管内的水银柱沿管壁上升 9.(海南省民族中学2009届高三月考试卷.物理.3)如图12-3-12所示,导热性能良好的 气缸内用活塞封闭一定质量的空气,气缸固定不动,外界温度恒定。一条细线左端连接在活 塞上,另一端跨过定滑轮后连接在一个小桶上,开始时活塞静止。现在不断向小桶中添加细 沙,使活塞缓慢向右移动(活塞始终未被拉出气缸)。忽略气 12-3-10 12-3-11
第三章气体分子热运动速率 和能量的统计分布 ?3.1气体分子的速率分布律 ?3.2用分子射线实验验证麦克斯韦速度分布律?3.3玻尔兹曼分布律 重力场中微粒按高度的分布 ?3.4能量按自由度均分定理
3.1气体分子的速率分布律 统计规律性: 分子运动论从物质微观结构出发,研究大量分子组成的系统的热性质。其中个别分子的运动(在动力学支配下)是无规则的,存在着极大的偶然性。但是,总体上却存在着确定的规律性。(例:理想气体压强)人们把这种支配大量粒子综合性质和集体行为的规律性称为统计规律性。 气体中个别分子的速度具有怎样的数值和方向完全 是偶然的,但就大量分子的整体来看,在一定的条件下,气体分子的速度分布也遵从一定的统计规律。为研究气 体分子速度分布的定量规律,有必要介绍分布函数的概 念。
例1:统计某城市中每个商店里职工的分布情况,可用下列方法。 分布函数和平均值 偶然事件:大量出现不可预测的事件。多次重复观察同样的事件,可获得该偶然事件的分布,从而得到其统计规律。 表示该城市中的商店总数 表示该城市中有个职工的商店数,称分布数。 i N i ∑=i N N 名职工的商店的百分数表示有i N N f i i 归一化的分布数,,=条件 归一化,1)(==∑∑N N f i i
例:我们以人的身高为例,来引入分布函数的概念。 设N 为总人数,d N (h )为身高在h--h+d h 间的人数。显然 ?=N h N )(d 令f (h )=d N (h )/N d h ,则 ?=1 d )(h h f 我们把f (h )称为归一化分布函数。 f (h )表征在单位高度内,身高为h 的人数占总人数的比率。 f(h)dh :高度在h 与h+dh 之间的概率
气体的等温变化、玻意耳定律典型例题 【例1】一个气泡从水底升到水面时,它的体积增大为原来的3倍,设水的密度为ρ=1×103kg/m3,大气压强p0=×105Pa,水底与水面的温度差不计,求水的深度。取g=10m/s2。 【分析】气泡在水底时,泡内气体的压强等于水面上大气压与水的静压强之和。气泡升到水面上时,泡内气体的压强减小为与大气压相等,因此其体积增大。由于水底与水面温度相同,泡内气体经历的是一个等温变化过程,故可用玻意耳定律计算。 【解答】设气泡在水底时的体积为V1、压强为:
p1=p0+ρgh 气泡升到水面时的体积为V2,则V2=3V1,压强为p2=p0。 由玻意耳定律 p1V1=p2V2,即 (p0+ρgh)V1=p0·3V1 得水深 【例2】如图1所示,圆柱形气缸活塞的横截面积为S,下表面与水平面的夹角为α,重量为G。当大气压为p0,为了使活塞下方密闭气体的体积减速为原来的1/2,必须在活塞上放置重量为多少的一个重物(气缸壁与活塞间的摩擦不计) 【误解】活塞下方气体原来的压强 设所加重物重为G′,则活塞下方气体的压强变为
∵气体体积减为原的1/2,则p2=2p1 【正确解答】据图2,设活塞下方气体原来的压强为p1,由活塞的平衡条件得 同理,加上重物G′后,活塞下方的气体压强变为 气体作等温变化,根据玻意耳定律:
得 p2=2p1 ∴ G′=p0S+G 【错因分析与解题指导】【误解】从压强角度解题本来也是可以的,但 免发生以上关于压强计算的错误,相似类型的题目从力的平衡入手解题比较好。在分析受力时必须注意由气体压强产生的气体压力应该垂直于接触面,气体压强乘上接触面积即为气体压力,情况就如【正确解答】所示。 【例3】一根两端开口、粗细均匀的细玻璃管,长L=30cm,竖直插入水银槽中深h0=10cm处,用手指按住上端,轻轻提出水银槽,并缓缓倒转,则此时管内封闭空气柱多长已知大气压P0=75cmHg。 【分析】插入水银槽中按住上端后,管内封闭了一定质量气体,空气柱长L1=L-h0=20cm,压强p1=p0=75cmHg。轻轻提出水银槽直立在空气中时,有一部分水银会流出,被封闭的空气柱长度和压强都会发生变化。设管中水银柱长h,被封闭气体柱长为L2=L-h。倒转后,水
第 二 章 分子动理学理论的平衡态理论 2-1 设有一群粒子按速率分布如下: 试求(1)平均速率V ;(2)方均根速率2 V (3)最可几速率Vp 解:(1)平均速率: 18 .32 864200 .5200.4800.3600.2400.12?++++?+?+?+?+?= V (m/s) (2) 方均根速率 37 .32 2 ?∑∑= i i i N V N V (m/s) 2-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。 解:s m RT V P /39510 3230031.8223 =???= = -μ s m RT V /44610 3214.330031.8883 =????= = -πμ s m RT V /48310 3230031.8333 2 =???= = -μ 2-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。 解:μ RT V P 2= 代入数据则分别为: T=100K 时 s m V P /1028.22 ?= T=1000K 时 s m V P /10 21.72 ?= T=10000K 时 s m V P /1028.23 ?=
2-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。 解:因 μ RT V 32 = πμ 2 8RT V = 由题意得: μRT 3πμ 2 8RT = ∴T 2/T 1=8 3π 2-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可 将dv 近似地取为△v=1m/s ) 解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N , 由麦氏速率分布律: △ N=V V e KT m N V KT m ????- 2 22 3 2 ) 2( 4ππ ∵ V p2= 2KT m ,代入上式 △N= V V V p p e V V V N ?- -? ?22221 4ρπ 因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /40210 2827331.823 ????= - △V=1m/s (v v p =1.24)代入计算得:△N=1.86×10-3N 个 2-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1 与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。 解: 取分子速率为V 1=3000m/s V 2=1500m/s, △V 1=△V 2=10m/s
第 三 章 气体分子热运动速率和能量的统计分布律 3-1 设有一群粒子按速率分布如下: 试求(1)平均速率V ;(2)方均根速率2 V (3)最可几速率 Vp 解:(1)平均速率: 18.32 864200 .5200.4800.3600.2400.12?++++?+?+?+?+?= V (m/s) (2) 方均根速率 37.32 2 ?∑∑= i i i N V N V (m/s) 3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。 解:s m RT V P /39510 32300 31.8223 =???= = -μ s m RT V /446103214.3300 31.8883 =????= = -πμ s m RT V /4831032300 31.8333 2 =???= = -μ 3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K
和10000K 。 解:μ RT V P 2= 代入数据则分别为: T=100K 时 s m V P /1028.22?= T=1000K 时 s m V P /1021.72?= T=10000K 时 s m V P /1028.23?= 3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。 解:因 μ RT V 32 = πμ 2 8RT V = 由题意得: μ RT 3πμ 2 8RT = ∴T 2/T 1=8 3π 3-5 求0℃时1.0cm 3 氮气中速率在500m/s 到501m/s 之间的 分子数(在计算中可将dv 近似地取为△v=1m/s ) 解:设1.0cm 3 氮气中分子数为N ,速率在500~501m/s 之间 内的分子数为△N ,由麦氏速率分布律: △ N=V V e KT m N V KT m ????-2223 2)2(4ππ ∵ V p2= 2KT m ,代入上式
习题课气体实验定律和理想气体状态方程 的应用
相关联的两部分气体的分析方法[要点归纳] 这类问题涉及两部分气体,它们之间虽然没有气体交换,但其压强或体积这些量间有一定的关系,分析清楚这些关系是解决问题的关键,解决这类问题的一般方法: (1)分别选取每部分气体为研究对象,确定初、末状态参量,根据状态方程列式求解。 (2)认真分析两部分气体的压强、体积之间的关系,并列出方程。 (3)多个方程联立求解。 [精典示例] [例1]用销钉固定的活塞把容器分成A、B两部分,其容积之比V A∶V B=2∶1,如图1所示,起初A中有温度为127 ℃、压强为1.8×105 Pa的空气,B中有温度为27 ℃、压强为1.2×105 Pa的空气,拔去销钉,使活塞可以无摩擦地移动且不漏气,由于容器壁缓慢导热,最后两部分空气都变成室温27 ℃,活塞也停住,求最后A、B中气体的压强。
图1 [解析] 对A 空气,初状态:p A =1.8×105 Pa ,V A =?,T A =400 K 。 末状态:p A ′=?,V A ′=?,T A ′=300 K , 由理想气体状态方程p A V A T A =p A ′V A ′T A ′得: 1.8×105V A 400 =p A ′V A ′300 对B 空气,初状态:p B =1.2×105 Pa ,V B =?T B =300 K 。 末状态:p B ′=?,V B ′=?,T B ′=300 K 。 由理想气体状态方程p B V B T B =p B ′V B ′T B ′得: 1.2×105V B 300 =p B ′V B ′300 又V A +V B =V A ′+V B ′, V A ∶V B =2∶1,p A ′=p B ′, 联立以上各式得p A ′=p B ′=1.3×105 Pa 。 [答案] 都为1.3×105 Pa
气体分子动理论 导读:本文是关于气体分子动理论,希望能帮助到您! 教学目标 知识目标 1、知道气体分子运动的特点. 2、知道分子沿各个方向运动的机会均等,分子速率按一定规律分布,这种规律是一种统计规律. 3、知道气体压强的微观解释以及气体实验定律的微观解释. 能力目标 通过用微观解释宏观,提出统计规律,渗透统计观点,以提高学生分析、综合、归纳能力. 情感目标 通过对气体分子定律以及气体实验定律的微观解释,尤其是统计规律的渗透,让学生体会其在科学研究中的作用.培养学生树立科学的探究精神. 教学建议 用微观的方法解释宏观现象,对学生来说,这是第一次接触,应从实际出发,通过模拟和举例来帮助学生理解统计规律的意义.理解气体压强的产生并解释气体的实验定律是本节的重要内容,也是提高学生分析、综合、归纳能力的有效途径.教学设计示例 (一)教学总体设计
1、教师应借助物理规律和课件展示,准确讲解,注意启发点拨,以学生自己讨论归纳. 2、学生应积极思考、认真观察、参与讨论、总结规律、解释现象. 教师通过动画模拟引入微观对宏观的解释、渗透统计思维,指导学生观察动画、分析特点,总结统计规律,解释有关现象.(二)重点·难点·疑点及解决办法 1、重点:气体压强的产生和气体实验定律的微观解释. 2、难点:用统计的方法分析气体分子运动的特点. 3、疑点 (1)气体分子运动与固体、液体分子运动有什么区别. (2)气体的压强是怎样产生的?它的大小由什么因素决定. 4、解决办法 用小球模拟分子碰撞器壁,联系实际,从实例出发理解气体压强的产生机理,并分析影响气体压强的因素. (三)教学过程 1、气体分子运动特点(条件允许,可以播放动画进行模拟演示) 在教师引导下得出结论: ①气体分子间距较大 ②气体分子充满整个容器空间 ③气体分子运动频繁碰撞 ④气体分子向各个方向运动的机会均等
分子和气体定律 SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
第六章 分子和气体定律 知识点一:阿伏伽德罗常数 1摩尔任何物质含有的微粒数相同,这个数叫做阿伏伽德罗常数,用A N 表示,且236.0210/A N mol =?。 注意:(1)阿伏伽德罗常数是联系微观世界和宏观世界的桥梁。如果已知物质的宏观量:摩尔质量M ,摩尔体积V ,就可以推算出分子质量,分子体积,估算出分子之间的距离等这些微观量。 (2)利用油膜法测量分子的直径,其测定结果表明,分子的直径的数量级是 1010m -。 【例1】对于液体和固体(不计分之间的空隙),若用M 表示摩尔质量,0m 表示分子质量,ρ表示物质密度,V 表示摩尔体积,0V 表示单个分子的体积,A N 表示阿伏伽德罗常数,则下列关系中正确的是( ) (A )0A V N V = (B )0A V N m ρ= (C )A M N V ρ= (D )M V ρ= 【例2】黄金的密度为3319.310/kg m ρ=?,摩尔质量为131.9710/u kg m -=?,求: (1) 金分子的质量 (2) 金分子的半径 【例3】将31cm 油酸溶于酒精,制成3200cm 的油酸酒精溶液。每31cm 该溶液有20滴。现将1滴该溶液滴到水面上,随着酒精溶解于水,油酸最终在水面上形成面积为20.50cm 的单分子膜层。试估测出油酸分子的直径。 知识点二:分子的热运动 1、扩散现象 不同的物质相互接触时彼此进入对方的想象叫扩散现象。 (1) 扩散的快慢与温度有光,温度越高,分子运动越激烈,扩散就越快。 (2) 扩散现象不仅可以在气体分子间发生,在固体之间和液体之间也会发 生。 2、布朗运动 液体中悬浮微粒的无规则运动叫布朗运动。
高中物理选修3-3导学案:8-5气体实验定律习题课
习题课:理想气体状态方程与气体实验定律的应用 1.理想气体状态方程与气体实验定律的关系: p 1V 1T 1=p 2V 2T 2? ???? T 不变:p 1V 1=p 2V 2(玻意耳定律) V 不变:p 1T 1=p 2 T 2(查理定律) P 不变:V 1T 1=V 2 T 2 (盖—吕萨克定律) 题型1: 玻璃管 2.几个重要的推论: ? ??? ?(1)查理定律推论:Δp =p 1T 1 ΔT (2)盖—吕萨克定律推论:ΔV =V 1T 1 ΔT (3)理想气体状态方程推论:p 0V 0T 0=p 1V 1T 1+ 1.一U 形玻璃管竖直放置,左端开口,右端封闭,左端上部有一光滑的轻活塞.初始时,管 内汞柱及空气柱长度如图所示.用力向下缓慢推活塞,直至管内两边汞柱高度相等时为止.求此时右侧管内气体的压强和活塞向下移动的距离.已知玻璃管的横截面积处处相同;在活塞向下移动的过程中,没有发生气体泄漏;大气压强p 0=75.0 cmHg.环境温度不变. 2.如图所示,一粗细均匀的U 形管竖直放置,A 侧上端封闭,B 侧上端与大气相通,下端开口处开关K 关闭;A 侧空气柱的长度l =10.0 cm ,B 侧水银面比A 侧的高h = 3.0 cm 。现将开关K 打开,从U 形管中放出部分水银,当两侧水银面的高度差为h 1=10.0 cm 时将开关K 关闭。已知大气压强p 0=75.0 cmHg 。 (1)求放出部分水银后A 侧空气柱的长度; (2)此后再向B 侧注入水银,使A 、B 两侧的水银面达到同一高度,求注入的水银在管内的长度。
《分子动理论 气体与热力学定律》专题讲练 一、考纲要求 六.分子动理论、热和功、气体 热学部分在高考理综中仅仅以一道选择题的形式出现,分值:6分。知识要点是分子动理论、 内能、热力学三定律及能量守恒定律和气体的性质。 二、典例分类评析 1、分子的两种模型及宏观量、微观量的计算 (1)分子的两种模型 ①球体模型:常用于固体、液体分子。V=1/6πd 3 ②立方体模型:常用于气体分子。V=d 3 (2)宏观量、微观量的计算 在此所指的微观量为:分子体积 0V ,分子的直径d ,分子的质量0m .宏观物理量为:物质的体积V 、摩尔体积mol V 、物质的质量m 、摩尔质量M 、物质的密度ρ。阿伏加德罗常数是联系微观 物理量和宏观物理量的桥梁。由宏观量去计算微观量,或由微观量去计算宏观量,都要通过阿伏 加德罗常数建立联系.所以说阿伏加德罗常数是联系宏观量与微观量的桥梁. ①计算分子的质量:0mol A A V M m N N ρ== ②计算分子的体积:0mol A A V M V N N ρ= =,进而还可以估算分子的直径(线度) d ,把分子看成小
球,由30432d V π??= ??? ,得d =(注意:此式子对固体、液体成立) ③计算物质所含的分子数:A A A mol m V V n N N N M V M ρ===. 例1、下列可算出阿伏加德罗常数的一组数据是 ( ) A .水的密度和水的摩尔质量 B .水的摩尔质量和水分子的体积 C .水分子的体积和水分子的质量 D .水分子的质量和水的摩尔质量 例2、只要知道下列哪一组物理量,就可以估算出气体中分子间的平均距离 ( ) A.阿伏加德罗常数,气体摩尔质量和质量 B .阿伏加德罗常数,气体摩尔质量和密度 C .阿伏加德罗常数,气体质量和体积 D .该气体的密度、体积和摩尔质量 例3、某固体物质的摩尔质量为M ,密度为ρ,阿伏加德罗常数为A N ,则每个分子的质量和单 位体积内所含的分子数分别是 ( ) A .A N M 、A N M ρ B .A M N 、A MN ρ C .A N M 、 A M N ρ D .A M N 、 A N M ρ 例4、若以 μ表示水的,υ表示在标准状态下水蒸气的摩尔体积, ρ为表示在标准状态下水蒸气 的密度,N A 为阿伏加德罗常数,m 、Δ分别表示每个水分子的质量和体积,下面是四个关系式中 正确的是 ( ) A . N A = ─── υρ m B .ρ = ─── μA N Δ C . m = ─── μA N D .Δ= ─── υA N 例5、已知地球半径约为6.4×106 m ,空气的摩尔质量约为29×10-3 kg/mol,一个标准大气压约为 1.0×105 Pa.利用以上数据可估算出地球表面大气在标准状况下的体积为 ( ) A.4×1016 m 3 B.4×1018 m 3 C. 4×1030 m 3 D. 4×1022 m 3 2、分子热运动和布朗运动 (1)布朗运动 ①布朗运动是指悬浮小颗粒的运动,布朗运动不是一个单一的分子的运动——单个分子是看不见 的,悬浮小颗粒是千万个分子组成的粒子,形成布朗运动的原因是悬浮小颗粒受到周围液体、气 体分子紊乱的碰撞和来自各个方向碰撞效果的不平衡,因此,布朗运动不是分子运动,但它间接 证明了周围液体、气体分子在永不停息地做无规则运动, ②布朗运动与扩散现象是不同的现象.布朗运动是悬浮在液体中的微粒所做的无规则运动.其运 动的激烈程度与微粒的大小和液体的温度有关.扩散现象是两种不同物质在接触时,没有受到外 力影响。而能彼此进到对方里去的现象.气、液、固体都有扩散现象,扩散快慢除和温度有关外, 还和物体的密度差、溶液的浓度有关.物体的密度差(或浓度差)越大,温度越高,扩散进行的越 快. ③布朗运动的激烈程度与微粒的大小和液体的温度有关。颗粒越小,布朗运动越明显;温度越高,
第十四章 气体分子热运动的统计规律 (statistical law of thermal motion of gas molecular ) §14-1 平衡态 概率 统计平均值 (equilibrium state ,probability ,statistical mean quantity ) 一、平衡态(equilibrium state ) 1、概念(concept ) 宏观性质长时间不改变的状态 2、描述(describe ) (1)状态参量 ① 体积V:气体分子所能到达的空间(3 m ) ② 压强P:单位面积上受到的压力 ( ) 单位面积的动量变化率 ( ) ③ 温度T:气体的冷热程度 (K) VPT间关系——物态方程 RT M pV μ = (但只有两个是独立变量) (2)几何图形(P-V图) ① 平衡态:点a(p、v ) ② 准静态过程 过程:物态随时间的变化, 多点集合——曲线 准静态过程:过程变化缓慢,每一步均可视为平衡态。 它在P-V图上为一曲线,如ab 。 二、概率(probability ) 1、 概念(concept ) 事件出现的相对机会,即可能性 2、 表示(expression ) N (N 很大)次试验中,x 事件出现了i N 次则X 事件出现的概率
P (X )= N N i (离散事件) 如果事件连续分布,且f (x )表示单位间隔中出现的概率, (亦称概率密度或分布函数)则出现在d x 间隔中的概率 p (x )= f (x )d x 3、 特性(specific property ) (1) 小于1 , p (x )≤1 (2) 归1 , ∑p (x )=1 , 1)(0 =? ∞ dx x f 4、 等概率假设(postulate of equal probability )处于平衡态时,分子向各个方向运动概 率相等 三、平均值(mean quantity ) 1、 概念(concept ) 物理量的平均大小,表示量上加“一”,如x 2、 计算(computer ) (1) 离散情况 n n i i p x p x p x N N x x +++=∑= (2211) (2) 连续情况 ? =dx x xf x )( 某变量的平均值=该量与分布函数的乘积对变量积分 §14—2 气体压强与温度的统计意义 (statistical meaning of gas pressure and temperature ) 一、气体的微观模型(microscopic model of gas ) 1、 微观模型 (microscopic model ) (1) 分子可视为质点,同类分子的质量相同 (2) 分子除碰撞外无其它相作用,而分子的碰撞为弹性碰撞 2、 验证(verification ) 不能直接用实验 而是根据其推论与宏观实际(气体宏观实验)一致性来检验 二、压强(pressure ) 1、 实质(substance ) 大量分子对器壁的碰撞, 单位面积的动量变化率 s t p s F p ???=?=
第八章抽样与抽样分布 一、名词解释 1、统计抽样:按照随机原则从被研究现象的总体中,抽取一部分单位进行观察,然后根据 观察的结果运用数理统计的原理,来估计总体综合指标或者对总体综合指标的某种假设进行 检验。 2、重复抽样:是从总体中每抽出一个样本单位后,把结果记录下来,随即将该单位放回到 总体中去,使它和其余的单位在下一次抽选中具有同等被抽中的机会,再抽取第二个单位,直至抽取n个单位为止。 3、不重复抽样:一个单位被抽中后不再放回总体,然后再从所剩下的单位中抽取第二个单位,直到抽出n个单位为止,这样的抽样方法不可能使一个总体单位被重复抽中,所以称为 不重复抽样。 4、简单随机抽样:在从总体中随机抽取n个单位作为样本时,要使得每一个总体的单位都 有相同的机会(概率)被抽中。 5、分层抽样:在抽样之前先将总体的单位划分为若干层(类),然后从各个层中抽取一定数 量的单位组成一个样本,这样的抽样方式称为分层抽样,也称为分类抽样。 6、系统抽样:在抽样中先将总体各单位按某种顺序排列,并按某种规则确定一个随机起点, 然后,每隔一定的间隔抽取一个单位,直至抽取n个单位形成一个样本。这样的抽样方式称 为系统抽样,也称等距抽样或机械抽样。 7、整群抽样:调查时,先将总体划分成若干群,然后再以群作为调查单位从中抽取部分群, 进而对抽中的各个群中所包含的所有个体单位进行调查或观察,这样的抽样方式称为整群抽样。 8、总体分布:总体是我们关心的若干个元素的集合,总体中每个元素的取值是不同的,这些 观察值所形成的相对频数分布就是总体分布。 9、样本分布:是指一个样本中各观察值所形成的相对频数分布。 10.抽样分布:某个样本统计量的抽样分布,从理论上说就是在重复选取容量为n的样本时, 由该统计量的所有可能取值形成的相对频数分布。 11、比率:是指总体(或样本)中具有某种属性的单位与全部单位总数之比。 12、样本比率的抽样分布:在重复选取容量为n的样本时,由样本比率的所有可能取值形成 的相对频数分布称为样本比率的抽样分布。 二、判断题 1、× 2、√ 3、× 4、× 5、√ 6、× 7、√ 8、√ 9、× 10、√ 三、选择题 1、A 2、A 3、B 4、B 5、C 6、D 7、D 8、D 9、C 10、D 11、C 12、B 13、C 14、C 15、A 16、D 17、A 18、B 19、C 20、B 21、B 22、B 23、B 24、A 25、A 四、简答题 1、简述统计抽样的基本特点。
教案适用对象批准人
<附讲稿:页)教研室教员年月日 课目:第十八讲气体分子速率分布 目的:理解速率分布函数及麦克斯韦速率分布律的意义。了解三种速率,了解自由程的概念。 重点:一、麦克斯韦气体分子速率分布率 1、测定气体分子速率分布的实验 2、麦克斯韦气体分子速率分布定律 3、三种统计定律 二、分子平均碰撞次数和平均自由程 三、气体迁移现象 1、粘滞现象 2、热传导现象 3、扩散现象 难点:理解速率分布函数及麦克斯韦速率分布律的意义,了解三种速率,了解自由程的概念。 主要方法:讲授讨论练习 基本要求:理解速率分布函数及麦克斯韦速率分布律的意义。了解3中速率,了解验证速率分布律的实验依据。了解玻耳兹曼能量分布律的意义及在重力场中粒子数密度公式。了解分子平均碰撞频率及平均自由程的概念。b5E2RGbCAP
图6-7 测定分子速率的实验装置示意图 教案内容:6.6 麦克斯韦速率分布律 6.6.1实验 小孔充分小,改变w ,测D 上的沉积厚度, 就可测气体速率分布。给定w 。 粒子速率分布实验曲线如图6-8所示。 6.6.2气体分子速率分布律<函数) 由于分子数目巨大且碰撞频繁,故单个分子速率取值任意偶然。但又由分子平均平动动能公式知:温度T 一定时,大量分子的方均根速率却又 是确定的。p1EanqFDPw 说明:平衡态时,虽然单个分子的速率取值偶然,但大量分子的速率满足一定的统计规律。麦克斯韦从理论上得出如下规律:DXDiTa9E3d 满足归一化条件: 1. 速率分布的概念 分子可能的速率值: 图6-8 分子速率分布实验曲线
速率区间: 使得: 内的分子数为 , 表示第i 个速 率间隔中的分子数占总分子数的百分比或表示单个分子速率值落在区间内的概率。 实验证明: 平衡态时,分布在不同区间的不同,但 却是确定的。 2. 气体分子速率分布律 由实验知: 与速率区间有关。当 时,与无关,仅是的连 续函数,即速率分布函数 物理意义: 速率在v 附近单位速率间隔内的分子数占总分子数的百分比,或某分子速率出现在v 附近的单位速率间隔内的概率。RTCrpUDGiT 归一化条件: 3. 三种速率: 1)最概然速率<最可几速率) 图6-9 不同温度下的速率分布曲线
第七单元分子气体定律内能 一、概述 本单元基础型课程的内容由分子和阿伏伽德罗常数、气体的状态参量、玻意耳定律和查理定律、内能和能量守恒定律等组成。本单元的内容是热学的重要组成部分,分子动理论是热学规律的基础;能量守恒定律是自然界最普遍的规律,贯串于整个物理学。这两部分知识是在初中学习的基础上加以深化和提高。 在本单元学习中,要经历“用单分子油膜估测分子的大小”的实验研究,体验建立物理模型在间接测量中的重要作用。要观察分析“伽耳顿板”等实验,感受统计学的研究方法。要经历模拟压强等实验,从宏观和微观的角度全面认识气体的体积、温度和压强三个状态参量。要运用控制变量与归纳的方法,研究气体实验定律。要了解能量转化的方向性以及能的转化和守恒定律,体会能源在可持续发展战略中的地位,树立节约能源的观念和环境保护意识。 本单元基础型课程需17课时。 二、学习内容与要求 (一)内容与水平
(二)导图: (三)要求 7.1.1知道分子,知道阿伏伽德罗常数。①知道物质是由大量分子组成的;②知道分子大小的数量级;③知道阿伏伽德罗常数;④知道布朗运动及其产生原因;⑤知道分子动理论的主要内容。 7.1.2学会“用单分子油膜估测分子的大小”的实验。①知道实验原理;②知道建立物理模型在间接测量方法中的作用;③会操作形成单层分子油膜;④会估测单层分子的油膜的面积;⑤能用实验数据计算分子直径。 7.1.3知道分子速率的统计分布规律。①知道分子速率的统计分布规律;②知道分子速率统计规律是针对大量分子统计的结果;③能通过观察伽耳顿板实验,感受模拟实验在物理研究的作用。 7.1.4理解气体的状态参量。①知道描述气体状态的三个参量;②知道气体压强、体积的微观解释;③能计算水银柱产生的压强;④能计算活塞对封闭气体产生的压强。 7.1.5学会“用DIS研究在温度不变时,一定质量的气体压强与体积的关系”的实验。
1初识分子热运动的统计规律 自我检测 1.(统计规律)在一场乒乓球比赛前,要决定由谁先发球,可用下面的方法:裁判员拿出一个抽签器,它是一个像大硬币似的均匀塑料圆板,一面是红圈,一面是绿圈,然后随意指定一名运动员,要他猜上抛的抽签器落到球台上时,是红圈那面朝上还是绿圈那面朝上,如果他猜对了,就由他先发球,否则,由另一方发球,试做出解释. 答案这样做体现了公平性,它使得两名运动员的先发球机会是相等的,用概率的语言描述就是两个运动员取得发球权的概率都是50%,因此任何一名运动员猜中的概率都是50%,也就是说每个运动员取得先发球权的概率均为50%,所以这个规则是公平的. 2.(分子运动速率分布)关于气体分子的运动情况,下列说法中正确的是() A.某一时刻具有任一速率的分子数目是相等的 B.某一时刻一个分子速度的大小和方向是偶然的 C.某一时刻向任意一个方向运动的分子数目基本相等 D.某一温度下每个气体分子的速率不会发生变化 答案BC 解析具有某一速率的分子数目并不是相等的,呈“中间多、两头少”的统计分布规律,选项A错误.由于分子之间频繁地碰撞,分子随时都会改变自己运动速度的大小和方向,因此在某一时刻一个分子速度的大小和方向完全是偶然的,选项B正确.虽然每个分子的速度瞬息万变,但是大量分子的整体存在着统计规律.由于分子数目巨大,某一时刻向任意一个方向运动的分子数目只有很小的差别,可以认为是相等的,选项C正确.某一温度下,每个分子的速率仍然是瞬息万变的,只是分子运动的平均速率不变,选项D是错误的.该题的正确答案为B、C. 3.(气体分子速率的分布规律)如图4所示,横坐标v表示分子速率,纵坐标f(v)表示各等间隔速率区间的分子数占总分子数的百分比.图中曲线能正确表示某一温度下气体分子麦克斯韦速率分布规律的是() 图4
“分子动理论气体及热力学定律”学前诊断 一、选择题 1.(2017·全国卷Ⅰ)氧气分子在0 ℃和100 ℃温度下单位速率间隔的分子数占总分子数的百分比随气体分子速率的变化分别如图中两条曲线所示。下列说法正确的是() A.图中两条曲线下面积相等 B.图中虚线对应于氧气分子平均动能较小的情形 C.图中实线对应于氧气分子在100 ℃时的情形 D.图中曲线给出了任意速率区间的氧气分子数目 E.与0 ℃时相比,100 ℃时氧气分子速率出现在0~400 m/s区间内的分子数占总分子数的百分比较大 解析:选ABC根据气体分子单位速率间隔的分子数占总分子数的百分比随气体分子速率的变化曲线的意义可知,题图中两条曲线下面积相等,选项A正确;题图中虚线占百分比较大的分子速率较小,所以对应于氧气分子平均动能较小的情形,选项B正确;题图中实线占百分比较大的分子速率较大,分子平均动能较大,根据温度是分子平均动能的标志,可知实线对应于氧气分子在100 ℃时的情形,选项C正确;根据分子速率分布图可知,题图中曲线给出了任意速率区间的氧气分子数目占总分子数的百分比,不能得出任意速率区间的氧气分子数目,选项D错误;由分子速率分布图可知,与0 ℃时相比,100 ℃时氧气分子速率出现在0~400 m/s区间内的分子数占总分子数的百分比较小,选项E错误。 2.(2015·全国卷Ⅱ)关于扩散现象,下列说法正确的是() A.温度越高,扩散进行得越快 B.扩散现象是不同物质间的一种化学反应 C.扩散现象是由物质分子无规则运动产生的 D.扩散现象在气体、液体和固体中都能发生 E.液体中的扩散现象是由于液体的对流形成的 解析:选ACD扩散现象与温度有关,温度越高,扩散进行得越快,A正确。扩散现