
藻毒素检测方法
原理:
样品中的微囊藻毒素与微囊藻毒素酶标记物竞争结合数量有限的抗体结点。
测试孔中包被有抗免IgG,用于捕获加入的免抗微囊藻毒素抗体,微囊藻毒素酶标记物和样品中的微囊藻毒素竞争结合数量有限的抗体结点,抗体与测试板中包被抗免IgG结合。
注意:颜色与微囊藻毒素的含量成反比。
较深的颜色=较低的浓度
较浅的颜色=较高的浓度
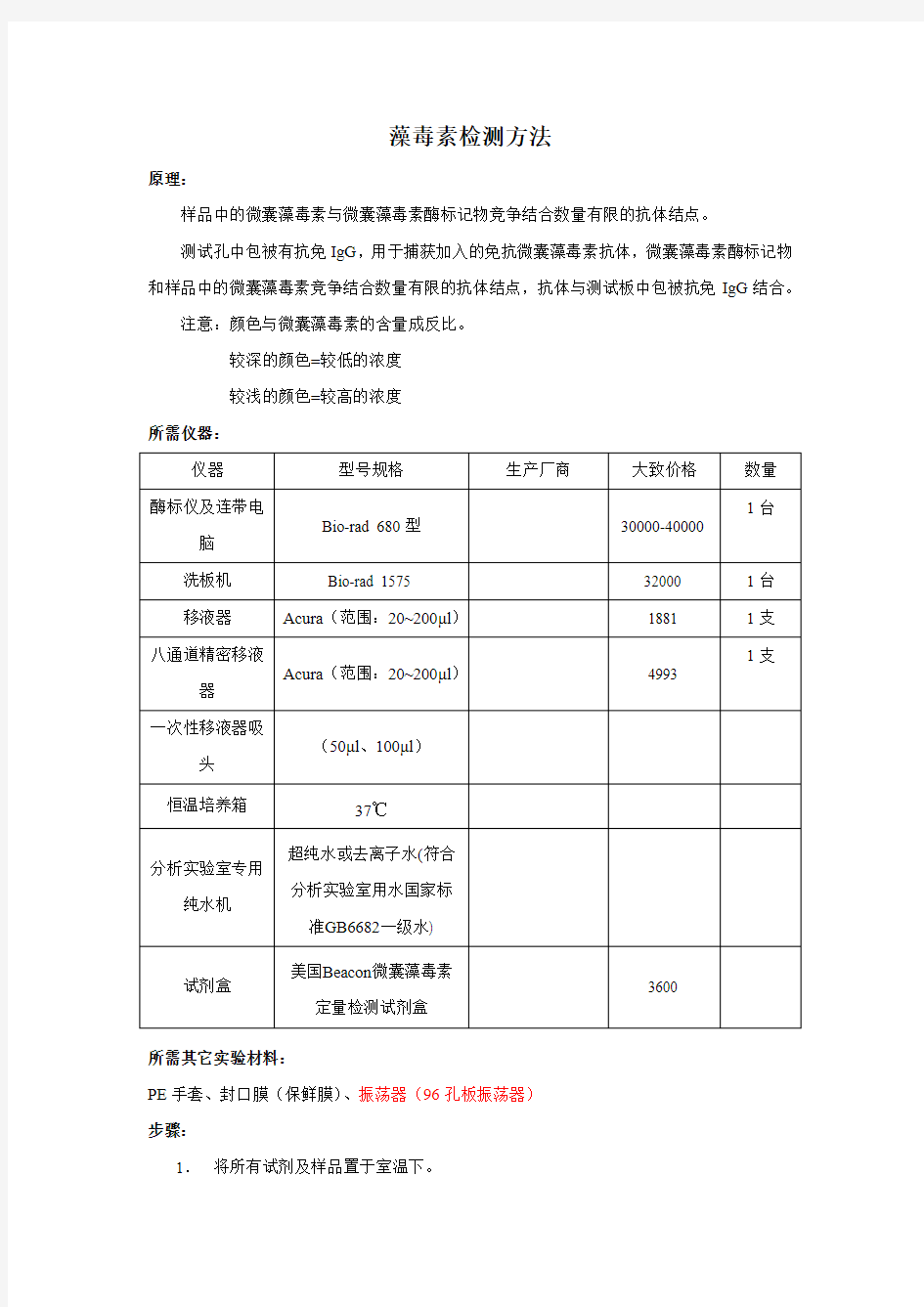
所需仪器:
仪器型号规格生产厂商大致价格数量
酶标仪及连带电
脑Bio-rad 680型30000-40000
1台
洗板机Bio-rad 1575 32000 1台移液器Acura(范围:20~200μl)1881 1支八通道精密移液
器Acura(范围:20~200μl)4993
1支
一次性移液器吸
头
(50μl、100μl)恒温培养箱37℃
分析实验室专用
纯水机超纯水或去离子水(符合分析实验室用水国家标准GB6682一级水)
试剂盒
美国Beacon微囊藻毒素
定量检测试剂盒
3600 所需其它实验材料:
PE手套、封口膜(保鲜膜)、振荡器(96孔板振荡器)
步骤:
1.将所有试剂及样品置于室温下。
2.从铝箔袋中拿出要求数量的微孔条,放入干燥剂并重新封好袋子以免微孔条受潮。3.稀释100倍浓缩清洗液为1倍清洗液,例:取5ml 100倍清洗液到500ml洗瓶中并加入495ml蒸馏水。
4.吸取50μl酶标记物到微孔板的每个孔中。
5.吸取50μl标准,阴性对照,样品到对应微孔中,必须保证每种溶液使用干净的吸头吸取,避免交叉污染。
6.加入50μl抗体溶液到每个小孔中。
7.快速震荡使孔中的溶液混合,并敷上薄膜,或者微孔板可以放在振荡器上震荡孵育,从而达到在孵育期间持续震荡的效果。
8.37℃孵育30分钟。
9.孵育完后,去掉封口膜将微孔中的溶液倒入水槽中,用1倍清洗液清洗完全充满微孔,震荡后倒掉,重复四次,总共五次洗板。在吸水纸上拍打,尽可能将水拍干。10.每个微孔中加入100μl底物溶液。
11.盖上小孔并37℃孵育30分钟。
12.按照加底物的顺序每孔中加入100μl停止液。停止液为1 N盐酸,需小心操作。13.450nm下读板,如果酶标仪有双波长,可同时测605或650nm双波长。
14.如果酶标仪可以处理数据,可用半对数线性或4参数曲线拟合,如果为手动计算,则可按照以下部分进行。
中国药典2010年版《细菌内毒素检查法》 ——凝胶法 凝胶法 凝胶法系通过鲎试剂与内毒素产生凝集反应的原理来检测或半定量内毒素的方法。 鲎试剂灵敏度复核试验在本检查法规定的条件下,使鲎试剂产生凝集的内毒素的最低浓度即为鲎试剂的标示灵敏度,用EU/ml表示。当使用新批号的鲎试剂或试验条件发生了任何可能影响检验结果的改变时,应进行鲎试剂灵敏度复核试验。 根据鲎试剂灵敏度的标示值(λ),将细菌内毒素国家标准品或细菌内毒素工作标准品用细菌内毒素检查用水溶解,在旋涡混合器上混匀15分钟,然后制成2λ、λ、0.5λ和0.25λ四个浓度的内毒素标准溶液,每稀释一步均应在旋涡混合器上混匀30秒钟。取分装有0.1ml鲎试剂溶液的10mm×75mm试管或复溶后的0.1ml/支规格的鲎试剂原安瓿18支,其中16管分别加入0.1ml不同浓度的内毒素标准溶液,每一个内毒素浓度平行做4管;另外2管加入0.1ml细菌内毒素检查用水作为阴性对照。将试管中溶液轻轻混匀后,封闭管口,垂直放入37℃±1℃恒温器中,保温60分钟±2分钟。 将试管从恒温器中轻轻取出,缓缓倒转180°,若管内形成凝胶,并且凝胶不变形、不从管壁滑脱者为阳性;未形成凝胶或形成的凝胶不坚实、变形并从管壁滑脱者为阴性。保温和拿取试管过程应避免受到振动造成假阴性结果。 当最大浓度2λ管均为阳性,最低浓度0.25λ管均为阴性,阴性对照管为阴性,试验方为有效。按下式计算反应终点浓度的几何平均值,即为鲎试剂灵敏度的测定值(λc). λc=1g-1(∑X/4)
式中 X为反应终点浓度的对数值(1g)。反应终点浓度是指系列递减的内毒素浓度中最后一个呈阳性结果的浓度。 当λc在0.5λ-2λ(包括0.5λ和2λ)时,方可用于细菌内毒素检查,并以标示灵敏度λ为该批鲎试剂的灵敏度。 干扰试验按表1制备溶液A、B、C和D,使用的供试品溶液应为未检验出内毒素且不超过最大有效稀释倍数(MVD)的溶液,按鲎试剂灵敏度复核试验项下操作。 只有当溶液A和阴性对照溶液D的所有平行管都为阴性,并且系列溶液C 的结果在鲎试剂灵敏度复核范围内时,试验方为有效。按下式计算系列溶液C和B的反应终点浓度的几何平均值(Es和Et)。 Es= 1g-1(∑Xs/4) Et= 1g-1(∑Xt/4) 式中,Xs、Xt分别为系列溶液C和溶液B的反应终点浓度的对数值(1g)。当Es在0.5λ—2λ(包括0.5λ和2λ)及Et在0.5Es—2Es (包括0.5Es 和2Es)时,认为供试品在该浓度下无干扰作用。若供试品溶液在小于MVD 的稀释倍数下对试验有干扰,应将供试品溶液进行不超过MVD的进一步稀释,再重复干扰试验。 表1 凝胶法干扰试验溶液的制备
微囊藻毒素检测方法的研究进展 湖泊、水库和河流中接纳过多的氮和磷等营养物质,使水体的生态结构和功能发生变化,导致藻类特别是蓝藻(Cyanobacteria)的异常繁殖生长而出现的蓝藻水华现象。随着水体富营养化的加剧而引起有害藻类水华(HAB,harmful algal bloom)的频繁发生已成为国内外普遍关注的环境问题。当蓝藻水华严重时,水面形成厚厚的蓝绿色湖靛,散发出难闻的气味。不仅影响人的感官,破坏了健康平衡的水生生态系统,而且因藻细胞破裂后释放出多种藻毒素而对人和动物的饮用水安全构成了严重的威胁。世界上25%~70%的蓝藻水华污染可产生藻毒素,在已发现的各种不同藻毒素中,微囊藻毒(Microcystins,MC)是目前已知的一种在蓝藻水华污染中出现频率最高、产生量最大和造成危害最严重的藻毒素种类。在20世纪80年代对全国范围内的水源水质进行过全面的调查,结果表明34个湖泊中有一半以上的湖泊面积处于富营养状态。进入20世纪90年代,全国淡水水体富营养化日益严重,涉及范围不断扩大。通过对各大饮用水水源及各种湖泊的监测表明,在夏秋季节藻类水华严重,每年长达7~8个月,而天然水体蓝藻水华80%是产生毒素的。从加拿大、日本、芬兰、美国、中国等地对湖水、河水、水库水、井水及自来水等水样的检测结果看,有的水体中微囊藻毒素检出率高达60%~87%,源水中微囊藻毒素浓度从130ng/ml~2μg/ml,经加氯处理后的浓度也在0.09~0.6μg/L之间。淡水水源受到微囊藻毒素的检测方法的研究日益深入,需要建立一种简单、快速、准确的系统的检测方法。 1 微囊藻毒素简介 1.1 微囊藻毒素 淡水藻类通常以蓝藻、绿藻、硅藻、甲藻、隐藻、裸藻、金藻、黄藻等8个门为主。蓝藻门是已知的产生毒素最多的门类,这些毒藻可产生具有明显肝毒性的肽类物质,称为微囊藻毒素(Microcystins,MC)。它是一种肝毒素,是肝癌的强烈致癌剂。 1.2 微囊藻毒素的结构 Louw认为,微囊藻毒素是一种具有强烈慢性肝脏中毒特征的生物碱。Hughes等人在1958年发现并分离得到铜绿微囊藻NRC-1有毒品系。1959年Bishop等人对铜绿微囊藻NRC-1有毒品系的毒性做全面研究,发现这种微囊藻毒素是由7种氨基酸组成的小分子环状多肽,为单环结构:D-丙氨酸-L-X-赤-β-甲基-D-谷氨酸-Mdha。其中Mdha是一种特殊的氨基酸;Adda为3-氨基-9-甲氧基-2,6,8-三甲基-10-苯-4,6-二烯酸;X和Y为两种可变L氨基酸。目前已鉴定的约有65个微囊藻毒素变式,其中多数毒性较高,如MC-LR,MC-RR和MC-YR等。 1.3 微囊毒素的产生 MC是细胞内毒素,它在细胞内合成,细胞破裂后释放出来并表现出毒性。由于它有很小的体积(分子量1000左右)、环状结构及其氨基酸的特殊结构,一般认为它不在核糖体内合成,而是由肽合成酶复合体合成的生物活性小肽,类似于在一些杆菌和真菌中小肽的合成。这些小肽大多是抗生素、免疫抑制物和一些对动物和植物有毒的物质。关于微囊藻毒素产生的机理有很多假设,但目前为止尚无令人满意的结果,现在常提到的有环境因素和遗传因素。微囊藻毒素受光照、温度、营养盐等多种环境因素影响,其中光照可起到非常重要的作用。但遗传论者认为微囊藻毒素的合成是由毒素肽合成酶基因多基因控制的,并由肽合成酶复合体合成(非核糖体合成的多肽)。 1.4 微囊藻毒素对生物的影响 因为MC主要以肝脏为靶器官,当动物被灌喂或腹腔注射后,破坏细胞内的蛋白磷酸化平衡,改变多种酶活性,引起肝脏病变,造成一系列的生理紊乱。中毒症状主要表现为虚弱、呼吸沉重、皮肤变白、呕吐、腹泻、毛立和嗜睡等。如猴子的中毒症状为昏迷、肌肉痉挛、呼吸急促、腹泻等,在数小时内或几天内死亡。1987年Brook WP用HC标记的MC-LR腹腔注射染毒小鼠,1分钟后肝脏内出现总标记的70%,3小时后肝脏内积聚的MC-LR占总量的90%,表明肝脏是MC-LR分布的主要器官。它不仅对动物有影响,而且对植物也有一定的影响。Mcelhiney等发现MC-LR的存在可对茄属植物的生长和豆类植物根的发育产生不良影响。Singh等研究了MC对藻类、微生物和真菌生长的效应,发现在初始50mg/L的MC可完全抑制灰色念珠藻和鱼腥藻的生长并使藻细胞溶解。观察到了MC对二氧化碳的吸收和光合作用的不良影响,
细菌内毒素检查法标准操作规程 1 目的 建立细菌内毒素检查法的标准操作规程。规范细菌内毒素检验操作,确保检验数据的准确性。 2 范围 适用于细菌内毒素的检验操作。 3 职责 3.1 质量控制部检验人员对具体操作负责; 3.2 质量保证部负责监督本规程的执行。 4 定义 无 5 内容 5.1 概述与原理 本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中内毒素的限量是否符合规定的一种方法。 细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。供试品检测时,可使用其中任何一种方法进行试验。当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。 基本原理:鲎试剂是鲎血液细胞提取物的冻干品,主要包含4种成分,分别是C 因子、B因子、凝固酶原和凝固蛋白原。细菌内毒素检查法主要依靠细菌内毒素可以活化其中的C因子,使鲎试剂发生一系列的酶联反应,最终形成凝胶或使凝固酶活化某些外加的显色集团(显色法)的原理,来检测细菌内毒素的量。 细菌内毒素的活性单位有两种表达方式,即EU和IU。美国、中国和日本扥国家使用EU,欧洲地区使用IU。在活性量值上,1EU=1IU,计算是可以互换。 5.2 仪器与用具 5.2.1 电子天平、电热干燥箱、时钟、水浴锅、温度计、试管架、漩涡器、剪刀、无菌封口膜、无热原吸头、试管、砂轮、移液枪,75%乙醇、木棉等。 5.2.2 细菌内毒素标准品 细菌内毒素标准品按级别分为国际标准品、国家标准品和工作标准品。其中,国际标准品是由WHO制备,在世界范围内进行效价的协作标定,主要用于世界各国标定各自国家的标准品之用,细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价。在细菌内毒素检查试验中,应使用细菌内毒素国家标准或细菌内毒素工作标准品。 5.2.3 细菌内毒素检查用水:内毒素含量小于0.015EU/mL(凝胶法),且对内毒素试验无干扰作用。 5.2.4 鲎试剂:一批新的鲎试剂在首次使用时要先进行灵敏度复核,结果符合药典规定后,方可用于后续试验。制备或试验条件发生了任何可能影响检验结果的改变时,应进行鲎试剂试验。
水体中微囊藻毒素的监测与分析 随着水体富营养化状况的日益加剧,蓝藻水华爆发带来的微囊藻毒素污染成为一个全球关注的环境问题。微囊藻毒素(Microcystins, MCs)是由蓝藻产生的一种具有强烈致癌作用的肝毒素,其分子结构复杂、种类繁多,以痕量形式稳定存在于各类富营养化的天然水体中。有资料表明,饮用水中的微囊藻毒素污染可能是除黄曲霉毒素以外导致肝癌的另一个重要诱因,随着世界各国对微囊藻毒素的重视,中国也在相关水质标准中新增了微囊藻毒素这一指标,如今水环境中微 囊藻毒素的监测与控制已变得非常重要。 一、微囊藻毒素的简介 1. 微囊藻毒素的产生 一般认为MCs 为细胞内毒素,在藻类死亡、细胞破裂后从细胞内释放到环境中。但是,已有研究发现,藻类在死亡之前也会向水体中分泌毒素。关于MCs 的产生机制主要有两种观点:一种认为是由遗传学因素主导;另一种认为是环境因素主导。 2. 微囊藻毒素的结构 微囊藻毒素是由水体中蓝绿藻如铜绿微囊藻(Microcystis aeruginosa)、鱼腥藻(Anabaena spp.)、颤藻(Oscillatoriaruescens)等产生的具有生物活性的单环七肽化合物,其可表示为环(D-丙氨酸-L-X-赤-β-甲基-D-异天冬氨酸-L-Z-Adda-D-异谷氨酸-N-甲基脱氢丙氨酸)。其中,Adda(3-氨基-9-甲氧基-2,6,8-三甲基-10-苯基-4,6-二烯酸)是MCs 生物活性表达所必需的;X、Z为两个可变的氨基酸残基,这两个可变的L-氨基酸的更替及其它氨基酸的去甲基化,衍生出众多的毒素类型,至今已发现MCs有60多种变体。在众多变体中存在最普遍、含量较多、毒性较大、研究详细的是MC-RR、MC-LR,R、L分别代表精氨酸、亮氨酸。 3. 微囊藻毒素的性质 MCs的性质稳定,在水中为中性或带负电荷的分子集团,可溶于水(溶解度>1g/L),在水中的自然降解过程缓慢,仅有少量能被水体微粒吸附沉淀。纯化的MCs在阳光照射下稳定,但当其曝露于波长在其吸收峰周围的紫外线中,分子发生异构化,方可使MC-LR快速降解。MCs具有热稳定性,加热煮沸(水浴100℃,
Advances in Environmental Protection 环境保护前沿, 2020, 10(2), 282-289 Published Online April 2020 in Hans. https://www.doczj.com/doc/248452912.html,/journal/aep https://https://www.doczj.com/doc/248452912.html,/10.12677/aep.2020.102032 Treatment Process of Microcystin in Drinking Water Siqi Shi, Jianhua Li College of Environment Science and Engineer, Tongji University, Shanghai Received: Mar. 28th, 2020; accepted: Apr. 22nd, 2020; published: Apr. 29th, 2020 Abstract The eutrophication has led to the increasing popularity of freshwater cyanobacteria blooms. The concentration of algae toxin in water increases rapidly with the proliferation of cyanobacteria. Microcystin (MCs) is a strong hepatotoxin and has carcinogenicity, which attracted widespread attention. In this article, author mainly introduced the research on the removal of intracellular and extracellular (lysed) algal toxins, introduced the process of removal of algal toxins from three aspects of physical methods, chemistry, and biology. This passage also summarizes the current treatment process simply and introduces the outlook. Keywords Algal Toxins, Microcystin, Degradation, Intracellularalgal Toxins, Extracellular (Lysed) Algal Toxins 饮用水中微囊藻毒素处理工艺 石思琦,李建华 同济大学环境科学与工程学院,上海 收稿日期:2020年3月28日;录用日期:2020年4月22日;发布日期:2020年4月29日 摘要 水体富营养化导致淡水蓝藻水华爆发日趋普遍。水体中藻毒素含量随蓝藻的大量增殖而快速升高,其中微囊藻毒素(MCs)是强烈的肝毒素,具有致癌性而引起广泛关注。文中主要介绍了去除胞内和胞外(溶解)藻毒素的相关研究,从物理方法、化学、生物三个方面介绍藻毒素去除工艺,并对目前的处理工艺进行
******有限公司 标准操作规程 目的 建立细菌内毒素检查操作规程,保证检测结果的准确性。 适用范围 所有原料、成品的细菌内毒素检查。 责任人 QC检验员 内容 1 简述 1.1 本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌毒素的限量是否符合规定的一种方法。 1.2 细菌内毒素检查包括凝胶法和光度测定法两种方法。供试品检测时可使用其中任何一种方法。当测定结果有争议时,除另有规定外,以凝胶法结果为准。 1.3 本规范适用于凝胶法检查。凝胶法系通过鲎试剂与内毒素产生凝集反应的原理来检测或半定量内毒素的方法。 1.4 细菌内毒素的量用内毒素单位(EU)表示 1.5 细菌内毒素国家标准品(NSE)系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素工作标准品的效价。 1.6 细菌内毒素工作标准品(WSE)系以细菌内毒素国家标准品为基准标定其效价,用于试验中的鲎试剂灵敏度复核、干扰试验及各种阳性对照。 1.7 凝胶法细菌内毒素检查用水(BET水)系指内毒素含量小于0.015Eu/ml灭菌注射用水。光度测定法用的细菌内毒素检查用水,其内毒素的含量应小于0.005Eu/ml。 1.8 鲎试剂灵敏度复核试验在本检查法规定的条件下,使鲎试剂产生凝集的内毒素
******有限公司 标准操作规程 的最低浓度即为鲎试剂的标示灵敏度,用EU/ml表示。当使用新批号的鲎试剂或试验条件发生了任何可能影响检验结果的改变时,应进行鲎试剂灵敏度复核试验。 1.9 供试品干扰试验项用于建立新品种细菌内毒素检查方法以及供试品的配方和生产工艺或试验环境有变化,鲎试剂来源不同或供试品阳性对照结果呈阴性时确定供试品是否存在抑制或增强作用。 1.10 检查法项为供试品细菌内毒素检查方法。阴性对照、阳性对照和供试品阳性对照必须同时进行,否则试验结果无效。 2实验材料及用具 2.1 天平供试品称量用,感量为0.1mg以下。 2.2 电热干燥箱除外源性内毒素用,温度应能维持250℃以上至少一小时。 2.3 恒温水浴箱或适宜的恒温器,应能在37土1℃保持一小时。 2.4 水银温度计或酒精温度计,精度在1℃以下。 2.5 旋涡混合器 2.6 鲎试剂(应具有国家主管部门的批准文号)及细菌内毒素检查用水(符合规定)。2.7 细菌内毒素国家标准品(NSE),细菌内毒素工作标准品(WSE),除另有规定外应由中国药品生物制品检定所统一发放。 2.8 实验用具移液管(或刻度吸管,定量移液器)、凝集管(103 75mm)、三角瓶、小试管(163100mm)、试管架、洗耳球、封口膜或金属试管帽、时钟、脱脂棉、吸水纸、剪刀、砂轮所用玻璃器皿须经250℃干烤至少1小时。塑料用具应使用其它适宜的除细菌内毒素方法。 2.9 试剂 75%乙醇、蒸馏水、5%重铬酸钾硫酸洗液。 3 操作方法 3.1 试验准备 3.1.1 洗液的配制配制铬酸洗液或其他适宜的细菌内毒素灭活剂。 3.1.2 玻璃器皿的洗涤将被洗涤的玻璃器皿用洗涤剂和自来水洗净并空干水分后置洗液中浸泡4小时,取出将洗液滤干,用自来水将残余的洗液洗净,再用新鲜蒸馏水冲洗干燥后置适宜的密闭金属容器中,迅速置烤箱中。
藻毒素检测方法 原理: 样品中的微囊藻毒素与微囊藻毒素酶标记物竞争结合数量有限的抗体结点。 测试孔中包被有抗免IgG,用于捕获加入的免抗微囊藻毒素抗体,微囊藻毒素酶标记物和样品中的微囊藻毒素竞争结合数量有限的抗体结点,抗体与测试板中包被抗免IgG结合。 注意:颜色与微囊藻毒素的含量成反比。 较深的颜色=较低的浓度 较浅的颜色=较高的浓度 所需仪器: 仪器型号规格生产厂商大致价格数量 酶标仪及连带电 脑Bio-rad 680型30000-40000 1台 洗板机Bio-rad 1575 32000 1台移液器Acura(范围:20~200μl)1881 1支八通道精密移液 器Acura(范围:20~200μl)4993 1支 一次性移液器吸 头 (50μl、100μl)恒温培养箱37℃ 分析实验室专用 纯水机超纯水或去离子水(符合分析实验室用水国家标准GB6682一级水) 试剂盒 美国Beacon微囊藻毒素 定量检测试剂盒 3600 所需其它实验材料: PE手套、封口膜(保鲜膜)、振荡器(96孔板振荡器) 步骤: 1.将所有试剂及样品置于室温下。
2.从铝箔袋中拿出要求数量的微孔条,放入干燥剂并重新封好袋子以免微孔条受潮。3.稀释100倍浓缩清洗液为1倍清洗液,例:取5ml 100倍清洗液到500ml洗瓶中并加入495ml蒸馏水。 4.吸取50μl酶标记物到微孔板的每个孔中。 5.吸取50μl标准,阴性对照,样品到对应微孔中,必须保证每种溶液使用干净的吸头吸取,避免交叉污染。 6.加入50μl抗体溶液到每个小孔中。 7.快速震荡使孔中的溶液混合,并敷上薄膜,或者微孔板可以放在振荡器上震荡孵育,从而达到在孵育期间持续震荡的效果。 8.37℃孵育30分钟。 9.孵育完后,去掉封口膜将微孔中的溶液倒入水槽中,用1倍清洗液清洗完全充满微孔,震荡后倒掉,重复四次,总共五次洗板。在吸水纸上拍打,尽可能将水拍干。10.每个微孔中加入100μl底物溶液。 11.盖上小孔并37℃孵育30分钟。 12.按照加底物的顺序每孔中加入100μl停止液。停止液为1 N盐酸,需小心操作。13.450nm下读板,如果酶标仪有双波长,可同时测605或650nm双波长。 14.如果酶标仪可以处理数据,可用半对数线性或4参数曲线拟合,如果为手动计算,则可按照以下部分进行。
医用输液、输血、注射器具细菌内毒素检验方法 中华人民共和国国家标准 GB/T14233.2—93 1993-03-16发布 一、定义及适用范围:本法系列用鲎试剂与细菌内毒素产生凝集反应 的机理,以判断供试品中内毒素限量是否符合规定的一种方法。 用以代替家兔法对供试品进行热原初试。本法仅适用于一次性使用输液器、输血器。其他产品可参照使用。 二、主要设备:超净工作台、电热干燥箱、恒温水浴。 三、试剂 1、细菌内毒素国家标准品:用于仲裁鲎试剂灵敏度和试验中阳性对照。 2、细菌内毒素工作标准品:用于标定鲎试剂灵敏度和试验中阳性对照。 3、鲎试剂:灵敏度为0.25EU/ml,规格为0.5ml。 4、无热原水:内毒素含量小于0.05EU/ml。 四、试验前准备 1、器具除热原:与试验液接触的所有器具均应除热原。玻璃器具置电热干燥箱内250℃干烤至少60min;塑料器具置30%双氧水中浸泡 4h,再用无热原水冲洗后于60℃烘干备用。 2、鲎试剂灵敏度测定 (1)试验前应核对使用批号鲎试剂的灵敏度,应符合规定。 (2)灵敏度测定:根据标示的灵敏度范围,将细菌内毒素工作 标准品用无热原水以1→2等比稀释,选择能出现阳性和阴性结果的4个连续稀释液。取同一批号鲎试剂若干支,分别按标示量
加入无热原水溶解为鲎试剂溶解液。取10mm×75mm试管若干 支,分别加入0.1ml鲎试剂溶解液,加入内毒素稀释液0.1ml,每一稀释液平行操作4管,轻轻振动试管混匀内容物,封闭管 口,置37±1℃恒温水浴中保温60±2min观察结果。最高浓度的4管应均为阳性,最低浓度的4管应为阴性。 五、试验方法 1、供试品数量 :同一批号至少3个单位供试品。 2、浸提介质:无热原水。 3、供试液制备:在无菌条件下,每套输液器内腔注入10ml,输血器内腔注入15ml浸提介质,反复荡洗5次后两端密封,置37±1℃恒温箱中保温2h,取出后将供试液汇集至一无热原具塞玻璃容器内。供试液贮存应不超过2h。 4、试验步骤:将鲎试剂和细菌内毒素工作标准品分别按标示量加入无热原水溶解。细菌内毒素工作标准品逐次稀释至0.5Eu/ml,供作阳性对热。取10mm×75mm试管6支,其中供试品管2支各加入0.1ml 内毒素工作标准品稀释液,阴性对照管2支各加入0.1ml无热原水,阳性对照管2支各加入0.1ml内毒素工作标准品稀释液,再逐一加入0.1ml鲎试剂溶解液。轻轻混匀试管内容物,封闭管口,垂直放入37±1℃水浴中保温60±2min,轻轻取出,观察结果。 5、结果判定 1)、将试管缓慢倒转180°,管内容物呈坚实凝胶者为阳性,记录为(+),不呈凝胶状或虽呈凝胶状但不能保持完整者为阴性,记录为(-)。
编号:作业指导书水中微囊藻毒素的测定 高效液相色谱法 临江市环境保护监测站 1、方法提要 微囊藻毒素在238nm下有 1、方法的适用范围 本标准规定了高效液相色谱法和间接竞争酶联免疫吸附法测定水中微囊藻毒素(环状七肽)的条件和详细分析步骤。 本标准适应于饮用水、湖泊水、河水、地表水中微囊藻毒素的测定。 样品中微囊藻毒素的检出限:高效液相色谱法和酶联免疫吸附法均匀为0.1μg/L。 2、微囊藻毒素的分子式、分子质量及结构式 2.1分子式 微囊藻毒素-RR(MC-RR):C49H75N13O12, 微囊藻毒素-YR(MC-YR):C52H72N10O13,
微囊藻毒素-LR(MC-LR):C49H74N10O12.。 2.2分子质量 MC-RR:1038.21mg,MC-YR:1045.2100μg,MC-LR:995.250μg。2.3结构式 MC-RR、MC-YR、MC-LR、X和Y 表1 MC-RR、MC-YR、MC-LR、X和Y 3、水样采集和保存 用采水器采集1500ml~2000ml水样(水样采集后,应在4 h内完成以下前处理步骤)。用500目的不锈钢筛()过滤,除去水样中大部分浮游生物和悬浮物。取过滤后的水样1200ml于玻璃杯式滤器()中,依次经滤膜()减压过滤。准确量取1000ml 滤液置于棕色试剂瓶中。注:如减压过滤后的水样不能立即分析,可置于玻璃容器中,在-20℃保存,30d内分析完毕。 4、试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯试剂和不含有机物的蒸馏水。 5.1甲醇,HPLC级(色谱级甲醇) 5.2二氯甲烷,农残级
《生活饮用水卫生标准》GB5749- 项目解读微囊藻毒素(1) 1 概述 微囊藻毒素 藻毒素主要的结构特征为N-甲基脱氢丙氨酸及两个L-氮基酸残基x和Z,根据1988年制定的微囊藻毒素(Microcystins或MCYST)命名法规定.x,Z二残基的不同组合由代表氨基酸的字母后缀区分。常见的有LR,RR,YR三种毒素,L,R,Y分别代表亮氨酸,精氨酸,酪氨酸。微囊藻毒素的一般结构为环(D-丙氨酸-L-X-赤-β-甲基-D-异天冬氨酸-L-Z—Adda-D-异谷氨酸-N-甲基脱氢丙氨酸),其中Adda(3氨基9-甲氨基2,6,8-三甲基10-苯基-4,6-二烯酸)是微囊藻毒素生物活性表达所必须的。已证实微囊藻毒素是一种肝毒素,能抑制蛋白质磷酸酯酶,从而帮助解除对细胞增殖的正常的制动作用,促进肿瘤的发育。微囊藻毒素虽然主要存在于藻细胞中.但研究表明藻细胞死亡解体后·不断有藻毒素释放到水体,对人类的饮用水源造成危害,已证明某些地区的肝癌高发率与饮用水源中的水华大量发生有关。微囊藻毒素是一类具生物活性的单环七肽,这类毒素主要由淡水藻类铜绿微囊藻(Microcystins aeruginosa)产生,此外其他种类的微囊藻,如绿色微囊藻(M.viridis)、惠氏微囊藻(M.wesenbergii)以及鱼腥藻(Anabaena)、念珠藻(Nostoc)、颤藻(Oscillatoria)的一些种或株系也能产生这类毒素。目前所检测到的微囊藻毒素异构体已超过50多种。 微囊藻毒素有不同的脂多糖和极性.毒性也不同,微囊藻毒素-LR是最早被阐明化学结构的藻毒素.在对藻毒素的研究中也多以它作为研究对象。它是一个环状的7肽分子,分子量约为1000道尔顿,许多国家出现的由藻毒素引发的事件大都
黄曲霉毒素及其检测方法整体解决方案 一、黄曲霉毒素介绍 黄曲霉毒素(aflatoxin,简称为AF)是到目前为止所发现的毒性最大的真菌毒素。它可通过多种途径污染食品和饲料,直接或间接进入人类食物链,威胁人类健康和生命安全,对人体及动物内脏器官尤其是肝脏损害严重,该毒素是黄曲霉和寄生曲霉中产毒菌株的代谢产物,普遍存在于霉变的粮食及粮食制品中。黄曲霉毒素比较耐热,加热至230℃才能被完全破坏,因此一般烹饪加工也不易消除。 二、黄曲霉毒素对人体的危害 1、引起急、慢性中毒: 黄曲霉毒素是剧毒物质,其毒性相当于氰化钾的10倍,砒霜的68倍。黄曲霉毒素属肝脏毒,除抑制DNA、RNA的合成外,也抑制肝脏蛋白质的合成,黄曲霉毒索引起人类的急性中毒事件,国内外均有许多报导,最典型的是印度的霉变玉米事件,该事件直接导致了数十人丧生,数百人患上不同类型的肝脏疾病。 2、致癌性: 黄曲霉毒素有极强的致癌性,长期摄入黄曲霉毒素会诱发肝癌。它诱发肝癌的能力比二甲基亚硝胺大75倍,是目前公认的致癌性最强的物质之一。另据世界卫生组织报导,黄曲霉毒素含量在30~50ug/kg时为低毒,50~100ug/kg时为中毒,100~1000ug/kg时为高毒,1000ug/kg以上为极毒。鉴于黄曲霉毒素对人类的巨大危害性,我国对其在食品中的含量作了严格规定,其中,乳制品中黄曲霉毒素最高允许量为5ug/kg(即5ppb)。 三、黄曲霉毒素的种类 黄曲霉毒素主要有4种:即B1、B2、G1、G2,其中B1被认为是主要的有毒物质,有2种这些毒素的代谢产物M1和M2。其中黄曲霉毒素B1主要存在于农产品,动物 饲料,中药等产品中;黄曲霉毒素M 1是动物摄入黄曲霉毒素B 1 后在体内经羟基 化代谢的产物,一部分从尿和乳汁排出,一部分存在于动物的可食部分,如乳、 肝、蛋类、肾、血和肌肉中,其中以乳最为常见。黄曲霉毒素M 1 的毒性和致癌 性与黄曲霉毒素B 1 的基本相似。由于牛乳及其制品是人类、特别是婴儿的主要食
细菌内毒素检查标准操作规程 1 简述 1.1 本规范适用于中国药典2005年版附录中细菌内毒素检查法一凝胶法和光度测定法。后者包括浊度法和显色基质法。供试品检测时,可使用其中任何一种方法进行实验。当 测定结果有争议时,除另有规定外,以凝胶法结果为准。 1.2 供试品细菌毒素限值的确定。 (一)药典中有规定的,按供试品各论中规定限值; (二)尚无标准规定的,按以下公式确定供试品内毒素限值: L=K/M 式中 L为供试品的细菌内毒素限值,以EU/ml、EU/mg、EU/U表示。 K为按规定的给药途径,人用每公斤体重每小时最大可接受的内毒素剂量,以EU/kg/h表示。其中注射剂,K=5EU/kg/h;放射性药品注射剂,K=2.5EU/kg/h;鞘内用注射剂, K=0.2EU/kg/h。 M为人用每公斤体重每小时的最大供试品剂量,以ml/kg/h、ml/kg/h、U/kg/h表示。药品人用最大剂量可参阅国家批准的药品说明书和《临床用药须知》等权威著作,中国人 均体重按60kg计算,注射时间小于1小时的按1小时计。按人用剂量计算限值时,如遇特殊情况,可根据生产和临床用实际情况做必要调整,但需说明理由。 1.3 供试品最大有效稀释倍数的确定 供试品的最大有效稀释倍数(MV D)按下式计算: MV D=C?L/λ L为供试品的细菌内毒素限值;C为供试品溶液的浓度。当L以EU/ml表示时,C等于1.0ml/ml;当L的单位以EU/mg或EU/U表示时,C为供试品制备成溶液后的浓度,单位为mg/ml 或U/ml。如供试品为注射用无菌粉末或原料药,则MV D取1,可计算供试品的最小有效稀释浓度C: λ/L。
中国药典XXXX年版《细菌内毒素检查法》 ——凝胶法 凝胶法 凝胶法系通过鲎试剂与内毒素产生凝集反应的原理来检测或半定量内毒素的方法。 鲎试剂灵敏度复核试验在本检查法规定的条件下,使鲎试剂产生凝集的内毒素的最低浓度即为鲎试剂的标示灵敏度,用EU/ml表示。当使用新批号的鲎试剂或试验条件发生了任何可能影响检验结果的改变时,应进行鲎试剂灵敏度复核试验。 根据鲎试剂灵敏度的标示值(λ),将细菌内毒素国家标准品或细菌内毒素工作标准品用细菌内毒素检查用水溶解,在旋涡混合器上混匀15分钟,然后制成2λ、λ、0.5λ和0.25λ四个浓度的内毒素标准溶液,每稀释一步均应在旋涡混合器上混匀30秒钟。取分装有0.1ml鲎试剂溶液的10mm×75mm试管或复溶后的0.1ml/支规格的鲎试剂原安瓿18支,其中16管分别加入0.1ml不同浓度的内毒素标准溶液,每一个内毒素浓度平行做4管;另外2管加入0.1ml细菌内毒素检查用水作为阴性对照。将试管中溶液轻轻混匀后,封闭管口,垂直放入37℃±1℃恒温器中,保温60分钟±2分钟。 将试管从恒温器中轻轻取出,缓缓倒转180°,若管内形成凝胶,并且凝胶不变形、不从管壁滑脱者为阳性;未形成凝胶或形成的凝胶不坚实、变形并从管壁滑脱者为阴性。保温和拿取试管过程应避免受到振动造成假阴性结果。 当最大浓度2λ管均为阳性,最低浓度0.25λ管均为阴性,阴性对照管为阴性,试验方为有效。按下式计算反应终点浓度的几何平均值,即为鲎试剂灵敏度的测定值(λc). λc=1g-1(∑X/4)
式中 X为反应终点浓度的对数值(1g)。反应终点浓度是指系列递减的内毒素浓度中最后一个呈阳性结果的浓度。 当λc在0.5λ-2λ(包括0.5λ和2λ)时,方可用于细菌内毒素检查,并以标示灵敏度λ为该批鲎试剂的灵敏度。 干扰试验按表1制备溶液A、B、C和D,使用的供试品溶液应为未检验出内毒素且不超过最大有效稀释倍数(MVD)的溶液,按鲎试剂灵敏度复核试验项下操作。 只有当溶液A和阴性对照溶液D的所有平行管都为阴性,并且系列溶液C 的结果在鲎试剂灵敏度复核范围内时,试验方为有效。按下式计算系列溶液C和B的反应终点浓度的几何平均值(Es和Et)。 Es= 1g-1(∑Xs/4) Et= 1g-1(∑Xt/4) 式中,Xs、Xt分别为系列溶液C和溶液B的反应终点浓度的对数值(1g)。当Es在0.5λ—2λ(包括0.5λ和2λ)及Et在0.5Es—2Es (包括0.5Es 和2Es)时,认为供试品在该浓度下无干扰作用。若供试品溶液在小于MVD 的稀释倍数下对试验有干扰,应将供试品溶液进行不超过MVD的进一步稀释,再重复干扰试验。 表1 凝胶法干扰试验溶液的制备
水环境中微囊藻毒素的检测现状概述 作者:周绪申, 张世禄, 许维, 罗阳 作者单位:海河流城水环境监测中心,天津,300170 刊名: 海河水利 英文刊名:Haihe Water Resources 年,卷(期):2011(4) 参考文献(11条) 1.WHO Cyanobacterial toxins:microcystin-LR in drinkingwater,background document for the development of WHO guidelines for drinking-water quality 2003 2.Duy T N;Lam P K S;Shaw G R Toxicology and risk assessment of fresh water cyanobacterial (Blue-green algae)toxins in water 2000 3.闫海;潘纲;张明明微囊藻毒素的研究进展 2002(11) 4.Jochimsen E M;Carmichael W W;An J Liver failure and death after exposure to microcystins at a hemodialysis center in Brazil[外文期刊] 1998(13) 5.钱芸;戴树桂;刘广良富营养化淡水水体中微囊藻毒素的研究进展[期刊论文]-环境污染治理技术与设备 2002(08) 6.Gago-Martínez A;Pineiro N;Aguete EC Further improvements in the application of high-performance liquid chromatography,capillary electrophoresis and capillary electrochromatography to the analysis of algal toxins in the aquatic environment 2003(1-2) https://www.doczj.com/doc/248452912.html,wton I A;Codd G A Cyanobactcria (blue-green algae)toxins and their significance in UK and European waters 1991(05) 8.HJ/T 91-2002,地表水和污水监测技术规范 9.GB3838-2002,地表水环境质量标准 10.GB/T 20466-2006,水中微囊藻毒素的测定 11.GB/T 5750.8-2006,生活饮用水标准检验方法有机物指标 本文链接:https://www.doczj.com/doc/248452912.html,/Periodical_hhsl201104014.aspx
药典三部(2015版)-通则-1143细菌内毒素检查法
1143 细菌内毒素检查法 本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。 细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。供试品检测时,可使用其中任何一种方法进行试验。当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。 本试验操作过程应防止内毒素的污染。 细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。 细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。 细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。 细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。 试验所用的器皿需经处理,以去除可能存在的外源性内毒素。耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。 供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。缓冲液必须经过验证不含内毒素和干扰因子。 内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公
编号: 作业指导书水中微囊藻毒素的测定高效液相色谱法 临江市环境保护监测站
1、方法提要 微囊藻毒素在238nm下有 1、方法的适用范围 本标准规定了高效液相色谱法和间接竞争酶联免疫吸附法测定水中微囊藻毒素(环状七肽)的条件和详细分析步骤。 本标准适应于饮用水、湖泊水、河水、地表水中微囊藻毒素的测定。 样品中微囊藻毒素的检出限:高效液相色谱法和酶联免疫吸附法均匀为μg/L。 2、微囊藻毒素的分子式、分子质量及结构式 分子式 微囊藻毒素-RR(MC-RR):C49H75N13O12, 微囊藻毒素-YR(MC-YR):C52H72N10O13, 微囊藻毒素-LR(MC-LR):C49H74N10O12.。 分子质量 MC-RR:,MC-YR:μg,MC-LR:μg。 结构式
MC-RR、MC-YR、MC-LR、X和Y 表1 MC-RR、MC-YR、MC-LR、X和Y 3、水样采集和保存 用采水器采集1500ml~2000ml水样(水样采集后,应在4 h内完成以下前处理步骤)。用500目的不锈钢筛()过滤,除去水样中大部分浮游生物和悬浮物。取过滤后的水样1200ml于玻璃杯式滤器()中,依次经滤膜()减压过滤。准确量取1000ml 滤液置于棕色试剂瓶中。注:如减压过滤后的水样不能立即分析,可置于玻璃容器中,在-20℃保存,30d内分析完毕。 4、试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯试剂和不含有机物的蒸馏水。
甲醇,HPLC级(色谱级甲醇) 二氯甲烷,农残级 阿特拉津标准贮备溶液,ρ=100μg/mL。 准确称取阿特拉津标准样品,用少量二氯甲烷溶解后,再用甲醇准确定容至100mL,作为阿特拉津标准贮备溶液。在4℃冰箱中保存,保存期半年。 阿特拉津标准使用液,ρ=μg/mL。 取阿特拉津标准贮备溶液于容量瓶中,甲醇定容,混匀,配制成标准使用溶液。在4℃冰箱中保存,保存期半年。 无水硫酸钠:在400℃灼烧4小时,冷却后密闭保存在玻璃瓶中。 氯化钠:在400℃灼烧4小时,冷却后密闭保存在玻璃瓶中。 5、仪器和设备 除非另有说明,分析时均使用符合国家标准A级玻璃量器。 高效液相色谱仪:具有可调波长紫外检测器或二极管阵列检测器。 色谱柱:填料为μm ODS,柱长200mm,内经反相色谱柱或其他性能相近的色谱柱。 振荡器:可调速。 浓缩装置:旋转蒸发装置或K-D浓缩器、浓缩仪等性能相当的设备。 分液漏斗:250mL。
细菌内毒素检查方法建立中应注意的几个问题 摘要:本文对细菌内毒素检查方法的建立、限值的确定、方法学验证及常见问题进行了介绍。在建立细菌内毒素检查法之前,应尽可能多的收集有关该药品的基本信息,例如:有关样品的溶解性信息,推荐的稀释液,在水中的溶解度,以及最适溶剂;样品的pH范围;分子量大小;产品规格、体积或重量;拟用于临床的用法和用量等等。以便选择合适的样品处理方法和内毒素检查方法,对于早期研发阶段的药物,应选择合适的赋形剂,以有利于细菌内毒素检查中对样品的稀释处理。此外,在确定内毒素限值时还应尽可能采用最大人拟用剂量,为临床安全性和有效性研究中增加剂量留出空间。 一、细菌内毒素检查方法建立的主要步骤 对某一新化合物建立细菌内毒素检查方法时,首先应根据人体最大日给药剂量和给药途径,计算和确定样品的内毒素限值,选择合适的鲎试剂,根据临床规格,计算最大有效稀释倍数,稀释产品,并在低于最大稀释倍数的浓度下进行检查。可以采用凝胶法,也可以采用终点法或动态法。当测定结果有争议时,除另有规定外,以凝胶法为准。 1、细菌内毒素限值的确定 一个药品在投放市场前,它是否满足内毒素限值的要求?样品的内毒素含量具体是多少?这些问题不但关注用药安全,还应该最大限度的提供有关内毒素含量的准确信息,为药品生产过程中质量控制提供警戒信息。尽管细菌内毒素检查方法的建立是一个科学方法的研究过程,但其最终目的还是要为控制药品质量服务。因此,在方法建立时,不但要阐明限值的合理性,考虑技术可能达到的限值,同时还要满足相关药品管理法规的要求。 研究人员在建立方法的早期,一般会按照临床建议的最大人用剂量确定一个非正式的限值,这个限值可以根据实验室可以达到的最低检测水平,把限值订的相对比较严格,但往往由于早期的临床剂量会比最终上市的临床剂量高几倍,所以严格的限值,可能会使得正式生产时很多产品不能通过检查,从而造成不必要的浪费;因此参按照法规允许的最高水平,酌情确定样品的限值。 样品内毒素限值的确定一般与临床人体最大给药剂量有关,剂量越大,单位重量或体积的内毒素限值越低。一般按以下公式计算:内毒素限值L=K/M。式中内毒素限值L是以EU/ml、EU/mg或EU/u表示;K为按规定的给药途径,人体每公斤体重每小时最大可耐受的内毒素剂量,以EU/(kg.h)表示,注射剂K=5EU/(kg.h),其中放射性药品注射剂K=2.5EU/(kg.h),鞘内用注射剂K=0.2EU/(kg.h)。一般我国人群平均体重按60kg计算,人体对细菌内毒素的最大耐受量为300EU/h;另我国人体的平均体表面积按1.55m2计算,人体每平方米的最大耐受剂量为(300EU/h)/ 1.55m2 =(193EU/h)/ m2 。 M为人体每公斤体重每小时接受的最大给药剂量,以ml/(kg.h)、mg/(kg.h)或u/(kg.h)表示。 内毒素限值计算举例(一):A注射剂的人体最大用量为每小时1.5g,每公斤每小时体重的剂量为1.5g/60kg=0.025g/kg=25mg/kg,内毒素限值L=K/M=(5EU/kg)/( 25mg/kg ) = 0.2EU/mg。在细菌内毒素检查法中,细菌内毒素标准品和鲎试剂常常以EU/ml表示,所以在具体实验中样品的内毒素的限量可以转换为EU/ml的表示方法,可使实验操作计算更为方便。假定产品A的浓度为100mg/ml(或原料药经溶解后的浓度为100mg/ml), 那么,将产品A的限值从EU/mg转变为EU/ml时,内毒素限值L= 0.2 EU/mg 100 mg/ml = 20 EU/ml。内毒素限值计算举例(二):B注射剂的临床最大用药剂量为1g/m2,规格为50mg/ml,内毒素限值L=(193 EU/ m2)/(1g/m2)=193 EU/g=0.193 EU/mg,转换为EU/ml 表示时,L = 0.193 EU/mg50 mg/ml=9.65EU/ml。 大输液品种的限值一般定为0.5EU/ml,灭菌注射用水则定为0.25EU/ml。内毒素限值没有考