
醛和酮 亲核加成反应
一、基本要求
1.掌握醛酮的命名、结构、性质;醛酮的鉴别反应;不饱和醛酮的性质 2.熟悉亲核加成反应历程及其反应活性规律;醛酮的制备
二、知识要点
(一)醛酮的分类和命名
(二)醛酮的结构:
醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。
C=O 双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。
(三)醛酮的化学性质
醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是羰基中带正电荷的碳。所以羰基易与亲核试剂进行加成反应(亲核加成反应)。
此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H )较活泼,能发生一系列反应。
亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。
1.羰基上的亲核加成反应
醛,酮亲核加成反应的影响因素:羰基碳上正电性的多少有关,羰基碳上所连的烃基结构有关,亲核试剂的亲核性大小有关。 (1)与含碳的亲核试剂的加成 ○
1氰氢酸: ○2 炔化物
C O
C O H C H O 121.8116.5。。sp 2
杂化键
键近平面三角形结构πσC C R
O H H ( )δδ
酸和亲电试剂进攻富电子的氧碱和亲核试剂进攻缺电子的碳
涉及醛的反应 氧化反应( )
αH 的反应羟醛缩合反应卤代反应C O C OH
+ HCN CN 羟基睛
α
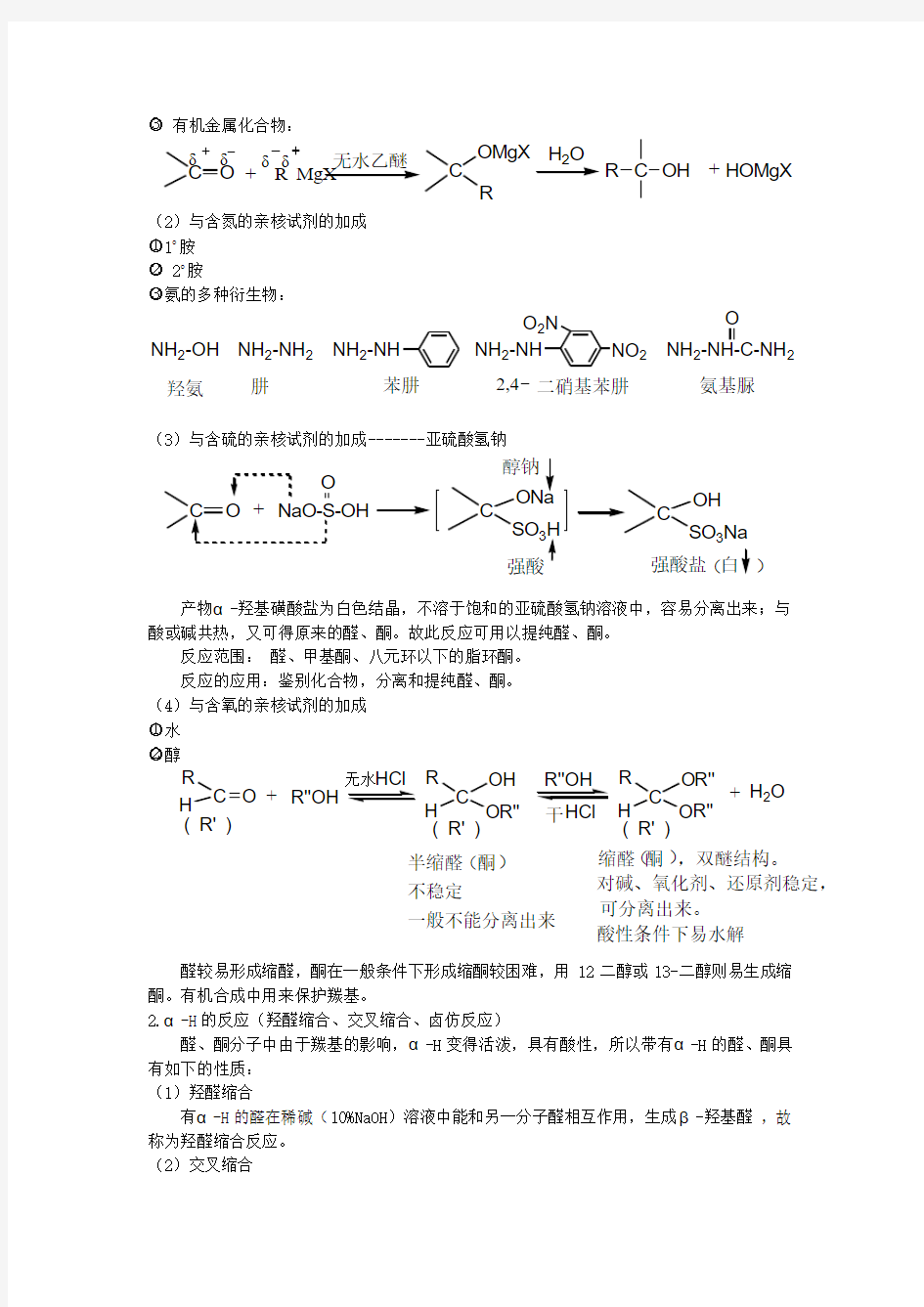
○3 有机金属化合物:
(2)与含氮的亲核试剂的加成 ○
11o 胺 ○
2 2o 胺 ○
3氨的多种衍生物:
(3)与含硫的亲核试剂的加成-------亚硫酸氢钠
产物α-羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、酮。故此反应可用以提纯醛、酮。
反应范围: 醛、甲基酮、八元环以下的脂环酮。 反应的应用:鉴别化合物,分离和提纯醛、酮。 (4)与含氧的亲核试剂的加成 ○1水 ○
2醇
醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用12二醇或13-二醇则易生成缩酮。有机合成中用来保护羰基。
2.α-H 的反应(羟醛缩合、交叉缩合、卤仿反应)
醛、酮分子中由于羰基的影响,α-H 变得活泼,具有酸性,所以带有α-H 的醛、酮具有如下的性质: (1)羟醛缩合
有α-H 的醛在稀碱(10%NaOH )溶液中能和另一分子醛相互作用,生成β-羟基醛 ,故称为羟醛缩合反应。 (2)交叉缩合
C O δδ+ R MgX δδC
OMgX R
H 2O R C OH +HOMgX
无水乙醚C O NaO-S-OH C
OH
SO 3Na
C ONa SO 3H
+O 醇钠
强酸强酸盐 白( )R C H ( R' )R C OH
H O ( R' )
O +R''
R''OH R
C
O H O ( R' )
R''OH R''R''
HCl
HCl 无水干+H 2O
半缩醛 酮不稳定
一般不能分离出来缩醛 酮 ,双醚结构。
对碱、氧化剂、还原剂稳定,可分离出来。酸性条件下易水解
( )
( )NH 2-OH NH 2-NH 2NH 2-NH NH 2-NH-C-NH 2O NH 2-NH O 2N NO 2羟氨
肼苯肼二硝基苯肼氨基脲2,4
(3)分子内缩合
(4)卤代反应和卤仿反应
醛、酮的α-H 易被卤素取代生成α-卤代醛、酮,特别是在碱溶液中,
反应能很顺利的进行。含有α-甲基的醛酮在碱溶液中与卤素反应,则生成卤仿。 若X 2用I 2则得到CHI 3 (碘仿) 黄色固体,称其为碘仿反应。 (5)外消旋化 3.氧化和还原反应 (1)康尼查罗反应
没有α-H 的醛在浓碱的作用下发生自身氧化还原(歧化)反应——分子间的氧化还原反应,生成等摩尔的醇和酸的反应称为康尼查罗反应。 (2)醛的氧化反应
醛易被氧化,弱的氧化剂即可将醛氧化为羧酸。土伦试剂是弱氧化剂,只氧化醛,不氧 化酮和C=C 。故可用来区别醛和酮。
○
1托伦试剂 ○2斐林试剂 (4)还原反应
○
1羰基还原成亚甲基 ○
2羰基还原成醇羟基 催化氢化:
LiAlH4还原:LiAlH4是强还原剂,除不还原C=C 、C ≡C 外,其它不饱和键都可被其还原。
NaBH4还原:只还原醛、酮、酰卤中的羰基,不还原其它基团。 ○
3酮的双分子还原
(五) 不饱和醛酮:不饱和醛酮的分类、命名和制备;α,β-不饱和醛酮的化学性质(加格
氏试剂,HCN 等);Michael 加成,亲核加成反应历程:(简单的加成反应历程,加成——消去反应历程)。
R C H O (R')+ H 2
Ni 热,加压R CH H OH (R')
RCHO + 2[Ag(NH 3)2]+ + 2OH -2Ag + RCOONH 4 + NH 3 +H 2O 土伦试剂银镜
三、习题
1.命名下列化合物,立体构型明确的要标明构型。
(1) (2) (3) (4)
(5) (6)
(7) (8) (9)
(10)
2.写出下列化合物结构
(1)1-苯基-1-丙酮(2)3-甲基丁醛(3)邻羟基苯甲醛
(4)对异丙基苯甲酮(5)3-甲基-2,4戊二酮(6)5-甲基-4-羰基-2-己烯醛
(7)R-3-甲基-2戊酮(8)3-氯-3-甲基-2-戊酮(9)3-丁烯-2-酮
(10)4-对甲基环己酮(11)3-(2-乙基苯基)丁醛(12)丙酮苯腙
3.填空
(1)下列化合物中,羰基亲核反应活性最强的是C。
A. B. C. D.
(2)下列化合物中,羰基亲核反应活性最强的是D。
A.B.C.D.
CH3CH(OH)CH2CHO CH2=CHCOCH3(CH3)3CHCH=CHCHO
(CH3)2CHCH2COCH2CHO
CH2CCH2
O
Cl
CH3
O
C
CH3
COCH2CH3
CHO
CHO
OH
OCH3
ClCH2CHO ClCH2CH2CHO Cl2CHCHO CH3CHO
CH3CHO ClCH2CHO CH3CH2CHO NO2CH2CHO
O
H
CH3
3-羰基丁烯
4-(3-氯苯甲酰)甲苯3-羟基丁醛
5-甲基-3-羰基己醛
(R)-3-甲基环己酮
4,4-二甲基-2-戊烯
2-丙酰基甲苯1,3-二甲基丙酮
2-羟基-3-甲氧基苯甲醛
(2z)-3,7-二甲基-2,6辛二烯
(3)下列化合物中能与乙基溴化镁反应,水解后生成2-甲基-2-丁醇的是 B 。 A .
B .
C .
D .
(4)下列化合物能与醛反应生成腙的是 B 。
A .
B .
C .
D .
(5)下列羰基化合物发生亲核加成反应的正确相对活性顺序为 C 。 Ⅰ 甲 醛 Ⅱ 乙 醛 Ⅲ 丁 酮 Ⅳ 丙 酮
A . Ⅲ >Ⅳ >Ⅱ >Ⅰ
B . Ⅰ >Ⅱ >Ⅲ >Ⅳ
C . Ⅰ >Ⅱ >Ⅳ >Ⅲ
D . Ⅱ >Ⅰ >Ⅳ >Ⅲ
(6)在干燥氯化氢的催化下,乙二醇与醛类反应的最终产物是 C 。 A . 卤代酸 B . 内 酯 C . 缩 醛 D . 羟基乙醛 (7)下列化合物与氢氰酸反应时, 反应速度最快的为 C .
A .
B . C. D.
(8) 下列化合物中, 可起歧化反应的为 AE , 可发生碘仿反应的为 D .
A .
B .
C .
D .
E .
(9) 格氏试剂与 D 反应的水解产物为三级醇.
A. B. C. D.
4.完成下列反应
(1)
(2)
(3)
(4)
CHO
CH 3CHO
10%NaOH
+CH 3CHO + HOCH 2CH 2OH
H +
CHO 40%NaOH CH 3CH 2CHO
稀 NaOH
CH 3CHCH 2O
CH 3CH 2CHO
CH 3COCH 3CH 3COOCH 3
NH 2OH NH 2NH
2NH 2NHCH 3C
O C O CH 3
Cl 3CCHO CH 3CHO CHO CH 3CH 2CHO (CH 3)2CHCHO CH 3COCH 3(CH 3)3CCHO
CH 3CHO HCHO CHO
CH 3COCH 3
(5)
(6)
(7)
(8)
(9)
(10) (11)
(12)
(13)
(14)
5, 用化学方法鉴别下列各组化合物,写出所加化学试剂及所出现的实验现象
(1)苯丙烯醇,苯丙烯醛 托伦试剂 (2)戊醛,3-戊酮 托伦试剂 (3)苯乙醛,苯乙酮 托伦试剂 (4)环己醇,环己酮
CHO
40%NaOH CH 3CHO + CH 3CH 2NO 2
C 2H 5ONa CHO
OH
O
+
(CH 3)2CHCOCH 3I 2/NaOH O
NH 2NHC 6H 5CH 3CH 2COCH 3 + NH 2
OH
CH 3CHO
HCN
H 3O
+
CHO
CH 3CHO 稀 NaOH
_H 2
O
(CH 3)3CCHO
40%NaOH
CH 3COCH 3 +
NHNH 2
肼
(5) 苯乙酮,环己酮,苯酚
先碘仿(I2/NAOH ),后FeCL3 (6)丙醛,丙酮,1-丙醇,甲乙醚 先托伦试剂,再加肼,后Na (7)甲醛,乙醛,甲醇,乙醇
先托伦试剂区分醛酮,再碘仿分别都区分 (8)乙醛 丙醛 丙酮 托伦试剂,再碘仿
6.制备 (1)
(2) 和
(3)
(4) (5)
(6)
(7)
(8)
7..结构推导题
(1)化合物A 的分子式为C 6H 12O ,能与羟胺作用生成肟,但不起银镜反应,A 催化加氢得到一种醇,此醇经过脱水、臭氧化、水解等反应后得到两种液体,其中之一有银镜反应,但无碘仿反应,另一种有碘仿反应而无银镜
CH 2CH 2OH C=CHCH 2CH 2OH CH 3COCH=CH 2CH 3COCH 2COOCH 2CH 3
O
CH 3CH 2COOH
HOOC
CH 3CH=CHCH 2OH CH 3CH 2OH CH=CH 2COCH
3
C CH 2CH 3
OH CH 3
和
CH 3
O HCCH 2CH 2CH 2CH 2CH
O O
CH 3C CH CH 3CH 2CH 2CH(CH 3)CH 2
OH
OH
OH
反应,试写出该化合物的结构式及有关反应式。
(2)化合物A(C10H12O2),不溶于NaOH溶液,能与2,4-二硝基苯肼反应,但不与Tollens 试剂作用。A经LiAlH4还原得B(C10H14O2)。A和B都能进行碘仿反应。A与HI作用生成C(C9H10O2),C能溶于NaOH溶液,但不溶于Na2CO3溶液。C经Clemmensen还原生成D(C9H12O),C经KMnO4氧化得对羟基苯甲酸。试写出A、B、C、D可能的结构式
(3).某化合物A分子式为C9H10O2,能溶于NaOH溶液,并能与溴水、羟胺、2,4-二硝基苯肼反应,经LiAlH4还原后生成B (C9H12O2),A和B均有碘仿反应,用锌汞齐和浓盐酸还原A得C (C9H12O),将C用NaOH溶液处理,再与碘甲烷加热回流生成D (C10H14O),用KMnO4氧化D得到对甲氧基苯甲酸,试推测化合物A、B、C、D的结构式。
(4)化合物A(C5H12O),具光学活性,用K2Cr2O7氧化时得到没有旋光性的B(C5H10O),B与CH3CH2CH2MgBr作用后水解生成化合物C,C能被拆分为对映体。试推测A、B、C 的结构并写出相应的反应。
(5)化合物A(C8H14O),能使Br2-CCl4溶液褪色,与苯肼反应生成相应的腙。A经臭氧氧化后得到丙酮和化合物B,B与I2-NaOH溶液反应生成黄色的CH3I沉淀和丁醛酸。试推测A的可能结构式并写出相应的反应式。
(6)化合物A(C6H14O),与金属钠作用产生氢气。当将其硫酸溶液加热时产生另一种化合物B,B能使Br2-CCl4溶液褪色;B经KMnO4的酸性溶液氧化后得到化合物C,C与异丙基溴化镁作用,再水解又得到A.。试推测A、B、C的结构并写出相应的反应式。
(7)化合物A的分子式为C5H10O,A能和苯肼反应,也能发生碘仿反应,A氢化还原得化合物B (C5H12O),B与浓H2SO4共热的主要产物为C (C5H10),C没有顺反异构现象。试写出A、B、C的结构式及各步反应式。
醛和酮 亲核加成反应 一、基本要求 1.掌握醛酮的命名、结构、性质;醛酮的鉴别反应;不饱和醛酮的性质 2.熟悉亲核加成反应历程及其反应活性规律;醛酮的制备 二、知识要点 (一)醛酮的分类和命名 (二)醛酮的结构: 醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。 C=O 双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。 (三)醛酮的化学性质 醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是羰基中带正电荷的碳。所以羰基易与亲核试剂进行加成反应(亲核加成反应)。 此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H )较活泼,能发生一系列反应。 亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。 1.羰基上的亲核加成反应 醛,酮亲核加成反应的影响因素:羰基碳上正电性的多少有关,羰基碳上所连的烃基结构有关,亲核试剂的亲核性大小有关。 (1)与含碳的亲核试剂的加成 ○ 1氰氢酸: ○2 炔化物 C O C O H C H O 121.8116.5。。sp 2 杂化键 键近平面三角形结构πσC C R O H H ( )δδ 酸和亲电试剂进攻富电子的氧碱和亲核试剂进攻缺电子的碳 涉及醛的反应 氧化反应( ) αH 的反应羟醛缩合反应卤代反应C O C OH + HCN CN 羟基睛 α
○3 有机金属化合物: (2)与含氮的亲核试剂的加成 ○ 11o 胺 ○ 2 2o 胺 ○ 3氨的多种衍生物: (3)与含硫的亲核试剂的加成-------亚硫酸氢钠 产物α-羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、酮。故此反应可用以提纯醛、酮。 反应范围: 醛、甲基酮、八元环以下的脂环酮。 反应的应用:鉴别化合物,分离和提纯醛、酮。 (4)与含氧的亲核试剂的加成 ○1水 ○ 2醇 醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用12二醇或13-二醇则易生成缩酮。有机合成中用来保护羰基。 2.α-H 的反应(羟醛缩合、交叉缩合、卤仿反应) 醛、酮分子中由于羰基的影响,α-H 变得活泼,具有酸性,所以带有α-H 的醛、酮具有如下的性质: (1)羟醛缩合 有α-H 的醛在稀碱(10%NaOH )溶液中能和另一分子醛相互作用,生成β-羟基醛 ,故称为羟醛缩合反应。 (2)交叉缩合 C O δδ+ R MgX δδC OMgX R H 2O R C OH +HOMgX 无水乙醚C O NaO-S-OH C OH SO 3Na C ONa SO 3H +O 醇钠 强酸强酸盐 白( )R C H ( R' )R C OH H O ( R' ) O +R'' R''OH R C O H O ( R' ) R''OH R''R'' HCl HCl 无水干+H 2O 半缩醛 酮不稳定 一般不能分离出来缩醛 酮 ,双醚结构。 对碱、氧化剂、还原剂稳定,可分离出来。酸性条件下易水解 ( ) ( )NH 2-OH NH 2-NH 2NH 2-NH NH 2-NH-C-NH 2O NH 2-NH O 2N NO 2羟氨 肼苯肼二硝基苯肼氨基脲2,4
《常见的醛酮羰基的加成反应》习题 一、选择题(每个选项只有一个正确选项) 1.下列关于醛的说法中正确的是() A.甲醛是甲基跟醛基相连而构成的醛 B.醛的官能团是—COH C.甲醛和丙醛互为同系物 D.饱和一元脂肪醛的分子组成符合通式C n H2n+2O 2.橙花醛是一种香料,其结构简式如下:(CH3)2C===CHCH2CH2C(CH3)===CHCHO。下列说法正确的是() A.橙花醛不可以与溴发生加成反应 B.橙花醛可以发生氧化反应和还原反应 C.1 mol橙花醛最多可以与2 mol氢气发生加成反应 D.橙花醛是乙烯的同系物 3. 扑热息痛是一种优良的解热镇痛剂,结构简式为,它不可能具有的化学性质是() A.能与烧碱溶液反应 B.能与溴水发生加成反应 C.能被氢气还原 D.遇FeCl3溶液呈现紫色 4. 不能由醛加氢还原制得的醇是() A.HOCH2CH2OH B. C. D. 5.已知某有机物的分子式为C8H8O,其中含有一个苯环、一个羰基。则该有机物可能的结构有() A.2种 B.3种 C.4种 D.5种
6.β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。 下列说法正确的是() A.β-紫罗兰酮可使酸性KMnO4溶液退色 B.1 mol中间体X最多能与2 mol H2发生加成反应 C.维生素A1易溶于NaOH溶液 D.β-紫罗兰酮与中间体X互为同分异构体 二、选择题(每个小题有1~2个正确选项) 7. 科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图。下列关于A的说法正确的是() A.化合物A的分子式为C15H22O3 B.与FeCl3溶液发生反应后溶液显紫色 C.1 mol A可以与1 mol NaOH反应 D.1 mol A最多与1 mol H2加成 8. 丙烯醛的结构简式为CH2===CHCHO,下列有关其性质的叙述中错误的是() A.能使溴水退色,也能使酸性高锰酸钾溶液退色 B.在一定条件下与H2充分反应生成2-丙醇 C. 在一定条件下能发生加聚反应 D. 与HCN反应后的产物中有两种官能团
大学化学 第15卷 第2期2000年4月 醛、酮结构对羰基亲核加成反应活性的影响 许 申 鸿 (青岛大学化学系 山东266071) 醛、酮分子中都含有活泼的羰基,亲核加成是醛酮最重要、最典型的反应之一。其反应历程为: 式中R为H或烃基,Nu为亲核试剂。这两种历程,决定反应速率的关键步骤均为Nu对羰基的进攻[1~3]。因此,羰基化合物的结构以及Nu的性质对加成反应进行的难易程度均有影响。但在相同的条件下,同一亲核试剂对不同羰基化合物的加成反应,影响反应活性的因素就只有羰基化合物的结构了。国内有机化学教科书[3~7]一般都是从两方面论述羰基反应活性的:①电子因素:当羰基碳上连有给电性基团(如烷基、芳基等)时,由于中心碳原子的电正性减小,从而降低了它的亲电能力,使反应活性下降。另一方面,给电作用还强化了过渡态中氧上发展出来的负电荷,使过渡态能量增加而不利于反应的进行。相反的,当羰基碳上连有吸电基团(如F3C—等)时,则会使反应速度加快。②空间因素:由于从反应物到过渡态及产物,羰基碳由sp2杂化变为sp3杂化,反应中存在着明显的空间特性。在反应过程中,R基会被越来越近地挤在一起,非键张力使过渡态内能增加,不利于反应的进行。故当R基的体积增大时,反应速率迅速下降。当然,Nu体积增大,同样也会降低反应速率。综合上述两方面的影响,可以得出一般醛、酮亲核加成反应的活性次序: 以上论述,对于一般脂肪醛酮的亲核加成反应活性的比较是足够的。例如根据上述讨论,很容易给出下列各组醛酮的亲核加成反应活性:①CF3CH2CH O>CH3CH2CH O>CH3C OCH2CH3 >CH3CH2C OCH2CH3;②ArCH2C OR>ArC OR>Ar2C O。 可是对于环酮来说,前面的讨论就显得有些单薄、不完善。例如,如何比较下两组酮①环己酮与CH3C OCH2CH2CH3;②环己酮与环丁酮的反应活性呢?对此,学生在解答习题时常会感到困难,不知该如何去分析解答。因为仅从上述两方面的影响因素去考虑,显然是不够的,无法做出正确判断。我们先来讨论例①。由于烷基的供电子能力差别甚小,因此,这两个 54
羰基的亲核加成及相关反应 羰基化合物包括醛、酮、羧酸及衍生物和CO 2。 5.1 羰基的结构 C O δ+δ- 亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。 5.2 亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。 ]CN ][CO [k v ->= OH - +HCN CN -+ H 2O 快 -C δ+δ-C O -CN C OH CN +OH - 反应的平衡位置受电子效应和空间效应的影响。 酮正向反应的趋势较小(空阻大)。 二、亲核加成反应的一般特点 1.反应可以被酸或碱催化 酸催化可提高羰基的亲电活性。 C O +H + + OH 碱催化提高亲核试剂的亲核性。 Nu H +OH --+H 2O Nu H -> 2.多数醛酮的亲核加成为可逆反应,用于分离与提纯。 5.2.2 影响羰基亲核加成反应活性的因素 一、羰基化合物的结构 1.电子效应 羰基碳的正电性越大,亲核加成速度越大,反应活性越大。羰基碳所连的吸电基(-I ,-C )使其亲核加成反应的活性增加,而供电基(+I ,+C )则使其活性降低。 活泼顺序:
ClCHO > HCHO > RCHO > CH 3COR > RCOOR' > RCONR'2 > RCOO --I > +C (+C) (+C,空阻) ( +C > -I) (+C) C O R R' 活性极低 (1)π-π共轭效应(增加其稳定性);(2)+C 效应(降低羰基碳的正电性);(3)加成产物失去共轭能,反应活化能高;(4)产物的张力大幅增加。 2.立体效应 C O - sp 2 活性: O C H H O C CH 3H O C CH 3CH 3O O C CH 3CH 2CH 2CH 3O C Ph Ph >>>> > 二、试剂的亲核性 对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。 1.带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。OH ->H 2O, RO ->ROH 。 2.极性大的分子比极性小的分子亲核性强。HCN>H 2O(极性与电负性)。 3.同周期元素的负离子的亲核性与碱性大小一致; R 3C ->R 2N ->RO ->F - 4.同一主族元素的负离子的亲核性与可极化度大小一致。 I ->Br ->Cl ->F - 5.2.3亲核加成反应的立体化学 一、非手性的羰基化合物的加成 C Nu O - H + C Nu OH 50%C O -Nu + C OH Nu 50%dl 前(潜)手性分子 结果得外消旋化产物 二、手性羰基化合物的亲核加成方向遵守Cram 规则,得立体选择性的非对称异构体产物。
1. 烯烃的分类:累积二烯烃(H 2C=C=CH 2)、孤立二烯烃、共轭二烯烃 2. 烯烃的结构特征:未参与杂化的p 轨道与烯烃平面垂直。 如果吸收一定的能量,克服了p 轨道的结合力,顺式或反式可以互转。 C=C 键的平均键能为610.9kJ ·mol -1,C-C σ键的平均键能为347.3 kJ ·mol -1, 因此 键的键能大约为263.6 kJ ·mol -1。 二元取代烯烃比一元取代烯烃稳定8.3~12.5 kJ ·mol -1。所以烯烃取代越多越稳定。 1,3-丁二烯是一个平面型分子。键长均匀化是共轭烯烃的共性。 3. 烯烃的物理性质 含2~4个碳原子的烯烃是气体,含5~15个碳原子的烯烃为液体,高级烯烃 为固体。所有烯烃都不溶于水,所有烃(C 、H )都不溶于水。燃烧时,火焰明亮。 在sp n 杂化轨道中,n 数值越小,s 性质越强。由于s 电子靠近原子核,它比p 电子与原子核结合得更紧,轨道的电负性越大,所以电负性大小次序为s>sp>sp 2>sp 3>p 。即碳原子的电负性随杂化时s 成分的增大而增大。烯烃由 于sp 2碳原子的电负性比sp 3碳原子的大,比烷烃容易极化,成为有偶极矩的分子。以丙烯为例,甲基与双键碳原子相连的键易于极化,键电子偏向于sp 2碳原子,形成偶极,负极指向双键,正极位于甲基一边。因此当烷烃和不饱和碳原子相连时,由于诱导效应与超共轭效应成为给电子基团。 第八章 烯烃 亲核加成 自由基加成 共轭加成
①在abC=Cab类型的烯烃中,顺型异构体总是偶极分子,而且沸点较高。这对于识别顺反异构体是很有用的。②也可以通过X射线衍射的方法测定 相同基团之间的距离,以确定顺反异构体。③核磁共振也是测定顺反异构体的有效方法。 共轭烯烃物理性质的特点:①紫外(电子)吸收光谱——向长波方向移动②易极化——折射率增高③趋于稳定——氢化热(烯烃催化加氢生成烷烃放出的热)降低。 4.烯烃的反应 (1)烯烃的加成:离子型(亲电加成、亲核加成)、自由基型、协同
1. 重要的亲核加成反应 (1) 加氰化氰 醛、脂肪族甲基酮和含8个碳以下的脂环酮都可以加氰化氢,生成氰醇(α-羟基腈)。 C O +C O H C H N CN α-羟基腈 实验证明碱对这个反应的影响颇大。例如,丙酮和氰化氢作用,不加任何催化剂,3至4小时内只有50%的丙酮起反应;当加入一滴氢氧化钠溶液,反应在两分钟内完成。若加入酸,反应速度减慢;加入较多的酸,放置几个星期也不反应;因为氢氰酸是弱酸,酸或碱的存在将直接影响它的电离平衡。 + H +--C O H H H N CN + 加入碱,平衡向右移动,CN -的浓度增加;加入酸,平衡向左移动,CN -的浓度降低。这些事实说明在丙酮与氰化氢的反应中起决定作用的是CN -本身的性质和浓度。 醛、酮加氰化氢的反应是可逆的,亲核试剂是CN -,其历程可以表示如下: 反应分两步进行,第一步是CN -进攻羰基碳,生成氧负离子中间体。这是个慢步骤,也是决定速度的步骤。第二步是氧负离子中间体和质子结合,形成氰醇,这是个快步骤。 醛、酮和氰化氢直接加成反应的产率较好,但是氰化氧有剧毒,且挥发性大(沸点26.5℃)。使用起来不安全。为了避免反应中直接使用氰化氢,一般采用醛或酮与氰化钾(钠)的水溶液混合,然后加入无机酸,使氰化氢一旦生成立即和醛或酮作用。.但在加酸时应控制溶液的pH 值,使之始终偏于碱性(pH ≌8),以利于反应的进行。 醛、酮加氰化氢在有机合成中很有实用价值。它是增长碳链的一种方法;此外加成物含 有双官能团,是一类较活泼的化合物,可进一步转化为多种其它化合物。例如: CH 3CH 3CH 2 CH 3 CH 3 CH 3CH 3 CH 3(CH 3)2C CH 2NH 2 CH 3 H H 2SO 4CH 3OH C O H O H O +C H C O O O H N CN C O C C H O C H 3+O 浓,Δ α-甲基丙烯酸甲酯(90%) α-甲基丙烯酸甲酯是合成有机玻璃——聚α-甲基丙烯酸甲酯的单体。 C R R R`δδ+ O H ()O + --慢快C H C H N CN + R`)H (-C R O CN R`)H (
羰基的亲核加成及相关反应 羰基化合物包括醛、酮、羧酸及衍生物和 5.1羰基的结构 CO 2。 C O 亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。 5.2亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。 v k[ CO ][CN ] 快 OH - + HCN CN - + H 2O 、f 慢 \ H 2O \ /OH CNJ / = O — /C 、b +0H - / CN / CN 酮正向反应的趋势较小(空阻大) 二、亲核加成反应的一般特点 1 .反应可以被酸或碱催化 酸催化可提高羰基的亲电活性。 碱催化提高亲核试剂的亲核性。 活性.Nu - > Nu — H 2?多数醛酮的亲核加成为可逆反应,用于分离与提纯。 5.2.2影响羰基亲核加成反应活性的因素 一、羰基化合物的结构 1 .电子效应 羰基碳的正电性越大,亲核加成速度越大,反应活性越大。羰基碳所连的吸电基( 加成反应的活性增加,而供电基( +I , +C )则使其活性降低。 活泼顺序: Nu —H + OH Nu - + H 2O C=O + C = O H — C +—OH -I , -C )使其亲核
50% ClCHO > HCHO > RCHO > CH 3COR > RCOOR' > RCONR' 2 > RCOO (1)-共轭效应(增加其稳定性);(2) +C 效应(降低羰基碳的正电性);(3)加成产物失去共轭 能,反应活化能高;(4 )产物的张力大幅增加。 2.立体效应 、试剂的亲核性 对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。 1 .带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。 OH ->H 2O, RO ->ROH 。 2?极性大的分子比极性小的分子亲核性强。 HCN>H 2O (极性与电负性)。 3?同周期元素的负离子的亲核性与碱性大小一致; R 3C ->R 2N ->RO ->F - 4?同一主族元素的负离子的亲核性与可极化度大小一致。 l ->Br ->CI ->F - 5.2.3亲核加成反应的立体化学 一、非手性的羰基化合物的加成 前(潜)手性分子 结果得外消旋化产物 、手性羰基化合物的亲核加成方向遵守 Cram 规则,得立体选择性的非对称异构体产物。 -I > +C 什C ) 什C,空阻) (+C > -I) 什 C) 活性极低 O II H > CH 3—C —H O II >CH 3—C —CH 3 > O O II II O >CH 3CH 2-C-CH 2CH 3> Ph-C —Ph R Nu R#、o - R Nu R'/ OH 50% dl R R ,Z Q C x Nu R R'Z OH C ? Nu R O ) 张力增加 O
亲电加成与亲核加成的区别 加成反应就是有机化学中一类最基本的化学反应, 它主要包含亲电加成反应、亲核加成反应与游离基加成反应几大类。其中由于亲电加成与亲核加成的“形式”相像, 而本质却存在着很大的差别, 因而学生往往会对亲电加成与亲核加成区分不清, 产生混淆,例如为什么同样就是双键, 碳碳双键易发生亲电加成反应而碳氧双键却易发生亲核加成反应。本文就简单分析分析亲电加成与亲核加成的本质区别。 关键词: 亲电加成,亲核加成,结构特征,反应机理 一、亲电试剂与亲核试剂 就一个反应来讲, 就是亲电的还就是亲核的, 通常规定由进攻试剂就是亲电的还就是亲核的来决定。所以要弄清楚什么就是亲电加成反应什么就是亲核加成反应, 就必须先弄清楚亲电试剂与亲核试剂的含义。所谓亲电试剂就是针对进攻试剂讲的,它一般就是一个缺电子的正离子也可以就是偶极或诱导偶极正的一端, 由于缺电子, 所以它总就是倾向于与给电子反应物即底物进行反应, 因此我们把它叫做亲电试剂。亲核试剂也就是对进攻试剂而言的, 它一般就是一个富电子的负离子也可以就是含有孤电子对的基团, 由于富电子, 所以它倾向于与缺电子反应物特别就是碳核发生反应, 因此我们把它叫做亲核试剂。 二.底物的结构特特征 1、亲电加成反应中底物的结构特征 亲电加成的典型代表就就是碳碳双键的亲电加成反应。碳碳双键包含着处于不同状态的两个键,一个较强的σ键,另一个较弱的π键由于π轨道重的一对电子比σ轨道中的一对电子更为分散,被碳核拉得较松, 因此就很容易被极化而导致双键中的二键容易断开,形成两个更强的σ键。另外由于电子云就是聚集在分子平面的上部与下部, 在整个分子中, 电子向外暴露的态势较为突出, 由此我们可以瞧出它们能遮蔽分子使之不易受到亲核试剂的进攻, 相反却容易受到亲电试剂的进攻而发生亲电加成反应。