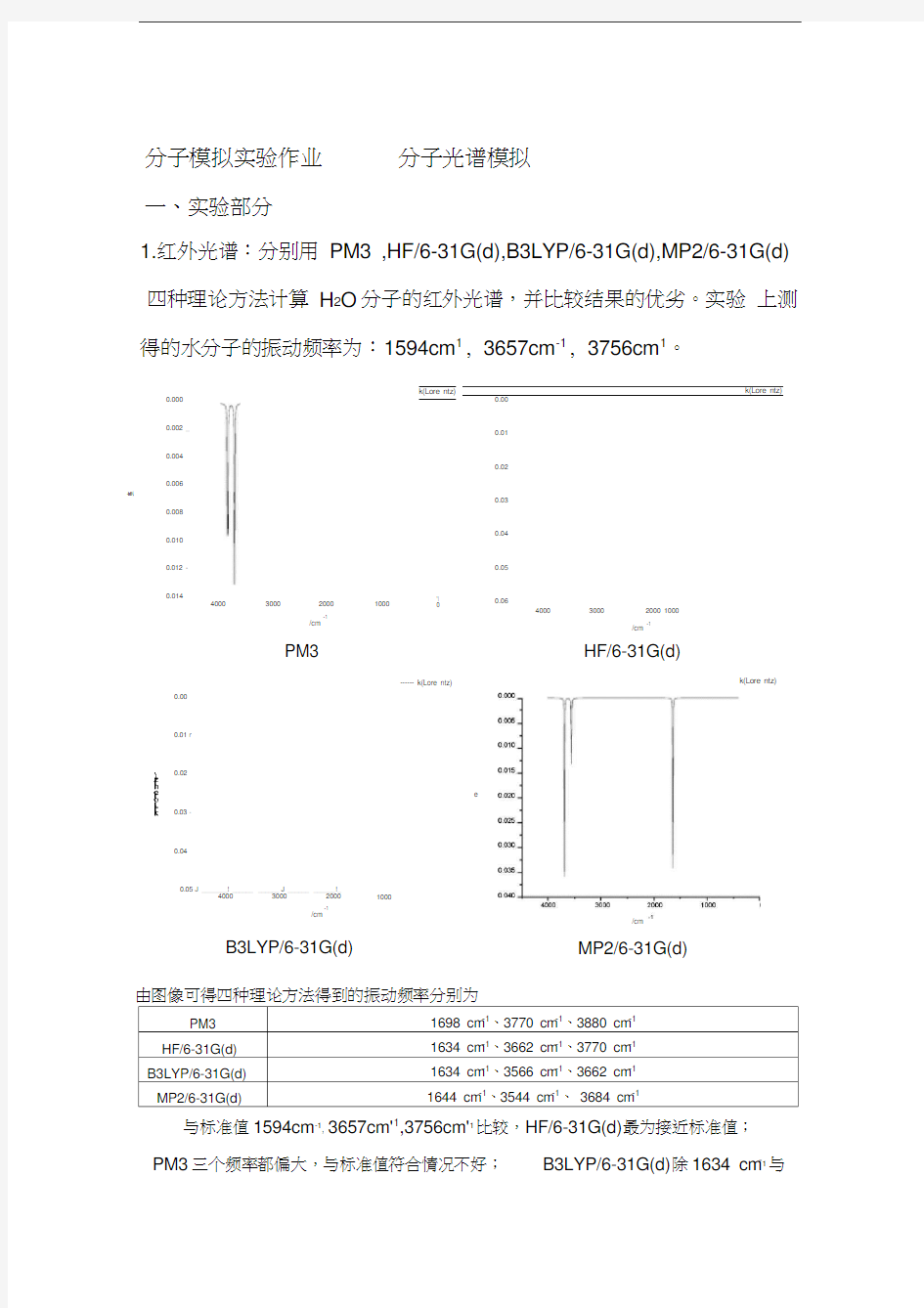

1.红外光谱:分别用 PM3 ,HF/6-31G(d),B3LYP/6-31G(d),MP2/6-31G(d) 四种理论方法计算 H 2O 分子的红外光谱,并比较结果的优劣。实验 上测得的水分子的振动频率为:1594cm 1, 3657cm -1, 3756cm 1。
k(Lore ntz)
B3LYP/6-31G(d)
由图像可得四种理论方法得到的振动频率分别为
PM3 1698 cm -1、3770 cm -1、3880 cm -1 HF/6-31G(d) 1634 cm -1、3662 cm -1、3770 cm -1 B3LYP/6-31G(d)
1634 cm -1、3566 cm -1、3662 cm -1 MP2/6-31G(d)
1644 cm -1、3544 cm -1、 3684 cm -1
与标准值1594cm -1, 3657cm'1,3756cm'1比较,HF/6-31G(d)最为接近标准值;
PM3三个频率都偏大,与标准值符合情况不好; B3LYP/6-31G(d)除1634 cm -1与
分子模拟实验作业 一、实验部分
分子光谱模拟
k(Lore ntz)
-DrnelPL (.
4000
3000
2000
-1
/cm
1000
'!
0.00
0.01
0.02
0.03
0.04
0.05
0.06
4000
3000
2000 1000
/cm
-1
PM3
HF/6-31G(d)
------ k(Lore ntz)
k(Lore ntz)
0.00
0.01 r
0.04
0.05 J _______ ! ______ ______ J ______ ______ !_
4000 3000 2000
-1
/cm
1000
MP2/6-31G(d)
0.000
0.002 _
0.004
0.006
0.008
0.010
0.012 - 0.014
0.02
0.03 -
e
/cm
标准值较接近外,其余两个频率均偏小;MP2/6-31G(d) 1644 cm-1与标准值接近,
其余两个频率均偏小
2?拉曼光谱的模拟
HF/6-31G(d)计算的CH4分子的拉曼谱图
111
图中特征波数为3290 cm、3189 cm、1705 cm
3?紫外可见光谱的模拟
计算甲酸分子5个垂直激发的单重态和三重态,2个绝热激发的单重态和三重态,并确定垂直激发和绝热激发波长。
(1)垂直激发
CI-SINGLES EXCITATION ENERGIES
STATE HARTREE EV KCAL/MOL CM-1
1A 0.2550545872 6.9404 160.0492 55978.01
1A 0.3796011178 10.3295 238.2033 83312.82
1A 0.4095383929 11.1441 256.9893 89883.29
1A 0.4158054412 11.3146 260.9219 91258.75
1A 0.4554734351 12.3941 285.8139 99964.86
HF/6-31G(d)理论水平下HCOOH分子5个单重激发态的垂直激发能
CI-SINGLES EXCITATION ENERGIES
STATE HARTREE EV KCAL/MOL CM-1
3A 0.2299108089 6.2562 144.2712 50459.59 3A 0.2330765536 6.3423 146.2578 51154.39 3A 0.3720691489 10.1245 233.4769 81659.74 3A 0.3918314869 10.6623 245.8780 85997.07 3A 0.4193773712 11.4118 263.1633 92042.69
HF/6-31G(d)理论水平下HCOOH分子5个三重激发态的垂直激发能
HF/6-31G(d)理论水平下HCOOH分子垂直激发波长表(单位:nm)
(2)绝热激发
E=-118309.6kcal/mol 第一个单重激发态
E=-11826O.9 kcal/mol
第二个单重激发态
△ E=189.1 kcal/mol
E=-118346.9kcal/mol
第一个三重激发态
△ E=103.1 kcal/mol
E=-118309.6 kcal/mol
第二个三重激发态
△ E=103.1 kcal/mol
△ E=140.4 kcal/mol
可见,垂直激发态中,三重态的波长总体看来大于单重态,因此垂直激发时, 单重态的能量要高于三重态的能量,因为单重态中两个单电子的自旋方向相反,
而三重态中两个单电子自旋相同。绝热激发态的波长总体上大于垂直激发的波长,其余规律与垂直激发类似。两种激发类型共同存在的趋势:激发态的数目越大,波长越小。
4.核磁共振(NMR )谱的模拟
AS H2)=(31.2+30.3)/2-33.4= -2.65
AS HN)=(32.4+31.9)/2-33.4= -1.25
AS (0)=27.8-33.4= -5.6
AS CH2)=200.2-257.2= -57
AS C=O)=100.7-257.2= -156.5
NMR的结果显然HF/STO-3G理论水平的计算值不可靠
分子模拟 编辑 分子模拟,是指利用理论方法与计算技术,模拟或仿真分子运动的微观行为,广泛的应用于计算化学,计算生物学,材料科学领域,小至单个化学分子,大至复杂生物体系或材料体系都可以是它用来研究的对象。 计算机分子模拟技术Computer Molecular Simulation,CMS 目录 1分类 2计算机分子模拟技术 3应用 1分类编辑 分子模拟的工作可分为两类:预测型和解释型。 预测型工作是对材料进行性能预测、对过程进行优化筛选,进而为实验提供可行性方案设计。解释型工作即通过模拟解释现象、建立理论、探讨机理,从而为实验奠定理论基础。 2计算机分子模拟技术编辑 这是随着计算机在科研中的应用而发展起来的一门新的科学,是计算机科学与基础科学相结合的产物。在药物研究方面通过分析和计算一系列活性药物分子的三维构象并将其叠合,可以了解某一类药物分子所应具有的药物构象,这一信息给予新药研究很大帮助,药效构象的计算为今后的药效基团方法以及数据库虚拟筛选的方法打下了基础。 3应用编辑 近年来分子模拟技术发展迅速并在多个学科领域得到了广泛的应用。在药物设计领域,可用于研究病毒、药物的作用机理等;在生物科学领域,可用于表征蛋白质的多级结构与性质;在材料学领域,可用于研究结构与力学性能、材料的优化设计等;在化学领域,可用于研究表面催化及机理等;在石油化工领域,可用于分子筛催化剂结构表征、合成设计、吸附扩散,可构建和表征高分子链以及晶态或非晶态本体聚合物的结构,预测包括共混行为、机械性质、扩散、内聚与润湿以及表面粘接等在内的重要性质。 生物化学与分子生物学总论 ?生物化学?生物无机化学?原始生物化学?古生物化学?前生命化学 ?地球生物化学?放射生物化学?低温生物化学?制备生物化学?反向生物化学 ?生命科学?分子生物学?结构分子生物学?分子遗传学?生物信息学 ?反向生物学?结构生物学?生物能学?生物物理化学?生物物理学 ?酶学?糖生物学?基因组学?结构基因组学?功能基因组学 ?比较基因组学?药物基因组学?转基因学?蛋白质组学?RNA组学 ?糖组学?相互作用物组学?代谢物组学?代谢组学?表型组学 其他科技名词 ?转录物组学?基因组?功能基因组?蛋白质组?转基因组 ?转录物组?表型组?代谢物组?RNA组?糖组 ?相互作用物组?生物大分子?生物多聚体?单体?多体 ?寡聚体?多聚体?残基?一级结构?二级结构
红外光谱仪调查及实验报告 第一部分红外光谱仪调查 1.1 简介 傅里叶红外光谱仪: 全名为傅里叶变换红外光谱仪(Fourier Transform Infrared Spectrometer,FTIR Spectrometer),是基于对干涉后的红外光进行傅里叶变换的原理而开发的红外光谱仪,主要由红外光源、光阑、干涉仪(分束器、动镜、定镜)、样品室、检测器以及各种红外反射镜、激光器、控制电路板和电源组成。傅里叶红外光谱仪不同于色散型红外分光的原理,可以对样品进行定性和定量分析,广泛应用于医药化工、地矿、石油、煤炭、环保、海关、宝石鉴定、刑侦鉴定等领域。 滤光片型近红外光谱仪器: 滤光片型近红外光谱仪器以滤光片作为分光系统,即采用滤光片作为单色光器件。滤光片型近红外光谱仪器可分为固定式滤光片和可调式滤光片两种形式,其中固定滤光片型的仪器时近红外光谱仪最早的设计形式。仪器工作时,由光源发出的光通过滤光片后得到一宽带的单色光,与样品作用后到达检测器。 色散型近红外光谱仪器: 色散型近红外光谱仪器的分光元件可以是棱镜或光栅。为获得较高分辨率,现代色散型仪器中多采用全息光栅作为分光元件,扫描型仪器通过光栅的转动,使单色光按照波长的高低依次通过样品,进入检测器检测。根据样品的物态特性,可以选择不同的测样器件进行投射或反射分析。 傅里叶变换型近红外光谱仪器: 傅里叶变换近红外分光光度计简称为傅里叶变换光谱仪,它利用干涉图与光谱图之间的对应关系,通过测量干涉图并对干涉图进行傅里叶积分变换的方法来测定和研究近红外光谱。其基本组成包括五部分:①分析光发生系统,由光源、分束器、样品等组成,用以产生负载了样品信息的分析光;②以传统的麦克尔逊干涉仪为代表的干涉仪,以及以后的各类改进型干涉仪,其作用是使光源发出的光分为两束后,造成一定的光程差,用以产生空间(时间)域中表达的分析光,即干涉光;③检测器,用以检测干涉光;④采
分子荧光光谱法实验报告 一、实验目的 1.掌握荧光光度计的基本原理及使用。 2.了解荧光分光光度计的构造和各组成部分的作用。 3.掌握分子荧光光度计分析物质的特征荧光光谱:激发光谱、发射光谱的测定方法。 4.了解影响荧光产生的几个主要因素。 5.学会运用分子荧光光谱法对物质进行定性和定量分析。 二、实验原理 原子外层电子吸收光子后,由基态跃迁到激发态,再回到较低能级或者基态时,发射出一定波长的辐射,称为原子荧光。对于分子的能级激发态称为分子荧光,平时所说的荧光指分子荧光。 具有不饱和基团的基态分子经光照射后,价电子跃迁产生荧光,是当电子从第一激发单重态S1的最低振动能级回到基态S0各振动能级所产生的光辐射。 (1)激发光谱 是指发光的某一谱线或谱带的强度随激发光波长(或频率)变化的曲线。横坐标为激发光波长,纵坐标为发光相对强度。 激发光谱反映不同波长的光激发材料产生发光的效果。即表示发光的某一谱线或谱带可以被什么波长的光激发、激发的本领是高还是低;也表示用不同波长的光激发材料时,使材料发出某一波长光的效
率。荧光为光致发光,合适的激发光波长需根据激发光谱确定——激发光谱是在固定荧光波长下,测量荧光体的荧光强度随激发波长变化的光谱。获得方法:先把第二单色器的波长固定,使测定的λem不变,改变第一单色器波长,让不同波长的光照在荧光物质上,测定它的荧光强度,以I为纵坐标,λex为横坐标所得图谱即荧光物质的激发光谱,从曲线上找出λex,,实际上选波长较长的高波长峰。 (2)发射光谱 是指发光的能量按波长或频率的分布。通常实验测量的是发光的相对能量。发射光谱中,横坐标为波长,纵坐标为发光相对强度。 发射光谱常分为带谱和线谱,有时也会出现既有带谱、又有线谱的情况。发射光谱的获得方法:先把第一单色器的波长固定,使激发的λex不变,改变第二单色器波长,让不同波长的光扫描,测定它的发光强度,以I为纵坐标,λem为横坐标得图谱即荧光物质的发射光谱;从曲线上找出最大的λem。 (3)荧光强度与荧光物质浓度的关系 用强度为I0的入射光,照射到液池内的荧光物质时,产生荧光,荧光强度If用仪器测得,在荧光浓度很稀(A 三、实验试剂和仪器试剂:罗丹明B乙醇溶液;1-萘酚乙醇溶液;3,3’-Diethyloxadicarbocyanine iodide:标准溶液,10μg/ml, 20μg/ml,30μg/ml,40μg/ml和未知浓度;蒸馏水;乙 醇。 仪器:Fluoromax-4荧光分光光度计;1cm比色皿;
一、基本原理 1.原子吸收光谱的产生 众所周知,任何元素的原子都是由原子核和绕核运动的电子组成,原子核外电子按其能量的高低分层分布而形成不同的能级。因此,一个原子核可以具有多种能级状态。能量最低的能级状态称为基态能级(E 0=0),其余能级称为激发态能级,而能最低的激发态则称为第一激发态。正常情况下,原子处于基态,核外电子在各自能量最低的轨道上运动。如果将一定外界能量如光能提供给该基态原子,当外界光能量E 恰好等于该基态原子中基态和某一较高能级之间的能级差△E 时,该原子将吸收这一特征波长的光,外层电子由基态跃迁到相应的激发态,而产生原子吸收光谱。电子跃迁到较高能级以后处于激发态,但激发态电子是不稳定的,大约经过10-8秒以后,激发态电子将返回基态或其它较低能级,并将电子跃迁时所吸收的能量以光的形式释放出去,这个过程称原子发射光谱。可见原子吸收光谱过程吸收辐射能量,而原子发射光谱过程则释放辐射能量。核外电子从基态跃迁至第一激发态所吸收的谱线称为共振吸收线,简称共振线。电子从第一激发态返回基态时所发射的谱线称为第一共振发射线。由于基态与第一激发态之间的能级差最小,电子跃迁几率最大,故共振吸收线最易产生。对多数元素来讲,它是所有吸收线中最灵敏的,在原子吸收光谱分析中通常以共振线为吸收线。 2.原子吸收光谱分析原理 2.1谱线变宽及其原因 原子吸收光谱分析的波长区域在近紫外区。其分析原理是将光源辐射出的待测元素的特征光谱通过样品的蒸汽中被待测元素的基态原子吸收后,测定发射光谱被减弱的程度,进而求得样品中待测元素的含量,它符合吸收定律: ()0k l I I e νν-= (1.1) 0log 0.434I K l A I ν ν=-=- (1.2) 其中:K v 为一定频率的光吸收系数,K v 不是常数,而是与谱线频率或波长有关,I v 为透射光强度,I 0为发射光强度。
分子模拟实验作业——分子光谱模拟 一、 实验部分 1. 红 外 光 谱 : 分 别 用 PM3 , HF/6-31G(d),B3LYP/6-31G(d),MP2/6-31G(d)四种理论方法计算H 2O 分子的红外光谱,并比较结果的优劣。实验上测得的水分子的振动频-1-1 由图像可得四种理论方法得到的振动频率分别为
B3LYP/6-31G(d) 1634 cm-1、3566 cm-1、3662 cm-1 MP2/6-31G(d) 1644 cm-1、3544 cm-1、3684 cm-1 与标准值1594cm-1,3657cm-1,3756cm-1比较,HF/6-31G(d)最为接近标准值; PM3三个频率都偏大,与标准值符合情况不好;B3LYP/6-31G(d)除1634 cm-1与标准值较接近外,其余两个频率均偏小;MP2/6-31G(d) 1644 cm-1与标准值接近,其余两个频率均偏小。 2.拉曼光谱的模拟 HF/6-31G(d)计算的CH4分子的拉曼谱图 图中特征波数为3290 cm-1、3189 cm-1、1705 cm-1 3.紫外可见光谱的模拟 计算甲酸分子5个垂直激发的单重态和三重态,2个绝热激发的单重态和三重态,并确定垂直激发和绝热激发波长。 (1)垂直激发 --------------------------------------------------------------------- CI-SINGLES EXCITATION ENERGIES STATE HARTREE EV KCAL/MOL CM-1 --------------------------------------------------------------------- 1A 0.2550545872 6.9404 160.0492 55978.01
竭诚为您提供优质文档/双击可除无水乙醇红外光谱分析实验报告 篇一:红外光谱分析实验报告 一、【实验题目】 红外光谱分析实验 二、【实验目的】 1.了解傅立叶变换红外光谱仪的基本构造及工作原理 2.掌握红外光谱分析的基础实验技术 3.学会用傅立叶变换红外光谱仪进行样品测试 4.掌握几种常用的红外光谱解析方法 三、【实验要求】 利用所学过的红外光谱知识对碳酸钙、聚乙烯醇、丙三醇、乙醇的定性分析制定出合理的样品制备方法;并对其谱图给出基本的解析。 四、【实验原理】 红外光是一种波长介于可见光区和微波区之间的电磁波谱。波长在0.78~300μm。通常又把这个波段分成三个区域,即近红外区:波长在0.78~2.5μm(波数在12820~
4000cm-1),又称泛频区;中红外区:波长在2.5~25μm(波数在4000~400cm-1),又称基频区;远红外区:波长在25~300μm(波数在400~33cm-1),又称转动区。其中中红外区是研究、应用最多的区域。 红外区的光谱除用波长λ表征外,更常用波数(wavenumber)σ表征。波数是波长的倒数,表示单位厘米波长内所含波的数目。其关系式为: 作为红外光谱的特点,首先是应用面广,提供信息多且具有特征性,故把红外光谱通称为"分子指纹"。它最广泛的应用还在于对物质的化学组成进行分析。用红外光谱法可以根据光谱中吸收峰的位置和形状来推断未知物的结构,依照特征吸收峰的强度来测定混合物中各组分的含量。其次,它不受样品相态的限制,无论是固态、液态以及气态都能直接测定,甚至对一些表面涂层和不溶、不熔融的弹性体(如橡胶)也可直接获得其光谱。它也不受熔点、沸点和蒸气压的限制,样品用量少且可回收,是属于非破坏分析。而作为红外光谱的测定工具-红外光谱仪,与其他近代分析仪器(如核磁共振波谱仪、质谱仪 等)比较,构造简单,操作方便,价格便宜。因此,它已成为现代结构化学、分析化学最常用和不可缺少的工具。根据红外光谱与分子结构的关系,谱图中每一个特征吸收谱带都对应于某化合物的质点或基团振动的形式。因此,特征吸收
荧光分光光度法 一、 实验目的 1、学习荧光分光光度法的基本原理; 2、学习荧光光谱仪的结构和操作方法; 3、学习激发光谱、发射光谱曲线的绘制方法。 二、 实验原理 荧光分光光度法(fluorescence spectroscopy, FS )通常又叫荧光分析法,具有灵敏度高、选择性强、所需样品量少等特点,已成为一种重要的痕量分析技术。荧光(fluorescence )是分子吸收了较短波长的光(通常是紫外光和可见光),在很短的时间内发射出比照射光波长较长的光。由此可见,荧光是一种光致发光。 任何荧光物质都有两个特征光谱,即激发光谱(excitation spectrum )和发射光谱(emission spectrum )或称荧光光谱(fluorescence spectrum )。激发光谱表示不同激发波长的辐射引起物质发射某一波长荧光的相对效率。绘制激发光谱时,将发射单色器固定在某一波长,通过激发单色器扫描,以不同波长的入射光激发荧光物质,记录荧光强度对激发波长的关系曲线,即为激发光谱,其形状与吸收光谱极为相似。荧光光谱表示在所发射的荧光中各种波长的相对强度。绘制荧光光谱时,使激发光的波长和强度保持不变,通过发射单色器扫描以检测各种波长下相应的荧光强度,记录荧光强度对发射波长的关系曲线,即为荧光光谱。激发光谱和荧光光谱可用于鉴别荧光物质,而且是选择测定波长的依据。 荧光强度(F )是表征荧光发射的相对强弱的物理量。对于某一荧光物质的稀溶液,在一定波长和一定强度的入射光照射下,当液层的厚度不变时,所发生的荧光强度和该溶液的浓度成正比,即 该式即荧光分光光度法定量分析的依据。使用时要注意该关系式只适用于稀溶液。 三、 仪器与试剂 F-4500荧光光谱仪;比色管(10mL );牛血清白蛋白(BSA ) 四、 实验内容 1、 开机准备:接通电源,启动电脑。打开光谱仪主机电源,预热15分钟。 2、 运行FL solution 软件,设定检测方法和测量参数: EX (激发波长):280nm EM (发射波长):340nm EX 扫描范围:210nm ~330nm EM 扫描范围:290nm ~450nm EX 缝宽:2.5nm ,EM 缝宽:2.5nm 扫描速度:240nm/min PMT 电压:700V 3、 激发光谱和发射光谱的绘制: 先固定激发波长为280nm ,在290~450nm 测定荧光强度,获得溶液的发射光谱,在343nm 附近为最大发射波长λem ;再固定发射波长为λem ,测定激发波长为200nm ~λem 时的荧光强度,获得溶液的激发光谱,在280nm 附近为最大激发波长λex 。 4、 退出FL solution 软件,关闭光谱仪主机电源,关闭计算机。 Kc F
氢原子光谱 摘 要:本实验用光栅光谱仪对氢原子光谱进行测量,测得了氢原子光谱巴尔末线系的波长,求出了里德伯常数。最后对本实验进行了讨论。 关键词:氢原子光谱,里德伯常数,巴尔末线系,光栅光谱仪 1. 引言 光谱线系的规律与原子结构有内在的联系,因此,原子光谱是研究原子结构的一种重要方法。1885年巴尔末总结了人们对氢光谱测量的结果,发现了氢光谱的规律,提出了著名的巴尔末公式,氢光谱规律的发现为玻尔理论的建立提供了坚实的实验基础,对原子物理学和量子力学的发展起过重要作用。1932年尤里根据里德伯常数随原子核质量不同而变化的规律,对重氢赖曼线系进行摄谱分析,发现氢的同位素氘的存在。通过巴尔末公式求得的里德伯常数是物理学中少数几个最精确的常数之一,成为检验原子理论可靠性的标准和测量其他基本物理常数的依据。 2. 氢原子光谱 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 (1) 式中λH 为氢原子谱线在真空中的波长。 λ0=364.57nm是一经验常数。 n取3,4,5等整数。 若用波数表示,则上式变为 (2) 式中RH 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 (3) 式中M为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,ε0为真空 42 2 0-=n n H λλ??? ??-==22 1211~n R v H H H λ)/1()4(23202 42M m ch z me R z += πεπ
实验报告 实验课程:DSP原理及应用 学生姓名: 学号: 专业班级: 2012年 5月 25日
目录 实验一定点除法运算 实验二FIR滤波器 实验三FFT算法 实验四卷积计算 实验五数码管显示 实验六语音录放
实验一定点除法运算 一、实验目的 1、熟悉C54指令系统,掌握常用汇编指令,学会设计程序和算法的技巧。 2、学习用指令实现除法运算。 二、实验设备 计算机;DSP 硬件仿真器;DSP 实验开发平台。 三、实验原理 由内置的硬件模块支持,数字信号处理器可以高速的完成加法和乘法运算。但TMS320 系列DSP不提供除法指令,为实现除法运算,需要编写除法子程序来实现。二进制除法是乘法的逆运算。乘法包括一系列的移位和加法,而除法可分解为一系列的减法和移位。本实验要求编写一个16 位的定点除法子程序。 1.除法运算的过程设累加器为8 位,且除法运算为10 除以3,除的过程包括与除数有关的除数逐步移位,然后进行减法运算,若所得商为正,则在商中置1,否则该位商为0 例如:4 位除法示例:(1)数的最低有效位对齐被除数的最高有效位00001010 - 00011000 11110010 (2)由于减法结果为负,丢弃减法结果,将被除数左移一位再减00010100 - 00011000 11111000 (3)结果仍为负,丢弃减法结果,将被除数左移一位再减00101000 - 00011000 00010000 (4)结果为正,将减法结果左移一位后把商置1,做最后一次减00100001 - 00011000 00001001 (5)结果为正,将减法结果左移一位加1 得最后结果,高4 位是余数,低4 位商:00010011 2.除法运算的实现为了尽量提高除法运算的效率,’C54x 系列提供了条件减指令SUBC 来完成除法操作。 四、实验步骤 1.用Simulator 方式启动Code Composer。 2 .执行Project New 建立新的项目,输入chuf作为项目的名称,将程序定位在D:\ti\myprojects\chuf目录。 3.执行File New Source File 建立新的程序文件,为创建新的程序文件命名为chuf.asm 并保存;执行Project Add Files to Project,把chuf.asm 加入项目中。4.执行File New Source File 建立新的文件并保存为chuf.cmd;执行Project Add Files to Project,把chuf.cmd 加入项目中。 5.编辑chuf.asm 加入如下内容: ;*** 编制计算除法运算的程序段。其中|被除数|<|除数|,商为小数*** .title "chuf.asm" .mmregs .def start,_c_int00
仪器分析实验 实验名称:红外光谱分析实验 学院:化学工程学院专业:化学工程与工艺班级: 姓名:学号: 指导教师: 日期:
一、 实验目的 1、掌握溴化钾压片法制备固体样品的方法; 2、学习并掌握美国尼高立IR-6700型红外光谱仪的使用方法; 3、初步学会对红外吸收光谱图的解析。 二、实验原理 红外光是一种波长介于可见光区和微波区之间的电磁波谱。波长在0.75~1000μm 。通常又把这个波段分成三个区域,即近红外区:波长在0.75~2.5μm (波数在13300~4000cm -1),又称泛频区;中红外区:波长在 2.5~50μm (波数在4000~200cm -1),又称振动区;远红外区:波长在50~1000μm (波数在200~10cm -1),又称转动区。其中中红外区是研究、应用最多的区域。 红外区的光谱除用波长λ表征外,更常用波数σ表征。波数是波长的倒数,表示单位厘米波长内所含波的数目。其关系式为: )(10)(4 1 cm cm λσ=- 三、仪器和试剂 1、仪器: 美国尼高立IR-6700 2、试剂: 溴化钾,聚乙烯,苯甲酸 3、傅立叶红外光谱仪(FTIR)的构造及工作原理 计算机检测器样品室干涉仪光源?→??→??→??→? 四、实验步骤 1、打开红外光谱仪并稳定大概5分钟,同时进入对应的计算机工作站。 2、波数检验:将聚乙烯薄膜插入红外光谱仪的样品池处,从4000-650cm -1进行 波数扫描,得到吸收光谱。然后将所得的谱图与计算机上的标准谱图进行匹配,分析得到最吻合的图谱,即可判断物质结构。 3、测绘苯甲酸的红外吸收光谱——溴化钾压片法 取1-2mg 苯甲酸,加入在红外灯下烘干的100-200mg 溴化钾粉末,在玛瑙研钵中充分磨细(颗粒约2μm ),使之混合均匀。取出约80mg 混合物均匀铺洒在干净的压模内,于压片机上制成直径透明薄片。将此片装于固体样品架上,样品架插入红外光谱仪的样品池处,从4000-400cm -1进行波数扫描,得到吸收光谱。然后将所得的谱图与计算机上的标准谱图进行匹配。 4、结束实验,关闭工作站和红外光谱仪。
原子吸收光谱定量分析实验报告班级:环科10-1 姓名:王强学号:2010012127 一、实验目的: 1.了解石墨炉原子吸收分光光度计的使用方法。 2.了解石墨炉原子吸收分光光度计进样方法及技术关键。 3.学会以石墨炉原子吸收分光光度法进行元素定量分析的方法。 二、实验原理: 在原子吸收分光光度分析中,火焰原子吸收和石墨炉原子吸收是目前使用最多、应用范围最广的两种方法。相对而言,前者虽然具有振作简单、重现性好等优点而得到广泛应用,但该法由于雾化效率低、火焰的稀释作用降低了基态原子浓度、基态原子在火焰的原子化区停留时间短等因素限制了测定灵敏度的提高以及样品使用量大等方面的原因,对于来源困难、鹭或数量很少的试样及固态样品的直接分析,受到很大的限制。石墨炉原子化法由于很好地克服了上述不足,近年来得到迅速的发展。 石墨炉原子吸收方法是利用电能使石墨炉中的石墨管温度上升至2000 ~ 3000 ℃的高温,从而使待测试样完全蒸发、充分的原子化,并且基态原子在原子化区停留时间长,所以灵敏度要比火焰原子吸收方法高几个数量级。样品用量也少,仅 5 ~ 100 uL。还能直接分析固体样品。该方法的缺点是干扰较多、精密度不如火焰法好、仪器较昂贵、操作较复杂等。 本实验采用标准曲线法,待测水样品用微量分液器注入,经过干
燥、灰化、原子化等过程对样品中的痕量镉进行分析。 三、仪器和试剂: 1.仪器 由北京瑞利分析仪器公司生产的WFX-120型原子吸收分光光度计。 镉元素空心阴极灯 容量瓶 50 mL(5只)微量分液器0.5 ~ 2.5 mL及5 ~ 50 uL 2.试剂 100 ng/mL镉标准溶液(1%硝酸介质) 2 mol/L硝酸溶液 四、实验步骤: 1.测定条件 分析线波长:228.8 nm 灯电流:3 mA 狭缝宽度:0.2 nm 干燥温度、时间:100℃、15 s 灰化温度、时间:400℃、10 s 原子化温度、时间:2200℃、3 s 净化温度、时间:2200℃、2 s 保护气流量:100 mL/min 2.溶液的配制 取4只50 mL容量瓶,分别加入0 mL、0.125 mL、0.250 mL、0.500 mL浓度为100 ng/mL的镉标准溶液,再各添加2.5 mL硝酸溶液(2 mol/L),然后以Milli-Q去离子水稀释至刻度,摇匀,供原子吸收测
目录 实验装置介绍 (1) 实验一一、二阶系统阶跃响应 (2) 实验二控制系统稳定性分析 (5) 实验三系统频率特性分析 (7) 实验四线性系统串联校正 (9) 实验五 MATLAB及仿真实验 (12)
实验装置介绍 自动控制原理实验是自动控制理论课程的一部分,它的任务是:一方面,通过实验使学生进一步了解和掌握自动控制理论的基本概念、控制系统的分析方法和设计方法;另一方面,帮助学生学习和提高系统模拟电路的构成和测试技术。 TAP-2型自动控制原理实验系统的基本结构 TAP-2型控制理论模拟实验装置是一个控制理论的计算机辅助实验系统。如上图所示,TAP-2型控制理论模拟实验由计算机、A/D/A 接口板、模拟实验台和打印机组成。计算机负责实验的控制、实验数据的采集、分析、显示、储存和恢复功能,还可以根据不同的实验产生各种输出信号;模拟实验台是被控对象,台上共有运算放大器12个,与台上的其他电阻电容等元器件配合,可组成各种具有不同系统特性的实验对象,台上还有正弦、三角、方波等信号源作为备用信号发生器用;A/D/A 板安装在模拟实验台下面的实验箱底板上,它起着模拟与数字信号之间的转换作用,是计算机与实验台之间必不可少的桥梁;打印机可根据需要进行连接,对实验数据、图形作硬拷贝。 实验台由12个运算放大器和一些电阻、电容元件组成,可完成自动控制原理的典型环节阶跃响应、二阶系统阶跃响应、控制系统稳定性分析、系统频率特性测量、连续系统串联校正、数字PID 、状态反馈与状态观测器等相应实验。 显示器 计算机 打印机 模拟实验台 AD/DA 卡
实验一一、二阶系统阶跃响应 一、实验目的 1.学习构成一、二阶系统的模拟电路,了解电路参数对系统特性的影响;研究二阶系统的两个重要参数:阻尼比ζ和无阻尼自然频率ωn对动态性能的影响。 2.学习一、二阶系统阶跃响应的测量方法,并学会由阶跃响应曲线计算一、二阶系统的传递函数。 二、实验仪器 1.自动控制系统实验箱一台 2.计算机一台 三、实验原理 模拟实验的基本原理: 控制系统模拟实验采用复合网络法来模拟一、二阶系统,即利用运算放大器不同的输入网络和反馈网络模拟一、二阶系统,然后按照给定系统的结构图将这些模拟环节连接起来,便得到了相应的模拟系统。再将输入信号加到模拟系统的输入端,并利用计算机等测量仪器,测量系统的输出,便可得到系统的动态响应曲线及性能指标。 若改变系统的参数,还可进一步分析研究参数对系统性能的影响。 四、实验内容 构成下述系统的模拟电路,并测量其阶跃响应: 1.一阶系统的模拟电路如图
KBr压片法测定固体样品的红外光谱 一、实验目的 1、掌握红外光谱分析法的基本原理。 2、掌握Nicolet5700智能傅立叶红外光谱仪的操作方法。 3、掌握用KBr压片法制备固体样品进行红外光谱测定的技术和方法。 4、了解基本且常用的KBr压片制样技术在红外光谱测定中的应用。 5、通过谱图解析及标准谱图的检索,了解由红外光谱鉴定未知物的一般过程。 二、仪器及试剂 1 仪器:美国热电公司Nicolet5700智能傅立叶红外光谱仪;HY-12型手动液压式红外压片机及配套压片模具;磁性样品架;红外灯干燥器;玛瑙研钵。 2 试剂:苯甲酸样品(AR);KBr(光谱纯);无水丙酮;无水乙醇。 三、实验原理 红外吸收光谱法是通过研究物质结构与红外吸收光谱间的关系,来对物质进行分析的,红外光谱可以用吸收峰谱带的位置和峰的强度加以表征。测定未知物结构是红外光谱定性分析的一个重要用途。根据实验所测绘的红外光谱图的吸收峰位置、强度和形状,利用基团振动频率与分子结构的关系,来确定吸收带的归属,确认分子中所含的基团或键,并推断分子的结构,鉴定的步骤如下: (1)对样品做初步了解,如样品的纯度、外观、来源及元素分析结果,及物理性质(分子量、沸点、熔点)。 (2)确定未知物不饱和度,以推测化合物可能的结构; (3)图谱解析 ①首先在官能团区(4000~1300cm-1)搜寻官能团的特征伸缩振动; ②再根据“指纹区”(1300~400cm-1)的吸收情况,进一步确认该基团的存在以及与其它基团的结合方式。
图1 仪器的基本结构 四、实验步骤 1. 红外光谱仪的准备 (1)打开红外光谱仪电源开关,待仪器稳定30 分钟以上,方可测定; (2)打开电脑,选择win98系统,打开OMNIC E.S.P软件;在Collect菜单下的Experiment Set-up 中设置实验参数; (3)实验参数设置:分辨率 4 cm-1,扫描次数32,扫描范围4000-400 cm-1;纵坐标为Transmittance 2.固体样品的制备 (1)取干燥的苯甲酸试样约1mg于干净的玛瑙研钵中,在红外灯下研磨成细粉,再加入约150mg干燥且已研磨成细粉的KBr一起研磨至二者完全混合均匀,混合物粒度约为2μm以下(样品与KBr的比例为1:100~1:200)。 (2)取适量的混合样品于干净的压片模具中,堆积均匀,用手压式压片机用力加压约30s,制成透明试样薄片。 3.样品的红外光谱测定 (3)小心取出试样薄片,装在磁性样品架上,放入Nicolet5700智能傅立叶红外光谱仪的样品室中,在选择的仪器程序下进行测定,通常先测KBr的空白
X 荧光分析 一.实验目的 1.了解能量色散X 荧光分析的原理、仪器构成和基本测量、分析方法。 2.验证莫塞莱定律,并从实验推出屏蔽常数。 3.研究对多道分析器的定标,以及利用X 荧光分析测量位未知样品成分及相对含量的方法。 二.实验原理 以一定能量的光子、电子、原子、α粒子或其它离子轰击样品,将物质原子中的内壳层电子击出,产生电子空位,原子处于激发态。外壳层电子向内壳层跃迁,填补内壳层电子空位,同时释放出跃迁能量,原子回到基态。跃迁能量以特征X 射线形式释放,或能量转移给另一个轨道电子,使该电子发射出来,即俄歇电子发射。测出特征X 射线能谱,即可确定所测样品中元素种类和含量。 特征曲线X 射线根据跃迁后电子所处能级可以分为,,K L M 系等;根据电子跃迁前所在能级又可分为βαγβαL L K K K ,,,,等不同谱线。特征X 谱线的的能量为两壳层电子结合能之差。因此,所有元素的,K L 系特征X 射线能量在几千电子伏到几十千电子伏之间。X 荧光分析中激发X 射线的方式一般有三种: (1)用质子、α粒子等离子激发
(2)用电子激发; (3)用X射线或低能γ射线激发。我们实验室采用X射线激发(XIX技术),用放射性同位素作为激发源的X光管。 XIX技术中,入射光子除与样品中原子发生光电作用产生内壳层空位外,还可以发生相干散射和非相干散射(康普顿散射),这些散射光子进入探测器,形成XIX分析中的散射本底。另外,样品中激发出的光电子又会产生轫致辐射,但这产生的本底比散射光子本底小得多,且能量也较低,一般在3keV以下。所以XIX能谱特征是:特征X射线峰叠加在散射光子峰之间的平坦的连续本底谱上。如图1能谱示意图所示。 图一:能谱示意图 测量特征X射线常用() Si Li探测器,它的能量分辨率高,适用于多元素同时分析,也可选用() Ge Li或高纯Ge探测器,但均价格昂贵。 在X荧光分析中,对于轻元素(一般指45 Z<的元素)通常测其KX射线,对于重元素(45 Z>的元素),因其KX射线能量较高且比LX射线强度弱,
氢原子光谱 一.实验目的 1.熟悉光栅光谱仪的性能和用法 2.用光栅光谱仪测量氢原子光谱巴尔末系数的波长,求里德伯常数 二.实验原理 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 2 024 H n n λλ=- (1) 式中H λ为氢原子谱线在真空中的波长。0364.57nm λ=是一经验常数。n 取3,4,5等整数。 若用波数表示,则上式变为 221 112H H R n νλ?? = =- ??? (2) 式中H R 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 () () 242 2 3 0241/Z me Z R ch m M ππε= + (3) 式中M 为原子核质量,m 为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,0ε为真空介电常数,Z 为原子序数。 当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)
() 242 2 3 024me Z R ch ππε∞= (4) 所以 () 1/Z R R m M ∞ = + (5) 对于氢,有 () 1/H H R R m M ∞ =+ (6) 这里H M 是氢原子核的质量。 由此可知,通过实验测得氢的巴尔末线系的前几条谱线j 的波长,借助(6)式可求得氢的里德伯常数。 里德伯常数R ∞是重要的基本物理常数之一,对它的精密测量在科学上有重要意义,目前它的推荐值为()=10973731.56854983/R m ∞ 表1为氢的巴尔末线系的前四条波长表 表1 氢的巴尔末线系波长 值得注意的是,计算H R 和R ∞时,应该用氢谱线在真空中的波长,而实验是在空气中进行的,所以应将空气中的波长转换成真空中的波长。即1λλλ?真空空气=+,氢巴尔末线系前6条谱线的修正值如表2所示。 表2 真空—空气波长修正值
红外光谱实验报告 一、实验原理: 1、红外光谱法特点: 由于许多化合物在红外区域产生特征光谱,因此红外光谱法广 泛应用于这些物质的定性和定量分析,特别是对聚合物的定性 分析,用其他化学和物理方法较为困难,而红外光谱法简便易 行,特别适用于聚合物分析。 2、红外光谱的产生和表示 红外光谱定义:分子吸收红外光引起的振动能级跃迁和转动能级跃 迁而产生的吸收信号。 分子发生振动能级跃迁需要的能量对应光波的红外区域分类为: i.近红外区:10000-4000cm-1 ⅱ.中红外区:4000-400cm-1——最为常用,大多数化合物的化键振 动能级的跃迁发生在这一区域。 ⅲ.远红外区:400-10cm-1 产生红外吸收光谱的必要条件: 1)分子振动:只有在振动过程中产生偶极矩变化时才能吸收红外辐射。 ⅰ.双原子分子的振动:(一种振动方式)理想状态模型——把两个 原子看做由弹簧连接的两个质点,用此来 描述即伸缩振动;
图1 双原子分子的振动模型 ⅱ.多原子分子的振动:(简正振动,依据键长和键角变化分两大类) 伸缩振动:对称伸缩振动 反对称伸缩振动 弯曲振动:面内弯曲:剪切式振动 (变形振动)平面摇摆振动 面外弯曲振动:扭曲振动 非平面摇摆振动 ※同一种键型,不对称伸缩振动频率大于对称伸缩振动频率,伸缩振动频率大于弯曲振动频率。 ※当振动频率和入射光的频率一致时,入射光就被吸收,因而同一基团基本上总是相对稳定地在某一特定范围内出现吸收峰。ⅲ.分子振动频率: 基频吸收(强吸收峰):基态到第一激发态所产生分子振动 的振动频率。 倍频吸收(弱吸收峰):基态到第二激发态,比基频高一倍 处弱吸收,振动频率约为基频两倍。 组频吸收(复合频吸收):多分子振动间相互作用,2个或2
实验报告 课程名称: 材料科学基础实验 指导老师: 乔旭升 成绩: 实验名称: 光谱分析 实验类型: 同组学生姓名: 一、实验目的和要求(必填) 三、主要仪器设备(必填) 五、实验数据记录和处理 七、讨论、心得 二、实验内容和原理(必填) 四、操作方法和实验步骤 六、实验结果与分析(必填)一、实验目的 通过本实验了解紫光/可见光光度计、傅里叶变换红外光谱仪(FTIR )和荧光光谱仪的基本原理、主要用途和实际操作过程。掌握玻璃透光率、薄膜吸收光谱、固体粉末红外光谱和固体发光材料荧光光谱的测试方法。学习分析影响测试结果的主要因素。 二、实验原理 电磁波可与多种物质相互作用。如果这种作用导致能量从电磁波转移至物质,就称为吸收。当光波与某一受体作用时,光子和接受体之间就存在碰撞。光子的能量可被传递给接受体而被吸收,由此产生吸收光谱。通常紫外和可见光的能量接近于某两个电子能级地能量差,故紫外与可见光吸收光谱起源于价电子在电子能级之间的跃迁,又称为电子光谱。 当一束平行单色光照射到非散射的均匀介质时,光的一部分将被介质所反射,一部分被介质吸收,一部分透过介质。如果入射光强度为I0.反射光强度为Ir ,吸收光强度为Ia ,透过光强度为It ,则有I0=Ir+Ia+It 投射光强度与入射光强度之比称为透光率 T=It/I0 当一束具有连续波长的红外光照射某化合物时,其分子要吸收一部分光能转变为分子的震动能量或转动能量。此时若将其透过的光用单色器进行色散,就可得到一带暗条的谱带。以红外光的波长或波数为横坐标,以吸收率或者透过率百分数为纵坐标,把该谱带记录下来,就可得到该化合物的红外吸收光谱图。不同的化合物均有标准特征谱,将实验所得的光谱与标准谱对照,就可进行分子结构的基础研究和化合组成的分析。可由吸收峰的位置和形状来推知被测物的结构,按照特征峰的强度来测定混合物中各组分的含量。 当分子吸收来自光辐射的能量后,其本身就由处于稳定的基态跃迁至不稳定的激发态: M+h ν→。激发态是不稳定的,寿命极短,激发态分子会迅速以向周围散热或再发射电磁波(荧光或磷光)的方式回到基态: →M+荧光(或磷光)。任何能产生荧光(或磷光)的物质都具有两个特征光谱:激发光谱和发射光谱。 激发光谱:荧光(或磷光)为光致发光,因此必须选择合适的激发光波长,这可通过激发
激光拉曼光谱实验报告 摘要:本实验研究了用半导体激光器泵浦的3Nd + :4YVO 晶体并倍频后得到的532nm 激 光作为激发光源照射液体样品的4CCL 分子而得到的拉曼光谱,谱线很好地吻合了理论分析的4CCL 分子4种振动模式,且频率的实验值与标准值比误差低于2%。又利用偏振片及半波片获得与入射光偏振方向垂直及平行的出射光,确定了各振动的退偏度,分别为、、、,和标准值0和比较偏大。 关键词:拉曼散射、分子振动、退偏 一, 引言 1928年,印度物理学家拉曼()和克利希南()实验发现,当光穿过液体苯时被分子散射的光发生频率变化,这种现象称为拉曼散射。几乎与此同时,苏联物理学家兰斯别而格()和曼杰尔斯达姆()也在晶体石英样品中发现了类似现象。在散射光谱中,频率与入射光频率0υ相同的成分称为瑞利散射,频率对称分布在0υ两侧的谱线或谱带01υυ±即为拉曼光谱,其中频率较小的成分01υυ-又称为斯托克斯线,频率较大的成分01υυ+又称为反斯托克斯线。这种新的散射谱线与散射体中分子的震动和转动,或晶格的振动等有关。 拉曼效应是单色光与分子或晶体物质作用时产生的一种非弹性散射现象。拉曼谱线的数目,位移的大小,谱线的长度直接与试样分子振动或转动能级有关。因此,与红外吸收光谱类似,对拉曼光谱的研究,也可以得到有关分子振动或转动的信息。目前拉曼光谱分析技术已广泛应用于物质的鉴定,分子结构的研究谱线特征。 20世纪60年代激光的问世促进了拉曼光谱学的发展。由于激光极高的单色亮度,它很快被用到拉曼光谱中作为激发光源。而且基于新激光技术在拉曼光谱学中的使用,发展了共振拉曼、受激拉曼散射和番斯托克斯拉曼散射等新的实验技术和手段。 拉曼光谱分析技术是以拉曼效应为基础建立起来的分子结构表征技术,其信号来源于分子的振动和转动。它提供快速、简单、可重复、且更重要的是无损伤的定性定量分析,无需样品准备,样品可直接通过光纤探头或者通过玻璃、石英、和光纤测量。拉曼光谱的分析方向有定性分析、结构分析和定量分析。
1.红外光谱:分别用 PM3 ,HF/6-31G(d),B3LYP/6-31G(d),MP2/6-31G(d) 四种理论方法计算 H 2O 分子的红外光谱,并比较结果的优劣。实验 上测得的水分子的振动频率为:1594cm 1, 3657cm -1, 3756cm 1。 k(Lore ntz) B3LYP/6-31G(d) 由图像可得四种理论方法得到的振动频率分别为 PM3 1698 cm -1、3770 cm -1、3880 cm -1 HF/6-31G(d) 1634 cm -1、3662 cm -1、3770 cm -1 B3LYP/6-31G(d) 1634 cm -1、3566 cm -1、3662 cm -1 MP2/6-31G(d) 1644 cm -1、3544 cm -1、 3684 cm -1 与标准值1594cm -1, 3657cm'1,3756cm'1比较,HF/6-31G(d)最为接近标准值; PM3三个频率都偏大,与标准值符合情况不好; B3LYP/6-31G(d)除1634 cm -1与 分子模拟实验作业 一、实验部分 分子光谱模拟 k(Lore ntz) -DrnelPL (. 4000 3000 2000 -1 /cm 1000 '! 0.00 0.01 0.02 0.03 0.04 0.05 0.06 4000 3000 2000 1000 /cm -1 PM3 HF/6-31G(d) ------ k(Lore ntz) k(Lore ntz) 0.00 0.01 r 0.04 0.05 J _______ ! ______ ______ J ______ ______ !_ 4000 3000 2000 -1 /cm 1000 MP2/6-31G(d) 0.000 0.002 _ 0.004 0.006 0.008 0.010 0.012 - 0.014 0.02 0.03 - e /cm
一、实验目的 1、掌握溴化钾压片法制备固体样品的方法; 2、学习并掌握美国尼高立IR-6700型红外光谱仪的使用方法; 3、初步学会对红外吸收光谱图的解析。 二、实验原理 红外光是一种波长介于可见光区和微波区之间的电磁波谱。波长在~1000μm。通常又把这个波段分成三个区域,即近红外区:波长在~μm(波数在13300~4000cm-1),又称泛频区;中红外区:波长在~50μm(波数在4000~200cm-1),又称振动区;远红外区:波长在50~1000μm(波数在200~10cm-1),又称转动区。其中中红外区是研究、应用最多的区域。 红外区的光谱除用波长λ表征外,更常用波数σ表征。波数是波长的倒数,表示单位厘米波长内所含波的数目。其关系式为: 三、仪器和试剂 1、仪器:美国尼高立IR-6700 2、试剂:溴化钾,聚乙烯,苯甲酸 3、傅立叶红外光谱仪(FTIR)的构造及工作原理 四、实验步骤
1、波数检验:将聚苯乙烯薄膜插入红外光谱仪的样品池处,从4000-650cm-1进行波数扫描,得到吸收光谱。 2、测绘苯甲酸的红外吸收光谱——溴化钾压片法 取1-2mg苯甲酸,加入在红外灯下烘干的100-200mg溴化钾粉末,在玛瑙研钵中充分磨细(颗粒约2μm),使之混合均匀。取出约80mg混合物均匀铺洒在干净的压模内,于压片机上制成直径透明薄片。将此片装于固体样品架上,样品架插入红外光谱仪的样品池处,从4000-400cm-1进行波数扫描,得到吸收光谱。 五、注意事项 1、实验室环境应该保持干燥; 2、确保样品与药品的纯度与干燥度; 3、在制备样品的时候要迅速以防止其吸收过多的水分,影响实验结果; 4、试样放入仪器的时候动作要迅速,避免当中的空气流动,影响实验的准确性。 5、溴化钾压片的过程中,粉末要在研钵中充分磨细,且于压片机上制得的透明薄片厚度要适当。 六、数据处理 该图中在波数700~800、1500~1600、2800~2975左右有峰形,证明了该物质中可能有烯烃的C-H变形振动,C-C间的伸缩振动,同时也拥有烷烃的C-H伸缩振动,推测为聚乙烯的红外谱图。 谱带位置/cm-1吸收基团的振动形式 )n—C— n≥4) (—C—(CH 2