一、极化曲线
1.绘制原理
铁在酸溶液中,将不断被溶解,同时产生H2,即:
Fe + 2H+ = Fe2+ + H2(a)
当电极不与外电路接通时,其净电流I总为零。在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:
(1)
I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
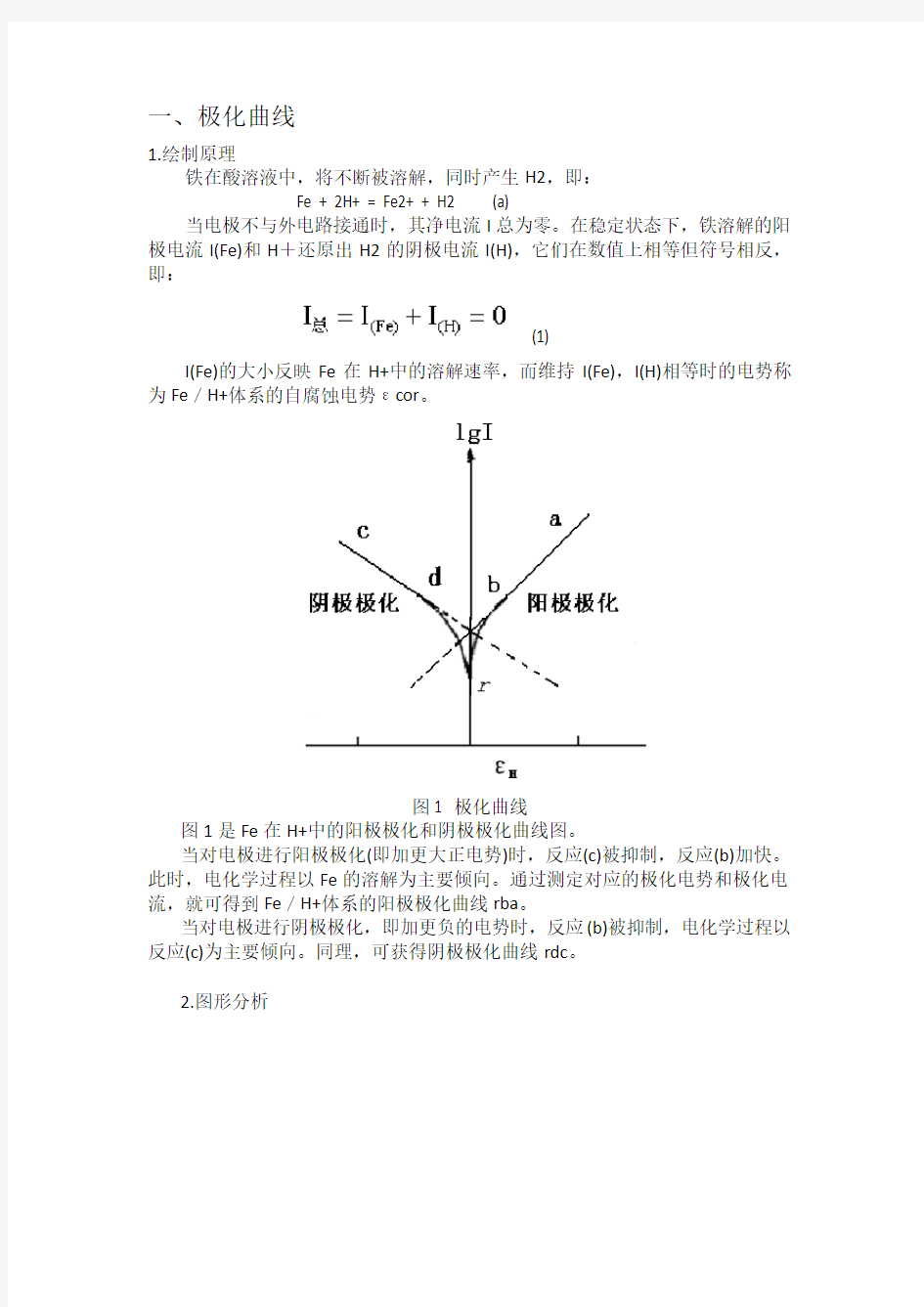
图1 极化曲线
图1是Fe在H+中的阳极极化和阴极极化曲线图。
当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。此时,电化学过程以Fe的溶解为主要倾向。通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。同理,可获得阴极极化曲线rdc。
2.图形分析
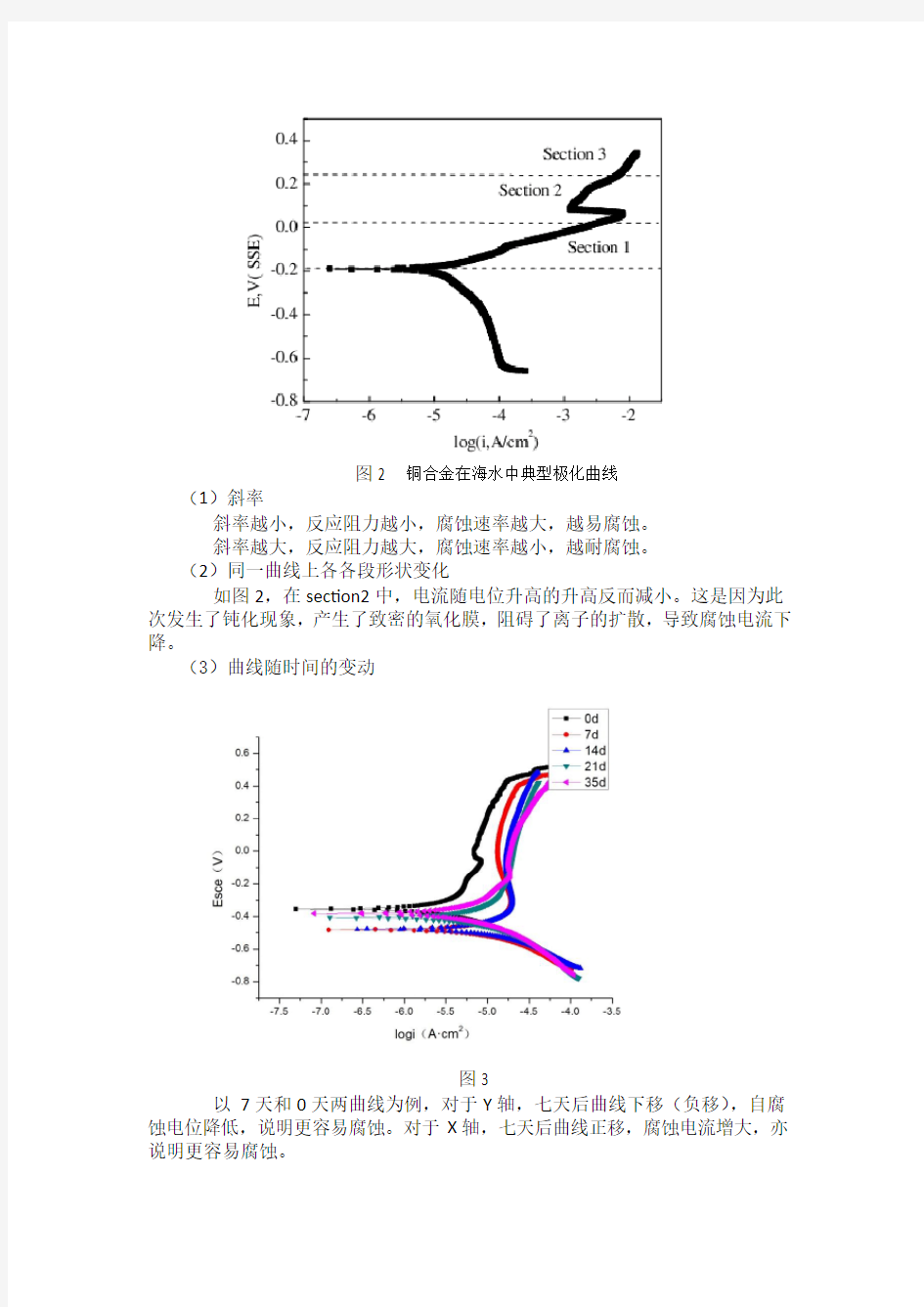
图2 铜合金在海水中典型极化曲线
(1)斜率
斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化
如图2,在section2中,电流随电位升高的升高反而减小。这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动
图3
以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱
1.测量原理
它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。从这些数据中可以计算出电化学响应的实部和虚部。阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
2. Bode图
Bode图是阻抗幅模的对数log| Z |和相角θ对相同时间的横坐标频率的对数logf的图。
图4 Bode图
阻抗:如果X是角频率为ω的正弦波电流信号,则Y即为角频率也是ω的
正弦电势信号。此时Y/X既称为系统的阻抗,用Z表示。
2.双电层电容(Cdl)
3.极化阻抗(Rp)
4.电荷转移电阻(Rct)
5.扩散电阻(Zw)
7.电感(L)
图6 两个时间常数
图7 三个时间常数
3. Nyquist图
电极的交流阻抗由实部z’和虚部z”组成,z=z’+j z”.Nyquist图是以阻抗虚部(-z”)对阻抗实部(z’)作的图。
对纯电阻,在Nyquist图上表现为z’轴上的一点,该点到原点的距离为电阻值的大小;对纯电容体系,表现为与z”轴重合的一条直线。图中的半圆弧就是容抗弧;后面的斜线是W扩散;感抗是低频的时候一个向下的收缩环。
圆弧半径越大,也就是极化电阻越大,耐腐蚀越好。
圆弧半径越小,也就是极化电阻越小,耐腐蚀越差。
一、极化曲线 1.绘制原理 铁在酸溶液中,将不断被溶解,同时产生H2,即: Fe + 2H+ = Fe2+ + H2(a) 当电极不与外电路接通时,其净电流I总为零。在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即: (1) I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。 图1 极化曲线 图1是Fe在H+中的阳极极化和阴极极化曲线图。 当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。此时,电化学过程以Fe的溶解为主要倾向。通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。 当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。同理,可获得阴极极化曲线rdc。 2.图形分析
图2 铜合金在海水中典型极化曲线 (1)斜率 斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。 斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。 (2)同一曲线上各各段形状变化 如图2,在section2中,电流随电位升高的升高反而减小。这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。 (3)曲线随时间的变动 图3 以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱 1.测量原理 它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。从这些数据中可以计算出电化学响应的实部和虚部。阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。 2. Bode图 Bode图是阻抗幅模的对数log| Z |和相角θ对相同时间的横坐标频率的对数logf的图。
应用电化学实验 本课程安排4个综合实验,每个实验4个学时,共16个学时,按照10人一组分别进行。自编实验讲义。实验仪器有:分析天平;直流稳压稳流电源;电化学工作站;恒温水浴;饱和甘汞电极;鲁金毛细管;H 型电解槽;Pt 电极;电解槽;赫尔槽;电力搅拌器、磁力搅拌器;pH 计。 实验1:极化曲线的测定 实验内容:测定Ni 2+离子、Co 2+离子单金属电沉积、以及Ni-Co 合金共电沉积的稳态阴极极化曲线。 一、 实验目的 1.掌握三电极体系装置和电化学工作站的应用。 2.掌握用线性电位扫描法测量极化曲线的原理和实验方法,学会从极化曲线上分析电极过程特征。 2.测定金属电沉积的阴极极化曲线。 3.学会数据的分析和处理。 二、 实验原理 研究电极过程的基本方法是测定极化曲线。电极上电势随电流密度变化的关系曲线称为极化曲线。极化曲线表示了电极电位与电流密度之间的关系,从极化曲线上可以求得任一电流密度下的过电势(超电势),看出不同电流密度时电势变化的趋势,直观地反映了电极反应速度与电极电势的关系。在某一电流密度下极化曲线的斜率i ???称为极化度(极化率),极化度的大小可以衡量极化的程度,判断电极过程的难易。极化度小,电极过程容易进行;极化度大,电极过程受到较大阻碍而难以进行。从极化曲线还可求电极过程动力学参数,如交换电流密度i 0、电子传递系数α、标准速度常数、以及扩散系数;还可以测定反应级数、电化学反应活化能等。 被控制的变量电极电位是随时间连续线性变化的。随时间连续线性变化的电位可用线性方程表示: Vt i +=??; 其中:?——扫描电位,t ——扫描时间,V ——扫描速度,i ?——扫描起点电位。
电化学阻抗谱的应用及其解析方法 交流阻抗法是电化学测试技术中一类十分重要的方法,是研究电极过程动力学和表面现象的重要手段。特别是近年来,由于频率响应分析仪的快速发展,交流阻抗的测试精度越来越高,超低频信号阻抗谱也具有良好的重现性,再加上计算机技术的进步,对阻抗谱解析的自动化程度越来越高,这就使我们能更好的理解电极表面双电层结构,活化钝化膜转换,孔蚀的诱发、发展、终止以及活性物质的吸脱附过程。 阻抗谱中的基本元件 交流阻抗谱的解析一般是通过等效电路来进行的,其中基本的元件包括:纯电阻R ,纯电容C ,阻抗值为1/j ωC ,纯电感L ,其阻抗值为j ωL 。实际测量中,将某一频率为ω的微扰正弦波信号施加到电解池,这是可把双电层看成一个电容,把电极本身、溶液及电极反应所引起的阻力均视为电阻,则等效电路如图1所示。 图1. 用大面积惰性电极为辅助电极时电解池的等效电路 图中A 、B 分别表示电解池的研究电极和辅助电极两端,Ra 、Rb 分别表示电极材料本身的电阻,Cab 表示研究电极与辅助电极之间的电容,Cd 与Cd ’表示研究电极和辅助电极的双电层电容,Zf 与Zf ’表示研究电极与辅助电极的交流阻抗。通常称为电解阻抗或法拉第阻抗,其数值决定于电极动力学参数及测量信号的频率,Rl 表示辅助电极与工作电极之间的溶液 电阻。一般将双电层电容Cd 与法拉第阻抗的并联称为界面阻抗Z 。 实际测量中,电极本身的内阻很小,且辅助电极与工作电极之间的距离较大,故电容Cab 一般远远小于双电层电容Cd 。如果辅助电极上不发生电化学反映,即Zf ’特别大,又使辅助 电极的面积远大于研究电极的面积(例如用大的铂黑电极),则Cd ’很大,其容抗Xcd ’比串 联电路中的其他元件小得多,因此辅助电极的界面阻抗可忽略,于是图1可简化成图2,这也是比较常见的等效电路。 图2. 用大面积惰性电极为辅助电极时电解池的简化电路 Element Freedom Value Error Error %Rs Free(+)2000N/A N/A Cab Free(+)1E-7N/A N/A Cd Fixed(X)0N/A N/A Zf Fixed(X)0N/A N/A Rt Fixed(X)0N/A N/A Cd'Fixed(X)0N/A N/A Zf'Fixed(X)0N/A N/A Rb Free(+)10000N/A N/A Data File: Circuit Model File:C:\Sai_Demo\ZModels\12861 Dummy Cell.mdl Mode: Run Fitting / All Data Points (1 - 1) Element Freedom Value Error Error %Rs Fixed(X )1500N/A N/A Zf Fixed(X )5000N/A N/A Cd Fixed(X ) 1E-6 N/A N/A Data File: Circuit Model File:C:\Sai_Demo\ZModels\Tutor3 R-C.mdl Mode: Run Simulation / Freq. Range (0.01 - 10000Maximum Iterations: 100 B
极化曲线在电化学腐蚀中的应用 娄浩 (班级:材料化学13-1 学号:120133202059) 关键词:电化学腐蚀;极化;极化曲线;极化腐蚀图 据工业发达国家统计,每年由于腐蚀造成的损失约占国民生产总值的l~4%,世界钢铁年产量约有十分之一因腐蚀而报废,因此研究金属腐蚀对于国民经济发展和能源的合理利用具有重大意义。其中电化学腐蚀是金属腐蚀的一种最普遍的形式。论文分析了电化学腐蚀的机理以及极化曲线的理论基础。利用测量极化曲线的方法,研究金属腐蚀过程,已经得到广泛的应用。 1.金属腐蚀的电化学原理 金属腐蚀学是研究金属材料在其周围环境作用下发生破坏以及如何减缓或防止这种破坏的一门科学[1]。通常把金属腐蚀定义为:金属与周围环境(介质)之间发生化学或电化学而引起的破坏或变质。所以,可将腐蚀分为化学腐蚀和电化学腐蚀[2]。 化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。其反应的特点是金属表面的原子与非电解质中的氧化剂直接发生氧化还原反应,形成腐蚀产物[3]。腐蚀过程中电子的传递是在金属与氧化剂之间直接进行的,因而没有电流产生。 电化学腐蚀是指金属表面与电子导电的介质(电解质)发生电化学反应而引起的破坏。任何以电化学机理进行的腐蚀反应至少包含有一个阳极反应和一个阴极反应,并以流过金属内部的电子流和介质中的离子流形成回路[4]。阳极反应是氧化过程,即金属离子从金属转移到介质中并放出电子;阴极反应为还原过程,即介质中的氧化剂组分吸收来自阳极的电子的过程。例如,碳钢[5]在酸中腐蚀,在阳极区Fe被氧化成Fe2+所放出的电子自阳极Fe流至钢表面的阴极区(如Fe3C)上,与H+作用而还原成氢气,即 阳极反应:Fe - 2e →Fe2+ 阴极反应:2H+ + 2e →H2 总反应:Fe + 2H+ →Fe2+ + H2 与化学腐蚀不同,电化学腐蚀的特点在于,它的腐蚀历程可分为两个相对独立并可
锂离子电池的电化学阻抗谱分析 1. 锂离子电池的特点 锂离子电池充电时,正极中的锂离子从基体脱出,嵌入负极;而放电时,锂离子会从负极中脱出,嵌入正极。因此锂离子电池正负极材料的充放电容量、循环稳定性能和充放电倍率等重要特性均与锂离子在嵌合物电极材料中的脱出和嵌入过程密切相关。这些过程可以很好地从电化学阻抗谱(EIS )的测量与解析中体现出来。 2. 电化学阻抗谱的解析 2.1. 高频谱解析 嵌合物电极的EIS 谱的高频区域是与锂离子通过活性材料颗粒表面SEI 膜的扩散迁移相关的半圆(高频区域半圆),可用一个并联电路R SEI /C SEI 表示。 R SEI 和C SEI 是表征锂离子活性材料颗粒表面SEI 膜扩散迁移过程的基本参数,如何理解R SEI 和C SEI 与SEI 膜的厚度、时间、温度的关系,是应用EIS 研究锂离子通过活性材料颗粒表面SEI 膜扩散过程的基础。 2.1.1. 高频谱解析R SEI 和C SEI 与SEI 膜厚度的关系 SEI 膜的电阻R SEI 和电容C SEI 与SEI 膜的电导率、介电常数ε的关系可用简单的金属导线的电阻公式和平行板电容器的电容公式表达出来 S l R SEI ρ = (1) l S C SEI ε= (2) 以上两式中S 为电极的表面积,l 为SEI 膜的厚度。倘若锂离子在嵌合物电极的嵌入和脱出过程中ρ、ε和S 变化较小,那么R SEI 的增大和C SEI 的减小就意味着SEI 厚度的增加。由此根据R SEI 和C SEI 的变化,可以预测SEI 膜的形成和增长情 2.1.2. SEI 膜的生长规律(R SEI 与时间的关系) 嵌合物电极的SEI 膜的生长规律源于对金属锂表面SEI 膜的生长规律的分析
电化学阻抗谱解析与应用 交流阻抗发式电化学测试技术中一类十分重要的方法,是研究电极过程动力学和表面现象的重要手段。特别是近年来,由于频率响应分析仪的快速发展,交流阻抗的测试精度越来越高,超低频信号阻抗谱也具有良好的重现性,再加上计算机技术的进步,对阻抗谱解析的自动化程度越来越高,这就使我们能更好的理解电极表面双电层结构,活化钝化膜转换,孔蚀的诱发、发展、终止以及活性物质的吸脱附过程。 1. 阻抗谱中的基本元件 交流阻抗谱的解析一般是通过等效电路来进行的,其中基本的元件包括:纯电阻R ,纯电容C ,阻抗值为1/j ωC ,纯电感L ,其阻抗值为j ωL 。实际测量中,将某一频率为ω的微扰正弦波信号施加到电解池,这是可把双电层看成一个电容,把电极本身、溶液及电极反应所引起的阻力均视为电阻,则等效电路如图1所示。 Element Freedom Value Error Error %Rs Free(+)2000N/A N/A Cab Free(+)1E-7N/A N/A Cd Fixed(X)0N/A N/A Zf Fixed(X)0N/A N/A Rt Fixed(X)0N/A N/A Cd'Fixed(X)0N/A N/A Zf'Fixed(X)0N/A N/A Rb Free(+)10000N/A N/A Data File:Circuit Model File:C:\Sai_Demo\ZModels\12861 Dummy Cell.mdl Mode: Run Fitting / All Data Points (1 - 1) Maximum Iterations:100Optimization Iterations:0Type of Fitting: Complex Type of Weighting: Data-Modulus 图1. 用大面积惰性电极为辅助电极时电解池的等效电路 图中A 、B 分别表示电解池的研究电极和辅助电极两端,Ra 、Rb 分别表示电极材料本身的电阻,Cab 表示研究电极与辅助电极之间的电容,Cd 与Cd ’表示研究电极和辅助电极的双电层电容,Zf 与Zf ’表示研究电极与辅助电极的交流阻抗。通常称为电解阻抗或法拉第阻抗,其数值决定于电极动力学参数 及测量信号的频率,Rl 表示辅助电极与工作电极之间的溶液电阻。一般将双电层电容Cd 与法拉第阻抗的并联称为界面阻抗Z 。 实际测量中,电极本身的内阻很小,且辅助电极与工作电极之间的距离较大,故电容Cab 一般远远小于双电层电容Cd 。如果辅助电极上不发生电化学反映,即Zf ’特别大,又使辅助电极的面积远大于研究电极的面积(例如用大的铂黑电极),则Cd ’很大,其容抗Xcd ’比串联电路中的其他元件小得多,因此 辅助电极的界面阻抗可忽略,于是图1可简化成图2,这也是比较常见的等效电路。 图2. 用大面积惰性电极为辅助电极时电解池的简化电路 2. 阻抗谱中的特殊元件 以上所讲的等效电路仅仅为基本电路,实际上,由于电极表面的弥散效应的存在,所测得的双电层 电容不是一个常数,而是随交流信号的频率和幅值而发生改变的,一般来讲,弥散效应主要与电极表面电流分布有关,在腐蚀电位附近,电极表面上阴、阳极电流并存,当介质中存在缓蚀剂时,电极表面就会为缓蚀剂层所覆盖,此时,铁离子只能在局部区域穿透缓蚀剂层形成阳极电流,这样就导致电流分布 极度不均匀,弥散效应系数较低。表现为容抗弧变“瘪”,如图3所示。另外电极表面的粗糙度也能影响弥散效应系数变化,一般电极表面越粗糙,弥散效应系数越低。 2.1 常相位角元件(Constant Phase Angle Element ,CPE ) 在表征弥散效应时,近来提出了一种新的电化学元件CPE,CPE 的等效电路解析式为: p j T Z )(1ω?=,CPE 的阻抗由两个参数来定义,即CPE-T ,CPE-P ,我们知道, )2sin()2cos(ππp j p j p +=,因此CPE 元件的阻抗Z 可以表示为
电化学阻抗谱的应用分析 交流阻抗法是电化学测试技术中一类十分重要的方法,是研究电极过程动力学和表面现象的 重要手段。特别是近年来,由于频率响应分析仪的快速发展,交流阻抗的测试精度越来越高, 超低频信号阻抗谱也具有良好的重现性,再加上计算机技术的进步,对阻抗谱解析的自动化 程度越来越高,这就使我们能更好的理解电极表面双电层结构,活化钝化膜转换,孔蚀的诱 发、发展、终止以及活性物质的吸脱附过程。 阻抗谱中的基本元件 交流阻抗谱的解析一般是通过等效电路来进行的,其中基本的元件包括:纯电阻R,纯电容C,阻抗值为1/j 3 C,纯电感L,其阻抗值为j 3 L。实际测量中,将某一频率为3的微扰正弦波信号施加到电解池,这是可把双电层看成一个电容,把电极本身、溶液及电极反应所引 起的阻力均视为电阻,则等效电路如图1所示。 Element Freedom Value Error Error % 图中A、B分剁谡示电解池唯e(尊极和辅1200极两端,N/A Ra、Rb分N/表示电极材料本身的电阻,Cab表郴跳电极与辅助豳极立间的电容--7 Cd与N Cd'表示研究翩A和辅助电极的双电 层电容,Zf与C Zf '表示研究电核肉XI助电极的交流阻抗。顺称为电解阻NA法拉第阻抗,其数值决定于电皱动力学参数族苗密令号的频% Rl源A辅助电极与WA作电极之间的溶液Rt Fixed(X) 0 N/A N/A 电阻。一般将双Cd层电容C 电化学曲线极化曲线阻抗谱分析 一、极化曲线 1.绘制原理 铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a) 当电极不与外电路接通时,其净电流I总为零。在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1) I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。 图1是Fe在H+中的阳极极化和阴极极化曲线图。图2 铜合金在海水中典型极化曲线 当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。此时,电化学过程以Fe的溶解为主要倾向。通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。 当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。同理,可获得阴极极化曲线rdc。 2.图形分析 (1)斜率 斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。 (2)同一曲线上各各段形状变化 如图2,在section2中,电流随电位升高的升高反而减小。这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。 (3)曲线随时间的变动 以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。 二、阻抗谱 1.测量原理 它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。从这些数据中可以计算出电化学响应的实部和虚部。阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。 电化学阻抗谱的应用分析 交流阻抗法是电化学测试技术中一类十分重要的方法,是研究电极过程动力学和表面现象的重要手段。特别是近年来,由于频率响应分析仪的快速发展,交流阻抗的测试精度越来越高,超低频信号阻抗谱也具有良好的重现性,再加上计算机技术的进步,对阻抗谱解析的自动化程度越来越高,这就使我们能更好的理解电极表面双电层结构,活化钝化膜转换,孔蚀的诱发、发展、终止以及活性物质的吸脱附过程。 阻抗谱中的基本元件 交流阻抗谱的解析一般是通过等效电路来进行的,其中基本的元件包括:纯电阻R ,纯电容C ,阻抗值为1/j ωC ,纯电感L ,其阻抗值为j ωL 。实际测量中,将某一频率为ω的微扰正弦波信号施加到电解池,这是可把双电层看成一个电容,把电极本身、溶液及电极反应所引起的阻力均视为电阻,则等效电路如图1所示。 图1. 用大面积惰性电极为辅助电极时电解池的等效电路 图中A 、B 分别表示电解池的研究电极和辅助电极两端,Ra 、Rb 分别表示电极材料本身的电阻,Cab 表示研究电极与辅助电极之间的电容,Cd 与Cd ’表示研究电极和辅助电极的双电层电容,Zf 与Zf ’表示研究电极与辅助电极的交流阻抗。通常称为电解阻抗或法拉第阻抗,其数值决定于电极动力学参数及测量信号的频率,Rl 表示辅助电极与工作电极之间的溶液 电阻。一般将双电层电容Cd 与法拉第阻抗的并联称为界面阻抗Z 。 实际测量中,电极本身的内阻很小,且辅助电极与工作电极之间的距离较大,故电容Cab 一般远远小于双电层电容Cd 。如果辅助电极上不发生电化学反映,即Zf ’特别大,又使辅助 电极的面积远大于研究电极的面积(例如用大的铂黑电极),则Cd ’很大,其容抗Xcd ’比串 联电路中的其他元件小得多,因此辅助电极的界面阻抗可忽略,于是图1可简化成图2,这也是比较常见的等效电路。 图2. 用大面积惰性电极为辅助电极时电解池的简化电路 Element Freedom Value Error Error %Rs Free(+)2000N/A N/A Cab Free(+)1E-7N/A N/A Cd Fixed(X)0N/A N/A Zf Fixed(X)0N/A N/A Rt Fixed(X)0N/A N/A Cd'Fixed(X)0N/A N/A Zf'Fixed(X)0N/A N/A Rb Free(+)10000N/A N/A Data File: Circuit Model File:C:\Sai_Demo\ZModels\12861 Dummy Cell.mdl Mode: Run Fitting / All Data Points (1 - 1) Element Freedom Value Error Error %Rs Fixed(X )1500N/A N/A Zf Fixed(X )5000N/A N/A Cd Fixed(X ) 1E-6 N/A N/A Data File: Circuit Model File:C:\Sai_Demo\ZModels\Tutor3 R-C.mdl Mode: Run Simulation / Freq. Range (0.01 - 10000Maximum Iterations: 100 B 电化学极化和浓差极化的动力学研究 摘要:电极过程的进行速度在金属保护、腐蚀分析等电化学实践领域有重要应用,加深对它的理解很有必要。电极反应速度由控制步骤,即速度最慢的单元步骤决定。本文讨论了电化学反应和液相传质这两个单元步骤的动力学规律,以及当整个电极反应由电化学极化控制、浓差极化或者是两类极化共存时的极化规律。 关键词:控制步骤;电化学极化;浓差极化;过电位;极化电流 引言 电极过程是由一系列性质不同的单元步骤串联组成的复杂过程,一般有液相传质、前置转化、电化学反应、随后转化和反应后的液相传质五个步骤。每一步骤都有不同的特性,步骤的反应速度取决于其活化能,当某一步骤的速度远远小于其他步骤,则整个电极反应速度等于这个最慢步骤,一般称之为控制步骤。文献指出,只要整个反应中有一个步骤的活化能比其余高出8~10KJ/mol以上,则能成为控制步骤;而当两个单元步骤的活化能相差不到4KJ/mol时,它们的反应速度相差不到5倍,则可能同时成为控制步骤,称为混合控制。混合控制的规律比较复杂,但仍会有一个控制步骤起较主要的作用。因此研究控制步骤的规律对于了解整个电极反应的速度规律,以及控制电极反应的速度和反应进行的方向均有重要意义。本文中主要讨论的是电化学反应步骤和液相传质步骤的动力学规律,并讨论当其成为控制步骤时的极化规律。 电化学反应步骤指反应物质在电极/溶液界面得失电子,从而发生还原或氧化反应的过程。这一单元步骤包括了化学反应和电荷传递两步,是整个电极过程的核心步骤。当电化学反应步骤成为电极过程的控制步骤时,电极反应的速度就取决于电化学反应步骤。电极过程最重要特征之一就是由于电子参与反应,电极电位的改变将对反应速度将从热力学和动力学两个方面产生影响,因此讨论电化学反应步骤时先从电极电位的影响谈起。 由于液相中的反应粒子需要通过传质过程输送至电极表面,反应产物也需要 第3章 电化学极化 (电荷转移步骤动力学) 绪论中曾提到:一个电极反应是由若干个基本步骤形成的,一个反应至少有三个基本步骤:0 0R R ze O O s s →→+→- 1) 反应粒子自溶液深处向电极表面的扩散——液相传质步骤。 2) 反应粒子在界面得失电子的过程——电化学步骤。 3) 产物生成新相,或向溶液深处扩散。 当有外电流通过电极时,?将偏离平衡值,我们就说此时发生了极化。如果传质过 程是最慢步骤,则?的偏离是由浓度极化引起的(此时0 i s i C C ≠,e ?的计算严格说是用s i C 。无浓度极化时0 i s i C C =,?的改变是由s i C 的变化引起) 。这时电化学步骤是快步骤,平衡状态基本没有破坏。因此反映这一步骤平衡特征的Nernst 方程仍能使用,但须用?代 e ?,s i C 代0i C ,这属于下一章的研究内容。如果传质等步骤是快步骤,而电化学步骤成 为控制步骤,则这时?偏离e ?是由电化学极化引起的,也就是本章研究的内容。 实际上该过程常常是比较慢的,反应中电荷在界面有积累(数量渐增),?随之变化。 由此引起的?偏离就是电化学极化,这时Nernst 方程显然不适用了,这时?的改变将直接以所谓“动力学方式”来影响反应速度。 3.1 电极电位与电化学反应速度的关系 电化学反应是一种特殊的氧化—还原反应(一个电极上既有氧化过程,又有还原过程)。若一个电极上有净的氧化反应发生,而另一个电极上有净的还原反应发生,则在这两个电极所构成的电化学装置中将有电流通过,而这个电流刚好表征了反应速度的大小, )(nFv i v i =∝[故电化学中总是用i 表示v ,又i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也用i 表示v 。i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为 mol/(cm 2.s )]。既然电极上有净的反应发生(反应不可逆了),说明电极发生了极化,?偏离了平衡值,偏离的程度用η表示,极化的大小与反应速度的大小有关,这里就来研究i ~?二者间的关系。 一个反应进行速度的大小,从本质上说,取决于反应粒子变成产物粒子所需越过的活化能垒的高度:能垒低,反应易进行,速度就快,反之则慢。 而电极电位对反应速度的影响就是通过影响反应活化能来实现的,即i ~G ~??,而i ~G ~??三者关系如何? 3.1.1 电极电位与反应活化能 1.电化学步骤的反应活化能 以Ag e Ag =+- + 的反应为例进行说明。如图3-1。 §4 电化学步骤动力学与电化学极化§4.1 电极电势对电极反应速度的影响 §4.1 电极电势对电极反应速度的影响…电极反应的特点 ——反应速度与电极电势有关。 §4.2 电化学步骤的基本动力学参数…电极电势可通过两种不同方式来影响电极反应速度。 (1)热力学方式 §4.3 电极反应平衡与电化学极化 §4.4 浓差极化对电化学极化的影响 §4.5 界面电势分布对电化学极化的影响 …当电化学步骤的平衡状态基本上未被破坏时,可通过改变电势来改变c i s ,从而间接地影响反应粒子i 的扩散 (RDS)速度。 …此时,无需知道电化学步骤的速度及其动力学参数,只要确知其近似地处于平衡状态,则仍可用Nernst公式来 计算c。 s i §4.1.1 电极电势对电化学反应活化能的影响 (2)动力学方式 …电化学步骤活化能较高 →电化学步骤成为RDS或RDS之一 例1:Ag/AgNO3电极体系 →电化学极化(活化极化)Ag +(溶液) +e Ag+i e(金属晶格) …此时,改变电势可直接改变电化学步骤和整个电极反 例2:Pt/Fe3+, Fe2+电极体系应的速度。 …本节主要讨论电化学极化,为了使问题简化,在下面的讨论中假设浓度极化可忽略,电化学步骤是唯一的Fe ++e (Pt) Fe +i e (Fe +外层电子轨道) 3 3 3 RDS。 Ag+?e (晶格) 氧化 还原 Ag+ (溶液) Ag+?e (晶格) 氧化 还原 Ag+ (溶液) 曲线1b:Ag+ 自溶液中逸出 时的势能曲线 曲线1:电势 为?时Ag+的 势能曲线 曲线4:电势 改变Δ?引起 的Ag+势能变 化曲线 曲线1a:Ag+ 自晶格逸出时 的势能曲线 曲线3:电势 改变Δ?后,紧 密层中的电势 变化曲线 ′=?(1?α) Δ? W W F 曲线2 =曲线1+曲线4 1 1 电势改变Δ?后Ag+势能曲线=W?βFΔ? 1 W′+FΔ?= 1 αFΔ? W+αFΔ? 1 FΔ?W2′=W2 +αFΔ? α+β=1 1 1.从图中可以看出,1的腐蚀电位比较正,且腐蚀电流较小,说明1号的耐蚀性能较好。 2号曲线上半支出现这种现象一般是由于钝化造成的 2.似乎你的极化曲线测试的有点问题,好像不大对!钝化区非常短,感觉可以多测试几次取个最好的值! 3.2虽然钝化了,但是钝化区间非常短。 我感觉你这两个图测试的也有问题,看看能不能重复测试一下,看重复性如何 4.极化曲线的腐蚀电位真的说明不了什么问题么,只看腐蚀电流?这个说法正确。但是要是一系列的实验中,腐蚀电位移动规律一样,倒是可以说明问题的极化曲线中腐蚀电位的问题确实很麻烦,对很多体系而言,腐蚀电位变化较大,倒是腐蚀电流还可以说明问题的。 5.我们对腐蚀电极系统做极化曲线,其目的无非是想从极化曲线中获得我们所需要的数据,极化曲线又可以分为线性极化区,弱极化区,强极化区,可以从中解析出我们所需要的动力学参数,依据动力学参数则可以定量的评价腐蚀体系的性能。个人认为用极化曲线来评价腐蚀体系还是一种很成熟的方法,在评价腐蚀体系时一般还用到了交流阻抗方法,虽然用交流阻抗方法可以获得更多的动力学参数,以更有力的数据来说明腐蚀体系,但交流阻抗方法还是存在很多问题的,也存在很多争议! 6.其实腐蚀电位的大小可以说明:腐蚀进难易程度;腐蚀电流的大小说明腐蚀的程度及腐蚀过程进行的快慢! 7.具体而言:实际试验中极化曲线分为四个区,活性溶解区、过渡钝化区、稳定钝化区、过钝化区。极化曲线可用实验方法测得。分析研究极化曲线,是解释金属腐蚀的基本规律、揭示金属腐蚀机理和探讨控制腐蚀途径的基本方法之一。 8.你们讨论的大多是金属电极,那么在金属氧化物电极中的腐蚀过程是指什么呢??是金属氧化物本身的溶解过程,还是金属氧化物的电还原产物(金属)的腐蚀过程呢??如氧化锌电极在氢氧化钾溶液中。请赐教!! 9.极化:由于电流通过电极而导致电极电势偏离平衡值的现象称为电极的极化。 极化曲线:描述电流密度与电极电势之间关系的曲线称作极化曲线 电化学曲线极化曲线阻抗谱分析 1 / 4 电化学曲线极化曲线阻抗谱分析 一、极化曲线 1.绘制原理 铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a) 当电极不与外电路接通时,其净电流I 总为零。在稳定状态下,铁溶解的阳极电流I(Fe)和H +还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即: (1) I(Fe)的大小反映Fe 在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe /H+体系的自腐蚀电势εcor 。 图1是Fe 在H+中的阳极极化和阴极极化曲线图。 图2 铜合金在海水中典型极化曲线 当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。此时,电化学过程以Fe 的溶解为主要倾向。通过测定对应的极化电势和极化电流,就可得到Fe /H+体系的阳极极化曲线rba 。 当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。同理,可获得阴极极化曲线rdc 。 2.图形分析 (1)斜率 斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。 斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。 (2)同一曲线上各各段形状变化 如图2,在section2中,电流随电位升高的升高反而减小。这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。 (3)曲线随时间的变动 以 7天和0天两曲线为例,对于Y 轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。对于X 轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。 二、阻抗谱 1.测量原理 它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。从这些数据中可以计算出电化学响应的实部和虚部。阻抗中涉及的参数有阻抗 Cview 2 软件操作步骤 1.打开软件 2 打开数据 点击这个按钮后,会弹出这个对话框。按步骤1,2,3,4做好. 做好第4步后,要得到这个结果. 模板文件要在“files to plot”框中显示;然后再点击OK. 3 数据处理(选取数据点操作) 这个是根据实验数据画的图。但是没有被激活。需要按下面步骤: 1 要选到你要处理的数据名称;然后数据就被激活,你可以看到各个数据点,注意你和不同的实验数据,一点要把这个选项选在相对应的数据文件.其中2和3处是两个可以动的小方框,非常重要,它是用来选取数据点的,对数据分析有 用。你只要双击这两个点中的一个,就可以激活相应的点,然后滚动鼠标中键,就可以选取任何一个实验数据点了。 4 数据处理(阳极拟合,阴极拟合) 点击Tools按钮,选择 Data Fitting 选项 得到这个界面 1处表示做Tafel拟合,2,3分别表示阳极拟合和阴极拟合,你可以先做阳极拟合,再做阴极拟合。下面是做阳极拟合:应该选择这一点 2 回到数据图片界面上,这个时候可以双击绿色小方块,滚动中键进行数据选择。不同的人选择的数据不一样,拟合结果不同,你选择你认为对的就可以了。 下面这个是我选择的阳极端的数据点,选好了之后点击Fit按钮,进行拟合。 3 阳极端拟合结果:可得到一条你拟合的曲线,以及在results里面会显示相关的电化学拟合数据。这和结果还不是最后结果,因为还没有做阴极端拟合。 4 阴极端拟合: 在上一个图片上双击小绿方块,可以生成新的小方块,然后把方块滚动到阴极端去,如下图所示。 第四节 极化与去极化 以上己节讨论了金属电化学腐蚀的热力学倾向,并未涉及腐蚀速度和影响腐蚀速度的因素等人们最为关心的问题。电化学过程中的极化和去极化是影响腐蚀速度的最重要因素,认清极化和去极化规律对研究金属的腐蚀与保护有重要的意义。 一、极化作用 我们已经知道,电化学腐蚀是由于腐蚀电池的作用而引起的,腐蚀电池产生的腐蚀电流的大小可以用来表示电化学腐蚀的速度。根据欧姆定律,腐蚀电流 c a V V I R -= (2-7) 式中 I ——腐蚀电流强度(A ); c V ——阴极电极电位(V ); a V ——阳极电极电位(V ); R ——腐蚀体系总电阻(包括R R 外内+)(Ω)。 按理将此带入式(2-5)或(2-6)就可算出理论腐蚀速度,然而通过试验测定的腐蚀速度与计算值相差甚远,计算值可以达到实测值的几十倍甚至上百倍。进一步的研究发现,造成这一差别的结果是腐蚀电池的阴、阳极电位的电流通过时发生了明显的变化,阴极电位变负而阳极电位变正,使得阴、阳极间的电位差(c a V V -)急剧缩小。如果把无电流通过时的电极电位叫做电极的起始电位,以平衡电位的符号e V 表示,那么腐蚀电池的起始电位差远大于其变化以后的电位差(ec ea c a V V V V ->>-),如图2-10所示,正因如此,计算所得腐蚀速度远大于实测的腐蚀速度。 极化就是指由于电极上通过电流而使电极电位发生变化的现象。阳极通过电流电位向正的方向变化叫阳极极化。阴极通过电流电位向负的方向变化叫阴极变化。无论阳极极化或阴极极化都能使腐蚀原电池的极间电位差减小,导致腐蚀电流减小,阻碍腐蚀过程顺利进行。 极化又称极化作用、极化现象。 二、极化曲线 试验证明,极化与电流密度关系密切,电流密度越大,电位变化幅度也越大。所谓极化曲线就是表示同一电极上电极电位与电流密度之间变化关系的曲线。利用图2-11的装置,就可以测定腐蚀电池的阴、阳极极化曲线。 电化学原理之浓差极化和电化学极化 ————————————————————————————————作者:————————————————————————————————日期: 电化学极化和浓差极化的动力学研究 摘要:电极过程的进行速度在金属保护、腐蚀分析等电化学实践领域有重要应用,加深对它的理解很有必要。电极反应速度由控制步骤,即速度最慢的单元步骤决定。本文讨论了电化学反应和液相传质这两个单元步骤的动力学规律,以及当整个电极反应由电化学极化控制、浓差极化或者是两类极化共存时的极化规律。 关键词:控制步骤;电化学极化;浓差极化;过电位;极化电流 引言 电极过程是由一系列性质不同的单元步骤串联组成的复杂过程,一般有液相传质、前置转化、电化学反应、随后转化和反应后的液相传质五个步骤。每一步骤都有不同的特性,步骤的反应速度取决于其活化能,当某一步骤的速度远远小于其他步骤,则整个电极反应速度等于这个最慢步骤,一般称之为控制步骤。文献指出,只要整个反应中有一个步骤的活化能比其余高出8~10KJ/mol以上,则能成为控制步骤;而当两个单元步骤的活化能相差不到4KJ/mol时,它们的反应速度相差不到5倍,则可能同时成为控制步骤,称为混合控制。混合控制的规律比较复杂,但仍会有一个控制步骤起较主要的作用。因此研究控制步骤的规律对于了解整个电极反应的速度规律,以及控制电极反应的速度和反应进行的方向均有重要意义。本文中主要讨论的是电化学反应步骤和液相传质步骤的动力学规律,并讨论当其成为控制步骤时的极化规律。 电化学反应步骤指反应物质在电极/溶液界面得失电子,从而发生还原或氧化反应的过程。这一单元步骤包括了化学反应和电荷传递两步,是整个电极过程的核心步骤。当电化学反应步骤成为电极过程的控制步骤时,电极反应的速度就取决于电化学反应步骤。电极过程最重要特征之一就是由于电子参与反应,电极电位的改变将对反应速度将从热力学和动力学两个方面产生影响,因此讨论电化学反应步骤时先从电极电位的影响谈起。 由于液相中的反应粒子需要通过传质过程输送至电极表面,反应产物也需要 不同材料电化学极化曲线的测量 一、实验目的 1 了解不同金属材料腐蚀电化学极化曲线的测试方法。 2 通过不同极化曲线规律的分析,了解材料电化学腐蚀机理 3 掌握电化学试样制备、三电极电化学测试系统的原理。 二、实验原理 金属发生电化学腐蚀的内在机理与材料本质及环境介质直接相关,不同金属材料的电化学腐蚀行为差异主要体现在两个方面:材料的标准电极电位和电极的极化,前者由材料在特定环境介质中耐蚀性能本质所决定,而后者则取决于金属/介质的界面特性以及扩散过程。动电位极化曲线的测量能够评价出金属/介质的平衡电位以及相应的极化规律,从而有助于评价金属的腐蚀行为,并研究其相应的腐蚀机理,通过在线性极化区和强极化(TAFEL)区内对平衡电位、极化曲线及各区段斜率的测量,分析不同材料发生电化学腐蚀的行为差异及机理。 三、实验设备 1 电化学恒电位仪 2 制样机 3 辅助电极、参比电极、盐桥 4 金相显微镜 四、实验内容 1碳钢的极化曲线测定 2不锈钢的极化曲线测定 3 纯镍的极化曲线测定 4纯铜的极化曲线测定 五、实验步骤 1 仪器设备、样品及腐蚀溶液的准备 1 设备:CP-5恒电位仪,电解池,硫酸亚汞电极(参比电极)、碳钢电极(研究电极)、Pt片电极(辅助电极) 2 溶液:3.5%NaCl 水溶液、0.1mol?L-1、1mol?L-1H2SO4溶液;1mol?L-1HCl溶液;乌洛托品(缓蚀剂)。注:实验可选做其中一两种,溶液样品不需全部准备配制。 3 样品(研究电极)准备:依次用粗砂纸、4#、6#金相砂纸将研究电极表面打磨平整光亮,用蒸馏水清洗后滤纸吸干。 2 设备连接及数据测定 1测量极化曲线:连接好测量装置,测定开路电位,测电极极化曲线(具体连接方法详见电位仪使用说明书)。 电极连接示意图 2 按步骤分别测定研究电极在3.5%NaCl 水溶液、0.1 mol?L-1和1mol?L-1H2SO4溶液,1.0 mol?L-1 HCl溶液及含1%乌洛托品的1.0 mol?L-1 HCl溶液中的极化曲线。 3 数据整理与分析 4 撰写实验报告 六、注意事项 1 实验前必须预习实验报告和相关的课程内容,需要记录哪些数据、观察哪些现象,预计有哪些结果等做到心中有数。 2实验前必须了解设备的性能和相关的操作规程,能正确调整设备,特别注意安全操作。 3 测试样品的表面(研究电极表面)一定要处理平整、光亮、干净,不能有点蚀孔。 4 实验前进行分组(六人一组)并确定组长,制定实验方案(选定材料种类,腐蚀介质,扫描速度,起始电压等,并写出实验操作步骤),提交实验方案,经指导教师确认后方可进实验室操作。(完整版)电化学曲线极化曲线阻抗谱分析
电化学阻抗谱的应用分析
电化学原理之浓差极化和电化学极化
电化学 第3章 电化学极化讲解
电化学步骤动力学与电化学极化
极化曲线分析
电化学曲线极化曲线阻抗谱分析
极化曲线分析
极化与去极化
电化学原理之浓差极化和电化学极化
不同材料电化学极化曲线的测量