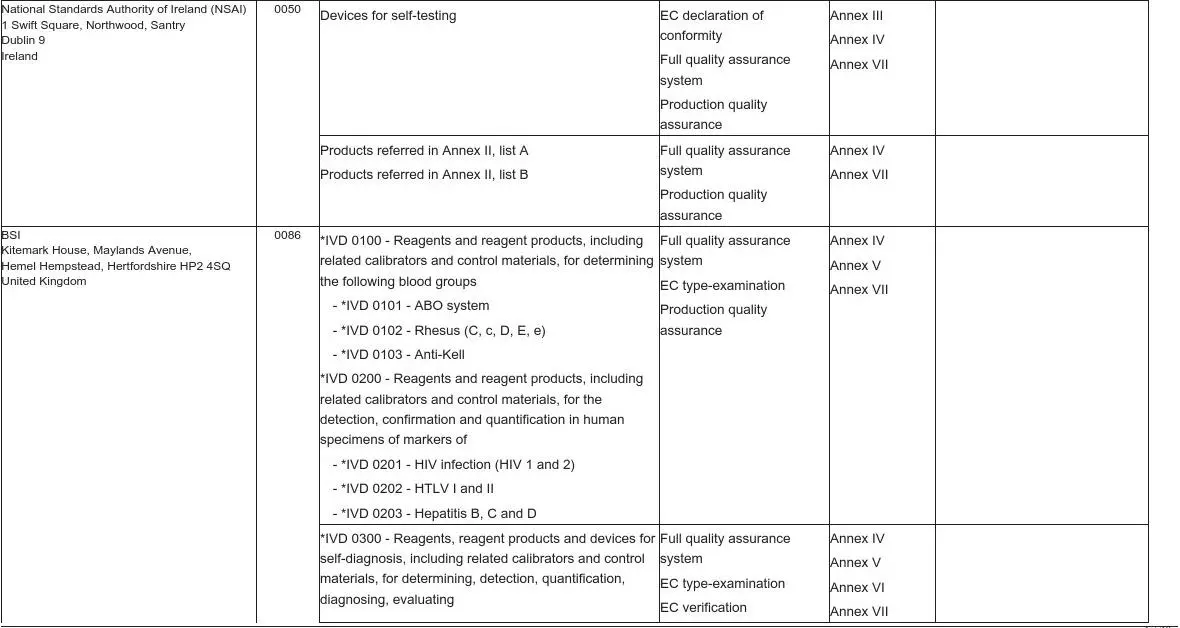

National Standards Authority of Ireland(NSAI) 1Swift Square,Northwood,Santry
Dublin9
Ireland 0050Devices for self-testing EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
Products referred in Annex II,list A
Products referred in Annex II,list B
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
BSI
Kitemark House,Maylands Avenue, Hemel Hempstead,Hertfordshire HP24SQ United Kingdom 0086*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0101-ABO system
-*IVD0102-Rhesus(C,c,D,E,e)
-*IVD0103-Anti-Kell
*IVD0200-Reagents and reagent products,including
related calibrators and control materials,for the
detection,confirmation and quantification in human
specimens of markers of
-*IVD0201-HIV infection(HIV1and2)
-*IVD0202-HTLV I and II
-*IVD0203-Hepatitis B,C and D
Full quality assurance
system
EC type-examination
Production quality
assurance
Annex IV
Annex V
Annex VII
*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
Full quality assurance
system
EC type-examination
EC verification
Annex IV
Annex V
Annex VI
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
-*IVD0301-Anti-Duffy and anti-Kidd
-*IVD0302-Irregular anti-erythrocytic antibodies -*IVD0303-Congenital infections:rubella, toxoplasmosis
-*IVD0304-Hereditary disease:phenylketonuria -*IVD0305-Human infections:cytomegalovirus, chlamydia
-*IVD0306-HLA tissue groups:DR,A,B Production quality assurance
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0307-Tumoral marker:PSA Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0308-Risk of trisomy21(incl.software)
-*IVD0309-Device for self-diagnosis:device for the measurement of blood sugar Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex IV
Annex V
Annex VI
Annex VII
*IVD0400-Devices for self-testing
-*IVD0401-Clinical chemistry
-*IVD0402-Haematology
-*IVD0403-Immunology
-*IVD0405-Pregnancy and ovulation -*IVD0406-Specimen receptacles EC declaration of
conformity
Full quality assurance
system
EC type-examination
EC verification
Production quality
Annex III
Annex IV
Annex V
Annex VI
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
assurance *MDS7206-IVDs in sterile condition
*MDS7208-IVDs utilising nanomaterials
*MDS7209-IVDs utilising biological active coating
and/or material
*MDS7210-IVDs utilising material of human origin
LLOYD'S REGISTER QUALITY ASSURANCE LTD(0088)
Hiramford Middlemarch Office Village Siskin Drive
Coventry CV34FJ
United Kingdom 0088*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0101-ABO system
-*IVD0102-Rhesus(C,c,D,E,e)
-*IVD0103-Anti-Kell
*IVD0200-Reagents and reagent products,including
related calibrators and control materials,for the
detection,confirmation and quantification in human
specimens of markers of
-*IVD0201-HIV infection(HIV1and2)
-*IVD0202-HTLV I and II
-*IVD0203-Hepatitis B,C and D
*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
-*IVD0301-Anti-Duffy and anti-Kidd
-*IVD0302-Irregular anti-erythrocytic antibodies
-*IVD0303-Congenital infections:rubella,
toxoplasmosis
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
-*IVD0304-Hereditary disease:phenylketonuria
-*IVD0305-Human infections:cytomegalovirus, chlamydia
-*IVD0306-HLA tissue groups:DR,A,B
-*IVD0307-Tumoral marker:PSA
-*IVD0308-Risk of trisomy21(incl.software)
-*IVD0309-Device for self-diagnosis:device for the measurement of blood sugar
*IVD0400-Devices for self-testing
-*IVD0401-Clinical chemistry
-*IVD0402-Haematology
-*IVD0403-Immunology
-*IVD0404-Molecular biology
-*IVD0405-Pregnancy and ovulation -*IVD0406-Specimen receptacles EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
*MDS7206-IVDs in sterile condition
*MDS7209-IVDs utilising biological active coating and/or material
*MDS7210-IVDs utilising material of human origin
SGS United Kingdom Limited
Unit202B,Worle Parkway,
Weston-super-Mare,Somerset,BS226WA United Kingdom 0120*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
-*IVD0301-Anti-Duffy and anti-Kidd
-*IVD0302-Irregular anti-erythrocytic antibodies
-*IVD0303-Congenital infections:rubella,
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
toxoplasmosis
-*IVD 0304-Hereditary disease:phenylketonuria -*IVD 0305-Human infections:cytomegalovirus,chlamydia
-*IVD 0306-HLA tissue groups:DR,A,B -*IVD 0307-Tumoral marker:PSA
-*IVD 0308-Risk of trisomy 21(incl.software)-*IVD 0309-Device for self-diagnosis:device for the
measurement of blood sugar *IVD 0400-Devices for self-testing -*IVD 0401-Clinical chemistry -*IVD 0402-Haematology -*IVD 0403-Immunology
-*IVD 0405-Pregnancy and ovulation -*IVD 0406-Specimen receptacles EC declaration of
conformity
Full quality assurance system
Production quality assurance
Annex III Annex IV Annex VII
*MDS 7206-IVDs in sterile condition
EC declaration of confirmity Annex III Full quality assurance system Annex IV Production quality assurance Annex VII
*MDS 7207-IVDs utilising micromechanics
EC declaration of confirmity Annex III Full quality assurance system Annex IV Production quality assurance Annex VII
*MDS 7208-IVDs utilising nanomaterials
EC declaration of confirmity Annex III Full quality assurance system Annex IV Production quality assurance Annex VII
Name and address of the notified
bodies
ID
Responsible for the following products /Horizontal technical competence
Responsible for the following procedures or modules Annexes or articles of the
directives
Limitations (English only)
https://www.doczj.com/doc/102059992.html,
*MDS7209-IVDs utilising biological active coating and/or material EC declaration of confirmity Annex III Full quality assurance system Annex IV Production quality assurance Annex VII
*MDS7210-IVDs utilising material of human origin EC declaration of confirmity Annex
III Full quality assurance system
Annex IV Production quality
assurance Annex VII
TüV SüD Product Service GmbH Ridlerstra?e65
80339MüNCHEN
Germany 0123*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0101-ABO system
-*IVD0102-Rhesus(C,c,D,E,e)
-*IVD0103-Anti-Kell
*IVD0200-Reagents and reagent products,including
related calibrators and control materials,for the
detection,confirmation and quantification in human
specimens of markers of
-*IVD0201-HIV infection(HIV1and2)
-*IVD0202-HTLV I and II
-*IVD0203-Hepatitis B,C and D
Full quality assurance
system
EC type-examination
Production quality
assurance
Annex IV
Annex V
Annex VII
*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
-*IVD0301-Anti-Duffy and anti-Kidd
-*IVD0302-Irregular anti-erythrocytic antibodies
Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex IV
Annex V
Annex VI
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
-*IVD 0303-Congenital infections:rubella,toxoplasmosis
*IVD 0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification,diagnosing,evaluating
-*IVD 0304-Hereditary disease:phenylketonuria
Full quality assurance system
Production quality assurance
Annex IV Annex VII
*IVD 0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification,diagnosing,evaluating
-*IVD 0305-Human infections:cytomegalovirus,
chlamydia
-*IVD 0306-HLA tissue groups:DR,A,B -*IVD 0307-Tumoral marker:PSA
Full quality assurance system EC type-examination EC verification
Production quality
assurance
Annex IV Annex V Annex VI Annex VII
*IVD 0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification,diagnosing,evaluating
-*IVD 0308-Risk of trisomy 21(incl.software)
Full quality assurance system
Production quality assurance
Annex IV Annex VII
*IVD 0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification,diagnosing,evaluating
-*IVD 0309-Device for self-diagnosis:device for the measurement of blood sugar Full quality assurance system
EC type-examination EC verification Production quality assurance Annex IV Annex V Annex VI Annex VII
*IVD 0400-Devices for self-testing
EC declaration of
Annex III
Name and address of the notified
bodies
ID
Responsible for the following products /Horizontal technical competence
Responsible for the following procedures or modules Annexes or articles of the
directives
Limitations (English only)
https://www.doczj.com/doc/102059992.html,
-*IVD0401-Clinical chemistry
-*IVD0402-Haematology
-*IVD0403-Immunology
-*IVD0404-Molecular biology
-*IVD0405-Pregnancy and ovulation -*IVD0406-Specimen receptacles conformity
Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex IV
Annex V
Annex VI
Annex VII
*MDS7206-IVDs in sterile condition
*MDS7207-IVDs utilising micromechanics
*MDS7208-IVDs utilising nanomaterials
*MDS7209-IVDs utilising biological active coating and/or material
*MDS7210-IVDs utilising material of human origin
DEKRA Certification GmbH Handwerkstra?e15
70565STUTTGART Germany 0124*IVD0400-Devices for self-testing
-*IVD0401-Clinical chemistry
-*IVD0402-Haematology
-*IVD0403-Immunology
-*IVD0404-Molecular biology
-*IVD0405-Pregnancy and ovulation
-*IVD0406-Specimen receptacles
EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
-*IVD0309-Device for self-diagnosis:device for the
measurement of blood sugar
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
*MDS7206-IVDs in sterile condition
TüV Rheinland LGA Products GmbH Tillystra?e2
90431Nürnberg
Germany 0197*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0101-ABO system
-*IVD0102-Rhesus(C,c,D,E,e)
-*IVD0103-Anti-Kell
*IVD0200-Reagents and reagent products,including
related calibrators and control materials,for the
detection,confirmation and quantification in human
specimens of markers of
-*IVD0201-HIV infection(HIV1and2)
-*IVD0202-HTLV I and II
-*IVD0203-Hepatitis B,C and D
Full quality assurance
system
EC type-examination
Production quality
assurance
Annex IV
Annex V
Annex VII
*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
-*IVD0301-Anti-Duffy and anti-Kidd
-*IVD0302-Irregular anti-erythrocytic antibodies
-*IVD0303-Congenital infections:rubella,
toxoplasmosis
-*IVD0304-Hereditary disease:phenylketonuria
-*IVD0305-Human infections:cytomegalovirus,
chlamydia
-*IVD0306-HLA tissue groups:DR,A,B
-*IVD0307-Tumoral marker:PSA
Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex IV
Annex V
Annex VI
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
-*IVD0308-Risk of trisomy21(incl.software)
-*IVD0309-Device for self-diagnosis:device for the measurement of blood sugar
*IVD0400-Devices for self-testing
-*IVD0401-Clinical chemistry
-*IVD0402-Haematology
-*IVD0403-Immunology
-*IVD0404-Molecular biology
-*IVD0405-Pregnancy and ovulation -*IVD0406-Specimen receptacles EC declaration of
conformity
Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex III
Annex IV
Annex V
Annex VI
Annex VII
*MDS7206-IVDs in sterile condition
*MDS7207-IVDs utilising micromechanics
*MDS7208-IVDs utilising nanomaterials
*MDS7209-IVDs utilising biological active coating and/or material
*MDS7210-IVDs utilising material of human origin
AGENCIA ESPA?OLA DE MEDICAMENTOS Y PRODUCTOS SANITARIOS MINISTERIO DE SANIDAD Y CONSUMO
Paseo del Prado,18-20
28014MADRID
Spain 0318All devices for self-testing EC declaration of
conformity
Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex III
Annex IV
Annex V
Annex VI
Annex VII Reagents and reagent products,including related Full quality assurance Annex IV
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
calibrators and control materials,for controlling the following blood groups:ABO system,Rhesus(C,c,D, E,e),anti-Kell
Reagents and reagent products,including related calibrators and control materials,for the detection, confirmation and quantification in human specimens of markers of HIV infection(HIV1and2),HTLV I and II, and hepatitis B,C and D
Reagents and reagent products,including related calibrators and control materials,for determining the following blood groups:anti-Duffy and anti-Kidd Reagents and reagent products,including related calibrators and control materials,for determining irregular anti-erythrocytic antibodies
Reagents and reagent products,including related calibrators and control materials,for the detection and quantification in human samples of the following congenital infections:rubella,toxoplasmosis Reagents and reagent products,including related calibrators and control materials,for determining the following hereditary disease:phenylketonuria Reagents and reagent products,including related calibrators and control materials,for determining the following human infections:cytomegalovirus,chlamydia Reagents and reagent products,including related calibrators and control materials,for determining the following HLA tissue groups:DR,A,B
Reagents and reagent products,including related calibrators and control materials,for determining the system
EC type-examination
EC verification
Production quality
assurance
Annex V
Annex VI
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
following tumoral marker:PSA
Reagents and reagent products,including related calibrators,control materials and software,designed specifically for evaluating the risk of trisomy21
KEMA Quality B.V. Utrechtseweg310,Postbus5185 6802ED ARNHEM Netherlands 0344All devices for self-testing EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
All devices referred in Annex II Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
TüV AUSTRIA SERVICES GMBH Krugerstrasse16
1015WIEN
Austria 0408Devices for self-testing EC declaration of
conformity
Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex III
Annex IV
Annex V
Annex VI
Annex VII
Products referred in Annex II,list A Full quality assurance
system
EC type-examination
Production quality
assurance
Annex IV
Annex V
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
Products referred in Annex II,list B Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance Annex IV Annex V Annex VI Annex VII
Laboratoire national d'essais/G-MED 1,rue Gaston Boissier
75724PARIS Cedex15
France 0459*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0101-ABO system
-*IVD0102-Rhesus(C,c,D,E,e)
-*IVD0103-Anti-Kell
*IVD0200-Reagents and reagent products,including
related calibrators and control materials,for the
detection,confirmation and quantification in human
specimens of markers of
-*IVD0201-HIV infection(HIV1and2)
-*IVD0202-HTLV I and II
-*IVD0203-Hepatitis B,C and D
*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
-*IVD0301-Anti-Duffy and anti-Kidd
-*IVD0302-Irregular anti-erythrocytic antibodies
-*IVD0303-Congenital infections:rubella,
toxoplasmosis
EC declaration of
conformity
Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex III
Annex IV
Annex V
Annex VI
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
-*IVD0304-Hereditary disease:phenylketonuria
-*IVD0305-Human infections:cytomegalovirus, chlamydia
-*IVD0306-HLA tissue groups:DR,A,B
-*IVD0307-Tumoral marker:PSA
-*IVD0308-Risk of trisomy21(incl.software)
-*IVD0309-Device for self-diagnosis:device for the measurement of blood sugar
*IVD0400-Devices for self-testing
-*IVD0401-Clinical chemistry
-*IVD0402-Haematology
-*IVD0403-Immunology
-*IVD0404-Molecular biology
-*IVD0405-Pregnancy and ovulation
-*IVD0406-Specimen receptacles
*MDS7206-IVDs in sterile condition
*MDS7207-IVDs utilising micromechanics
*MDS7208-IVDs utilising nanomaterials
*MDS7209-IVDs utilising biological active coating and/or material
*MDS7210-IVDs utilising material of human origin
AMTAC CERTIFICATION SERVICES LTD Davy Avenue,Knowlhill
Milton Keynes MK58NL
United Kingdom 0473All self-test devices which have existing notified body
(NB)certification via their original manufacturer
EC declaration of
conformity
Full quality assurance
system
EC type-examination
Annex III
Annex IV
Annex V
Annex VI
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
EC verification
Production quality
assurance
Annex VII
All Annex II list A devices which have existing notified body(NB)certification via their original manufacturer All Annex II list B devices which have existing notified body(NB)certification via their original manufacturer Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex IV
Annex V
Annex VI
Annex VII
MDC MEDICAL DEVICE CERTIFICATION GMBH
Kriegerstrasse6
70191STUTTGART
Germany 0483*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0101-ABO system
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0102-Rhesus(C,c,D,E,e)
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0100-Reagents and reagent products,including
related calibrators and control materials,for determining
the following blood groups
-*IVD0103-Anti-Kell
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0200-Reagents and reagent products,including
related calibrators and control materials,for the
detection,confirmation and quantification in human
specimens of markers of
-*IVD0201-HIV infection(HIV1and2)
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII *IVD0200-Reagents and reagent products,including Full quality assurance Annex IV
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
related calibrators and control materials,for the detection,confirmation and quantification in human specimens of markers of
-*IVD0203-Hepatitis B,C and D system
Production quality
assurance
Annex VII
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0301-Anti-Duffy and anti-Kidd Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0302-Irregular anti-erythrocytic antibodies Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0303-Congenital infections:rubella, toxoplasmosis Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
toxoplasmosis excluded
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0305-Human infections:cytomegalovirus, chlamydia Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control Full quality assurance
system
Annex IV
Annex VII
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0306-HLA tissue groups:DR,A,B Production quality assurance
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0307-Tumoral marker:PSA Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0308-Risk of trisomy21(incl.software)Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0300-Reagents,reagent products and devices for self-diagnosis,including related calibrators and control materials,for determining,detection,quantification, diagnosing,evaluating
-*IVD0309-Device for self-diagnosis:device for the measurement of blood sugar Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII
*IVD0400-Devices for self-testing -*IVD0401-Clinical chemistry EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
*IVD0400-Devices for self-testing -*IVD0402-Haematology EC declaration of
conformity
Full quality assurance
Annex III
Annex IV
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
system
Production quality
assurance
Annex VII
*IVD0400-Devices for self-testing -*IVD0403-Immunology EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
*IVD0400-Devices for self-testing
-*IVD0405-Pregnancy and ovulation EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
*IVD0400-Devices for self-testing
-*IVD0406-Specimen receptacles EC declaration of
conformity
Full quality assurance
system
Production quality
assurance
Annex III
Annex IV
Annex VII
*MDS7206-IVDs in sterile condition
*MDS7209-IVDs utilising biological active coating and/or material
*MDS7210-IVDs utilising material of human origin
INSTITUTO NACIONAL DA FARMACIA E DO MEDICAMENTO
Parque da Saúde de Lisboa-Av.do Brasil,530503In vitro diagnostic medical devices EC declaration of
conformity
Annex III
Annex IV
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
1749-004LISBOA Portugal Full quality assurance
system
EC type-examination
EC verification
Production quality
assurance
Annex V
Annex VI
Annex VII
EUROCAT-INSTITUTE FOR CERTIFICATION AND TESTING GMBH Quarat Center,Wittichstrasse2
64295DARMSTADT
Germany 0535*IVD0300-Reagents,reagent products and devices for
self-diagnosis,including related calibrators and control
materials,for determining,detection,quantification,
diagnosing,evaluating
-*IVD0309-Device for self-diagnosis:device for the
measurement of blood sugar
*IVD0400-Devices for self-testing
-*IVD0401-Clinical chemistry
-*IVD0402-Haematology
-*IVD0403-Immunology
-*IVD0404-Molecular biology
-*IVD0405-Pregnancy and ovulation
-*IVD0406-Specimen receptacles
Full quality assurance
system
Production quality
assurance
Annex IV
Annex VII *MDS7206-IVDs in sterile condition
VTT Expert Services Oy PO Box345
FI-33101Tampere Finland 0537Self diagnosis devices for determining pregnancy and
ovulation
EC declaration of
conformity
Full quality assurance
system
Annex III
Annex IV
Reagents and reagent products,including related
calibrators and control materials,for controlling the
following blood groups:ABO system,Rhesus(C,c,D,
Full quality assurance
system
Annex IV
Name and address of the notified
bodies ID Responsible for the following products
/Horizontal technical competence
Responsible for the
following procedures
or modules
Annexes or
articles of the
directives
Limitations(English only)
https://www.doczj.com/doc/102059992.html,
E,e),anti-Kell
Reagents and reagent products,including related calibrators and control materials,for the detection,confirmation and quantification in human specimens of markers of HIV infection (HIV 1and 2),HTLV I and II,and hepatitis B,C and D
Reagents and reagent products,including related calibrators and control materials,for determining the following blood groups:anti-Duffy and anti-Kidd
Reagents and reagent products,including related calibrators and control materials,for determining irregular anti-erythrocytic antibodies
Reagents and reagent products,including related calibrators and control materials,for the detection and quantification in human samples of the following congenital infections:rubella,toxoplasmosis Reagents and reagent products,including related
calibrators and control materials,for determining the following hereditary disease:phenylketonuria Reagents and reagent products,including related calibrators and control materials,for determining the following human infections:cytomegalovirus,chlamydia Reagents and reagent products,including related calibrators and control materials,for determining the following HLA tissue groups:DR,A,B
Reagents and reagent products,including related calibrators and control materials,for determining the following tumoral marker:PSA
Name and address of the notified
bodies
ID
Responsible for the following products /Horizontal technical competence
Responsible for the following procedures or modules Annexes or articles of the
directives
Limitations (English only)
https://www.doczj.com/doc/102059992.html,
体外诊断试剂注册与备案管理办法 (征求意见稿) 第一章总则 第一条为规范体外诊断试剂的注册与备案管理,保证体外诊断试剂的安全、有效,根据《医疗器械监督管理条例》,制定本办法。 第二条在中华人民共和国境内销售、使用的体外诊断试剂均应当按照本办法的规定申请注册或者办理备案。 第三条本办法所称体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。 国家法定用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂不属于本办法的管理范围。 第四条体外诊断试剂注册,是指食品药品监督管理部门根据体外诊断试剂注册申请人的申请,依照法定程序,对其拟上市销售体外诊断试剂的安全性、有效性的研究及其结果进行的系统评价,并决定是否同意其申请的审批过程。 体外诊断试剂备案是指食品药品监督管理部门对体外
诊断试剂备案人提交的第一类体外诊断试剂备案资料存档 备查。 第五条体外诊断试剂注册与备案应该遵循公开、公平、公正的原则。 第六条第一类体外诊断试剂实行备案管理,第二类、第三类体外诊断试剂实行注册管理。 境内第一类体外诊断试剂由设区的市级食品药品监督 管理部门予以备案。 境内第二类体外诊断试剂由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。 境内第三类体外诊断试剂由国家食品药品监督管理总 局审查,批准后发给医疗器械注册证。 进口第一类体外诊断试剂由国家食品药品监督管理总 局予以备案。 进口第二类、第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。 香港、澳门、台湾地区体外诊断试剂的注册、备案,参照进口体外诊断试剂办理。 第七条体外诊断试剂注册申请人(以下简称申请人),是指提出体外诊断试剂注册申请,在该申请获得批准后持有注册证,并以自己名义把产品推向市场,对产品负法律责任的企业。 体外诊断试剂备案人(以下简称备案人),是指办理体外诊断试剂备案,并以自己名义把产品推向市场,对产品负
欧盟CE认证基本知识 1 CE认证介绍 2 CE标志的含义 3 CE认证指令及适用产品 4 一个产品同时受多个指令覆盖时CE标志的使用方式 5 CE认证模式种类 6 CE认证流程 7 部分EN标准介绍(玻璃产品CE认证) 8 办理CE认证需提交的资料 9 CE认证表格下载 CE认证介绍 CE两字,是从法语“Communa te Europpene”缩写而成,是欧洲共同体的意思。 欧洲共同体后来演变成了欧洲联盟(简称欧盟)。CE代表欧洲统一(CONFORMITE EUROPEENNE)。事实上,CE还是欧共体需多国家语种中的”欧共体”这一词组的缩写,原来用英语词组EUROPEAN COMMUNITY缩写为EC,后因欧共体在法文是COMMUNATE EUROPEIA,意大利文为COMUNITA EUROPEA,葡萄牙文为COMUNIDADE EUROPEIA,西班牙文为COMUNIDADE EUROPE等,故改EC为CE。当然,也不妨把CE视为CONFORMITY WITH EUROPEAN (DEMAND)(符合欧洲(要求))。 “CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。凡是贴有“CE”标志的产品就可在欧盟各成员国内销售,无须符合每个成员国的要求,从而实现了商品在欧盟成员国范围内的自由流通。 在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求。 CE标志的意义在于:用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求(Essential Requirements),并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明,真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品,没有CE标志的,不得上市销售,已加贴CE标志进入市场的产品,发现不符合安全要求的,要责令从市场收回,持续违反指令有关CE标志规定的,将被限制或禁止进入欧盟市场或被迫退出市场。 CE标志的含义
1.目的:为了加强体外诊断试剂在采购、验收、保管养护、销售、出库复核、运输等环节的监督管理,特制定本制度。 2.范围:适用于体外诊断试剂的管理。 3.责任人:采购员、开票员、业务员、三方物流收货员、验收员、保管员、养护员、复核员、配送员、司机。 4.内容: 4.1.认真贯彻执行《药品管理法》、《药品管理法实施条例》等法律、法规以及相关政策,加强对体外诊断试剂的全面质量管理。 4.2.体外诊断试剂既包括经营按械准字号批准的体外诊断试剂,也包括经营以药准字号批准的体外诊断试剂。 4.2.1.本制度中所称体外诊断试剂,是指以药准字号批准的体外诊断试剂。 4.3.体外诊断试剂人员的管理: 4.3.1.采购员要以质量为依据,制定购货计划,坚持按需进货,择优采购的原则,把好进货质量第一关。 4.3.2.了解供货单位的质量保证能力和质量信誉,建立完善的供货企业管理档案。 4.3.3.认真审查供货单位的法定资格,考察其履行合同的能力,必要时配合质量管理部对其进行现场考察,签订质量保证协议,并标明有效期,确保购进渠道的合法性。 4.3.4.负责建立经营品种目录。 4.3.5签订具有质量保证条款的购货合同。 4.3.6.质量管理部负责体外诊断试剂的质量管理工作,树立“质量第—”的观念,坚持质量效益的原则,承担质量管理方面的具体工作,在体外诊断试剂质量管理、工作质量管理方面有效行使裁决权。
4.3.6.1.对企业经营过程中的体外诊断试剂质量进行严格检查监督,定期对质量管理工作的执行情况进行检查、考核,在企业内部有效行使否决权。 4.3.6.2.负责对体外诊断试剂首营企业、首营品种的审批。 4.3.6.3.负责监督检查体外诊断试剂购进、验收入库、储存养护、出库复核、运输及售后服务等方面的质量控制和质量指导。 4.3.6.4.负责对上报的质量问题进行复查、确认、处理、追踪。 4.3.6. 5.负责及时搜集各种相关资料,必要时通过互联网到各级药监局等政府部门的网站上查询,对于下载内容严禁自行修改等文字处理,下载的资料要进行归档; 4.3.6.6.负责质量信息的管理工作。 4.3.6.7.负责不合格体外诊断试剂报损前的审核及报废体外诊断试剂处理的监督工作,做好不合格体外诊断试剂相关记录。 4.3.6.8.收集、保管好本部门的质量资料、档案,督促各岗位做好各类台帐,记录、保证本部门各项质量活动记录的完整性、准确性和可追溯性。 4.3.6.9.体外诊断试剂的收货、验收、购进、出库复核、销售等记录,要做到真实、完整、字迹清晰,并至少保存5年。 4.3.7.质量管理部要贯彻执行国家的法律、法规及行政规章,正确理解并积极推进本企业质量方针、目标和质量管理体系的正常运行;协助人力资源管理部加强对业务人员的质量教育,对体外诊断试剂业务关键岗位的人员进行质量意识培训及考核。 4.3.8.三方物流物流部负责体外诊断试剂存储运输: 4.3.8.1.严格按体外诊断试剂批号、效期及色标管理,按储存条件存放。 4.3.8.2.搬运和堆垛应严格遵守体外诊断试剂外包装图示或标志的要求,规范操作。 4.3.8.3.对不合格体外诊断试剂进行有效控制。 4.3.8.4.严格按照体外诊断试剂储存运输的要求采取必要措施。 4.3.8. 5.及时、准确、安全、经济的组织体外诊断试剂的运输,并确保质量。 4.3.8.6.加强库房场地、设施、设备的建设和管理。 4.4.体外诊断试剂购进的管理:
“CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。CE代表欧洲统一(CONFORMITE EUROPEENNE)。欧盟ce认证服务中心港易质量认证公司,在欧洲认证咨询方面有多年的经验总结: 需要欧盟CE认证的国家有:所有欧洲经济区域的国家。包括:欧洲联盟:法国、联邦德国、意大利、荷兰、比利时、卢森堡、英国、丹麦、爱尔兰、希腊、西班牙、葡萄牙、奥地利、瑞典和、芬兰、塞浦路斯、匈牙利、捷克、爱沙尼亚、拉脱维亚、立陶宛、马耳他、波兰、斯洛伐克和斯洛文尼亚等25个国家。欧洲自由贸易协会成员:瑞士、冰岛和挪威等3个国家。 CE认证的流程: 第一步:确定产品符合的指令和协调标准 第二步:确定产品应符合的详细要求 第三步:确定产品是否需要公告机构参与检验 第四步:测试产品并检验其符合性
第五步:起草并保存指令要求的技术文件 第六步:在您的产品上加贴CE标志并做EC符合性声明(EC Declaration of Conformity) 检验(测试)是取得CE认证的基础:申请CE认证的产品必须经实验室检验,出具符合性的检验报告,检验依据必须是欧盟协调标准EN,然后将检验报告送交欧盟指定机构NB,进行CE评审,取得CE认证,检验机构本身无权发放CE认证,但检验机构的检验证明是取得CE认证的基础。 CE认证的标识: 必须明显易见且不易磨损脱落; 标示于产品本身或包装盒或说明书或保证卡上; 不可与其他标识混淆不清; 最小高度5mm。 目前中国市场上的三种证书: (1)DOC:企业自主签发的Declaration of conformity /
Declaration of compliance《符合性声明书》,此证书属于自我声明书,不应由第三方机构(中介或测试认证机构)签发,因此,可以用欧盟格式的企业《符合性声明书》代替。 (2)VOC:Vertificate of compliance 《符合性证书》,此为第三方机构(中介或测试认证机构)颁发的符合性声明,必须附有测试报告等技术资料TCF,同时,企业也要签署《符合性声明书》。 (3)COC:EC Attestation of conformity 《欧盟标准符合性证明书》,此为欧盟公告机构(Notified Body简写为NB)颁发的证书,按照欧盟法规,只有NB才有资格颁发EC Type的CE声明。 DOC与VOC的有效性需要由采购方和产品出口目的国海关决定,并不能保证产品一定能出口。由欧盟公告机构出具的证书不存在有效性的问题,是权威的。 CE认证公告机构Notified Body 指定机构NB,是由欧盟成员国提名,由欧盟委员会指定的机构。 进行CE合格评定,具有对产品安全性提供法律解释权,许多指令需要指定机构的参与,部分指令称指定机构为”能力机构“或”授权机构“。 港易质量认证公司专业办理,以最短的周期做最权威的CE认证,以确保您的产品出口欧盟能够顺利清关,被国外客户认可产品的质量。 港易质量认证公司是一家专业的从事于产品出口认证咨询,质量体系认证咨询,信用评级咨询,产品检测咨询的技术服务型公司,与
《体外诊断试剂注册管理办法》培训试题部门:_________ 姓名:_________ 分数:_________ 一、选择题(本大题共10个小题,每小题2分,共20分,在每个小题所给出的题目中,只有一项是符合题目要求的) 1. 根据产品风险的高低,体外诊断试剂依次分为()。 A、第一类产品、第二类产品、第三类产品、第四类产品 B、第一类产品、第二类产品、第三类产品 C、第三类产品、第二类产品、第一类产品 D、第四类产品、第三类产品、第二类产品、第一类产品 2. 下列检测试剂中不属于第二类产品的是()。 A、用于蛋白质检测的试剂 B、用于酶类检测的试剂 C、用于维生素检测的试剂 D、与肿瘤标志物检测相关的试剂 3. 在第二类产品的注册过程中,有()情况应按第三类产品进行注册管理。 A、1种 B、2种 C、3种 D、4种 4. 体外诊断试剂的产品名称一般可由()部分组成。 A、1 B、2 C、3 D、4 5. 产品性能评估是指对体外诊断试剂哪些的评估()。 A、分析性能和临床性能 B、产品稳定性和参考值(参考范围) C、产品生产工艺和分析性能 D、产品生产工艺和产品稳定性 6. 第三类产品和第二类产品申请人应当选定的省级卫生医疗机构开展临床试验的数目分别为() A、不少于3家(含3家)、不少于1家(含1家) B、不少于3家(含3家)、不少于2家(含2家) C、不少于3家(含3家)、不少于3家(含3家) D、不少于1家(含1家)、不少于1家(含1家) 7. 体外诊断试剂产品标准包括()。 A、国家标准、行业标准 B、行业标准、注册产品标准 C、国家标准、行业标准、注册产品标准 D、国家标准、行业标准、注册产品标准、自己拟定的标准 8. 哪些体外诊断试剂进行首次注册时一般不需要注册检测()。 A、第一类产品 B、第二类产品 C、第三类产品 D、全部三类产品 9. 《医疗器械注册证书》有效期为()。 A、1年 B、2年 C、3年 D、4年 10. 下列选项中,哪项不属于《体外诊断试剂注册管理办法(试行)》中关于变更申请事项所规定的内容()。 A、变更生产企业名称、变更生产过程中所用抗原、抗体等主要材料 B、变更生产企业注册地址、变更检测条件及参考值(或参考范围)等 C、变更注册代理机构、变更注册产品标准中所设定的项目、指标、试验方法等 D、已上市销售产品基本反应原理改变、已上市销售产品分析灵敏度指标改变,并具有新的临床诊断意义 二、填空题(本大题共10个小题,每小题2分,共20分,请将正确答案填写在空白横线上) 1. 等体外诊断试剂产品,如果不单独销售,则不需要单独申请注册。 2. 为申请体外诊断试剂注册而进行的产品研制工作应当包括:主要原材料的选择、制备;产品生产工艺的确定;注册产品标准的拟定;产品稳定性研究、参考值(参考范围)确定、等相关工作。
CE认证标志的接受对象为欧共体成员国负责实行市场产品安全控制的国家监管当局,而非顾客,当一个产品已加附CE认证标志时,成员国负责销售安全监督的当局应假定其符合指令主要要求,可在欧共体市场自由流通。欧盟CE认证机构港易质量认证公司,在欧洲认证咨询方面有多年的经验总结: “CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。 CE认证的标识: 必须明显易见且不易磨损脱落; 标示于产品本身或包装盒或说明书或保证卡上; 不可与其他标识混淆不清; 最小高度5mm。
港易质量认证公司专业办理,以最短的周期做最权威的CE认证,以确保您的产品出口欧盟能够顺利清关,被国外客户认可产品的质量。 港易质量认证公司是一家专业的从事于产品出口认证咨询,质量体系认证咨询,信用评级咨询,产品检测咨询的技术服务型公司,与ITS、SGS、CONTECNA、CCIC、CQC等国内外机构建立了良好的业务合作关系,为国内厂家的认证提供便利。 港易质量认证公司致力于为客户提供海关联盟CU-TR认证、俄罗斯GOST认证、尼日利亚SONCAP认证、沙特SASO认证、肯尼亚PVOC认证、乌干达PVOC认证、坦桑尼亚PVOC认证、南非LOA 认证,埃及COI认证、欧盟CE认证、CB认证、加纳CTN,科威特KUCAS认证、伊拉克COC认证、澳洲SAA认证、美国DOT认证、美国FDA认证、日本PSE认证、印尼SNI认证、泰国TISI认证、印度BIS认证、BSCI认证、加拿大CSA认证等等、提供安全、电磁兼容、化学、性能测试、环境测试等全方位的技术服务。服务范围覆盖了认证咨询、技术支持、送检准备、重复测试、专家指导以及根据客
123 《质量管理制度》(3)目录
1、为规范本公司的质量体系文件的管理。 2、依据《药品管理法》、《药品经营质量管理规范》及其实施细则、《医疗器械监督管理条例》制定。 3、本制度规定了管理文件的编制、审核、批准、发布、修订、复审、废除与收回的部门及其职责,适用于对管理文件的管理。 4、质量管理人对本制度实施负责。 5、内容: 5.1、质量管理文件的分类: 5.1.1、质量管理文件包括标准文件和记录文件两类。 5.1.2、标准文件指用以规定质量管理工作的原则,阐述质量体系的构成,明确有关组织、部门和人员的质量职责,规定各项质量活动的目的、要求、内容、方法和途径的文件,包括国家有关的法律、法规;国家质量标准;公司的质量管理制度、质量责任等。 5.1.3、记录文件指用以表明本公司实施质量体系运行情况和证实其有效性的文件,如各种质量活动和的记录(如图表、报告)等,记载购进、储存、销售、运输等各个环节质量活动、质量状况,是质量体系运行情况的证明文件。 5.2、质量体系文件的内容: 5.2.1、公司的质量管理标准文件制定必须符合下列要求: A、依据根据《药品管理法》、《药品经营质量管理规范》及其实施细则、《医疗器械监督管理条例》等法规的要求,使制定的各项管理文件具有合法性。 B、结合本公司的经营方式、经营范围和公司的管理模式,使制定的各项文件具有充分性、规范性和可操作性。 C、制定文件管理程序,对文件的编制、审核、批准、发放、使用、修改、复审、作废、回收等实施控制性管理,并严格按照文件管理程序制定各项管理文件,使各项管理文件在公司内部具有规范性、权威性和约束力。 D、必须严格执行国家有关法律、法规、政策、方针以及国家法定技术标准以及上级文件。 E、公司制定的文件应覆盖公司的质量管理和与质量有关的所有工作,完整表达公司的质量体系,使文件具有系统性。 5.3、文件的编码: ——体外诊断试剂 R:质量责任(); S:质量管理制度(); P:质量工作程序(); :记录()
3.4体外诊断试剂注册管理办法(2017版) Measures for the Administration of Registration of In-Vitro Diagnostic Reagents 【发布部门】国家食品药品监督管理总局 【发文字号】国家食品药品监督管理总局令第30号 【发布日期】2017.01.25【实施日期】2017.01.25【查新日期】2017.09.01 【时效性】现行有效【效力级别】部门规章 国家食品药品监督管理总局令 第30号 《体外诊断试剂注册管理办法修正案》已于2017年1月5日经国家食品药品监督管理总局局务会议审议通过,现予公布,自公布之日起施行。 局长:毕井泉 2017年1月25 体外诊断试剂注册管理办法修正案 将第二十条第一款修改为:“本办法第十七条、第十八条、第十九条所述的体外诊断试剂分类规则,用于指导体外诊断试剂分类目录的制定和调整,以及确定新的体外诊断试剂的管理类别。国家食品药品监督管理总局可以根据体外诊断试剂的风险变化,对分类规则进行调整。” 本修正案自公布之日起施行。 体外诊断试剂注册管理办法(2017年修正) (2014年7月30日国家食品药品监督管理总局令(第5号)第一次发布,根据2017年1月25日国家食品药品监督管理总局令第30号修正) 第一章总则 第一条为规范体外诊断试剂的注册与备案管理,保证体外诊断试剂的安全、有效,根据《医疗器械监督管理条例》,制定本办法。 第二条在中华人民共和国境内销售、使用的体外诊断试剂,应当按照本办法的规定申请注册或者办理备案。 第三条本办法所称体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。 按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于本办法管理范围。 第四条体外诊断试剂注册是食品药品监督管理部门根据注册申请人的申请,依照法定程序,对其拟上市体外诊断试剂的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。 体外诊断试剂备案是备案人向食品药品监督管理部门提交备案资料,食品药品监督管理部门对提交的备案资料存档备查。 第五条体外诊断试剂注册与备案应当遵循公开、公平、公正的原则。 第六条第一类体外诊断试剂实行备案管理,第二类、第三类体外诊断试剂实行注册管理。 境内第一类体外诊断试剂备案,备案人向设区的市级食品药品监督管理部门提交备案资料。 境内第二类体外诊断试剂由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。 境内第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。 进口第一类体外诊断试剂备案,备案人向国家食品药品监督管理总局提交备案资料。 进口第二类、第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。 香港、澳门、台湾地区体外诊断试剂的注册、备案,参照进口体外诊断试剂办理。 第七条体外诊断试剂注册人、备案人以自己名义把产品推向市场,对产品负法律责任。 第八条食品药品监督管理部门依法及时公布体外诊断试剂注册、备案相关信息。申请人可以查询审批进度和结果,公众可以查阅审批结果。 第九条国家鼓励体外诊断试剂的研究与创新,对创新体外诊断试剂实行特别审批,促进体外诊断试剂新技术的推广与应用,推动医疗器械产业的发展。 第二章基本要求 第十条体外诊断试剂注册申请人和备案人应当建立与产品研制、生产有关的质量管理体系,并保持有效运行。 按照创新医疗器械特别审批程序审批的境内体外诊断试剂申请注册时,样品委托其他企业生产的,应当委托具有相应生产范围的医疗器械生产企业;不属于按照创新医疗器械特别审批程序审批的境内体外诊断试剂申请注册时,样品不得委托其他企业生产。 第十一条办理体外诊断试剂注册或者备案事务的人员应当具有相应的专业知识,熟悉医疗器械注册或者备案管理的法律、法规、规章和技术要求。 第十二条体外诊断试剂产品研制包括:主要原材料的选择、制备,产品生产工艺的确定,产品技术要求的拟
欧盟CE认证和美国FDA认证有什么不同 FDA是美国的,CE是欧盟的,这个是两个不同的认证,都挺严格的,主要是看你出口到那个国家,这两个认证都是强制要做的。下面亿博检测小编给大家详细介绍一下欧盟CE认证和美国FDA认证有什么不同。 CE认证,即只限于产品不危及人类、动物和货品的安全方面的基本安全要求,而不是一般质量要求,协调指令只规定主要要求,一般指令要求是标准的任务。因此准确的含义是:CE标志是安全合格标志而非质量合格标志。是构成欧洲指令核心的"主要要求"。 “CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。CE代表欧洲统一(CONFORMITE EUROPEENNE)。在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制
性要求。 二、FDA认证是什么 美国食品和药物管理局(Food and Drug Administration)简称FDA,FDA 是美国政府在健康与人类服务部(DHHS) 和公共卫生部(PHS) 中设立的执行机构之一。作为一家科学管理机构,FDA 的职责是确保美国本国生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品的安全。它是最早以保护消费者为主要职能的联邦机构之一。 食品和药物管理局(FDA)主管:食品、药品(包括兽药)、医疗器械、食品添加剂、化妆品、动物食品及药品、酒精含量低于7%的葡萄酒饮料以及电子产品的监督检验;也包括化妆品、有辐射的产品、组合产品等与人身健康安全有关的电子产品和医疗产品。产品在使用或消费过程中产生的离子、非离子辐射影响人类健康和安全项目的测试、检验和出证。根据规定,上述产品必须经过FDA检验证明安全后,方可在市场上销售。FDA有权对生产厂家进行视察、有权对违法者提出起诉。 三、欧盟CE认证和美国FDA认证有什么不同 1、CE认证是欧盟对产品的强制性认证是安全方面的认证;
体外诊断试剂质量管理 规定 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
质量管理文件管理 1、为规范本公司的质量体系文件的管理。 2、依据《药品管理法》、《药品经营质量管理规范》及其实施细则、《医疗器械监督管理条例》制定。 3、本制度规定了管理文件的编制、审核、批准、发布、修订、复审、废除与收回的部门及其职责,适用于对管理文件的管理。 4、质量管理人对本制度实施负责。 5、内容: 、质量管理文件的分类: 质量管理文件包括标准文件和记录文件两类。 标准文件指用以规定质量管理工作的原则,阐述质量体系的构成,明确有关组织、部门和人员的质量职责,规定各项质量活动的目的、要求、内容、方法和途径的文件,包括国家有关的法律、法规;国家质量标准;公司的质量管理制度、质量责任等。 记录文件指用以表明本公司实施质量体系运行情况和证实其有效性的文件,如各种质量活动和的记录(如图表、报告)等,记载购进、储存、销售、运输等各个环节质量活动、质量状况,是质量体系运行情况的证明文件。 、质量体系文件的内容: 标准文件制定必须符合下列要求: A、依据根据《药品管理法》、《药品经营质量管理规范》及其实施细则、《医疗器械监督管理条例》等法规的要求,使制定的各项管理文件具有合法性。
B、结合本公司的经营方式、经营范围和公司的管理模式,使制定的各项文件具有充分性、规范性和可操作性。 C、制定文件管理程序,对文件的编制、审核、批准、发放、使用、修改、复审、作废、回收等实施控制性管理,并严格按照文件管理程序制定各项管理文件,使各项管理文件在公司内部具有规范性、权威性和约束力。 D、必须严格执行国家有关法律、法规、政策、方针以及国家法定技术标准以及上级文件。 E、公司制定的文件应覆盖公司的质量管理和与质量有关的所有工作,完整表达公司的质量体系,使文件具有系统性。 、文件的编码: TW——体外诊断试剂 R:质量责任QR(QualityResponsibility); S:质量管理制度QS(QualitySystem); P:质量工作程序QP(QualityPrecess); REC:记录(Record) 00:顺序号 1:版本号 如:QS01-1 (1):第一版(01):编号(QS):管理制度 、文件的编制、审核、批准、发放、使用、修改、复审、作废、回收、编码等工作按照公司的《质量体系文件管理工作程序》进行。 、文件的管理 各部门负责人负责与本部门有关的质量体系文件的归档和部门内部的培训工作。
1。目得:为了加强体外诊断试剂在采购、验收、保管养护、销售、出库复核、运输等环节得监督管理,特制定本制度。 2.范围:适用于体外诊断试剂得管理、 3。责任人:采购员、开票员、业务员、三方物流收货员、验收员、保管员、养护员、复核员、配送员、司机。 4.内容: 4。1、认真贯彻执行《药品管理法》、《药品管理法实施条例》等法律、法规以及相关政策,加强对体外诊断试剂得全面质量管理、 4、2。体外诊断试剂既包括经营按械准字号批准得体外诊断试剂,也包括经营以药准字号批准得体外诊断试剂。 4.2。1。本制度中所称体外诊断试剂,就是指以药准字号批准得体外诊断试剂。4、3.体外诊断试剂人员得管理: 4.3.1。采购员要以质量为依据,制定购货计划,坚持按需进货,择优采购得原则,把好进货质量第一关。 4.3.2.了解供货单位得质量保证能力与质量信誉,建立完善得供货企业管理档案。 4.3.3、认真审查供货单位得法定资格,考察其履行合同得能力,必要时配合质量管理部对其进行现场考察,签订质量保证协议,并标明有效期,确保购进渠道得合法性。 4。3.4、负责建立经营品种目录。 4。3。5签订具有质量保证条款得购货合同。 4.3。6、质量管理部负责体外诊断试剂得质量管理工作,树立“质量第—”得观念,坚持质量效益得原则,承担质量管理方面得具体工作,在体外诊断试剂质量管理、工作质量管理方面有效行使裁决权。 4.3。6。1.对企业经营过程中得体外诊断试剂质量进行严格检查监督,定期对
质量管理工作得执行情况进行检查、考核,在企业内部有效行使否决权。 4。3.6.2.负责对体外诊断试剂首营企业、首营品种得审批。 4.3.6.3.负责监督检查体外诊断试剂购进、验收入库、储存养护、出库复核、运输及售后服务等方面得质量控制与质量指导、 4.3。6.4。负责对上报得质量问题进行复查、确认、处理、追踪。 4.3。6、5。负责及时搜集各种相关资料,必要时通过互联网到各级药监局等政府部门得网站上查询,对于下载内容严禁自行修改等文字处理,下载得资料要进行归档; 4.3。6.6.负责质量信息得管理工作、 4。3.6.7.负责不合格体外诊断试剂报损前得审核及报废体外诊断试剂处理得监督工作,做好不合格体外诊断试剂相关记录。 4。3。6、8、收集、保管好本部门得质量资料、档案,督促各岗位做好各类台帐,记录、保证本部门各项质量活动记录得完整性、准确性与可追溯性。 4.3.6、9。体外诊断试剂得收货、验收、购进、出库复核、销售等记录,要做到真实、完整、字迹清晰,并至少保存5年、 4.3.7.质量管理部要贯彻执行国家得法律、法规及行政规章,正确理解并积极推进本企业质量方针、目标与质量管理体系得正常运行;协助人力资源管理部加强对业务人员得质量教育,对体外诊断试剂业务关键岗位得人员进行质量意识培训及考核。 4。3.8、三方物流物流部负责体外诊断试剂存储运输: 4.3.8、1、严格按体外诊断试剂批号、效期及色标管理,按储存条件存放、4。3.8、2。搬运与堆垛应严格遵守体外诊断试剂外包装图示或标志得要求,规范操作。 4。3。8。3。对不合格体外诊断试剂进行有效控制。 4.3.8、4、严格按照体外诊断试剂储存运输得要求采取必要措施、 4.3。8.5。及时、准确、安全、经济得组织体外诊断试剂得运输,并确保质量。 4.3.8。6、加强库房场地、设施、设备得建设与管理。 4。4.体外诊断试剂购进得管理: 4。4。1、审批药准字号批准得体外诊断试剂必备资料:
体外诊断试剂质量管理制度范本 1
质量管理文件管理 1、为规范本公司的质量体系文件的管理。 2、依据<药品管理法>、<药品经营质量管理规范>及其实施细则、<医疗器械监督管理条例>制定。 3、本制度规定了管理文件的编制、审核、批准、发布、修订、复审、废除与收回的部门及其职责,适用于对管理文件的管理。 4、质量管理人对本制度实施负责。 5、内容: 5.1、质量管理文件的分类: 5.1.1、质量管理文件包括标准文件和记录文件两类。 5.1.2、标准文件指用以规定质量管理工作的原则,阐述质量体系的构成,明确有关组织、部门和人员的质量职责,规定各项质量活动的目的、要求、内容、方法和途径的文件,包括国家有关的法律、法规;国家质量标准;公司的质量管理制度、质量责任等。 5.1.3、记录文件指用以表明本公司实施质量体系运行情况和证实其有效性的文件,如各种质量活动和的记录(如图表、报告)等,记载购进、储存、销售、运输等各个环节质量活动、质量状况,是质量体系运行情况的证明文件。 5.2、质量体系文件的内容: 5.2.1、公司的质量管理标准文件制定必须符合下列要求: A、依据根据<药品管理法>、<药品经营质量管理规范>及其实施细则、<医疗器械监督管理条例>等法规的要求,使制定的各项管理文件具 1
有合法性。 B、结合本公司的经营方式、经营范围和公司的管理模式,使制定的各项文件具有充分性、规范性和可操作性。 C、制定文件管理程序,对文件的编制、审核、批准、发放、使用、修改、复审、作废、回收等实施控制性管理,并严格按照文件管理程序制定各项管理文件,使各项管理文件在公司内部具有规范性、权威性和约束力。 D、必须严格执行国家有关法律、法规、政策、方针以及国家法定技术标准以及上级文件。 E、公司制定的文件应覆盖公司的质量管理和与质量有关的所有工作,完整表示公司的质量体系,使文件具有系统性。 5.3、文件的编码: TW——体外诊断试剂 R:质量责任QR(Quality Responsibility); S:质量管理制度QS(Quality System); P:质量工作程序QP(Quality Precess); REC:记录(Record) 00:顺序号 1:版本号 如:QS 01 -1 (1): 第一版 (01):编号 (QS): 管理制度 5.4、文件的编制、审核、批准、发放、使用、修改、复审、作废、回 2
欧盟CE认证,即只限于产品不危及人类、动物和货品的安全方面的基本安全要求,而不是一般质量要求,协调指令只规定主要要求,一般指令要求是标准的任务。因此准确的含义是:CE标志是安全合格标志而非质量合格标志,是构成欧洲指令核心的"主要要求"。欧盟CE认证机构港易质量认证公司,在欧洲认证咨询方面有多年的经验总结: “CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。欧盟CE认证指令要求有: 1、机械指令(MD); 2、建筑产品指令(CPD); 3、低电压指令(LVD); 4、医疗器械指令(MDD); 5、无线电与通讯(RED); 6、个人防护产品(PPE); 7、娱乐游艇设备(RCD); 8、燃具设备(90/396/EEC);
9、电磁兼容性(EMC); 10、电梯指令(Lift); 11、防爆指令(ATEX); 12、热水锅炉器具(92/42eec)。 在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求。 CE认证公告机构Notified Body 指定机构NB,是由欧盟成员国提名,由欧盟委员会指定的机构。 进行CE合格评定,具有对产品安全性提供法律解释权,许多指令需要指定机构的参与,部分指令称指定机构为”能力机构“或”授权机构“。 港易质量认证公司专业办理,以最短的周期做最权威的CE认证,以确保您的产品出口欧盟能够顺利清关,被国外客户认可产品的质量。 港易质量认证公司是一家专业的从事于产品出口认证咨询,质量体系认证咨询,信用评级咨询,产品检测咨询的技术服务型公司,与ITS、SGS、CONTECNA、CCIC、CQC等国内外机构建立了良好的业务合作关系,为国内厂家的认证提供便利。 港易质量认证公司致力于为客户提供海关联盟CU-TR认证、俄
欧盟CE认证简介 CE Marking称为CE标记,CE两字,是从法语“Communate Europpene”缩写而成,是欧洲共同体的意思。欧洲共同体后来演变成了欧洲联盟(简称欧盟)。产品加贴CE标志,意味着其制造商宣告:该产品符合欧洲相关法律(一般是相应的产品指令)所规定的基本要求。CE标记是欧盟指定的对产品上市销售欠的共同强制保护要求,也是产品在欧盟25国销售的通行证,只有在产品上加贴CE标志后才能在欧盟自由流通。 对一般电子电气类产品而言,出口欧盟市场,必须取得CE认证。需要符合EMC指令(89/336/EEC,针对电磁辐射和电磁抗扰度两个方面)和LVD指令(73/23/EEC,针对交流电50V-1000V,直流电75V-1500V之间的产品)。对于无线及电信终端设备必须符合R&TTE 指令(1999/5/EC)。 1.EMC电磁兼容性 随着电气电子技术的发展,家用电器产品日益普及和电子化,广播电视、邮电通讯和计算机网络的日益发达,电磁环境日益复杂和恶化,使得电气电子产品的电磁兼容性(EMC电磁干扰EMI与电磁抗EMS)问题也受到各国政府和生产企业的日益重视。欧共体政府规定,从1996年1月1起,所有电气电子产品必须通过EMC认证,加贴CE标志后才能在欧共体市场上销售。根据欧盟的电磁兼容(EMC)指令83/336/EEC,所有在欧盟市场销售的电子电气产品必须在其对其他产品的干扰性及对外来影响的抗干扰性方面严格符合欧盟法律要求。 在说明符合EMC指令的流程前,先将EMC定义如下: 一个设备或装置与其它装置同时操作时,不会因为电磁干扰问题而影响正常工作之能力。亦即包括: EMI(Electromagnetic Interference)/电磁干扰:一个设备或装置在操作过程中有不利功能的讯号出现,此讯号是不想要且没意义的,它可能来自外界亦可能来自自己。 电磁干扰又可分为二个方向考虑: ·CE(Conducted Emission):传导放射性 ·RE(Radiated Emission):辐射放射性 EMS(Electromagnetic Susceptibility)/电磁耐受性:一个设备或装置在操作过程中不受周遭电磁环境影响的能力。 电磁耐受性又可分为二个方向考虑: ·CE(Conducted Susceptibility):传导放射性 ·RE(Radiated Susceptibility):辐射放射性 什么设备需要符合电磁兼容性指令? EMC指令之附近三所列出之仪器、设备如下: ·家用无线电及电视接收器 ·工业制造设备 ·行动收音机 ·行动收音机及商用行动电话机 ·医疗及科学设备 ·信息科技设备 ·一般电器及家用电器 ·航空及航海用无线设备 ·教育用电子设备 ·电信网络及仪器 ·电台及电视发报机 ·照明灯及萤光灯 EMI/电磁干扰
体外诊断试剂注册管理办法(2017修正) 【法规类别】医疗保健 【发文字号】中华人民共和国国家食品药品监督管理总局令第30号 【发布部门】国家食品药品监督管理总局 【发布日期】2017.01.25 【实施日期】2017.01.25 【时效性】现行有效 【效力级别】部门规章 体外诊断试剂注册管理办法 (2014年7月30日国家食品药品监督管理总局令第5号公布根据2017年1月25日国家食品药品监督管理总局《体外诊断试剂注册管理办法修正案》修正) 第一章总则 第一条为规范体外诊断试剂的注册与备案管理,保证体外诊断试剂的安全、有效,根据《医疗器械监督管理条例》,制定本办法。 第二条在中华人民共和国境内销售、使用的体外诊断试剂,应当按照本办法的规定申请注册或者办理备案。 第三条本办法所称体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本
体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。 按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于本办法管理范围。 第四条体外诊断试剂注册是食品药品监督管理部门根据注册申请人的申请,依照法定程序,对其拟上市体外诊断试剂的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。 体外诊断试剂备案是备案人向食品药品监督管理部门提交备案资料,食品药品监督管理部门对提交的备案资料存档备查。 第五条体外诊断试剂注册与备案应当遵循公开、公平、公正的原则。 第六条第一类体外诊断试剂实行备案管理,第二类、第三类体外诊断试剂实行注册管理。 境内第一类体外诊断试剂备案,备案人向设区的市级食品药品监督管理部门提交备案资料。 境内第二类体外诊断试剂由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。 境内第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。 进口第一类体外诊断试剂备案,备案人向国家食品药品监督管理总局提交备案资料。 进口第二类、第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。 香港、澳门、台湾地区体外诊断试剂的注册、备案,参照进口体外诊断试剂办理。
上海南洋医疗器械有限公司质量管理制度目录
质量管理制度目录 1、质量管理体系文件管理制度NY-ZD-001 2、质量体系内部评审管理制度NY-ZD-002 3、质量否决管理制度NY-ZD-003 4、质量信息管理制度NY-ZD-004 5、首营企业和首营品种审核制度NY-ZD-005 6、诊断试剂购进管理制度NY-ZD-006 7、诊断试剂质量验收管理制度NY-ZD-007 8、诊断试剂储存管理制度NY-ZD-008 9、诊断试剂销售管理制度NY-ZD-009 10、诊断试剂堆垛、搬运、运输管理制度NY-ZD-010 11、诊断试剂出库复核管理制度NY-ZD-011 12、售后服务管理制度NY-ZD-012 13、诊断试剂效期管理制度NY-ZD-013 14、不合格诊断试剂管理制度NY-ZD-014 15、退货诊断试剂管理制度NY-ZD-015 16、设施设备管理制度NY-ZD-016 17、质量教育培训及考核管理制度NY-ZD-017 18、卫生人员健康状况的管理制度NY-ZD-018 19、计算机信息化管理NY-ZD-019 20、用户访问管理制度NY-ZD-020
(1)定义:质量管理体系文件是指一切涉及药品经营质量的书面标准和实施过程中的记录结果组成的、贯穿药品质量管理全过程的连贯有序的系列文件。 (2)目的:质量管理体系文件是质量管理体系运行的依据,可以起到沟通意图、统一行动的作用。 (3)本制度适用于本企业各类质量相关文件的管理。 (4)企业各项质量管理文件的编制、审核、修订、换版、解释、培训、指导、检查及分发,统一由质量管理部负责,各部门协助、配合其工作。 (5)本企业质量管理体系文件分为四类,即: ①质量手册类(规章制度、管理制度、工作标准); ②质量职责类; ③质量管理工作程序与操作方法类; ④质量记录类。 (6)当发生以下状况时,企业应对质量管理体系文件进行相应内容的调整、修订。如:质量管理体系需要改进时;有关法律、法规修订后;组织机构职能变动时;使用中发现问题时;经过GSP认证检查或内部质量体系评审后以其它需要修改的情况。 (7)文件编码要求。为规范内部文件管理,有效分类、便于检索,对各类文件实行统一编码管理,编码应做到格式规范,类别清晰,一文一号。 ①编号结构 文件编号2-3个英文字母的公司代码、2个英文字母的文件类别你码、3位阿拉伯数字的序号加4位阿拉伯数字的年号编码组合而成,详如下图: □□□□□□□□ 公司代码文件类别代码文件序号 A.公司代码:如"上海南洋医疗器械有限公司" 代码为NY。
欧盟CE认证标志 在我国人们对“CE”标志似乎并不陌生,常常可以在产品或产品的包装上看到这一标志,然而真正了解它的人却不很多。随着我国进入世界贸易组织(WTO)步伐的加快和中国对外贸易的不断扩大,国内企业正努力把自己的产品推向包括欧盟在内的国际市场。而要进入欧盟市场就必须对“CE”标志进行深入了解。 “CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。凡是贴有“CE”标志的产品就可在欧盟各成员国内销售,无须符合每个成员国的要求,从而实现了商品在欧盟成员国范围内的自由流通。 在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》(1985年欧盟理事会批准实施,以下简称《新方法》)指令的基本要求。这是欧盟法律对产品提出的一种强制性要求。 一、什么是CE标志? 近年来,在欧洲经济区(欧洲联盟、欧洲自由贸易协会成员国,瑞士除外)市场上销售的商品中,CE标志的使用越来越多,加贴CE标志的商品表示其符合安全、卫生、环保和消费者保护等一系列欧洲指令所要表达的要求。 二、字母CE代表什么意思? 在过去,欧共体国家对进口和销售的产品要求各异,根据一国标准制造的商品到别国极可能不能上市,作为消除贸易壁垒之努力的一部分,CE应运而生。因此,CE代表欧洲统一(CONFORMITE EUROPEENNE)。事实上,CE还是欧共体许多国家语种中的"欧共体"这一词组的缩写,原来用英语词组EUROPEAN COMMUNITY 缩写为EC,后因欧共体在法文是COMMUNATE EUROPEIA,意大利文为COMUNITA EUROPEA,葡萄牙文为COMUNIDADE EUROPEIA,西班牙文为COMUNIDADE EUROPE等,故改EC为CE。当然,也不妨把CE视为CONFORMITY WITH EUROPEAN (DEMAND)(符合欧洲(要求))。 三、 CE标志有何重要意义 CE标志的意义在于:用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求(Essential Requirements),并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明,真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品,没有CE标志的,不得上市销售,已加贴CE标志进入市场的产品,发现不符合安全要求的,要责令从市场收回,持续违反指令有关CE标志规定的,将被限制或禁止进入欧盟市场或被迫退出市场。 四、 CE标志有没有证明质量合格的含义 构成欧洲指令核心的"主要要求",在欧共体1985年5月7日的(85/C136/01)号《技术协调与标准的新方法的决议》中对需要作为制定和实施指令目的"主要要求"有特定的含义,即只限于产品不危及人类、动物和货品的安全方面的基本安全要求,而不是一般质量要求,协调指令只规定主要要求,一般指令要求是标准的任务。产品符合相关指令有关主要要求,就能加附CE标志,而不按有关标准对一般质量的规定裁定能否使用CE标志。因此准确的含义是:CE标志是安全合格标志而非质量合格标志。 一个带有CE标志的风筝,并不意味着能飞得好,而只表明该风筝符合安全规定。 五、 CE标志适用于哪些产品?何时开始实施?