
实验五双液系的气液平衡相图
摘要:
本实验利用阿贝折射仪测定液体和蒸气的组成,并用折光率确定双组分体系的组成,绘制在一大气压下水——正丙醇双液系的气液平衡相图,从而确定其最低恒沸点温度及恒沸混合物的组成。
关键词:
双液系气液平衡相图最低恒沸点
Abstract:
This experiment using abbe refraction analyzer to measure liquid and the composition of the steam, and determine the refractive index of the two components system composition, draw in a water-was propanol, atmospheric pressure double liquid gas and liquid of the department of equilibrium phase diagram, so as to determine the minimum constant boiling point temperature and the composition of the azeotropic mixture.
Key-words:
bi-liquid system gas-liquid equilibrium phase-graph
lowest constant boiling point
前言:
一、实验原理
在常温下,两液态物质混合而成的体系称为双液系。两液体若只能在一定比例范围内互相溶解,称为部分互溶双液系,若两液体能以任意比例相互溶解,则称为完全互溶双液系。例如:苯-乙醇体系,正丙醇-水体系,环己烷—乙醇体系都是完全互溶双液系,苯-水体系则是部分互溶双液系。
液体的沸点是指液体的蒸气压与外压相等时的温度。在一定的外压下,纯液体的沸点有确定的值。但对于双液系来说,沸点不仅与外压有关,而且还与双液系的组成有关,即与双液系中两种液体的相对含量有关。
双液系在蒸馏时具有另一个特点是:在一般情况下,双液系的气相组成和液相组成并不相同。因此原则上有可能用反复蒸馏的方法,使双液系中的两液体互相分离。
通常用几何作图的方法将双液系的沸点对其气相、液相组成作图,所得图形称为双液系T-x相图,在一定温度下还可画出体系的压力P与组成的P-x关系图。完全互溶双液系在恒定压力下的气液平衡相图可分为三类:
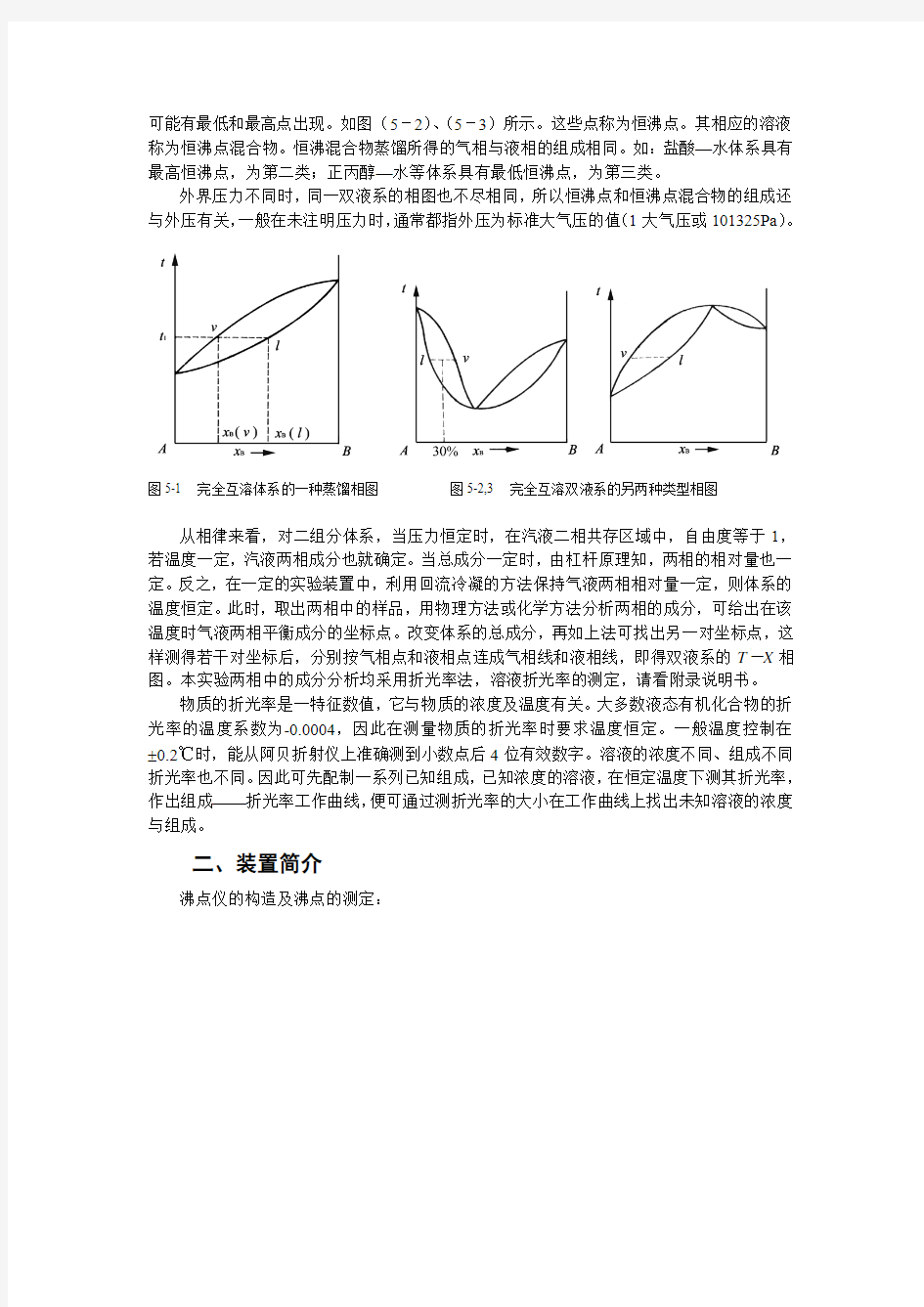
如果溶液与拉乌尔定律的偏差不大,在T—x图上,溶液的蒸汽压和沸点介于A,B两纯组分蒸汽压及沸点之间,如甲苯-苯体系(图5-1)所示,为第一类。
实际溶液由于A—B两组分的相互影响,常与拉乌尔定律有较大的偏差。在T—X图上
可能有最低和最高点出现。如图(5-2)、(5-3)所示。这些点称为恒沸点。其相应的溶液称为恒沸点混合物。恒沸混合物蒸馏所得的气相与液相的组成相同。如:盐酸—水体系具有最高恒沸点,为第二类;正丙醇—水等体系具有最低恒沸点,为第三类。
外界压力不同时,同一双液系的相图也不尽相同,所以恒沸点和恒沸点混合物的组成还与外压有关,一般在未注明压力时,通常都指外压为标准大气压的值(1大气压或101325Pa)。
图5-1 完全互溶体系的一种蒸馏相图图5-2,3 完全互溶双液系的另两种类型相图
从相律来看,对二组分体系,当压力恒定时,在汽液二相共存区域中,自由度等于1,若温度一定,汽液两相成分也就确定。当总成分一定时,由杠杆原理知,两相的相对量也一定。反之,在一定的实验装置中,利用回流冷凝的方法保持气液两相相对量一定,则体系的温度恒定。此时,取出两相中的样品,用物理方法或化学方法分析两相的成分,可给出在该温度时气液两相平衡成分的坐标点。改变体系的总成分,再如上法可找出另一对坐标点,这样测得若干对坐标后,分别按气相点和液相点连成气相线和液相线,即得双液系的T-X相图。本实验两相中的成分分析均采用折光率法,溶液折光率的测定,请看附录说明书。
物质的折光率是一特征数值,它与物质的浓度及温度有关。大多数液态有机化合物的折光率的温度系数为-0.0004,因此在测量物质的折光率时要求温度恒定。一般温度控制在±0.2℃时,能从阿贝折射仪上准确测到小数点后4位有效数字。溶液的浓度不同、组成不同折光率也不同。因此可先配制一系列已知组成,已知浓度的溶液,在恒定温度下测其折光率,作出组成??折光率工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的浓度与组成。
二、装置简介
沸点仪的构造及沸点的测定:
沸点仪的设计虽各有异,但其设计思想都集中在
如何正确地测定沸点和气液相的组成,以及防止过热
和避免分馏等方面。我们所使用的沸点仪如图5-4所
示:
这是一只带有回流冷凝管的长颈圆底烧瓶,冷凝
管底部有一球形小室D,用以收集冷凝下来的汽相样
品。液相样品则通过烧瓶上的支管L抽取,图中E是
一根用300W的电炉丝截制而成的电加热丝,直接浸
入溶液中加热,以减少溶液沸腾时的过热暴沸现象。
温度计安装时须注意使水银球一半浸在液面下,一半
露在蒸气中,并在水银球外围套一小玻璃管C,这样,
溶液沸腾时,在气泡的带动下,使气液不断喷向水银
球而自玻璃管上端溢出;小玻璃管C还可减少沸点周
围环境(如空气流动或其它热源的辐射)对温度计读
数可能引起的波动,因此这样测得的温度就能较好地
代表气液两相的平衡温度。
分析平衡时气相和液相的组成,须正确取得气相
和液相样品。沸点仪中蒸气的分馏作用会影响气相的
平衡组成,使取得的气相样品的组成与气液平衡时的
组成产生偏差,因此要减少气相的分馏作用。本实验
中所用沸点仪是将平衡时的蒸气凝聚在小球D内,在
容器A中的溶液不会溅入小球D的前提下,尽量缩短
小球D与大球A的距离,为防止分馏,尽量减少小球D的体积即可达此目的。为了加速达到体系的平衡,可把D球中最初冷凝的液体倾回到容器A中。
沸点的测定:
用玻璃水银温度计测量溶液的沸点,如图5-5,固定在沸点仪上的水银温度计是全浸式的,使用时除了要对温度计的零点和刻度误差等因素进行校正外,还应作露茎校正。这是由于温度计未能完全置于被测体系中而引起的。根据玻璃与水银膨胀系数的差异,校正值的计算式为:
?t露/℃=1.6?10-4·n·(t观-t环)
校正的方法是在测量沸点的温度计B旁再固定一支同样精度的温度计G,G的水银球底部应置于测量温度计沸点稳定值至固定温度计橡皮塞露出那一段水银柱的中部。读沸点时同
时读取温度计G上的读数,得到温度t
观和t
环
。在测量过程中,由于组成的变动,t
观
也在变
动,因此温度计G的位置也应随着沸点稳定值而进行调整,始终让其置于温度计B露出水银柱的中部。式中的n是露出那段水银柱的长。1.6?10-4是水银对玻璃的相对膨胀系数。
沸点除了要进行露茎校正外,还需要进行压力校正。标准大气压下(P=760mmHg或101325Pa)测得的沸点为正常沸点。实际测量时,压力一般都不恰好为标准大气压。应用特鲁顿规则及克劳修斯-克拉贝龙公式,可得溶液沸点随大气压变动而变动的近似值:
?t C t C P P a
/
(./)(/)?=
+?
?
-
27315
10
101325
101325
校正后,溶液的正常沸点为:
t沸=t观+?t压+?t露
图5-4 沸点仪
A-盛液容器;B-测量温度计;C-小玻管;D-小球;E-电热丝F-冷凝管;G-温度计;L-支管
图5-5 温度计露茎校正示意图
三、仪器和药品
沸点仪(南大万和(NJUWH)YP-2B南京大学应用物理研究所监制)1套
阿贝折射仪(WY A(2WAJ)上海申光仪器仪表有限公司)1台
调压变压器1只
超级恒温水浴(南大万和HK-2A南京大学应用物理研究所监制)1台
水银温度计(50~100℃,分度为0.1℃)1支
(0-50℃,分度为0.1℃)1支
10mL,20mL,50mL移液管各1支
干燥吸管20-30支擦镜纸
正丙醇(C3H8O):分析纯(AR)纯度99.5% 批号:T20100105
H2O
实验部分:
一、实验步骤
1、正丙醇-水溶液折光率与组成工作曲线的测定:
⑴配制正丙醇的质量百分比为10%、20%、30%、40%、55%、70%、80%、90%的正丙醇水溶液各10mL。准确计算正丙醇和水的量,用分析天平准确称量,为避免样品在称量过程中挥发,应尽量做到动作迅速。各个溶液确切的组成可按实际称量结果计算。
⑵调节恒温槽温度并使其稳定,使阿贝折射仪上的温度稳定在某一定值,用纯水校正阿贝折射仪,并测量上述溶液的折光率。为了适应季节的变化,可选择若干温度测量,一般可选25℃、30℃、35℃三个温度。
⑶在坐标纸上绘制不同温度时正丙醇-水溶液的组成与折光率工作曲线。
2、安装沸点仪:
将烘干的沸点仪按图5-4安装好,注意带有温度计和加热丝的橡皮塞要塞紧,不要触及烧瓶底部,温度计和加热丝之间要有一定的距离,装上辅助温度计G。操作时要小心,防止打破水银温度计。
3、测正丙醇的沸点:
用50mL的移液管从支管L中加入正丙醇溶液50mL,注意观察电加热丝是否全部浸没在溶液中,水银温度计的水银球是否一半在溶液中,一半在蒸汽中。否则应调整好。夹上电热丝夹,打开冷却水,插上电源,调节变压器电压由零慢慢增加,观察加热丝上是否有小气泡逸出,电压控制在20V以内,溶液会慢慢沸腾。体系中的蒸汽经冷凝管冷凝后,聚于小球D中。冷凝液不断地冲刷D球,必要时可将D球中的冷凝液倾入烧瓶中,观察B温度计上的读数达到稳定,此时体系处于平衡状态,调整G温度计到正确位置;再稳定5-7分钟,
准确记下温度计上t
观和t
环
。并记下橡皮塞处温度计的读数。切断电源。
4、取样并测定组成(折光率)
用干燥的滴定管自冷凝管中取出小球D内的全部气相冷凝液,用另一支干燥吸管从L 口中取液相液1mL左右,分别放入带有磨口的小试管中,并将试管置于一盛有冷水的小烧瓶中让其冷却,防止挥发。
观察阿贝折射仪上的温度是否正确,用丙酮棉球擦拭镜面,并用吹风机吹干。把待测的气相液,液相液分别滴于镜面上迅速测量。每个样品测量2-3次,取读数的平均值。
5、用10mL移液管移取H2O 0.5 mL,从支管L加入烧瓶中,以改变溶液的总组成,按
步骤3-4测量新体系中的液相、气相的折光率和平衡时的t
观和t
环
。
6、依次向烧瓶中加入1,1.5,2,2.5,4,6mL的水,仍按步骤3-4逐一进行测量,分别得到不同组成时的汽相、液相的折光率及各自的沸点。
7、把该混合液置于试剂瓶中,用蒸馏水反复洗涤烧瓶;并用20mL的移液管加入40mL 蒸馏水,按以上方法测量水的折光率和沸点,并逐一加入0.5,1,1.5,2,4,10,20mL的正丙醇,改变体系的总组成,测量气液平衡时各个样品的折光率和沸点。
8、由以上测得的个点汽相、液相样品的折光率,从工作曲线上查找出其对应的组成。
在实验过程中,可观察到由正丙醇—纯水体系汽相、液相的折光率将向着降低或升高的方向移动,起初气液两相折光率的读数相差较小,相差慢慢增加,又慢慢减小,直至相等。表示此时已达到最低恒沸点组成,此组成为最低恒沸点混合物。该体系的最低恒沸点在87℃左右,正丙醇含量在69~71%之间。
9、实验结束时,先让老师审查实验结果,然后再拆除实验装置,做好卫生,方可离开实验室。
整个实验需要的时间较长,故在实验中可由两同学分别从水,从正丙醇开始做,各自进行一半的测量,共同完成一相图。
二、实验注意事项
1、加热电阻丝一定要被欲测液体浸没,否则通电加热时可能会引起有机液体燃烧;所加电压不能太大,加热丝上有小气泡逸出即可;温度计的水银球不要直接碰到加热丝。
2、一定要使体系达到气液平衡,即温度读数要稳定,然后再取样;先停止通电再取样。
3、注意保护阿贝折射仪的棱镜,不能用硬物触及(如滴管),擦拭棱镜需用擦镜纸。
结果和讨论:
一、数据处理
1.实验条件
实验前实验后大气压/mmHg764.60767.00
温度/℃18.4518.75
查询资料可得合肥地区重力加速度为:g合肥=9.7948m/s2
水银的密度:ρ水银=13.6g/cm3
所以室温:C
t0
60
.
18
=
kpa
h
P211
.
102
10
6.
13
7948
.9
76730
.0
g3=
?
?
?
=
?
?
=
合肥
水银
ρ
纯水的折射率:1.3325
2.原始数据及处理
I.正丙醇中加水(此组数据来自明同辉)
去离子水的折射率:1.3315
t观/℃t环/℃t橡皮塞/℃n气n液
正丙醇(50ml
)+水0.0ml 96.3520.5864.15 1.3825 1.3820
0.5ml 94.8021.1364.15 1.3813 1.3822
1.0ml 9
2.3121.4064.08 1.3791 1.3822
1.5ml 90.0520.8863.90 1.3780 1.3817
2.0ml 88.5821.606
3.89 1.3772 1.3807 2.5ml 87.8121.1563.87 1.3765 1.3796
4.0ml 87.5522.2063.55 1.3761 1.3771 6.0ml 87.5121.5063.45 1.3754 1.3737
II.水中加正丙醇
去离子水的折射率:1.3325
t观/℃t环/℃t橡皮塞/℃n气n液
水(40ml
)+正丙醇
0.0ml 99.81 21.35 65.95 1.3325 1.3320
0.5ml 99.11 20.50 65.95 1.3524 1.3326
1.0ml 97.40 20.40 65.95 1.3642 1.3333
1.5ml 95.35 20.25 65.95 1.3712 1.3345
2.0ml 9
3.05 21.15 65.78 1.3734 1.3369
4.0ml 90.30 20.45 6
5.78 1.3746 1.3423 10.0ml 88.45 25.15 65.61 1.3752 1.3536 20.0ml 87.98 24.55 64.50 1.3762 1.3650
两表校正后合并:
n气 1.3835 1.3823 1.3801 1.3790 1.3782 1.3775 1.3771 1.3764
1.3325 1.3524 1.3642 1.3712 1.3734 1.3746 1.3752 1.3762 n液 1.3830 1.3832 1.3832 1.3827 1.3817 1.3806 1.3781 1.2747
1.3320 1.3326 1.3333 1.3345 1.3369 1.3423 1.3536 1.3650
将以上数据在工作曲线上读数即得各相的百分含量
3.正丙醇-水溶液工作曲线如下图:
组别 气相
液相
折射率
百分比/% 折射率
百分比/% 1 1.3835 96.0 1.3830 93.5 2 1.3823 90.5 1.3832 94.0 3 1.3801 82.1 1.3832 94.0 4 1.3790 78.3 1.3827 92.5 5 1.3782 75.8 1.3817 88.0 6 1.3775 73.9 1.3806 84.0 7 1.3771 72.5 1.3781 75.4 8 1.3764 70.8 1.3747
66.0 9 1.3325 0.1 1.3320 -0.3 10 1.3524 23.2 1.3326 0.3 11 1.3642 42.8 1.3333 0.8 12 1.3712 57.3 1.3345 2.0 13 1.3734 62.7 1.3369 4.4 14 1.3746 65.9 1.3423 10.3 15 1.3752 67.3 1.3536 24.9 16
1.3762 69.8
1.3650
44.5
4.温度校正: I.露茎校正
()()环观橡皮塞观环观露t t t t t t n t C -?-??=-???=?-4
-4
/10
6.1)(10
6.10
II.压力校正
()()
101325
/10132510
/15.273/0
pa P C
t
C t -?
+=
?观
()pa P 102211=
校正后,溶液的正常沸点为:
露压观沸t t t t ?+?+=
组别 t 观/℃ t 环/℃ t
橡皮塞
/℃
C
t 0
/露?
C
t 0
/压?
t 沸/0
c
1 96.35 20.58 64.15 0.39037 -0.32310 96.4
2 2 94.80 21.1
3 64.15 0.36128 -0.3217
4 94.84 3 92.31 21.40 64.08 0.32029 -0.31956 92.31 4 90.0
5 20.88 63.90 0.28940 -0.31759 90.02 5 88.58 21.60 63.89 0.26460 -0.31630 88.53
6 87.81 21.15 63.8
7 0.25533 -0.31563 87.75 7 87.55 22.20 63.55 0.25094 -0.31540 87.49
8 87.51 21.50 63.45 0.25411 -0.31537 87.45
9 99.81 21.35 65.95 0.42507 -0.32612 99.91 10 99.11 20.50 65.95 0.41707 -0.32551 99.20 11 97.40 20.40 65.95 0.38746 -0.32401 97.46 12 95.35 20.25 65.95 0.35327 -0.32222 95.38 13 93.05 21.15 65.78 0.31371 -0.32021 93.04 14 90.30 20.45 65.78 0.27404 -0.31781 90.26 15 88.45 25.15 65.61 0.23132 -0.31619 88.37 16
87.98
24.55
64.50 0.23829 -0.31578 87.90
5.作气液平衡相图:
将各沸点和对应折射率组成下表: 组别 气相百分比/%
液相百分比/%
沸点/0
c 1 96.0 93.5 96.42 2 90.5 94.0 94.84 3 82.1 94.0 92.31 4 78.3 92.5 90.02 5 75.8 88.0 88.53 6 73.9 84.0 87.75 7 72.5 75.4 87.49 8 70.8 66.0 87.45 9 0.1 -0.3 99.91 10 23.2 0.3 99.20 11 42.8 0.8 97.46 12 57.3 2.0 95.38 13 62.7 4.4 93.04 14 65.9 10.3 90.26 15 67.3 24.9 88.37 16
69.8
44.5
87.90
根据表中数据做气液相图如下:
20
40
60
80
100
86
889092949698100t/c
X/%
由图像可知:
实验测得水—正丙醇体系最低恒沸点的温度为:87.480
C 恒沸点时的正丙醇的百分含量为:71.77%
二、结果讨论与误差分析
1. 实验过程影响因素及注意事项的讨论
(1)物质的折光率是一特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定,即能从阿贝折射仪上准确测到小数点后4 位有效数字。实验过程中,恒温槽温度在25.5℃左右,符合恒温要求,故其波动对实验结果影响不大。
(2)分析平衡时气相和液相的组成,须正确取得气相和液相样品。沸点仪中蒸气的分馏作用会影响气相的平衡组成,使取得的气相样品的组成与气液平衡时的组成产生偏差,因此要减少气相的分馏作用。本实验中所用沸点仪是将平衡时的蒸气凝聚在小球D 内,在容器A 中的溶液不会溅入小球D 的前提下,尽量缩短小球D 与大球A 的距离,为防止分馏,尽量减少小球D 的体积即可达此目的。为了加速达到体系的平衡,可把D 球中最初冷凝的液体倾回到容器A 中。在取气相样品时,应尽量将小球D 内的样品全部取出,否则会干扰下次取样的气相样品,若取不出,则沸腾的时间加长也可以排除这个误差。
(3)测折光率时气、液两相的温度应该相等,且应该等于工作曲线的温度,然而实际上两相温度有一定差异。因此,在做工作曲线时应尽量选择接近室温的温度。在测样品时,先使样品冷却到室温,再测其折光率,这样就可避免气、液样品温度不同的影响。
2.误差分析
I.一般性误差分析
①偶然误差
实验中测定双液系组分是利用其折射率得到的,因而在使用阿贝折射仪测量时的估读误差大小对结果的准确性有决定性作用,因此,使视野清晰,色散影响减小对结果至关重要,但由于人的视觉分辨率的限制,估读误差是不可避免的,所以会
对结果产生一定影响。由于折射率与温度和入射光的波长有关,因此在测量时要保持阿贝折射仪温度恒定,但由于恒温槽自身的控温机制这一内在因素的影响,使得折射仪的温度有一定波动,可能会使测得的折射率产生些许偏差。
②操作误差
正丙醇本身极易挥发,因而在从体系中取样后,应迅速放入冷水中降温,以减慢其挥发,但实际操作中难免会有一定正丙醇损失,因而会给实验结果带来很大影响。如果用一个带有盖子的小瓶取样,可能会好一些,取出后,马上塞紧盖子,然后将小瓶置于冷水中,也许会减少正丙醇的挥发量。
③其他因素
实验过程中,温度变化总是先升高到一定温度后维持一段时间,然后会突然急剧升高。但若此时拔开活塞,气温又会急剧下降。因此,可推断随实验进行,因装置排气不畅导致温度计后期测得的温度不准确。故实验时应全神贯注,在温度急剧升高前读数,避免测得沸点误差过大。
II.针对实验过程分析
根据书中所给数据,正丙醇—水体系最低恒沸点在87℃左右,正丙醇百分含量在69%~71%之间。可知,恒沸点温度大致符合,而测得的正丙醇百分含量偏高,但偏离不大,仍可认为实验结果基本符合真实值。
我的实验部分为向水中加入正丙醇,反映在图中为曲线的左半部分,气液相曲线比较符合理论情况。
综上几点因素,使得实验结果与理论值之间存在一定差距。但从双液系T-x相图来看,基本与理论要求的一致,恒沸点温度也比较接近理论值,因此,利用折射率来测量双液系组成是一种相对精确的方法。从该平衡相图中可以近似估计不同浓度正丙醇的水溶液的沸点,某一温度下该平衡体系中的气液相组成情况,求出最低恒沸点及其对应组成。
三、对实验的体会和认识
通过本次实验,我对双液系的性质有了更清晰的了解,掌握了双组份沸点的测定方法,学会了阿贝折射率仪的使用,并了解了实验中的露茎校正和压力校正。而由于实验条件的限制致使本次实验的数据并不是特别准确,因此在分析实验结果的过程中更需要去认真发现问题,提出问题,并努力解决,从而得到更准确的结果,这有效培养了我对实验的分析能力。
参考文献:
1.《物理化学实验讲义》中国科学技术大学,2005 年
2.《物理化学》(第五版上册),傅献彩,沈文霞,姚天扬,侯文华编,南京大学化学化工学院,高等教育出版社,2005 年
3.《大学物理实验》第一册霍剑青等编高等教育出版社,2005.11
实验二二元液系气液平衡相图 一、实验目的 1、了解环己烷—乙醇系的沸点—组成图 2、由图上得出其最低恒沸温度及最低恒沸组成(含乙醇%) 3、学会使用数字阿贝折射仪 4、学会使用WTS—05数字交流调压器 二、原理 一个完全互溶双液体系的沸点—组成图,表明在气液二相平衡时沸点和二相成分间的关系,它对了解这一体系对行为及分馏过程都有很大的实用价值。 在恒压下完全互溶双液系的沸点与组分关系有下列三种情况:1、溶液沸点介于二纯组分之间;2、溶液有最高恒沸点;3、溶液有最低恒沸点。 图1表示有最低恒沸点,本次实验图形也像如此的样子,A′LB′代表液相线的交点表示在该温度时互成平衡的二相的成份。 绘制沸点—成份图的简单原理如下:当总成份为X的溶液开始蒸馏时,体系的温度沿虚线上升,开始沸腾时成份为Y的气相生成。若气相量很少,x、y二点即代表互成平衡时液气二相成份。继续蒸馏,气相量逐渐增多,沸点沿虚线继续上升,气液二相成份分别在气相和液相线上沿箭头指示方向变化。当二相成份达到某一对数值x′和y′,维持二相的量不变,则体系气液二相又在此成份达到平衡,而二相的物质数量按杠杆原理分配。 本实验利用回流的方法保持气液二相相对量一定,则体系温度恒定。待二相平衡后,取出二相的样品,用阿贝折光仪测定其折射率。得出该温度下气液二相平衡成份的坐标点,改变体系的总成份,再用上法找出一对坐标点,这样测得若干坐标点后,分别按气相点和液相点连成气相线和液相线,即得T—X平衡图。 三、步骤 1、安装接通仪器,打开冷凝水; 2、加入环己烷20ml,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2—3分钟基本不变,记下温度,关闭调压器; 3、A组加入乙醇0.5ml,用上法测定温度,然后关闭调压器,取出气相,液相的样品,测其折射率,以后分别加入1.0,2.0,4.0,8.0,12.0ml乙醇;
双液系气-液平衡相图的绘制 一、实验目的 (1)用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。找出恒沸点混合物的组成及恒沸点的温度。 (2)掌握测定双组分液体的沸点及正常沸点的测定方法。 (3)了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。 二、实验原理 2.1液体的沸点 液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。 2.2双液系的沸点 双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。理想的二组分体系在全部浓度范围内符合拉乌尔定律。结构相似、性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T-x (y )图。大多数情况下,曲线将出现或正或负的偏差。当这一偏差足够大时,在T-x (y )曲线上将出现极大点(负偏差)或极小点(正偏差)。这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。 恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。 (2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图1(b)所示。 (3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点,如水-乙醇体系,如图1(c))所示。 图1. 二组分真实液态混合物气—液平衡相图(T-x 图) 考虑综合因素,实验选择具有最低恒沸点的乙醇-乙酸乙酯双液系。根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1。若温度一定时,则气液亮相的组成也随之而定。当溶液组成一定时,根据杠 t A t A t A t B t B t B t / o C t / o t / o x B x B x B A B A A B B (a) (b) (c)x ' x '
实验名称:二元液系相图 学院:XXXXXXXXXX 班级:XXXXXXXXX 姓名(学号):XXX(XXXXXXXX) 指导教师:XXX 实验时间:XXXXXXXXXXXXXX
二元液系相图 一、实验目的 1.测定环己烷-乙醇系统的沸点组成图(T-X图)。 2.掌握阿贝(Abbe)折光仪的使用方法。 二、实验原理 两种液态物质以任何比例混合都形成均相溶液的系统称这完全 互中溶双液系。在恒定压力下溶液沸点与平衡的气液相组成的关系,可用沸点-组成图(t-x图)表示。 完全互溶双液系的沸点-组成图可分为两三种: 一种为最简单的情况,溶液沸点介于两个纯组分沸点之间,如图6-1所示。纵坐标表示温度,横坐标表示组分B的摩尔分数(x B,y B)。下面一条曲线表示气液平衡时温度(即溶液沸点)与液想组成的关系,称液相线(T-x线)。上面的线表示平衡温度与气相组成的关系,称气相线(T-y线)。若总组成为Z B的系统在压力p及温度t时达到气液两相平衡,其液相组成为x B气相组成为y B(见图6-1)。 另两种类型为具有恒沸点的完全互溶双液系统气液平衡相图,如图6-2所示。其中(a)为具有低恒沸点相图,(b)为具有高恒沸点相图。这两类相图中气相线与液相线在某处相切。相切点对应的温度称为恒沸温度,对应组成的混合物称恒沸混合物。恒沸混合物在恒沸点达气液平衡,平衡的气、液组成相同。同一双液系在不同压力下,恒沸点及恒沸混合物是不同的。
本实验绘制环己烷-乙醇二元液系的T-X图。其方法为将不同组成的溶液于蒸馏仪中进行蒸馏,沸腾平衡后记下温度,依次吸取少量的蒸馏液和蒸出液。分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率-组成标准曲线或其数据表确定相应组成,从而绘制环己烷-乙醇二元液系相图。 三、仪器和试剂 沸点测定仪;取样管;阿贝折光仪。 环己烷(分析纯);无水乙醇(分析纯);环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液。 四、实验步骤 1.纯液体折光率的测定 分别测定乙醇和环己烷的折光率。 2.标准曲线的绘制 测定环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液的折光率,绘制标准曲线。 3.测定沸点-组成数据 1)安装沸点测定仪。 2)溶液配制。 粗略配制环己烷质量百分数分别为0.05、0.1、0.2、0.45、0.55、0.6、0.7、0.8、0.9等组成的环己烷-乙醇溶液约50ml。
`` 实验2 双液系的气液平衡相图 唐盛昌2006011835 分6 同组实验者:徐培 实验日期:2008-10-9,提交报告日期:2008-10-23 带实验助教:尚培华 1 引言(简明的实验目的/原理) 实验目的: 1.用沸点仪测定在常压下环已烷—乙醇的气液平衡相图。 2.掌握阿贝折射仪的使用方法。 实验原理: 将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图5—1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图5—1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图5—1(c)。第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。 图1 沸点组成图 为了测定二元液系的T-x图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。方法是用沸点仪(图2)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折射仅测定其折射率。为了求出相应的组成,必须先测定已知组成的溶液的折射率,
双液系气液平衡相图的绘制 (物化实验得认真做) 一、实验目的 1.用回流冷凝法测定沸点是气相和液相的组成,绘制双液系相图。 2找出恒沸点混合物的组成和恒沸点的温度。掌握测定双组分液体的沸点及正常沸点的测定方法。 3了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。 二、实验原理 1液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。 2大多数情况下,T-x曲线将出现或正或负的偏差,当这个偏差足够大的时候,在曲线上将出现极大点或极小点。这种极大点或者极小点就称为恒沸点。 3考虑综合因素,实验选择具有最低恒沸点的乙醇-乙酸乙酯双液系。 4根据相平衡原理,对两组分体系,当压力恒定时,在气液平衡两相去,体系的自由度为1.若温度一定时,则气液两相的组成也随之而定。当原溶液的组成一定时,根据杠杆原理,两相的相对量一定。反之,实验中利用回流的方法保持气液两相相对量一定,测量体系温度不发生改变时,即两相平衡后,取出两相的样品,用阿贝折射计测定气相、液相的折射率,再通过预先测定的折射率-组成工作曲线来确定平衡时气相、液相的组成(即该温度下气液两相平衡成分的坐标点)。改变体系的总成分,再如上法找出另一对坐标点。这样得若干对坐标点分别按气相点和液相点连成气相线和液相线,即得T-x平衡图。 三、实验仪器和试剂 1、实验仪器
沸点仪、阿贝折射仪、调压变压器、温度计两只、干燥小烧杯3只,干燥5ml小试管16只,软木塞若干,擦镜纸 2、实验试剂 无水乙醇(AR)乙酸乙酯(AR)丙酮(C.P)乙醇体积分数为5%、10%、15%、22%、38%、50%、70%、90%组成的乙醇-乙酸乙酯溶液。 四、实验过程 1、将干燥的沸点仪安装好。从侧管加入约20mL5%混合液于蒸馏瓶内,并使温度计浸入液体内。冷凝管接通冷凝水。将稳流电源电压调至13V左右,使加热丝将液体加热至缓慢沸腾。最初在冷凝管下端内的液体不能代表平衡气相的组分,为加速达到平衡,可以等转折处液体收集较多时,倾斜装置是冷凝液体流回至圆底烧瓶,重复三次,待温度计的读数稳定后应再维持3~5min,以使体系达到平衡。记下温度计的读数,即为该混合液的沸点。同时读出环境的温度;算出露茎温度,以便进行温度的校正。 2、切断电源,停止加热,用吸管从小槽中取出气相冷凝液,同时用另一只干燥胶头滴管,从侧管处吸取容器中的溶液约1~2ml,分别转移到两只干燥的小试管中,立即塞紧。两只小试管置于盛有冷水的小烧杯中保持待测,以防组分改变。测定各自的折光率。将沸点仪的剩余溶液倒入回收瓶。按5%混合液的操作,依次测定10%、15%、22%、38%、50%、70%、90%混合液的沸点和气-液平衡时的气、液相折光率,同时直接测量乙醇(AR),乙酸乙酯(AR)的折光率(无须测定沸点) 3、折光率的测定先用去离子水测定阿贝折射计的读数校正值(水的折射率为 1.3325)。分别测定上面取的气相和液相样品的折射率。每次加样要测读数2次,取其平均值,并用水读数校正和温度读数校正,即为所测样品在该温度的折射率,每次加样测量之前,必须先将折光仪的棱镜面洗净,方法是用数滴丙酮淋洗,再用擦镜纸轻轻拭去残留在镜面上的溶剂,阿贝折射计在是用完毕后也必须将镜面处理干净。 五、实验分析和数据处理 1、实验注意事项 (1)测定折光率时,动作应迅速,以避免样品中易挥发组元损失,确保数据准确。
实验三双液系气液平衡相图的绘制姓名:学号: 班级:实验日期:2015年9月21日 提交报告日期:2015年9月28日 1、实验目的 1.了解沸点仪的原理和使用方法。 2.在大气压力下用沸点仪测绘环己烷-乙醇双液系的气相平衡相图。 3.掌握阿贝折射仪的使用方法。 2、实验原理 双液系是指两种液态物质混合而成的物系。双液系可以分为完全互溶双液系、部分互溶双液系和完全不溶双液系。 将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的平衡状态图,简称相图。沸点和组成的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间;(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见;(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点。第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。 为了测定二元液系的相图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的相图。方法是用沸点仪直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿
编号123456 7 8 贝折射仅测定其折射率。为了求出相应的组成,必须先测定已知组成的溶液的折射率,作出折射率对组成的工作曲线,在此曲线上即可查得对应于样品折射率的组成。 3、实验仪器和试剂 1.仪器 沸点仪1个、加热电源(0.5kW)1台、阿贝折射仪1台、长颈胶头滴管2支、镜头纸、 超级恒温槽、50~10℃温度计1支。 2.药品 乙醇、环己烷、丙酮。 4、实验操作步骤及方法要点 1.启动超级恒温槽的加热和搅拌系统,把超级恒温槽的控制温度调至27℃。 2.测定标准溶液的折射率 用与超级恒温槽相连接的已经恒温的阿贝折射仪测定标准溶液的折射率,作折射率对组成的工作曲线。 3.溶液沸点及气液平衡组成的测定。 往沸点仪中加入20mL乙醇,通冷却水,打开电源并调电压至12V,加热溶液至沸腾。待其温度计上所指示的温度保持恒定后,读下该温度值,同时停止加热,并立即在小泡中取气相冷凝液,迅速测定其折射率,并用另一滴管取少量液相测定其折射率。 接下来,往沸点仪中分别加入1mL、2mL、2mL、2mL、5mL环己烷,并按前述方法测定气液平衡温度和气液两相的折光率。结束后,将沸点仪中溶液倒入回收瓶并用电吹风把沸点仪烘干。 往沸点仪中加入20mL环己烷,经行实验。在之后往沸点仪中分别加入的是1mL、2mL、2mL、2mL、5mL乙醇。 注意:每次测量折射率后,要将折射仪的棱镜打开晾干,以备下次测定用。 5、实验数据 1)原始实验测量数据 大气压力:97.13kPa 室温:25.5℃ 以下数据测定过程中阿贝折射仪(恒温槽)温度为27.0℃。
双液系的气-液平衡相图 1. 简述由实验绘制环己烷-乙醇气-液平衡T-x相图的基本原理。 答:通过测定不同沸点下组分的气、液相的折射率,在标准的工作曲线上找出该折射率对应的浓度,结合其沸点画出平衡相图。 2. 在双液系的气-液平衡相图实验中,作环己烷-乙醇的标准折光率-组成曲线的目的是什么? 答:作标准曲线的目的是通过测气、液相相得折射率从而在标准工作曲线上找出对应的浓度。 3. 用精馏的方法是否可把乙醇和环己烷混合液完全分离,为什么? 答:不能完全分离。因为环己烷-乙醇二组分具有最低恒沸点。 4. 测定纯环己烷和纯乙醇的沸点时,沸点仪中有水或其它物质行吗? 答:有水和其他物质都是不行的。因为有水和其他物质会使所测沸点改变。 5. 为什么工业上常生产95%酒精?只用精馏含水酒精的方法是否可能获得无水酒精? 答:因为水-乙醇二组分具有最低恒沸点,所以工业上常生产95%的酒精。用精馏的方法无法获得无水酒精,只能获得95%的酒精。 6. 在双液系的气-液平衡相图实验中,如何判断气-液相达平衡状态?
答:观察贝克曼温度计的读数,如果读数稳定3-5分钟,说明已达平衡状态。 7. 在双液系的气-液平衡相图实验中,每次加入沸点仪中的环己烷或乙醇是否应按记录表所规定的体积精确计量?为什么? 答:不需要按记录表的加。因为组分的浓度不是按所加物质的量计算得来的,而是通过测折射率间接得到的。 8. 在双液系的气-液平衡相图实验中,在测定沸点时,溶液出现分馏现象,将使绘出的相图图形发生什么变化? 答:出现馏分将使测得的沸点偏高,使相图向上移动。 9. 在双液系的气-液平衡相图实验中,蒸馏器中收集气相冷凝的小球大小对结果有何影响? 答:小球太小难以收集气相,小球太大,小球内的组分更新太慢,产生馏分,导致实验误差。 10. 在双液系的气-液平衡相图实验中,通过测定什么参数来测定双液系气-液平衡时气相和液相的组成? 答:通过测定组分的折射率来测定双液系气-液平衡时气相和液相的组成。 11. 在双液系的气-液平衡相图中,如何通过测定溶液的折光率来求得溶液的组成? 答:通过测得的折射率在标准曲线上找出对应的浓度,根据气、液相平衡浓度与测得的沸点作出平衡相图。
双液系的气液平衡相图 实验者:林澄昱生04 2010030007 同组者:张弯弯 实验日期:2012-03-10 提交日期:2012-03-16 实验指导:刘晓惠 1引言 两种蒸气压不同的挥发性液体在混合之后,其溶液组成与与其平衡气相的组成不同。 在恒外压下,二组分系统达到气液平衡时,表示液态混合物的沸点与平衡时气液两相组成关系的相图,称为沸点和组成(T-x)图。大致分为三大类,包括: (1)理想液体混合物或接近理想液体混合物的双液系,其混合物沸点介于两纯物质沸点之间。见图1(a); (2)各组分蒸气压对拉乌尔定律产生很大的负偏差,有最高恒沸点。见图1(b); (3)各组分蒸汽压对拉乌尔定律产生很大的正偏差,有最低恒沸点。见图2(c)1。 图1 三类沸点组成(T-x)图 本实验为了绘制常压下环己烷-乙醇的气液平衡相图,先利用阿贝折射仪测定一系列已知组成混合溶液及纯液体的折射率,绘制标准曲线,再通过沸点仪测定一系列混合溶液的沸点,收集少量气相冷凝液以及溶液,测定其各自折射率,反查标准曲线得到气液两相的组成,绘得双液系的气液平衡相图。 2实验操作 2.1实验药品、仪器及测试装置示意图 2.1.1实验药品 环己烷,无水乙醇; 2.1.2实验仪器 沸点仪,调压器,温度传感器,锥形瓶,分析天平(AR2140),阿贝折射 仪(型号不明,为靠近恒温箱的一台),恒温箱,胶头滴管,10ml吸量管, 洗耳球; 2.1.3装置示意图
1. 冷却水入口 2. 气相冷凝液贮存小泡 3. 温度传感器 4. 喷嘴 5. 电热丝 6. 调压器2 图2 沸点仪 2.2实验条件 恒温槽温度:26 ℃ 室温:未测 气压:未测 2.3实验操作步骤及方法要点 2.3.1标准曲线的测定及绘制 2.3.1.1标准溶液的配制 取5个干燥、洁净的锥形瓶,编号为1~5,分别称量空瓶质量并记录;依照表1分别量取并加入相应体积的环己烷和无水乙醇,每加 入一种溶液以后称量其质量并记录;得到5份已知组分的标准溶液。 表1 标准溶液的配制方案 通过称量得到的质量,可以计算得到每锥形瓶中液体含有的环己烷质量分数,通过测定其折射率,可以确定特定环己烷质量分数与折 射率的关系;同时,直接量取纯的无水乙醇和环己烷,测定其折射率, 可以绘制在环己烷质量分数在0~1之间的无水乙醇混合溶液与折射率 的关系曲线。 2.3.1.2标准溶液折射率测定 (1)将阿贝折射仪与恒温箱相连,调节反光镜使目镜视野明亮,此 时仪器可以用来测量; (2)用胶头滴管加入待测溶液,在右目镜视野中观察,用右侧旋钮 调节色散程度,使明暗分界线清晰,再用左侧旋钮调节,使明 暗交界线处于叉丝中心。注意接下来实验过程中保证左侧旋钮
双液系的气—液平衡相图 一、实验目的 1.绘制在Pθ环已烷—乙醇的气液平衡相图,了解相图和相律基本概念; 2.掌握测定双组分液体的沸点及正常沸点的方法; 3.掌握用折光率确定二元液体的组成方法。 二、实验原理 液体的沸点是指液体的蒸气压和外压相等时的温度,在一定的外压下,纯液体的沸点有确定值。但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。根据相律: 自由度=组分数-相数+2 因此,一个气—液共存的二组分体系,其自由度为2。只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。 两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。沸点和组成(T-x)的关系有下列三种: (1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a); (2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b); (3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。 第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
图1. 沸点和组成(T-x)图 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。方法是用沸点仪(如图2所示)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折光仪测定其折光率。根据已知组成的溶液折光率,作出一定温度下(25℃)该溶液的折光率—组成工作曲线,然后根据测得的样品溶液的气液两相的折光率,在此曲线上即可按描法得到待测未知样品溶液的组成。 图2. 沸点测定仪示意图 三、仪器与药品 沸点测定仪1只丙酮(分析纯) 水银温度计(50~100℃,分度值0.1℃)1支超级恒温水浴1台玻璃温度计(0~100℃,分度值1℃)1支称量瓶(高型)10只
二元液系相图 一、实验目的 二、1、用沸点仪测定在常压下环己烷-乙醇的气液平衡相图。 三、2、了解沸点的测定方法。 四、3、掌握阿贝折射仪的测量原理及使用方法。 五、二、实验原理 六、1、液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。在一定外压下,纯液体的沸点有确定的值。但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。 七、 八、2、用阿贝折射仪测定气液组成的折光率,来获得气液组成。 三、实验装置
四、仪器及试剂 仪器:EF-03沸点测量仪、阿贝折射仪、沸点仪、取样管 试剂:无水乙醇、环己烷 五、实验步骤 1、安装好干燥的沸点仪。 2、加入纯乙醇30ml左右,盖好瓶塞,使电热丝浸入液体中,温度传感器与液面接触。
3、开冷凝水,将稳流电源调至(1.8-2.0A),接通电热丝,加热至沸腾,待数字温度计上读数恒定后,读下该温度值。 4、关闭电源,停止加热,将干燥的取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液样,迅速用阿贝折射仪测其折光率。 5、用干燥的小滴管取液相液样,用阿贝折射仪测其折光率。 6、分别在沸点仪中加入混合液,1、2、3、4、5、6重复上述操作。 7、根据环己烷-乙醇标准溶液的折射率,将上述数据转换成环己烷的摩尔分数,绘制相图。 8、实验完毕后,关闭冷凝水,关闭电源,整理实验台。 六、阿贝折光仪的使用 1、用擦镜纸将镜面擦干,取样管垂直向下将样品滴加在镜面上,注意不要有气泡,然后将上棱镜合上,关上旋钮。 2、打开遮光板,合上反射镜。 3、轻轻旋转目镜,使视野最清晰。 4、旋转刻度调节手轮(下手轮),使目镜中出现明暗面(中间有色散面),图a。
双液系的气液平衡相图 张泳辉,PB08206072 中国科学技术大学化学系 摘要:本实验利用一定温度下溶液折光率与其浓度的对应关系,用阿贝折射仪测量出各种 浓度的水—正丙醇双液系在达到沸点时的气相和液相组成,并且绘制双液系的平衡相图,以确定体系的最低恒沸点。 关键词:气液双相恒沸点平衡相图折光率 前言:本次实验主要是通过测量不同组成的双相系的折光率得到其相图。再通过测量不同 组成下的沸点得到双液系组成与沸点的关系。 在常温下,两液态物质混合而成的体系称为双液系。两液体若只能在一定比例范围内互相溶解,称为部分互溶双液系,若两液体能以任意比例相互溶解,则称为完全互溶双液系。这次实验的水—正丙醇就是部分互溶双液系。 液体的沸点是指液体的蒸汽压与外压相等时的温度。在一定的外压下,纯液体的沸点有确定的值。但对于双液系来说,沸点不仅与外压有关,而且还与双液系的组成有关,即与双液系中两种液体的相对含量有关。 双液系在蒸馏时具有另一个特点是:在一般情况下,双液系的气相组成和液相组成并不相同。因此原则上有可能用反复蒸馏的方法,使双液系中的两液体互相分离。 本实验两相中的成分分析均采用折射率法,通过测折光率的大小在工作曲线上找出未知溶液的浓度与组成,从而画出体系的相图,找出最低恒沸点。 实验部分: 1、实验装置: 调压变压器型号:ZBK 42004-87 额定电压:220V 额定容量:1KVA 单相50Hz 数字阿贝折射仪物理光学有限公司型号:WAY-2S 申光 超级恒温器上海实验仪器厂出厂日期:2001年9月 最高使用温度:95℃电压:220V 频率:50Hz 功率:15KW 2、实验方法 ①调节恒温槽温度并使其稳定,使阿贝折射仪上的温度稳定在30℃±0.2℃。 ②安装沸点仪:将烘干的沸点仪安装好,注意带有温度计和加热丝的橡皮塞要塞紧,不要触及烧瓶底部,温度计和加热丝之间要有一定的距离,装上辅助温度计G。操作时要小心,防止打破水银温度计。
大学化学基础实验Ⅱ 学院:酿酒与食品工程学院 专业:食品科学与工程 年级:食科141 学号: 1400940106 1400940107 1400940108 学生姓名:丁金浩郭雨宁魏国庆 指导教师: 2015年11月17日
完全互溶双液系气液平衡相图的绘制 一.实验目的 1.掌握阿贝折射仪的使用方法,通过测定混合物的折射率确定其组成。 2.学习常压下完全互溶双液系统气-液平衡相图的测绘方法,加深对相律、恒沸点的理解。 二.实验原理 由两种液体物质混合而成的两组分体系称为双液系统。根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。当压力保持一定,混合物沸点与两组分的相对含量有关。 恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x),根据体系对拉乌尔定律的偏差情况,可分为3类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图2.7(a)所示。 (2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压 2.7 都大,混合物存在着最低沸点如图2.7(c))所示。 图2.7 二组分真实液态混合物气—液平衡相图(T-x 图) 后两种情况为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了测定双液系的T -x 相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。 本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2.8)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T -x 相图。 本实验中两相的成分分析均采用折光率法测定。 折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。溶液的浓度不同、组成不同,t A t A t A t B t B t B t / o C t / o t / o x B x B x B A B A A B B (a)(b)(c)x 'x '
4.3 完全互溶的双夜系相图 4.3.1 二组分系统的相律的应用 最多可有四相平衡共存,是无变量系统。 最多可有三个自由度-T ,p ,x 均可变,属三变量系统。因此,要完整的描述二组分系统相平衡状态,需要三维坐标的立体图。但为了方便,往往指定一个变量固定不变,观察另外两个变量之间的关系,这样就得到一个平面图。如: 保持温度不变,得 p-x 图 较常用 保持压力不变,得 T-x 图 常用 保持组成不变,得 T-p 图 不常用。 若保持一个变量为常量,从立体图上得到平面图。相律 单相,两个自由度。 最多三相共存。 二组分系统相图种类很多,以物态来区分,大致分为: 完全互溶双液系 气-液平衡相图 部分互溶双液系 完全不互溶双液系 具有简单低共熔混合物 稳定化合物 有化合物生成 不稳定化合物 固-液平衡相图 固相完全互溶 固相部分互溶 固相部分互溶 等 C 2C 24= f Φ+=Φ =--min max 1 3Φf ==min max 0 4 f Φ==213f ΦΦ *=-+=-*min max 1 2Φf ==*max min 3 0 Φf ==
4.3.2 理想的完全互溶双液系相图 若A 、B 两种液体均能以任意比例相互混容形成均匀单一的液相,则该系统称为完全互溶双液系。根据相似相容原理,它可以分为:理想的完全互溶双液系 和非理想的完全互溶双液系。首先学习理想液态混合物的相图。 4.3.2.1. 理想溶液p-x 图 设A 、B 形成理想溶液,其饱和蒸气压分别为P A * 和P B *,P 为体系的总蒸气压。 以x A 为横坐标,以P 蒸气压为纵坐标,在p-x 图上分别表示出P A 、P B 、P 与x A l 的关系。 p-x-y 图 同压下 , 之间的关系 若知道一定温度下的P A *、P B *,就可据液相组成(x A /x B )求其气相组成(y A /y B ) p x p p p y A A A A *== B A B A B A x x p p y y * *= 若 则 此时 即蒸气压大的组分在气相中浓度更大。 若 ,此时 , 即蒸气压小的组分气相中浓度更小。 l-液相区 f * =2;g-l-气液平衡区 f * =1;g-气相区 f * =2。 * A A A p p x =* B B B p p x =()A B l l A A B B **l B A B A (1) l l A A B A p p p p x p x p x p x p p p x *****=+=+=+-=+-~A p y 线: A y A x ()A A B A A A B A p x p p y x p p p * * ** +-==**A B p p >A A y x >, B B y x <,**A B p p 四川理工学院实验报告 系:材化系 课程名称:简明物理化学实验 日期:2011年4月18日 姓名 学号 实验室 528 专业 材料科学与工程 班号 2009级2班 老师鉴定 实验名称 完全互溶双液系气液平衡相图的绘制 成绩评定 一、实验目的 (1)测定常压下环已烷—乙醇二元系统的气液平衡数据,绘制沸点—组成相图;(2)掌握双组分沸点的测定方法,通过实验进一步理解分馏原理;(3)掌握阿贝折射仪的使用方法。二、实验原理 两种液体物质混合而成的两组分体系称为双液系。根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶3种情况。两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。当压力保持一定,混合物沸点与两组分的相对含量有关。 恒定压力下,真实的完全互溶双液系的气—液平衡相图(图),根据体系对拉乌x T 尔定律的偏差情况,可分为3类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯—苯体系 ,如图2.7(a ) 所示。 (2)最大负偏差:存在一个最小蒸气压值,比两个纯液体的蒸气压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b )所示。 (3)最大正偏差:存在一个最大蒸气压值,比两个纯液体的蒸气压都大,混合物存在着最低沸点,如正丙醇—水体系,如图2.7(c )所示。 B B B B (a) (b) (c) 图2.7 二组分真实液态混合物气—液平衡相图(T-x 图) 后两种情况为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同,因而不能像第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了绘制双液系的T-x 相图,需测定几组原始组成不同的双液系在气—液两相平衡后的沸点和液相、气相的平衡组成。 本实验以环已烷—乙醇为体系,该体系属于上述第3种类型。在沸点仪(如图2.8所示)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x 相图。本实验中气液两相的组成均采用折光率法测定。 折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率 完全互溶双液系气液平衡相图的绘制 一.实验目的 1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。 2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。 3.掌握阿贝折射仪的使用方法及原理。 4.了解和掌握沸点仪的测定原理及方法。 5.加深对完全互溶双液系气液平衡相图的理解和增强个人动手能力。 二.实验原理 两种液体物质混合而成的两组分体系称为双液系。根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。当压力保持一定,混合物沸点与两组分的相对含量有关。 恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x图),根据体系对拉乌尔定律的偏差情况,可分为三类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。 (2)最大负偏差:存在一个最小蒸气压值,比两个纯液体的蒸气压都小,混合物存在着最高沸点,如盐酸-水体系,如图1 (b)所示。 (3)最大正偏差:存在一个最大蒸气压值,比两个纯液体的蒸气压都大,混合物存在着最低沸点,如正丙醇—水体系,如图1(c))所示。 对于后两种情况,为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了绘制双液系的T-x相图,需测定几组原始组成不同的双液系在气-液两相平衡后的沸点和液相、气相的平衡组成。 本实验以环己烷-乙醇为体系,该体系属于上述第三种类型。在沸点仪(如图2所示)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。 本实验中气液两相的组成均采用折光率法测定。 折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。溶液的浓度不同、组成不同,折光率也不同。因此可先配制一系列已知组成的溶液,在恒定温度下测其折光图1 二组分真实液态混合物气-液平衡相图(T-x图) 双液体系气—液平衡相图的绘制 一、 实验目的 1. 绘制环己烷—异丙醇双液体系的沸点组成图, 确定其恒沸组成和恒沸温度。 2. 掌握回流冷凝管法测定溶液沸点的方法。 3.掌握阿贝折射仪的使用方法。 二、 实验原理 两种液体物质混合而成的两组分体系称为双液系。根据两组分间溶解度的不 同, 可分为完全互溶、 部分互溶和完全不互溶三种情况。两种挥发性液体混合形成完全互溶体系时, 如果该两组分的蒸气压不同, 则混合物的组成与平衡时气相的组成不同。当压力保持一定, 混合物沸点与两组分的相对含量有关。 恒定压力下, 真实的完全互溶双液系的气-液平衡相图( T -x ) , 根据体系对拉乌尔定律的偏差情况, 可分为3类: ( 1) 一般偏差: 混合物的沸点介于两种纯组分之间, 如甲苯-苯体系, 如图 (a)所示。 ( 2) 最大负偏差: 存在一个最小蒸汽压值, 比两个纯液体的蒸汽压都小, 混合物存在着最高沸点, 如盐酸—水体系, 如图 (b)所示。 ( 3) 最大正偏差: 存在一个最大蒸汽压值, 比两个纯液体的蒸汽压都大, 混合 物存在着最低沸点如图 (c)) 所示。 t A t A t A t B t B t B t / o C t / o t / o x B x B x B A B A A B B (a) (b) (c) x ' x ' 上图为二组分真实液态混合物气—液平衡相图( T-x图) 后两种情况为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同, 因而不能象第一类那样经过重复蒸馏的方法而使双液系的两个组分相互分离, 而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了测定双液系的T-x相图, 需在气-液平衡后, 同时测定双液系的沸点和液相、气相的平衡组成。 本实验以环己烷-异丙醇为体系, 该体系属于上述第三种类型, 在沸点仪中蒸馏不同组成的混合物, 测定其沸点及相应的气、液二相的组成, 即可作出T -x相图。 本实验中两相的成分分析均采用折光率法测定。 三、仪器与试剂 1、仪器: 沸点仪1台; 调压变压器1台; 阿贝折射仪1台; 温度计(0-100℃) 1支; 长滴管1个; 短滴管2支; 2、试剂: 环己烷(分析纯); 异丙醇(分析纯) 异丙醇—环己烷标准溶液(异丙醇分别为0.20, 0.40, 0.50, 0.60, 0.80, 0.90) 四、主要实验步骤 1. 测定环己烷、异丙醇及标准溶液的折射率 调节阿贝折射仪, 用一支干燥的短滴管吸取环己烷数滴, 注入折射仪的加液孔内, 测定其折射率n, 读数两次, 取其平均值。然后打开棱镜组, 待环己烷挥发后, 再用擦镜纸轻轻吸去残留在镜面上的液体, 合上棱镜组。 双液系气液平衡相图的绘制 姓名:陈万东 ..化工班学号:...... 指导教师:栗印环 一、实验目的 1、测定在θp下环己烷-乙醇双液系的气-液平衡相图,了解相图和相率的基本概念; 2、掌握测定双组分液体的沸点及正常沸点的方法; 3、掌握用折光率确定二元液体组成的方法。 二、实验原理 1、气-液相图: 液体的沸点是指液体的蒸汽压与外界压力相等时的温度。 测定一系列不同配比溶液的沸点及气液两相的组成,就可绘制气-液体系的相图。 2、组成分析: 可用折光率-组成工作曲线来测得平衡体系的两相组成。 三、实验仪器及试剂 沸点测定仪 1只水银温度计 1支 调压变压器 1只超级恒温水浴 1台 数字式Abbe折光仪(棱镜恒温) 1台 玻璃漏斗(直径5cm) 1只长滴管 10支 带玻璃磨口塞试管(5mL) 4个烧杯(50mL,250mL)各1 个 环己烷(分析纯)无水乙醇(分析纯) 重蒸馏水 实验室预先配制环己烷-乙醇系列溶液,以环己烷摩尔分数计大约为、、、、、、和。 四、实验步骤 1、标准曲线的绘制(实验室已提前绘制好)。 2、安装沸点仪 根据图1所示,将已洗净、干燥的沸点仪安装好。检查带有温度计的软木塞是否塞紧。电阻丝要靠近烧瓶底部的中心。温度计水银球的位置应处在支管之下,但至少要高于电热丝2cm。 图.沸点仪的结构图 1.温度计; 2.加样口; 3.电热丝; 4.气相 冷凝液取样口;5.凹形小槽 . 3、测定混合物的沸点 1)借助玻璃漏斗由支管加入组成的混合液,使液面达到温度计水银球的中部,注意使电热丝达到温度计水银球的中部。打开冷却水,接通电源,调节电压为10V左右,慢慢加热,使蒸汽在冷凝管中回流的高度不能超过1/2,温度计读数达到稳定后再稳定3~5min使体系达到平衡,记下此时温度计的读数。 2)切断电源,停止加热,用冷水使沸点仪底部冷却,用干燥的吸管分别吸取冷凝管和圆底烧瓶底部的冷凝液,在数字式阿贝折光仪上分别测定两者的折光率,并由标准曲线读出对应的组成,此数值可认为分别是气相和液相的组成,测定完后将溶液倒入指定的储液瓶里。 3)按上述步骤分别测组成为摩尔百分比为,,,,,,的环己烷-乙醇混合物在沸点下的气相和液相的组成。 4、用测定的数据绘制T-x图 双液系沸点-组成图测绘实验报告 实验时间:2015年4月15日 学号:1120132970 一、目的要求 1 ?测定相应组成时的沸点并制作常压下环已烷一无水乙醇双液系的平衡相图。 2 ?从沸点组成图了解分馏原理。 3.了解沸点的测定技术,掌握两组分液体沸点的测定方法。 4 ?掌握折光率与组成的关系及阿贝折光仪的测量原理和使用方法。 二.实验原理 1、由液态物质混合而成的二组分系统称为双液系统。若两液体能以任意比例互 溶,称其为完全互溶双液系,若两液体只能部分互溶,称其为部分互溶双液系。 一个完全互溶的二元体系,两个纯液体组分在所有组成范围内完全互溶。在 定压下,完全互溶的二元体系的沸点一组成图可分为三类,如图C7.1所示。 a. 溶液的沸点介于两纯组分沸点之间,如苯一甲苯体系; b. 溶液有最低恒沸点,如环己烷-乙醇体系; c. 溶液有最高恒沸点,如丙酮一氯仿体系。 Xi JF4 Xi jn B A B X x B 下面以a为例,简单说明绘制沸点-组成图的原理。加热总组成为x1的溶液, 体系的温度上升,达液相线上1点时溶液开始沸腾,组成为x2的气相开始生成,但气相量很少,趋于0,x1、x2二点代表达到平衡时液、气两相组成。继续加热, 气相量逐渐增多,沸点继续上升,气、液二相组成分别在气相线和液相线上变化,当达某温度(如2点)并维持温度不变时,则x3、x4为该温度下液、气两相组成,气相、液相的量之比按杠杆规则确定。从相律 f = c - p +2 可知:当外压恒定时,在气、液两相共存区域自由度等于1;当温度一定时,则气、液两相的组成也就确定,总组成一定,由杠杆 规则可知两相的量之比也已确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相的量与液相的量之比也不变时(达气-液平衡),则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下气、液两相平衡时各相的组成。改变溶液总组成,得到另一温度下气、液两相平衡时各相的组成。测得溶液若干总组成下的气液平衡温度及气、液相组成,分别将气相点用线连接即为气相线,将液相点用线连接即为液相线,得到沸点-组成图。 气相、液相的成份分析采用折光率法:折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。溶液的浓度不同、组成不同,折光率也不同。因此可先配制一系列已知组成的溶液,绘出折光率-组成(n-x)的等温线,方法是在定温下测定已知各种组成(x )的折光率(n),绘出n-x等温线。对于未知组成的样品,取出各相样品后,迅速测出该温度下的折光率(n),便可以从n-x线查出其相应组成。 2、阿贝折光仪的原理 它的主要部分为两块直角棱镜PI,PII,棱镜PI的粗糙表面与PII的光学平面镜AD之间约有0.1到0.15mm的空隙,用于装待测液体并使在PI、PII间铺成一簿层。光线从反射镜射入棱镜PI后,由于面是粗糙的毛玻璃而发生漫射,从各种角度透过缝隙的被测液体;进入棱镜PII中,由前所知,从各个方向进入棱镜PII的光线均产生折射,而其折射角都落在临界角rc之内(因为棱镜的折 射率大于液体的折射率,因此人射角从到的全部光线都能通过棱镜而发生折 射)。具有临界角rc的光线穿出棱镜PII后射于目镜上,此时若将目镜的十字线调节到适当位置,则会见到目镜上半明半暗。 从几何光学原理可以证明,缝隙中液体的折射率n液与rc间的关系为:n 液=sinB ,B对一定的棱镜为一常数,n棱镜在定温下也是个定值。所以液体的折射率n液是角rc的函数。由rc可计算液体折射率。折光仪上已经把读数rc 换算成n液的值,可直接读出n液的值。 3、阿贝折光仪使用方法完全互溶双液系气液均衡相图的绘制
完全互溶双液系气液平衡相图的绘制
双液体系气液平衡相图的绘制及思考题样本
双液系气液平衡相图的绘制(2)
双液系气液平衡相图的绘制实验报告