第二章 配合物的结构及异构现象
- 格式:doc
- 大小:182.00 KB
- 文档页数:35


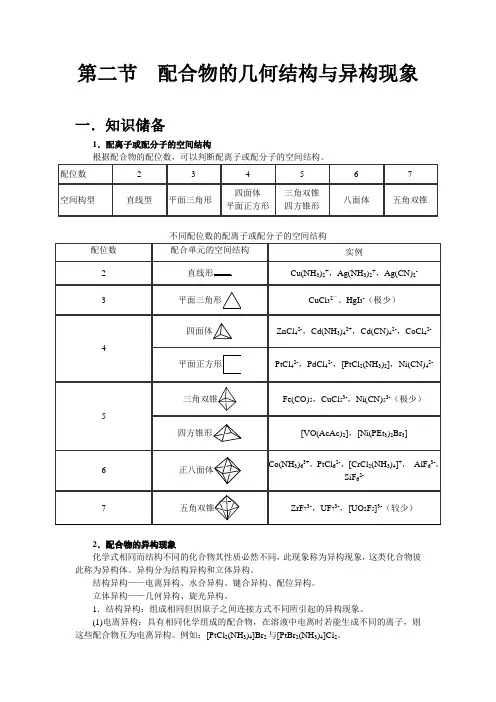
第二节配合物的几何结构与异构现象一.知识储备1.配离子或配分子的空间结构根据配合物的配位数,可以判断配离子或配分子的空间结构。
不同配位数的配离子或配分子的空间结构2.配合物的异构现象化学式相同而结构不同的化合物其性质必然不同,此现象称为异构现象,这类化合物彼此称为异构体。
异构分为结构异构和立体异构。
结构异构——电离异构、水合异构、键合异构、配位异构。
立体异构——几何异构、旋光异构。
1.结构异构:组成相同但因原子之间连接方式不同所引起的异构现象。
(1)电离异构:具有相同化学组成的配合物,在溶液中电离时若能生成不同的离子,则这些配合物互为电离异构。
例如:[PtCl2(NH3)4]Br2与[PtBr2(NH3)4]Cl2。
(2)水合异构:当电离异构配合物分子中有一个配体换成水分子时就成为水合异构。
例如:[Cr(H 2O)6]Cl 3(紫色)、[CrCl(H 2O)5]Cl 2.H 2O(亮绿色)与[CrCl 2(H 2O)4]Cl.2H 2O(暗绿色)。
(3)键合异构:有一些配体能够以二种或多种不同方式与中心离子键合。
例如:[Co(NO 2)(NH 3)5]Cl 2(黄褐色)与[Co(ONO)(NH 3)5]Cl 2(红褐色);[Cr(SCN)(H 2O)5]2+与[Co(NCS)(H 2O)5]2+。
(4)配位异构:在由配阳离子和配阴离子组成的盐里,因配体在配阳离子和配阴离子中分配不同而引起的异构现象。
例如:[Co(NH 3)6][Cr(CN)6]与[Cr(NH 3)6] [Co(CN)6];[Cr(NH 3)6]2.立体异构:配体在中心原子周围因排列方式不同而产生的异构现象,称为立体异构。
立体异构分为几何异构和旋光异构。
(1)几何异构(顺—反异构)四配位数的平面四边形配合物可能形成几何异构,而四面体构型的配合物不存在几何异构现象。
几何异构体之间不仅物理性质不同,而且某些化学性质也差别很大。
①平面四边形配合物MA 2B 2型平面四边形配合物有顺式和反式两种异构体。


第二章配合物的结构及异构现象第一节配位数与配位多面体配位多面体:把围绕中心原子的配位原子看作点,以线按一定的方式连接各点就得到配位多面体。
用来描述中心离子的配位环境。
1、配位数为2理想构型为直线型结构,大多限于Cu(I)、Ag(I)、Au(I)和Hg(II)的配合物。
如:[Ag(NH3)2]+2、配位数为3理想构型为等边三角形结构。
如:[HgI3]−3、配位数为41)四面体构型 2) 平面正方形构型[NiCl4]2−[Ni(CN)4]2−[Zn(NH3)4]2+ [Pt(NH3)4]2+4、配位数为51)三角双锥构型2) 四方锥构型[Fe(CO)5][InCl5]2−[CuCl5]3−5、配位数为6八面体构型三棱柱构型[Co(NH3)6]3+Re(S2C2Ph2)36、配位数为71)五角双锥构型如[ZrF7]3−2)单面心三棱柱构型3)单面心八面体构型7、配位数为81)四方反棱柱。
如[Sr(H2O)8]2+2)三角十二面体。
如[Co(NO3)4]2-8、配位数大于8的情况多出现在镧系及锕系金属配合物中。
为什么?N H N NNNNHN H NNNHNOOOONHNNNHNLa第二节几何异构现象(geometrical isomerism)几何异构:由于配体在空间的位置不同而产生的异构现象。
1.平面正方形配合物 1)[Pt(NH 3)2Cl 2]PtCl ClH 3NH 3NPtNH 3ClClH 3N顺式反式ClNH 3H 3N Cl2)[Pt(NH 3)(py)ClBr]PtPy BrClH 3NPt PyNH 3ClBrH平面正方形配合物几何异构体数目配合物类型 MA 4 MA 3B MA 2B 2 MA 2BC MABCD异构体数目 1 1 2 2 32.八面体构型的配合物[Co(NH3)4Cl2]+的几何异构体:有两种几何异构体:NH3NH3Cl NH3ClNH3NH3NH3H3NNH3ClCl顺式(绿色)反式(紫色)[Rh(py)3Cl3]:Py PyCl ClClPyPyPyClPyClCl面式(facial)经式(meridional))[Co(en)2Cl2]+ (en = H2NCH2CH2NH2):N H2H2 NN H2NH2ClClNH2NH2Cl ClH2NH2N反式顺式八面体配合物几何异构体数目类型MA6MA5B MA4B2 MA3B3MA4BC数目 1 1 2 2 2类型MA3B2C MA2B2C2 MABCDEF数目 3 5 153、几何异构体的鉴别方法1)偶极矩偶极矩:μ= q x l如:例:Pt(II)配合物的偶极矩(Debye): 顺式反式[Pt(NH 3)2Cl 2] 8.7 02)红外光谱cis-[PtCl 2(NH 3)2]NH 3NH 3ClPtCltrans-[PtCl2(NH3)2] cis-[PtCl2(NH3)2]trans-[PtCl2(NH3)2] 3)紫外-可见光谱法cis-和trans-[Co(en)2Cl(NO2)]+的紫外-可见光谱4) X射线衍射法可确定原子在空间的三维坐标。
1、配位数为2
大多限于Cu(I)、Ag(I)、Au(I)和Hg(II)的配合物。
如:[Ag(NH3)2]+
2、配位数为3
[Fe(CO)5]
[InCl5]2-
[CuCl5]3-
5、配位数为6
八面体构型三棱柱构型
6、配位数为7
1)五角双锥构型如[ZrF7]3-2)单面心三棱柱构型
3)单面心八面体构型
7、配位数为8
1)四方反棱柱。
如[Sr(H2O)8]2+ 2)三角十二面体。
如[Co(NO3)4]2-
平面正方形配合物几何异构体数目
配合物类型MA4MA3B MA2B2 MA2BC MABCD
异构体数目 1 1 2 2 3
2.八面体构型的配合物
[Co(NH3)4Cl2]+的几何异构体:
面式(facial)经式(meridional))
[Co(en)2Cl2]+ (en = H2NCH2CH2NH2):
[Pt(PEt3)2Cl2] 10.7 0
Et = CH3CH2-
2) X射线衍射法
可确定原子在空间的三维坐标。
第三节旋光异构现象(optical isomerism)
1、旋光异构及其与对称性的关系
1)旋光异构体(对映异构体):CHClBrI。
例:CCl4具有S4轴。
特例:S1=σ(对称面)
S2=i (对称中心)
因此具有对称面或对称中心的分子不存在旋光异构体。
2、旋光异构体实例
* 平面正方形配合物不存在旋光异构体。
1)[Rh(en)2Cl2]+:
例::拆分[Rh(en)3]3+的两种异构体(Werner的工作):
A、拆分试剂:硝基樟脑磺酸钠(NaL)
d,l-[Rh(en)3]3++NaL →l-[Rh(en)3]L3↓+
d-
[Rh(en)3]L3(aq)
B、除去拆分试剂:
l-[Rh(en)3]L3+NaI→l-[Rh(en)3]I3+NaL
C、溶解度较大的d—异构体可从溶
液中回收。
第四节其他异构现象
1、电离异构
由于阴离子处于内界或外界不同而引起的异构现象。
例:[Co(NH3)5Br]SO4═[Co(NH3)5Br]2++SO42-
[Co(NH3)5SO4]Br ═[Co(NH3)5SO4]++Br-
2、水合异构
由于水分子处于内界或外界不同而引起的异构现象。
例:[Cr(H2O)4Cl2]Cl.2H2O
[Cr(H2O)5Cl]Cl2.H2O
3、键合异构
配体用不同的配位原子与中心原子键合而产生的异构。
例:[(NH3)5Co-NO2] Cl2、[(NH3)5Co-O-N=O] Cl2
[(H2O)5Cr-SCN]2+、[(H2O)5Cr-NCS]2+
4、配合异构
由于配体在配阳离子和配阴离子之间分配不同而引起的异构。
例:[Co(NH3)6] [Cr(CN)6]
[Cr(NH3)6] [Co(CN)6]
5、配体异构
若配体为异构体,则其相应的配合物亦为异构体。
例:[Co(1,2-pn)2Cl2]Cl [Co(1,3-pn)2Cl2]Cl
1,2-pn= 1, 2-丙二胺1,3-pn= 1, 3-丙二胺。